Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1291-1304
Длительная постоянная темнота модулирует возрастные изменения уровня α-токоферола у крыс
И. В. Баишникова 1, *, Т. Н. Ильина 1, Е. А. Хижкин 1, В. А. Илюха 1
1 Институт биологии Карельского научного центра РАН, ФИЦ “КарНЦ РАН”
Петрозаводск, Россия
* E-mail: iravbai@mail.ru
Поступила в редакцию 19.07.2022
После доработки 22.08.2022
Принята к публикации 23.08.2022
- EDN: CZJVNI
- DOI: 10.31857/S0869813922100028
Аннотация
Цикл света и темноты является одним из основных факторов окружающей среды, влияющих на ритмичность биологических процессов в организме. Изменение или отсутствие этой цикличности приводит к нарушению суточных ритмов и негативно влияет на функционирование всех систем организма. Целью данного исследования было изучение влияния постоянной темноты, воздействие которой начиналось с внутриутробного периода (DD/DD) или с момента рождения (LD/DD) и продолжалось в течение всей жизни, на содержание α-токоферола у крыс линии Вистар в позднем онтогенезе (3, 6, 12, 18 и 24 мес.). Контрольные животные содержались в стандартных световых условиях (LD). Уровень α-токоферола определяли методом высокоэффективной жидкостной хроматографии. Модулирующее влияние длительной световой депривации обнаружено в печени, скелетной мышце и легких, большинство изменений наблюдалось у 12-месячных крыс. Так, в печени уровень витамина снижался в обеих экспериментальных группах, что связано, вероятно, с регулирующей ролью органа в поддержании гомеостаза витамина Е в организме. В скелетной мышце крыс из группы DD/DD отмечено значительное повышение содержания α-токоферола. Это может свидетельствовать о накоплении в миоцитах липидов в результате нарушения гомеостаза основных энергетических субстратов скелетных мышц. У 24-месячных крыс этой группы уровень витамина в ткани был значительно ниже, чем в контроле, что может указывать на снижение антиоксидантной защиты скелетной мышцы вследствие возрастных изменений. У крыс, на которых воздействие постоянной темноты начиналось после рождения, наблюдались отличия по сравнению с контрольной группой в направленности изменений уровня α-токоферола в легких в возрасте 6 и 12 мес. У стареющих и старых животных воздействие световой депривации, вероятно, сглаживалось возрастными нарушениями в функционировании циркадной системы, поэтому в большинстве исследованных органов содержание витамина не различалось у крыс контрольной и экспериментальных групп. Полученные данные могут быть полезны при оценке физиологического состояния людей, работающих или проживающих в условиях пониженной освещенности.
Витамин Е (α-токоферол) выполняет в организме ряд специфических функций, среди которых участие в клеточной сигнализации, модуляция транскрипции генов, этот витамин также является антиоксидантом, защищающим липидные компоненты биологических мембран [1, 2]. Особенно актуальной роль этого витамина становится при старении, когда вследствие изменения состава мембраны и накопления в ней продуктов перекисного окисления липидов изменяется ее физическое состояние и нарушается функционирование [3]. Подавляя окисление клеточных макромолекул, витамин Е, наряду с другими компонентами системы антиоксидантной защиты, способствует поддержанию баланса между уровнями свободных радикалов и антиоксидантов, обеспечивающего клеточный гомеостаз и замедляющего старение [1]. Установлено, что более высокий уровень витамина Е в организме снижает риск развития такой возрастной патологии скелетных мышц, как саркопения [4].
Важную роль в процессах старения играет циркадная система, синхронизирующая различные биологические процессы в организме с факторами окружающей среды, основным из которых является цикл света и темноты. Под циркадным контролем находится функционирование эндокринной системы и обмен основных питательных веществ [5, 6], в том числе липидов, с которыми тесно связан метаболизм витамина Е. Нарушение циркадных ритмов приводит к десинхронизации множества физиологических процессов и изменению гормонального статуса, в особенности это касается мелатонина, синтезируемого эпифизом в темное время суток [7, 8]. Как и витамин Е, мелатонин и его метаболиты обладают антиоксидантными свойствами и способны напрямую взаимодействовать со свободными радикалами, а также регулировать экспрессию генов некоторых ферментов антиоксидантной защиты и стимулировать синтез глутатиона [7]. Действуя через свои рецепторы, которые экспрессируются по всему организму, мелатонин участвует в регуляции энергетического метаболизма, в том числе поддерживает гомеостаз глюкозы [9].
В условиях постоянной темноты отсутствие световых сигналов приводит к появлению так называемых “свободно текущих” циркадных ритмов, при которых может нарушаться функционирование различных физиологических систем [10, 11]. Функционирование циркадной системы в “свободном режиме” наблюдается у большинства полностью слепых людей [12], а также длительно работающих в условиях пониженной освещенности или проживающих на территориях Крайнего Севера в период полярной ночи [13]. Исследования возможных нарушений, возникающих при воздействии постоянной темноты на организм, активно проводятся на моделях животных, у которых циркадные ритмы уже сформированы в условиях стандартного фотопериода (12 ч свет/12 ч темнота), а продолжительность действия этого фактора чаще всего не превышает 6–10 нед. [14–16]. При этом значительный интерес представляет изучение влияния световой депривации в процессе индивидуального развития организма. Важным моментом является и то, в какой период онтогенеза начинается воздействие. Известно, что циркадные ритмы начинают формироваться уже в пренатальный период при участии циркадной системы матери, а собственная система хронометража “созревает” у грызунов в течение первых двух недель после рождения. Условия освещения, которые воздействуют на организм в течение первых трех недель постнатального развития, оказывают формирующее влияние не только на функционирование циркадной системы, но и на физиологию и поведение во взрослом возрасте [16, 17]. В связи с этим выявление долгосрочных эффектов пренатальной и ранней постнатальной световой среды представляет особый интерес для лучшего понимания потенциальных последствий для здоровья измененных условий освещения. Ранее мы сообщали, что при действии постоянной темноты на самок крыс во время беременности (внутриутробный период) у их потомства наблюдалось значительное снижение уровня α-токоферола на ранних этапах постнатального онтогенеза. Более позднее воздействие световой депривации (с рождения) вызывало меньше изменений в уровне витамина [18]. Целью данного исследования было изучение влияния постоянной темноты, воздействие которой начиналось с внутриутробного периода или с момента рождения и продолжалось в течение всей жизни, на содержание α-токоферола у крыс в позднем онтогенезе.
МЕТОДЫ ИССЛЕДОВАНИЯ
В эксперименте использовали крыс линии Вистар, которые находились в стандартных условиях вивария при свободном доступе к воде и пище (гранулированный корм). Все манипуляции с животными соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям комиссии по гуманному обращению с животными Института биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”.
Для разведения 4-месячных самцов и самок крыс содержали в условиях стандартного фиксированного режима освещения (12 ч свет 750 лк/12 ч темнота; LD) или при постоянной темноте (0–0.5 лк, DD). Самок, содержавшихся при стандартном освещении, и их потомство сразу после рождения в случайном порядке разделили на две группы и либо оставили в тех же световых условиях (LD, контроль), либо перенесли в постоянную темноту (LD/DD). Самок и потомство, рожденное в постоянной темноте, оставили в тех же условиях (DD/DD). В возрасте 3, 6, 12, 18 и 24 мес. у потомства из каждой группы (во всех группах n = 6; по 3 самца и 3 самки) после декапитации были собраны кровь и образцы тканей печени, почек, сердца, скелетной мышцы, легких и селезенки. Все манипуляции в условиях постоянной темноты проводились при красном свете (не более 0.5 лк).
Исследования выполнены с использованием научного оборудования Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”. Содержание α-токоферола определяли методом высокоэффективной жидкостной хроматографии. Для анализа содержания витаминов в тканях животных готовили 10%-ный гомогенат: навеску ткани (100 мг) гомогенизировали в 0.9 мл 0.25 М раствора сахарозы (pH 7.4), содержащей 0.001 М этилендиаминтетрауксусной кислоты. В конические полиэтиленовые пробирки вносили 0.25 мл гомогената или сыворотки крови, добавляли 0.25 мл 0.025%-ного раствора бутилокситолуола в этаноле, тщательно смешивали содержимое пробирки для осаждения белков, затем добавляли 0.5 мл 0.0125%-ного раствора бутилокситолуола в н-гексане, встряхивали в течение 5 мин, затем центрифугировали 10 мин при 3000 об./мин и оставляли образцы на холоде на 40 мин. Концентрацию витамина определяли в гексановом слое на микроколоночном жидкостном хроматографе Милихром 6 (Россия) с ультрафиолетовым детектором при длине волны 292 нм. Элюентом служила смесь гексана с изопропанолом (98.5 : 1.5). Количественную оценку содержания α-токоферола проводили методом внешнего стандарта (Sigma, США) с использованием системы регистрации и обработки хроматографических данных UniChrom 4.x-5.
Полученные данные обрабатывались с использованием пакетов программ MS Exel 2007 и Statgraphics 5.0 общепринятыми методами вариационной статистики и представляли в виде M ± m. Оценку достоверности различий между группами и крысами разного возраста проводили с применением критерия Вилкоксона–Манна–Уитни. Для выявления зависимостей и их характера между изучаемыми показателями в каждом световом режиме использовали корреляционный анализ. Влияние факторов “возраст”, “световой режим” и “пол” оценивали с помощью многофакторного дисперсионного анализа (MANOVA). Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
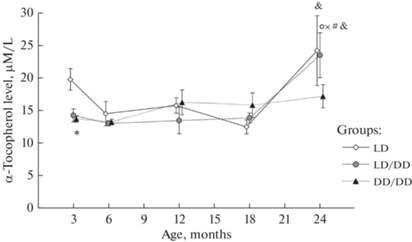
В исследованные периоды онтогенеза в сыворотке крови у 24-месячных крыс в группах LD и LD/DD обнаружено повышение содержания α-токоферола (рис. 1). У контрольных животных в этом возрасте уровень витамина был значительно выше, чем у 18-месячных, тогда как в группе LD/DD разница была достоверной по сравнению со всеми предыдущими возрастными периодами (p < 0.05). В 3-месячном возрасте у крыс группы DD/DD концентрация витамина была значительно ниже, чем у контрольных (p < 0.05).
Рис. 1.
Возрастные изменения содержания α-токоферола в сыворотке крови крыс при разных световых режимах. Здесь и на рис. 2: различия достоверны по сравнению * – с группой LD, ○ – с возрастом 3 мес., × – 6 мес., # – 12 мес., & – 18 мес. (p < 0.05).
В печени содержание α-токоферола у контрольных крыс с возрастом увеличивалось (рис. 2a), значительные различия обнаружены у 12- и 24-месячных животных по сравнению с 3-месячными (p < 0.05). В условиях постоянной темноты уровень витамина у животных повышался в 6-месячном возрасте, а в 12 месяцев наблюдалось его существенное снижение, в группе LD/DD эти изменения были достоверными (p < 0.05). В 18- и 24-месячном возрасте содержание α-токоферола в обеих экспериментальных группах увеличивалось, по сравнению с 12-месячным (p < 0.05). В группах LD/DD и DD/DD уровень витамина в 12 месяцев был значительно ниже, чем в контроле (p < 0.05).
Рис. 2.
Возрастные изменения содержания α-токоферола в печени (a), почках (b), сердце (c), скелетной мышце (d), легких (e) и селезенке (f) крыс при разных световых режимах.
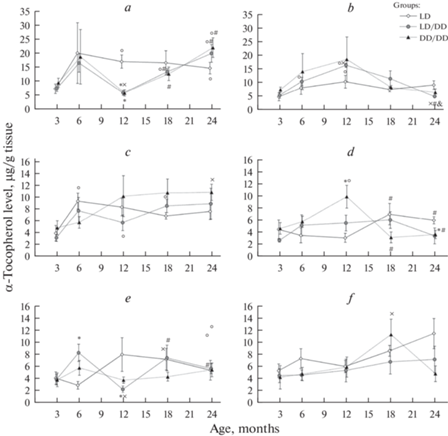
В почках во всех трех группах наблюдалось повышение уровня α-токоферола в 12-месячном возрасте (рис. 2b). Затем в экспериментальных группах содержание витамина снижалось, однако статистически значимо лишь в группе LD/DD, где у крыс самого старшего возраста различия были достоверными по сравнению с 6-, 12- и 18-месячными (p < 0.05). Уровень α-токоферола в сердце у животных всех исследованных групп в 3-месячном возрасте был самым низким (рис. 2c). В контрольной группе содержание витамина повышалось в 6-месячном возрасте (p < 0.05), а затем изменялось незначительно. В группе DD/DD уровень витамина увеличивался в течение всей жизни и у 24-месячных крыс был значительно выше, чем у 6-месячных (p < 0.05). У крыс LD/DD достоверное повышение по сравнению с 3-месячным возрастом выявлено в 12 и 18 месяцев. В селезенке крыс из групп LD и LD/DD не было обнаружено статистически значимых возрастных изменений уровня α-токоферола (рис. 2f). У 18-месячных крыс группы DD/DD содержание витамина было значительно выше, чем у 6-месячных (p < 0.05). Влияния условий освещения на содержание α-токоферола в почках, сердце и селезенке в исследованные возрастные периоды выявлено не было.
В скелетной мышце контрольных крыс содержание α-токоферола значительно повышалось после 12-месячного возраста (p < 0.05, рис. 2d). У крыс DD/DD содержание α-токоферола существенно увеличивалось уже в 12 мес. (p < 0.05) и было выше, чем в контроле (p < 0.05). В 18 и 24 мес. уровень витамина снижался по сравнению с 12-месячными (p < 0.05) и у крыс самого старшего возраста был ниже, чем у контрольных (p < 0.05). В группе LD/DD существенных возрастных изменений уровня α-токоферола обнаружено не было.
В легких контрольных крыс содержание α-токоферола увеличивалось после 6-месячного возраста и в 18 месяцев было значительно выше, чем в 6 (p < 0.05, рис. 2e). В группе LD/DD повышение уровня витамина наблюдалось уже в 6-месячном возрасте, а к 12 месяцам его содержание резко снижалось (p < 0.05). В эти возрастные периоды зафиксированы достоверные различия в уровне α-токоферола по сравнению с контрольной группой (p < 0.05). В 18 и 24 мес. содержание витамина было значительно выше, чем в 12-месячном возрасте (p < 0.05) и практически совпадало с показателями контрольной группы. У крыс DD/DD не было обнаружено возрастных изменений содержания α-токоферола в легких.
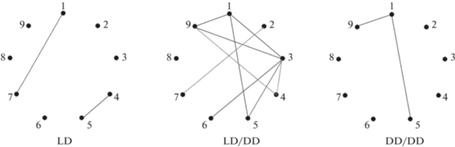
Многофакторный дисперсионный анализ (табл. 1) показал, что возраст и пол животных, а также световой режим оказывали в разной степени выраженное влияние на содержание α-токоферола в сыворотке крови и тканях органов. Большинство изменений было вызвано возрастом, в то время как световой режим оказывал модулирующее влияние на содержание витамина только в скелетной мышце. В легких статистически значимого влияния исследуемых факторов на уровень α-токоферола выявлено не было. В результате корреляционного анализа (рис. 3) обнаружено сравнительно высокое количество зависимостей между изучаемыми показателями у крыс, которых поместили в условия постоянной темноты после рождения. В этой группе наибольшее число связей выявлено с основным депонирующим и регулирующим статус витамина Е органом – печенью.
Таблица 1.
Результаты дисперсионного анализа по влиянию факторов “возраст”, “световой режим” и “пол” на содержание α-токоферола в органах и тканях крыс
| Орган/ткань | Факторы (η%, F, p) | |||||
|---|---|---|---|---|---|---|
| возраст (А) | световой режим (Б) |
пол (В) | АБ | АВ | БВ | |
| Сыворотка крови | 23.6%, 7.7, р < 0.001 |
8.3%, 2.7, р < 0.05 |
||||
| Печень | 14.3%, 3.2, р < 0.05 |
|||||
| Почки | 17.2%, 4.1, р < 0.01 |
|||||
| Сердце | 15.0%, 4.0, р < 0.01 |
11.6%, 3.1, р < 0.05 |
||||
| Скелетная мышца | 3.8%, 4.4, р < 0.05 |
25.7%, 3.7, р < 0.01 |
||||
| Селезенка | 13.8%, 3.7, р < 0.01 |
7.9%, 4.3, р < 0.05 |
||||
Рис. 3.
Влияние световых режимов на корреляционные зависимости между изученными показателями. 1 – возраст животных, 2 – пол животных; содержание α-токоферола в: 3 –печени, 4 – почках, 5 – сердце, 6 – легких, 7 – селезенке, 8 – скелетной мышце, 9 – сыворотке крови; сплошная линия – положительная корреляция, пунктирная линия – отрицательная корреляция; LD, LD/DD, DD/DD – группы животных. Отражены только значимые зависимости (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изучению возрастной динамики содержания витамина Е в связи с его способностью поддерживать клеточную функцию при старении уделяется большое внимание. Данные литературы, касающиеся возрастных изменений уровня α-токоферола в тканях противоречивы. Во многих исследованиях сообщается о возрастном увеличении концентрации витамина в крови [19, 20], что в основном связано с механизмами, контролирующими циркулирующие липиды [21], содержание которых в крови повышается с возрастом [22]. В нашем исследовании содержание α-токоферола в сыворотке крови увеличивалось у 24-месячных крыс в контрольной группе и находившихся в условиях световой депривации с момента рождения. В 3-месячном возрасте уровень витамина в крови крыс групп LD/DD и DD/DD был ниже, чем у контрольных, что могло являться следствием снижения у них содержания α-токоферола на ранних этапах постнатального онтогенеза под влиянием постоянной темноты [18].
Известно, что уровень витамина Е в тканях также зависит от содержания в них липидов [23], а при старении вследствие нарушения дифференцировки преадипоцитов белой жировой ткани в организме происходит перераспределение липидов и накопление их в органах, таких как печень, сердце и скелетные мышцы [24, 25]. Рядом авторов было установлено значительное увеличение уровня витамина Е в печени, почках и сердце старых крыс и мышей [26–28]. В своей работе Linard с соавт. [28] пришли к выводу, что повышение содержания витамина Е в микросомальной мембране печени связано со снижением перекисных процессов в связи с возрастным уменьшением доли n-6 полиненасыщенных жирных кислот в мембранных фосфолипидах и наблюдалось при сбалансированном содержании в корме крыс линолевой и α-линоленовой кислот. В другом исследовании в печени 12- и 24-месячных крыс показатели перекисного окисления липидов были значительно выше, а уровень эндогенных антиоксидантов ниже, чем у 3-месячных [29]. В сердечной мышце крыс было зарегистрировано возрастное снижение содержания α-токоферола, что сопровождалось повышением окислительных повреждений митохондрий [30]. В печени и сердце мышей после 6-месячного возраста было выявлено уменьшение уровня α-токоферола, нормализованного по содержанию триглицеридов [31]. Другими авторами не было обнаружено различий в уровне витамина Е в печени и сердце между молодыми (3-месячными) и старыми (20-месячными) крысами [32]. Вероятно, одним из важнейших факторов, определяющих содержание витамина Е в тканях является интенсивность перекисных процессов, которая во многом зависит от природы жирных кислот, поступающих в организм с пищей [28, 33].
В нашем исследовании в стандартных условиях освещения содержание α-токоферола у взрослых и старых крыс было выше, чем у молодых в печени, почках и сердце. В скелетной мышце уровень витамина увеличивался после 12-месячного возраста, а в легких у крыс старше 6 месяцев. Длительная световая депривация модулировала возрастные изменения содержания α-токоферола в печени, скелетной мышце и легких. При этом у 12-месячных крыс различия с контрольной группой наблюдались в тканях всех этих органов: более низкие значения в печени в обеих экспериментальных группах и в легких в группе LD/DD, более высокое значение в скелетной мышце в группе DD/DD.
Регулярно чередующиеся циклы света и темноты синхронизируют циркадные часы организма, которые генерируют примерно 24-часовые суточные ритмы поведения, физиологических и обменных процессов. В условиях постоянной темноты циркадные ритмы сохраняются, однако в отсутствие световых стимулов являются “свободно текущими” и отличаются от 24-часового ритма [10, 12]. В печени циркадные ритмы в первую очередь определяются графиком кормления [34], однако цикл света и темноты является необходимым условием для автономного функционирования циркадных часов органа [35]. Установлено, что у мышей, находившихся в условиях постоянной темноты в течение 6 недель, в печени эндогенный циркадный ритм часовых генов, генов системы цитохрома P 450 и метаболизма липидов устойчиво сохраняется, однако немного изменяется период и амплитуда их колебаний [14]. На уровне организма, нарушение синхронности в функционировании центральных и периферических циркадных часов может нарушать метаболический гомеостаз [14, 36].
Печень и скелетные мышцы считаются основными метаболическими тканями, поэтому их скоординированное функционирование является решающим условием нормального протекания обменных процессов [37]. В печени часовыми генами регулируется множество метаболических путей – от дыхания митохондрий, биогенеза рибосом и секреции белков до специфических для гепатоцитов функций, таких как липогенез, детоксикация ксенобиотиков, синтез холестерина и желчных кислот [6]. Циркадные часы скелетных мышц, регулирующие процессы транскрипции, обмен веществ, в том числе гомеостаз липидов, а также миогенную способность модулируются условиями освещения посредством нейрогуморальных и температурных сигналов [37, 38]. В экспериментах на моделях с нарушениями молекулярных часов чаще всего патологии возникают именно в скелетных мышцах [39]. Установлено, что у мышей с дефицитом в скелетных мышцах гена Bmal 1 снижается утилизация тканью глюкозы и активируется более энергоемкий путь окисления жирных кислот, что приводит к уменьшению уровня циркулирующих липидов и их запаса в печени [36, 38].
Печень играет центральную роль в регуляции распределения и экскреции различных форм витамина Е, который метаболизируется подобно ксенобиотикам [2]. Значительное снижение содержания α-токоферола в печени 12-месячных крыс, содержавшихся в постоянной темноте, может быть связано либо со снижением его всасывания в кишечнике и поглощения печенью, либо с усиленным расходованием. Известно, что в регуляции процессов абсорбции и транспорта липидов, в том числе витамина Е, принимают участие часовые гены [5]. Вместе с тем отсутствие различий между группами в уровне витамина в сыворотке крови и значительное повышение его содержания в скелетной мышце у крыс группы DD/DD может свидетельствовать о перераспределении α-токоферола между печенью и скелетной мышцей. У 12-месячных крыс группы LD/DD уровень витамина в этой ткани также был выше, чем в контроле, однако разница не была статистически значимой. Увеличение содержания α-токоферола в скелетной мышце может быть связано с накоплением в миоцитах липидов, когда поглощение жирных кислот превышает скорость их окисления [40]. Важную роль в доставке α-токоферола в периферические ткани из липопротеинов и хиломикронов играет липопротеиновая липаза, контролирующая поглощение жирных кислот тканями в соответствии с их потребностями. Скелетные мышцы являются одним из основных мест экспрессии этого фермента, активность которого регулируется множеством факторов, в том числе циркадным ритмом [40, 41]. Чрезмерное поступление липидов может приводить к метаболической дисфункции скелетных мышц, нарушению энергетического баланса в организме, что является потенциальной причиной метаболического синдрома [41, 42]. При этом возникновение в мышечной ткани резистентности к инсулину, являющейся первопричиной развития этого заболевания, связывают с накоплением в миоцитах внутриклеточных метаболитов жирных кислот и нарушением окислительно-восстановительного баланса [43, 44]. Вероятно, это могло быть причиной значительного снижения содержания α-токоферола в скелетной мышце крыс в группе DD/DD к 18-месячному возрасту, который оставался примерно на том же уровне у 24-месячных животных и был существенно ниже, чем в контроле. У 24-месячных крыс группы LD/DD уровень α-токоферола в скелетной мышце также снижался до значений, сопоставимых с группой DD/DD, однако существенных различий с контролем обнаружено не было. Следует отметить, что метаболические нарушения часто сопровождаются изменениями массы тела [44]. В процессе исследования нами не было зафиксировано значимых различий массы тела между крысами контрольной и экспериментальных групп (данные не приводятся).
Помимо печени и скелетной мышцы, модулирующее действие длительной световой депривации на содержание α-токоферола было обнаружено в легких у крыс группы LD/DD в возрасте 6 и 12 мес. В раннем онтогенезе уровень витамина в легких у животных обеих экспериментальных групп был ниже, чем у контрольных [18]. В 3 мес. эта разница нивелировалась, а в возрасте 6 и 12 мес. наблюдались отличия в направленности изменений уровня α-токоферола между контрольной и LD/DD группами. То, что влияние световой депривации на содержание витамина Е в позднем онтогенезе проявилось в группе, помещенной в экспериментальные условия после рождения, связано, вероятно, с особенностями постнатального развития легких. У крыс альвеоляризация этого органа продолжается до 60-го дня [45], а конец второй постнатальной недели считается наиболее уязвимым периодом в развитии дыхательной системы, когда происходит структурно-функциональное становление систем, контролирующих дыхание [46]. Нарушение в этот период взаимосвязанных нейроэндокринной, вегетативной и иммунной систем может привести к повышенной реактивности и чувствительности дыхательных путей к воспалению, а также к снижению функции легких во взрослом возрасте [47]. В течение первых двух недель после рождения заканчивается формирование собственной циркадной системы. Важную роль в этом процессе играют материнский мелатонин, поступающий с молоком, а с началом функционирования фоторецепторов сетчатки важны и условия освещения [17]. В связи с пластичностью циркадной системы в данном возрасте воздействующие на организм факторы, такие как уровень мелатонина и световые условия, могут оказывать долгосрочные эффекты на различные физиологические системы. В плодный и ранний постнатальный периоды мелатонин действует как нейроэндокринный модификатор нервной, сердечно-сосудистой, иммунной систем, а также энергетического метаболизма [48]. Экспериментально показано, что при отсутствии световых импульсов в течение 10 дней концентрация мелатонина в крови крыс увеличивается [49]. Можно предположить, что в нашем исследовании изменения в содержании α-токоферола в легких в позднем онтогенезе у крыс, помещенных в постоянную темноту после рождения, связаны с влиянием повышенного уровня мелатонина, поступающего с молоком матери, и модификацией в функционировании циркадной системы, вызванной отсутствием света. Известно, что антиоксидантная функция витамина Е в защите мембранных липидов от окислительных повреждений становится еще более актуальной в легких, которые непосредственно подвергаются воздействию кислорода, а также различных оксидантов и микроорганизмов, содержащихся в воздухе. Ткань легких и альвеолярный сурфактант содержат большое количество ненасыщенных жирных кислот, которые являются субстратом для перекисного окисления липидов [50]. У крыс контрольной группы уровень α-токоферола в легких повышался с возрастом, что согласуется с данными литературы [51]. Резкие изменения содержания витамина у 6- и 12-месячных крыс группы LD/DD являются, вероятно, результатом реакции антиоксидантной системы легких, свидетельствующим о нарушениях в функционировании дыхательной системы в этом возрасте. Причем увеличение уровня α-токоферола может наблюдаться в результате его мобилизации из других тканей в случае повышенной потребности при каких-либо экстремальных воздействиях [50].
В нашем исследовании большинство различий с контрольной группой в содержании α-токоферола было обнаружено у 12-месячных крыс. С возрастом в организме происходит ряд метаболических изменений, большинство которых у крыс наблюдается к концу первого года жизни, а нарушения циркадной ритмичности, вероятно, способствуют определенным процессам, усугубляющим эти изменения. В печени обнаружено снижение уровня транскриптов генов, кодирующих ферменты семейства цитохрома P 450 [52]. В крови самцов крыс Вистар выявлено значительное усиление окислительного стресса в возрастном периоде между 8 и 12 мес. [53]. У 12-месячных самок крыс в печени, почках, сердце и легких наблюдались более высокие уровни вызванного окислительным стрессом повреждения белков, липидов и ДНК и низкая антиоксидантная эффективность по сравнению с молодыми 3-месячными животными [54]. Мы не обнаружили влияния условий освещения на уровень α-токоферола в большинстве исследованных органов у крыс старшего возраста (18 и 24 мес.). Старение связано с нарушениями в функционировании циркадной системы, что проявляется в уменьшении амплитуды, фазы и продолжительности периода циркадных ритмов, повышении тенденции к внутренней десинхронизации и нарушении синхронизации с окружающей средой [34]. Как сообщают Nakamura и соавт. [55], регулярно повторяющиеся циклы света и темноты маскируют некоторые возрастные нарушения циркадных колебаний часовых генов в супрахиазматических ядрах мышей, которые проявляются в условиях световой депривации. Результаты нашего исследования свидетельствуют о том, что у старых крыс содержание в условиях постоянной темноты повлияло на уровень α-токоферола в скелетной мышце, что может быть связано с ролью мышц в обмене основных метаболических субстратов в организме.
Таким образом, модулирующее влияние длительной световой депривации на возрастную динамику содержания α-токоферола было обнаружено в печени, скелетной мышце и легких, причем большинство изменений наблюдалось у 12-месячных крыс. В обеих экспериментальных группах в этом возрасте уровень витамина значительно снижался в печени, а в группе DD/DD увеличивался в скелетной мышце. Вероятно, длительное нахождение в условиях постоянной темноты привело к нарушению гомеостаза основных энергетических субстратов скелетных мышц, что вызвало накопление в миоцитах липидов и α-токоферола. Эти метаболические нарушения могли являться причиной возрастных изменений в мышечной функции у старых животных, которые привели к значительному снижению уровня витамина у 24-месячных крыс в группе DD/DD. Воздействие световой депривации с момента рождения повлияло на возрастные изменения уровня α-токоферола в легких 6- и 12-месячных крыс, что может быть связано с особенностями постнатального развития этих органов. У стареющих и старых животных воздействие постоянной темноты, вероятно, сглаживается возрастными нарушениями в функционировании циркадной системы, поэтому в большинстве исследованных органов изменения в содержании витамина отсутствовали. Выявленные в результате исследования особенности возрастной динамики уровня α-токоферола в организме крыс, содержавшихся в постоянной темноте, подтверждают важную роль циркадных ритмов в обменных процессах. Полученные данные могут быть полезны при оценке физиологического состояния людей, работающих или проживающих в условиях пониженной освещенности.
Список литературы
Mocchegiani E, Costarelli L, Giacconi R, Malavolta M, Basso A, Piacenza F, Ostan R, Cevenini E, Gonos ES, Franceschi C, Monti D (2014) Vitamin E – gene interactions in aging and inflammatory age-related diseases: Implications for treatment. A systematic review. Ageing Res Rev 14: 81–101. https://doi.org/10.1016/j.arr.2014.01.001
Traber MG (2013) Mechanisms for the prevention of vitamin E excess. J Lipid Res 54(9): 2295–2306. https://doi.org/10.1194/jlr.R032946
Hulbert AJ, Pamplona R, Buffenstein R, Buttemer WA (2007) Life and Death: Metabolic Rate, Membrane Composition, and Life Span of Animals. Physiol Rev 87: 1175–1213. https://doi.org/10.1152/physrev.00047.2006
Mulligan AA, Hayhoe RPG, Luben RN, Welch AA (2021) Positive Associations of Dietary Intake and Plasma Concentrations of Vitamin E with Skeletal Muscle Mass, Heel Bone Ultrasound Attenuation and Fracture Risk in the EPIC-Norfolk Cohort. Antioxidants 10(2): 159. https://doi.org/10.3390/antiox10020159
Hussain MM, Pan X (2015) Circadian regulation of macronutrient absorption. J Biol Rhythms 30(6): 459–469. https://doi.org/10.1177/0748730415599081
Janich P, Meng Q-J, Benitah SA (2014) Circadian control of tissue homeostasis and adult stem cells. Curr Opin Cell Biol 31: 8–15. https://doi.org/10.1016/j.ceb.2014.06.010
Reiter RJ, Rosales‑Corral S, Tan DX, Jou MJ, Galano A, Xu B (2017) Melatonin as a mitochondria‑targeted antioxidant: one of evolution’s best ideas. Cell Mol Life Sci 74: 3863–3881. https://doi.org/10.1007/s00018-017-2609-7
Анисимов ВН (2008) Молекулярные и физиологические механизмы старения (в 2-х т.). СПб. Наука. Т 1. [Anisimov VN (2008) Molecular and Physiological Mechanisms of Aging. St Petersburg. Nauka. V 1. (In Russ)].
Owino S, Buonfiglio DDC, Tchio C, Tosini G (2019) Melatonin Signaling a Key Regulator of Glucose Homeostasis and Energy Metabolism. Front Endocrinol 10: 488. https://doi.org/10.3389/fendo.2019.00488
González MMC (2018) Dim Light at Night and Constant Darkness: Two Frequently Used Lighting Conditions That Jeopardize the Health and Well-being of Laboratory Rodents. Front Neurol 9: 609. https://doi.org/10.3389/fneur.2018.00609
Tapia-Osorio A, Salgado-Delgado R, Angeles-Castellanos M, Escobar C (2013) Disruption of circadian rhythms due to chronic constant light leads to depressive and anxiety-like behaviors in the rat. Behav Brain Res 252: 1–9. https://doi.org/10.1016/j.bbr.2013.05.028
Hartley S, Dauvilliers Y, Quera-Salva M-A (2018) Circadian Rhythm Disturbances in the Blind. Curr Neurol Neurosci Rep 18: 65. https://doi.org/10.1007/s11910-018-0876-9
Lockley SW, Arendt J, Skene DJ (2007) Visual impairment and circadiam rhythm disorders. Dialogues Clin Neurosci 9(3): 301–314. https://doi.org/10.31887/DCNS.2007.9.3/slockley
Li H, Zhang S, Zhang W, Chen S, Rabearivony A, Shi Y, Liu J, Corton CJ, Liu C (2020) Endogenous circadian time genes expressions in the liver of mice under constant darkness. BMC Genomics 21: 224. https://doi.org/10.1186/s12864-020-6639-4
Talaei SA, Azami A, Salami M (2016) Developmental effect of light deprivation on synaptic plasticity of rats' hippocampus: implications for melatonin. Iran J Basic Med Sci 19: 899–909.
Bishnupuri KS, Haldar C (2000) Impact of photoperiodic exposures during late gestation and lactation periods on the pineal and reproductive physiology of the Indian palm squirrel, Funambulus pennant. J Reprod Fertil 118: 295–301. https://doi.org/10.1530/jrf.0.1180295
Brooks E, Canal MM (2013) Development of circadian rhythms: Role of postnatal light environment. Neurosci Biobehav Rev 37: 551–560. https://doi.org/10.1016/j.neubiorev.2013.02.012
Baishnikova IV, Ilyina TN, Khizhkin EA, Ilyukha VA, Vinogradova IA (2021) Effect of Long-Term Light Deprivation on α-Tocopherol Content in Rats during Ontogeny. Bull Exp Biol Med 170(3): 294–298. https://doi.org/10.1007/s10517-021-05054-1
Stuetz W, Weber D, Dollé MET, Jansen E, Grubeck-Loebenstein B, Fiegl S, Toussaint O, Bernhardt J, Gonos ES, Franceschi C, Sikora E, Moreno-Villanueva M, Breusing N, Grune T, Bürkle A (2016) Plasma Carotenoids, Tocopherols, and Retinol in the Age-Stratified (35–74 Years) General Population: A Cross-Sectional Study in Six European Countries. Nutrients 8(10): 614. https://doi.org/10.3390/nu8100614
Grolier P, Boirie Y, Levadoux E, Brandolini M, Borel P, Azais-Braesco V, Beaufrère B, Ritz P (2000) Age-related changes in plasma lycopene concentrations, but not in vitamin E, are associated with fat mass. Br J Nutr 84: 711–716. https://doi.org/10.1017/S0007114500002063
Traber MG, Leonard SW, Bobe G, Fu X, Saltzman E, Grusak MA, Booth SL (2015) α-Tocopherol disappearance rates from plasma depend on lipid concentrations: studies using deuterium-labeled collard greens in younger and older adults. Am J Clin Nutr 101(4): 752–759. https://doi.org/10.3945/ajcn.114.100966
Nesic DM, Stevanovic DM, Stankovic SD, Milosevic VL, Trajkovic V, Starcevic VP, Severs WB (2013) Age-dependent modulation of central ghrelin effects on food intake and lipid metabolism in rats. Eur J Pharmacol 710: 85–91. https://doi.org/10.1016/j.ejphar.2013.03.052
Szewczyk K, Chojnacka A, Górnicka M (2021) Tocopherols and Tocotrienols – Bioactive Dietary Compounds; What Is Certain, What Is Doubt? Int J Mol Sci 22: 6222. https://doi.org/10.3390/ijms22126222
Zhao L, Zou X, Feng Z, Luo C, Liu J, Li H, Chang L, Wang H, Li Y, Long J, Gao F, Liu J (2014) Evidence for association of mitochondrial metabolism alteration with lipid accumulation in aging rats. Exp Gerontol 56: 3–12. https://doi.org/10.1016/j.exger.2014.02.001
Kim JY, Kim DH, Choi J, Park J-K, Jeong K-S, Leeuwenburgh C, Yu BP, Chung HY (2009) Changes in lipid distribution during aging and its modulation by calorie restriction. Age 31: 127–142. https://doi.org/10.1007/s11357-009-9089-0
König J, Besoke F, Stuetz W, Malarski A, Jahreis G, Grune T, Höhn A (2016) Quantification of age-related changes of α-tocopherol in lysosomal membranes in murine tissues and human fibroblasts. Biofactors 42(3): 307–315. https://doi.org/10.1002/biof.1274
van der Loo B, Labugger R, Aebischer CP, Skepper JN, Bachschmid M, Spitzer V, Kilo J, Altwegg L, Ullrich V, Lüscher TF (2002) Cardiovascular Aging Is Associated With Vitamin E Increase. Circulation 105: 1635–1638. https://doi.org/10.1161/01.CIR.0000014986.29834.71
Linard A, Macaire J-P, Christon R (2001) Phospholipid hydroperoxide glutathione peroxidase activity and vitamin E level in the liver microsomal membrane: effects of age and dietary a-linolenic acid deficiency. J Nutr Biochem 12: 481–491. https://doi.org/10.1016/s0955-2863(01)00165-6
Manikonda PK, Jagota A (2012) Melatonin administration differentially affects age-induced alterations in daily rhythms of lipid peroxidation and antioxidant enzymes in male rat liver. Biogerontology 13: 511–524. https://doi.org/10.1007/s10522-012-9396-1
Kamzalov S, Sohal RS (2004) Effect of age and caloric restriction on coenzyme Q and alpha-tocopherol levels in the rat. Exp Gerontol 39(8): 1199–1205. https://doi.org/10.1016/j.exger.2004.04.007
Takahashi K, Takisawa S, Shimokado K, Kono N, Arai H, Ishigami A (2017) Age‑related changes of vitamin E: α‑tocopherol levels in plasma and various tissues of mice and hepatic α‑tocopherol transfer protein. Eur J Nutr 56:1317–1327. https://doi.org/10.1007/s00394-016-1182-4
Çoban J, Öztezcan S, Doğru-Abbasoğlu S, Bingül I, Yeşil-Mizrak1 K, Uysal M (2014) Olive leaf extract decreases age-induced oxidative stress in major organs of aged rats. Geriatr Gerontol Int 14(4): 996–1002. https://doi.org/10.1111/ggi.12192
Navarro-Hortal MD, Ramírez-Tortosa CL, Varela-López A, Romero-Márquez JM, Ochoa JJ, Ramírez-Tortosa MC, Forbes-Hernández TY, Granados-Principal S, Battino M, Quiles JL (2019) Heart Histopathology and Mitochondrial Ultrastructure in Aged Rats Fed for 24 Months on Different Unsaturated Fats (Virgin Olive Oil, Sunflower Oil or Fish Oil) and Affected by Different Longevity. Nutrients 11: 2390. https://doi.org/10.3390/nu11102390
Sadria M, Layton AT (2021) Aging affects circadian clock and metabolism and modulates timing of medication. Science 24(4): 102245. https://doi.org/10.1016/j.isci.2021.102245
Koronowski KB, Kinouchi K, Welz P-S, Smith JG, Zinna VM, Shi J, Samad M, Chen S, Magnan CN, Kinchen JM, Li W, Baldi P, Benitah SA, Sassone-Corsi1 P (2019) Defining the Independence of the Liver Circadian Clock. Cell 177(6): 1448–1462. https://doi.org/10.1016/j.cell.2019.04.025
Yin H, Li W, Chatterjee S, Xiong X, Saha P, Yechoor V, Ma K (2020) Metabolic-sensing of the skeletal muscle clock coordinates fuel oxidation. FASEB J 34(5): 6613–6627. https://doi.org/10.1096/fj.201903226RR
Harfmann BD, Schroder EA, Esser KA (2015) Circadian Rhythms, the Molecular Clock, and Skeletal Muscle. J Biol Rhythms 30(2): 84–94. https://doi.org/10.1177/0748730414561638
Harfmann BD, Schroder EA, Kachman MT, Hodge BA, Zhang X, Esser KA (2016) Muscle-specific loss of Bmal1 leads to disrupted tissue glucose metabolism and systemic glucose homeostasis. Skelet Muscle 6: 12. https://doi.org/10.1186/s13395-016-0082-x
Andrews JL, Zhang X, McCarthy JJ, McDearmonc EL, Hornberger TA, Russell B, Campbell KS, Arbogast S, Reid MB, Walker JR, Hogeneschg JB, Takahashi JS, Essera KA (2010) CLOCK and BMAL1 regulate MyoD and are necessary for maintenance of skeletal muscle phenotype and function. PNAS 107: 4419090–19095. https://doi.org/10.1073/pnas.1014523107/-/DCSupplemental
Kersten S (2014) Physiological regulation of lipoprotein lipase. Biochim Biophys Acta 1841: 919–933. https://doi.org/10.1016/j.bbalip.2014.03.013
Delezie J, Dumont S, Dardente H, Oudart H, Gréchez-Cassiau A, Klosen P, Teboul M, Delaunay F, Pévet P, Challet E (2012). The nuclear receptor REV-ERBα is required for the daily balance of carbohydrate and lipid metabolism. FASEB J 26(8): 3321–3335. https://doi.org/10.1096/fj.12-208751
Kim JK, Fillmore JJ, Chen Y, Yu C, Moore IK, Pypaert M, Lutz EP, Kako Y, Velez-Carrasco W, Goldberg IJ, Breslow JL, Shulman GI (2001) Tissue-specific overexpression of lipoprotein lipase causes tissue-specific insulin resistance. PNAS 98(13): 7522–7527. https://doi.org/10.1073ypnas.121164498
Gilbert M (2021) Role of skeletal muscle lipids in the pathogenesis of insulin resistance of obesity and type 2 diabetes. J Diabetes Invest 12(11): 1934–1941. https://doi.org/10.1111/jdi.13614
Park SS, Seo Y-K (2020) Excess Accumulation of Lipid Impairs Insulin Sensitivity in Skeletal Muscle. Int J Mol Sci 21(6): 1949. https://doi.org/10.3390/ijms21061949
Tschanz SA, Salm LA, Roth-Kleiner M, Barré SF, Burri PH, Schittny JC (2014) Rat lungs show a biphasic formation of new alveoli during postnatal development. J Appl Physiol 117: 89–95. https://doi.org/10.1152/japplphysiol.01355.2013
Wong-Riley MTT, Liu Q, Gao X (2019) Mechanisms underlying a critical period of respiratory development in the rat. Respir Physiol Neurobiol 264: 40–50. https://doi.org/10.1016/j.resp.2019.04.006
Wright RJ (2010) Perinatal stress and early life programming of lung structure and function. Biol Psychol 84: 46–56. https://doi.org/10.1016/j.biopsycho.2010.01.007
Motta-Teixeira LC, Machado-Nils AV, Battagello DS, Diniz GB, Andrade-Silva J, Silva S Jr, Matos RA, do Amaral FG, Xavier GF, Bittencourt JC, Reiter RJ, Lucassen PJ, Korosi A, Cipolla-Neto J (2018) The absence of maternal pineal melatonin rhythm during pregnancy and lactation impairs offspring physical growth, neurodevelopment, and behavior. Horm Behav 105: 146–156. https://doi.org/10.1016/j.yhbeh.2018.08.006
Farhadi N, Gharghani M, Farhadi Z (2016) Effects of long-term light, darkness and oral administration of melatonin on serum levels of melatonin. Biomed J 39: 81–84. https://doi.org/10.1016/j.bj.2015.09.003
Kolleck I, Sinha P, Rüstow B (2002) Vitamin E as an Antioxidant of the Lung Mechanisms of Vitamin E Delivery to Alveolar Type II Cells. Am J Respir Crit Med 166(12 Pt 2): S62–S66. https://doi.org/10.1164/rccm.2206019
Matsuo M, Gomi F, Dooley MM (1992) Age-related alterations in antioxidant capacity and lipid peroxidation in brain, liver, and lung homogenates of normal and vitamin E-deficient rats. Mech Ageing Dev 64(3): 273–292. https://doi.org/10.1016/0047-6374(92)90084-q
Mori K, Blackshear PE, Lobenhofer EK, Parker JS, Orzech DP, Roycroft JH, Walker KL, Johnson KA, Marsh TA, Irwin RD, Boorman GA (2007) Hepatic Transcript Levels for Genes Coding for Enzymes Associated with Xenobiotic Metabolism are Altered with Age. Toxicol Pathol 35: 242–251. https://doi.org/10.1080/01926230601156286
Kumar D, Rizvi SI (2014) A critical period in lifespan of male rats coincides with increased oxidative stress. Arch Gerontol Geriatr 58(3): 427–433. https://doi.org/10.1016/j.archger.2013.11.006
Braidy N, Guillemin GJ, Mansour H, Chan-Ling T, Poljak A, Grant R (2011) Age Related Changes in NAD+ Metabolism Oxidative Stress and Sirt1 Activity in Wistar Rats. PLoS One 6(4): e19194. https://doi.org/10.1371/journal.pone.0019194
Nakamura TJ, Nakamura W, Tokuda IT, Ishikawa T, Kudo T, Colwell CS, Block GD (2015) Age-Related Changes in the Circadian System Unmasked by Constant Conditions. ENEURO 2(4): 0064-15.2015. https://doi.org/10.1523/ENEURO.0064-15.2015
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


