Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1279-1290
Особенности экспрессии регулятора стресса эндоплазматического ретикулума XBP1 в кишечно-ассоциированной лимфоидной ткани у крыс линии Вистар в условиях хронического стресса
И. А. Топол 1, *, И. С. Полякова 1, А. В. Елыкова 1, А. М. Камышный 2
1 Белгородский государственный национальный исследовательский университет
Белгород, Россия
2 Тернопольский государственный медицинский университет
Тернополь, Украина
* E-mail: innatopol08@gmail.com
Поступила в редакцию 19.03.2022
После доработки 31.07.2022
Принята к публикации 02.08.2022
- EDN: GVTNWE
- DOI: 10.31857/S0869813922100119
Аннотация
Хронический социальный стресс способен вызывать физиологические нарушения, провоцируя развитие депрессии и тревоги, а стресс-индуцированная иммунная дисрегуляция является триггером развития многих патологических состояний, включая воспалительные заболевания кишечника. Новые данные на экспериментальных моделях животных предполагают определенную связь между стрессом эндоплазматического ретикулума, депрессией и развитием воспалительного процесса. В условиях клеточного стресса количество белков с нарушенным фолдингом растет, что приводит к развитию стресса эндоплазматического ретикулума. Стресс эндоплазматического ретикулума, в свою очередь, активирует систему “ответа на несвернутые белки” (unfolded protein response, UPR), среди которых чрезвычайно важное значение имеет сигнальная система IRE1–XBP1. Транскрипционный фактор XBP1 является ответственным за регуляцию экспрессии большого количества генов, причастных к правильному свертыванию и созреванию белков, деградации неправильно свернутых белков, регуляции иммунных реакций, а изменения его экспрессии могут существенно влиять на риск развития заболевания и прогрессировании воспалительных и аутоиммунных заболеваний, включая воспалительные заболевания кишечника.
Ситуация, сложившаяся в последние годы в современном обществе, характеризуется высоким уровнем социального напряжения, при котором стрессы приобретают затяжной характер. Активация реакции на стресс приводит к изменениям, связанным с возможностью организма скорректировать свой гомеостаз и таким образом минимизировать потенциальное воздействие угрозы. Однако хронический социальный стресс способен вызывать физиологические нарушения не только в нейроэндокринной системе, провоцируя развитие депрессии и тревоги, но и приводить к изменениям функционирования врожденного и адаптивного иммунитета, а стресс-индуцированная иммунная дисрегуляция является триггером развития многих патологических состояний, включая воспалительные заболевания кишечника [1].
Как известно, даже в нормальных физиологических условиях до 30% белков, синтезируемых на рибосомах, имеют нарушенную третичную и четвертичную структуру (так называемые “дефектные рибосомальные продукты”) [2–4]. В условиях клеточного стресса количество таких белков с нарушенным фолдингом растет еще больше, что приводит к развитию стресса эндоплазматического ретикулума (СЭР) и функциональной перегрузке системы молекулярных шаперонов и убиквитин-протеасомной системы [2, 5]. Это, в свою очередь, нарушает уровень презентации эндогенных пептидов антиген-представляющим клеткам и может приводить к развитию аутофагии, апоптоза или воспаления [6, 7]. Как противодействие развитию СЭР в клетках активируется система “ответа на несвернутые белки” (unfolded protein response, UPR), которая необходима для сохранения ее функциональной целостности [3–5]. Этот процесс носит защитный, приспособительный характер, позволяя клеткам нивелировать нарушения, связанные со СЭР. Однако если синтез, фолдинг, транспорт и деградация белков не нормализуются, в клетке развивается апоптоз из-за прямой активации протеаз (специфичной для эндоплазматического ретикулума каспазы 12), ряда протеинкиназ (Ask, JNK, р38 МАРК) и транскрипционных факторов (ATF4, ATF6) [6–9].
Среди трех канонических путей, регулирующих развитие СЭР, чрезвычайно важное значение имеет сигнальная система IRE1–XBP1. При стрессе ЭПР происходит активация трансмембранной киназы/эндорибонуклеазы IRE1, которая специфически распознает 5' и 3' сайты сплайсинга мРНК XBP1 и вырезает 2-й нуклеотидный интрон – короткую последовательность длиной 26 пН [2, 10]. Это приводит к сдвигу рамки считывания и трансляции активного транскрипционного фактора XBP1 длиной в 376 аминокислот. Образование и накопление сплайсинговой формы мРНК гена XBP1 является характерным маркером активации сигнального пути IRE1–XBP1 системы UPR, координирующей метаболические и иммунные реакции [11–14]. Именно этот альтернативный сплайс-вариант транскрипционного фактора XBP1 отвечает за регуляцию экспрессии сотен генов, причастных к правильному свертыванию и созреванию белков, в том числе к деградации неправильно свернутых белков [10].
Как известно, транскрипционный фактор XBP1 (X box-binding protein 1) был первоначально выявлен как критический фактор в регуляции экспрессии генов главного комплекса гистосовместимости (МНС, от англ. major histocompatibility complex) II класса у человека в начале 90-х годов. Позднее в ряде исследований на экспериментальных моделях грызунов была показана ключевая роль XBP1 в регуляции иммунных реакций, в частности продукции провоспалительных цитокинов. А изменение уровня транскрипционной активности XBP1 оказывало существенное влияние на риск развития воспалительных и аутоиммунных заболеваний, в том числе воспалительных заболеваний кишечника, так как снижение его экспрессии блокировало продукцию антимикробных пептидов клетками Панета, вызывало развитие СЭР, гиперактивацию IRE1 и в дальнейшем могло приводить к активации генов провоспалительных цитокинов, развитию хронического воспаления и клеточной смерти (в первую очередь аутофагии) [4, 6, 7, 10].
Представляют интерес данные о наличие функциональной связи между СЭР и хроническим социальным стрессом, в частности, в ряде работ показана взаимосвязь системы “ответа на несвернутые белки” с развитием стресс-индуцированной депрессии и когнитивных нарушений у крыс [15–17], а изменения уровня экспрессии ключевых регуляторов PERK, IRE1a и ATF6a индуцировали развитие апоптоза в условиях хронического социального стресса [18, 19]. Это, в свою очередь, дает возможность предположить участия стресса ЭПР в развитии и прогрессировании воспалительных и аутоиммунных заболеваний в условиях хронического социального стресса.
Учитывая литературные данные, нами было допущено, что одним из возможных механизмов изменения функционального состояния иммунных структур, ассоциированных со слизистыми оболочками желудочно-кишечного тракта в условиях ХСС являлось снижение экспрессии транскрипционного фактора ХВР1, и как следствие, нарушение дифференциации и выживания дендритных клеток, В- и Т-лимфоцитов с последующей активацией продукции провоспалительных цитокинов иммунными клетками.
В связи с этим, целью настоящей работы было изучение уровня экспрессии мРНК XBP1, провоспалительных цитокинов IL-1β, IL-17α в кишечно-ассоциированной лимфоидной ткани у крыс линии Вистар в экспериментальных моделях хронического социального стресса.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводились на 60 половозрелых самках крыс линии Вистар. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами Украины, принципам Базельской декларации и рекомендациям комиссии по биоэтике Института физиологии НАН Украины (от 21.02.2006 № 3447-IV). Животные случайным образом были разделены на 3 экспериментальные группы по 20 крыс: контрольные крысы (группа 1), которые содержались в стандартных условиях, со свободным доступом к воде и пище, такие параметры содержания, как температура и влажность, поддерживались постоянными на протяжении всего эксперимента. Крысы, которым моделировали хронический социальный стресс ХСС1 путем трехнедельной социальной изоляции и длительного психоэмоционального воздействия, содержались в условиях перманентного проживания самок в “агрессивной среде”, а именно, через перфорированную перегородку в клетке с агрессивным самцом, ежедневно вступающим в конфронтации с подсаженным к нему другим самцом (группа 2). Группу 3 составляли крысы, которым моделировали ХСС2 путем содержания животных в перенаселенных клетках с ежедневной сменой группировки, при этом подопытную самку каждый день помещали в новую сбалансированную и перенаселенную колонию.
Для получения доказательства того, что у крыс действительно развился социальный стресс, выраженный проявлением тревожности и депрессивного состояния, были проведены характерные поведенческие тесты. Уровень эмоционально-поведенческой и исследовательской активности изучали в тестах “открытое поле” и “перегородка”, где эти параметры оценивались по числу фекальных болюсов, подъемах на задние лапки, обнюхивании, замирании (фризинг), времени и числу грумингов, поиске убежища [20]. В тесте Порсолта (“принудительное плавание”) по времени пассивного плавания и проявлению первой иммобильности определяли уровень депрессивности животных [21].
Объектом для молекулярно-генетических исследований методом полимеразной цепной реакции с обратной транскрипцией в режиме реального времени (ОТ-ПЦР Real-time) были сгруппированные лимфоидные узелки подвздошной кишки (пейеровы бляшки), которые помещали в фиксатор Буэна, проводили дегидратацию в восходящих концентрациях этанола и парафинировали.
Выделение тотальной РНК, полученной из гистологических срезов толщиной 15 мкм путем предварительной депарафинизации в ксилоле с последующей регидратацией в нисходящих концентрациях этанола (100, 96, 70%) и гомогенизацией с помощью ступки и пестика, проводили с использованием набора “Trizol RNA Prep 100” (Изоген Lab., LTD, Россия), который содержал Trizol reagent (лизирующий реагент, в состав которого входил денатурирующий агент гуанидинтиоционат и фенол, рН 4.0) и ExtraGeneЕ (суспензия смеси ионообменников). Подготовку и проведение реакции проводили соответственно протоколу набора.
Концентрацию и качество выделенной тотальной РНК определяли на спектрофотометре LibraS32PC (Biochrom Ltd., Англия). Для последующей процедуры обратной транскрипции (ОТ) отбирали образцы РНК со следующими показателями (по соотношению оптической плотности А260/А280): 260 нм/280 нм = 1.8–2.2.
Для проведения ОТ и получения кДНК использовали 2 мкл РНК и набор ОТ-1 фирмы “Синтол” (Россия). Для определения уровня экспрессии исследуемых генов использовали амплификатор CFX96 Real-Time PCR Detection Systems (“Bio-Rad Laboratories, Inc.”, США) и набор реактивов Maxima SYBR Green/ROX qPCR MasterMix (2X) (Thermo Scientific, США). Согласно инструкции производителя, финальная реакционная смесь для амплификации включала краситель SYBR Green, ДНК-полимеразу Maxima HotStartTaq DNA Polymerase, по 0.3 мМ прямого и обратного специфических праймеров, 1 мкл матрицы (кДНК). Реакционную смесь доводили до общего объема 25 мкл добавлением деионизированной Н2О. Специфические пары праймеров (5'–3') для анализа исследуемых и референсного генов были подобраны с помощью программного обеспечения PrimerBlast (www.ncbi.nlm.nih.gov/tools/primer-blast) и изготовлены фирмой Metabion (Германия) (табл. 1). Амплификация происходила при следующих условиях: инициированная денатурация 95°C – 10 мин; далее 50 циклов: денатурация – 95°С, 15 с, отжиг праймеров – 58–63°С, 30 с, эллонгация – 72°С, 30 с. Регистрация интенсивности флуоресценции происходила автоматически в конце стадии эллонгации каждого цикла по каналу автоматически SybrGreen. В качестве референс-гена для определения относительного значения изменения уровня экспрессии исследуемых генов был использован ген глицеральдегид-3-фосфат-дегидрогеназы (GAPDH). Относительное нормализованное количество кДНК таргетных генов определяли методом ΔΔCt. Данные нормировали по среднему значению контрольной группы и логарифмировали по основанию 2, чтобы привести к нормальному распределению. В эксперимент были включены отрицательные контроли: без добавления кДНК матрицы в реакцию ПЦР, без добавления мРНК матрицы в синтезе кДНК, без добавления фермента в синтезе кДНК. Все реакции амплификации выполняли на индивидуальных образцах в трех повторах. Всего в этом опыте использовано по 10 самок крыс каждой экспериментальной группы.
Таблица 1.
Праймеры, используемые для анализа экспрессии мРНК исследованных и референсного генов
| Ген | GenBank accession | Праймер |
|---|---|---|
| ХВР1 | NC_051349.1 | F = 5'-ACACGCTTGGGA ATGGACAC-3' R = 5'-CCATGGGAAGATGTTCTGGG-3' |
| Il17a | NC_051344.1 | F = 5'CTGGACTCTGAGCCGCAATG-3' R = 5'TGCCTCCCAGATCACAGAAG-3' |
| Il1b | NC_051338.1 | F = 5'TCTTTGAAGAAGAGCCCGTCC-3' R = 5'GGTCGTCATCATCCCACGAG-3' |
| GAPDH | NC_051339.1 | F = 5'GCCTGGAGAAACCTGCCAAG-3' R =5'GCCTGCTTCACCACCTTCT-3' |
Статистический анализ данных ПЦР проводили с помощью программного обеспечения CFX Manager™ (Bio-Rad, США). С целью проверки гипотезы о характере распределения исследуемых данных применяли тест Колмогорова–Смирнова. При подтверждении гипотезы о нормальном распределении использовали параметрический непарный t-критерий, при отклонении гипотезы – непараметрический непарный U-критерий Манна–Уитни. Значимость полученных результатов оценивали с помощью однофакторного дисперсионного анализа, в качестве апостериорного критерия применяли критерий Даннета. Критичный уровень значимости при проверке статистических гипотез принимали равным 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Известно, что изменения экспрессии XBP1 могут существенно влиять на уровень продукции провоспалительных цитокинов и в дальнейшем приводить к развитию воспалительных и аутоиммунных заболеваний. В связи с этим в нашей работе была проанализирована транскрипционная активность генов XBP1/про-воспалительных цитокинов IL-1β, IL-17α в кишечно-ассоциированной лимфоидной ткани.
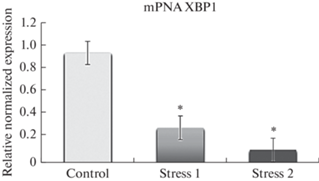
Согласно нашим данным, уровень экспрессии мРНК XBP1 в клетках демонстрировал динамику к снижению. Так, в экспериментальных моделях этот показатель уменьшился при ХСС1 в 3.1 раза (p < 0.05), а на фоне ХСС2 – в 8 раз (p < 0.05) по сравнению с контрольной группой крыс (рис. 1).
Рис. 1.
Относительное нормализованное количество мРНК гена ХВР1. Нормализация по методу ΔΔCt с референсным геном GAPDH. control – контроль; stress 1 – ХСС1; stress 2 – ХСС2. * – наличие достоверных различий между показателями контрольных и опытных групп, p < 0.05.
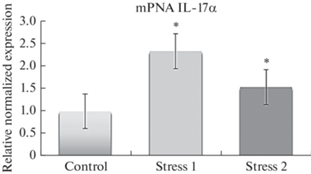
Развитие хронического социального стресса также сопровождалось существенными изменениями в экспрессии генов IL-1β и IL-17α в кишечно-ассоциированной лимфоидной ткани крыс, более выраженной в случае ХСС1. В частности, проведенное исследование установило однонаправленную динамику роста транскрипционной активности IL-1β (в 6 раз (p < 0.05) при ХСС1 и в 2.8 раз (p < 0.05) при ХСС2); IL-17α (в 2.3 раза (p < 0.05) при ХСС1 и на 53% (p < 0.05) при ХСС2) по сравнению с контрольной группой животных (рис. 2–3).
Рис. 2.
Относительное нормализованное количество мРНК гена IL-1β в клетках кишечно-ассоциированной лимфоидной ткани. Нормализация по методу ΔΔ Ct с референсным геном GAPDH. control – контроль; stress 1 – ХСС1; stress 2 – ХСС2. * – наличие достоверных различий между показателями контрольных и опытных групп, p < 0.05.
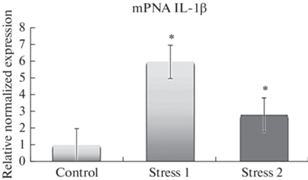
Рис. 3.
Относительное нормализованное количество мРНК гена IL-17α в клетках кишечно-ассоциированной лимфоидной ткани. Нормализация по методу ΔΔCt с референсным геном GAPDH. Примечание: control – контроль; stress 1 – ХСС1; stress 2 – ХСС2. * – наличие достоверных различий между показателями контрольных и опытных групп, p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно литературным данным, XBP1 является одним из ключевых факторов транскрипции, индуцирующих ответ на несвернутые белки, и мощным регулятором работы генов провоспалительных цитокинов. Поэтому изменения его экспрессии в условиях действия стрессовых факторов различной природы, в том числе хронического социального стресса, по мнению ряда авторов, могут существенно влиять на уровень продукции провоспалительных цитокинов (IL-1β, IL-6, IL-17α и TNF-α) и в дальнейшем приводить к развитию воспалительных и аутоиммунных заболеваний [22–27]. В настоящем исследовании мы установили, что во всех группах животных на фоне экспериментальных моделей ХСС1 и ХСС2 наблюдалось достоверное снижение уровня экспрессии мРНК ХВР1. Это, в свою очередь, сопровождалось активацией продукции IL-17α и IL-1β иммунными клетками. Возможно, дефицит ХВР1, вызванный, согласно нашему исследованию, социальным стрессом, являлся одним из тех механизмов, который приводил к развитию СЭР и, как следствие, способствовал повышенной транскрипционной активности генов IL-1β и IL-17α. И данный факт подтверждался в ряде работ [6, 18, 24, 26–28]. Так, в исследовании Lotrich было обнаружено, что повышение уровня IL-6, TNF-α, IL-1β и их растворимых рецепторов опосредуется UPR у пациентов с тяжелой депрессией [28]. А работы Liu с соавт. и Zhang с соавт. на животных продемонстрировали взаимосвязь между изменением экспрессии ХВР1 и развитием воспалительных процессов при хроническом социальном стрессе [15, 29].
Кроме того, недавно было выявлено наличие важной связи между внутриклеточным стрессом ЭПР и органоспецифическим воспалением в кишечнике [6, 30, 31]. В частности, исследования показали, что делеция XBP1 в эпителиальных клетках мышей приводила к спонтанному развитию воспаления в тонком кишечнике, включая формирование абсцессов крипт, лейкоцитарную инфильтрацию и явные язвы. Примечательно, что даже удаление одного аллеля XBP1 было достаточно, чтобы вызвать развитие спонтанного энтерита у большого количества животных [6, 22]. Кроме того, гипоморфный XBP1 с потерей одного аллеля также приводил к дисфункции клеток Панета и повышенной чувствительности к DSS – индуцированному колиту у мышей, а удаление обоих аллелей приводило к апоптозу клеток Панета [22]. Более ранние исследования на людях показали аналогичные результаты. При этом стресс ЭПР может быть основной причиной воспалительного процесса в кишечнике (например, как это наблюдалось у XBP1–/– мышей) или следствием воспаления (например, как у IL-10–/– и IRE1β–/– дефицитных мышей) [22], а пациенты с болезнью Крона и язвенным колитом продемонстрировали снижение уровня XBP1 [22, 23].
Также несколько полногеномных исследований указывали на связь между воспалительными заболеваниями кишечника и областью генома физически близкого к генам XBP1 и IRE1β [11, 12]. Секвенированием определены новые редкие однонуклеотидные полиморфизмы (SNP) в XBP1, которые наряду с другими экологическими и генетическими факторами риска могут давать склонность или индуцировать патологический процесс в кишечнике. Так, Kaser и соавт. обнаружили, что SNP XBP1 rs5997391, rs5762795 и rs35873774 ассоциированы с воспалительными заболеваниями кишечника [6]. Однако несмотря на безусловную важность изменений экспрессии XBP1 эпителиальными клетками кишечника в развитии патологии, в настоящее время в целом ряде работ была показана способность данного транскрипционного фактора регулировать реакции врожденного и адаптивного иммунитета [11, 12, 30–34]. Недавно было показано, что сигнализация через TLR активирует путь IRE1/XBP1, и это имеет решающее значение для иммунной защиты организма [12, 14, 34]. Как было отмечено, TLR – высококонсервативные рецепторы, распознающие патоген-ассоциированные молекулярные паттерны и сигналы опасности. При стимуляции in vitro макрофагов агонистами TLR2 (Pam3CSK4) и TLR4 (LPS) активируется IRE1/XBP1-путь независимо от других механизмов системы “ответа на несвернутые белки” и в отсутствие стресса ЭПР [12]. Интересно, что обработка активированных макрофагов липополисахаридом вместе с туникамицином (tunicamycin) вызывала ингибирование туникамицин-индуцированного стресса ЭПР. В дальнейшем исследовании авторы наблюдали TLR-опосредованный путь активации XBP1. В свою очередь, XBP1 способствовал выработке провоспалительных цитокинов, включая IL-6, TNF и IFN-β [12]. Таким образом, дефицит XBP1 увеличивал бактериальную инфекцию у мышей за счет снижения уровней этих цитокинов. Было обнаружено, что транскрипционный фактор XBP1 взаимодействовал с промоторными областями генов IL-6 и TNF, что вызвало устойчивую продукцию провоспалительных цитокинов (IL-6 и TNF-α) [12]. Поэтому можно считать, что XBP1 играет важную физиологическую, в том числе и защитную роль как во врожденном, так и в адаптивном иммунитете. Это неудивительно, учитывая, что IRE1 имеет α и β домены РНКазы, являющиеся уникальными гомологами подобным доменам RNase L, важной составляющей противовирусной системы [35, 36].
Как известно, дендритные клетки играют решающую роль в распознавании патогенов и в инициации врожденных и адаптивных иммунных реакций. Несколько исследований показали высокий уровень экспрессии XBP1s в дендритных клетках по сравнению с инактивированными Т- и В-лимфоцитами. IRE1α–XBP1 сигнальный путь системы “ответа на несвернутые белки” также имеет важное значение для развития и выживания дендритных клеток, в том числе и плазматических дендритных клеток (pDCs) [22, 37, 38]. Так, у XBP1-дефицитных мышей наблюдалось снижение количества этих клеток, особенно плазматических и соответственно уменьшение уровня секреции IFN-α. Также снижение экспрессии или отсутствие XBP1 нарушало дифференциацию и выживание дендритных клеток, а повышенная экспрессия транскрипционного фактора усиливала их развитие [22, 30].
Кроме этого, выявленные нами изменения экспрессии XBP1 при стрессе могут оказать значительное влияние и на процессы дифференцировки клеток адаптивной иммунной системы. Доказано, что XBP1 индуцирует дифференцировку активированных В-лимфоцитов в плазматические клетки [27, 30, 38]. Было продемонстрировано, что XBP1-дефицитные В-клетки показали нормальную пролиферацию и активацию, однако при этом был снижен уровень экспрессии J-цепи, необходимой для сборки Ig [3, 30]. Поэтому эти животные были более восприимчивы к инфекциям, а восстановление экспрессии XBP1 приводило к возобновлению производства Ig. Известно, что индуцированная XBP1 экспрессия IL-6 в В-клетках селезенки является фактором их терминальной дифференцировки [3, 38]. Таким образом, экспрессия XBP1 в профессиональных секреторных клетках, возможно, способствует развитию дополнительных функций, позволяющих этим клеткам реагировать на физиологические сигналы системы “ответа на несвернутые белки”. Механизм активации системы “ответа на несвернутые белки” и XBP1 при дифференцировке плазматических клеток до сих пор остается интересным и открытым вопросом. А учитывая ту важность, которую играют В-клетки в защите слизистой кишечника от патогенов, становятся понятны возможные последствия выявленных нами изменений экспрессии XBP1 лимфоцитами кишечно-ассоциированной лимфоидной ткани. Кроме того, данные изменения могут влиять и на конечную продукцию плазмоцитами аутоантител к клеточным антигенам, что объясняет резкое увеличение частоты аутоиммунных заболеваний у людей, подвергавшихся действию социального стресса. Также известно, что реакция на стресс ЭПР – это критический фактор инициации дифференцировки Т-клеток при распознавании антигена [39–42].
Таким образом, полученные результаты раскрывают роль стресса ЭПР в развитии воспалительных и аутоиммунных заболеваний, в том числе и в воспалительных заболеваниях кишечника.
ЗАКЛЮЧЕНИЕ
Настоящее исследование показало, что события, происходящие в кишечно-ассоциированной лимфоидной ткани в условиях хронического социального стресса, явно противоречат классической парадигме стресса и провоцируют не иммуносупрессию, а выраженную активацию иммунной системы с последующим развитием воспалительного процесса. На наш взгляд, одним из возможных механизмов такого физиологического изменения в структурах, ассоциированных со слизистыми оболочками желудочно-кишечного тракта являлось снижение экспрессии транскрипционного фактора ХВР1, и как следствие, последующая активация продукции провоспалительных цитокинов иммунными клетками. Полученные нами данные продемонстрировали достоверное уменьшение уровня экспрессии мРНК XBP1. Это, в свою очередь, приводило к увеличению продукции провоспалительных цитокинов, таких как IL-1β и IL-17α.
Таким образом, результаты эксперимента дают возможность предположить участия стресса эндоплазматического ретикулума в развитии и прогрессировании воспалительных заболеваний кишечника в условиях хронического социального стресса.
Список литературы
Dhabhar F (2014) Effects of stress on immune function: the good, the bad, and the beautiful. Immunol Res 58(2–3): 193–210.https://doi.org/10.1007/s12026-014-8517-0.210
Almanza A, Carlesso A, Chintha C, Creedican S, Doultsinos D, Leuzzi B, Luis A, McCarthy N, Montibeller L, More S, Papaioannou A, Püschel F, Sassano ML, Skoko J, Agostinis P, Jackie de Belleroche, Eriksson LA, Fulda S, Gorman AM, Healy S, Kozlov A, Muñoz-Pinedo C, Rehm M, Chevet E (2019) Endoplasmic reticulum stress signalling–from basic mechanisms to clinical applications. FEBS J 286: 241–278. https://doi.org/10.1111/febs.14608
Schwarz DS, Blower MD (2016) The endoplasmic reticulum: Structure, function and response to cellular signaling. Cell Mol Life Sci 73: 79–94. https://doi.org/10.1007/s00018-015-2052-6
Дедов ИИ, Смирнова ОМ, Горелышев АС (2012) Стресс эндоплазматического ретикулума: цитологический сценарий патогенеза заболеваний человека. Пробл эндокринол 58(5): 57–65. [Dedov II, Smirnova OM, Gorelyshev AS (2012) Stress of endoplasmic reticulum: the cytological “scenario” of pathogenesis of human diseases. Probl Endokrinol 58(5): 57–65. (In Russ)].
Зверев ЯФ, Брюханов ВМ (2013) Стресс эндоплазматического ретикулума глазами нефролога. Нефрология 17(2): 39–54. [Zverev YF, Bryuhanov VM (2013) Endoplasmic reticulum stress in terms of nephrologist (message ii). Nephrology (Saint-Petersburg) 17(2): 39–54. (In Russ)]. https://doi.org/10.24884/1561-6274-2013-17-2-39-546
Kaser A, Blumberg R (2010) Endoplasmic reticulum stress and intestinal inflammation. Mucos Immunol 3: 11–16. https://doi.org/10.1038/mi.2009.122
Kaser A, Flak M, Blumberg R (2011) The unfolded protein response and its role in intestinal homeostasis and inflammation. Exp Cell Res 15: 2772–2779. https://doi.org/10.1016/j.yexcr.2011.07.008
Меситов МВ, Московцев АА, Кубатиев АА (2013) Молекулярная логика сигнальных путей при стрессе эндоплазматического ретикулума: система UPR (Unfolded Protein Response). Патол физиол экспер терапия 4: 97–108. [Mesitov MV, Moskovtsev AA, Kubatiev AA (2013) Molecular logic of the endoplasmic reticulum stress signal pathways: the system of unfolded protein response Patol Fiziol Eksp Ter 4: 97–108. (In Russ)].
Hillary RF, FitzGerald U (2018) A lifetime of stress: ATF6 in development and homeostasis. J Biomed Sci 25(1): 48. https://doi.org/10.1186/s12929-018-0453-1
Glimcher L (2010) XBP1: the last two decades. Ann Rheum Dis 69: 67–71. https://doi.org/10.1136/ard.2009.119388
Martinon F, Glimcher L (2011) Regulation of Innate Immunity by signaling pathways emerging from the endoplasmic reticulum. Curr Opin Immunol 23: 35–40. https://doi.org/10.1016/j.coi.2010.10.016
Martinon F, Chen X, Glimcher L (2010) Toll-like receptor activation of XBP1 regulates innate immune responses in macrophages. Nat Immunol 11: 411–418. https://doi.org/10.1038/ni.1857
Rong Wu, Qing-Hai Zhang, Yan-Ju Lu, Kun Ren, Guang-Hui Yi (2015) Involvement of the IRE1α–XBP1 pathway and XBP1s-dependent transcriptional reprogramming in metabolic diseases DNA. Cell Biol 34(1): 6–18. https://doi.org/10.1089/dna.2014.2552
Kaufman R, Cao S (2010) Inositol-requiring 1/X-box-binding protein 1 is a regulatory hub that links endoplasmic reticulum homeostasis with innate immunity and metabolism. EMBO Mol Med 6: 189–192. https://doi.org/10.1002/emmm.201000076
Zhang Y, Liu W, Zhou Y, Ma C, Li S, Cong B (2014) Endoplasmic reticulum stress is involved in restraint stress-induced hippocampal apoptosis and cognitive impairments in rats. Physiol Behav 131: 41–48. https://doi.org/10.1016/j.physbeh.2014.04.014
Zhao T, Huang GB, Muna SS, Bagalkot TR, Jin Han-Jung Chae HM, Chung Y-Ch (2013) Effects of chronic social defeat stress on behavior and choline acetyltransferase, 78-kDa glucose-regulated protein, and CCAAT/enhancer-binding protein (C/EBP) homologous protein in adult mice. Psychopharmacology 228: 217–230. https://doi.org/10.1007/s00213-013-3028-6
Timberlake M, Roy Bh, Dwivedi Y (2019) A Novel Animal Model for Studying Depression Featuring the Induction of the Unfolded Protein Response in Hippocampus. Mol Neurobiol 56(12): 8524–8536. https://doi.org/10.1007/s12035-019-01687-6
Wu J, Rutkowski TD, Dubois M, Swathirajan J, Saunders T, Junying Wang, Benbo Song, Yau Grace D-Y, Kaufman RJ (2007) ATF6α Optimizes Long-Term Endoplasmic Reticulum Function to Protect Cells from Chronic Stress. Development Cell 13(3): 351–364. https://doi.org/doi.org/10.1016/j.devcel.2007.07.005
Gao H, He C, Hua R, Guo Y, Wang B, Liang C, Gao L, Shang H, Xu JD (2022) Endoplasmic Reticulum Stress of Gut Enterocyte and Intestinal Diseases. Front Mol Biosci 24(9): 817392. https://doi.org/10.3389/fmolb.2022.817392
Амикишиева АВ (2009) Поведенческое фенотипирование: современные методы и оборудование Вестник ВОГиС 13(3):529–542. [Amikishieva AV (2009) Behavioral phenotyping: Modern methods and equipment. Bull VOGiS 13(3): 529–542. (In Russ)].
Porsolt RD, Pichon ML, Jalfre M (1977) Depression: a new animal model sensitive to antidepressant treatment. Nature 266: 730–732.
Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis ES, Higgins DE, Schreiber S, Glimcher LH, Blumberg RS (2008) XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease. Cell 134(5): 743–756. https://doi.org/10.1016/j.cell.2008.07.021
Ma X, Dai Z, Sun K, Zhang Y, Chen J, Yang Y, Tso P, Wu G, Wu Z (2017) Intestinal Epithelial Cell Endoplasmic Reticulum Stress and Inflammatory Bowel Disease Pathogenesis: An Update Review. Front Immunol 8: 1271. https://doi.org/10.1016/S0140-6736(19)30038-8
Reverendo M, Mendes A, Argüello RJ, Gatti E, Pierre P (2019) At the crossway of ER-stress and pro-inflammatory responses. The FEBS J 286(2): 297–310. https://doi.org/10.1111/febs.14391
Giraud-Billoud M, Fader CM, Aguero R, Ezquer F, Ezquer M (2018) Diabetic nephropathy, autophagy and proximal tubule protein endocytic transport: a potentially harmful relationship. Biocell 42(2): 35–40. https://doi.org/10.32604/biocell.2018.07010
Hooper KM, Barlow PG, Henderson P, Stevens C (2019) Interactions between autophagy and the unfolded protein response: implications for inflammatory bowel disease. Inflam Bowel Dis 25 (4): 661–671. https://doi.org/10.1093/ibd/izy
Coleman OI, Haller D (2019) ER Stress and the UPR in Shaping Intestinal Tissue Homeostasis and Immunity. Front Immunol 10: 2825. https://doi.org/10.3389/fimmu.2019.02825
Lotrich F (2012) Inflammatory Cytokines, Growth Factors, and Depression. Curr Pharm Des 18: 5920–5935. https://doi.org/10.2174/138161212803523680
Liu L, Zhao Z, Lu L, Liu JL, Sun J, Wu X, Dong J (2019) Icariin and icaritin ameliorated hippocampus neuroinflammation via inhibiting HMGB1-related pro-inflammatory signals in lipopolysaccharide-induced inflammation model in C57BL/6J mice. Int Immunopharmacol 68: 95–105. https://doi.org/10.1016/j.intimp.2018.12.055
So J-S (2018) Roles of endoplasmic reticulum stress in immune responses. Mol Cells 41: 705–716. https://doi.org/10.14348/molcells.2018.0241
Cao SS, Luo KL, Shi L (2016) Endoplasmic reticulum stress interacts with inflammation in human disease. J Cell Physiol 231: 288–294.https://doi.org/10.1002/jcp.25098
Oakes SA, Papa FR (2015) The role of endoplasmic reticulum stress in human pathology. Annu Rev Pathol Mech Dis 10: 173–194.https://doi.org/10.1146/annurev-pathol-012513-104649
Wu R, Zhang Q-H, Lu Y-J, Ren K, Yi G-H (2015) Involvement of the IRE1alpha-XBP1 pathway and XBP1s-dependent transcriptional reprogramming in metabolic diseases. DNA Cell Biol 34: 6–18. https://doi.org/10.1089/dna.2014.2552
Hirayama D, Iida T, Nakase H (2018) Phagocytic function of macrophages – providing innate immunity and tissue homeostasis. Int J Mol Sci 19: 92. https://doi.org/10.3390/ijms19010092
Park SM, Kang TI, So JS (2021) Roles of XBP1s in Transcriptional Regulation of Target Genes. Biomedicines 9(7): 791. https://doi.org/10.3390/biomedicines9070791
Kazantseva AV, Davydova YD, Enikeeva RF Valinurov RG, Gareeva AE Khusnutdinova NN, Khusnutdinova EK (2021) The association study of polymorphic variants of hypothalamic-pituitary-adrenal system genes (AVPR1B, OXTR) and aggressive behavior manifestation: a focus on social environment. Res Results Biomed 7(3): 232–244. https://doi.org/10.18413/2658-6533-2021-7-3-0-3
Wang Y, Zhang Y, Yi P, Dong W, Nalin AP, Zhang J, Zhu Z, Chen L, Benson DM, Mundy-Bosse BL, Freud AG, Caligiuri MA, Jianhua Yu (2019) The IL-15-AKT-XBP1s signaling pathway contributes to effector functions and survival in human NK cells. Nat Immunol 20: 10–17. https://doi.org/10.1038/s41590-018-0265-1
Brunsing R, Omori S, Niwa M (2008) B- and T-cell Development Both Involve Activity of the Unfolded Protein Response Pathway. J Biol Chem 283: 17954–17961. https://doi.org/10.1074/jbc.M801395200
Stadhouders R, Lubberts E, Hendriks RW (2018) A cellular and molecular view of T helper 17 cell plasticity in autoimmunity. J Autoimmun 87: 1–15.
Saravia J, Chapman NM, Chi H (2019) Helper T cell differentiation. Cell Mol Immunol 16: 634–643. https://doi.org/10.1038/s41423-019-0220-6
Pramanik J, Chen X, Kar G, Henriksson J, Gomes T, Park J-E, Natarajan K, Meyer KB, Miao Z, McKenzie ANJ, Mahata B, Teichmann SA (2018) Genome-wide analyses reveal the IRE1α-XBP1 pathway promotes T helper cell differentiation by resolving secretory stress and accelerating proliferation. Genome Med 10: 76. https://doi.org/10.1186/s13073-018-0589-3
Walker JA, McKenzie ANJ (2018) TH2 cell development and function. Nat Rev Immunol 18: 121–133. https://doi.org/10.1038/nri.2017.118
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


