Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1353-1364
Экспрессия с-Fos в клетках продолговатого мозга крыс после субдиафрагмальной ваготоми и введения антигенов различной природы
А. С. Дятлова 1, О. Л. Коченда 1, *, Н. В. Лавров 1, Е. А. Корнева 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: ol8991.kochenda@mail.ru
Поступила в редакцию 19.06.2022
После доработки 06.09.2022
Принята к публикации 09.09.2022
- EDN: ENAHPA
- DOI: 10.31857/S0869813922100053
Аннотация
Изучение путей обмена информацией между иммунной и нервной системами остается актуальной задачей современной нейроиммунофизиологии. Участие блуждающего нерва в передаче информации о поступлении антигена в мозг обуславливает необходимость исследования паттернов активации его ядер при введении антигенов различной природы. Цель работы. Определение количества с‑Fos-позитивных нейронов в ядре одиночного пути (NTS) и дорзальном моторном ядре (DMX) продолговатого мозга при интраперитонеальном введении LPS (липополисахарида) и SEB (стафилококкового энтеротоксина Б) после субдиафрагмальной ваготомии. Методы исследования. Для изучения реакций мозга на интраперитонеальное введение антигенов различной природы на фоне полной субдиафрагмальной ваготомии использовали иммуногистохимический метод исследования, выявляя маркер активации нейронов – белок с-Fos – в клетках различных зон NTS и DMX. Основные результаты. В ядре DMX не обнаружено с-Fos-позитивных клеток у контрольных животных и после введения антигенов. Введение LPS инициирует повышение количества с-Fos-позитивных клеток, наиболее выраженное в медиальной зоне NTS. После субдиафрагмальной ваготомии констатировано повышение количества с-Fos-позитивных клеток в NTS у крыс после введения LPS или SEB. Анализ зон NTS продемонстрировал, что повышение количества с-Fos-позитивных клеток после субдиафрагмальной ваготомии и последующем введении LPS происходит в латеральной, медиальной, центральной зонах NTS, а после введения SEB – только в медиальной зоне этого ядра. Выводы. Показаны особенности ответа NTS на введение определенных антигенов. После субдиафрагмальной ваготомии констатирована активация клеток NTS при введении LPS и SEB.
Важность изучения путей и механизмов взаимодействия нервной и иммунной систем определяется тем, что патология одной из них влияет на работу и функции другой. Анализ механизмов передачи сигналов от иммунной системы к нервной и особенностей модуляции иммунного ответа нервной системой может способствовать разработке новых терапевтических подходов к лечению заболеваний аутоиммунной, аллергической, инфекционной и опухолевой природы.
Блуждающий нерв (n. vagus, X пара черепных нервов) обеспечивает парасимпатическую иннервацию большинства внутренних органов грудной и брюшной полостей, за исключением органов малого таза. Нерв является смешанным: 20% его волокон являются эфферентными и 80% – афферентными [1], т.е. сенсорная информация от органов грудной и брюшной полостей поступает главным образом в ядро солитарного тракта (nucleus tractus solitarius , NTS), хотя часть афферентных волокон проецируется в дорзальное моторное ядро блуждающего нерва (DMX), где они образуют моносинаптические связи с мотонейронами этого нерва; другие проецируются в area postrema (AP), – область ствола мозга, интегрирующую периферические и центральные сигналы, участвующие в формировании ощущения тошноты и индукции рвотного рефлекса. Часть нейронов NTS второго порядка проецируется в DM X, а часть – на вышележащие структуры мозга, включая гипоталамус и лимбическую систему, модулирующие вегетативные функции и поведение [2].
На периферии сенсорные нейроны блуждающего нерва экспрессируют широкий спектр рецепторов, включая рецепторы нейромодуляторов, цитокинов и факторов роста [3]. Кроме того, существуют хемосенсорные параганглии, связанные с брюшными ветвями блуждающего нерва. Параганглии находятся за пределами желудочно-кишечного тракта. Высказано предположение, что параганглии блуждающего нерва могут служить второй линией хеморецептивной защиты, мониторируя сгустки крови и лимфы в сосудах желудочно-кишечного тракта и модулируя интенсивность афферентации [4].
Блуждающий нерв рассматривается в качестве ключевого посредника передачи информации от иммунной системы к нервной. В работах группы Tracey описан так называемый “рефлекс воспаления” – противовоспалительный ваговагальный рефлекс, реализующийся в результате передачи информации по афферентным волокнам блуждающего нерва в парасимпатические центры продолговатого мозга. Клетки иммунной системы при обнаружении антигена активируются и выделяют провоспалительные цитокины (IL-1, 6, TNF-α), которые воспринимают афферентные волокна блуждающего нерва. Информация о развитии воспалительного процесса по афферентным волокнам блуждающего нерва поступает в продолговатый мозг (NTS, DMX), где происходит активация эфферентных путей блуждающего нерва с последующей секрецией ацетилхолина в их дистальных отделах, что приводит к противовоспалительному эффекту [5, 6]. Таким образом, предполагается, что блуждающий нерв участвует в регуляции процессов воспаления.
Среди иммуногенов выделяют две группы антигенов – Т-зависимые и Т-независимые. К первым относятся в основном полисахариды и липополисахариды (LPS, туберкулин, полисахариды капсулы пневмококка, фиколл). Тимусзависимые антигены представляют собой белки или гаптены, ассоциированные с белками. К таким антигенам относятся сывороточные белки (бычий сывороточный альбумин), бактериальные токсины (стафилококковый энтеротоксин), вирусы, а также антигены чужеродных эритроцитов [7]. Механизм иммунного ответа на тимусзависимые и тимуснезависмые антигены различен. Особенности механизмов нервной регуляции ответной реакции организма на введение антигенов различной природы изучаются.
Предприняты попытки выяснить пути, по которым информация о пероральном и интраперитонеальном введении липополисахарида (LPS) и стафилококкового энтеротоксина Б (SEB) в организм достигает нейронов головного мозга, для чего оценивали сосудистые реакции мозга [8], а также количество с-Fos-позитивных нейронов в ядрах блуждающего нерва в ответ на введение SEB до и после полной и селективной ваготомии [9]. Результаты этих и других подобных исследований противоречивы.
Целью настоящей работы явилось определение количества с-Fos-позитивных нейронов в ядре одиночного пути (NTS) и дорзальном моторном ядре (DMX) при интраперитонеальном введении LPS и SEB после субдиафрагмальной ваготомии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на 45 самцах крыс линии Вистар массой 200–250 г. План исследования одобрен локальным этическим комитетом ФГБНУ Институт экспериментальной медицины (протокол № 6/20 от 21.10.20).
Для выявления реакций клеток ядер блуждающего нерва на введение антигенов различной природы 15 экспериментальным животным интраперитонеально вводили физиологический раствор (n = 5), LPS (500 мкг/кг, n = 5) или SEB (500 мкг/кг, n = 5) в объеме 250 мкл. Через 2 ч после инъекции животных наркотизировали и выводили из эксперимента путем транскардиальной перфузии физиологическим раствором с последующей фиксацией 4%-ным раствором параформальдегида. Доза и время воздействия антигена были подобраны в соответствии с литературными данными и первичной апробацией методики [9, 10].
Субдиафрагмальная ваготомия. Для изучения влияния субдиафрагмальной ваготомии на активность нейронов NTS при введении LPS и SEB 15 экспериментальных животных были подвергнуты субдиафрагмальной ваготомии и 15 – аналогичным хирургическим манипуляциям, но без пересечения блуждающего нерва.
Все оперативные вмешательства производили при использовании золетил-ксилазинового наркоза по следующей схеме: Золетил 0.3 мг в/м (Virbac, Франция), Ксила 0.8 мг в/м (Интерхеми Верхен, Нидерланды) из расчета на 100 г массы тела животного. Наркоз верифицировали по исчезновению реакции на болевые раздражители (укол лапы) и угнетению роговичного рефлекса. Для проведения процедуры субдиафграгмальной двусторонней ваготомии животное располагали на спине и фиксировали на подложке. Шерсть в районе живота аккуратно выстригали ножницами. Стерильным скальпелем производили небольшой вертикальный разрез в области желудка ниже диафрагмы, не повреждая ее. Далее извлекали желудок с частью пищевода, препарировали правую ветвь блуждающего нерва, идущую вдоль пищевода совместно с крупными сосудами. На правую ветвь блуждающего нерва и сосуды накладывали плотную лигатуру. Затем препарировали левую ветвь блуждающего нерва и перерезали ее. Желудок аккуратно помещали назад в брюшную полость. Разрез ушивали послойно: сначала зашивали мышечный слой, затем кожу. Поверхность шва обрабатывали антисептиком. После операции однократно внутримышечно вводили 0.2 мл Цефтриаксона (Рафарма АО, Россия).
Через 2–3 дня восстановительного периода животным вводили антигены либо физиологический раствор, и через 2 ч их выводили из эксперимента путем транскардиальной перфузии. Таким образом, во второй части эксперимента исследовали 6 экспериментальных групп (табл. 1).
После транскардиальной перфузии головной мозг извлекали, дополнительно фиксировали, оставляя в 4%-ном растворе параформальдегида при 4°С на двое суток. После фиксации осуществляли проводку образца по растворам сахарозы восходящей концентрации (10, 15 и 20%), выдерживая по 1 ч в каждом растворе при комнатной температуре. Затем образец, погруженный в 20%-ный раствор сахарозы, оставляли при 4°С на ночь. На следующий день изготавливали замороженные срезы продолговатого мозга (уровни 65–73 в соответствии с атласом мозга крысы Swanson), используя микротом Reichert Austria и замораживающий столик Миконта-02. Срезы помещали в 30%-ный раствор сахарозы и замораживали при –21°С до последующего иммуногистохимического исследования.
Иммуногистохимический анализ с-Fos-позитивных нейронов. Срезы продолговатого мозга отмывали 3 раза по 5 мин в PBS, затем осуществляли демаскировку антигена в цитратном буфере (pH 6.0) и блокировку неспецифичного окрашивания, инкубируя срезы в 1%-ном растворе бычьего сывороточного альбумина (BSA) с добавлением 0.04% Triton-X100. В качестве первичных антител использовали поликлональные антитела кролика к с-Fos (Anti-с-Fos antibody – BSA free (ab190289), Abcam) в разведении 1 : 1000. Инкубацию срезов с первичными антителами проводили в течение двух суток при 4°С. Затем срезы промывали PBS 3 раза по 5 мин, после чего проводили инкубацию со вторичным антителами, меченными биотином (Goat Anti-Rabbit IgG H&L (Biotin) (ab97049)) в разведении 1 : 1000 в течение 1 ч при комнатной температуре. После трехкратной смены PBS срезы инкубировали в растворе авидин-пероксидазы (Sigma) в разведении 1 : 2500 в течение 1 ч при комнатной температуре. Срезы трижды промывали PBS, затем осуществляли визуализацию антигена, используя DAB substrate kit (Abcam).
Окрашенные срезы промывали dH20, монтировали на стекла, высушивали в течение суток и заключали, используя канадский бальзам (Sigma).
Основываясь на предыдущих исследованиях, анализировали каудальную часть дорзального вагального комплекса (уровень 67 в соответствии с атласом мозга крысы Swanson). Также анализу подвергали дорзальное моторное ядро блуждающего нерва и ядро одиночного пути. Подсчет с-Fos-позитивных клеток в ядре NTS осуществляли в трех зонах: медиальной (NTSm), центральной (NTSce) и латеральной (NTSl), используя программное обеспечение ImageJ (NIH, США).
Статистическую обработку полученных данных проводили, используя методы непараметрической статистики, в программном обеспечении R Studio. Для обработки результатов первой части эксперимента использовали непараметрический аналог дисперсионного анализа – критерий Краскелла–Уоллиса, с последующим применением post-hoc критерия Данна. Для обработки результатов второй части эксперимента использовали U-критерий Манна–Уитни для попарного сравнения групп по схеме “опыт–контроль”.
Для визуализации полученных результатов использовали библиотеки Seaborn и Matplotlib в Jupiter Notebook.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В первой части исследования изучали реакцию клеток ядер блуждающего нерва на введение антигенов – LPS и SEB.
Подсчет осуществляли билатерально в ядрах NTS и DMX. В DMX c-Fos-позитивные нейроны после введения антигенов не обнаружены.
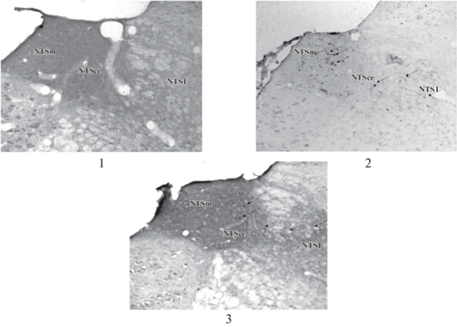
В ядре NTS на 67-ом уровне выделяют три зоны: медиальную (NTSm), латеральную (NTSl) и центральную (NTSce) (рис. 1).
Рис. 1.
Реакция клеток NTS на введение антигенов различной природы. Срезы мозга крыс: 1 – контроль, 2 – после введения липополисахарида в дозе 500 мкг/кг, 3 – после введения стафилококкового энтеротоксина Б в дозе 500 мкг/кг. Иммуногистохимическое окрашивание, с-Fos, ×10.
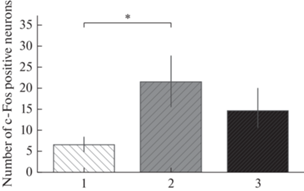
Установлено, что после введения LPS происходит увеличение количества с-Fos-позитивных нейронов в ядре NTS, чего не наблюдается после введения SEB (рис. 1, 2).
Рис. 2.
Количество с-Fos-позитивных нейронов в NTS после введения антигенов различной природы. 1 – контроль, 2 – введение липополисахарида в дозе 500 мкг/кг, 3 – введение стафилококкового энтеротоксина Б в дозе 500 мкг/кг. * – p < 0.05.
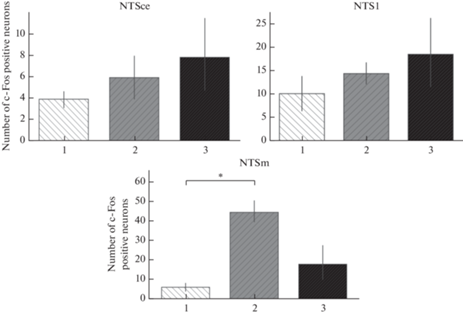
После введения LPS увеличение количества с-Fos-позитивных нейронов в NTS происходит за счет возрастания их числа в медиальной зоне ядра в 4.5 раза по сравнению с контролем (p < 0.001, рис. 3). При этом в остальных зонах отличия от контроля не достоверны.
Рис. 3.
Количество с-Fos-позитивных нейронов в разных зонах NTS продолговатого мозга после введения антигенов различной природы. 1 – контроль, 2 – введение липополисахарида в дозе 500 мкг/кг, 3 – введение стафилококкового энтеротоксина Б в дозе 500 мкг/кг. NTSm – медиальная, NTSl – латеральная, NTSce – центральная зона. * – p < 0.001.
Таким образом, установлено, что NTS, входящее в дорзальный вагальный комплекс, реагирует на введение Т-независимого антигена LPS увеличением количества активированных нейронов, расположенных в медиальной части ядра, чего не происходит при введении Т-зависимого антигена – SEB.
В клетках DMX с-Fos-позитивные нейроны после введения антигенов не обнаружены как после субдиафрагмальной ваготомии, так и у ложнооперированных крыс.
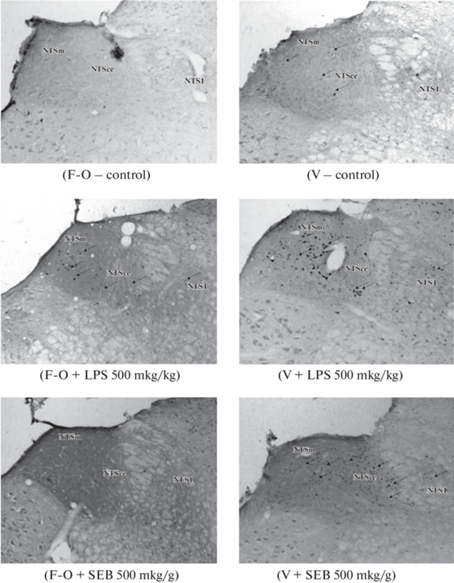
После субдиафрагмальной ваготомии констатировано возрастание интенсивности активации нейронов NTS после введения LPS и SEB (рис. 4).
Рис. 4.
Количество с-Fos-позитивных нейронов в ядре NTS продолговатого мозга при введении антигенов различной природы после субдиафрагмальной ваготомии. 1 – контроль, 2 – введение липополисахарида в дозе 500 мкг/кг, 3 – введение стафилококкового энтеротоксина Б в дозе 500 мкг/кг, F – ложнооперированные, V – ваготомированные животные. * – p < 0.05 по сравнению с ложнооперированными животными и введением LPS, ** – p < 0.05 по сравнению c ложнооперированными животными и введением SEB.
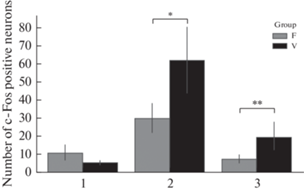
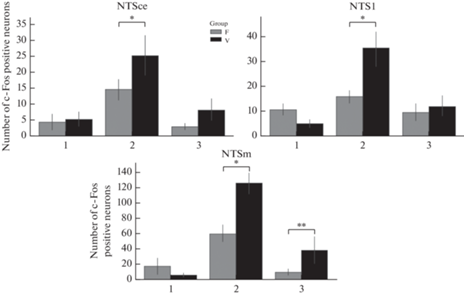
После введения физиологического раствора не наблюдалось различий между животными исследуемых групп. При введении LPS после субдиафрагмальной ваготомии в зонах NTS происходило повышение количества с-Fos-позитивных нейронов, а введение SEB инициировало увеличение количества этих нейронов после субдиафрагмальной ваготомии в нейронах медиальной зоны NTS (рис. 5, 6).
Рис. 5.
Количество с-Fos-позитивных нейронов в зонах NTS после введения антигенов различной природы на фоне субдиафрагмальной ваготомии. 1 – контроль, 2 – введение LPS в дозе 500 мкг/кг, 3 – введение SEB в дозе 500 мкг/кг, F – ложнооперированные, V – ваготомированные животные. NTSm – медиальная, NTSl – латеральная, NTSce – центральная зона. * – p < 0.05 по сравнению с группой ложнооперированных животных и введением LPS, ** – p < 0.05 по сравнению с группой ложнооперированных животных и введением SEB.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Перекрест и соавт. [10] продемонстрировали, что при введении антигенов различной природы – LPS и BSA – происходит активация гипоталамических структур, оцениваемая по интенсивности экспрессии c-fos-гена и количеству c-Fos-позитивных клеток. Было показано, что паттерны активации этих клеток после введения различных антигенов не одинаковы: реакция на LPS характеризовалась активацией большего количества нейронов, это было наиболее выражено в передней гипоталамической области, паравентрикулярном ядре, латеральном и заднем гипоталамусе. Введение BSA приводило к активации меньшего количества нейронов, но с большим количеством c-Fos-белка в них, что выражалось в повышении оптической плотности нейронов в структурах вентромедиального, латерального и заднего гипоталамуса [10].
Блуждающий нерв и его ядра также относят к компонентам центральной автономной сети [11, 12]. Tracey и соавт. ввели понятие холинергического противовоспалительного рефлекса, реализуемого посредством блуждающего нерва. Активность афферентных волокон вагуса стимулируется цитокинами и PAMP, после чего сигнал через NTS и DMX активирует эфферентные волокна вагуса. Эфферентный (холинергический) блуждающий нерв стимулирует CD4+ Т-клетки в селезенке через селезеночный симпатический (адренергический) нерв. Высвобожденный норадреналин в селезенке связывается с β2-адренорецепторами (β2AR) на CD4+ Т-клетках, что ведет к высвобождению ими ацетилхолина, который в свою очередь связывается с альфа-7-никотин-ацетилхолиновыми рецепторами (α7nAChR) на макрофагах и вызывает противовоспалительный ответ, такой как подавление TNF-α [13].
Показана активация дорзального вагального комплекса, оцениваемая по количеству c-Fos-позитивных нейронов, при введении различных антигенов – LPS, SEB и провоспалительных цитокинов (IL-1, TNFa) [14]. Настоящее исследование частично подтверждает эти данные: согласно полученным результатам, ядро одиночного пути, входящее в состав дорзального вагального комплекса, активируется при введении LPS, но не при введении SEB. Возможно, это связано с недостаточным временем воздействия и дозой SEB: некоторые авторы описывали реакции NTS на SEB в дозе 1 мг/кг через 4 ч после интраперитонеального введения [15].
Продемонстрированные нами различия ответа клеток различных зон NTS на введение LPS ранее не описаны в литературе, за исключением одного сообщения [16]. Согласно полученным данным, медиальная часть каудального NTS обеспечивает активацию дорзального вагального комплекса при введении LPS. Известно, что каудальная часть NTS получает висцеросенсорную информацию, а также через медиальный пучок переднего мозга (MFB) или дорсальный продольный пучок (DLF) посылает проекции в широкий спектр областей мозга: вентролатеральный продолговатый мозг (VLM), гипоталамус, центральное ядро миндалевидного тела (ACe), ядро ложа терминальной полоски (BNST), задние рога спинного мозга, ретикулярную формация ствола мозга, голубое пятно (LC), серый периакведукт (PAG) [17]. Медиальная зона NTS обеспечивает общую висцеральную иннервацию, а вентролатеральная часть ядра регулирует респираторную функцию и обеспечивает регуляцию вкусовой сенсорной системы [18].
Полученные данные демонстрируют, что NTS реагирует на введение LPS, но не на введение SEB.
Изучение участия блуждающего нерва в передаче информации о поступлении антигена в ЦНС позволило показать, что перерезка блуждающего нерва приводит к снижению активации его ядер в продолговатом мозге в ответ на введение Т-зависимых и Т-независимых антигенов [8, 9, 19, 20], что подтверждает гипотезу о передаче по волокнам вагуса информации о поступлении антигена. Однако результаты некоторых работ демонстрируют, что таких изменений не происходит [21, 22].
Показан совершенно другой паттерн активации ядра одиночного пути блуждающего нерва после субдиафрагмальной ваготомии и введении антигена. Перерезка блуждающего нерва не только не была связана со снижением активации NTS в ответ на введение LPS и SEB по сравнению с ложнооперированными животными, но и ассоциировалась с увеличением количества c-Fos-позитивных нейронов при введении как LPS, так и SEB.
Реакция различных зон NTS на введение антигенов после субдиафрагмальной ваготомии отличаются: введение LPS приводит к повышению количества c-Fos-позитивных нейронов во всех зонах ядра. В то же время при введении SEB активируется только медиальная зона ядра, но не латеральная и центральная, демонстрируя различия паттерна активации NTS на введение антигенов после субдиафрагмальной ваготомии.
В работе Somann и соавт. [23] получены результаты, позволяющие предположить, что различные ветви блуждающего нерва по-разному влияют на интенсивность продукции цитокинов (IL-10, TNF-α, GM-CSF, IL-17F, IL-6, IL-22, INF-γ) при введении антигена. Крысам вводили LPS и анализировали соответствующие эффекты электрической стимуляции поддиафрагмальных ветвей (передняя желудочная, добавочная чревная и печеночная) левого блуждающего нерва в течение 5.5 ч после введения антигена. Авторы настаивают на том, что внутрибрюшинное введение LPS приводит к физиологически значимой стимуляции воспаления и вызывает системную реакцию. При внутривенном введении LPS сразу поступает в кровоток. Высказано предположение, что это объясняет более высокую вариабельность результатов исследований, выполненных на модели внутрибрюшинного введения LPS крысам [23].
Согласно данным Hofmann и соавт. [24, 25], односторонняя ваготомия вызывает изменения морфологии астроцитов и микроглии в области NTS и DMX в сторону реактивного фенотипа, что может свидетельствовать о возникновении нейровоспаления. В таком случае любой из вводимых антигенов может усиливать уже возникшее нейровоспаление, что объясняет реакцию NTS на SEB при ваготомии, которая не наблюдалась в отсутствие хирургических манипуляций.
Полученные результаты демонстрируют, что эффекты пересечения блуждающего нерва на активацию NTS не однозначны, как было описано ранее, это может быть связано, в том числе, с избирательным участием различных ветвей n. vagus в регуляции продукции цитокинов на введение антигена, а также с усилением антигенами возникающего при ваготомии нейровоспаления.
Список литературы
Prechtl JC, Powley TL (1990) The fiber composition of the abdominal vagus of the rat. Anat Embryol 181: 101–115. https://doi.org/10.1007/BF00198950
Gasparini S, Howland JM, Thatcher AJ, Geerling JC (2020) Central afferents to the nucleus of the solitary tract in rats and mice. J Compar Neurol 528: 2708–2728. https://doi.org/10.1002/cne.24927
Bonaz B, Sinniger V, Pellissier S (2016) Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. J Physiol 594: 5781–5790. https://doi.org/10.1113/JP271539
Hillsley K, Grundy D (2004) Vagus Nerve. In: Johnson LR (ed) Encyclopedia of Gastroenterology. Elsevier. New York. 573–576.
Czura CJ, Tracey KJ (2005) Autonomic neural regulation of immunity. J Intern Med 257: 156–166. https://doi.org/10.1111/j.1365-2796.2004.01442.x
Pavlov VA, Tracey KJ (2017) Neural regulation of immunity: molecular mechanisms and clinical translation. Nat Neurosci 20: 156–166. https://doi.org/10.1038/nn.4477
Calzetta L, Luongo L, Cazzola M, Page C, Rogliani P, Facciolo F, Maione S, Capuano A, Rinaldi B, Matera MG (2015) Contribution of sensory nerves to LPS-induced hyperresponsiveness of human isolated bronchi. Life Sci 131: 44–50. https://doi.org/10.1016/j.lfs.2015.03.023
Serrats J, Sawchenko PE (2009) How T-Cell-Dependent and -Independent Challenges Access the Brain: Vascular and Neural Responses to Bacterial Lipopolysaccharide and Staphylococcal Enterotoxin B. Brain Behav Immunol 23: 1038–1052. https://doi.org/10.1016/j.bbi.2009.06.004
Wang X, Wang B-R, Zhang X-J, Duan X-L, Guo X, Ju G (2004) Fos expression in the rat brain after intraperitoneal injection of Staphylococcus enterotoxin B and the effect of vagotomy. Neurochem Res 29: 1667–1674. https://doi.org/10.1023/b:nere.0000035801.81825.2a
Перекрест СВ, Гаврилов ЮВ, Абрамова ТВ, Новикова НС, Корнева ЕА (2006) Активация клеток гипоталамических структур при введении антигенов различной природы (по экспрессии c-Fos гена). Мед иммунол 8: 631–636. [Perekrest SV, Gavrilov YuV, Abramova TV, Novikova NS, Korneva EA (2006) Activation of cells of hypothalamic structures with the introduction of antigens of various nature (by expression of the c-Fos gene). Med immunol 8: 631–636. (In Russ)].
Sklerov M, Dayan E, Browner N (2019) Functional neuroimaging of the central autonomic network: recent developments and clinical implications. Clin Auton Res 29: 555–566. https://doi.org/10.1007/s10286-018-0577-0
Reisert M, Weiller C, Hosp JA (2021) Displaying the autonomic processing network in humans – a global tractography approach. Neuroimage 231: 117852. https://doi.org/10.1016/j.neuroimage.2021.117852
Tracey KJ (2007) Physiology and immunology of the cholinergic antiinflammatory pathway. J Clin Invest 117: 289–296. https://doi.org/10.1172/JCI30555
Goehler LE, Erisir A, Gaykema RPA (2006) Neural-immune interface in the rat area postrema. Neuroscience 140: 1415–1434. https://doi.org/10.1016/j.neuroscience.2006.03.048
Goehler LE, Gaykema RP, Hansen MK, Kleiner JL, Maier SF, Watkins LR (2001) Staphylococcal enterotoxin B induces fever, brain c-Fos expression, and serum corticosterone in rats. Am J Physiol Regul Integr Comp Physiol 280: R1434–1439. https://doi.org/10.1152/ajpregu.2001.280.5.R1434
Friedrich T, Schalla MA, Goebel-Stengel M, Kobelt P, Rose M, Stengel A (2022) Inflammatory Stress Induced by Intraperitoneal Injection of LPS Increases Phoenixin Expression and Activity in Distinct Rat Brain Nuclei. Brain Sci 12: 135. https://doi.org/10.3390/brainsci12020135
Kawai Y (2018) Differential Ascending Projections From the Male Rat Caudal Nucleus of the Tractus Solitarius: An Interface Between Local Microcircuits and Global Macrocircuits. Front Neuroanat 12. https://doi.org/10.3389/fnana.2018.00063
Herbert H, Moga MM, Saper CB (1990) Connections of the parabrachial nucleus with the nucleus of the solitary tract and the medullary reticular formation in the rat. J Comp Neurol 293: 540–580. https://doi.org/10.1002/cne.902930404
Tillinger A, Mravec B (2021) Vagotomy Affects Lipopolysaccharide-Induced Changes of Urocortin 2 Gene Expression in the Brain and on the Periphery. Neurochem Res 46: 159–164. https://doi.org/10.1007/s11064-020-03165-1
Azab AN, Kaplanski J (2001) Vagotomy attenuates the effect of lipopolysaccharide on body temperature of rats in a dose-dependent manner. J Endotoxin Res 7: 359–364.
Hermann GE, Emch GS, Tovar CA, Rogers RC (2001) c-Fos generation in the dorsal vagal complex after systemic endotoxin is not dependent on the vagus nerve. Am J Physiol Regul Integr Comp Physiol 280: R289–299. https://doi.org/10.1152/ajpregu.2001.280.1.R289
Hansen MK, Nguyen KT, Fleshner M, Goehler LE, Gaykema RP, Maier SF, Watkins LR (2000) Effects of vagotomy on serum endotoxin, cytokines, and corticosterone after intraperitoneal lipopolysaccharide. Am J Physiol Regul Integr Comp Physiol 278: R331–R336. https://doi.org/10.1152/ajpregu.2000.278.2.R331
Somann JP, Wasilczuk KM, Neihouser KV, Sturgis J, Albors GO, Robinson JP, Powley TL, Irazoqui PP (2019) Characterization of plasma cytokine response to intraperitoneally administered LPS & subdiaphragmatic branch vagus nerve stimulation in rat model. PLoS One 14: e0214317. https://doi.org/10.1371/journal.pone.0214317
Hofmann GC, Hasser EM, Kline DD (2021) Unilateral vagotomy alters astrocyte and microglial morphology in the nucleus tractus solitarii of the rat. Am J Physiol Regul Integr Comp Physiol 320: R945–R959. https://doi.org/10.1152/ajpregu.00019.2021
Gallaher ZR, Ryu V, Herzog T, Ritter RC, Czaja K (2012) Changes in microglial activation within the hindbrain, nodose ganglia, and the spinal cord following subdiaphragmatic vagotomy. Neurosci Lett 513: 31–36. https://doi.org/10.1016/j.neulet.2012.01.079
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова