Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1340-1352
Электрическая активность сердца крыс в период реполяризации желудочков после однократного бега на тредбане до отказа
А. Г. Ивонин 1, *, С. Л. Смирнова 1, И. М. Рощевская 2
1 Федеральный исследовательский центр Коми научный центр Уральского отделения
Российской академии наук
Сыктывкар, Россия
2 Научно-исследовательский институт фармакологии им. В.В. Закусова
Москва, Россия
* E-mail: alexivonin@mail.ru
Поступила в редакцию 07.08.2022
После доработки 06.09.2022
Принята к публикации 09.09.2022
- EDN: JLKHER
- DOI: 10.31857/S0869813922100089
Аннотация
Работа посвящена исследованию электрической активности сердца крыс в период реполяризации желудочков после однократного принудительного бега до отказа. Электрофизиологические свойства миокарда изучали методами традиционной ЭКГ и поверхностного ЭКГ-картирования. Кардиоэлектрические потенциалы у крыс, наркотизированных золетилом, регистрировали за 3–5 сут до (исходное состояние) и через 5, 10, 20 и 30 мин после бега на тредбане до отказа. По сравнению с исходным состоянием у крыс через 5 мин после физической нагрузки до отказа было показано увеличение длительности интервалов QTII, JTII и Tpeak-TendII, более раннее начало и более позднее завершение, а также увеличение продолжительности реполяризации желудочков на эквипотенциальных картах распределения потенциалов электрического поля сердца (ЭПС) на поверхности тела. Спустя 10 мин после бега до отказа временные параметры электрической активности сердца возвращались к исходным значениям. Изменения амплитудных характеристик ЭКГII (депрессия сегмента ST, снижение амплитуды Т-волны) и ЭПС на поверхности тела (снижение максимальных амплитуд положительного и отрицательного экстремумов в период реполяризации желудочков) обнаруживались через 5–10 мин и сохранялись до 20–30 мин после бега до отказа. Выявлена положительная корреляционная связь между изменениями максимальной амплитуды отрицательного экстремума ЭПС на поверхности грудной клетки и изменениями амплитуды ТII-волны в анализируемые периоды времени после физической нагрузки до отказа. Сделано предположение, что обнаруженные изменения электрической активности сердца в период реполяризации желудочков у крыс после принудительного бега на тредбане были обусловлены ишемическим повреждением миокарда, индуцированным выполнением истощающей физической нагрузки.
Регулярная физическая активность является важным компонентом профилактики и лечения большинства сердечно-сосудистых заболеваний [1] и связана со снижением общей и кардиоваскулярной смертности [2]. В то же время избыточные физические нагрузки могут оказывать негативное влияние на сердце. Высокие уровни физических нагрузок увеличивают риск развития жизнеугрожающих желудочковых аритмий, острого инфаркта миокарда и внезапной сердечной смерти у предрасположенных лиц [3]. Длительные интенсивные физические нагрузки могут приводить к повышению уровня циркулирующих сердечных тропонинов и временному снижению функции миокарда у практически здоровых людей [4].
Для моделирования предельных (истощающих) физических нагрузок у лабораторных животных используют бег на тредбане или принудительное плавание до отказа [5, 6]. Выполнение крысами физической нагрузки до отказа приводит к гипоксически-ишемическому повреждению миокарда вследствие быстрого усиления насосной деятельности сердца и перераспределения сердечного кровотока [7]. После физической нагрузки до отказа у крыс выявлены изменения ультраструктуры кардиомиоцитов, увеличение концентрации маркеров повреждения миокарда в сыворотке крови, нарушение сердечного метаболизма [8], ослабление систолической и диастолической функций левого желудочка [9].
Функциональное состояние сердца отражается на его электрофизиологических свойствах. Процесс реполяризации (восстановления возбудимости) миокарда высокочувствителен к действию различных факторов [10], включая физические нагрузки [11]. У лабораторных животных анализ электрических процессов в сердце в период реполяризации желудочков после физической нагрузки до отказа проводится по показателям ЭКГ в отведениях от конечностей (амплитуде сегмента ST и Т-волны) [7, 12]. Вместе с тем изменения на ЭКГ в стандартных отведениях в период реполяризации миокарда желудочков не обладают высокой специфичностью, однотипная картина изменений ST-сегмента и Т-волны может наблюдаться при различных функциональных состояниях сердца [13]. Поверхностное ЭКГ-картирование, основанное на синхронной регистрации кардиоэлектрических потенциалов от множества отведений на поверхности грудной клетки, является перспективным неинвазивным методом исследования биоэлектрических процессов в миокарде, позволяет проводить более сложный и обширный анализ по сравнению со стандартной ЭКГ [14, 15]. Чувствительность и специфичность многоканального поверхностного ЭКГ-картирования выше, чем у ЭКГ в общепринятых отведениях [16]. С помощью метода поверхностного картирования ЭКГ-сигналов ранее были выявлены существенные изменения электрических свойств миокарда у крыс при экспериментальном моделировании патологий сердечно-сосудистой системы [17, 18].
Цель настоящей работы – исследовать электрическую активность сердца крыс в период реполяризации желудочков после однократного бега на тредбане до отказа с использованием традиционной электрокардиографии и картирования кардиоэлектрических потенциалов на поверхности тела.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на самцах нелинейных белых крыс (возраст 12 недель, масса 267 ± 24 г), полученных в филиале “Столбовая” ФГБУН “Научный центр биомедицинских технологий Федерального медико-биологического агентства” (п. Столбовая, Россия). Крысы содержались в стандартных условиях вивария при режиме 12 ч свет/12 ч темнота и температуре 22 ± 2°С в групповых клетках и получали стандартный коммерческий корм для грызунов и питьевую воду без ограничений. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по биомедицинской этике ФГБНУ “НИИ фармакологии им. В.В. Закусова”.
Для моделирования физической нагрузки использовали моторизированный тpедбан для грызунов (Panlab/Harvard Apparatus, Испания) с cиcтемой упpавления, позволяющей задавать необходимой уровень нагрузки. Крыс приучали к бегу на тредбане в течение трех суток подряд по 10 мин/сутки при постепенном увеличении скорости от 12 до 36 м/мин и наклоне дорожки 0°. Для стимуляции бега применяли удары электрическим током (0.5 мА) от электропроводящей решетки, расположенной в заднем конце тредбана. Животных, проявивших способность к бегу во время ознакомительных тренировок, отбирали для использования в тесте с физической нагрузкой до отказа. В день тестирования крыс подвергали бегу до отказа при скорости 36 м/мин и 0° угле наклона дорожки. Критерием отказа [19] являлась неспособность крыс продолжать бег против движущейся ленты тредбана, несмотря на электростимуляцию. Из 24 крыс, участвующих в ознакомительных тренировках, для теста с физической нагрузкой до отказа были отобраны 20 животных. Продолжительность бега этих крыс до момента отказа составила 19.5 ± 5.6 мин.
Электрическую активность сердца крыс регистрировали за три–пять суток до (исходное состояние) и через 5, 10, 20 и 30 мин после бега до отказа. Животных наркотизировали золетилом (Virbac, Франция) в дозе 3.5 мг/100 г массы тела (внутримышечно) и располагали лежа на спине. Регистрацию униполярных ЭКГ осуществляли от 64 (в исходном состоянии) или 32 (после бега до отказа) подкожных игольчатых электродов, равномерно распределенных вокруг грудной клетки. Синхронно с униполярными ЭКГ с поверхности тела регистрировали ЭКГ в стандартных (биполярных) отведениях от конечностей. Данные записывали с помощью многоканальной автоматизированной системы (разрешение 16 бит, полоса пропускания 0.05–1000 Гц, частота дискретизации сигнала 4000 Гц). Период от трех до пяти суток между записью ЭКГ-сигналов в исходном состоянии и бегом до отказа служил для восстановления животных после общей анестезии. Для регистрации электрической активности сердца после выполнения физической нагрузки крыс наркотизировали сразу же после отказа от бега и снятия с ленты тредбана.
На ЭКГ во II отведении от конечностей (ЭКГII) по трем кардиоциклам измеряли длительность интервалов R-R, QT, JT, J-Tpeak и Tpeak-Tend, амплитуду S-зубца и Т-волны. По длительности R-R интервалов рассчитывали частоту сердечных сокращений (ЧСС). Амплитуду S-зубца рассматривали в качестве амплитуды сегмента ST [20].
На основе туловищных ЭКГ строили эквипотенциальные моментные карты, отражающие распределение потенциалов электрического поля сердца (ЭПС) в каждый заданный момент кардиоцикла на развертке поверхности тела на плоскость прямоугольника. По эквипотенциальным моментным картам определяли моменты начала и завершения реполяризации желудочков (о начале реполяризации судили по характерному паттерну пространственного распределения потенциалов ЭПС на поверхности грудной клетки, о завершении реполяризации – по наибольшему снижению амплитуд потенциалов ЭПС), продолжительность периода реполяризации желудочков, максимальные амплитуды положительного и отрицательного экстремумов кардиоэлектрических потенциалов, время достижения экстремумами максимальных амплитуд. Отсчет времени (в мс) осуществляли относительно пика R-зубца на ЭКГII.
Статистический анализ данных проводили с использованием программы Statistica 10.0 (StatSoft, Tulsa, OK, США). При определении временных параметров ЭКГII и временных характеристик ЭПС на поверхности тела учитывали животных (n = 14), у которых нисходящая фаза Т-волны на ЭКГ в отведениях от конечностей и туловищных отведениях пересекалась с изоэлектрической линией (уровнем сегмента PQ); крыс, у которых Т-волна наслаивалась на Р-волну последующего кардиоцикла до достижения изолинии, не учитывали. При анализе амплитудных параметров ЭКГII и амплитудных характеристик ЭПС на поверхности тела объем выборки составлял 20 животных (n = 20). Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. При нормальном распределении данных для сравнения средних значений одного и того же параметра в различные периоды времени применяли дисперсионный анализ для повторных измерений (RM-ANOVA). В случае выявления значимого влияния фактора времени на изучаемый параметр проводили апостериорный анализ (post hoc тест) с помощью критерия Даннета, сравнивая значения параметра в каждый период измерения после бега до отказа с таковым в исходном состоянии. Если распределение данных отличалось от нормального, для сравнения переменных использовали непараметрический критерий Фридмана. Данные с нормальным распределением представлены в виде средней арифметической ± стандартное отклонение. Данные с распределением, отличным от нормального, приведены в виде медианы, первого и третьего квартилей. Взаимосвязь между показателями оценивали при помощи коэффициента корреляции Пирсона (r). Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Параметры ЭКГII у крыс в исходном состоянии и в анализируемые периоды времени после принудительного бега до отказа представлены в табл. 1. Значения ЧСС до и после бега до отказа значимо не различались (F4, 52 = 2.49, p > 0.05, RM-ANOVA). Наблюдалось влияние фактора времени на длительность интервалов QTII, JTII и Tpeak-TendII (F4, 52 = 2.70, р = 0.04 для QTII, F4, 52 = 3.94, p < 0.01 для JTII и F4, 52 = 4.18, р < 0.01 для Tpeak-TendII интервала). Апостериорный анализ показал увеличение длительности вышеперечисленных интервалов ЭКГ через 5 мин после бега до отказа относительно исходного состояния (p = 0.01 для QTII, p < 0.01 для JTII и p < 0.01 для Tpeak-TendII интервала). Длительность интервала J-TpeakII до и после бега практически не различалась (F4, 52 = 0.36, p > 0.05, RM-ANOVA).
Таблица 1.
Параметры ЭКГ у крыс в исходном состоянии и после бега до отказа
| Параметры | Исходное состояние | Период после бега до отказа (мин) | |||
|---|---|---|---|---|---|
| 5 | 10 | 20 | 30 | ||
| ЧСС, уд./мин | 485 ± 22 | 479 ± 21 | 491 ± 22 | 489 ± 26 | 491 ± 23 |
| QTII, мс | 62.5 ± 3.5 | 65.1 ± 3.2* | 64.1 ± 3.7 | 64.2 ± 4.4 | 63.2 ± 3.7 |
| JTII, мс | 46.6 ± 3.5 | 50.0 ± 3.6** | 48.6 ± 3.9 | 48.4 ± 4.8 | 47.9 ± 4.2 |
| J-TpeakII, мс | 18.5 ± 2.2 | 18.9 ± 3.1 | 18.6 ± 3.1 | 18.4 ± 2.9 | 18.9 ± 3.4 |
| Tpeak-TendII, мс | 28.1 ± 3.3 | 31.1 ± 2.5** | 30.0 ± 3.8 | 29.8 ± 3.7 | 28.8 ± 3.0 |
| STII сегмент, мВ | –0.28 ± 0.15 | –0.35 ± 0.18*** | –0.35 ± 0.19*** | –0.37 ± 0.19*** | –0.35 ± 0.19*** |
| TII-волна, мВ | 0.19 ± 0.05 | 0.17 ± 0.06* | 0.16 ± 0.06*** | 0.17 ± 0.05* | 0.18 ± 0.05 |
Значительный эффект времени был обнаружен для амплитудных параметров ЭКГ (F4, 76 = 14.83, р < 0.001 для амплитуды сегмента STII и F4, 76 = 4.76, р = 0.02 для амплитуды ТII-волны, RM-ANOVA). Амплитуда сегмента STII во все периоды измерения (5, 10, 20, 30 мин) после бега до отказа была больше, чем в исходном состоянии (р < 0.001 для всех парных сравнений, критерий Даннета). По сравнению с исходной величиной, амплитуда ТII-волны была меньше через 5 (p = 0.02), 10 (p < 0.001) и 20 мин (p = 0.01) после бега до отказа (критерий Даннета). Корреляционный анализ показал отсутствие статистически значимой взаимосвязи между изменением амплитуд сегмента STII и ТII-волны в анализируемые периоды времени после бега до отказа относительно исходного состояния (r = 0.06–0.18, p = 0.45–0.79).
Пространственное распределение кардиоэлектрических потенциалов на поверхности грудной клетки в период реполяризации желудочков у крыс после физической нагрузки до отказа было схожим с таковым в исходном состоянии (рис. 1). Формирование на поверхности тела ЭПС, характерного для реполяризации желудочков, происходило в период, соответствующий переходу восходящей части S-зубца в Т-волну на ЭКГII. При этом область положительных кардиопотенциалов с экстремумом располагалась в каудальной части вентральной поверхности грудной клетки. Область отрицательных потенциалов занимала всю остальную поверхность грудной клетки, отрицательный экстремум чаще находился на дорсальной поверхности грудной клетки в ее краниальной трети. Такое расположение областей и экстремумов кардиопотенциалов на поверхности тела сохранялось на протяжении всего периода реполяризации желудочков сердца (о завершении процесса реполяризации свидетельствовало наибольшее уменьшение амплитуд потенциалов ЭПС, которое практически соответствовало окончанию Т-волны на ЭКГII).
Рис. 1.
Пространственное распределение кардиоэлектрических потенциалов на поверхности тела крысы (№ 13) в период реполяризации желудочков в исходном состоянии, через 5 и 30 мин после бега до отказа. а – начало ТII-волны; b – вершина ТII-волны; c – окончание ТII-волны. Показаны области положительных (закрашены) и отрицательных кардиопотенциалов. Знаки плюс и минус обозначают местоположение положительного и отрицательного экстремумов соответственно. Под каждой картой указано время относительно пика RII-зубца, представлены амплитуды положительного и отрицательного экстремумов. Справа от каждой карты приведена ЭКГII с маркером времени (вертикальная черта). Шаг изолиний равен 0.1 мВ. Левая половина каждой карты соответствует вентральной стороне тела, правая – дорсальной.
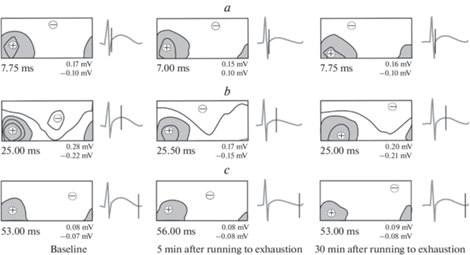
Статистический анализ выявил значимое влияние фактора времени на моменты начала и завершения периода реполяризации желудочков (F4, 52 = 12.29, р < 0.001 и F4, 52 = 9.36, р < 0.01 соответственно, RM-ANOVA), а также на длительность реполяризации желудочков на эквипотенциальных картах распределения потенциалов ЭПС на поверхности тела (F4, 76 = 11.83, р < 0.001, RM-ANOVA). Post hoc тест показал, что процесс реполяризации желудочков у крыс через 5 мин после бега до отказа начинался значимо раньше (р < 0.001) и завершался значимо позже (р < 0.001), чем в исходном состоянии (табл. 2). Длительность реполяризации желудочков у крыс через 5 мин после бега до отказа значимо превышала таковую в исходном состоянии (р < 0.001) (табл. 2).
Таблица 2.
Временные параметры ЭПС на поверхности тела в период реполяризации желудочков у крыс в исходном состоянии и после бега до отказа
| Параметры | Исходное состояние | Период после бега до отказа (мин) | |||
|---|---|---|---|---|---|
| 5 | 10 | 20 | 30 | ||
| Момент начала реполяризации желудочков, мс | 6.5 ± 1.4 | 5.9 ± 1.3*** | 6.4 ± 1.4 | 6.6 ± 1.3 | 6.5 ± 1.4 |
| Момент завершения реполяризации желудочков, мс | 57.4 ± 5.9 | 61.3 ± 3.4*** | 57.9 ± 4.0 | 56.4 ± 4.5 | 56.3 ± 4.0 |
| Длительность реполяризации желудочков, мс | 50.9 ± 6.0 | 55.5 ± 3.4*** | 51.5 ± 4.1 | 49.8 ± 4.5 | 49.8 ± 4.3 |
Амплитуды положительного и отрицательного экстремумов кардиопотенциалов на поверхности тела крыс в период реполяризации желудочков постепенно увеличивались, достигая максимальных значений около вершины ТII-волны, после чего уменьшались. Наблюдалось значительное влияние фактора времени на максимальную амплитуду экстремумов за период реполяризации желудочков (F4, 76 = 25.06, р < 0.001 для положительного и F4, 76 = 5.87, р < 0.01 для отрицательного экстремума, RM-ANOVA). Максимальная амплитуда положительного экстремума во все периоды измерения после бега до отказа была значимо меньше, чем в исходном состоянии (p < 0.001 для каждого парного сравнения) (рис. 2). По сравнению с исходным значением максимальная амплитуда отрицательного экстремума была значимо меньше через 10 (p < 0.001) и 20 мин (p < 0.01) после бега до отказа (рис. 2).
Рис. 2.
Максимальная амплитуда положительного (темная заливка) и отрицательного (светлая заливка) экстремумов ЭПС на поверхности тела в период реполяризации желудочков у крыс в исходном состоянии и после бега до отказа. Данные представлены как средняя арифметическая ± стандартное отклонение. Различия значимы по сравнению с исходным состоянием. ** р < 0.01, *** р < 0.001, критерий Даннета.

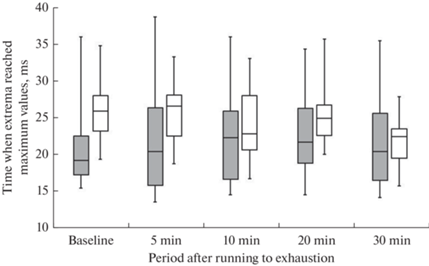
Статистически значимая прямая взаимосвязь была установлена между изменением максимальной амплитуды отрицательного экстремума ЭПС на поверхности тела и изменением амплитуды ТII-волны в анализируемые периоды времени после бега до отказа относительно исходного состояния (табл. 3). Значимая связь между изменением максимальной амплитуды положительного экстремума и изменением амплитуды ТII-волны в различные периоды времени после бега до отказа отсутствовала (табл. 3). Время достижения экстремумами ЭПС максимальных амплитуд до и после бега до отказа значимо не различалось (χ2 = 6.26, df = 4, p > 0.05 для положительного и χ2 = 7.19, df = 4, p > 0.05 для отрицательного экстремума, критерий Фридмана) (рис. 3).
Таблица 3.
Взаимосвязь изменений максимальной амплитуды положительного (dMax) и отрицательного (dMin) экстремумов ЭПС на поверхности тела в период реполяризации желудочков с изменением амплитуды ТII-волны (dТII) у крыс в анализируемые периоды времени после бега до отказа относительно исходного состояния
| Показатель | Период после бега до отказа (мин) | |||||||
|---|---|---|---|---|---|---|---|---|
| 5 | 10 | 20 | 30 | |||||
| r | p | r | p | r | p | r | p | |
| dMax, мВ–dТII, мВ | 0.31 | 0.19 | 0.41 | 0.07 | 0.26 | 0.26 | 0.38 | 0.10 |
| dMin, мВ–dТII, мВ | 0.71 | <0.01 | 0.79 | <0.001 | 0.85 | <0.001 | 0.82 | <0.001 |
Рис. 3.
Момент достижения положительным (темная заливка) и отрицательным (светлая заливка) экстремумами ЭПС на поверхности тела максимальных амплитуд в период реполяризации желудочков у крыс в исходном состоянии и после бега до отказа. Нижняя и верхняя граница каждого прямоугольника – первый и третий квартили соответственно; поперечная линия внутри – медианa; концы отрезков – минимум и максимум соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Принудительный бег на тредбане вызывает у грызунов мощный метаболический стресс, требующий значительного увеличения доставки кислорода к работающим мышцам [21]. Реакцией сердечно-сосудистой системы крыс на принудительную беговую нагрузку является увеличение ЧСС [22], обеспечивающее возрастание сердечного выброса. Учащение сердечного ритма у крыс во время бега на тредбане в значительной степени определяется деятельностью автономной нервной системы, в особенности активацией симпатических кардиотропных влияний [23]. Cнижение ЧСС после прекращения физической нагрузки связывают с вагусной реактивацией [24]. У нетренированных крыс линии Вистар величина ЧСС во время бега до отказа повышалась от 427 до 595 уд./мин и снижалась до исходного уровня спустя 10 мин после окончания бега [25]. В нашем исследовании в анализируемые периоды времени (5, 10, 20 и 30 мин) после бега до отказа ЧСС не отличалась от таковой до бега, что связывали с ее восстановлением до исходного уровня в течение первых 5 мин после прекращения физической нагрузки.
На фоне отсутствия изменений ЧСС у крыс после бега до отказа наблюдали обратимое увеличение длительности отдельных составляющих кардиоцикла (интервалов QT, JT и Tpeak-Tend) относительно исходного состояния. Длительность интервала QT, отражающего общее время де- и реполяризации желудочков сердца, во время физической нагрузки сокращается по мере увеличения ЧСС [13, 26]. Отсутствие укорочения интервала QT при физической нагрузке рассматривается в качестве маркера ишемии миокарда [27]. Интервал JT отражает непосредственно процесс реполяризации миокарда желудочков [28], при физической нагрузке наблюдается укорочение данного интервала [29]. В исследованиях на экспериментальных животных выявлена пролонгация интервала JT при доксорубицин-индуцируемом повреждении сердца [30], ишемии-реперфузии миокарда [31]. Длительность интервала Tpeak-Tend коррелирует с глобальной дисперсией реполяризации, удлинение интервала свидетельствует о повышенной неоднородности реполяризации желудочков и является предиктором жизнеугрожающих аритмий и внезапной сердечной смерти при ишемической болезни сердца и других патологических состояниях [32]. Выявленное нами увеличение длительности интервалов QTII, JTII и Tpeak-TendII у крыс через 5 мин после бега до отказа могло быть проявлением транзиторной ишемии миокарда и косвенно указывало на повышение риска неблагоприятных кардиальных событий у животных при выполнении истощающей физической нагрузки.
Депрессия ST сегмента на ЭКГ человека при физической нагрузке служит маркером преходящей ишемии миокарда [11, 33]. У взрослых крыс изоэлектрический сегмент ST на ЭКГ отсутствует, что связывают с кратковременностью фазы медленной реполяризации на внутриклеточном потенциале действия рабочих кардиомиоцитов желудочков вследствие высокой плотности выходящего калиевого тока Ito [34]. Депрессию сегмента SТ на ЭКГ крыс предложено оценивать по увеличению амплитуды S-зубца [20, 35]. В исследованиях на человеке показано, что амплитуда Т-волны на ЭКГ увеличивается сразу после завершения физической нагрузки [11]. Снижение амплитуды (уплощение) Т-волны на ЭКГ после нагрузочного тестирования может указывать на ишемию миокарда [13]. Уплощение Т-волны в сочетании с депрессией ST сегмента было обнаружено на ЭКГ крыс линии Вистар после ежедневного, в течение семи суток, принудительного плавания до отказа [12]. Таким образом, депрессия сегмента SТII и снижение амплитуды ТII-волны у крыс после бега до отказа в настоящем исследовании могли быть результатом гипоксически-ишемического повреждения миокарда желудочков, возникающего вследствие неспособности коронарных сосудов удовлетворить возросшие потребности сердечной мышцы в кислороде. Корреляционный анализ свидетельствовал о низкой сопряженности изменений амплитуды сегмента SТII и ТII-волны в анализируемые периоды времени после бега до отказа.
Пространственное распределение кардиоэлектрических потенциалов на поверхности грудной клетки в период Т-волны ЭКГ отражает последовательность восстановления возбудимости желудочков сердца [36], обусловленную, в свою очередь, распределением локальных длительностей реполяризации [37]. В нашем исследовании расположение областей кардиопотенциалов, положительного и отрицательного экстремумов ЭПС на поверхности тела крыс в период реполяризации желудочков после бега до отказа существенно не изменялось и соответствовало таковому, описанному ранее у взрослых крыс линии Вистар [36].
Анализ ЭПС на поверхности тела выявил изменения временных характеристик электрической активности миокарда у крыс через 5 мин после бега до отказа: более раннее начало и более позднее завершение реполяризации желудочков, увеличение продолжительности периода реполяризации желудочков. Известно, что физические нагрузки могут вызывать уменьшение длительности деполяризации (возбуждения) желудочков сердца, что отражается на ЭКГ в виде укорочения комплекса QRS [38]. В представленной работе более раннее начало реполяризации на эквипотенциальных моментных картах у крыс после бега до отказа сопровождалось уменьшением длительности комплекса QRS на ЭКГII (данные не представлены), и поэтому могло быть обусловлено изменением продолжительности возбуждения миокарда желудочков. Более позднее завершение периода реполяризации желудочков на эквипотенциальных картах у крыс после истощающей физической нагрузки до отказа свидетельствовало о замедлении процесса восстановления возбудимости кардиомиоцитов желудочков, связываемом нами с преходящей ишемией сердечной мышцы.
В немногочисленных работах анализировалось влияние физических нагрузок на амплитудные характеристики ЭПС на поверхности тела человека в период реполяризации желудочков. По данным одних авторов, максимальная амплитуда положительного экстремума кардиоэлектрических потенциалов в период Т-волны у здоровых испытуемых после нагрузочной пробы повышалась на 30–260% по сравнению с состоянием покоя [39]. Другие исследователи не выявили выраженных изменений максимальной и минимальной амплитуд кардиопотенциалов на поверхности тела здоровых испытуемых в момент пика Т-волны реперной ЭКГ после нагрузочного тестирования [40]. На основании сопоставления параметров ЭПС на поверхности грудной клетки у здоровых лиц и больных с ишемической болезнью сердца снижение амплитуды Т-волны в прекордиальных отведениях после физической нагрузки было предложено рассматривать в качестве маркера транзиторной ишемии миокарда [41]. Выявленное нами уменьшение максимальных амплитуд положительного и отрицательного экстремумов ЭПС на поверхности тела в период реполяризации желудочков у крыс после бега до отказа могло быть следствием значительной гипоксии нагрузки, приведшей к ишемии миокарда желудочков. Прямая корреляционная связь между изменениями амплитуды ТII-волны и изменениями максимальной амплитуды отрицательного экстремума ЭПС в анализируемые периоды времени после бега до отказа косвенно подтверждала ишемическое происхождение последних.
Таким образом, у ранее нетренированных крыс после однократного бега на тредбане до отказа выявлены изменения временных и амплитудных параметров ЭКГII и ЭПС на поверхности тела, характеризующих процесс реполяризации желудочков. При этом изменения временных параметров электрической активности сердца обнаруживались через 5 мин и исчезали через 10 мин после бега до отказа, а амплитудных – выявлялись спустя 5–10 мин и сохранялись до 20–30 мин после бега до отказа. Большая часть из обнаруженных изменений электрофизиологических характеристик миокарда, предположительно, была обусловлена гипоксически-ишемическим повреждением сердечной мыщцы, индуцированным истощающей физической нагрузкой. Использование метода поверхностного ЭКГ-картирования у крыс после воздействия физической нагрузки до отказа позволило выявить изменения электрической активности миокарда в начальную фазу реполяризации желудочков, не находящие отражения на ЭКГ во II отведении от конечностей.
Список литературы
Pinckard K, Baskin KK, Stanford KI (2019) Effects of exercise to improve cardiovascular health. Front Cardiovasc Med 6: 69. https://doi.org/10.3389/fcvm.2019.00069
Nocon M, Hiemann T, Müller-Riemenschneider F, Thalau F, Roll S, Willich SN (2008) Association of physical activity with all-cause and cardiovascular mortality: a systematic review and meta-analysis. Eur J Cardiovasc Prev Rehabil 15(3): 239–246. https://doi.org/10.1097/HJR.0b013e3282f55e09
Franklin BA, Thompson PD, Al-Zaiti SS, Albert CM, Hivert MF, Levine BD, Lobelo F, Madan K, Sharrief AZ, Eijsvogels T, American Heart Association Physical Activity Committee of the Council on Lifestyle and Cardiometabolic Health; Council on Cardiovascular and Stroke Nursing; Council on Clinical Cardiology; and Stroke Council (2020) Exercise-Related Acute Cardiovascular Events and Potential Deleterious Adaptations Following Long-Term Exercise Training: Placing the Risks Into Perspective-An Update: A Scientific Statement From the American Heart Association. Circulation 141(13): e705–e736. https://doi.org/10.1161/CIR.0000000000000749
Whyte GP (2008) Clinical significance of cardiac damage and changes in function after exercise. Med Sci Sports Exerc 40(8): 1416–1423. https://doi.org/10.1249/MSS.0b013e318172cefd
Zaretsky DV, Kline H, Zaretskaia MV, Rusyniak DE (2018) Automatic analysis of treadmill running to estimate times to fatigue and exhaustion in rodents. Peer J 6: e5017. https://doi.org/10.7717/peerj.5017
Wang CC, Ding L, Zhang LY, Shi HH, Xue CH, Chi NQ, Yanagita T, Zhang TT, Wang YM (2020) A pilot study on the effects of DHA/EPA-enriched phospholipids on aerobic and anaerobic exercises in mice. Food Funct 11(2): 1441–1454. https://doi.org/10.1039/c9fo02489a
Su Y, Wang Y, Xu P, Sun Y, Ping Z, Huang H, Cao X (2021) Study on the time-effectiveness of exercise preconditioning on heart protection in exhausted rats. Chin J Physiol 64(2): 97–105. https://doi.org/10.4103/CJP.CJP_65_20
Ping Z, Zhang LF, Cui YJ, Chang YM, Jiang CW, Meng ZZ, Xu P, Liu HY, Wang DY, Cao XB (2015) The Protective Effects of Salidroside from Exhaustive Exercise-Induced Heart Injury by Enhancing the PGC-1훼-NRF1/NRF2 Pathway and Mitochondrial Respiratory Function in Rats. Oxid Med Cell Longev 2015: 876825. https://doi.org/10.1155/2015/876825
Li Y, Xu P, Wang Y, Zhang J, Yang M, Chang Y, Zheng P, Huang H, Cao X (2020) Different Intensity Exercise Preconditions Affect Cardiac Function of Exhausted Rats through Regulating TXNIP/TRX/NF-ĸBp65/NLRP3 Inflammatory Pathways. Evid Based Complement Alternat Med 2020: 5809298. https://doi.org/10.1155/2020/5809298
Locati ET, Bagliani G, Padeletti L (2017) Normal ventricular repolarization and QT interval: ionic background, modifiers, and measurements. Card Electrophysiol Clin 9(3): 487–513. https://doi.org/10.1016/j.ccep.2017.05.007
Fletcher GF, Ades PA, Kligfield P, Arena R, Balady GJ, Bittner VA, Coke LA, Fleg JL, Forman DE, Gerber TC, Gulati M, Madan K, Rhodes J, Thompson PD, Williams MA, American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee of the Council on Clinical Cardiology, Council on Nutrition, Physical Activity and Metabolism, Council on Cardiovascular and Stroke Nursing, and Council on Epidemiology and Prevention (2013) Exercise standards for testing and training: a scientific statement from the American Heart Association. Circulation 128(8): 873–934. https://doi.org/10.1161/CIR.0b013e31829b5b44
Wang F, Zhao J, Wang C (2010) The dynamic changes on ECG in different time cases after repeated exhausted exercise in rats. Chin J Rehabilitat Med 25(11): 1030–1034.https://doi.org/10.3969/j.issn.1001-1242.2010.11.003
Аронов ДМ, Лупанов ВП (2007) Функциональные пробы в кардиологии. М. МЕДпресс-информ. [Aronov DM, Lupanov VP (2007) Functional tests in cardiology. M. MEDpress-inform. (In Russ)].
Bond RR, Finlay DD, Nugent CD, Moore G, Guldenring D (2013) Methods for presenting and visualising electrocardiographic data: From temporal signals to spatial imaging. J Electrocardiol 46(3): 182–196. https://doi.org/10.1016/j.jelectrocard.2013.01.008
Bergquist J, Rupp L, Zenger B, Brundage J, Busatto A, MacLeod RS (2021) Body surface potential mapping: contemporary applications and future perspectives. Hearts 2(4): 514–542. https://doi.org/10.3390/hearts2040040
Kania M, Maniewski R, Zaczek R, Kobylecka M, Zbieć A, Królicki L, Opolski G (2019) High-Resolution Body Surface Potential Mapping in Exercise Assessment of Ischemic Heart Disease. Ann Biomed Eng 47(5): 1300–1313. https://doi.org/10.1007/s10439-019-02231-2
Смирнова СЛ, Суслонова ОВ, Рощевская ИМ (2020). Неинвазивное выявление аритмогенных очагов предсердий по кардиоэлектрическому полю на поверхности тела при экспериментальной легочной гипертензии. Вестн аритмол 1(99): 63–69. [Smirnova SL, Suslonova OV, Roshchevskaya IM (2020) Non-invasive detection of arrhythmogenic foci of atria by using the cardioelectric field on the surface of the body during experimental pulmonary hypertension. J Arhythmol 1(99): 63–69. (In Russ)]. https://doi.org/10.35336/VA-2020-1-63-69
Суслонова ОВ, Смирнова СЛ, Рощевская ИМ (2021) Кардиоэлектрическое поле на поверхности тела крыс в период деполяризации желудочков при хроническом воздействии доксорубицина. Эксперим клин фармакол 84(12): 9–13. [Suslonova OV, Smirnova SL, Roshchevskaya IM (2021) Cardioelectric field on the rat body surface during ventricular depolarization under chronic exposure to doxorubicin. Exp Cin Pharmacol 84(12): 9–13. (In Russ)]. https://doi.org/10.30906/0869-2092-2021-84-12-9-13
Walters TJ, Ryan KL, Tate LM, Mason PA (2000) Exercise in the heat is limited by a critical internal temperature. J Appl Physiol 89(2): 799–806. https://doi.org/10.1152/jappl.2000.89.2.799
Yamamoto S, Matsui K, Sasabe M, Kitano M, Ohashi N (2000) Effect of SMP-300, a new Na+/H+ exchange inhibitor, on myocardial ischemia and experimental angina models in rats. Jpn J Pharmacol 84(2): 196–205. https://doi.org/10.1254/jjp.84.196
Poole DC, Copp SW, Colburn TD, Craig JC, Allen DL, Sturek M, O’Leary DS, Zucker IH, Musch TI (2020) Guidelines for animal exercise and training protocols for cardiovascular studies. Am J Physiol Heart Circ Physiol 318(5): 1100–1138. https://doi.org/10.1152/ajpheart.00697.2019
Borges JP, Masson GS, Tibiriçá E, Lessa MA (2014) Aerobic interval exercise training induces greater reduction in cardiac workload in the recovery period in rats. Arq Bras Cardiol 102(1): 47–53. https://doi.org/10.5935/abc.20130230
Тарасова ОС, Борзых АА, Кузьмин ИВ, Боровик АС Лукошкова ЕВ, Шарова АП, Виноградова ОЛ, Григорьев АИ (2012) Динамика изменений частоты сокращений сердца у крыс при ступенчатом изменении скорости бега на тредбане. Рос физиол журн им ИМ Сеченова 98(11): 1372–1379. [Tarasova OS, Borzykh AA, Kuzmin IV, Borovik AS, Lukoshkova EV, Sharova AP, Vinogradova OL, Grugoriev AI (2012) Dynamics of heart rate changes in rats following stepwise change of treadmill running speed. Russ J Physiol 98(11): 1372–1379. (In Russ)].
van de Vegte YJ, Tegegne BS, Verweij N, Snieder H, van der Harst P (2019) Genetics and the heart rate response to exercise. Cell Mol Life Sci 76(12): 2391–2409. https://doi.org/10.1007/s00018-019-03079-4
Gleeson TT, Baldwin KM (1981) Cardiovascular response to treadmill exercise in untrained rats. J Appl Physiol Respir Environ Exerc Physiol 50(6): 1206–1211. https://doi.org/10.1152/jappl.1981.50.6.1206.
Терегулов ЮЭ, Салямова ЛФ, Максумова НВ, Гизатуллина АФ (2018) Оценка интервала QT при проведении пробы с физической нагрузкой. Практ мед 1 (112): 30–36. [Teregulov YuE, Salyamova LF, Maksumova NV, Gizatullina AF (2018) Evaluation of the QT interval during stress tests. Pract Med 1 (112): 30–36. (In Russ)].
Watanabe T, Harumi K, Akutsu Y, Yamanaka H, Michihata T, Okazaki O, Katagiri T (1998) Relation between exercise-induced myocardial ischemia as assessed by nitrogen-13 ammonia positron emission tomography and QT interval behavior in patients with right bundle branch block. Am J Cardiol 81(7): 816–821. https://doi.org/10.1016/s0002-9149(98)00002-2
Zonneveld MH, Noordam R, Grond JV, Sabayan B, Mooijaart SP, Mcfarlane PW, Jukema JW, Trompet S (2020) Ventricular repolarization is associated with cognitive function, but not with cognitive decline and brain magnetic resonance imaging (MRI) measurements in older adults. J Clin Med 9(4): 911. https://doi.org/10.3390/jcm9040911
van den Berg J, de Bie S, Meijboom FJ, Hop WC, Pattynama PM, Bogers AJ, Helbing WA (2008) Changes during exercise of ECG intervals related to increased risk for ventricular arrhythmia in repaired tetralogy of Fallot and their relationship to right ventricular size and function. Int J Cardiol 124(3): 332–338. https://doi.org/10.1016/j.ijcard.2007.02.009
Al-Jaouni S, Abdul-Hady S, El-Bassossy H, Salah N, Hagras M (2019) Ajwa Nanopreparation Prevents Doxorubicin-Associated Cardiac Dysfunction: Effect on Cardiac Ischemia and Antioxidant Capacity. Integr Cancer Ther 18: 1534735419862351. https://doi.org/10.1177/1534735419862351
Nazari A, Mohamadi A, Imani AR, Faghihi M, Tarahi MJ, Moghimian M, Cheraghi M (2021) Effect of vasopressin on electrocardiographic changes produced by ischemia-reperfusion in rats. Pak J Pharm 34(4): 1409–1414.
Tse, G, Gong M, Meng L, Wong CW, Georgopoulos S, Bazoukis G, Wong M, Letsas KP, Vassiliou VS, Xia Y, Baranchuk AM, Yan GX, Liu T (2018) Meta-analysis of Tpeak-Tend and Tpeak-Tend/QT ratio for risk stratification in congenital long QT syndrome. J Electrocardiol 51(3): 396–401. https://doi.org/10.1016/j.jelectrocard.2018.03.001
Katheria R, Setty SK, Arun BS, Bhat P, Jagadeesh HV, Manjunath CN (2021) Significance of 'recovery ST-segment depression' in exercise stress test. Indian Heart J 73(6): 693–696. https://doi.org/10.1016/j.ihj.2021.10.001
Joukar S (2021) A comparative review on heart ion channels, action potentials and electrocardiogram in rodents and human: extrapolation of experimental insights to clinic. Lab Anim Res 37(1): 25. https://doi.org/10.1186/s42826-021-00102-3
Farraj AK, Hazari MS, Haykal-Coates N, Lamb C, Winsett DW, Ge Y, Ledbetter AD, Carll AP, Bruno M, Ghio A, Costa DL (2011) ST depression, arrhythmia, vagal dominance, and reduced cardiac micro-RNA in particulate-exposed rats. Am J Respir Cell Mol Biol 44(2): 185–196. https://doi.org/10.1165/rcmb.2009-0456OC
Рощевская ИМ (2008) Кардиоэлектрическое поле теплокровных животных и человека. СПб. Наука. [Roshhevskaya IM (2008) Cardioelectric field of warm-blooded animals and humans. SPb. Nauka. (In Russ)].
Opthof T, Janse MJ, Meijborg VM, Cinca J, Rosen MR, Coronel R (2016) Dispersion in ventricular repolarization in the human, canine and porcine heart. Prog Biophys Mol Biol 120(1–3): 222–235. https://doi.org/10.1016/j.pbiomolbio.2016.01.007
Berntsen RF, Gjestvang FT, Rasmussen K (1995) QRS prolongation as an indicator of risk of ischemia-related ventricular tachycardia and fibrillation induced by exercise. Am Heart J 129(3): 542–548. https://doi.org/10.1016/0002-8703(95)90283-x
Miller WT, Spach MS, Warren RB (1980) Total body surface potential mapping during exercise: QRS-T-wave changes in normal young adults. Circulation 62(3): 632–645. https://doi.org/10.1161/01.cir.62.3.632
Takala P, Hänninen H, Montone J, Mäkijärvi M, Nenonen J, Oikarinen L, Simeliu K, Toivonen L, Katil T (2001) Magnetocardiographic and electrocardiographic exercise mapping in healthy subjects. Ann Biomed Eng 29(6): 501–509.https://doi.org/10.1114/1.1376388
Hanninen H, Takala P, Rantonen J, Mäkijärvi M, Virtanen K, Nenonen J, Katila T, Toivonen L (2003) ST-T integral and T-wave amplitude in detection of exercise-induced myocardial ischemia evaluated with body surface potential mapping. J Electrocardiol 36(2): 89–98. https://doi.org/10.1054/jelc.2003.50013
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


