Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1264-1278
Коррекция поведенческих нарушений и состояния микроглии рекомбинантным антагонистом рецептора IL-1 при экспериментальной черепно-мозговой травме
Е. Е. Фомичева 1, С. Н. Шанин 1, Т. А. Филатенкова 1, Н. С. Новикова 1, А. С. Дятлова 1, А. М. Ищенко 2, Н. Б. Серебряная 1, *
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 НИИ эпидемиологии и микробиологии им. Пастера
Санкт-Петербург, Россия
* E-mail: serebr@gmail.com
Поступила в редакцию 25.04.2022
После доработки 01.07.2022
Принята к публикации 30.07.2022
- EDN: DVCGKV
- DOI: 10.31857/S0869813922100077
Аннотация
Черепно-мозговая травма (ЧМТ) – многофакторное заболевание, которое может приводить к развитию ряда неврологических заболеваний. Для коррекции нарушений физиологических функций используются противовоспалительные цитокины, в частности рецепторный антагонист IL-1 (IL-1RA). Цель работы – оценить эффективность препарата рекомбинантного (r)IL-1RA для коррекции посттравматического нейровоспаления. ЧМТ у крыс моделировали путем падения груза массой 115 г с высоты 120 см в центр теменной области, препарат в дозе 50 мг/кг вводили подкожно через 60 мин после травмы. Исследовали уровни кортикостерона в крови и поведенческие реакции в тесте “Открытое поле”. Для характеристики активационного паттерна микроглии оценивали морфологические изменения Iba1+-клеток в различных отделах мозга. Подсчет общего количества Iba1+ клеток микроглии на 7-е сутки после ЧМТ показал, что у животных, получавших rIL-1Ra, количество клеток микроглии было существенно большим, чем у контрольных животных, однако степень их активации была существенно меньшей. Исследования нарушений функций ЦНС после ЧМТ показали, что двигательная и ориентировочно-исследовательская активности были значительно угнетены, что, совместно с нарушением эмоционального статуса животных, свидетельствует о развитии у контрольных крыс неврологического дефицита. У животных, пролеченных rIL-1Rа, изменения поведенческих характеристик были менее выражены. Снижение неврологического дефицита у пролеченных животных было напрямую связано с нормализаций состояния микроглии. Полученные в работе данные свидетельствуют, что применение rIL-1RA через 1 ч после ЧМТ позволяет скорректировать двигательную, ориентировочно-исследовательскую активности и снизить активацию микроглии в различных отделах ЦНС.
Черепно-мозговая травма (ЧМТ) – одна из важных причин заболеваемости в России и развитых странах, которая может приводить к развитию неврологических заболеваний и инвалидности. Различные последствия ЧМТ могут проявляться как изменения личности, когнитивные проблемы, нарушения моторики и иммунной системы при снижении качества жизни [1]. Неврологические исходы ЧМТ в значительной степени зависят от вторичных последствий, которые возникают в ходе развития посттравматического процесса. Причиной развития и поддержания нейровоспаления, формирования неврологического дефицита может быть вторичное повреждение, обусловленное ишемией, эксайтотоксической гибелью нейронов и продукцией свободных радикалов.
Воспалительные цитокины, включая интерлейкин-1 (IL-1α и IL-1β), являются важными организаторами нейровоспаления. Основной функциональной мишенью этих эндогенных цитокинов является рецептор IL-1 типа 1 (IL-1R1), блокирующим лигандом которого является антагонист рецептора IL-1 (IL-1RA) [2]. В мозге функциональная экспрессия IL-1R1 была продемонстрирована в астроцитах, микроглии, нейронах и эндотелиальных клетках [3]. Регуляторная роль IL-1R1 в активации врожденной иммунной системы делает его идеальным кандидатом для блокирования последующих эффектов IL-1, в том числе при нейровоспалении [4]. Препараты рекомбинантного рецепторного антагониста IL-1 (rIL-1RA) считаются перспективными при лечении ЧМТ. Показано, что введение rIL-1RA при церебральной ишемии у экспериментальных животных обеспечивает нейропротекторный эффект: улучшается течение восстановительного периода в связи с улучшением кровоснабжения мозга и его энергетического и пластического метаболизма [5, 6]. Показано, что при введении rIL-1RA после экспериментальной ЧМТ угнетается высокая экспрессия провоспалительных цитокинов, улучшается когнитивная функция [7], уменьшаются потеря объема ткани в поврежденной коре мозга и повреждение аксонов, улучшается пространственная память [8, 9], предотвращается развитие судорожного синдрома у предрасположенных к нему животных [10]. Препарат человеческого rIL-1RA (анакинра) проходит клинические испытания у больных с ЧМТ [8]. Показано, что введение 100 мг анакинры подкожно один раз в день в течение 5 дней пациентам с тяжелой ЧМТ является безопасным, препарат проникает в плазму и цереброспинальную жидкость, значительно увеличивая уровни IL-1RA в головном мозге и в плазме крови, угнетая нейровоспалительный ответ [9]. При проведении цитируемых клинических испытаний было выявлено, что лечение способствует появлению у макрофагов склонности к провоспалительному фенотипу M1, который характеризуется повышенными уровнями экспрессии цитокинов GM-CSF и IL-1β, тогда как уровни IL-4 и IL-10, связанные с противовоспалительным фенотипом M2-типа, снижаются [2, 11]. Эти результаты противоречат исследованиям, показавшим снижение уровней IL-1β как в группах пролеченных пациентов [10], так и в экспериментальных исследованиях [5, 6]. Несоответствие результатов различных исследований, неожиданность ряда полученных данных свидетельствуют, что современных знаний о механизме действия IL-1RA и его препаратов недостаточно и требуется дальнейшее изучение.
Одной из проблем, связанных с использованием rIL-1RA, является узкое терапевтическое окно в раннем посттравматическом периоде. Так, при введении препарата через 2 ч, а не через 5 или 15 мин после травмы, было отмечено уменьшение нейропротекторного действия препарата [12].
Настоящее исследование предпринято с целью оценить эффективность введения препарата rIL-1RA в посттравматическом периоде для коррекции развивающегося нейровоспаления, вызванного экспериментальной ЧМТ.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 60 крысах-самцах породы Вистар массой 280–330 г. Животных содержали в условиях вивария при комнатной температуре с 12-часовым циклом свет/темнота, свободным доступом к воде и пище, на стандартной диете в соответствии с нормами содержания лабораторных животных. Все процедуры с животными проводились в одно и то же время. В качестве модели механической травмы головного мозга использовали модель “падающего груза”, также известную как “модель ударного ускорения” в собственной модификации, вызывающей в основном диффузное повреждение мозга [13]. Груз массой 115 г падал с высоты 120 см для нанесения травмы средней тяжести в центр теменной части головы животного. Падение груза направлялось при помощи цилиндрической трубки с внутренним диаметром 20 мм, которая была жестко закреплена на штативе двумя держателями и центрирована над головой крысы. Расстояние между концом трубки и головой животного составляло 7 см. Перед нанесением травмы животные получали наркоз из расчета 3–5 мл медицинского эфира на 1 кг массы тела в смеси с атмосферным воздухом. По завершении опыта животных выводили из эксперимента путем декапитации с соблюдением правил эвтаназии согласно требованиям п. 12 Хельсинкской декларации Всемирной медицинской ассоциации о гуманном отношении к животным. Эксперименты проводили в соответствии с Национальным стандартом РФ ГОСТ Р-53434-2009 “Принципы надлежащей лабораторной практики” и Приказом Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики”. Все манипуляции, проводимые на животных, были рассмотрены и одобрены на заседании биоэтической комиссии Института экспериментальной медицины.
Препарат rIL-1RA (ГосНИИОЧБ, Санкт-Петербург, РФ зарегистрирован в Госреестре лекарственных средств как ЛСР-007452/10 от 30.07.2010) вводили подкожно в дозе 50 мг/кг массы тела животного в 0.5 мл изотонического раствора NaCl через 1 ч после ЧМТ и еще дважды в течение последующих двух суток (всего три инъекции). Отбор материала для исследования осуществлялся на 3-и, 7-е и 14-е сутки после ЧМТ. Контрольные животные получали изотонический раствор NaCl.
Для исследования эффектов действия препарата rIL-1RA были сформированы следующие экспериментальные группы:
1 – контрольные животные (контроль, n = 20);
2 – животные, перенесшие ЧМТ (ЧМТ, n = 20);
3 – опытные животные, перенесшие ЧМТ и получавшие rIL-1Ra (ЧМТ + rIL-1Ra, n = 20).
В каждой опытной группе животных (группы 2 и 3) выделяли 3 подгруппы по 5 крыс для исследования поведения и уровня кортикостерона на 3-и, 7-е и 14-е сутки после ЧМТ. В группе контрольных животных 5 крыс были интактными, а 3 подгруппы по 5 особей использовали как контроль для каждого этапа эксперимента. Две дополнительные подгруппы выделяли в группах опытных животных для проведения морфологических исследований мозга на 7-е сутки после ЧМТ, используя соответствующий контроль (все подгруппы также по 5 крыс).
Изучение поведенческих реакций животных. Изучение нарушений поведенческих реакций и изменений функций ЦНС необходимо для понимания процессов, происходящих в мозге после ЧМТ и выявления неврологического дефицита [14]. Регистрация поведенческих реакций животных проводилась в тесте “Открытое поле”. Установка “Открытое поле” представляла собой открытую ярко-освещенную круглую арену диаметром 1 м с высотой стенок 40 см, расчерченную на центральные и периферические сектора, с отверстиями в дне. Животное помещали в центр арены и регистрировали поведение в течение 5 мин. Каждое животное помещалось в арену однократно с целью избежать эффекта привыкания к условиям теста. Поведенческие реакции, такие как нахождение в тех или иных секторах открытого поля, средняя скорость передвижения, общая длина пройденного пути (пробег, дистанция), а также показатели вертикальной двигательной активности и груминга регистрировали и анализировали с использованием программного обеспечения VideoMot 2 (TSESystems, Германия).
Определение концентрации кортикостерона в крови животных проводилось с помощью наборов для иммуноферментного анализа фирмы DRG Diagnostic (Германия) согласно протоколу, предложенному фирмой-производителем. Кровь собирали после декапитации и выделяли сыворотку путем центрифугирования при температуре 4–6°С.
Морфологические исследования. Работа выполнена на 15 животных через 7 суток после ЧМТ. Крыс подвергали эвтаназии при последовательном внутрибрюшинном введении золетил–ксилазин (40 мг/кг + 10 мг/кг), транскардиальной перфузией физиологическим раствором с гепарином (20 ед/мл), затем фиксирующим раствором, содержащим 4%-ный параформальдегид на 0.1 М PBS (рН 7.4) и 0.2%-ную пикриновую кислоту. Через 2 ч мозг извлекали из черепа животного с последующей дофиксацией в 4%-ном параформальдегиде в течение 12 ч при комнатной температуре и уравновешивали в криозащитном растворе 20%-ной сахарозы при комнатной температуре в течение 2–4 ч. Мозг замораживали при температуре –26°C и с помощью замораживающего столика (Миконта-2), установленного на санном микротоме, были созданы корональные срезы толщиной 30 мкм. Срезы помещали в криопротектор до иммуногистохимического окрашивания. Для выявления клеток микроглии использовали первичные антитела: Rabbit anti-Iba1 (Abcam) в разведении 1 : 2000, инкубация длилась 2 суток при 4°С, затем проводили последовательные этапы инкубации со вторичными биотинилизированными антителами (goat anti-rabbit antibodies, Abcam) 1 : 1000 и авидин-пероксидазой (Sigma) 1 : 300. После каждой инкубации срезы промывали PBS 3 раза по 5 мин. Визуализацию иммуногистохимического окрашивания проводили раствором DAB (Abcam), Срезы мозга от –2.85 до –4.20 мм от брегмы (bregma), что соответствует с 29-го по 32-й уровни согласно атласу мозга крыс Swanson [15], анализировали на микроскопе Leica 2500 при увеличении ×10 и ×40. Полученные изображения анализировали при помощи программного обеспечения ВидеоТест Морфология 5.2.
Подсчет клеток микроглии. Количество Iba1-позитивных клеток микроглии подсчитывали на 5 срезах от каждого животного в нескольких полях зрения (2–4) для каждой исследованной зоны мозга с пересчетом на одно поле зрения площадью 0.62 мм2. Степень активации микроглии оценивали как процентное отношение количества активированных клеток микроглии к общему количеству Iba1-позитивных клеток микроглии. Критерием активации клеток микроглии являлось изменение их морфологических характеристик: трансформация отростчатой микроглии в амебоидную с увеличением размеров тела клетки с укорочением и утолщением первичных отростков [16]. Активированными клетками микроглии считали Iba1-позитивные клетки, площадь перинуклеарного пространства которых превышала 30 мкм2, так как размер неактивированных клеток микроглии не превышает 6 мкм в длину и 3 мкм в ширину [17]. Для характеристики распределения активированной микроглии в исследуемых областях головного мозга были сформированы классы, учитывающие процент активированной микроглии относительно общего количества микроглиальных клеток: “±” – единичные активированные клетки микроглии – менее 5%; “+” – от 5 до 10%; “++” – от 11 до 30%; “+++” – более 30%.
Статистическую обработку результатов проводили с использованием программ STATISTICA for Windows (версия 7). Количественные показатели оценивались на соответствие нормальному распределению с помощью критериев Шапиро–Уилка. Результаты представлены в виде М ± SD, где М – среднее арифметическое значение, SD – стандартное отклонение. При сравнении показателей трех групп использовали поправку Бонферрони. В случае несоответствия нормальному распределению использовали U-критерий Манна–Уитни (результаты представлены графически как медианы, верхний и нижний квартили (Q1, Q3) и минимальное и максимальное значение выборок). Различия сравниваемых параметров считали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
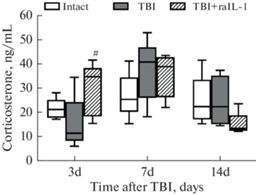
ЧМТ явилась существенным стрессогенным событием, о чем свидетельствуют колебания уровня кортикостерона в крови травмированных животных (рис. 1). На 3-й день после ЧМТ у животных, не получавших лечения, уровень кортикостерона был существенно ниже, чем у контрольных животных, но резко повышался к 7-му дню после травмы и возвращался к уровню контрольных животных. Однако у животных, получавших rIL-1RA, наблюдался другой паттерн изменения уровня кортикостерона: на 3-й день после травмы уровень этого гормона был существенно выше, чем у травмированных нелеченых крыс, но не отличался от показателей контрольных животных на всех сроках наблюдения (рис. 1). Представленные на рис. 1 данные свидетельствуют, что динамика уровня кортикостерона в обеих группах отличается от типичной стресс-реакции (гормональный пик с 4-кратным подъемом уровня гормона через 2 ч после травмы с последующим падением и нормализацией к 14-му дню после травмы) [18].
Рис. 1.
Изменения уровня кортикостерона у животных на 3-и, 7-е и 14-е сутки после ЧМТ и введения препарата rIL-1Rа. # – p < 0.05 по сравнению с показателем у травмированных нелеченых животных.
Учитывая, что перенесенный стресс связан с потерей массы тела [19], был прослежен характер изменения массы тела в исследуемых группах животных (рис. 2). Показано, что на 3-и сутки после ЧМТ наблюдалось значимое снижение массы тела у травмированных животных и у крыс, получавших rIL-1RA, однако падение массы тела на 7-е и 14-е дни после ЧМТ в группе нелеченых крыс было несколько большим.
Рис. 2.
Изменения массы тела у животных на 3-и, 7-е и 14-е сутки после ЧМТ и введения rIL-1Rа. * – p < 0.05 по сравнению с показателем у контрольных животных, # – p < 0.05 по сравнению с показателем у травмированных животных.
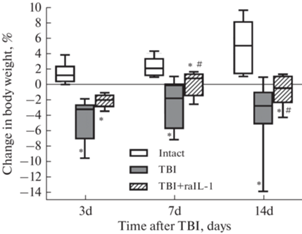
Сопоставление уровней кортикостерона и показателей массы тела свидетельствует, что более высокие концентрации кортикостерона на 3-и сутки после ЧМТ у пролеченных животных были ассоциированы с меньшем падении массы тела на 3-и, 7-е и 14-е сутки, чем в группе нелеченых животных после ЧМТ, это, по нашему мнению, свидетельствует о менее выраженной стресс-реакции при проведении 3-дневного курса rIL-1RA.
Изучение поведения животных в тесте “Открытое поле” показало, что у крыс после ЧМТ горизонтальная двигательная активность по показателям пробега (дистанции) и скорости пробега была достоверно снижена на 7-е и 14-е дни после травмы по сравнению с показателями двигательной активности контрольных животных (табл. 1). У животных, пролеченных препаратом rIL-1RA, показатели двигательной активности не отличалась от таковых у контрольных животных и были достоверно выше, чем у нелеченых крыс на 7-и и 14-е сутки после ЧМТ.
Таблица 1.
Горизонтальная двигательная активность животных на 3-и, 7-е и 14-е сутки после нанесения ЧМТ и введения препарата IL-1RА
| Группы животных | Длина пробега (дистанция), м | Скорость пробега, см/с |
|---|---|---|
| Контроль | 15.5 ± 2.5 | 5.2 ±0.9 |
| ЧМТ | ||
| 3-и сутки | 17.1 ± 6.9 8.0 ± 2.9* (р < 0.01) 12.2 ± 4.1* (р < 0.05) |
5.7 ± 2.3 2.7 ± 0.9* (р < 0.01) 4.1 ± 0.7* (р < 0.05) |
| 7-е сутки | ||
| 14-е сутки | ||
| ЧМТ + rIL-1RA | ||
| 3-и сутки | 17.3 ± 3.7 13.2 ± 3.5# (р < 0.05) 15.4 ± 2.6# (р < 0.05) |
5.8 ± 1.2 4.4 ± 1.2# (р < 0.05) 5.1 ± 0.9# (р < 0.05) |
| 7-е сутки | ||
| 14-е сутки | ||
В табл. 1–4 обозначение * – статистические данные сравнения с показателями контрольных животных; # – статистические данные сравнения с травмированными животными в те же сроки после ЧМТ.
Ориентировочно-исследовательскую реакцию (ОИР) у травмированных крыс оценивали по числу заглядываний в “норки”, вертикальных стоек (вертикальная двигательная активность) и количеству выходов в центр поля (табл. 2). Показано, что у крыс после ЧМТ ориентировочно-исследовательская реакция по всем 3 показателям была существенно угнетена на 7-й день после травмы по сравнению с этими показателями у контрольных животных, а по одному из показателей (посещение центра поля) оставалась сниженной и на 14-й день после травмы. Но у животных, пролеченных rIL-1RA, показатели ОИР не угнетались и соответствовали параметрам контрольных животных, причем на 7-й день после ЧМТ все показатели были достоверно выше, чем у нелеченых травмированных крыс.
Таблица 2.
Ориентировочно-исследовательская активность животных на 3-и, 7-е и 14-е сутки после ЧМТ и введения препарата IL-1RA
| Группы животных | Вертикальные стойки | Заглядывания в норки | Посещения центра поля |
|---|---|---|---|
| Контроль | 19.3 ± 7.0 | 9.0 ± 2.4 | 7.0 ± 2.8 |
| ЧМТ | |||
| 3-и сутки | 20.9 ± 8.8 10.8 ± 6.8* (р < 0.05) 16.5 ± 3.5 |
14.0 ± 9.4 1.8 ± 1.4* (p < 0.05) 6.8 ± 3.1 |
5.5 ± 1.3 2.8 ± 0.5* (р < 0.05) 4.3 ± 2.3* (р < 0.05) |
| 7-е сутки | |||
| 14-е сутки | |||
| ЧМТ+ IL-1RA | |||
| 3-и сутки | 18.0 ± 6.7 19.4 ± 7.5# (р < 0.05) 18.7 ± 3.9 |
11.5 ± 5.3 7.4 ± 4.1# (р < 0.05) 8.0 ± 2.7 |
7.8 ± 2.2 5.0 ± 1.3# (р < 0.05) 9.0 ± 2.4# ( р = < 0.01) |
| 7-е сутки | |||
| 14-е сутки | |||
Обозначения те же, что в табл. 1.
Об эмоциональной реакции и состоянии скрытой тревожности у крыс судили по времени пребывания в центре поля и по количеству и длительности актов груминга (табл. 3). Показано, что время пребывания в центре поля было значительно снижено у травмированных нелеченых животных на 7-е и 14-е дни после травмы, а в группе пролеченных крыс в течение всего периода наблюдения этот показатель был существенно выше и не отличался от показателя контрольных животных.
Таблица 3.
Время нахождения в центре открытого поля, количество актов и продолжительность груминга на 3-и, 7-е и 14-е сутки после нанесения ЧМТ и введения препарата rIL-1RА
| Группы животных | Время в центре, с | Груминг | Время груминга, с |
|---|---|---|---|
| Контроль | 21.7 ± 13.1 | 5.0 ± 2.6 | 27.5 ± 13.7 |
| ЧМТ | |||
| 3-и сутки | 18.6 ± 9.6 5.0 ± 2.5* (р < 0.05) 9.3 ± 5.1* (р < 0.05) |
4.8 ± 3.2 6.0 ± 0.8 5.8 ± 3.1 |
15.80 ± 14.3 77.3 ± 18.0* (р < 0.01) 59.3 ± 25.4* (р < 0.05) |
| 7-е сутки | |||
| 14-е сутки | |||
| ЧМТ+ IL-1RA | |||
| 3-и сутки | 26.5 ± 5.5 15.0 ± 7.9# (р < 0.05) 24.0 ± 5.6# (р < 0.05) |
3.9 ± 4.5 6.0 ± 1.3 2.0 ± 1.6# (р < 0.05) |
22.9 ± 24.2 31.6 ± 16.0# (р < 0.01) 16.3 ± 13.5# (р < 0.05) |
| 7-е сутки | |||
| 14-е сутки | |||
Обозначения те же, что в табл. 1.
У травмированных крыс количество актов груминга практически не отличалось от таковых у контрольных животных на 3-и, 7-е и 14-е дни после ЧМТ, однако длительность груминга значительно возрастала на 7-е и 14-е дни после травмы. При этом у пролеченных животных количество актов груминга на 14-е сутки после ЧМТ было меньше, чем у нелеченых крыс, а их продолжительность на 7–14-е дни была существенно более короткой.
Таким образом, представленные данные о характере изменения двигательной, ориентировочно-исследовательской активности, а также об эмоциональном статусе животных свидетельствуют, что после ЧМТ у крыс развивались выраженные поведенческие нарушения, что особенно ярко проявилось на 7-й день после травмы (когда были изменены 7 из 8 показателей), причем по 4 из 8 показателей нарушения сохранялись на 14-й день после ЧМТ. У животных, пролеченных rIL-1RA, поведенческие нарушения не были значимыми в течении всего периода наблюдения.
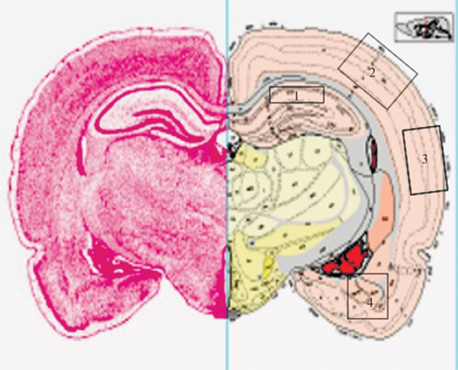
Для получения данных, характеризующих нейровоспаление, анализировали количество и степень активации Iba1-позитивных клеток микроглии в препаратах срезов мозга в зонах, отмеченных на рис. 3.
Рис. 3.
Схема среза мозга 31-го уровня: 1 – гиппокамп зона СА1, 2 – первичная соматосенсорная зона коры (SSp), 3 – височная ассоциативная зона коры (AUD), 4 – амигдала, область базолатерального и базомедиального ядер (BLAp и BMAp) [15].
На 7-е сутки после ЧМТ у животных, получавших rIL-1RА, количество Iba1-позитивных клеток микроглии во всех исследованных областях мозга было существенно большим, чем у контрольных и травмированных нелеченых животных (табл. 4). При этом у пролеченных животных на 7-й день после травмы микроглия во всех исследованных областях мозга имела морфологические черты, свойственные нормальной неактивированной микроглии, а активированная микроглии присутствовала только в незначительном количестве.
Таблица 4.
Количество Iba1-позитивных клеток микроглии на площади 0.62 мм2 и степень их активации в различных отделах мозга на 7-е сутки после ЧМТ
| Группы животных | Отделы мозга | |||
|---|---|---|---|---|
| Гиппокамп СА1 | Соматосенсорная кора | Височная ассоциативная кора | Амигдала | |
| Контроль | ||||
| Количество клеток | 9.4 ± 0.9 | 5.7 ± 1.1 | 6.9 ± 0.75 | 12.2 ± 1.3 |
| Степень активации | ± | – | ± | ± |
| ЧМТ | ||||
| Количество клеток | 11.1 ± 1.2 | 8.7 ± 2.9 | 13.6 ± 4.6* (p = < 0.001) |
14.0 ± 2.6 |
| Степень активации | ++ | ++ | +++ | +++ |
| ЧМТ + rIL-1RA | ||||
| Количество клеток | 26.0 ± 6.2 *(p < 0.001) #(p < 0.001) |
23.3 ± 7.1 *(p < 0.001) #(p < 0.005) |
28.9 ± 4.4 *(p < 0.001) #(p < 0.001) |
30.4 ± 5.8 *(p < 0.001) #(p < 0.001) |
| Степень активации | + | ± | + | + |
Выявленные изменения иллюстрируют микрофотографии участков височной ассоциативной коры головного мозга у животных изученных групп с указанием на активированные и неактивированные клетки микроглии (рис. 4).
Рис. 4.
Клетки микроглии височной ассоциативной коры головного мозга крыс на 7-е сутки после ЧМТ:1 – контроль, 2 – ЧМТ, 3 – ЧМТ + IL-1RА. Калибровочный маркер соответствует 50 мкм. Неактивированные клетки микроглии отмечены черными стрелками, активированные клетки микроглии – красными стрелками. Иммуногистохимическое окрашивание, маркер Iba1; ×40.

Суммарно, выявленные изменения указывают, что протективные и репаративные процессы в мозге крыс после ЧМТ, пролеченных препаратом rIL-1RА, протекают эффективнее и быстрее, по сравнению с таковыми у контрольных животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что ЧМТ индуцирует продукцию провоспалительных цитокинов, которые влияют на нейрональные, гормональные и поведенческие реакции. В частности, IL-1β активирует гипоталамо-гипофизарно-надпочечниковую ось, а также метаболизм норадреналина и индоламина в головном мозге [20]. Показано, что IL‑1RA индуцируется теми же сигналами, которые характерны для синтеза и высвобождения IL-1, а также самим IL-1, однако экспрессия IL-1RA существенно отстает от экспрессии IL-1α и IL-1β по времени [21], вследствие чего IL-1RA не отменяет развившуюся воспалительную реакцию, а только модулирует/смягчает ее течение. Полученные данные показали, что при использовании препарата rIL-1RА через 60 мин и в течение 2 последующих дней после ЧМТ, направленность изменения концентрации кортикостерона на 3-и сутки существенно отличалась от показателей травмированных нелеченых животных. Изучение влияние препаратов IL-1RА на уровни АКТГ и кортикостерона в плазме крови крыс показало, что внутрибрюшинное введение даже больших доз препарата не снижает повышенные уровни перечисленных стресс-гормонов [22], что совпадает с полученными нами результатами. Однако, учитывая цикличность посттравматического процесса и развитие “вторичного воспаления”, важно отметить, что IL-1RA может блокировать повторные/дополнительные высвобождения IL-1β в ЦНС и плазме крови [20, 23], влияя на более поздние этапы посттравматической болезни. Снижение массы тела у травмированных животных обусловлено системной катаболической реакцией, которая истощает как жировую, так и мышечную массу и обусловлена существенным повышением уровня провоспалительных цитокинов, таких как TNF, IL-1α, IL-6 [23]. Учитывая эту закономерность, можно утверждать, что существенно менее выраженное снижение массы тела у крыс, получавших rIL-1RA, по сравнению с нелечеными травмированными животными, свидетельствует о подавлении у них активности воспалительного процесса после ЧМТ.
Исследования нарушений функций ЦНС после ЧМТ на основе поведенческих тестов показало, что двигательная и ориентировочно-исследовательская активность были значительно угнетены, также нарушался эмоциональный статус животных. Полученные данные свидетельствуют, что у травмированных крыс развивался неврологический дефицит, проявляющийся на протяжении всего периода наблюдения, что это согласуется с литературными данными [24]. Некоторые авторы отмечают, что характер двигательной активности животных в постстрессорный период (в том числе после ЧМТ) в тесте “Открытое поле” определялся изменениями концентрации кортикостерона в крови [25]. Так, количество пересечений центра открытого поля и количество обследованных предметов были выше у крыс со сниженным постстрессовым уровнем гормона. В то же время длительность груминга была выше у крыс с высоким содержанием кортикостерона в крови, чем у крыс с низким уровнем гормона в постстрессовый период. Ранее были опубликованы результаты исследования в тестах “Открытого поля” поведенческих особенностей травмированных животных и животных, получивших rIL-1RA профилактически перед нанесением ЧМТ (в обоих экспериментах использовалась доза препарата 15 мг/кг) [5, 6]. На модели ЧМТ средней тяжести у крыс было показано, что профилактическое применение rIL-1RA улучшало течение восстановительного периода, нормализуя показатели функционального состояния ЦНС (мышечный тонус и координация движений, двигательную и исследовательскую активности, эмоциональные реакции) в реабилитационном периоде ЧМТ. Такое активирующее действие rIL-1RA на ЦНС авторы связывают со способностью данного цитокина повышать церебральное содержание катехоламинов (норадреналина и адреналина), стимулируя адренергическую нейротрансмиссию [6]. В экспериментах с окклюзией обеих сонных артерий с последующей их реперфузией rIL-1RA примерно в 3 раза уменьшал снижение кровотока. При этом rIL-1RA также способствовал уменьшению ацидоза в крови, оттекающей от головного мозга, снижая деструкцию нейронов и содержание IL-1β [5]. При сопоставлении полученных нами данных с вышеприведенными результатами других исследований можно отметить, что использование трехкратного введения препарата rIL-1RA в дозе 50 мг/кг, начатое через 1 ч после ЧМТ, приводит к эффектам, сходным с теми, что были выявлены при профилактическом введении препарата (в дозе 15 мг/кг), что, безусловно, важно для его дальнейшего клинического использования.
В исследовании Greenhalgh и соавт. [26] было показано, что при хроническом посттравматическом нейровоспалении, осложненном эпилепсией, достичь позитивного эффекта у грызунов позволяет доза 100 мг/кг rIL-1RA. Показано, что эта доза обеспечивает проникновение через гематоэнцефалический барьер и приводит к устойчивым высоким концентрациям IL-1RA в плазме и спинномозговой жидкости, обеспечивает проникновение в ткань головного мозга в области нарушения гематоэнцефалического барьера, способствуя нейропротекции на моделях повреждения ЦНС [27]. Важно отметить, что в клинических исследованиях препаратов rIL-1RA пациентам вводится доза 100 мг на одно введение в сутки, что значительно меньше дозы, используемой для животных [10, 28], поэтому выбор нами относительно небольшой дозы препарата представляется вполне оправданным.
Исследования способности препаратов rIL-1RA проникать через гематоэнцефалический барьер активно продолжаются. В модельных экспериментах выявлена способность препарата проходить через эндотелиальный монослой в клинически значимых концентрациях [29]. Кроме того, показано, что даже если rIL-1RA не проникает через гематоэнцефалический барьер, он может модулировать состояние микроглии опосредованно сигналами от клеток эндотелия [30] или стромы и эпителия сосудистого сплетения [31]. Такая опосредованная передача цитокиновых сигналов также обеспечивает изменения баланса IL-1/IL-1RA в ткани мозга и способствует снижению активности воспаления.
Кроме вводимой дозы препарата, существенное влияние на эффективность терапии оказывает время его введения по отношению к моменту травмы. Предполагают, что между началом каскада вторичных повреждений и моментом, когда эти изменения становятся необратимыми, может существовать окно возможностей для фармакологических воздействий, которые могут улучшить исходы заболевания [32], и крайне важно определить длительность такого окна для использованного цитокинового препарата. Полученные нами данные подтверждают, что выбранный нами режим терапии способен существенно улучшать течение раннего посттравматического периода при ЧМТ у крыс.
Важно отметить, что снижение неврологического дефицита у пролеченных животных, выявленное в поведенческих тестах, напрямую связано с существенно лучшим состоянием клеток ЦНС, а именно микроглии. Активированные клетки микроглии в различных отделах мозга синтезируют различные цитокины и экспрессируют определенные маркеры, которые позволяют выделять условные активационные фенотипы: М0, М1 и М2a, b, c, d [33]. Показано, что для микроглии в состоянии М0 и М1 (связанном с продукцией провоспалительных цитокинов) характерным маркером является адаптерная молекула связывания ионизированного кальция 1 (Iba1) [34]. Подсчет количество Iba1-положительных клеток микроглии в нескольких областях мозга крыс на 7-е сутки после ЧМТ показал, что у животных, получавших rIL-1RA, количество Iba1-позитивных клеток микроглии было существенно большим, чем у контрольных и травмированных нелеченых животных, однако степень их активации была более низкой (табл. 4, рис. 4). Такое состояние микроглии, важнейшего источника цитокинов в ЦНС, свидетельствует, по нашему мнению, о меньшой выраженности нейровоспаления, поскольку увеличение плотности клеток может быть связано с транзиторным повышением миграционной активности микроглии в направлении очагов повреждения [35 ] .
Таким образом, полученные в работе данные свидетельствуют, что применение rIL-1RA (курс из 3 ежедневных инъекций в дозе 50 мг/кг массы, начатый через 60 мин после ЧМТ) позволило животным: лучше перенести последствия травматического стресса; скорректировать двигательную, ориентировочно-исследовательскую активности и улучшить эмоциональный статус животных; снизить активацию микроглии в различных отделах ЦНС, что свидетельствует о проявлении нейропротективных свойств данного цитокинового препарата.
Список литературы
McAllister TW (2011) Neurobiological consequences of traumatic brain injury. Dialog Clin Neurosci 13(3): 287–300. https://doi.org/10.31887/DCNS.2011.13.2/tmcallister
Helmy EA, Todd BP, Mahoney J, Pieper AA, Ferguson PJ, Bassuk AG (2018) Combined Blockade of Interleukin-1α and -1β Signaling Protects Mice from Cognitive Dysfunction after Traumatic Brain Injury. eNeuro 5(2): ENEURO.0385-17.2018. https://doi.org/10.1523/ENEURO.0385-17.2018
Liu X, Yamashita T, Chen Q, Belevych N, Mckim DB, Tarr AJ, Coppola V, Nath N, Nemeth DP, Syed ZW, Sheridan JF, Godbout JP, Zuo J, Quan N (2015) Interleukin 1 type 1 receptor restore: a genetic mouse model for studying interleukin 1 receptor-mediated effects in specific cell types. Interleukin 1 type 1 receptor restore: a genetic mouse model for studying interleukin 1 receptor-mediated effects in specific cell types. J Neurosci 35: 2860–2870. https://doi.org/0.1523/JNEUROSCI.3199-14.2015
Thome JG, Reeder EL, Collins SM, Gopalan P, Robson MJ (2020) Contributions of Interleukin-1 Receptor Signaling in Traumatic Brain Injury. Front Behav Neurosci 13: 287. https://doi.org/10.3389/fnbeh.2019.00287
Щекина ЕГ, Ищенко АМ, Штрыголь СЮ, Дроговоз СМ, Симбирцев АС (2013) Изучение церебропротекторных свойств рекомбинантного рецепторного антагониста интерлейкина 1 человека (IL-1Ra) в эксперименте I. Влияние IL-1Ra на кровоснабжение головного мозга, нарушения кислотно-щелочного баланса, деструкцию нейронов и содержание интерлейкина 1 при экспериментальной церебральной ишемии у крыс. Цитокины и воспаление 12(1–2): 45–51. [Shchekina EG, Ishchenko AM, Shtrygol SY, Drogovoz SM, Simbirtsev AS (2013) Study of the cerebroprotective properties of a recombinant human interleukin 1 receptor antagonist (IL-1Ra) in experiment I. Effect of IL-1Ra on cerebral blood supply, acid-base balance disorders, neuronal destruction and interleukin 1 content in experimental cerebral ischemia in rats. Cytokines and Inflammat 12(1–2): 45–51. (In Russ)].
Щекина ЕГ, Ищенко АМ, Штрыголь СЮ, Дроговоз СМ, Симбирцев АС (2013) Изучение церебропротекторных свойств рекомбинантного рецепторного антагониста интерлейкина 1 человека (IL-1Ra) в эксперименте II. Церебропротекторные свойства IL-1Ra при ишемическом и травматическом поражении головного мозга у мышей Цитокины и воспаление. 12(3): 29–34. [Shchekina EG, Ishchenko AM, Shtrygol SY., Drogovoz SM, Simbirtsev AS (2013) Study of the cerebroprotective properties of the recombinant human interleukin 1 receptor antagonist (IL-1Ra) in experiment II. Cerebroprotective properties of IL-1Ra in ischemic and traumatic brain injury in mice. Cytokines and Inflammation 12(3): 29–34. (In Russ)].
Pradillo JM, Murray KN, Coutts GA, Moraga A, Oroz-Gonjar F, Boutin H, Moro MA, Lizasoain I, Rothwell NJ, Allan SM (2017) Reparative effects of interleukin-1 receptor antagonist in young and aged/co-morbid rodents after cerebral ischemia. Brain Behav Immun 61: 117–126. https://doi.org/10.1016/j.bbi.2016.11.013
Smith CJ, Hulme S, Vail A, Heal C, Parry-Jones AR, Scarth S, Hopkins K, Hoadley M, Allan SM, Rothwell NJ, Hopkins SJ, Tyrrell PJ (2018) SCIL-STROKE (Subcutaneous interleukin-1 receptor antagonist in ischemic stroke) A randomized controlled phase 2 trial. Stroke 49: 1210–1216. https://doi.org/0.1161/STROKEAHA.118.020750
Sun M, Brady RD, Wright DK, Kim HA, Zhang SR, Sobey CG, Johnstone MR, O’Brien TJ, Semple BD, McDonald SJ, Shultz SR (2017) Treatment with an interleukin-1 receptor antagonist mitigates neuroinflammation and brain damage after polytrauma. Brain Behav Immun 66: 359–371. https://doi.org/10.1016/j.bbi.2017.08.005
Helmy A, Guilfoyle MR, Carpenter KL, Pickard JD, Menon DK, Hutchinson PJ (2014) Recombinant human interleukin-1 receptor antagonist in severe traumatic brain injury: a phase II randomized control trial. J Cereb Blood Flow Metab 34: 845–851. https://doi.org/10.1038/jcbfm.2014.23
Helmy A, Guilfoyle MR, Carpenter KLH, Pickard JD, Menon DK, Hutchinson PJ (2016) Recombinant human interleukin-1 receptor antagonist promotes M1 microglia biased cytokines and chemokines following human traumatic brain injury. J Cereb Blood Flow Metab 36: 1434–1448. https://doi.org/10.1177/0271678X15620204
Bergold PJ (2016) Treatment of traumatic brain injury with anti-inflammatory drugs. Exp Neurol 275(3): 367–380. https://doi.org/10.1016/j.expneurol.2015.05.024
Шанин СН, Фомичева ЕЕ, Филатенкова ТА, Серебряная НБ (2018) Коррекция нарушений нейроиммунных взаимодействий при экспериментальной черепно-мозговой травме препаратом рекомбинантного интерлейкина-2. Мед иммунол 20 (2): 171–178. [Shanin SN, Fomicheva EE, Filatenkova TA, Serebryanaya NB (2018) Correction of disorders of neuroimmune interactions in experimental traumatic brain injury with recombinant interleukin-2. Med Immunol 20(2): 171–178. (In Russ)]. https://doi.org/10.15789/1563-0625-2018-2-171-178
Буреш Я, Бурешова О, Хьюстон ДП (1991) Методики и основные эксперименты по изучению мозга и поведения. Перевод с англ Ред АС Батуев. [Buresh Ya, Bureshova O, Houston DP (1991) Methods and basic experiments to study the brain and behavior. Transl from English Ed AS Batuev. (In Russ)].
Swanson LW (2004) Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models and schematics (3rd ed). Amsterdam. Elsevier.
Graeber MB (2010) Changing face of microglia. Science 330(6005): 783–788. https://doi.org/10.1126/science.119092921051630
Alekseeva OS, Kirik OV, Gilerovich EG, Korzhevsky DE (2019) Brain microglia: origin, structure and functions. J Evol Biochem Physiol 559(4): 231–241. https://doi.org/10.1134/S0044452919040028
Фомичева ЕЕ, Шанин СН, Филатенкова ТА, Серебряная НБ (2020) IL-2 как регулятор уровней стресс-гормонов и нейротропного фактора BDNF при экспериментальной черепно-мозговой травме. Мед иммунол 22 (4): 647–656. [Fomicheva EE, Shanin SN, Filatenkova TA, Serebryanaya NB (2020) IL-2 as a regulator of stress hormones and BDNF in experimental traumatic brain injury Med Immunol 22 (4): 647–656. (In Russ)]. https://doi.org/10.15789/1563-0625-IAR-1973
Мураева НА (2019) Влияние хронического стресса на массу тела и иммунных органов экспериментальных животных раннего возраста. Волгоградск научно-мед журн 64 (4):3. [Muraeva NA (2019) Effect of chronic stress on body weight and immune organs of experimental animals of early age. Volgograd Scient Med J 64(4): 3. (In Russ)].
Dunn AJ (2000) Effects of the IL-1 receptor antagonist on the IL-1- and endotoxin-induced activation of the HPA axis and cerebral biogenic amines in mice. Neuroimmunomodulation 7(1): 36–45. https://doi.org/10.1159/000026418
Bartfai T, Sanchez-Alavez M, Andell-Jonsson S, Schultzberg M, Vezzani A, Danielsson E, Conti B (2007) Interleukin-1 system in CNS stress: seizures, fever, and neurotrauma. Ann N Y Acad Sci 1113: 173–177. https://doi.org/10.1196/annals.1391.022
Gądek-Michalska A, Tadeusz J, Rachwalska P, Spyrka J, Bugajski J (2011) Effect of prior stress on interleukin-1β and HPA axis responses to acute stress. Pharmacol Rep 63(6): 1393–1403. https://doi.org/10.1016/s1734-1140(11)70703-4
Johnson JD, O’Connor KA, Watkins LR, Maier SF (2004) The role of IL-1beta in stress-induced sensitization of proinflammatory cytokine and corticosterone responses. Neuroscience 127(3): 569–577. https://doi.org/10.1016/j.neuroscience.2004.05.04625
Дмитриенко ЕВ, Филатенкова ТА, Рыбакина ЕГ, Корнева ЕА (2014) Поведенческие реакции животных после экспериментальной черепно-мозговой травмы: влияние препарата нуклеотидной природы. Вестн Санкт-Петербургск Универ 11(3): 180–191. [Dmitrienko EV, Filatenkova TA, Filatenkova TA, Rybakina EG, Korneva EA (2014) Behavioral reactions of animals after experimental traumatic brain injury: the effect of a drug of nucleotide nature. Bull St-Petersburg Univer 11(3): 180–191. (In Russ)]. https://cyberleninka.ru/article/n/povedencheskie-reaktsii-zhivotnyh-posle-eksperimentalnoy-cherepno-mozgovoy-travmy-vliyanie-preparata-nukleotidnoy-prirody https://doi.org/10.1007/s11055-017-0421-3
Umryukhin PE, Grigorchuk OS (2017) Behavior of Rats in an Open Field Test as a Prognostic Indicator of Corticosterobe Levels Before and After Stress. Neurosci Behav Physiol 47(4): 456–458. https://doi.org/10.1007/s11055-017-0421-3
Greenhalgh AD, Galea J, Dénes A, Tyrrell PJ, Rothwell NJ (2010) Rapid brain penetration of interleukin-1 receptor antagonist in rat cerebral ischaemia: pharmacokinetics, distribution, protection. Br J Pharmacol 160(1): 153–159. https://doi.org/10.1111/j.1476-5381.2010.00684.x
McCann SK, Cramond F, Macleod MR, Sena ES (2016) Systematic Review and Meta-Analysis of the Efficacy of Interleukin-1 Receptor Antagonist in Animal Models of Stroke: An Update. Transl Stroke Res 7(5): 395–406. https://doi.org/10.1007/s12975-016-0489-z
Lassarén P, Lindblad C, Frostell A, Carpenter KLH, Guilfoyle MR, Hutchinson PJA, Helmy A, Thelin EP (2021) Systemic inflammation alters the neuroinflammatory response: a prospective clinical trial in traumatic brain injury. J Neuroinflam 18(1): 221. https://doi.org/10.1186/s12974-021-02264-2
Sjöström EO, Culot M, Leickt L, Åstrand M, Nordling E, Gosselet F, Kaiser C (2021) Transport study of interleukin-1 inhibitors using a human in vitro model of the blood-brain barrier. Brain Behav Immun Health 16: 100307. https://doi.org/10.1016/j.bbih.2021.100307
Zhu L, Liu X, Nemeth DP, DiSabato DJ, Witcher KG, Mckim DB, Oliver B, Le X, Gorantla G, Berdysz O, Li J, Ramani AD, Chen Z, Wu D, Godbout JP, Quan N (2019) Interleukin-1 causes CNS inflammatory cytokine expression via endothelia-microglia bi-cellular signaling. Brain Behav Immun 81: 292–304. https://doi.org/0.1016/j.bbi.2019.06.026
Shimada A, Hasegawa-Ishii S (2021) Increased cytokine expression in the choroid plexus stroma and epithelium in response to endotoxin-induced systemic inflammation in mice. Toxicol Rev 8: 520–528. https://doi.org/10.1016/j.toxrep.2021.03.002
Kumar A, Loane DJ (2012) Neuroinflammation after traumatic brain injury: opportunities for therapeutic intervention. Brain Behav Immun 26: 1191–2127. https://doi.org/10.1016/j.bbi.2012.06.008
Патлай НИ, Сотников ЕБ, Тучина ОП (2020) Роль микроглиальных цитокинов в модуляции нейрогенеза во взрослом мозге. Международ журн прикладн и фундамент исследов 5: 15–23 [Patlay NI, Sotnikov EB, Tuchina OP (2020) The role of microglial cytokines in the modulation of neurogenesis in the adult brain. J Int Appl and Basic Res 5: 15–23. (In Russ)]. https://doi.org/10.17513/mjpfi.13062
Ito D, Tanaka K, Suzuki S, Dembo T, Fukuuchi Y (2001) Enhanced expression of Iba1, ionized calcium-binding adapter molecule 1, after transient focal cerebral ischemia in rat brain. Stroke 32(5): 1208–1215. https://doi.org/10.1161/01.str.32.5.1208
Серебряная НБ, Фомичева ЕЕ, Якуцени ПП (2021) Пуринергическая регуляция нейровоспаления при черепно-мозговой травме. Успехи физиол наук 52 (3): 24–40 [Serebryanaya NB, Fomicheva EE, Yakutseni PP (2021) Purinergic regulation of neuroinflammation in traumatic brain injury. Advanc Physiol Sci 52(3): 24–40. (In Russ)]. https://doi.org/10.31857/S0301179821030073
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


