Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1329-1339
Влияние нефрэктомии на вызванное электростимуляцией изменение тонуса артерий нормотензивных и спонтанно гипертензивных крыс
В. Н. Ярцев *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: yartsev@infran.ru
Поступила в редакцию 16.07.2022
После доработки 28.08.2022
Принята к публикации 29.08.2022
- EDN: SADNGQ
- DOI: 10.31857/S0869813922100120
Аннотация
В опытах на сегментах верхней брыжеечной (ВБА) и внутренней сонной артерии (ВСА) крыс линий WKY и SHR изучалось влияние нефрэктомии на изменение тонуса этих артерий, вызванное их электростимуляцией. Проводилась проверка гипотезы о том, что хроническая болезнь почек (ХБП) приводит к увеличению нейрогенного тонуса сосудов как у нормотензивных, так и у гипертензивных животных. В качестве модели ХБП использовали нефрэктомию. Нейрогенную констрикцию сегментов вызывали путем стимуляции периваскулярных нервов электрическим полем в отсутствие и на фоне действия блокаторов калиевых каналов (тетраэтиламмония или глибенкламида) либо ингибитора гуанилатциклазы – метиленового синего. В отсутствие блокаторов, а также в присутствии глибенкламида нефрэктомия увеличивала нейрогенное сокращение ВБА крыс линии WKY. В отсутствие, а также на фоне действия блокаторов нейрогенный ответ ВБА крыс линии SHR после нефрэктомии не изменялся, в то время как у ВСА нефрэктомированных крыс линии WKY на фоне действия блокаторов наблюдалась более значительная по сравнению с контрольными животными констрикция, а у крыс линии SHR дилатация. Связанное с нефрэктомией усиление констрикции у крыс линии WKY наблюдалось также при действии фенилэфрина на ВБА и тетраэтиламмония на ВСА, в то время как у крыс линии SHR нефрэктомия приводила к ослаблению констрикции ВСА, вызванной фенилэфрином и тетраэтиламмонием. Полученные данные позволяют предположить, что ХБП может приводить к увеличению нейрогенного и вызванного химическими веществами тонуса сосудов у изначально нормотензивных и к его уменьшению у изначально гипертензивных животных. В наибольшей степени эти изменения могут быть выражены в ВСА и связаны с повышением активности калиевых каналов и гуанилатциклазы в данной артерии при ХБП у изначально нормотензивных и со снижением этой активности у гипертензивных животных.
Хроническая болезнь почек (ХБП) является широко распространенным заболеванием, связанным с повышенным риском сердечно-сосудистых осложнений и высокой смертностью, превышающей общую в 10–20 раз [1]. Нарушения работы сердечно-сосудистой системы у пациентов, страдающих ХБП, в частности, связаны с кальцификацией артерий и с дисфункцией эндотелия, выражающейся в ослаблении эндотелий-зависимой вазодилатации и сопровождающейся сужением сосудов [2]. Было показано, что диметиларгинин, являющийся одним из важнейших “уремических токсинов”, подавляет продукцию эндотелием оксида азота (NO), что приводит к длительным тоническим сокращениям гладкомышечных клеток сосудов, способствуя развитию артериальной гипертензии [3, 4]. Окислительный стресс и хроническое воспаление, возникающее при ХБП, также вызывают нарушение функции эндотелия [5].
В связи с ограниченными возможностями проведения исследований на человеке было разработано несколько моделей ХБП на животных, что позволило детальнее изучить характер повреждения стенки сосудов при этом заболевании. Наиболее широко применяемой является модель с удалением 5/6 почечной ткани [6–8], приводящим к снижению клубочковой фильтрации и метаболическим нарушениям, характерным для пациентов с уремией.
Другим широко распространенным и опасным заболеванием, связанным с нарушением функционирования сердечно-сосудистой системы, является гипертоническая болезнь. Сопровождающая ее артериальная гипертензия – это ключевой фактор риска сердечно-сосудистых заболеваний, стоящих на первом месте среди причин смертности во всем мире [9]. Как показали результаты исследований, проведенных на изолированных кровеносных сосудах спонтанно гипертензивных крыс, а также на людях, страдающих гипертензией, при повышенном артериальном давлении происходят структурные и функциональные изменения артерий, сопровождающиеся увеличением сократительной реакции на вазоконстрикторы, такие как норадреналин и АТФ, при этом наблюдается уменьшение дилататорной реакции на ацетилхолин [10].
Как известно, нейрогенный тонус, с помощью которого осуществляется регуляция кровотока со стороны центральной нервной системы, является важным компонентом общего сосудистого тонуса. Было обнаружено, что при гипертензии происходит усиление этого тонуса, связанное как с увеличением частоты импульсации в сосудодвигательных нервах [11], так и с усилением сократительного ответа на стимуляцию этих нервов [12, 13].
Гипертензия и ХБП являются заболеваниями, одно из которых может приводить к появлению другого [14], причем, как было показано, каждое из них изменяет сократительные свойства кровеносных сосудов, однако практически не изученным оказался вопрос о влиянии ХБП на сократительную активность артерий в случае возникновения ХБП на фоне уже имеющейся гипертонической болезни. Нам удалось обнаружить только одну работу по выяснению действия нефрэктомии на реактивность артерий спонтанно гипертензивных крыс [15]. Относительно же влияния ХБП на нейрогенный тонус кровеносных сосудов обнаружить сведений нам не удалось. Мы предположили, что ХБП, подобно гипертонии, может приводить к увеличению нейрогенного тонуса артерий и с целью проверки этого предположения провели данное исследование с использованием кровеносных сосудов как нормо-, так и гипертензивных животных.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из ЦКП Биоколлекция Института физиологии им. И.П. Павлова РАН, поддержанной Программой по сохранению и развитию биоресурсных коллекций. Опыты проводили (в соответствии с принципами Базельской декларации и рекомендациями Комиссии по биоэтике Института физиологии им. И.П. Павлова РАН) на самцах крыс линии SHR через 3 месяца после нефрэктомии (n = 9, артериальное давление (АД) 238 ± 2 мм рт. ст.) и контрольных (n = 11, АД 190 ± 2 мм рт. ст., р < 0.001), а также на нефрэктомированных (n = 12, АД 127.2 ± 2.2 мм рт. ст.) и контрольных (n = 12, АД 127.1 ± 1.8 мм рт. ст., р > 0.05) крысах линии WKY массой 250–350 г. АД измеряли манжеточным методом на хвосте с помощью электроманометра фирмы ELEMA (Швеция). ХБП моделировали путем резекции 5/6 массы почечной ткани у крыс в возрасте 3 месяца по описанной ранее методике [16]. Через 4 мес. после такой операции содержание мочевины в сыворотке крови крыс увеличивалось в среднем с 4.9 ± 0.6 до 20.1 ± 2.6 ммоль/л (р < 0.001) [16]. В качестве контрольных служили ложнооперированные крысы, которые подвергались аналогичному оперативному вмешательству за исключением удаления почечной ткани. Эвтаназию животных осуществляли посредством эфирного наркоза. После эвтаназии отпрепаровывали левую внутреннюю сонную артерию (ВСА), а затем верхнюю брыжеечную артерию (ВБА). От каждой из этих артерий отрезали кольцевой участок длиной 2 мм, который надевали на две вольфрамовые иголочки (диаметром 70 мкм каждая), одна из которых была соединена со штоком погружателя микроэлектродов, а вторая – с механотроном 6МХ1С, сигнал от которого, отражающий изменение натяжения в стенке сегмента, усиливался и поступал на вольтметр самопишущий S-Recorder-L (ADSlab, Россия), а далее на персональный коьпьютер для обработки в программе S-Recorder (ADSlab, Россия). Иголочки с кольцевым участком помещали в проточную термостатируемую (37°C) ванночку объемом 10 мл, заполненную бикарбонатным раствором Кребса следующего состава (в мМ): NaCl – 115, KCl – 4.7, CaCl2 – 2.6, MgSO4.7H2O – 1.2, NaHCO3 – 25, KH2PO4 –1.2, глюкоза – 10. рН раствора доводили до значения 7.4 и контролировали в течение всего эксперимента, поддерживая это значение путем пропускания через раствор соответствующего количества СО2 или комнатного воздуха. После погружения в раствор иголочки миографа ступенчато разводили до значения натяжения, при котором наблюдался максимальный ответ сосудистого сегмента на стимуляцию электрическим полем (30 В, 3 мс, в течение 3 с) с частотой 10 Гц. Электростимуляция осуществлялась с помощью двух платиновых электродов, расположенных на расстоянии 2 мм от сосудистого сегмента. Ранее в опытах с применением тетродотоксина (0.1 мкМ) нами было показано, что в наших методических условиях при указанных параметрах электростимуляции сокращение сосуда происходит, преимущественно, за счет раздражения его периваскулярных нервов [17]. После адаптации препарата, продолжавшейся 30 мин, начинали регистрацию натяжения стенки сосуда. С целью оценки участия Ca2+-активируемых К+-каналов большой проводимости, АТФ-чувствительных К+-каналов и растворимой гуанилатциклазы в сосудистых реакциях в ванночку вводили соответствующие блокаторы: тетраэтиламмоний хлорид (Вектон, Россия) 10–3 М, глибенкламид (Sigma-Aldrich, США) 10–5 М или ингибитор растворимой гуанилатциклазы – метиленовый синий (Вектон, Россия) 10–5 М. Электростимуляцию осуществляли до и через 15 мин после введения блокатора или ингибитора в ванночку. Для оценки максимального сократительного ответа сосудистого сегмента использовали фенилэфрин (Sigma-Aldrich, США) в концентрации 10–5 М. Раствор глибенкламида получали, используя в качестве растворителя диметилсульфоксид (Вектон, Россия), широко применяемый для этой цели в экспериментах на изолированных сосудах. Маточные растворы остальных используемых веществ готовили на основе дистиллированной воды.
При статистическом анализе результатов использовали программу Statistica v. 12. Оценку нормальности распределения выборок проводили с помощью критерия Шапиро–Уилка. Вследствие нормальности распределения полученные данные представляли в виде среднего значения ± стандартная ошибка среднего. Достоверность отличий реакций сосудов нефрэктомированных и контрольных крыс в отсутствие и на фоне действия блокаторов К+-каналов и ингибитора гуанилатциклазы определяли, применяя двухфакторный дисперсионный анализ с поправкой Бонферрони при последующем post-hoc анализе. Для сравнения двух выборок использовали t-критерий Стьюдента. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В экспериментах на ВCА контрольных и нефрэктомированных крыс линии WKY величина исходного нейрогенного сократительного ответа на электростимуляцию была примерно одинакова и составляла 0.087 ± 0.022 и 0.081 ± 0.021 мН соответственно. На фоне действия тетраэтиламмония этот ответ у контрольных крыс не изменялся, а у нефрэктомированных животных достоверно увеличивался, в то время как на фоне действия глибенкламида и метиленового синего у контрольных крыс он достоверно уменьшался и становился дилататорным, а у нефрэктомированных животных не изменялся (рис. 1a). Нейрогенный ответ нефрэктомированных крыс линии WKY на фоне действия блокаторов и ингибитора был достоверно больше, чем у контрольных.
Рис. 1.
Сократительная реакция (a, b) сегмента внутренней сонной артерии и изменение этой реакции по сравнению с первоначальной реакцией (с, d) на электростимуляцию сегмента данной артерии контрольных (С) и нефрэктомированных (NE) крыс линии WKY (a, c) и SHR (b, d) в условиях отсутствия блокаторов и ингибитора (-B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Результаты выражены в % к сокращению от действия фенилэфрина. Данные представлены в виде среднего значения + стандартная ошибка среднего. * р < 0.05; ** р < 0.01 при сравнении с соответствующей группой.
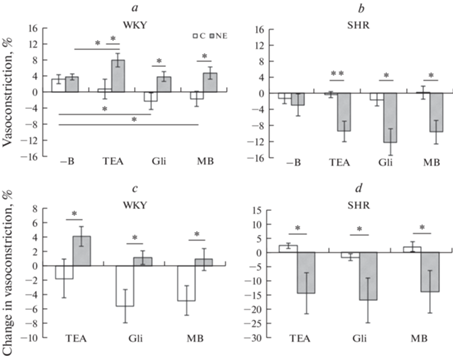
Реакция на электростимуляцию ВCА контрольных и нефрэктомированных крыс линии SHR была преимущественно дилататорной. Ингибитор и блокаторы не вызывали достоверного изменения нейрогенного ответа ВCА контрольных и нефрэктомированных крыс этой линии, однако на фоне их действия степень дилатации данной артерии нефрэктомированных крыс была значительно больше, чем контрольных (рис. 1b). Данное отличие связано с более значительным изменением нейрогенного ответа относительно исходного значения у нефрэктомированных животных (рис. 1d).
Величина нейрогенной констрикции ВБА нефрэктомированных крыс линии WKY была значительно больше, чем у контрольных животных и составляла 0.36 ± 0.07 и 0.15 ± 0.04 мН соответственно (р < 0.05). Тетраэтиламмоний и метиленовый синий не оказывали действия на величину этой констрикции в отличие от глибенкламида, который достоверно ее снижал у контрольных и нефрэктомированных крыс (рис. 2a). На фоне действия глибенкламида величина нейрогенной констрикции нефрэктомированных животных была больше соответствующего показателя контрольных крыс.
Рис. 2.
Сократительная реакция сегмента верхней брыжеечной артерии на электростимуляцию сегмента этой артерии контрольных (C) и нефрэктомированных (NE) крыс линии WKY (a) и SHR (b) в условиях отсутствия блокаторов и ингибитора (–B) в ванночке, а также при наличии в ней тетраэтиламмония (TEA, 10–3 М), глибенкламида (Gli, 10–5 М) или метиленового синего (MB, 10–5 М). Результаты выражены в % к сокращению от действия фенилэфрина. Данные представлены в виде среднего значения + стандартная ошибка среднего. * р < 0.05; ** р < 0.01 при сравнении с соответствующей группой.
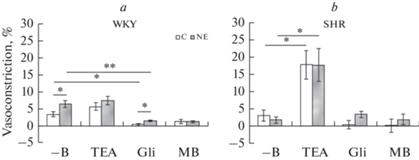
У крыс линии SHR величина нейрогенной констрикции ВБА нефрэктомированных крыс была несколько меньше, чем у контрольных животных и составляла 0.06 ± 0.03 и 0.14 ± 0.09 мН соответственно, однако это отличие было статистически недостоверным. Величина констрикторной реакции на электростимуляцию достоверно отличалась от исходного значения только на фоне действия тетраэтиламмония, и это отличие выражалось в ее значительном возрастании как у контрольных, так и у нефрэктомированных крыс (рис. 2b). Нефрэктомия не оказала влияния на величину нейрогенной констрикции ни в отсутствие, ни при наличии ингибитора и блокаторов.
Сократительная реакция на фенилэфрин у ВСА нефрэктомированных крыс линии SHR была меньше, чем у контрольных, а у ВБА нефрэктомированных крыс линии WKY больше, чем у контрольных животных (рис. 3a).
Рис. 3.
Сократительная реакция на фенилэфрин (РЕ, 10–5 М) (a) и тетраэтиламмоний (TEA, 10–3 М) (b) сегмента верхней брыжеечной (SMA) и внутренней сонной артерии (ICA) контрольных (C) и нефрэктомированных (NE) крыс линии WKY и SHR. Результаты для TEA выражены в % к сокращению от действия фенилэфрина. Данные представлены в виде среднего значения ± стандартная ошибка среднего. * р < 0.05 при сравнении с соответствующей группой.
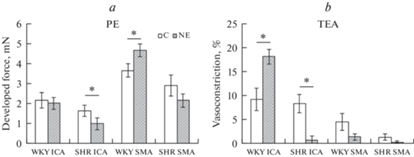
Тетраэтиламмоний сам по себе вызывал сокращение сосудов, которое для ВСА контрольных крыс линии WKY и SHR было примерно одинаковым, составляя 9.3 + 2.4 и 8.4 + 1.9% (р > 0.05) соответственно. У нефрэктомированных крыс линии WKY величина этого сокращения в 2 раза увеличилась относительно контрольных животных , в то время как у нефрэктомированных крыс линии SHR она в 10 раз уменьшилась, составляя 8.2 + 1.5 и 0.8 + 0.8% (р < 0.05) соответственно (рис. 3b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наиболее интересным, с нашей точки зрения, является обнаруженное нами разнонаправленное действие нефрэктомии при нормотонии и гипертонии, выражающееся, в частности, в увеличении вазоконстрикторной реакции ВСА на электростимуляцию у крыс линии WKY и в увеличении вазодилататорной реакции этой артерии на электростимуляцию у крыс линии SHR.
Следует заметить, что влияние нефрэктомии на нейрогенную вазомоторную реакцию ВСА проявлялось только в условиях действия блокаторов K+-каналов и ингибитора гуанилатциклазы. При использовании этих веществ многие авторы наблюдали уменьшение дилататорных и увеличение констрикторных реакций кровеносных сосудов. Так, например, тетраэтиламмоний ингибировал расслабление сосудов брыжейки мыши от ацетилхолина [18] и брыжеечной артерии крысы [19] от электростимуляции в условиях пресокращения этих сосудов и усиливал сокращение радиальной артерии крысы [20] от норадреналина, а также радиальной [20] и хвостовой артерии крысы [21] от электростимуляции. Аналогично тетраэтиламмонию глибенкламид ингибировал дилататорную реакцию, в частности, средней мозговой артерии крысы [22] на гипоксию, а также непресокращенных мозговых артериол крысы на гиперкапнию [23] и артериол m. cremaster хомяка на электростимуляцию [24]. Однако в ряде работ глибенкламид не оказывал действия на дилататорную реакцию, в частности, вызванную электростимуляцией пресокращенной базилярной артерии крысы [25], не изменял констрикторную реакцию, вызванную электростимуляцией радиальной артерии свиньи [26], а также уменьшал сокращение брыжеечной артерии крысы, вызванное фенилэфрином [27].
Анализируя опыты, в которых было показано, что различные блокаторы KATP-каналов устраняют вазоконстрикцию мозговых сосудов, вызванную гипокапническим алкалозом, Rosenblum предположил, что гипокапния уменьшала вероятность открытого состояния KATP-каналов даже больше глибенкламида, поэтому глибенкламид уменьшал сократительную реакцию этих сосудов [28]. Аналогичным образом можно предположить, что наблюдаемое в наших экспериментах на фоне действия глибенкламида уменьшение сократительной реакции ВСА и ВБА крыс линии WKY в ответ на электростимуляцию связано с тем, что электростимуляция больше глибенкламида уменьшала вероятность открытого состояния KATP-каналов, а показанное нами на фоне действия тетраэтиламмония и глибенкламида большее сокращение внутренней сонной артерии на электростимуляцию у крыс линии WKY и большее расслабление этой артерии у крыс SHR после нефрэктомии по сравнению с контролем связано в первом случае с большей, а во втором с меньшей проводимостью калиевых каналов гладкомышечных клеток ВСА нефректомированных животных по сравнению с контрольными.
В наших опытах было показано, что при наличии в среде метиленового синего вместо констрикторной реакции на электростимуляцию сонной артерии контрольных крыс линии WKY наблюдается дилатация этого сосуда. Можно предположить, что причиной такого изменения реакции является то, что в данной артерии таких крыс в отсутствие метиленового синего активность растворимой гуанилатциклазы при электростимуляции меньше активности, проявляющейся на фоне его действия, а наблюдаемое в наших экспериментах на фоне действия метиленового синего большее сокращение ВСА в ответ на электростимуляцию у крыс WKY и большее ее расслабление у крыс линии SHR после нефрэктомии по сравнению с контролем связано в первом случае с большей, а во втором с меньшей активностью растворимой гуанилатциклазы у крыс при электростимуляции после нефрэктомии по сравнению с контрольными животными.
При электростимуляции ВСА крыс линии SHR как в условиях наличия, так и при отсутствии блокаторов калиевых каналов и ингибитора растворимой гуанилатциклазы, преимущественно, наблюдалась дилататорная реакция. Такая реакция на электростимуляцию различных артерий наблюдалась другими авторами, как правило, в условиях пресокращения этих артерий различными вазоконстрикторами [29, 30]. Однако у некоторых сосудов дилатация в ответ на электростимуляцию происходила и в условиях отсутствия пресокращения. В частности, такая реакция наблюдалась у артериол m. cremaster хомяка, имевших значительный миогенный тонус [24]. Можно предположить, что наблюдавшееся в наших опытах преобладание дилататорной реакции на электростимуляцию ВСА крыс линии SHR по сравнению с WKY связано с более значительным исходным тонусом этой артерии у гипертензивных животных, так как известно, что при гипертензии миогенный тонус некоторых артерий повышен. В частности, это было показано на дуговой [31], коронарной [32], средней мозговой [33] и общей сонной [34] артерии крысы.
Ранее было продемонстрировано, что ослабление констрикторного и усиление дилататорного ответа кровеносных сосудов на электростимуляцию может быть обусловлено различными причинами, в том числе стимуляцией холинергических [29], NO-ергических [35] и CGRP-ергических нервов [30, 36], образованием супероксидного анион-радикала [25] и выделением простациклина, а также NO из эндотелия [37]. Не исключено, что некоторые из указанных причин могут объяснять обнаруженное нами изменение реакции ВСА крыс линии SHR после нефрэктомии.
Следует отметить, что в отсутствие блокаторов калиевых каналов и ингибитора гуанилатциклазы статистически достоверное усиление нейрогенного ответа после нефрэктомии наблюдалось только у нормотензивных крыс и только для ВБА, у которой, в отличие от ВСА, нами было отмечено также усиление сократительного ответа на фенилэфрин, действующий через α1-адренорецепторы. Как известно, основным медиатором, обуславливающим нейрогенную сократительную реакцию ВБА крысы, является норадреналин [38], вызывающий вазоконстрикцию вследствие стимуляции постсинаптических α1-адренорецепторов. Исходя из вышесказанного, можно предположить, что усиление нейрогенного ответа у ВБА крыс линии WKY связано с повышением концентрации и/или активности постсинаптических α1-адренорецепторов этой артерии после нефрэктомии нормотензивных крыс. Отсутствие изменения реакции на фенилэфрин после нефрэктомии, показанное в наших опытах на ВСА крыс линии WKY, было отмечено и ранее на общей сонной артерии крысы [39]. Разное действие нефрэктомии на разные сосуды было показано и другими авторами. В частности, в опытах на аорте и хвостовой артерии крысы [6] после нефрэктомии величина сократительного ответа на фенилэфрин на аорте возрастала, а на хвостовой артерии снижалась.
Итак, в нашем исследовании реакции ВСА на электростимуляцию с использованием блокаторов К+-каналов и ингибитора растворимой гуанилатциклазы впервые показано, что если у исходно нормотензивных крыс нефрэктомия способна вызывать увеличение сократительной способности артерий, то у исходно гипертензивных она вызывает уменьшение этой способности, что подтверждается большей величиной сокращения ВСА нефрэктомиванных крыс линии WKY на тетраэтиламмоний и меньшей у крыс линии SHR на тетраэтиламмоний и фенилэфрин. На ВБА эта закономерность проявлялась лишь отчасти и выражалась в большей величине сокращения на электростимуляцию в отсутствие блокаторов и при наличии глибенкламида, а также в большей величине сокращения на фенилэфрин у крыс WKY, но не SHR. Можно предположить, что уменьшение сократительной способности артерий у нефрэктомированных крыс SHR, особенно выраженное на ВСА, связано с чрезвычайно высоким значением АД (238 ± 2 мм рт. ст.) после нефрэктомии у изначально гипертензивных крыс. Это повышает вероятность инсульта вследствие высокого АД в областях мозга, лежащих выше ВСА, имеющей сниженную способность к сокращению, которое могло бы препятствовать росту АД в мозгу.
Полученные нами данные позволяют предположить, что в условиях снижения активности Ca2+-активируемых К+-каналов большой проводимости, АТФ-чувствительных К+-каналов или растворимой гуанилатциклазы ХБП может приводить к усилению нейрогенного тонуса ВСА при нормотензии и к ослаблению этого тонуса при наличии гипертензии. Ослабление нейрогенного тонуса ВСА при ХБП в условиях гипертензии может способствовать возникновению инсульта.
Список литературы
Liyanage T, Ninomiya T, Jha V, Neal B, Patrice HM, Okpechi I, Zhao MH, Lv J, Garg AX, Knight J, Rodgers A, Gallagher M, Kotwal S, Cass A, Perkovic V (2015) Worldwide access to treatment for end-stage kidney disease: a systematic review. Lancet 385(9981): 1975–1982. https://doi.org/10.1016/s0140-6736(14)61601-9
Fujii H, Kono K, Nishi S (2019) Characteristics of coronary artery disease in chronic kidney disease. Clin Exp Nephrol 23(6): 725–732. https://doi.org/10.1007/s10157-019-01718-5
Kimura K (2012) [Methylarginies-induced endothelial dysfunction in chronic kidney disease]. Yakugaku Zasshi 132(4): 443–448. https://doi.org/10.1248/yakushi.132.443
Vallianou NG, Mitesh S, Gkogkou A, Geladari E (2019) Chronic Kidney Disease and Cardiovascular Disease: Is there Any Relationship? Curr Cardiol Rev 15(1): 55–63. https://doi.org/10.2174/1573403x14666180711124825
Townsend RR (2015) Arterial stiffness and chronic kidney disease: lessons from the Chronic Renal Insufficiency Cohort study. Curr Opin Nephrol Hypertens 24(1): 47–53. https://doi.org/10.1097/mnh.0000000000000086
Spradley FT, White JJ, Paulson WD, Pollock DM, Pollock JS (2013) Differential regulation of nitric oxide synthase function in aorta and tail artery from 5/6 nephrectomized rats. Physiol Rep 1(6): e00145. https://doi.org/10.1002/phy2.145
Li T, Gua C, Wu B, Chen Y (2018) Increased circulating trimethylamine N-oxide contributes to endothelial dysfunction in a rat model of chronic kidney disease. Biochem Biophys Res Commun 495(2): 2071–2077. https://doi.org/10.1016/j.bbrc.2017.12.069
Hamzaoui M, Djerada Z, Brunel V, Mulder P, Richard V, Bellien J, Guerrot D (2020) 5/6 nephrectomy induces different renal, cardiac and vascular consequences in 129/Sv and C57BL/6JRj mice. Sci Rep 10(1): 1524. https://doi.org/10.1038/s41598-020-58393-w
Campbell NR, Lackland DT, Lisheng L, Niebylski ML, Nilsson PM, Zhang XH (2015) Using the Global Burden of Disease study to assist development of nation-specific fact sheets to promote prevention and control of hypertension and reduction in dietary salt: a resource from the World Hypertension League. J Clin Hypertens (Greenwich) 17(3): 165–167. https://doi.org/10.1111/jch.12479
Brown IAM, Diederich L, Good ME, DeLalio LJ, Murphy SA, Cortese-Krott MM, Hall JL, Le TH, Isakson BE (2018) Vascular Smooth Muscle Remodeling in Conductive and Resistance Arteries in Hypertension. Arterioscler Thromb Vasc Biol 38(9): 1969–1985. https://doi.org/10.1161/atvbaha.118.311229
Ma H, Chen SR, Chen H, Pan HL (2019) Endogenous AT1 receptor-protein kinase C activity in the hypothalamus augments glutamatergic input and sympathetic outflow in hypertension. J Physiol 597(16): 4325–4340. https://doi.org/10.1113/jp278427
Goonetilleke L, Ralevic V, Dunn WR (2013) Influence of pressure on adenosine triphosphate function as a sympathetic neurotransmitter in small mesenteric arteries from the spontaneously hypertensive rat. J Hypertens 31(2): 312–320. https://doi.org/10.1097/HJH.0b013e32835bd74d
Lataro RM, Silva MAB, Mestriner FL, Cau SBA, Tostes RCA, Salgado HC (2019) Chronic Treatment With Acetylcholinesterase Inhibitors Attenuates Vascular Dysfunction in Spontaneously Hypertensive Rats. Am J Hypertens 32(6): 579–587. https://doi.org/10.1093/ajh/hpz036
Ku E, Lee BJ, Wei J, Weir MR (2019) Hypertension in CKD: Core Curriculum 2019. Am J Kidney Dis 74(1): 120–131. https://doi.org/10.1053/j.ajkd.2018.12.044
Thuraisingham RC, Raine AE (1999) Maintenance of normal agonist-induced endothelium-dependent relaxation in uraemic and hypertensive resistance vessels. Nephrol Dial Transplant 14(1): 70–75. https://doi.org/10.1093/ndt/14.1.70
Иванова ГТ, Лобов ГИ, Береснева ОН, Парастаева ММ (2019) Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов. Нефрология 23(4): 88–95. [Ivanova GT, Lobov GI, Beresneva ON, Parastaeva MM (2019) Changes in the reactivity of rat vessels with an experimental decrease in the mass of functioning nephrons. Nephrology 23(4): 88–95. (In Russ)].
Dvoretsky DP, Yartsev VN, Karachentseva OV, Granstrem MP (2000) Changes in reactivity of rat arteries subjected to dynamic stretch. Acta Physiol Scand 169(1): 13–19. https://doi.org/10.1046/j.1365-201x.2000.00693.x
Fujiwara H, Wake Y, Hashikawa-Hobara N, Makino K, Takatori S, Zamami Y, Kitamura Y, Kawasaki H (2012) Endothelium-derived relaxing factor-mediated vasodilation in mouse mesenteric vascular beds. J Pharmacol Sci 118(3): 373–381. https://doi.org/10.1254/jphs.11197fp
Ozkan MH, Ozturk EI, Uma S (2013) Electrical field stimulation (EFS)-induced relaxations turn into contractions upon removal of extracellular calcium in rat mesenteric artery. Pharmacol Res 70(1): 60–65. https://doi.org/10.1016/j.phrs.2013.01.001
Martínez AC, Pagán RM, Prieto D, Recio P, García-Sacristán A, Hernández M, Benedito S (2009) Modulation of noradrenergic neurotransmission in isolated rat radial artery. J Pharmacol Sci 111(3): 299–311. https://doi.org/10.1254/jphs.09135fp
Bao JX, Stjärne L (1993) Dual contractile effects of ATP released by field stimulation revealed by effects of alpha,beta-methylene ATP and suramin in rat tail artery. Br J Pharmacol 110(4): 1421–1428. https://doi.org/10.1111/j.1476-5381.1993.tb13979.x
Fredricks KT, Liu Y, Rusch NJ, Lombard JH (1994) Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol 267(2 Pt 2): H580–H586. https://doi.org/10.1152/ajpheart.1994.267.2.H580
Janigro D, Nguyen TS, Meno J, West GA, Winn HR (1997) Endothelium-dependent regulation of cerebrovascular tone by extracellular and intracellular ATP. Am J Physiol 273(2 Pt 2): H878–H885. https://doi.org/10.1152/ajpheart.1997.273.2.H878
Hammer LW, Ligon AL, Hester RL (2001) Differential inhibition of functional dilation of small arterioles by indomethacin and glibenclamide. Hypertension 37(2 Pt 2): 599–603. https://doi.org/10.1161/01.hyp.37.2.599
Conde MV, Marín J, Balfagón G (1999) Superoxide anion and K+ channels mediate electrical stimulation-induced relaxation in the rat basilar artery. Eur J Pharmacol 372(2): 179–186.https://doi.org/10.1016/s0014-2999(99)00215-0
Pagán RM, Martínez AC, Martínez MP, Hernández M, García-Sacristán A, Correa C, Prieto D, Benedito S (2009) Endothelial and potassium channel dependent modulation of noradrenergic vasoconstriction in the pig radial artery. Eur J Pharmacol 616(1-3): 166–174. https://doi.org/10.1016/j.ejphar.2009.06.002
Huang Y, Chan NW (1998) Involvement of endothelium in relaxant action of glibenclamide on the rat mesenteric artery. Eur J Pharmacol 343(1): 27–33. https://doi.org/10.1016/s0014-2999(97)01516-1
Rosenblum WI (2003) ATP-sensitive potassium channels in the cerebral circulation. Stroke 34(6): 1547–1552. https://doi.org/10.1161/01.str.0000070425.98202.b5
Van Riper DA, Bevan JA (1992) Electrical field stimulation-mediated relaxation of rabbit middle cerebral artery. Evidence of a cholinergic endothelium-dependent component. Circ Res 70(6): 1104–1112. https://doi.org/10.1161/01.res.70.6.1104
Norton CE, Grunz-Borgmann EA, Hart ML, Jones BW, Franklin CL, Boerman EM (2021) Role of perivascular nerve and sensory neurotransmitter dysfunction in inflammatory bowel disease. Am J Physiol Heart Circ Physiol 320(5): H1887–H1902. https://doi.org/10.1152/ajpheart.00037.2021
Nademi S, Lu C, Dickhout JG (2020) Enhanced Myogenic Constriction in the SHR Preglomerular Vessels Is Mediated by Thromboxane A2 Synthesis. Front Physiol 11: 853. https://doi.org/10.3389/fphys.2020.00853
Choi SK, Lim M, Byeon SH, Lee YH (2016) Inhibition of endoplasmic reticulum stress improves coronary artery function in the spontaneously hypertensive rats. Sci Rep 6: 31925. https://doi.org/10.1038/srep31925
Szarka N, Amrein K, Horvath P, Ivic I, Czeiter E, Buki A, Koller A, Toth P (2017) Hypertension-Induced Enhanced Myogenic Constriction of Cerebral Arteries Is Preserved after Traumatic Brain Injury. J Neurotrauma 34(14): 2315–2319. https://doi.org/10.1089/neu.2016.4962
Shimamura K, Zhou M, Ito Y, Kimura S, Zou LB, Sekiguchi F, Kitramura K, Sunano S (2002) Effects of flufenamic acid on smooth muscle of the carotid artery isolated from spontaneously hypertensive rats. J Smooth Muscle Res 38(1–2): 39–50. https://doi.org/10.1540/jsmr.38.39
Xavier FE (2020) Nitrergic perivascular innervation in health and diseases: Focus on vascular tone regulation. Acta Physiol (Oxf) 230(1): e13484. https://doi.org/10.1111/apha.13484
Tellİ G, Tel BC, GÜmÜŞel B (2020) The Cardiopulmonary Effects of the Calcitonin Gene-related Peptide Family. Turk J Pharm Sci 17(3): 349–356. https://doi.org/10.4274/tjps.galenos.2019.47123
Sheng Y, Zhu L (2018) The crosstalk between autonomic nervous system and blood vessels. Int J Physiol Pathophysiol Pharmacol 10(1): 17–28.
Blanco-Rivero J, Couto GK, Paula SM, Fontes MT, Rossoni LV (2021) Enhanced sympathetic neurotransduction in the superior mesenteric artery in a rat model of heart failure: role of noradrenaline and ATP. Am J Physiol Heart Circ Physiol 320(2): H563–H574. https://doi.org/10.1152/ajpheart.00444.2020
Köhler R, Eichler I, Schönfelder H, Grgic I, Heinau P, Si H, Hoyer J (2005) Impaired EDHF-mediated vasodilation and function of endothelial Ca-activated K channels in uremic rats. Kidney Int 67(6): 2280–2287. https://doi.org/10.1111/j.1523-1755.2005.00331.x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


