Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 10, стр. 1316-1328
Регистрация изменений уровня внеклеточного дофамина в прилежащем ядре методом быстросканирующей циклической вольтамперометрии при стимуляции зоны вентральной области покрышки, раздражение которой вызывает и реакцию самостимуляции
С. С. Пюрвеев 1, 2, В. В. Сизов 1, А. А. Лебедев 1, *, Е. Р. Бычков 1, В. Н. Мухин 1, А. В. Дробленков 1, П. Д. Шабанов 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный педиатрический медицинский университет
Министерства здравоохранения Российской Федерации
Санкт-Петербург, Россия
* E-mail: aalebedev-iem@rambler.ru
Поступила в редакцию 01.06.2022
После доработки 11.08.2022
Принята к публикации 23.08.2022
- EDN: HVMITZ
- DOI: 10.31857/S0869813922100107
Аннотация
Целью работы было установление возможности использования метода циклической вольтамперометрии с быстрым сканированием (FSCV) для регистрации выброса дофамина в прилежащем ядре в ответ на электрическую стимуляцию той зоны вентральной области покрышки (VТА) электродом, которая используется для изучения реакции самостимуляции у крыс. Методом FSCV in vivo проводили регистрацию высвобождения дофамина в прилежащем ядре в ответ на электрическую стимуляцию VТА, а далее на этих животных вырабатывали реакцию самостимуляции при раздражении тех же зон VТА. У наркотизированных животных производили стимуляцию (240 мкА) пачкой импульсов (100 Гц), длительностью 0.5 с через каждые 3 мин в течение 1 ч, затем вводили внутрибрюшинно фенамин в дозе 1 мг/кг и продолжали регистрацию еще в течение 1 ч. Электростимуляция VТА вызывала увеличение содержания внеклеточного дофамина в течение 1.45 ± 0.03 с с амплитудой 4.6 ± 0.3 нА. Последующее введение фенамина на фоне стимуляции увеличивало длительность сигнала до 5.2 ± 0.1 с и его амплитуду до 20.8 ± 0.9 нА, что соответствует пропорциональному увеличению количества дофамина. Данная реакция была максимально выражена на 45-й минуте после введения фенамина. Исследованные зоны VТА были также протестированы на наличие реакции самостимуляции в тесте “подъема”, когда инструментальная реакция для получения внутримозгового подкрепления заключалась в подъеме головы на 38 градусов в беспроводной телеметрической установке. Реакцию самостимуляции тестировали до введения фенамина и после его введения в течение 1 ч. Установлено, что число подъемов для получения внутримозгового подкрепления увеличивалось к 45-й минуте после введения фенамина. Таким образом, в настоящем исследовании было показано, что стимуляция зон положительного подкрепления в VТА вызывает (у наркотизированных животных) стабильные, продолжительные эффекты фазического высвобождения дофамина, после введения непрямого адреномиметика фенамина активация высвобождения дофамина соответствует по времени изменениям параметров самостимуляции, наблюдаемым после введения вещества. Кроме того, объединение метода FSCV и метода самостимуляции позволяет более четко и надежно, под контролем регистрации выброса дофамина, локализовать стимулирующий электрод в VTA. Это дает основания для применения данного метода, состоящего из двух экспериментов: 1) регистрация высвобождения дофамина с помощью FSCV у наркотизированных животных; 2) исследование реакции самостимуляции на этих животных. Такой подход имеет перспективы для стандартизации протоколов оценки действия сенсорных и фармакологических агентов на дофамин-зависимые формы поведения.
Внутримозговая самостимуляция является одной из известных моделей для исследования механизмов вознаграждения и аддикции [1, 2]. Суть методики самостимуляции состоит в том, что животное, нажимая на педаль (или совершая другие инструментальные реакции для получения внутримозгового подкрепления), производит электрическое раздражение участков мозга с помощью вживленного электрода [3]. Нейромедиатор дофамин традиционно ассоциируется с нейрохимическими исследованиями механизмов подкрепления при самостимуляции [4, 5]. В частности, препараты, активирующие дофаминергическую систему мозга, такие как амфетамин, кокаин повышают число нажатий педали и снижают пороги реакции самостимуляции [6, 7]. Показано, что структуры мозга, при прямом или опосредованном раздражении которых наблюдается интенсивная реакция самостимуляции, содержат дофаминергические нейроны [8]. Избирательная активация дофаминергических нейронов, как показали оптогенетические исследования, достаточна для облегчения развития реакции самостимуляции [9]. Важную роль в подкрепляющих эффектах электрической самостимуляции латерального гипоталамуса играют нисходящие волокна медиального пучка переднего мозга, направляющиеся в вентральную область покрышки (ventral tegmental area, VТА) [10]. При этом отдельные нейроны латерального гипоталамуса активируют дофаминергические клетки VТА во время самостимуляции за счет высвобождения возбуждающих нейромедиаторов, таких как ацетилхолин и глутамат [11, 12].
Регистрация высвобождения дофамина при самостимуляции была впервые выполнена с использованием метода прижизненного микродиализа, который определяет изменения тонического внеклеточного уровня дофамина. Этот метод показал повышение концентрации внеклеточного дофамина во время самостимуляции с последующим снижением до базального уровня после завершения исследования [13]. Развитие быстро-сканирующей циклической вольтамперометрии (fast scan cyclic voltammetry, FSCV) дало возможность наблюдать кинетику дофамина во временной шкале, соответствующей поведенческим реакциям (фазические колебания внеклеточного уровня дофамина с временным разрешением меньше секунды) [14]. В отличие от микродиализа, регистрация методом FSCV в прилежащем ядре (nucleus accumbens) выявила снижение фазического выброса дофамина во время длительной самостимуляции вплоть до предела его измерения [15]. Однако дальнейшее совершенствование метода FSCV показало, что фазическое высвобождение дофамина не исчезает при длительной самостимуляции, а снижается до меньших, устойчивых уровней, ранее не обнаруживаемых [16]. Таким образом, из приведенных данных литературы можно сделать вывод, что фазическое высвобождение дофамина отмечается только в начале серии самостимуляции, а дальнейшая непрерывная и длительная самостимуляция уже не всегда позволяет его полностью зарегистрировать (необходимо использовать дополнительные методы оценки). Поэтому для исследования механизмов положительного подкрепления при самостимуляции более целесообразно регистрировать и анализировать выброс дофамина в ответ на навязанную стимуляцию области мозга, которая протестирована также и на наличие реакции самостимуляции. Такой подход также имеет перспективы и для оценки действия сенсорных и фармакологических агентов.
Целью работы было установление возможности использования метода быстро-сканирующей циклической вольтамперометрии для регистрации выброса дофамина в прилежащем ядре в ответ на электрическую стимуляцию той зоны вентральной области покрышки, которая используется для изучения реакции самостимуляции у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент проведен на 9 крысах-самцах линии Вистар средней массой 250 г в соответствии с этическими принципами работы с лабораторными животными, изложенными в Директиве Европейского парламента и Совета Европейского Союза 2010/63/EC от 22 сентября 2010 г., одобренной комиссией по биоэтике ФГБНУ “ИЭМ”. Было проведено два эксперимента. В первом эксперименте проводили регистрацию высвобождения дофамина в прилежащем ядре in vivo методом быстросканирующей циклической вольтамперометрии в ответ на электрическую стимуляцию зоны VTA, а во втором эксперименте на тех же животных тестировали реакцию самостимуляции VTA.
Секреторную активность дофаминергических нейронов in vivo оценивали по изменению уровня дофамина в межклеточном пространстве прилежащего ядра методом быстросканирующей циклической вольтамперометрии в ответ на электрическую стимуляцию VТА на оборудовании, изготовленном в мастерских ФГБНУ ИЭМ (Санкт-Петербург). Преимущество быстросканирующей циклической вольтамперометрии – высокая степень временного и пространственного разрешения. Временное разрешение обеспечивается частотой сканирования – 10 раз в секунду, пространственное разрешение определяется размерами сенсора (углеволокно длиной 100 мкм и толщиной 7 мкм) [19]. Перед экспериментом на животных сенсорный углеродный микроэлектрод в стеклянной изоляции калибровали in vitro. При увлечении концентрации дофамина в растворе наблюдалось дозозависимое увеличение электрического сигнала.
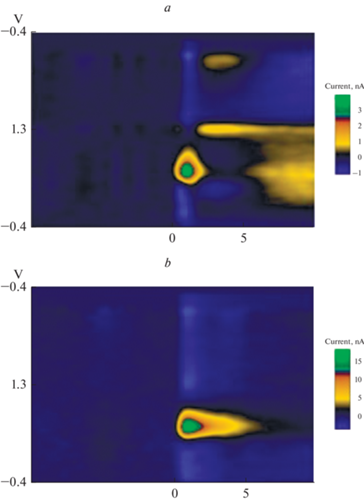
Крыс наркотизировали золетилом-100, в дозе 50 мг/кг (Valdepharm, Франция). В правую вентральную область покрышки вживляли стимулирующий электрод (стальной биполярный электрод с изоляцией толщиной 0.2 мм) по координатам относительно Bregma: АР = ‒5.3 мм, L = 0.8 мм, Н = 8.2 мм [17]. Сенсорный углеродный микроэлектрод в стеклянной изоляции (длина открытого кончика 100 мкм и толщина 7 мкм), регистрирующий уровень дофамина, имплантировали ипсилатерально в прилежащее ядро с использованием стереотаксических координат: AP = +2.0 мм (от Bregma ); L = 1.2 мм; Н = 6.8 мм от поверхности черепа [17]. Имплантировали также электрод сравнения из прессованного Ag/AgCl диаметром 3 мм. Он располагался на поверхности черепа АР = +5.5 мм относительно Bregma; L = 0. Для его крепления использовался стоматологическую акриловую пасту с УФ-отверждением. Электроды (и стимулирующий и регистрирующий) перемещали до получения максимального выброса дофамина и затем фиксировали. Стимуляцию VTA производили пачками прямоугольных электрических импульсов с интервалом 3 мин в течение 1 ч (сила тока 240 мкА, длительность импульса 1 мс с частотой 100 Гц в течение 0.5 с). Затем вводили фенамин в дозе 1 мг/кг внутрибрюшинно и продолжали регистрацию еще 1 ч. Использовали продолжительность сканирования 10 мс и потенциал удержания ‒ 0.4 В, при величине анодного предела +1.3 В (рис. 1 ). Далее в течение 1 недели животное изолировали для восстановления после оперативного вмешательства.
Рис. 1.
Кинетика изменения внеклеточного уровня дофамина в прилежащем ядре в ответ на электрическую стимуляцию зоны вентральной области покрышки. Показана вольтамперограмма после стимуляции вентральной области покрышки до (a) и через 45 мин после инъекции фенамина (b). Цветовая шкала отражает величину изменения электрического тока по сравнению с его уровнем в точке 0 по оси времени.
Для анализа полученных данных использовали веб-приложение Analysis Kid (созданное лабораторией Hashemi Lab) с инструментами калибровки и анализа данных для сигналов электроактивных молекул при циклической вольтамперометрии с быстрым сканированием. Analysis Kid предоставляет приложение с открытым исходным кодом, которое позволяют визуализировать, фильтровать, калибровать и анализировать нейрохимические сигналы [20].
В дальнейшем, при тестировании реакции самостимуляции в фиксированном режиме, использовались пачки импульсов с такими же характеристиками, но меньшей силой тока (длительность пачки импульсов составляла 0.5 с, для получения повторного внутримозгового подкрепления животное обучалось совершать инструментальное движение головы вниз и вновь инструментальное движение вверх).
Для воспроизведения реакции самостимуляции у крыс использовался акселерометр в составе устройства регистрации, который устанавливали параллельно плоскости черепа. В реальном времени в градусах вычислялись тангаж – наклон головы вперед–назад (нос вверх–вниз) крен – наклон головы (одно ухо выше другого). Для самостимуляции задавались 3 параметра: 1) уголема (в градусах) – подъем головы животного на этот угол автоматически вызывает электрический стимул; 2) угол сброса (в градусах) – после начала стимула крыса должна опустить голову до этого угла, иначе следующего стимула производиться не будет; 3) максимальный крен (в градусах) – это ограничение можно вводить для того, чтобы животное поднимало голову в одной плоскости. Задаваемые параметры электростимуляции были стандартные: длительность импульса (1 мс), частота (100 Гц), количество импульсов (50), угол подъема 38 градусов, угол сброса 0 градусов, максимальный крен не использовался. Устройство располагалось на голове животного, связь с компьютером осуществлялось посредством телеметрии.
Животное помещалось в специальную кольцевую камеру (внешний диаметр цилиндра 50 см, внутренний диаметр 26 см), где параметры движения животного регистрировались автоматически с помощью телеметрической установки и компьютера. Для появления ориентировочно-исследовательской реакции при обучении использовали одновременную кратковременную подачу светового и звукового раздражителей (1 с), которая использовалась для провокации поднятия животным головы. Анализировали число поднятий головы за каждую минуту для получения внутримозгового подкрепления в фиксированном режиме FR1 (подкреплялся каждый подъем головы) и порог реакции самостимуляции (в мкА). Для определения порога реакции самостимуляции подавался ток в навязанном режиме нарастающими порциями (priming stimulation) длительностью по 5 с шагом по 2 мкА до появления реакции поднятия головы. Затем повышали силу тока на 50% от пороговых значений, когда наблюдали выраженную реакцию самостимуляции, и включали режим снижения силы тока (шаг 2 мкА длительностью стимуляции 5 с) до появления отказа от поднятия головы. Процедуру поиска пороговых значений силы тока повторяли 2 раза. При совпадении значений силы тока, полученных с использованием нарастающего и снижающего режимов, его считали порогом реакции самостимуляции [3]. В дальнейшем использовали надпороговую силу тока на 50% выше пороговых значений. Отмеченная интенсивность электрического раздражения структур головного мозга при самостимуляции в режиме FR1 часто используется в аналогичных экспериментах [18]. Преимущество нашего метода заключается в том, что реакцию самостимуляции можно выработать в течение минут при минимальных сроках ее стабилизации. Для анализа реакции самостимуляции как дофамин-зависимой реакции применяли непрямой адреномиметик фенамина гидрохлорид (1 мг/кг, внутрибрюшинно).
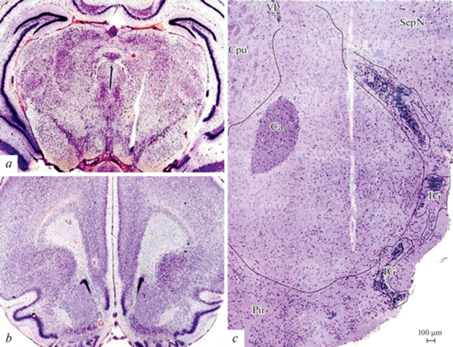
По завершении опытов был произведен морфологический контроль локализации электродов. Животных умерщвляли передозировкой нембутала и перфузировали физиологическим раствором, фиксировали в формалине, выделяли мозг и заливали целлоидином, делали фронтальные срезы и окрашивали крезиловым фиолетовым по методу Ниссля (рис. 2). Область расположения электродов верифицировали после завершения эксперимента в гистологических срезах мозга, используя стереотаксический атлас [17]. Для морфологической верификации следа стимулирующего электрода в вентральной области покрышки делали фронтальный разрез на уровне Bregma ‒5.3 мм (рис. 2а), согласно стереотаксическому атласу [17]. В этой области территория вентральной покрышки наиболее обширна и представлена дофаминергическим паранигральным ядром среднего мозга. Для верификации следа регистрирующего (сенсорного) электрода в прилежащем ядре делали фронтальный срез на уровне Bregma +2.7 мм (рис. 2b) согласно атласу. Далее продолжали иссекать срезы на протяжении 0.7‒1 мм до той части переднего мозга, в которой прилежащее ядро занимает наибольшую площадь (рис. 2с). В этой области передняя спайка смещалась к верхней медиальной части ядра, тогда как в его наиболее крупной средней части располагался след регистрирующего электрода (рис. 2с).
Рис. 2.
Морфологический контроль следа электродов в головном мозге крыс. След электрода для стимуляции в VTA на уровне Bregma –5.3 мм: (а), ок. ×4, об. ×10. (b) – область начала поиска следа тонкого регистрирующего электрода на уровне Bregma +2.7 мм, ок. ×4, об. ×10. (c) – передняя часть прилежащего ядра с дефектом мозга из области вживления тонкого регистрирующего электрода на уровне Bregma +2.0, ок. ×10, об. ×10. IG – обонятельные ядра, Cpu – стриопаллидарный комплекс, Pir – грушевидная кора, SepN – ядра перегородки, VL – боковой желудочек, ca – передняя спайка мозга. Окраска методом Ниссля.
Полученные данные анализировали с использованием пакета статистических программ GraphPad PRISM 6.0. Различия в показателях уровня секреции дофамина и реакции самостимуляции оценивали с помощью однофакторного дисперсионного анализа с применением поправки Бонферрони для множественных сравнений. Различия считали статистически значимыми при р < 0.05. Данные представлены как среднее арифметическое ± стандартная ошибка среднего арифметического.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
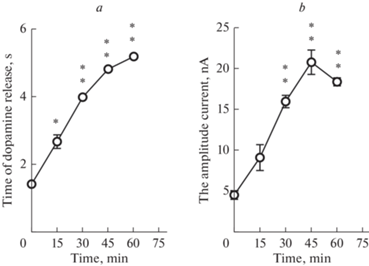
Электростимуляция зоны VTA вызывала увеличение содержания внеклеточного дофамина в течение 2 с, что проявлялось увеличением силы тока на 5 нА (в максимуме) во время достижения сканирующим импульсом напряжения окисления дофамина с максимальной амплитудой 5нА. Введение фенамина на фоне стимуляции зоны положительного подкрепления увеличивало как длительность повышения силы тока до 5 с, так и амплитуду до 18 нА, что соответствует пропорциональному увеличению количества дофамина. Максимально данная реакция была выражена на 45‑й минуте после введения фенамина (рис. 3).
Рис. 3.
Динамика величины фазических волн повышения дофамина в прилежащем ядре в ответ на электрическую стимуляцию вентральной области покрышки после внутрибрюшинного введения фенамина 1 мг/кг. Показана продолжительность (а) и амплитуда (b) волн увеличения уровня дофамина в прилежащем ядре. 0 – до введения фенамина, далее 15, 30, 45 и 60 мин после внутрибрюшинного введения фенамина. * – p < 0.05; ** – p < 0.01 относительно значений до введения фенамина.
Таким образом, при стимуляции той зоны VTA, которая в дальнейшем была протестирована на наличие реакции самостимуляции, наблюдается увеличение фазического повышения уровня дофамина при введении фенамина.
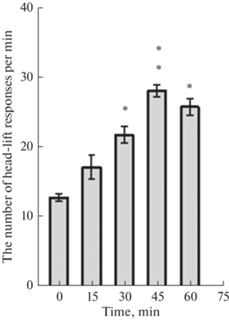
На втором этапе исследований, после проведения экспериментов по регистрации высвобождения дофамина в прилежащем ядре, было проведено тестирование реакции самостимуляции. Исследования показали, что пороговая для самостимуляции сила тока составляла от 54 до 88 мкА. Все животные поднимали голову для самостимуляции более 250 раз за 10 мин. Тестирование самостимуляции производили до введения фенамина и сразу после его введения в течение 1 ч. Было установлено, что число подъемов головы для самостимуляции увеличивается к 45-й минуте после введения (рис. 4).
Рис. 4.
Изменение числа реакций подъема головы для внутримозгового подкрепления после внутрибрюшинного введения фенамина 1 мг/кг. Показано число реакций подъема головы. 0 – до введения фенамина, далее 15, 30, 45 и 60 мин после внутрибрюшинного введения фенамина. * – p < 0.05; ** – p < 0.01 относительно значений до введения фенамина.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Большинство исследователей сходятся во мнении, что высвобождение дофамина в прилежащем ядре играет важную роль в механизмах внутримозгового подкрепления при выработке реакции самостимуляции. Доказательством важности дофамина при самостимуляции являются снижение ответа у крыс с поражением дофаминергических нейронов [21, 22], прекращение самостимуляции после введения антагонистов рецепторов дофамина в прилежащее ядро [23, 24] и нарушение поведения самостимуляции у мышей с нокаутом по гену D1-рецепторов [25]. В настоящей работе была произведена регистрация высвобождения дофамина в прилежащем ядре с помощью быстросканирующей циклической вольтамперометрии в ответ на электрическую стимуляцию вентральной области покрышки, зоны под электродом, которая в дальнейшем была протестирована на наличие реакции самостимуляции. На основе анализа данных литературы мы сделали заключение о том, что для исследования механизмов подкрепления при самостимуляции более целесообразно регистрировать и анализировать подъем уровня дофамина в ответ на навязанную стимуляцию области мозга, при стимуляции которой наблюдается и реакция самораздражения. В условиях свободного поведения интервалы между нажатиями педали (в нашем случае инструментальные движения головы, необходимые для получения внутримозгового подкрепления) при самостимуляции обычно сильно варьируют – от 0.1 до 10 с, отдельные высвобождения дофамина при последовательных нажатиях педали могут накладываться друг на друга и давать неясную картину при регистрации вольтамперограмм. Поэтому в настоящих исследованиях при изучении фазического высвобождения дофамина у наркотизированных животных подавали пачку импульсов каждые 3 мин (длительностью 0.5 с) с фиксированной силой тока. В ряде исследований показано, в частности, что фазическое высвобождение дофамина отмечается лишь в начале серии самостимуляции, а дальнейшая непрерывная и длительная самостимуляция уже не позволяет его полностью зарегистрировать (необходимо использовать дополнительные методы оценки) [16]. Более того, в ряде исследований обнаружено, что при непрерывной самостимуляции в режиме FR1 высвобождение дофамина подавляется [26]. Показано, что при увеличении временного интервала между подачей подкрепления в режиме FR8 (когда подкрепляется только каждое 8-е нажатие педали) можно зарегистрировать стабильное высвобождение дофамина во время самостимуляции [27]. В пользу применения навязанной стимуляции зон положительного подкрепления у наркотизированных животных говорит и неконтролируемое частое, спонтанное высвобождение дофамина в ответ на обстановочные раздражители у животных в свободном поведении, вызывающие активацию и ориентировочную реакцию [28].
В настоящем исследовании показано, что в ответ на раздражение зоны самостимуляции VTA наблюдается кратковременное высвобождение дофамина в прилежащем ядре, а после введения фенамина оно значительно увеличивается. В то же время высвобождение дофамина в прилежащем ядре после введения фенамина не только значительно увеличивается по сравнению с показателями до введения вещества, но и нарастает к 45-й минуте после его введения. Эти закономерности были найдены как по амплитуде, так и по длительности высвобождения дофамина. Необходимо отметить, что подкрепляющие свойства электрического раздражения при самостимуляции VTA после введения фенамина так же, как и высвобождение дофамина в прилежащем ядре не только значительно увеличиваются по сравнению с показателями до введения вещества, но и нарастают к 45-й минуте после его введения. Эти закономерности показаны по числу инструментальных реакций поднятия головы для получения внутримозгового подкрепления в режиме FR1 при фиксированной силе тока, превышающей пороговую для самостимуляции на 50%. Полученные данные во многом согласуются с данными литературы [29]. При этом в большинстве проведенных экспериментов описываются отдельные стороны настоящей работы, либо по изучению отдельно реакции самостимуляции, либо по изучению высвобождения дофамина с помощью быстросканирующей циклической вольтамперометрии. Показано, в частности, что активирующие эффекты ряда фармакологических веществ объясняются их способностью повышать уровень дофамина в прилежащем ядре [29]. Механизмы повышения уровня дофамина при этом различаются. Ранее считалось, что вещества психостимулирующего типа действия вызывают отток (efflux) дофамина [30]. Это независимый от потенциала действия неэкзоцитотический тип высвобождения опосредуется нарушением механизмов обратного захвата дофамина нейронами и связан с его истощением в синаптических везикулах [31]. В то же время накапливается все больше данных об участии потенциал-зависимых механизмов в действии психостимулирующих средств [32]. Фазические сигналы, генерируемые импульсным возбуждением дофаминовых нейронов, имеют решающее значение для обучения, связанного с вознаграждением, и опосредуют действие веществ на систему положительного подкрепления [33].
Подобные эффекты были описаны для внутрибрюшинного введения фенамина [32]. Он напрямую действует на везикулярный транспортер моноаминов, что приводит к нарушению обратного транспорта дофамина [34]. Механизм его действия также зависит от дозы вещества. В малой дозе, которая использовалась в настоящей работе, блокада обратного транспорта дофамина преобладает, при этом отток дофамина играет второстепенную роль из-за ограниченного уровня дофамина в цитозоле. Отток дофамина преобладает при введении умеренных и высоких доз вещества, когда дофамин перераспределяется из везикулярных пулов в цитозольные [35]. Известно, что наибольший эффект на положительную систему подкрепления при самостимуляции наблюдается при использовании низких доз (0.5–1.5 мг/кг внутрибрюшинно), а средние и высокие его дозы вызывают стереотипию [36].
Таким образам, в настоящем исследовании было показано, что стимуляция зон положительного подкрепления у наркотизированных животных вызывает стабильные, продолжительные эффекты фазического высвобождения дофамина, и после введения непрямого адреномиметика фенамина активация высвобождения дофамина соответствует по времени изменениям параметров самостимуляции, наблюдаемым после введения вещества. Кроме того, объединение метода FSCV и метода самостимуляции позволяет более четко и надежно, под контролем регистрации выброса дофамина, локализовать стимулирующий электрод в VTA. Это дает основание для применения данного метода, состоящего из двух экспериментов: 1) регистрация высвобождения дофамина с помощью быстросканирующей циклической вольтамперометрии у наркотизированных животных и 2) исследование реакции самостимуляции. Такой подход также имеет перспективы для стандартизации протоколов оценки действия сенсорных и фармакологических агентов на дофамин-зависимые формы поведения.
Список литературы
Olds J, Milner P (1954) Positive reinforcement produced by electrical stimulation of septal area and other regions of rat brain. J Comp Physiol Psychol 47(6): 419−427. https://doi.org/10.1037/h0058775
Carlezon WA, Chartoff EH (2007) Intracranial self-stimulation(ICSS) in rodents to study the neurobiology of motivation. Nat Protoc 2(11): 2987−2995. https://doi.org/10.1038/nprot.2007.441
Lebedev AA, Bessolova YN, Efimov NS, Bychkov ER, Droblenkov AV, Shabanov PD (2020) Role of orexin peptide system in emotional overeating induced by brain reward stimulation in fed rats. Res Results Pharmacol 6(1): 81−91. https://doi.org/10.3897/rrpharmacology6.52180
Phillips AG, Fibiger HC (1978) The role of dopamine in maintaining intracranial self-stimulation in the ventral tegmentum, nucleus accumbens and medial prefrontal cortex. Can J Psychol 32(2): 58−66. https://doi.org/10.1037/h0081676
Бычков ЕР, Лебедев АА, Ефимов НС, Крюков АС, Карпова ИВ, Пюрвеев СС, Дробленков АВ, Шабанов ПД (2020) Особенности вовлечения дофаминергической и серотонинергической систем мозга в положительные и отрицательные эмоциональные состояния у крыс. Обзоры клин фармакол лекарств терапии 18(2):123−130. [Bychkov ER, Lebedev AA, Efimov NS, Kryukov AS, Karpova IV, Pyurveev SS, Droblenkov AV, Shabanov PD (2020) Features of the involvement of the dopaminergic and serotonergic systems of the brain in positive and negative emotional states in rats. Obzory klin farmakol lekarstv terapii18 (2): 123−130. (In Russ)]. https://doi.org/10.7816/RCF182123-130
Wise RA (1996) Addictive drugs and brain stimulation reward. Annu Rev Neurosci 19: 319−340. https://doi.org/10.1146/annurev.ne.19.030196.001535
Лебедев АА, Шабанов ПД (1992) Сопоставление реакции самостимуляции и условного предпочтения места при введении фенамина у крыс. Журн высш нервн деятельн им ИП Павлова 42(4): 692−698. [Lebedev AA, Shabanov PD (1992) Comparison of the reaction of self-stimulation and conditional preference of place after administration of phenamine in rats. Zhurn vysshey nervn deyatel’n IP Pavlova 42 (4): 692−698. (In Russ)].
Corbett D, Wise RA (1980) Intracranial self-stimulation in relation to the ascending dopaminergic systems of the midbrain: amoveable electrode mapping study. Brain Res 185(1): 1−15. https://doi.org/10.1016/0006-8993(80)90666-6
Steinberg EE, Boivin JR, Saunders BT, Witten IB, Deisseroth K, Janak PH (2014) Positive reinforcement mediated by midbrain dopamine neurons requires D1 and D2 receptor activation in the nucleus accumbens. PLoS One 9 e94771. https://doi.org/10.137/journal.pone.0094771
Yeomans JS, Maidment NT, Bunney BS (1988) Excitability properties of medial forebrain bundle axons of A9 and A10 dopamine cells. Brain Res 450(1–2): 86−93. https://doi.org/10.1016/0006-8993(88)91547-8
Sombers LA, Beyene M, Carelli RM, Wightman RM (2009) Synaptic overflow of dopamine in the nucleus accumbens arises from neuronal activity in the ventral tegmental area. J Neurosci 29(6): 1735−1742. https://doi.org/10.1523/JNEUROSCI.5562-08.2009
Shabanov PD, Lebedev AA (2013) Involvement of GABA- and dopaminergic mechanisms of the bed nucleus of the stria terminalis in the reinforcing effects of psychotropic substances mediated via the lateral hypothalamus Neurosci Behav Physiol 43(4): 485−491. https://doi.org/10.1007/s11055-013-9759-3
Fiorino DF, Coury A, Fibiger HC, Phillips AG (1993) Electrical stimulation of reward sites in the ventral tegmental area increases dopamine transmission in the nucleus accumbens of the rat. Behav Brain Res 55(2): 131−141. https://doi.org/10.1016/0166-4328(93)90109-4
Garris PA, Kilpatrick M, Bunin MA, Michael D, Walker QD, Wightman RM (1999) Dissociation of dopamine release in the nucleus accumbens from intracranial self-stimulation. Nature 398(6722): 67−69. https://doi.org/10.1038/18019
Keithley RB, Carelli RM, Wightman RM (2010) Rank estimation and the multivariate analysis of in vivo fast-scan cyclic voltammetric data. Anal Chem 82(13): 5541−5551. https://doi.org/10.1021/ac100413t
Rodeberg NT, Johnson JA, Bucher ES, Wightman RM (2016) Dopamine dynamics during continuous intracranial self-stimulation: effect of waveform on fast-scan cyclic voltammetry data. ACS Chem Neurosci 7(11): 1508–1518. https://doi.org/10.1021/acschemneuro.6b00142
Paxinos G, Watson C (1998) The rat brain in stereotaxic coordinate. 4-th ed. Paxinos G, Watson C (eds). Sydney, Orlando, San Diego, New-York, Austin, London, Montreal, Toronto. Acad Press.
Шабанов ПД, Лебедев АА, Мещеров ШК (2002) Дофамин и подкрепляющие системы мозга. Санкт-Петербург. [Shabanov PD, Lebedev AA, Mescherov ShK (2002) Dopamine and the reinforcing systems of the brain. Saint Petersburg. (In Russ)].
Мухин ВН, Сизов ВВ, Павлов КИ, Клименко ВМ (2017) β-амилоид 25—35 подавляет секреторную активность дофаминергических систем мозга крыс. Рос физиол журн им ИМ Сеченова 103(12): 1350—1360. [Mukhin VN, Sizov VV, Pavlov KI, Klimenko VM (2017) β-amyloid 25-35 suppresses the secretory activity of the dopaminergic systems of the rat brain. Russ J Physiol 103(12): 1350−1360. (In Russ)].
Mena S, Dietsch S, Berger SN, Witt CE, Novel PH (2021) User-friendly experimental and analysis strategies for fast voltammetry: the Analysis Kid for FSCV. ACS Meas 1(1): 11–19.
Fibiger HC, LePiane FG, Jakubovic A, Phillips AG (1987) The role of dopamine in intracranial self-stimulation of the ventral tegmental area. J Neurosci 7(12): 3888–3896. https://doi.org/10.1523/JNEUROSCI.07-12-03888.1987
Petrov ES, Lebedev AA (1997) Dopamine and the reinforcing system of the brain. Neurosci Behav Physiol 27(3): 309−311.
Smith KS, Tindell AJ, Wayne AJ, Berridge KC (2009) Ventral pallidum roles in reward and motivation. Behav Brain Res 196(2): 155–167. https://doi.org/10.1016/j.bbr.2008.09.038
Шевелева МВ, Лебедев АА, Роик РО, Шабанов ПД (2013) Нейробиологические механизмы систем награды и наказания в головном мозге при активации прилежащего ядра. Обзоры клин фармакол лекарств терапии 11(3): 3−19. [Sheveleva MV, Lebedev AA, Roik RO, Shabanov PD (2013) Neurobiological mechanisms of reward and punishment systems in the brain upon activation of the nucleus accumbens. Obzory klin farmakol lekarstv terapii 11(3): 3−19. (In Russ)].
Tran AH, Tamura R, Teruko U, Kobayashi T, Katsuki M, Taketoshi O (2005) Dopamine D1 receptors involved in locomotor activity and accumbens neural responses to prediction of reward associated with place. Proc Natl Acad Sci U S A 102(6): 2117–2122. https://doi.org/10.1073/pnas.0409726102
Cheer JF, Wassum KM, Heien ML, Phillips PE, Wightman RM (2004) Cannabinoids enhance subsecond dopamine release in the nucleus accumbens of awake rats. J Neurosci 24(18): 4393–4400. https://doi.org/10.1523/JNEUROSCI.0529-04.2004
Yavich L, Tiihonen J (2000) Patterns of dopamine overflow in mouse nucleus accumbens during intracranial self-stimulation. Neurosci Lett 293(1):41−44. https://doi.org/10.1016/s0304-3940(00)01484-1
Covey DP, Bunner KD, Schuweiler D R, Cheer JF, Garris PA (2000) Amphetamine elevates nucleus accumbens dopamine via an action potential-dependent mechanism that is modulated by endocannabinoids. Eur J Neurosci 43(12):1661−1673. https://doi.org/10.1016/s0304
Nestler EJ (2005) Is there a common molecular pathway for addiction? Nat Neurosci 8(11):1445−1449. https://doi.org/10.1038/nn1578
Seiden LS, Sabol KE, Ricaurte GA (1993) Amphetamine: effects on catecholamine systems and behavior. Annu Rev Pharmacol Toxicol 33: 639– 677. https://doi.org/10.1146/annurev.pa.33.040193.003231
Sulzer D (2011) How addictive drugs disrupt presynaptic dopamine neurotransmission. Neuron 69(4): 628–649. https://doi.org/10.1016/j.neuron.2011.02.010
Daberkow DP, Brown HD, Bunner KD, Kraniotis SA, Doellman MA, Ragozzino ME, Garris PA, Roitman MF (2013) Amphetamine paradoxically augments exocytotic dopamine release and phasic dopamine signals. J Neurosci 33(2): 452−463. https://doi.org/10.1523/JNEUROSCI.2136-12.2013
Hamid AA, Pettibone JR, Mabrouk OS, Hetrick VL, Schmidt R, Vander Weele CM, Kennedy RT, Aragona BJ, Berke JD (2016) Mesolimbic dopamine signals the value of work. Nature Neurosci 19(1): 117–126. https://doi.org/10.1038/nn.4173
Rothman RB, Baumann MH (2003) Monoamine transporters and psychostimulant drugs. Eur J Pharmacol 479(1-3): 23–40. https://doi.org/10.1016/j.ejphar.2003.08.054
Sulzer D (2011) How addictive drugs disrupt presynaptic dopamine neurotransmission. Neuron 69(4): 628−649. https://doi.org/10.1016/j.neuron.2011.02.010
Kafkafi N, Levi-Havusha S, Golani I, Benjamini Y (1996) Coordination of side-to-side head movements and walking in amphetamine-treated rats: A stereotyped motor pattern as a stable equilibrium in a dynamical system. Biol Cybern 74(6):487−495. https://doi.org/10.1007/BF00209420
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


