Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1426-1441
Уровни инсулина и лептина в крови и структурах мозга крыс с диета-индуцированным ожирением и влияние на них различных фармакологических препаратов
К. В. Деркач 1, *, В. Н. Сорокоумов 2, А. А. Бахтюков 1, В. М. Бондарева 1, А. О. Шпаков 1, 3
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Институт химии, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Медицинский факультет, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: derkatch_k@list.ru
Поступила в редакцию 10.08.2022
После доработки 01.09.2022
Принята к публикации 27.09.2022
- EDN: SSNJRU
- DOI: 10.31857/S0869813922110024
Аннотация
При ожирении инсулиновые и лептиновые пути в мозге и периферических тканях ослабляются. В мозге одной из причин этого является нарушение транспорта инсулина и лептина через гематоэнцефалический барьер (ГЭБ), показателем чего является изменение соотношения их концентраций в кровотоке и в структурах мозга. Однако такие изменения при ожирении и влияние на них фармакологических препаратов практически не изучены. Цель работы состояла в оценке уровней инсулина и лептина в структурах мозга (гипоталамусе, мозжечке) и их соотношений с таковыми в крови у самцов крыс с ожирением, вызванным длительной комбинированной высококалорийной диетой, а также в изучении влияния на эти показатели 4-недельного лечения крыс с ожирением с помощью метформина (200 мг/кг/сутки), бромокриптина (0.6 мг/крысу/сутки) и интраназально вводимым инсулином (ИВИ) (0.5 МЕ/крысу/сутки) и их двухнедельной обработки PI4, ингибитором фосфатазы 1B (PTP1B) (10 мг/кг/сутки). Показано, что при ожирении на фоне гиперинсулинемии и гиперлептинемии ослабляется транспорт инсулина и лептина через ГЭБ в гипоталамус и мозжечок, что приводит к значительному возрастанию соотношений концентрации этих гормонов в крови и структурах мозга. Лечение метформином не только нормализовало метаболические показатели и чувствительность к инсулину и лептину, но и в полной мере восстанавливало уровни инсулина и лептина в мозге. Лечение ИВИ и бромокриптином было менее эффективным. Обработка PI4 вызывала значительное снижение массы тела и жировой ткани у крыс с ожирением, уменьшала потребление ими пищи, улучшала метаболические показатели и повышала чувствительность к инсулину и лептину. Ингибитор PTP1B также восстанавливал соотношение концентраций инсулина и лептина в крови и структурах мозга, но не вследствие повышения их уровня в мозге, как в случае метформина, а в результате значительного снижения концентраций гормонов в крови. Полученные данные указывают на то, что лечение различными по химической природе и механизмам действия препаратами, улучшающими метаболические и гормональные показатели при ожирении, приводит к нормализации соотношения инсулина и лептина на периферии и в ЦНС, восстанавливая, тем самым, инсулиновый и лептиновый сигналинг в гипоталамусе и других отделах мозга и центральную инсулиновую и лептиновую регуляцию метаболических процессов на периферии.
Характерными особенностями ожирения, а также ассоциированных с ним метаболического синдрома и сахарного диабета 2-го типа являются развитие резистентности тканей-мишеней к инсулину (ИР) и лептину (ЛР) и, как следствие, обусловленное этим нарушение регуляции множества физиологических и биохимических процессов [1, 2]. В условиях снижения чувствительности тканей к инсулину и лептину компенсаторно повышается продукция инсулина β-клетками поджелудочной железы и лептина адипоцитами жировой ткани, что приводит к гиперинсулинемии и гиперлептинемии. Мишенями инсулина и лептина у человека и животных являются не только периферические ткани, но и мозг, в первую очередь гипоталамические структуры, через которые эти гормоны осуществляют центральную регуляцию метаболизма, контролируют функции нервной, эндокринной и других систем организма [3–5]. В гипоталамических нейронах имеются все основные компоненты инсулиновой и лептиновой систем, включая инсулиновые рецепторы (преимущественно нейрональная форма) и полноразмерные лептиновые рецепторы ObRb [3]. При этом лептин в ЦНС не синтезируется и поступает к структурам мозга только из кровотока, посредством рецептор-опосредуемого эндоцитоза, в то время как инсулин в мозге может синтезироваться только на ранних стадиях развития, а во взрослом состоянии поступает в основном или исключительно с периферии, путем трансцитоза с участием инсулиновых рецепторов [6–8]. Вследствие этого активность регулируемых инсулином и лептином сигнальных систем в гипоталамусе и других отделах мозга в значительной степени определяется эффективностью их транспорта через гематоэнцефалический барьер (ГЭБ) из кровотока.
Нами ранее было продемонстрировано снижение содержания лептина в гипоталамусе у крыс с диета-индуцированным ожирением и у агути-мышей с генетически-обусловленным ожирением, несмотря на значительное повышение его концентрации в крови [9, 10]. Нарушение транспорта лептина в мозг было показано и другими авторами на моделях ожирения у мышей [11–13]. На фоне выраженной гиперинсулинемии у агути-мышей нами было обнаружено снижение в гипоталамусе содержания инсулина [10]. Помимо нашего исследования имеется лишь одна работа, авторы которой продемонстрировали снижение уровня инсулина в цереброспинальной жидкости крыс с диабетом 2-го типа [14]. Уровень инсулина в гипоталамусе и других структурах мозга при диета-индуцированном ожирении до настоящего времени не изучался. Улучшение транспорта инсулина и лептина через ГЭБ может рассматриваться как один из перспективных путей для нормализации инсулинового и лептинового сигналинга в гипоталамусе при метаболических расстройствах. Однако исследования влияния различных фармакологических препаратов, используемых для улучшения чувствительности тканей к инсулину и лептину, на их транспорт через ГЭБ и на соотношение концентраций инсулина и лептина на периферии и в мозге отсутствуют.
Основываясь на вышесказанном, целью работы было изучить соотношение уровней инсулина и лептина в крови, гипоталамусе и мозжечке самцов крыс с ожирением, вызванным длительной высококалорийной диетой, и оценить влияние на него лечения животных метформином, интраназально вводимым инсулином (ИВИ), бромокриптином и этил 3-(гидроксиметил)-4-оксо-1,4-дигидроциннолин-6-карбоксилатом (PI4), ингибитором протеинфосфотирозинфосфатазы 1B (PTP1B). Выбор препаратов был обусловлен следующими фактами (рис. 1). Метформин, который применяется для лечения сахарного диабета 2-го типа, ожирения и метаболического синдрома, в значительной степени повышает чувствительность тканей к инсулину и лептину, нормализуя, тем самым, углеводный и липидный обмен [15, 16]. Синтезированное и изученное нами ранее соединение PI4 посредством ингибирования активности фосфатазы PTP1B, негативного регулятора инсулинового и лептинового сигналинга, ослабляет ИР и ЛР, подавляет потребление пищи и снижает массу тела, что указывает на его перспективность для коррекции ожирения и других метаболических расстройств [17]. С этой целью в настоящее время разрабатываются и другие классы ингибиторов PTP1B [18–20]. ИВИ, минуя ГЭБ, восполняет дефицит инсулина в мозге и, тем самым, активирует инсулиновые сигнальные пути и опосредованно влияет на лептиновую сигнализацию, которая в гипоталамусе положительно ассоциирована с инсулиновыми сигнальными путями [3, 21, 22]. При ожирении D2-дофаминовая сигнализация в ЦНС, в том числе в гипоталамусе, ослабляется, вследствие чего для ее компенсации может быть использована терапия D2-агонистом бромокриптином [3, 23]. Лечение пациентов с диабетом 2-го типа с помощью бромокриптина нормализует массу тела и улучшает глюкозный гомеостаз, что связывают с улучшением чувствительности к инсулину и лептину [24, 25], причем такое лечение наиболее эффективно при наличии у пациентов ожирения и сердечно-сосудистых дисфункций [26]. Наряду с уровнями инсулина и лептина в крови и структурах мозга мы оценивали влияние избранных для изучения препаратов на массу тела и жировой ткани, пищевое поведение, глюкозный гомеостаз, уровни липидов, стимулированные глюкозой уровни инсулина и лептина, а также на генную экспрессию рецепторов инсулина и лептина и фермента PTP1B в гипоталамусе. Выбор мозжечка был обусловлен необходимостью оценить изменение транспорта инсулина и лептина через ГЭБ не только в гипоталамусе, но и в других отделах мозга, чтобы исключить трактовку выявленных изменений как специфичных только для гипоталамуса.
Рис. 1.
Мишени действия метформина, интраназально вводимого инсулина, бромокриптина и PI4, ингибитора PTP1B, и их возможное влияние на инсулиновый и лептиновый сигналинг в гипоталамусе при ожирении.

МЕТОДЫ ИССЛЕДОВАНИЯ
Все эксперименты, включающие уход за животными, их использование для изучения метаболических и гормональных показателей, а также лечение с помощью фармакологических препаратов осуществляли в строгом соответствии с требованиями Этического комитета ИЭФБ РАН (протокол № 05-04/2021 от 27.04.2021 г.), European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
В экспериментах использовали самцов крыс Вистар, которых содержали в стандартных условиях вивария. Ожирение вызывали переводом животных на 26-й день после рождения (P26) на комбинированную высококалорийную диету. Она включала потребление насыщенных жиров в виде маргарина (5–7 г маргарина/крысу/сутки, в зависимости от возраста) как дополнение к стандартному сухому корму и потребление 30%-ного раствора сахарозы вместо питьевой воды. Контрольные крысы потребляли стандартный сухой корм и обычную воду. Крысы экспериментальных групп находились на диете в течение трех с половиной месяцев, после чего их тестировали, отбирая животных с повышенной массой тела (на 10% выше среднего значения в контрольной группе), повышенным уровнем постпрандиальной глюкозы (на 25% выше среднего значения в контрольной группе), а также с нарушенной толерантностью к глюкозе, которую оценивали с помощью интраперитонеального глюкозотолерантного теста (ИГТТ). При проведении ИГТТ крысам в/б вводили раствор глюкозы из расчета 2 г/кг и измеряли уровень глюкозы в крови до и через 15, 30, 60 и 120 мин после нагрузки. По результатам ИГТТ рассчитывали интегрированную площадь под глюкозной концентрационной кривой (AUC0–120), которая у крыс, отобранных для дальнейших исследований, была не менее чем на 10% выше средних значений в контрольной группе.
Отобранных животных с ожирением случайным образом делили на 5 групп (в каждой по 6 животных): крысы с ожирением без лечения (ОЖ), крысы с ожирением, леченные в течение 4 нед. метформином (200 мг/кг/сутки, перорально) (ОЖ + МФ), инсулином (0.5 МЕ/крысу, интраназально) (ОЖ + ИВИ) и бромокриптином (0.6 мг/кг/сутки, перорально) (ОЖ + БК), а также крысы с ожирением, обрабатываемые в течение двух недель этил 3-(гидроксиметил)-4-оксо-1,4-дигидроциннолин-6-карбоксилатом (PI4, 10 мг/кг/сутки, в/б) (ОЖ + PI4). Выбор используемых доз препаратов был основан на результатах предварительных экспериментов и наших предыдущих исследований [17, 23, 27–29]. Соединение PI4 было синтезировано с помощью реакции Соногаширы, катализируемой ациклическими диаминокарбеновыми комплексами палладия (II), и реакции Рихтера, используемой для формирования циннолинового ядра, как описано ранее [17]. Структура соединения PI4 была доказана с помощью ЯМР-спектроскопии и масс-спектрометрии высокого разрешения: 1) 1H-ЯМР (400 MHz, DMSO-d6), δ: 13.56 (s, 1H), 8.61 (d, J = 1.8 Hz, 1H), 8.22 (dd, J = 8.9, 1.9 Hz, 1H), 7.66 (d, J = 8.8 Hz, 1H), 5.00 (s, 1H), 4.54 (s, 2H), 4.36 (q, J = 7.1 Hz, 2H), 1.36 (t, J = 7.1 Hz, 3H); 2) 13C-ЯМР (101 MHz, DMSO), δ: 170.08, 165.28, 150.90, 143.77, 133.38, 126.92, 125.61, 121.45, 117.56, 61.55, 58.99, 14.63; 3) масс-спектрометрия (C12H12N2O4) [M + H] + = 249.0883.
Лечение препаратами начинали через две недели после тестирования и распределения крыс на группы, в случае PI4 – через 4 нед., при этом до и во время лечения продолжая содержать крыс на высококалорийной диете. В день, когда животных декапитировали, лечение препаратами не проводили. Контрольным крысам в/б вводили физиологический раствор. В процессе лечения оценивали массу тела животных и потребление корма (в килокалориях). За 3 дня до окончания эксперимента проводили ИГТТ, оценивая чувствительность к глюкозе, базовые и стимулированные глюкозой уровни инсулина и лептина, а также уровень гликированного гемоглобина. Образцы крови для определения уровней липидов и свободных жирных кислот забирали непосредственно перед декапитацией. Забор крови из хвостовой вены осуществляли в условиях местной анестезии, для которой использовали раствор лидокаина (из расчета 2–4 мг/кг).
В конце эксперимента крыс наркотизировали хлоральгидратом (400 мг/кг, в/б), декапитировали, забирали образцы тканей гипоталамуса и мозжечка, которые тщательно отмывали от крови и тканевой жидкости, после чего их использовали для определения гормонов и, в случае гипоталамуса, для оценки экспрессии целевых генов. Уровни глюкозы в крови, в том числе при проведении ИГТТ, оценивали с помощью тест-полосок “One Touch Select” (США) и глюкометра (“Life Scan Johnson & Johnson”, Дания). Уровни инсулина и лептина в крови и образцах тканей гипоталамуса и мозжечка измеряли с помощью ИФА-наборов “Rat Insulin ELISA” (“Mercodia”, Швеция) и “ELISA for Leptin, Rat” (“Cloud-Clone Corp.”, США), как описано ранее [10]. Уровень свободных жирных кислот (СЖК) измеряли с помощью набора “NEFA FS kit” (“DiaSys”, Германия), содержание гликированного гемоглобина – с помощью набора “Multi Test HbA1c System kit” (“Polymer Technology Systems”, США), концентрацию триглицеридов и общего холестерина – с помощью тест-полосок “Triglycerides multiCare-in” и “Cholesterol multiCare-in” (“Biochemical Systems Int.”, Италия).
Для определения содержания лептина и инсулина в гипоталамусе и мозжечке образцы тканей гомогенизировали в соотношении 1 : 10 в лизирующем буфере, содержащем 20 мМ Tris-HCl (рН 7.5), 150 мМ хлорида натрия, 2 мМ ЭДТА, 2 мМ ЭГТА, 0.25 М сахарозы, 0.5% Triton X-100, 0.5% дезоксихолата натрия, 15 мМ фторида натрия, 10 мМ глицерофосфата натрия, 10 мМ пирофосфата натрия, 1 мМ ортованадата натрия, 1 мМ фенилметилсульфонилфторида, 0.02% азида натрия и коктейль ингибиторов протеаз (“Sigma-Aldrich”, США). Полученные гомогенаты центрифугировали (10 000 g, 5 мин) и измеряли концентрацию лептина и инсулина в надосадочной жидкости согласно инструкции производителя, как описано нами ранее [10].
Экспрессию мРНК для генов, кодирующих рецептор инсулина (InsR) и полноразмерную форму рецептора лептина (ObRb), а также фермент фосфатазу PTP1B (Ptp1b) осуществляли с помощью ПЦР в реальном времени, Для этого из ткани гипоталамуса выделяли тотальную РНК с помощью реагента Extract RNA (“Evrogen”, Россия). Обратную транскрипцию проводили с использованием набора “MMLV RT Kit” (“Evrogen”, Россия), экспрессию оценивали с помощью амплификатора 7500 Real-Time PCR System (“Thermo Fisher Scientific Inc.”, США). Для оценки экспрессии генов в гипоталамусе крыс использовали следующие праймеры: для гена InsR – CTGGAGAACTGCTCGGTCATT (For) и GGCCATAGACACGGAAAAGAAG (Rev), для гена ObRb – GCATGCAGAATCAGTGATATTTGG (For) и CAAGCTGTATCGACACTGATTTCTTC (Rev), для гена Ptp1b – CAACCGAGGAGGAACAAAAGG (For) и CAGTCTGTCAGTGAAAACATACCCG (Rev). В качестве референсных использовали ген 18S RNA и ген, кодирующий β-актин (Actb). Результаты анализировали методом ΔΔСt и с использованием программного обеспечения 7500 Software v2.0.6 и Expression Suite Software v1.0.3. Значения RQ рассчитывали по отношению к контрольной группе животных, как описано ранее [27].
Статистический анализ полученных данных осуществляли с помощью программы “Microsoft Office Excel 2007”. Результаты представляли как среднее ± стандартная ошибка среднего (M ± SEM). Нормальность распределения оценивали с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Достоверными считали различия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У крыс группы “ОЖ”, наряду со значительным повышением массы тела и жировой ткани, отмечали повышение уровней триглицеридов и общего холестерина (табл. 1). Уровень гликированного гемоглобина в группе “ОЖ” имел тенденцию к повышению, но значимо от контроля не отличался (p = 0.056). У крыс с ожирением была нарушена толерантность к глюкозе, о чем свидетельствует более высокое расположение концентрационной кривой для глюкозы в ИГТТ в сравнении с контрольными крысами, а также повышенные значения уровня глюкозы через 120 мин после глюкозной нагрузки и показателя AUC0–120 для глюкозных кривых в ИГТТ (рис. 2). В группе “ОЖ” были повышены в сравнении с контролем уровни инсулина и лептина, как базовые, так и стимулированные глюкозой, а также рассчитанные индексы ИР как до, так и через 120 мин после глюкозной нагрузки (рис. 3). Одной из причин метаболических и гормональных расстройств является повышенное потребление крысами группы “ОЖ” высококалорийной пищи (табл. 1).
Таблица 1.
Масса тела и жировой ткани, потребление корма, уровни постпрандиальной глюкозы, гликированного гемоглобина и липидов у крыс с ожирением, а также влияние на эти показатели обработки метформином, интраназальным инсулином, бромокриптином и PTP1B-ингибитором PI4
| Параметр | К | ОЖ | ОЖ + МФ | ОЖ + ИВИ | ОЖ + БК | ОЖ + PI4 |
|---|---|---|---|---|---|---|
| Масса, г | 373.2 ± 10.4 | 427.0 ± 9.3* | 381.8 ± 9.5# | 405.2 ± 11.2 | 403.8 ± 9.6 | 367.3 ± 12.9# |
| Масса АЖ, г | 5.5 ± 0.2 | 11.8 ± 1.0* | 7.2 ± 0.6# | 9.9 ± 0.6* | 9.3 ± 0.5* | 6.1 ± 0.4# |
| Масса ЭЖ, г | 3.6 ± 0.2 | 6.1 ± 0.6* | 3.9 ± 0.2# | 5.3 ± 0.3* | 5.3 ± 0.6* | 3.2 ± 0.2# |
| Доля жира, % | 2.4 ± 0.1 | 4.2 ± 0.3* | 2.9 ± 0.2# | 3.7 ± 0.1* | 3.6 ± 0.2* | 2.5 ± 0.1# |
| Корм, ккал/крысу/ день | 78.3 ± 4.7 | 110.3 ± 4.4* | 87.0 ± 3.2# | 102.3 ± 3.6* | 102.8 ± 2.8* | 54.8 ± 2.6*# |
| Глюкоза, мМ | 3.92 ± 0.06 | 5.07 ± 0.28* | 4.43 ± 0.36 | 4.43 ± 0.48 | 4.90 ± 0.32 | 4.62 ± 0.31 |
| HbA1c, % | 4.05 ± 0.15 | 4.75 ± 0.32 | 4.23 ± 0.17 | 4.37 ± 0.22 | 4.35 ± 0.29 | 3.75 ± 0.22 |
| ТГ, мМ | 2.02 ± 0.08 | 3.13 ± 0.27* | 2.25 ± 0.11# | 2.40 ± 0.21 | 2.82 ± 0.12* | 1.93 ± 0.16# |
| ОХ, мМ | 4.08 ± 0.17 | 5.15 ± 0.26* | 4.45 ± 0.27 | 4.88 ± 0.28 | 5.32 ± 0.27* | 4.85 ± 0.16* |
| СЖК, мМ | 3.58 ± 0.14 | 4.63 ± 0.35 | 3.45 ± 0.16# | 3.83 ± 0.19 | 4.27 ± 0.22 | 3.25 ± 0.16# |
Рис. 2.
Глюкозные концентрационные кривые в ИГТТ (a) и значения AUC0–120 для этих кривых (b) у крыс с ожирением и влияние на них обработки животных метформином, ИВИ, бромокриптином и PTP1B-ингибитором PI4. Обозначения групп: C – “К”, OB – “ОЖ”, OB + MF – “ОЖ + МФ”, OB + I-I – “ОЖ + ИВИ”, OB + BC – “ОЖ + БК”, OB + PI4 – “ОЖ + PI4". Для AUC0–120 различия с контролем (*) и группой "ОЖ” (#) статистически значимы при p < 0.05. Данные представлены как M ± SEM, n = 6 в каждой группе.
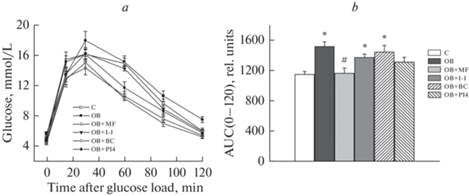
Рис. 3.
Уровни глюкозы, инсулина и лептина в крови до и через 120 мин после глюкозной нагрузки в ИГТТ, а также рассчитанные индексы ИР у крыс с ожирением и влияние на эти показатели обработки метформином, ИВИ, бромокриптином и PTP1B-ингибитором PI4. (a) – глюкоза, (b) – инсулин, (c) – индекс ИР, (d) – лептин. Обозначения групп: C – “К”, OB – “ОЖ”, OB + + MF – “ОЖ + МФ”, OB + I-I – “ОЖ + ИВИ”, OB + BC – “ОЖ + БК”, OB + PI4 – “ОЖ + PI4”. Значения индекса ИР рассчитаны, как произведение концентраций глюкозы и инсулина в крови перед нагрузкой глюкозой (ИР-0) или через 120 мин после нее (ИР-120). Различия с контролем (*) и группой “ОЖ” (#) статистически значимы при p < 0.05. Данные представлены как M ± SEM, n = 6 в каждой группе.
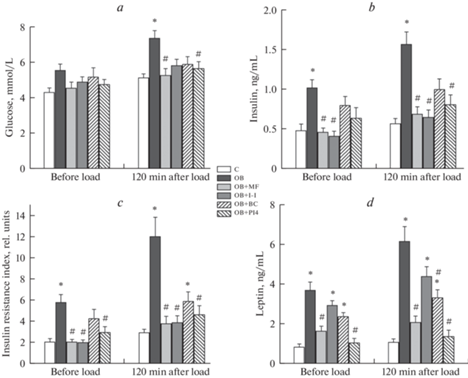
Лечение метформином в значительной степени нормализовало эти показатели, значимо снижая в сравнении с группой “ОЖ” массу тела и жировой ткани, долю жировой ткани, потребление корма, уровни триглицеридов, СЖК, инсулина и лептина, индекс ИР, а также улучшая чувствительность к глюкозе, о чем свидетельствует снижение уровня глюкозы через 120 мин после глюкозной нагрузки и значения AUC0–120 для глюкозных кривых до их уровня в контроле (табл. 1, рис. 2, 3). Лечение ИВИ и бромокриптином было менее эффективным, сравнительно слабо влияя на массу тела и жира и пищевое поведение, показатели липидного обмена и глюкозный гомеостаз (табл. 1, рис. 2, 3). В то же время ИВИ существенно ослаблял гиперинсулинемию и повышал чувствительность периферических тканей к инсулину, что иллюстрируется снижением в группе “ОЖ + ИВИ” в сравнении с группой “ОЖ” индекса ИР, как базового, так и через 120 мин после глюкозной нагрузки (рис. 3). Лечение бромокриптином значимо снижало глюкоза-стимулированный уровень лептина (рис. 3).
В группе “ОЖ + БК” также отмечали тенденцию к снижению в сравнении с группой “ОЖ” базового уровня лептина (p = 0.055), а также уровня инсулина (p = 0.069) и индекса ИР (p = 0.051) через 120 мин после нагрузки глюкозой (рис. 3). Двухнедельная обработка животных с помощью PI4, ингибитора PTP1B, вызывала резкое снижение потребления пищи (ниже такового в контроле), что приводило к значимому снижению массы тела, абдоминального и эпидидимального жира, адипозности, уровней триглицеридов и СЖК, уровней глюкозы, инсулина и лептина через 120 мин после глюкозной нагрузки, а также базового уровня лептина (табл. 1, рис. 3). Отмечали улучшение чувствительности к инсулину, о чем свидетельствует снижение значений индекса ИР, а также частичное восстановление толерантности к глюкозе, поскольку значение AUC0–120 для глюкозных кривых в группе “ОЖ + PI4” значимо не отличалось от такового в контроле (рис. 2, 3).
Сравнительное изучение содержания инсулина и лептина в крови и структурах мозга показало, что, несмотря на сильно выраженную системную гиперинсулинемию и гиперлептинемию, уровни инсулина и лептина в гипоталамусе и взятом для сравнения мозжечке не отличались от таковых в контроле, а в случае лептина в гипоталамусе даже достоверно снижались в сравнении с группой “К”, что указывает на ослабление транспорта этих гормонов через ГЭБ в условиях инсулиновой и лептиновой резистентности (табл. 2).
Таблица 2.
Содержание инсулина и лептина в крови, гипоталамусе и мозжечке крыс с ожирением и влияние на них обработки метформином, ИВИ, бромокриптином и PTP1B-ингибитором PI4
| Параметр | К | ОЖ | ОЖ + МФ | ОЖ + ИВИ | ОЖ + БК | ОЖ + PI4 |
|---|---|---|---|---|---|---|
| Инсулин, нг/мл (кровь) | 0.58 ± 0.08 | 1.18 ± 0.15* | 0.62 ± 0.11# | 0.51 ± 0.07# | 0.88 ± 0.13 | 0.59 ± 0.11# |
| Инсулин, нг/г (гипот.) | 1.30 ± 0.17 | 0.88 ± 0.07 | 1.15 ± 0.12 | 0.76 ± 0.10 | 1.03 ± 0.08 | 1.01 ± 0.06 |
| Инсулин, нг/г (мозж.) | 1.03 ± 0.13 | 0.61 ± 0.04 | 1.07 ± 0.13# | 0.63 ± 0.05 | 0.82 ± 0.07 | 0.92 ± 0.11 |
| Инсулин, кровь/гипот. | 0.44 ± 0.02 | 1.37 ± 0.19* | 0.52 ± 0.06# | 0.70 ± 0.09# | 0.93 ± 0.21 | 0.56 ± 0.08# |
| Инсулин, кровь/мозж. | 0.55 ± 0.02 | 1.90 ± 0.16* | 0.56 ± 0.06# | 0.81 ± 0.08*# | 1.13 ± 0.23 | 0.65 ± 0.09# |
| Лептин, нг/мл (кровь) | 0.85 ± 0.14 | 3.45 ± 0.38* | 1.64 ± 0.29# | 2.38 ± 0.28* | 2.12 ± 0.23* | 0.94 ± 0.19# |
| Лептин, нг/г (гип.) | 5.16 ± 0.48 | 3.38 ± 0.21* | 4.21 ± 0.29 | 3.70 ± 0.31 | 4.15 ± 0.43 | 3.10 ± 0.41* |
| Лептин, нг/г (мозж.) | 2.07 ± 0.15 | 1.57 ± 0.16 | 2.31 ± 0.22# | 1.84 ± 0.19 | 2.17 ± 0.15# | 1.67 ± 0.19 |
| Лептин, кровь/гипот. | 0.16 ± 0.02 | 1.03 ± 0.12* | 0.39 ± 0.08# | 0.67 ± 0.12* | 0.55 ± 0.10*# | 0.31 ± 0.05# |
| Лептин, кровь/мозж. | 0.40 ± 0.05 | 2.37 ± 0.44* | 0.73 ± 0.16# | 1.37 ± 0.25* | 1.00 ± 0.14* | 0.56 ± 0.09# |
Рассчитанное соотношение концентраций инсулина и лептина в крови и структурах мозга при ожирении было значимо выше, чем в контроле. Так, соотношение концентраций инсулина и лептина в крови и гипоталамусе в группе “ОЖ” было соответственно в 3.1 и 6.4 раза выше, чем в группе “К”. Лечение метформином нормализовало уровни инсулина и лептина как в крови, так и в структурах мозга, вследствие чего соотношение концентраций инсулина и лептина в крови и гипоталамусе или мозжечке было сходным с таковым для контрольных животных и значимо снижалось в сравнении с группой “ОЖ” (табл. 2). ИВИ был в этом отношении менее эффективен, и соотношение инсулина в крови и мозжечке и лептина в крови и обеих структурах мозга оставалось значимо выше, чем в контроле (табл. 2). Лечение бромокриптином в большей степени влияло на уровни лептина, так что соотношение концентраций этого адипокина в крови и гипоталамусе было значимо ниже, чем в группе “ОЖ”, а для соотношения уровней лептина в крови и мозжечке отмечалась тенденция к снижению этого показателя (p = 0.057). Однако в обоих случаях сохранялись значимые различия от контрольной группы (табл. 2). Ингибитор PTP1B восстанавливал соотношение концентраций инсулина и лептина в крови и структурах мозга, но не вследствие их нормализации в ЦНС, а в результате значительного снижения концентрации этих гормонов в крови (табл. 2). Так, например, уровни лептина в группе “ОЖ + PI4” в мозге были сходными с таковыми в группе “ОЖ”, в то время как соотношение концентраций лептина в крови и гипоталамусе или мозжечке были снижены соответственно в 3.3 и 4.2 раза.
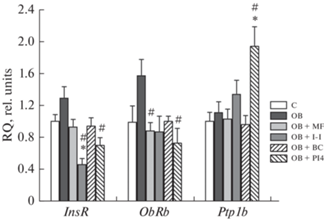
Оценка экспрессии генов, кодирующих инсулиновый (InsR) и лептиновый рецепторы (ObRb) в гипоталамусе крыс с ожирением, показала тенденцию к ее возрастанию в группе “ОЖ”, но различия с контролем не были значимыми. В случае экспрессии гена PTP1B (Ptp1b) различия между группами “К” и “ОЖ” отсутствовали (рис. 4). При лечении ИВИ и PI4 отмечали значимое снижение экспрессии гена InsR по сравнению с группой “ОЖ”, в то время как при лечении метформином и PI4 – значимое снижение экспрессии гена ObRb. В группе “ОЖ + ИВИ” экспрессия гена InsR оказалась ниже ее уровня в контроле (рис. 4). Экспрессия гена Ptp1b существенно не менялась в группе “ОЖ” и в группах с обработкой метформином, ИВИ и бромокриптином, но в два раза повышалась в группе с лечением PI4 (рис. 4).
Рис. 4.
Экспрессия генов рецептора инсулина (InsR), полноразмерного рецептора лептина (ObRb) и фосфатазы PTP1B (Ptp1b) в гипоталамусе крыс с ожирением и влияние на нее обработки животных метформином, ИВИ, бромокриптином и PTP1B-ингибитором PI4. Обозначения групп: C – “К”, OB – “ОЖ”, OB + MF – “ОЖ + МФ”, OB + I-I – “ОЖ + ИВИ”, OB + BC – “ОЖ + БК”, OB + PI4 – “ОЖ + PI4”. Различия с контролем (*) и группой “ОЖ” (#) статистически значимы при p < 0.05. Данные представлены как M ± SEM, n = 6 в каждой группе.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Длительная, в течение 4.5 мес. высококалорийная диета приводила к развитию у крыс ожирения и отчетливо выраженных признаков метаболического синдрома – дислипидемии, постпрандиальной гипергликемии, нарушенной толерантности к глюкозе, гиперинсулинемии и гиперлептинемии. Это хорошо согласуется с нашими ранними результатами и данными других авторов об индукции ожирения и широкого спектра метаболических и гормональных расстройств при потреблении корма, обогащенного легкими углеводами и насыщенными жирами [9, 30, 31].
При ожирении, метаболическом синдроме и сахарном диабете 2-го типа функциональная активность инсулиновых и лептиновых сигнальных путей в мозге существенно снижена, что и является одним из молекулярных механизмов развития широкого спектра функциональных нарушений в ЦНС и на периферии, и, по мнению значительного числа исследователей, обусловлено развитием центральной инсулиновой и лептиновой резистентности [32–35]. При этом одной из первопричин развития ИР и ЛР в мозге и на периферии, как правило, является длительное и значительное повышение уровней инсулина и лептина [2]. Однако проведенная нами оценка уровня инсулина и лептина в гипоталамусе и взятом для сравнения мозжечке у крыс с ожирением показала, что уровень этих гормонов, в отличие от такового в крови, не превышает таковой в контроле и даже имеет тенденцию к снижению. Это влечет за собой многократное повышение соотношений между концентрациями инсулина и лептина в крови и исследованных структурах мозга в группе крыс с ожирением. Ранее нами и другими авторами при изучении грызунов с другими формами ожирения было показано, что, несмотря на сильно выраженную гиперинсулинемию и гиперлептинемию уровень инсулина и лептина в структурах мозга у них также не превышает этот показатель у здоровых животных и в небольшой степени снижен, в случае лептина значимо [9–13]. Этот парадокс обусловлен нарушением рецептор-опосредуемого транспорта инсулина и лептина через ГЭБ в условиях периферической ИР и ЛР. Тем самым одной из возможных причин ослабления инсулиновой и лептиновой сигнализации может быть снижение уровня гормонов в ЦНС, а не только и не столько развитие центральной резистентности к ним, являющееся результатом липотоксичности, гипергликемии и нейродегенеративных изменений в мозге. Важно отметить, что, как показано нами, экспрессия генов рецепторов инсулина и лептина в гипоталамусе крыс с ожирением имеет тенденцию к повышению, что может обеспечивать повышение эффективности связывания этих гормонов.
Метформиновая терапия в течение 4 нед. в полной мере восстанавливала массу тела, чувствительность к глюкозе и инсулину, оцениваемые в ИГТТ, нормализовала показатели липидного обмена и уровни инсулина и лептина в крови животных. Высокая эффективность метформиновой терапии при ожирении, вызванном как диетой, так и генетическими факторами, продемонстрирована как при работе с экспериментальными животными, так и в условиях клиники [10, 15, 16]. Этот эффект метформина во многом обусловлен его способностью восстанавливать метаболизм, нарушенный при ожирении, поскольку основной его мишенью является фермент АМФ-активируемая протеинкиназа, энергетический сенсор клеток, активность которого в периферических тканях при ожирении снижается [36, 37]. Метформин не только восстанавливает липидный и углеводный обмен на периферии, но и нормализует передачу нейромедиаторных и гормональных сигналов в ЦНС, в первую очередь в гипоталамусе [38]. Одной из причин этого может быть нормализация рецептор-опосредуемого транспорта инсулина и лептина через ГЭБ как результат вызываемого метформином повышения чувствительности к ним клеток, осуществляющих такой транспорт. Нами показано, что у леченных метформином животных соотношение уровней инсулина и лептина в крови и структурах мозга (гипоталамусе, мозжечке) восстанавливалось до их уровня в контроле, а в гипоталамусе нормализовалась экспрессия генов рецепторов этих гормонов, причем, в случае гена ObRb различия с группой “ОЖ” были значимыми. Тем самым, терапевтический эффект метформина на пищевое поведение и периферический метаболизм может быть во многом обусловлено нормализацией транспорта инсулина и лептина через ГЭБ и восстановлением гипоталамических механизмов действия этих гормонов. Следует отметить, что до нас исследований влияния метформиновой терапии на соотношение инсулина и лептина в крови и мозге не проводилось.
Метаболические и гормональные эффекты ИВИ и бромокриптина при ожирении различного генеза с отчетливо выраженными метаболическими и гормональными нарушениями остаются малоизученными, а данные о влиянии этих препаратов на уровни инсулина и лептина в ЦНС отсутствуют. Ранее нами и другими авторами показано, что при метаболическом синдроме и диабете 2-го типа ИВИ восстанавливает когнитивные функции, препятствуя процессам нейродегенерации, нормализует пищевое поведение и периферический метаболизм, улучшая глюкозный гомеостаз [3, 22, 39, 40]. В настоящем исследовании нами было обнаружено существенное снижение ИР при лечении крыс с ожирением с помощью ИВИ, хотя в целом его восстанавливающие эффекты были выражены намного слабее в сравнении с метформином. Положительное влияние ИВИ на инсулиновую чувствительность и метаболические процессы на периферии, как мы полагаем, обусловлено компенсаторным повышением уровня инсулина в гипоталамусе и других отделах мозга крыс с ожирением и, как следствие, активацией инсулиновых и тесно взаимодействующих с ними лептиновых путей. Значительное, на протяжении 4 нед. повышение уровня инсулина в ЦНС вследствие его интраназального введения привело не только к снижению концентрации инсулина в крови как результат центрального эффекта инсулина, но и вызвало значительное снижение экспрессии инсулиновых рецепторов в гипоталамусе, что можно рассматривать как компенсаторную реакцию на их гиперактивацию с помощью ИВИ. Показательно, что в отношении экспрессии лептиновых рецепторов в гипоталамусе такого эффекта выявлено не было.
Лечение бромокриптином, агонистом D2-дофаминовых рецепторов, так же, как и лечение ИВИ, по эффективности уступало лечению метформином, но при этом оказывало существенное влияние на уровни лептина в крови и структурах мозга крыс с ожирением. Лечение бромокриптином не только снижало уровни лептина в крови, ослабляя периферическую ЛР, но и повышало содержание лептина в структурах мозга, что приводило к значимому снижению соотношения концентраций лептина в крови и гипоталамусе. До наших исследований сведения о влиянии бромокриптина на проницаемость ГЭБ для лептина отсутствовали. При этом было обнаружено стимулирующее влияние бромокриптина на перенос лептина с грудным молоком от матери к плоду через мембрану клеток молочной железы, хотя механизмы этого процесса и роль в нем бромокриптина остаются невыясненными [41, 42]. Нами ранее был продемонстрирован ряд положительных эффектов бромокриптиновой терапии на метаболические и гормональные показатели при диабете 2-го типа с ожирением [3, 23]. Имеются многочисленные свидетельства успешного применения препаратов бромокриптина в клинике для лечения гиперфагии, ожирения и других метаболических расстройств [24–26, 43]. Наши данные позволяют предположить, что в основе этого лежит индуцированное бромокриптином восстановление лептиновой и тесно ассоциированной с ней инсулиновой систем в гипоталамусе и, возможно, в других отделах мозга.
Фосфатаза PTP1B является важнейшим негативным регулятором инсулинового и лептинового сигналинга, дефосфорилируя активные формы инсулинового и лептинового рецептора, а также сопряженных с ними белков-субстратов инсулинового рецептора. Повышение экспрессии и активности PTP1B рассматривают как один из ключевых факторов развития ИР и ЛР, в том числе в ЦНС [44]. При ожирении активность PTP1B в гипоталамусе повышается, и это приводит к нарушению анорексигенных путей, реализуемых через лептиновые рецепторы [44]. В настоящее время предпринимаются попытки разработать селективные ингибиторы PTP1B, которые будут способны нормализовать пищевое поведение и предотвращать развитие метаболических нарушений [45]. Нами ранее было синтезировано и изучено соединение PI4, ингибитор PTP1B на основе оксо-1,4-дигидроциннолина, которое проявляло отчетливо выраженный анорексигенный эффект и стимулировало лептиновый сигналинг в гипоталамических нейронах [17]. Его введение крысам с ожирением в течение двух недель приводило к значительному снижению массы тела и жировой ткани, как следствие двукратного в сравнении с группой “ОЖ” сокращения потребления пищи. В гипоталамусе существенно повышалась экспрессия гена Ptp1b, которая слабо менялась в других изученных группах, включая группу с ожирением, что является ответом на длительное ингибирование фосфатазы с помощью PI4. Индуцированное PI4 системное повышение чувствительности к инсулину и лептину приводило к снижению уровня этих гормонов в крови, но при этом не влияло на их содержание в структурах мозга, что могло быть следствием снижения концентрации инсулина и лептина в кровотоке. Соотношение гормонов в крови и структурах мозга не отличалось от контрольных значений и было сходным с таковым в группе “ОЖ-МФ”, и это может указывать на приближение эффективности транспорта инсулина и лептина через ГЭБ к таковому у здоровых животных.
ЗАКЛЮЧЕНИЕ
Нами впервые показано, что при ожирении, вызванном комбинированной высококалорийной диетой, на фоне системной гиперинсулинемии и гиперлептинемии, ассоциированных с ИР и ЛР, отмечается ослабление поступления инсулина и лептина через ГЭБ в гипоталамус и мозжечок. Следствием этого является значительное возрастание соотношения концентраций этих гормонов в крови и в структурах мозга. Четырехнедельное лечение крыс с ожирением с помощью метформина не только нормализовало метаболические показатели, но и в полной мере восстанавливало уровни инсулина и лептина в гипоталамусе и взятом для сравнения мозжечке. Четырехнедельное лечение ИВИ и бромокриптином было в этом отношении менее эффективным. Двухнедельная обработка крыс с ожирением ингибитором PTP1B вызывала значительное снижение у них массы тела и жировой ткани, уменьшала потребление пищи, улучшала метаболические показатели и чувствительность к инсулину и лептину. У животных под влиянием ингибитора PTP1B восстанавливалось соотношение концентраций инсулина и лептина в крови и в структурах мозга, но не вследствие повышения их уровня в мозге, а в результате значительного снижения их концентрации в крови. Полученные данные указывают на то, что лечение различными по химической природе и механизмам действия препаратами, улучшающими метаболические и гормональные показатели при ожирении, приводит к нормализации соотношения инсулина и лептина на периферии и в ЦНС, восстанавливая, тем самым, инсулиновый и лептиновый сигналинг в гипоталамусе и других отделах мозга. Одной из возможных причин этого может являться восстановление нарушенного в условиях инсулиновой и лептиновой резистентности транспорта инсулина и лептина через ГЭБ. Это может вносить существенный вклад в терапевтические эффекты метформина, ИВИ, бромокриптина и ингибиторов фосфатазы PTP1B при лечении метаболических расстройств и должно стать предметом дальнейшего изучения.
Список литературы
Könner AC, Brüning JC (2012) Selective insulin and leptin resistance in metabolic disorders. Cell Metab 16: 144–152. https://doi.org/10.1016/j.cmet.2012.07.004
Erichsen JM, Fadel JR, Reagan LP (2022) Peripheral versus central insulin and leptin resistance: Role in metabolic disorders, cognition, and neuropsychiatric diseases. Neuropharmacology 203: 108877. https://doi.org/10.1016/j.neuropharm.2021.108877
Shpakov AO, Derkach KV, Berstein LM (2015) Brain signaling systems in the Type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Sci OA 1: FSO25. https://doi.org/10.4155/fso.15.23
Boucsein A, Kamstra K, Tups A (2021) Central signalling cross-talk between insulin and leptin in glucose and energy homeostasis. J Neuroendocrinol 33: e12944. https://doi.org/10.1111/jne.12944
Rawlinson S, Andrews ZB (2021) Hypothalamic insulin signalling as a nexus regulating mood and metabolism. J Neuroendocrinol 33: e12939. https://doi.org/10.1111/jne.12939
Kastin AJ, Pan W (2016) Involvement of the Blood-Brain Barrier in Metabolic Regulation. CNS Neurol Disord Drug Targets 15: 1118–1128. https://doi.org/10.2174/1871527315666160920124928
Banks WA (2020) The Blood-Brain Barrier Interface in Diabetes Mellitus: Dysfunctions, Mechanisms and Approaches to Treatment. Curr Pharm Des 26: 1438–1447. https://doi.org/10.2174/1381612826666200325110014
Zhang W, Liu QY, Haqqani AS, Leclerc S, Liu Z, Fauteux F, Baumann E, Delaney CE, Ly D, Star AT, Brunette E, Sodja C, Hewitt M, Sandhu JK, Stanimirovic DB (2020) Differential expression of receptors mediating receptor-mediated transcytosis (RMT) in brain microvessels, brain parenchyma and peripheral tissues of the mouse and the human. Fluids Barriers CNS 17: 47. https://doi.org/10.1186/s12987-020-00209-0
Romanova IV, Derkach KV, Mikhrina AL, Sukhov IB, Mikhailova EV, Shpakov AO (2018) The Leptin, Dopamine and Serotonin Receptors in Hypothalamic POMC-Neurons of Normal and Obese Rodents. Neurochem Res 43: 821–837. https://doi.org/10.1007/s11064-018-2485-z
Derkach K, Zakharova I, Zorina I, Bakhtyukov A, Romanova I, Bayunova L, Shpakov A (2019) The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One 14: e0213779. https://doi.org/10.1371/journal.pone.0213779
El-Haschimi K, Pierroz DD, Hileman SM, Bjørbaek C, Flier JS (2000) Two defects contribute to hypothalamic leptin resistance in mice with diet-induced obesity. J Clin Invest 105: 1827–1832. https://doi.org/10.1172/JCI9842
Banks WA, Farrell CL (2003) Impaired transport of leptin across the blood-brain barrier in obesity is acquired and reversible. Am J Physiol Endocrinol Metab 285: E10–E15. https://doi.org/10.1152/ajpendo.00468.2002
Pan W, Hsuchou H, He Y, Sakharkar A, Cain C, Yu C, Kastin AJ (2008) Astrocyte leptin receptor (ObR) and leptin transport in adult-onset obese mice. Endocrinology 149: 2798–2806. https://doi.org/10.1210/en.2007-1673
Hu SH, Jiang T, Yang SS, Yang Y (2013) Pioglitazone ameliorates intracerebral insulin resistance and tau-protein hyperphosphorylation in rats with type 2 diabetes. Exp Clin Endocrinol Diabetes 121: 220–224. https://doi.org/10.1055/s-0032-1333277
Grammatiki M, Sagar R, Ajjan RA (2021) Metformin: Is it Still the First Line in Type 2 Diabetes Management Algorithm? Curr Pharm Des 27: 1061–1067. https://doi.org/10.2174/1381612826666201222154616
Kononova YA, Likhonosov NP, Babenko AY (2022) Metformin: Expanding the Scope of Application-Starting Earlier than Yesterday, Canceling Later. Int J Mol Sci 23: 2363. https://doi.org/10.3390/ijms23042363
Zakharova IO, Sorokoumov VN, Bayunova LV, Derkach KV, Shpakov AO (2018) 4-Oxo-1,4-dihydrocinnoline derivative with phosphatase 1B inhibitor activity enhances leptin signal transduction in hypothalamic neurons. J Evol Biochem Physiol 54: 273–280.
Bakke J, Haj FG (2015) Protein-tyrosine phosphatase 1B substrates and metabolic regulation. Semin Cell Dev Biol 37: 58–65. https://doi.org/10.1016/j.semcdb.2014.09.020
Nandi S, Saxena M (2020) Potential Inhibitors of Protein Tyrosine Phosphatase (PTP1B) Enzyme: Promising Target for Type-II Diabetes Mellitus. Curr Top Med Chem 20: 2692–2707. https://doi.org/10.2174/1568026620999200904121432
Singh S, Singh Grewal A, Grover R, Sharma N, Chopra B, Kumar Dhingra A, Arora S, Redhu S, Lather V (2022) Recent updates on development of protein-tyrosine phosphatase 1B inhibitors for treatment of diabetes, obesity and related disorders. Bioorg Chem 121: 105626. https://doi.org/10.1016/j.bioorg.2022.105626
Ott V, Benedict C, Schultes B, Born J, Hallschmid M (2011) Intranasal administration of insulin to the brain impacts cognitive function and peripheral metabolism. Diabetes Obes Metab 14: 214–221. https://doi.org/10.1111/j.1463-1326.2011.01490.x
Hallschmid M (2021) Intranasal insulin. J Neuroendocrinol 33: e12934. https://doi.org/10.1111/jne.12934
Derkach KV, Ivantsov AO, Sukhov IB, Shpakov AO (2017) Restoration of hypothalamic signaling systems as a cause of improved metabolic parameters in rats with neonatal diabetes model during treatment with bromocryptine mesylate. Cell Tissue Biol 11: 234–241. https://doi.org/10.1134/S1990519X17030038
Grunberger G (2013) Novel therapies for the management of type 2 diabetes mellitus: part 1. pramlintide and bromocriptine-QR. J Diabetes 5: 110–117. https://doi.org/10.1111/1753-0407.12034
Weiland CM, Hilaire ML (2013) Bromocriptine mesylate (Cycloset) for type 2 diabetes mellitus. Am Fam Physician 87: 718–720.
Siamashvili M, Davis S (2021) Late phase completed clinical trials investigating bromocriptine mesylate quick release as treatment of type 2 diabetes mellitus. Expert Opin Pharmacother 22: 241–247. https://doi.org/10.1080/14656566.2020.1825683
Bakhtyukov AA, Derkach KV, Sorokoumov VN, Stepochkina AM, Romanova IV, Morina IY, Zakharova IO, Bayunova LV, Shpakov AO (2021) The Effects of Separate and Combined Treatment of Male Rats with Type 2 Diabetes with Metformin and Orthosteric and Allosteric Agonists of Luteinizing Hormone Receptor on Steroidogenesis and Spermatogenesis. Int J Mol Sci 23: 198. https://doi.org/10.3390/ijms23010198
Derkach KV, Bogush IV, Berstein LM, Shpakov AO (2015) The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats. Horm Metab Res 47: 916–924. https://doi.org/10.1055/s-0035-1547236
Derkach KV, Sukhov IB, Bondareva VM, Shpakov AO (2018) Effect of metformin on metabolic parameters and hypothalamic signaling systems in rats with obesity induced by a high-carbohydrate and high-fat diet. Adv Gerontol 8: 228–234. https://doi.org/10.1134/S2079057018030037
Kalivarathan J, Chandrasekaran SP, Kalaivanan K, Ramachandran V, Carani Venkatraman A (2017) Apigenin attenuates hippocampal oxidative events, inflammation and pathological alterations in rats fed high fat, fructose diet. Biomed Pharmacother 89: 323–331. https://doi.org/10.1016/j.biopha.2017.01.162
Li TT, Huang ZR, Jia RB, Lv XC, Zhao C, Liu B (2021) Spirulina platensis polysaccharides attenuate lipid and carbohydrate metabolism disorder in high-sucrose and high-fat diet-fed rats in association with intestinal microbiota. Food Res Int 147: 110530. https://doi.org/10.1016/j.foodres.2021.110530
Genchi VA, D’Oria R, Palma G, Caccioppoli C, Cignarelli A, Natalicchio A, Laviola L, Giorgino F, Perrini S (2021) Impaired Leptin Signalling in Obesity: Is Leptin a New Thermolipokine? Int J Mol Sci 22: 6445. https://doi.org/10.3390/ijms22126445
Galizzi G, Di Carlo M (2022) Insulin and Its Key Role for Mitochondrial Function/Dysfunction and Quality Control: A Shared Link between Dysmetabolism and Neurodegeneration. Biology (Basel) 11: 943. https://doi.org/10.3390/biology11060943
Ortiz GG, Huerta M, González-Usigli HA, Torres-Sánchez ED, Delgado-Lara DL, Pacheco-Moisés FP, Mireles-Ramírez MA, Torres-Mendoza BM, Moreno-Cih RI, Velázquez-Brizuela IE (2022) Cognitive disorder and dementia in type 2 diabetes mellitus. World J Diabetes 13: 319–337. https://doi.org/10.4239/wjd.v13.i4.319
Rhea EM, Banks WA, Raber J (2022) Insulin Resistance in Peripheral Tissues and the Brain: A Tale of Two Sites. Biomedicines 10: 1582. https://doi.org/10.3390/biomedicines10071582
Shpakov AO (2021) Improvement Effect of Metformin on Female and Male Reproduction in Endocrine Pathologies and Its Mechanisms. Pharmaceuticals (Basel) 14: 42. https://doi.org/10.3390/ph14010042
Szymczak-Pajor I, Wenclewska S, Śliwińska A (2022) Metabolic Action of Metformin. Pharmaceuticals (Basel) 15: 810. https://doi.org/10.3390/ph15070810
López M (2018) Hypothalamic AMPK and energy balance. Eur J Clin Invest 48: e12996. https://doi.org/10.1111/eci.12996
Dodd GT, Tiganis T (2017) Insulin action in the brain: Roles in energy and glucose homeostasis. J Neuroendocrinol 29: . https://doi.org/10.1111/jne.12513
Scherer T, Sakamoto K, Buettner C (2021) Brain insulin signalling in metabolic homeostasis and disease. Nat Rev Endocrinol 17: 468–483. https://doi.org/10.1038/s41574-021-00498-x
Younes-Rapozo V, Moura EG, Manhães AC, Peixoto-Silva N, de Oliveira E, Lisboa PC (2015) Early weaning by maternal prolactin inhibition leads to higher neuropeptide Y and astrogliosis in the hypothalamus of the adult rat offspring. Br J Nutr 113: 536–545. https://doi.org/10.1017/S0007114514003882
Carvalho JC, Lisboa PC, de Oliveira E, Peixoto-Silva N, Nobre JL, Fraga MC, Manhães AC, Moura EG (2016) Effects of postnatal bromocriptine injection on thyroid function and prolactinemia of rats at adulthood. Neuropeptides 59: 71–81. https://doi.org/10.1016/j.npep.2016.05.003
Raskin P, Cincotta AH (2016) Bromocriptine-QR therapy for the management of type 2 diabetes mellitus: developmental basis and therapeutic profile summary. Expert Rev Endocrinol Metab 11: 113–148. https://doi.org/10.1586/17446651.2016.1131119
Dodd GT, Xirouchaki CE, Eramo M, Mitchell CA, Andrews ZB, Henry BA, Cowley MA, Tiganis T (2019) Intranasal Targeting of Hypothalamic PTP1B and TCPTP Reinstates Leptin and Insulin Sensitivity and Promotes Weight Loss in Obesity. Cell Rep 28: 2905–2922.e5. https://doi.org/10.1016/j.celrep.2019.08.019
Prabhakar PK, Sivakumar PM (2019) Protein Tyrosine Phosphatase 1B Inhibitors: A Novel Therapeutic Strategy for the Management of type 2 Diabetes Mellitus. Curr Pharm Des 25: 2526–2539. https://doi.org/10.2174/1381612825666190716102901
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


