Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1482-1496
Взаимосвязь микробиома крови и содержания нейротрофинов при различных метаболических типах ожирения
И. М. Колесникова 1, *, А. М. Гапонов 2, 3, С. А. Румянцев 1, 2, М. С. Карбышев 1, Т. В. Григорьева 4, В. В. Макаров 5, С. М. Юдин 5, О. В. Борисенко 1, А. В. Шестопалов 1, 2, 6
1 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
2 Центр цифровой и трансляционной биомедицины “Центр Молекулярного Здоровья”
Москва, Россия
3 НИИ общей реаниматологии им. В.А. Неговского
Москва, Россия
4 Казанский (Приволжский) федеральный университет
Казань, Россия
5 Центр стратегического планирования и управления медико-биологическими рисками здоровью
Москва, Россия
6 Национальный медицинский исследовательский центр детской гематологии,
онкологии и иммунологии им. Дмитрия Рогачева
Москва, Россия
* E-mail: ir.max.kolesnikova@gmail.com
Поступила в редакцию 07.07.2022
После доработки 11.09.2022
Принята к публикации 11.10.2022
- EDN: TCXMVC
- DOI: 10.31857/S0869813922110048
Аннотация
Микробная ДНК крови – один из патоген-ассоциированных молекулярных паттернов, сигнальные пути которого способны изменять экспрессию нейротрофинов, таких как нейротрофический фактор мозга (BDNF) и фактор роста нервов (NGF). Изучение нейротрофинов интересно при ожирении, так как оно сопряжено с риском развития нейропатий. При этом риск развития осложнений зависит от метаболического типа ожирения: при метаболически нездоровом типе (МНЗО) этот риск существенно выше, чем при метаболически здоровом (МЗО). Целью работы стало изучение взаимосвязи между отдельными таксонами микробиома крови и сывороточными концентрациями BDNF и NGF при различных метаболических типах ожирения. У здоровых доноров содержание таксонов-обитателей почв и вод было негативно взаимосвязано с содержанием BDNF, тогда как при ожирении, особенно МНЗО, эта связь носила положительный характер. У пациентов с ожирением с уровнем BDNF негативно ассоциировались таксоны-представители флоры желудка (Helicobacter pylori) и кишечника (Sutterella spp.). Содержание NGF у здоровых лиц было позитивно ассоциировано с Akkermansia muciniphila – таксоном, участвующим в поддержании целостности кишечной стенки и снижающим кишечную проницаемость. У пациентов с МНЗО положительная связь была отмечена между уровнем NGF и Ruminococcus bromii. Для здоровых доноров и пациентов с МНЗО, но не с МЗО, были также выявлены многочисленные негативные взаимосвязи между таксонами-представителями кишечной флоры и концентрацией NGF. В целом, влияние микробной ДНК крови на сывороточную концентрацию нейротрофинов зависит от источников транслокации, проницаемости внешних барьеров, особенностей микробиомов (кишечника, кожи и т.д.), а также наличия или отсутствия метаболических нарушений у пациентов с разной массой тела.
Распространенность ожирения в последние годы начала приобретать катастрофические масштабы. По оценкам исследования NCD-RisC к 2025 г. практически четверть населения планеты может иметь индекс массы тела (ИМТ) свыше 30 кг/м2 [1]. В связи с этим, изучение патогенеза осложнений ожирения становится особенно актуальным. Однако риск развития осложнений не одинаков у разных пациентов и определяется метаболическим типом ожирения – метаболически нездоровое ожирение (МНЗО) ассоциировано с высоким риском развития осложнений, тогда как у пациентов с метаболически здоровым типом (МЗО) этот риск существенно ниже [2]. Поражение центральной и периферической нервных систем (ЦНС и ПНС соответственно) при ожирении снижает качество жизни пациентов и является одной из причин их инвалидизации [3]. В связи с этим представляется интересным исследование нейротрофинов – белков, участвующих в дифференцировке, функционировании и выживании нейронов, при разных типах ожирения. Основными нейротрофинами являются фактор роста нервов (Nerve Growth Factor, NGF) и нейротрофический фактор мозга (Brain-Derived Neurotrophic Factor, BDNF). NGF и BDNF играют значительную роль и в энергетическом гомеостазе, что также актуально у пациентов с ожирением. В гипоталамусе действие BDNF связано с формированием чувства насыщения, в том числе и в рамках реализации анорексигенного эффекта лептина [4]. Действие NGF способствует пластичности симпатических нейронов в жировой ткани при охлаждении, что приводит к “бежевой” трансфдифференцировке белых адипоцитов и рассеиванию энергии в виде тепла [5]. Кроме того, и указанные нейротрофины и их рецепторы экспрессируются как белой, так и бурой жировой тканью [6].
В последние десятилетия уделяется пристальное внимание роли кишечной микробиоты в развитии ожирения, метаболического синдрома и сахарного диабета II типа [7]. Многочисленные двусторонние взаимодействия между кишечной микробиотой и нервной системой получили название оси “микробиота–кишечник–мозг”. Наиболее изученными медиаторами в этой системе являются короткоцепочечные жирные кислоты, серотонин и другие метаболиты триптофана, а также патоген-ассоциированные молекулярные паттерны (pathogen-associated molecular patterns, PAMPs), такие как липополисахариды [8, 9]
Ожирение также ассоциировано с увеличением кишечной проницаемости, что приводит к увеличению альфа-разнообразия и изменению таксономического состава микробиома крови [10, 11]. Микробная ДНК представляет собой один из PAMPs, способных стимулировать иммунный ответ через ряд внутриклеточных сенсоров. Основным рецептором распознавания образов (pattern-recognition receptors, PRRs) микробной ДНК является толл-подобный рецептор 9-го типа (toll-like receptor 9, TLR9), локализованный на эндосомах и лизосомах [12]. Стимуляция TLR9 приводит к активации ядерного фактора каппа-В (nuclear factor κB, NF-κB), что усиливает продукцию фактора некроза опухоли альфа (tumor necrosis factor alpha, TNFα) и других провоспалительных цитокинов [12]. Помимо клеток иммунной системы, TLR9 присутствует и в адипоцитах, в которых его стимуляция приводит к парадоксальному противовоспалительному эффекту [13]. Также TLR9 экспрессируется в нервной ткани микроглией, астроцитами и даже нейронами, что демонстрирует вовлеченность этих рецепторов в формирование нейровоспаления, которое является распространенным осложнением ожирения [14, 15].
Внутриклеточное распознавание ДНК не ограничено TLR9 и включает ряд цитозольных сенсоров, таких как путь циклической ГМФ–АМФ синтазы (cyclic GMP–AMP synthase, cGAS) и белок, отсутствующий при меланоме 2 (absent in melanoma 2, AIM2) [16]. Путь cGAS связан с активацией NF-κB и усилением синтеза провоспалительных цитокинов, в частности интерлейкина 6 (interleukin 6, IL6) и TNFα [17]. Однако путь cGAS не является только прерогативой иммунных клеток и может вносить свой вклад в патогенез ожирения. Было показано, что ожирение приводит к высвобождению митохондриальной ДНК в цитозоль, что активирует сигнальный каскад cGAS и способствует формированию хронического воспаления в жировой ткани [18]. Также активация этого пути приводит к подавлению термогенеза и уменьшению рассеивания энергии при ожирении [19]. Взаимодействие AIM2 с двухцепочечной ДНК приводит к сборке инфламмасомы, активирует каспазу-1 и запускает процессинг интерлейкина 1β (interleukin 1β, IL1β) и интерлейкина 18 (interleukin 18, IL18) [20]. В контексте ожирения роль AIM2 неоднозначна. Было показано, что IL1β вносит вклад в формирование системного воспаления и инсулинорезистентности при ожирении [21]. С другой стороны, IL18, который также продуцируется инфламмасомой AIM2, стимулирует липолиз и защищает от метаболической дисфункции, что было показано на модели мышей с ожирением [22].
Активация сигнальных путей и синтез провоспалительных цитокинов в ответ на PAMPs способствует не только формированию иммунного ответа, но может регулировать экспрессию нейротрофинов. Было показано, что активация NF-κB способствует усилению выработки NGF β-клетками и микроглией [23, 24]. Кроме того, провоспалительные цитокины IL1β, TNFα и IL6 способны стимулировать синтез NGF в различных типах клеток [25]. Экспрессия BDNF в ЦНС также регулируется IL1β [26]. Наличие этих сигнальных путей позволяет рассматривать микробную ДНК крови как один из медиаторов оси “микробиота–кишечник–мозг”, а нейротрофины – в качестве индукторов. Поэтому целью нашей работы стало изучение взаимосвязи между отдельными таксонами бактериальной ДНК крови и сывороточной концентрацией нейротрофинов BDNF и NGF у пациентов с разными метаболическими типами ожирения.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в исследованиях с участием людей, соответствуют этическим стандартам национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. Проведение научно-исследовательской работы одобрено ЛЭК ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (протокол №186 от 26.06.2019) и ЛНЭК ФГБОУ ВО РостГМУ Минздрава России (протокол № 20/19 от 12.12.2019). От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Проведено когортное одномоментное исследование на базе Центра цифровой и трансляционной биомедицины ООО “Центр молекулярного здоровья”, кафедры внутренних болезней № 3, ФГБОУ ВО РостГМУ Минздрава России и ФГАОУ ВО “Казанский (Приволжский) федеральный университет” в период 2018–2020 гг. Группу 1 сформировали 114 здоровых доноров с ИМТ от 18.5 до 24.9 кг/м2, при отсутствии метаболических нарушений (дислипидемия, гипергликемия, гиперурикемия) и без признаков артериальной гипертензии. В Группу 2 вошли 98 пациентов с ожирением (ИМТ ≥ 30 кг/м2), окружность талии которых превышала 102 см у мужчин или 88 см у женщин. Пациенты Группы 2 были разделены на подгруппы в зависимости от метаболического типа ожирения в соответствии с критериями NCEP-ATP III [27]. Ожирение считалось метаболически нездоровым, если для пациента были характерны три и более критериев: 1) объем талии (♂ > 102 см; ♀ > 88 см); 2) триглицериды сыворотки (≥1.7 ммоль/л); 3) холестерол ЛПВП (♂ < 1.03 ммоль/л; ♀ < 1.29 ммоль/л); 4) артериальное давление (sys ≥130 мм рт. ст.; dia ≥85 мм рт. ст.); 5) глюкоза натощак (≥ 5.6 ммоль/л). В подгруппу пациентов с МЗО вошли 36 человек, тогда как подгруппу с МНЗО составили 53 пациента. Для 9 пациентов не было получено убедительных данных для включения их в одну из подгрупп, поэтому результаты их исследований не были включены в анализ влияния микробиома крови на сывороточную концентрацию нейротрофинов при различных метаболических типах ожирения.
У всех пациентов проводился отбор крови, в образцах сыворотки которой проводилось определение концентрации нейротрофинов BDNF и NGF методом мультиплексного иммуноферментного анализа на анализаторе Magpix (BioRad, США) с использованием наборов Milliplex: Human Adipokine Magnetic Bead Panel 2 и Human Myokine Magnetic Bead Panel (Merck, Германия). Также из образцов крови проводилось выделение бактериальной ДНК в соответствии с протоколом производителя QIAamp BiOstic Bacterimia DNA Kit (Qiagen, Германия). Секвенирование вариабельного участка v3–v4 гена 16S рРНК проводили на платформе “Illumina MiSeq” на базе Междисциплинарного центра коллективного пользования Казанского федерального университета. Полученные последовательности генов были проанализированы с помощью программы “QIIME v.1.9.1” с использованием референсной базы данных “Greengenes v.13.8” с 97%-ным порогом сходства между последовательностями. Данные представленности бактериальных таксонов в общем пуле ридов были получены в долях (от 0 до 1), которые были рассчитаны на основе количества картированных ридов для каждого таксона. Также для характеристики альфа-разнообразия микробиома крови были рассчитаны стандартные индексы: индекс Simpson, индекс Chao1, индекс Shannon, индекс филогенетического разнообразия (Phylogenetic diversity, PD), а также общее количество наблюдаемых операционных таксономических единиц (OTUs).
Статистический анализ проводился с помощью программного обеспечения MedCalc (MedCalc Software Ltd, Бельгия). Все полученные массивы данных были проверены на нормальность распределения с использованием критерия Шапиро–Уилка. Содержание нейротрофинов в Группах 1 и 2 носило нормальный характер, однако в подгруппах, ввиду меньшей выборки, распределение данных содержания нейротрофинов и показателей альфа-разнообразия не всегда носило нормальный характер, поэтому полученные данные были представлены в виде медианы и 25–75 перцентилей, а сравнение групп/подгрупп между собой проводили с использованием критерия Манна–Уитни. Для установления наличия или отсутствия влияния разнообразия микробиома крови на содержание нейротрофинов пациенты Группы 1 и Группы 2, а также пациенты с МЗО и МНЗО были разделены на три подгруппы: с высокими, средними и низкими показателями α-разнообразия. Разделение по каждому из показателей альфа-разнообразия на подгруппы проводилось по квантилям. Для выявления различий между содержанием нейротрофинов в сформированных подгруппах использовался однофакторный дисперсионный анализ (ANOVA) при условии нормального распределения и равенства дисперсий в подгруппах. В случае отсутствия нормального распределения или при неравенстве дисперсий в сформированных подгруппах для выявления различий использовался непараметрический критерий Краскела–Уоллиса. Для многих таксонов не было характерно нормальное распределение, поэтому для установления взаимосвязи между содержанием отдельных таксонов кишечного микробиома и концентрацией нейротрофинов был проведен корреляционный анализ с расчетом коэффициента ранговой корреляции Спирмена. Коэффициенты корреляции (rho) принимались во внимания, если они по модулю были более 0.3 (умеренная сила связи в соответствии со шкалой Чеддока) при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее мы показали, что для пациентов с ожирением, вне зависимости от его метаболического типа, характерна сниженная концентрация NGF по сравнению со здоровыми донорами, на фоне неизменного содержания BDNF (табл. 1) [28]. При этом МНЗО ассоциировано с увеличением альфа-разнообразия микробиома крови, тогда как пациенты с МЗО не демонстрируют отличий от здоровых доноров [11].
Таблица 1.
Содержание нейротрофинов в сыворотке и характеристики α-разнообразия микробиома крови у исследуемых групп пациентов
| Группа 1 | Группа 2 | МЗО | МНЗО | |
|---|---|---|---|---|
| BDNF, нг/мл | 7346.8 [5635.0–9589.9] |
8063.2 [5525.63–10272.13] |
7821.1 [6301.3–9592.3] |
8388.2 [5461.7–10489.0] |
| NGF, нг/мл | 0.57 [0.34–1.38] |
0.50* [0.34–0.92] |
0.47* [0.33–0.66] |
0.52*† [0.34–0.93] |
| Индекс Simpson | 0.975 [0.953–0.983] |
0.977 [0.965–0.984] |
0.972 [0.957–0.980] |
0.980*† [0.970–0.984] |
| Индекс Shannon | 5.99 [5.26–6.72] |
6.22 [5.53–6.66] |
6.08 [5.53–6.56] |
6.31* [5.81–6.83] |
| Индекс Chao1 | 168.46 [114.50–280.50] |
210.47* [134.00–280.09] |
205.03 [129.57–265.22] |
220.80* [141.46–343.35] |
| OTUs | 125.50 [79.00–206.00] |
148.00 [99.00–209.00] |
140.00 [92.00–201.50] |
149.00* [109.25–233.00] |
| PD | 12.12 [8.45–17.44] |
14.32* [10.69–18.57] |
13.43 [9.78–16.92] |
14.95* [11.61–19.63] |
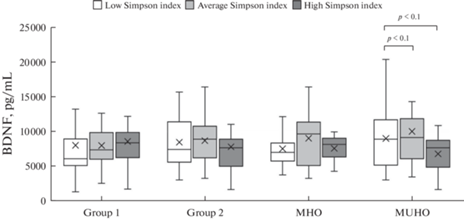
Разделение исследуемых групп пациентов в зависимости от величин индексов альфа-разнообразия показало, что подгруппы были сравнимы между собой по сывороточным концентрациям нейротрофинов BDNF и NGF. Единственным близким к статистически значимому различию было сниженное содержание BDNF у пациентов с МНЗО с высокими значениями индекса Simpson (рис. 1). Учитывая, что МНЗО ассоциировано с высокими показателями индексов альфа-разнообразия, можно предполагать, что высокие показатели этого индекса могут быть связаны со снижением сывороточной концентрации BDNF. Подобное предположение подтверждает слабая отрицательная корреляция между содержанием BDNF и индексом Shannon (rho = –0.267, p = 0.05). Следует отметить, что пациенты с МНЗО были единственной подгруппой, для которой были характерны корреляции между уровнем BDNF и характеристиками альфа-разнообразия микробиома крови.
Рис. 1.
Содержание BDNF в сыворотке крови у исследуемых групп в зависимости от величины индекса Simpson.
Корреляционный анализ показал множественные взаимосвязи между отдельными таксонами микробиома крови и сывороточным содержанием нейротрофинов. Следует отметить, что среди таксонов, ДНК которых было выделено из крови подавляющего большинства пациентов каждой из групп, не было отмечено корреляции с уровнем BDNF и NGF. Таксоны, взаимосвязанные с содержанием нейротрофинов, в основном выделялись не более чем у трети пациентов каждой из исследуемых групп. Подобное наблюдение дает основание предполагать, что стабильное, “конститутивное” ядро микробиома крови напрямую не влияет на синтез и секрецию нейротрофинов в кровь. Однако среди менее часто выделяемых видов, родов и семейств присутствовал спектр таксонов как положительно, так и отрицательно коррелировавших с уровнем BDNF (табл. 2 и 3) и NGF (табл. 4 и 5).
Таблица 2.
Таксоны, доля которых в микробиоме крови положительно коррелировала с сывороточной концентрацией BDNF
| Группа | Таксон | Среда обитания |
|---|---|---|
| Группа 1 | Micrococcus spp. rho = 0.692, p < 0.01, n = 13 | Кожа, почва, вода |
| Lactobacillus iners rho = 0.551, p < 0.005, n = 26 | Вагинальная флора | |
| Haemophilus parainfluenzae rho = 0.463, p = 0.05, n = 18 | Ротовая полость, дыхательные пути | |
| Clostridium spp. rho = 0.334, p < 0.06, n = 33 | Кишечник, почва, вода | |
| Gemellaceae rho = 0.622, p < 0.05, n = 12 | Ротовая полость | |
| Группа 2 | Rickettsialesf. mitochondria rho = 0.709, p < 0.005, n = 16 | Внутриклеточные паразиты |
| Rhizobiales1 rho = 0.537, p < 0.05, n = 17 | Почва | |
| Coriobacteriaceae2 rho = 0.636, p < 0.005, n = 20 | Ротовая полость, кишечник, половые пути | |
| Providencia spp. rho = 0.503, p < 0.05, n = 18 | Вода, кишечник | |
| Nocardioidaceae rho = 0.327, p < 0.05, n = 42 | Почва, вода, кожа | |
| Rhodococcus spp. rho = 0.436, p < 0.005, n = 48 | Почва | |
| Paracoccus spp.3 rho = 0.455, p < 0.005, n = 40 | Почва | |
| Lachnospira spp. rho = 0.369, p < 0.05, n = 36 | Толстый кишечник | |
| Chitinophagaceae4 rho = 0.369, p < 0.05, n = 36 | Почва, вода, кишечник | |
| МЗО | Micrococcus spp. rho = 0.457, p < 0.05, n = 22 | Кожа, почва, вода |
| МНЗО | Rhodococcus spp. rho = 0.499, p < 0.01, n = 26 | Почва |
| Lachnospira spp. rho = 0.482, p < 0.05, n = 23 | Кишечник | |
| Providencia spp. rho = 0.794, p < 0.01, n = 10 | Вода, кишечник | |
| Streptophyta rho = 0.565, p < 0.01, n = 20 | Вода | |
| Paracoccus spp.3 rho = 0.509, p < 0.05, n = 23 | Почва | |
| Rhizobiales1 rho = 0.721, p < 0.05, n = 10 | Почва | |
| Rickettsialesf. mitochondria rho = 0.673, p < 0.05, n = 10 | Внутриклеточные паразиты | |
| Nocardioidaceae rho = 0.499, p < 0.01, n = 26 | Почва, вода, кожа |
1 Неидентифицированные таксоны порядка, не принадлежащие к семействам Aurantimonadaceae, Beijerinckiaceae, Bradyrhizobiaceae, Brucellaceae, Hyphomicrobiaceae, Methylobacteriaceae, Phyllobacteriaceae, Rhizobiaceae, Xanthobacteraceae; 2 неидентифицированные таксоны семейства, не принадлежащие к родам Adlercreutzia, Atopobium, Collinsella, Eggerthella, Slackia; 3 неидентифицированные виды, не принадлежащие к видам P. aminovorans, P. marcusii; 4 неидентифицированные таксоны, не принадлежащие к семействам Chitinophaga, Flavihumibacter, Flavisolibacter, Niabella, Sediminibacterium.
Таблица 3.
Таксоны, доля которых в микробиоме крови отрицательно коррелировала с сывороточной концентрацией BDNF
| Группа | Таксон | Среда обитания |
|---|---|---|
| Группа 1 | Hymenobacter spp. rho = 0.636, p < 0.05, n = 11 | Почва |
| Micrococcaceae1 rho = –0.441, p < 0.01, n = 34 | Почва, кожа | |
| Dorea spp.2 rho = –0.392, p < 0.05, n = 35 | Кишечник | |
| Chryseobacterium spp. rho = –0.366, p < 0.05, n = 30 | Почва, вода, пища | |
| Geodermatophilaceae rho = –0.437, p < 0.05, n = 27 | Почва, вода | |
| Группа 2 | Microbacterium spp. rho = –0.756, p < 0.001, n = 16 | Пища |
| Thermus spp. rho = –0.608, p < 0.01, n = 17 | Минеральные источники | |
| Helicobacterpylori rho = –0.587, p < 0.05, n = 12 | Желудок | |
| Solirubrobacterales3 rho = –0.523, p < 0.05, n = 20 | Почва, вода | |
| Sutterella spp. rho = –0.330, p = 0,05, n = 35 | Кишечник | |
| МЗО | Pseudomonas spp.4 rho = –0.709, p < 0.05, n = 10 | Почва, вода, пища |
| [Eubacterium] spp. rho = –0.697, p < 0.05, n = 10 | Кишечник | |
| Bacteroides uniformis rho = –0.566, p = 0,05, n = 12 | Кишечник | |
| Leuconostocaceae rho = –0.624, p = 0,05, n = 10 | Пища, кишечник | |
| МНЗО | Microbacterium spp. rho = –0.714, p < 0.05, n = 8 | Пища |
| Clostridium spp. rho = –0.521, p < 0.05, n = 16 | Кишечник, почва, вода | |
| Gaiellaceae rho = –0.709, p < 0.05, n = 10 | Почва, вода |
1 Неидентифицированные таксоны семейства, не принадлежащие к родам Arthrobacter, Kocuria, Microbispora, Micrococcus, Nesterenkonia, Renibacterium и Rothia; 2 неидентифицированные виды, не принадлежащие к виду D. formicigenerans; 3 неидентифицированные таксоны порядка, не принадлежащие к семействам Conexibacteraceae, Patulibacteraceae, Solirubrobacteraceae; 4 неидентифицированные виды, не принадлежащие к видам P. fragi и P. viridiflava.
Таблица 4.
Таксоны, доля которых в микробиоме крови положительно коррелировала с сывороточной концентрацией NGF
| Группа | Таксон | Среда обитания |
|---|---|---|
| Группа 1 | Akkermansiamuciniphila rho = 0.495, p < 0.005, n = 38 | Кишечник |
| Dorea spp.1 rho = 0.399, p < 0.05, n = 35 | Кишечник, почва | |
| Aerococcus spp. rho = 0.661, p < 0.05, n = 10 | Кожа, пыль | |
| Группа 2 | Ruminococcusbromii rho = 0.640, p < 0.01, n = 17 | Кишечник |
| МЗО | [Prevotella] spp. rho = 0.706, p < 0.05, n = 9 | Кишечник |
| МНЗО | Ruminococcusbromii rho = 0.619, p < 0.05, n = 14 | Кишечник |
Таблица 5.
Таксоны, доля которых в микробиоме крови отрицательно коррелировала с сывороточной концентрацией NGF
| Группа | Таксон | Среда обитания |
|---|---|---|
| Группа 1 | Clostridium spp. rho = –0.386, p < 0.05, n = 35 | Кишечник, почва, вода |
| Oxalobacteraceae1 rho = –0.409, p < 0.05, n = 34 | Кишечник, почва, вода | |
| Pirellulaceae rho = –0.636, p < 0.05, n = 11 | Кишечник, почва, вода | |
| Chitinophagaceae2 rho = –0.709, p < 0.01, n = 13 | Кишечник, почва, вода | |
| Nocardioidaceae3 rho = –0.450, p < 0.05, n = 21 | Почва, вода | |
| [Eubacterium] spp. rho = –0.297, p < 0.05, n = 49 | Кишечник | |
| Hyphomicrobiaceae rho = –0.548, p < 0.05, n = 17 | Почва, вода | |
| МЗО | Christensenellaceae rho = –0.929, p < 0.001, n = 8 | Кишечник |
| МНЗО | Bacteroides spp.4 rho = –0.446, p < 0.005, n = 46 | Кишечник |
| Thermus spp. rho = –0.756, p < 0.05, n = 8 | Минеральные источники | |
| [Barnesiellaceae] rho = –0.492, p < 0.05, n = 19 | Кишечник | |
| Bifidobacteriumadolescentis rho = –0.490, p < 0.05, n = 19 | Кишечник | |
| Roseburia spp. rho = –0.479, p < 0.05, n = 26 | Кишечник | |
| Oxalobacteraceae rho = –0.433, p < 0.05, n = 26 | Кишечник, почва, вода |
1 Неидентифицированные таксоны семейства, не принадлежащие к родам Cupriavidus, Janthinobacterium, Oxalobacter, Polynucleobacter, Ralstonia; 2 неидентифицированные таксоны семейства, не принадлежащие к родам Chitinophaga, Flavihumibacter, Flavisolibacter, Niabella, Sediminibacterium; 3 неидентифицированные таксоны семейства, не принадлежащие к родам Aeromicrobium, Friedmanniella, Kribbella, Nocardioides, Pimelobacter, Nocardiopsis; 4 неидентифицированные виды, не принадлежащие к видам B. acidifaciens, B. barnesiae, B. caccae, B. coprophilus, B. eggerthii, B. fragilis, B. ovatus, B. plebeius, B. uniformis.
Интересно, что среди таксонов, положительно взаимосвязанных с уровнем BDNF у лиц Группы 1, присутствовали обитатели разных микробных сообществ человеческого организма – кишечника, вагинальной флоры, микробиома ротовой полости и кожи. При этом таксоны, отрицательно коррелировавшие с содержанием этого нейротрофина у здоровых доноров, преимущественно принадлежали к представителям микробиомов почвы и воды. Подобная среда обитания может быть основанием для предположения, что микробная ДНК этих таксонов могла быть транслоцирована в кровь с поверхности кожи и/или слизистых дыхательных путей. Возможно, у здоровых лиц, не страдающих ожирением, микробная транслокация по этим путям негативно взаимосвязана с сывороточной концентрацией BDNF.
Напротив, у пациентов Группы 2 некоторые таксоны-обитатели почв продемонстрировали положительную корреляцию с уровнем этого нейротрофина. Если ДНК данных таксонов транслоцируется в кровь с поверхности кожи, подобное наблюдение может быть объяснимо взаимосвязью ожирения и дерматологических патологий [29]. Ожирение повышает риск развития атопического дерматита, который, в свою очередь, ассоциирован с усиленной продукцией BDNF эозинофилами [30, 31]. Кроме того, ожирение является одним из факторов риска развития бронхиальной астмы, при которой также наблюдается повышение плазменной концентрации BDNF [32, 33]. Появление положительной взаимосвязи у пациентов с ожирением между BDNF и таксонами-обитателями почв, является объяснимой, учитывая, что микробиомы кожи, легких и желудочно-кишечного тракта вовлечены в развитие аллергических заболевания, включая атопический дерматит и бронхиальную астму [34]. Если предположить, что ДНК таксонов, обитающих в почве, попадает в кровь с поверхности кожи, остается непонятным, почему подобная транслокация у здоровых доноров отрицательно взаимосвязана с содержанием BDNF, а у пациентов с ожирением – положительно. Возможно, эта взаимосвязь находится под влиянием специфических факторов, характерных для пациентов с ожирением, таких как гипергликемия, гиперинсулинемия или гиперлептинемия. Например, лептин является одним из факторов, стимулирующих экспрессию BDNF в ЦНС, а также вовлечен в патогенез атопического дерматита и бронхиальной астмы [35–37]. Учитывая, что эти патологии взаимосвязаны с изменением в микробных сообществах организма и гиперпродукцией BDNF, лептин может выступать одним из факторов, регулирующих выявленную связь между BDNF и транслокацией ДНК таксонов-обитателей почв.
Среди таксонов, отрицательно коррелировавших с уровнем BDNF в Группе 2, присутствовал Helicobacter pylori, представитель патогенной флоры желудка. Вместе с H. pylori, негативно с содержанием BDNF были связаны таксоны, характерные для пищевых продуктов – Microbacterium spp. и Thermus spp. Можно предполагать, что ожирение сопровождается увеличением проницаемости стенки желудка для бактериальной ДНК на фоне гиперфагии и перерастяжения желудка. Косвенно это подтверждает работа Rohm и соавт., которые отметили, что ожирение ассоциировано с увеличением количества провоспалительных макрофагов в стенке желудка [38]. Возможно, усиление микробной транслокации из желудка может негативно сказываться на концентрации BDNF сыворотки.
После разделения пациентов Группы 2 на подгруппы по метаболическому типу ожирения было выявлено, что для пациентов с МНЗО, так же, как и для общей группы пациентов с ожирением, характерна позитивная связь между таксонами- обитателями почвы и воды и сывороточной концентрацией BDNF. В целом, большее разнообразие микробиома крови, характерное для пациентов с МНЗО, обуславливает большее количество таксонов, для которых была выявлена связь с содержанием BDNF, по сравнению МЗО. У пациентов с МЗО единственным таксоном, продемонстрировавшим положительную корреляцию с содержанием этого нейротрофина был Micrococcus spp. Для пациентов с МЗО, как и для пациентов с МНЗО, был характерен уникальный спектр таксонов с отрицательной корреляцией с уровнем BDNF. Преимущественно эти таксоны были представлены обитателями кишечника, а также таксонами, характерными для продуктов питания. Следует отметить, что выделенная негативная взаимосвязь “Eubacterium–BDNF” у пациентов с МЗО не является новой, Kim и соавт. показали, что содержание Eubacterium в микробиоме кишечника также отрицательно коррелирует с содержанием BDNF [39].
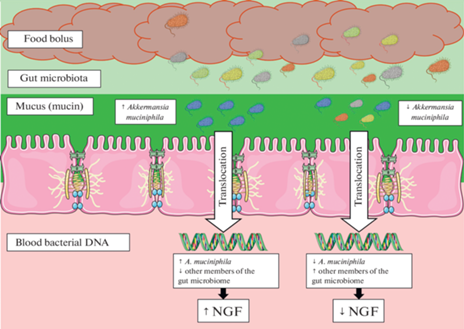
Анализ взаимосвязи содержания отдельных таксонов микробиома крови и NGF показал, что у пациентов Группы 1 одним из основных таксонов, положительно коррелировавших с концентрацией этого нейротрофина, был Akkermansia muciniphila. В последние годы роли A. muciniphila в кишечном микробиоме уделяется пристальное внимание. Являясь облигатным анаэробом, A. muciniphila обитает непосредственно в толще муцина, в отличие от других представителей кишечного микробиома, которые в основном формируют микробный барьер поверх муцинового слоя [40, 41]. Было показано, что A. muciniphila участвует в поддержании целостности эпителиоцитов кишечника и нормальной толщины слизистого слоя, а также регулирует экспрессию генов в энтероцитах и иммунокомпетентных клетках [42]. Применение этого микроорганизма в качестве пробиотика представляется перспективным с целью уменьшения проницаемости кишечника и нормализации метаболического гомеостаза у пациентов с ожирением и сахарным диабетом II типа, для которых характерно снижение содержания A. muciniphila [43]. Микробная транслокация из кишечника, очевидно, происходит из муцинового слоя, находящегося непосредственно поверх кишечного эпителия. Можно предполагать, что бо́льшее содержание A. muciniphila препятствует проникновению других микроорганизмов в слой слизи и их транслокации из просвета кишечника (рис. 2). Появление положительной взаимосвязи “A. muciniphila–NGF” у здоровых доноров свидетельствует о том, что деятельность этого микроорганизма, направленная на поддержание целостности стенки кишечника, ассоциирована с более высокими уровнями NGF. По-видимому, микробная транслокация ряда представителей кишечной флоры негативно сказывается на содержании NGF. Подобное предположение подтверждают многочисленными негативными взаимосвязями между уровнем этого нейротрофина и представителями кишечной флоры, такими как [Eubacterium] spp., Clostridium spp. и Oxalobacteraceae.
Рис. 2.
Возможное влияние A. muciniphila на транслокацию других представителей кишечного микробиома и формирование пула NGF сыворотки у пациентов Группы 1, комментарии в тексте. Рисунок создан с частичным использованием изображений Servier Medical Art, распространяемых по лицензии Creative Commons Attribution 3.0 Unported License [44].
У пациентов с ожирением и, в частности, с МНЗО, единственным таксоном, положительно коррелировавшим с уровнем NGF, был Ruminococcus bromii. Следует отметить, что R. bromii является одним из основных бутират-продуцирующих бактерий кишечника, который, в свою очередь, способен усиливать экспрессию NGF [45, 46]. Возможно, появление связи “R. bromii–NGF” обуславливается бутиратом и объяснимо повышенной проницаемостью кишечника, характерной для ожирения, особенно метаболически нездорового типа. У пациентов с МЗО такой связи выявлено не было, что, скорее всего, связано с более редкой представленностью этого таксона в микробиоме крови. ДНК R. bromii было выделено почти у половины (n = 17) пациентов с МНЗО, тогда как в группе лиц с МЗО ДНК данного вида определялась только у 2 пациентов. Так же, как и у здоровых доноров, у пациентов с МНЗО был выделен ряд таксонов, характерных для кишечного микробиома, и негативно коррелировавших с содержанием NGF. Однако у пациентов с МЗО подобные таксоны практически отсутствовали. Ранее мы высказывали предположение, что более разнообразный кишечный микробиом, характерный для лиц с МЗО обуславливает меньшую проницаемость кишечной стенки для микробной ДНК [11].
Несмотря на то, что PAMPs и провоспалительные цитокины, такие как IL1β, IL6 и TNFα, способствуют продукции NGF [25], полученные нами данные предполагают, что транслокация бактериальной ДНК некоторых таксонов из кишечника, в целом, негативно взаимосвязана с содержанием NGF в плазме. При этом подобная динамика наблюдается как у здоровых лиц, так и у пациентов с ожирением. Можно предполагать, что влияние транслокации кишечной микробиоты на уровень NGF не ограничивается потенцированием воспаления, а включает пока не установленные сигнальные молекулы и/или сигнальные пути.
ВЫВОДЫ
Транслокация бактериальной ДНК в кровь может оказывать влияние на сывороточную концентрацию нейротрофинов BDNF и NGF. Транслокация ДНК таксонов-обитателей почв и вод у здоровых доноров оказывает негативное влияние на содержание BDNF, тогда как при ожирении – позитивное. Подобная взаимосвязь характерна для пациентов с метаболически нездоровым ожирением, но не для лиц с метаболически здоровым типом. Ожирение также ассоциировано с появлением негативной взаимосвязи между сывороточным уровнем BDNF и представленностью ДНК таксонов-обитателей желудка в микробиоме крови.
Среди таксонов микробиома крови, взаимосвязанных с сывороточной концентрацией NGF, наибольшим влиянием обладают представители микробного сообщества кишечника. Как у здоровых лиц, так и у пациентов с ожирением, по-видимому, транслокация бактериальной ДНК из кишечника оказывала преимущественно негативное влияние на содержание этого нейротрофина. У здоровых доноров была выделена положительная ассоциация между уровнем NGF и Akkermansia muciniphila – таксоном, участвующим в поддержании целостности кишечной стенки. Для пациентов с ожирением, особенно с метаболически нездоровым типом, была характерна позитивная связь NGF с Ruminococcus bromii, который представляет один из основных бутират-продуцирующих таксонов кишечника.
В целом, взаимосвязь микробной ДНК крови и сывороточной концентрации нейротрофинов зависит от источников транслокации, проницаемости внешних барьеров, особенностей микробиомов (кишечника, кожи и т.д.), а также наличия или отсутствия метаболических нарушений у пациентов с разной массой тела.
Список литературы
NCD Risk Factor Collaboration (NCD-RisC) (2016) Trends in adult body-mass index in 200 countries from 1975 to 2014: A pooled analysis of 1698 population-based measurement studies with 19.2 million participants. Lancet 387: 1377–1396. https://doi.org/10.1016/S0140-6736(16)30054-X
Iacobini C, Pugliese G, Blasetti Fantauzzi C, Federici M, Menini S (2019) Metabolically healthy versus metabolically unhealthy obesity. Metabolism 92: 51–60. https://doi.org/10.1016/j.metabol.2018.11.009
Stino AM, Smith AG (2017) Peripheral neuropathy in prediabetes and the metabolic syndrome. J Diabetes Invest 8: 646–655. https://doi.org/10.1111/jdi.12650
Rios M (2014) Neurotrophins and the regulation of energy balance and body weight. Handb Exp Pharmacol 220: 283–307. https://doi.org/10.1007/978-3-642-45106-5_11
Cao Y, Wang H, Zeng W (2018) Whole-tissue 3D imaging reveals intra-adipose sympathetic plasticity regulated by NGF-TrkA signal in cold-induced beiging. Protein Cell 9: 527–539. https://doi.org/10.1007/s13238-018-0528-5
Camerino C, Conte E, Cannone M, Caloiero R, Fonzino A, Tricarico D (2016) Nerve growth factor, brain-derived neurotrophic factor and osteocalcin gene relationship in energy regulation, bone homeostasis and reproductive organs analyzed by mrna quantitative evaluation and linear correlation analysis. Front Physiol 7: 1–9. https://doi.org/10.3389/fphys.2016.00456
Tseng C, Wu C (2018) The gut microbiome in obesity. J Formos Med Assoc 1–7. https://doi.org/10.1016/j.jfma.2018.07.009
Jamar G, Ribeiro DA, Pisani LP (2020) High-fat or high-sugar diets as trigger inflammation in the microbiota-gut-brain axis. Crit Rev Food Sci Nutr 1–19. https://doi.org/10.1080/10408398.2020.1747046
Margolis KG, Cryan JF, Mayer EA (2022) The Microbiota-Gut-Brain Axis : From Motility to Mood. Gastroenterology 160: 1486–1501. https://doi.org/10.1053/j.gastro.2020.10.066
Massier L, Blüher M, Kovacs P, Chakaroun RM (2021) Impaired Intestinal Barrier and Tissue Bacteria: Pathomechanisms for Metabolic Diseases. Front Endocrinol (Lausanne) 12: 1–18. https://doi.org/10.3389/fendo.2021.616506
Шестопалов АВ, Колесникова ИМ, Гапонов АМ, Григорьева ТВ, Хуснутдинова ДР, Камальдинова ДР, Волкова НИ, Макаров ВВ, Юдин СМ, Румянцев АГ, Румянцев СА (2022) Влияние метаболического типа ожирения на микробиом крови. Вопр биол мед фармацевт химии 25: 35–41. [Shestopalov AV, Kolesnikova IM, Gaponov AM, Grigoryeva TV, Khusnutdinova DR, Kamaldinova DR, Volkova NI, Makarov VV, Yudin SM, Rumyantsev AG, Rumyantsev SA (2022) Effect of metabolic type of obesity on blood microbiome. Problems Biol Med Pharmac Chem 25(2): 35−41. (In Russ)]. https://doi.org/10.29296/25877313-2022-02-06
Kumagai Y, Takeuchi O, Akira S (2008) TLR9 as a key receptor for the recognition of DNA. Adv Drug Deliv Rev 60: 795–804. https://doi.org/10.1016/j.addr.2007.12.004
Thomalla M, Schmid A, Neumann E, Pfefferle PI, Müller-Ladner U, Schäffler A, Karrasch T (2019) Evidence of an anti-inflammatory toll-like receptor 9 (TLR 9) pathway in adipocytes. J Endocrinol 240: 325–343. https://doi.org/10.1530/JOE-18-0326
Guillemot-Legris O, Muccioli GG (2017) Obesity-Induced Neuroinflammation: Beyond the Hypothalamus. Trends Neurosci 40: 237–253. https://doi.org/10.1016/j.tins.2017.02.005
Kumar V (2019) Toll-like receptors in the pathogenesis of neuroinflammation. J Neuroimmunol 332: 16–30. https://doi.org/10.1016/j.jneuroim.2019.03.012
Cheng Z, Abrams ST, Austin J, Toh J, Wang SS, Wang Z, Yu Q, Yu W, Toh CH, Wang G (2020) The Central Role and Possible Mechanisms of Bacterial DNAs in Sepsis Development. Mediators Inflamm 2020: 7418342. https://doi.org/10.1155/2020/7418342
Motwani M, Pesiridis S, Fitzgerald KA (2019) DNA sensing by the cGAS–STING pathway in health and disease. Nat Rev Genet 20: 657–674. https://doi.org/10.1038/s41576-019-0151-1
Bai J, Cervantes C, Liu J, He S, Zhou H, Zhang B, Cai H, Yin D, Hu D, Li Z, Chen H, Gao X, Wang F, O’Connor JC, Xu Y, Liu M, Dong LQ, Liu F (2017) DsbA-L prevents obesity-induced inflammation and insulin resistance by suppressing the mtDNA release-activated cGAS-cGAMP-STING pathway. Proc Natl Acad Sci U S A 114: 12196–12201. https://doi.org/10.1073/pnas.1708744114
Bai J, Cervantes C, He S, He J, Plasko GR, Wen J, Li Z, Yin D, Zhang C, Liu M, Dong LQ, Liu F (2020) Mitochondrial stress-activated cGAS-STING pathway inhibits thermogenic program and contributes to overnutrition-induced obesity in mice. Commun Biol 3: 257. https://doi.org/10.1038/s42003-020-0986-1
Kumari P, Russo AJ, Shivcharan S, Rathinam VA (2021) AIM2 in health and disease: inflammasome and beyond. Immunol Rev 297:83–95. https://doi.org/10.1111/imr.12903.AIM2
Engin AB (2017) Adipocyte-Macrophage Cross-Talk in Obesity. Adv Exp Med Biol 960: 327–343. https://doi.org/10.1007/978-3-319-48382-5_14
Murphy AJ, Kraakman MJ, Kammoun HL, Dragoljevic D, Lee MKS, Lawlor KE, Wentworth JM, Vasanthakumar A, Gerlic M, Whitehead LW, DiRago L, Cengia L, Lane RM, Metcalf D, Vince JE, Harrison LC, Kallies A, Kile BT, Croker BA, Febbraio MA, Masters SL (2016) IL-18 Production from the NLRP1 Inflammasome Prevents Obesity and Metabolic Syndrome. Cell Metab 23: 155–164. https://doi.org/10.1016/j.cmet.2015.09.024
Heese K, Fiebich BL, Bauer J, Otten U (1998) NF-kappaB modulates lipopolysaccharide-induced microglial nerve growth factor expression. Glia 22: 401–407. https://doi.org/10.1002/(sici)1098-1136(199804)22:4<401::aid-glia9>3.0.co;2-5
Heese K, Inoue N, Sawada T (2006) NF-κB Regulates B-Cell-Derived Nerve Growth Factor Expression. Cell Mol Immunol 3: 63–66.
Minnone G, De Benedetti F, Bracci-Laudiero L (2017) NGF and its receptors in the regulation of inflammatory response. Int J Mol Sci 18. https://doi.org/10.3390/ijms18051028
Rage F, Silhol M, Tapia-Arancibia L (2006) IL-1beta regulation of BDNF expression in rat cultured hypothalamic neurons depends on the presence of glial cells. Neurochem Int 49: 433–441. https://doi.org/10.1016/j.neuint.2006.03.002
Expert panel on detection evaluation and treatment of high blood cholesterol in adults (2001) Executive summary of the third report (NCEP) – adult treatment panel III. J Am Med Assoc 285: 2486–2497. https://doi.org/10.1001/jama.285.19.2486
Kolesnikova IM, Rumyantsev SA, Volkova NI, Gaponov AM, Grigor’eva TV, Laikov AV, Makarov VV, Yudin SM, Borisenko OV, Shestopalov AV (2022) Influence of Obesity and Its Metabolic Type on the Serum Concentration of Neurotrophins. Neurochem J 16: 200–206.https://doi.org/10.1134/S1819712422020088
Hirt PA, Castillo DE, Yosipovitch G, Keri JE (2019) Skin changes in the obese patient. J Am Acad Dermatol 81: 1037–1057. https://doi.org/10.1016/j.jaad.2018.12.070
Son MJ, Yang G-J, Jo E-H, Shim Y-H, Kang S-J, Hong J-E, Kim Y-E, Lee J-E, Chun J, Park S, Jung J, Park M-C (2019) Association of atopic dermatitis with obesity via a multi-omics approach: A protocol for a case-control study. Medicine (Baltimore) 98: e16527. https://doi.org/10.1097/MD.0000000000016527
Guseva D, Rüdrich U, Kotnik N, Gehring M, Patsinakidis N, Agelopoulos K, Ständer S, Homey B, Kapp A, Gibbs BF, Ponimaskin E, Raap U (2020) Neuronal branching of sensory neurons is associated with BDNF-positive eosinophils in atopic dermatitis. Clin Exp Allergy 50: 577–584. https://doi.org/10.1111/cea.13560
Sideleva O, Black K, Dixon A (2013) Effects of obesity and weight loss on airway physiology and inflammation in asthma. Pulm Pharmacol Ther 26: 455–458. https://doi.org/10.1201/b13996-3
Sreter KB, Popovic-Grle S, Lampalo M, Konjevod M, Tudor L, Nikolac Perkovic M, Jukic I, Bingulac-Popovic J, Safic Stanic H, Markeljevic J, Pivac N, Svob Strac D (2020) Plasma Brain-Derived Neurotrophic Factor (BDNF) Concentration and BDNF/TrkB Gene Polymorphisms in Croatian Adults with Asthma. J Pers Med 10. https://doi.org/10.3390/jpm10040189
Pascal M, Perez-Gordo M, Caballero T, Escribese MM, Lopez Longo MN, Luengo O, Manso L, Matheu V, Seoane E, Zamorano M, Labrador M, Mayorga C (2018) Microbiome and Allergic Diseases. Front Immunol 9: 1584. https://doi.org/10.3389/fimmu.2018.01584
Zhang L, Yin Y, Zhang H, Zhong W, Zhang J (2017) Association of asthma diagnosis with leptin and adiponectin: a systematic review and meta-analysis. J Investig Med Off Publ Am Fed Clin Res 65: 57–64.https://doi.org/10.1136/jim-2016-000127
Jiménez-Cortegana C, Ortiz-García G, Serrano A, Moreno-Ramírez D, Sánchez-Margalet V (2021) Possible Role of Leptin in Atopic Dermatitis : A Literature Review. Biomolecules 11: 1–11.https://doi.org/10.3390/biom11111642
Li C, Meng F, Lei Y, Liu J, Liu J, Zhang J, Liu F, Liu C, Guo M, Lu X-Y (2021) Leptin regulates exon-specific transcription of the Bdnf gene via epigenetic modifications mediated by an AKT/p300 HAT cascade. Mol Psychiatry 26: 3701–3722. https://doi.org/10.1038/s41380-020-00922-0
Rohm T V, Fuchs R, Müller RL, Keller L, Baumann Z, Bosch AJT, Schneider R, Labes D, Langer I, Pilz JB, Niess JH, Delko T, Hruz P, Cavelti-Weder C (2021) Obesity in Humans Is Characterized by Gut Inflammation as Shown by Pro-Inflammatory Intestinal Macrophage Accumulation. Front Immunol 12: 668654. https://doi.org/10.3389/fimmu.2021.668654
Kim C-S, Cha L, Sim M, Jung S, Chun WY, Baik HW, Shin D-M (2021) Probiotic Supplementation Improves Cognitive Function and Mood with Changes in Gut Microbiota in Community-Dwelling Older Adults: A Randomized, Double-Blind, Placebo-Controlled, Multicenter Trial. J Gerontol A Biol Sci Med Sci 76: 32–40. https://doi.org/10.1093/gerona/glaa090
Geerlings SY, Kostopoulos I, de Vos WM, Belzer C (2018) Akkermansia muciniphila in the human gastrointestinal tract: When, where, and how? Microorganisms 6: 1–26. https://doi.org/10.3390/microorganisms6030075
Portincasa P, Bonfrate L, Khalil M, De Angelis M, Calabrese FM, D’amato M, Wang DQH, Di Ciaula A (2022) Intestinal Barrier and Permeability in Health, Obesity and NAFLD. Biomedicines 10: 1–62. https://doi.org/10.3390/biomedicines10010083
Zhang T, Li Q, Cheng L, Buch H, Zhang F (2019) Akkermansia muciniphila is a promising probiotic. Microb Biotechnol 12: 1109–1125. https://doi.org/10.1111/1751-7915.13410
Xu Y, Wang N, Tan HY, Li S, Zhang C, Feng Y (2020) Function of Akkermansia muciniphila in Obesity: Interactions With Lipid Metabolism, Immune Response and Gut Systems. Front Microbiol 11: 1–12. https://doi.org/10.3389/fmicb.2020.00219
Servier Medical Art by Servier is licensed under a Creative Commons Attribution 3.0 Unported License. https://smart.servier.com/. Accessed 6 Jul 2022
Rosés C, Cuevas-Sierra A, Quintana S, Riezu-Boj JI, Martínez JA, Milagro FI, Barceló A (2021) Gut Microbiota Bacterial Species Associated with Mediterranean Diet-Related Food Groups in a Northern Spanish Population. Nutrients 13. https://doi.org/10.3390/nu13020636
Long X, Li M, Li L-X, Sun Y-Y, Zhang W-X, Zhao D-Y, Li Y-Q (2018) Butyrate promotes visceral hypersensitivity in an IBS-like model via enteric glial cell-derived nerve growth factor. Neurogastroenterol Motil 30: e13227. https://doi.org/10.1111/nmo.13227
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


