Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1497-1510
Роль оксида азота (NO) в механизмах структурных изменений интерстиция почечной медуллы в условиях гипотиреоза у крыс с различным уровнем вазопрессина в крови
П. Д. Правикова 1, *, Л. Н. Иванова 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
* E-mail: PollyPravi@yandex.ru
Поступила в редакцию 29.08.2022
После доработки 07.10.2022
Принята к публикации 11.10.2022
- EDN: DWWMDZ
- DOI: 10.31857/S0869813922110097
Аннотация
У крыс линии WAG c высоким уровнем вазопрессина и у вазопрессин-дефицитной линии крыс Brattleboro в условиях гипотиреоза исследована роль почечного аутакоида оксида азота (NO) в механизмах структурных изменений интерстиция почечной медуллы, влияющих на внеклеточную проницаемость матрикса для воды и ионов. Установлено, что гипотиреоз у крыс WAG не приводит к существенным изменениям параметров гидроуретической функции, тогда как для крыс Brattleboro характерна антидиуретическая реакция вследствие активации реабсорбции осмотически свободной воды. Предполагается, что отсутствие изменений параметров гидроуреза у крыс WAG при гипотиреозе обусловлено увеличением в медуллярной зоне почки содержания гиалуронана, основного компонента интерстиция, образующего барьер на пути диффузии воды и ионов. В то же время у крыс Brattleboro стимуляция концентрирующей функции при моделировании гипотиреоза не сопровождается существенными изменениями состояния внеклеточного матрикса, который для данной линии крыс в интактном состоянии характеризуется практически полным отсутствием гиалуронана. Установлено, что NO играет существенную роль в изменении структуры почечного интерстиция у крыс WAG в условиях гипотиреоза. Блокада синтеза NO с помощью L-NAME приводит к устранению выявленных при гипотиреозе изменений внеклеточного матрикса сосочка почки в связи с изменением до базальных значений контрольной группы уровня экспрессии гена гиалуронансинтазы-2 (HAS2), кодирующего фермент синтеза гиалуронана. Результаты исследования позволяют заключить, что гипотиреоз приводит к нарастанию содержания гиалуронана в интерстиции почечной медуллы, причем ключевую роль в проявлении данного эффекта играет NO, базальная активность которого в сосочке почки зависит от уровня вазопрессина в крови.
Процесс осмотического концентрирования реализуется в зоне почечной медуллы, где барьер, разделяющий элементы концентрирующего механизма, представлен не только эпителием канальцев, но и экстрацеллюлярным матриксом, определяющим внеклеточную проницаемость для диффузии воды и ионов [1]. Одним из главных компонентов почечного интерстиция является кислый гликозаминогликан (ГАГ), гиалуронан (ГН) [2, 3], формирующий в сосочке почки гель с высоким сопротивлением для диффузии жидкости [4]. Процесс биосинтеза ГН в соматических тканях млекопитающих, в том числе в интерстициальных клетках почки, осуществляется с участием ключевого фермента гиалуронансинтазы (НАS) [5], тогда как основную роль в деградации полимера играет семейство ферментов гиалуронидаз (HYAL1, 2) [6]. Нейрогипофизарный гормон вазопрессин, основной регулятор осмотического гомеостаза, реализует антидиуретический эффект не только путем стимуляции факультативной реабсорбции воды [7], но также посредством контроля проницаемости внеклеточного матрикса, регулируя гиалуронидазную активность [8, 9] и экспрессию генов метаболизма ГН [10]. Установлена тесная зависимость эффективности осмотического концентрирования от взаимодействия системных гормонов и тканевых аутакоидов в регуляции содержания ГН в интерстиции сосочка почки [11, 12]. Однако механизм вовлечения ГН интерстиция почки в процесс осмотического концентрирования остается дискуссионным и требует дальнейших исследований [13].
Тиреоидные гормоны (ТГ), секретируемые щитовидной железой, являются одним из главных факторов в системе регуляции водно-электролитного гомеостаза, влияющих как на почечную гемодинамику [14], так и на реабсорбцию солей и воды [15, 16]. Гипотиреоз сопровождается снижением скорости клубочковой фильтрации [17] и нарушением водовыделительной функции на фоне гиперсекреции ВП [18, 19], однако изменения внеклеточного матрикса почечной медуллы, определяющего скорость диффузии воды и ионов между элементами концентрирующего механизма, при гипотиреозе остается неизученными. Данные о развитии тканевых отеков при гипотиреозе вследствие увеличения содержания муцинов и ГН [20, 21] позволяют предположить, что дисфункция щитовидной железы приводит к изменению содержания ГН в интерстиции почки, образующего барьер на пути диффузии воды и ионов из просвета канальцев в кровоток.
Адекватность работы любой регуляторной системы зависит от факторов, модулирующих эффект основного гормона, и в последние годы значительное внимание уделяется роли местных, аутакоидных агентов, синтез которых нередко активируется самим гормоном, формирующим отрицательную обратную связь [22]. При хроническом гипотиреозе наблюдается увеличение уровня почечного аутакоида NO в сосочке почки [23], что позволяет предположить участие данного фактора в регуляции состояния внеклеточного матрикса почечной медуллы при подавлении синтеза ТГ. Целью данной работы явилось исследование роли NO в механизмах структурных изменений интерстициального матрикса почечной медуллы в условиях гипотиреоза у крыс с различным уровнем эндогенного вазопрессина в крови.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на крысах инбредной линии WAG (Wistar Albino Glaxo) с высоким уровнем вазопрессина в крови, а также на гомозиготных крысах Brattleboro, лишенных вазопрессина вследствие мутации гена, кодирующего предшественник гормона [24]. В опытах использованы крысы в возрасте 60 дней и массой 150–200 г из вивария конвенциональных животных Института цитологии и генетики СО РАН, содержавшиеся в условиях стандартного рациона со свободным доступом к питьевой воде и сухому корму. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ (Приложение к Приказу Министерства здравоохранения РФ № 267 от 19.06.2003), а также с учетом международных рекомендаций по работе с экспериментальными животными.
Животные каждой линии были разделены на 3 экспериментальные группы (по 9 особей в каждой): 1) контрольная группа; 2) крысы в условиях блокады синтеза тиреоидных гормонов раствором метимазола; 3) гипотиреоидные крысы с блокадой синтеза NO путем введения L-NAME. Крысы WAG в течение 6 недель потребляли 0.05%-ный раствор метимазола (Тирозол, Merk, Германия), блокирующего пероксидазу, участвующую в йодировании ТГ [25]. Учитывая межлинейные различия в суточном объеме потребляемой жидкости, для уравнивания суточной дозы препарата особи Brattleboro, характеризовавшиеся полидипсией, получали для питья 0.01%-ный раствор метимазола. Контрольные особи двух линий потребляли дистиллированную воду. Принимая во внимание увеличение в условиях гипотиреоза уровня NO во многих тканях [26, 27], в том числе в почке [23], для выявления значимости NO при гипотиреозе была предпринята серия экспериментов, в которых блокада синтеза NO при внутрибрюшинном введении L-NAME – неселективного ингибитора синтаз NO – дважды в день в течение последних 2 сут в дозе 3 мг на 100 г массы тела [28] осуществлялась на фоне подавления синтеза ТГ метимазолом.
По окончании экспериментального периода животных взвешивали и на 2 ч помещали в индивидуальные клетки с проволочным дном для сбора спонтанно экскретируемой мочи, затем животных анестезировали тиопенталом натрия (10 мг/100 г массы тела, внутрибрюшинно) и забирали пробы крови и образцы почечной ткани для гистохимического и молекулярно-генетического анализа.
Осмоляльность мочи и сыворотки крови определяли криоскопическим методом (миллиосмометр ОСКР-1М КИВИ, Россия). Концентрацию креатинина в моче и сыворотке крови определяли методом Яффе на спектрофотометре (BioPhotometr plus, “Eppendorf”, Германия, 490 нм), скорость клубочковой фильтрации рассчитывали по клиренсу эндогенного креатинина. Расчет почечных функций проводили по стандартным формулам на 100 г массы тела. Концентрацию общего уровня тетрайодтиронина (T4) в сыворотке крови определяли иммуноферментным методом (Rat thyroxine (T4) ELISA Kit, Сusabio, CSB-E05082r).
Пробоподготовку почечной ткани для гистохимического анализа проводили по стандартному протоколу [29]. Окрашивание срезов толщиной 5 мкм для специфического выявления кислых ГАГ производили альциановым синим (БиоВитрум, Россия). Гистологические препараты изучали с использованием светового микроскопа Axioscop 40 (Carl Zeiss), морфометрическое исследование высоты эпителиоцитов собирательных трубок середины сосочка проводили с помощью программы AxioVision 4.5.
Уровень экспрессии генов, кодирующих ферменты метаболизма гиалуроновой кислоты (HAS2, Hyal2) в почечной медулле, определяли методом ПЦР в реальном времени (ПЦР-РВ). В качестве внутреннего стандарта использовались праймеры для гена, кодирующего белок “домашнего хозяйства” гипоксантинфосфорибозил-трансферазу-1 (HPRT1). Выделенные образцы ткани почки помещали в стерильные пробирки, замораживали в жидком азоте и хранили при –70°C. Тотальную РНК из ткани почек выделяли при помощи набора реагентов Aurum Total RNA Mini kit (Bio-Rad, США) на спин-колонках согласно прилагаемому протоколу. Концентрацию РНК в полученном образце измеряли на спектрофотометре BioPhotometer plus (“Eppendorf”, Германия). Для получения кДНК использовали коммерческий набор “MMLV RT Kit” (“Евроген”, Россия): смешивали 0.5–1 мкг тотальной РНК в 20 мкл реакционной смеси. Реакционная смесь инкубировалась в течение 60 мин при 42°C, для остановки реакции смесь прогревали в течение 10 мин при 70°C. ПЦР-РВ проводили в присутствии красителя EVA Green (Синтол, Россия) объемом 20 мкл, содержащей 2 мкл кДНК, 8 мкл 2.5× реакционной смеси, 8 мкл деионизированной воды, 1 мкл MgCl2 25 мМ, по 0.5 мкл прямого и обратного праймеров с концентрацией 8 пкмоль/мкл (Биосинтез, Новосибирск, Россия). А-мплификацию проводили в системе CFX96 (BioRad, США) по следующей схеме: 1) денатурация 95°C – 5 мин; 2) денатурация 95°C – 10 с, отжиг при оптимальной температуре для выбранных праймеров (60°C) – 30 с, элонгация 72°C – 20 с, 39 циклов; 3) определение кривых плавления продуктов амплификации в диапазоне температур от 65 до 95°C при шаге в 0.5°C для подтверждения специфичности амплификации и отсутствия димерных праймеров. Ген-специфичные праймеры, синтезированные в группе олигонуклеотидного синтеза Института химической биологии и фундаментальной медицины СО РАН, представлены в табл. 1. После проведения ПЦР-РВ данные анализировали в пакете программ CFX Manager Software ver. 3.1 (Bio-Rad, США). Каждое измерение нормировали относительно экспрессии гена HPRT1 и рассчитывали по методу ΔΔCt [30].
Таблица 1.
Последовательность ген-специфичных олигонуклеотидных праймеров
| Ген | Последовательность праймера | Длина ампликона, п.н. | Тm(°C) | Источник |
|---|---|---|---|---|
| Has2 | F: 5'-CTTCCGAGAGTGGCTATACAATGC-3' | 198 | 61 | [31] |
| R: 5'-GCGAAAGACGACTTGATGAGACC-3' | 62 | |||
| Hyal2 | F: 5'-CGTTACGTCAAGGCAGTCAG-3' | 188 | 59 | [32] |
| R: 5'-AGGTACACGGAGGGAAAGAG-3' | 58 | |||
| HPRT1 | F: 5'-AGTTTGTTGTTGGATATGCCCTTG-3' | 126 | 60 | [33] |
| R: 5'-TGTAGATTCAACTTGCCGCTGTC-3' | 61 |
Данные представлены в виде среднего значения ± ошибка среднего (M ± SEM). Достоверность различий оценивали в программе Statistica 8.0 с помощью апостериорного LSD критерия Фишера для множественных сравнений. Для парного сравнения средних между линиями крыс применялся критерий Стьюдента для независимых выборок. Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
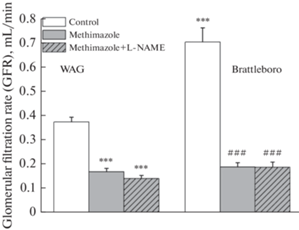
Параметры осмотического концентрирования у контрольных крыс линий WAG и вазопрессин-дефицитных Brattleboro, содержавшихся на стандартном водно-пищевом рационе, существенно различались (табл. 2). У крыс WAG установлена низкая скорость мочеотделения, тогда как интактные вазопрессин-дефицитные особи Brattleboro характеризовались полиурией вследствие снижения реабсорбции осмотически свободной воды (табл. 2) при увеличении скорости клубочковой фильтрации (рис. 1). У крыс обеих линий, содержавшихся в течение 6 недель в условиях подавления метимазолом синтеза ТГ, было выявлено значительное снижение общего уровня тетрайодтиронина (Т4) как у крыс WAG (152.6 ± 3.9 нг/мл в контроле; 66.8 ± 13.4 нг/мл при гипотиреозе, р < 0.001), так и у крыс Brattleboro (158.5 ± 3.7 нг/мл в контроле; 28.8 ± 8.7 нг/мл при гипотиреозе, р < 0.001). Моделирование гипотиреоза вызвало снижение скорости клубочковой фильтрации у крыс обеих линий (рис. 1), тогда как параметры гидроуретической функции почек достоверно изменились лишь у вазопрессин-дефицитной линии Brattleboro (табл. 2). У гипотиреоидных крыс Brattleboro, в отличие от линии WAG, была зафиксирована антидиуретическая реакция: снижение диуреза вследствие увеличения реабсорбции осмотически свободной на фоне замедления скорости клубочковой фильтрации. Вместе с тем устранение действия NO при введении L-NAME на фоне гипотиреоза способствовало у крыс WAG снижению реабсорбции осмотически свободной воды, тогда как у линии Brattleboro, напротив, установлена стимуляция концентрирующей функции почек (табл. 2).
Таблица 2.
Влияние блокады NO (L-NAME) на параметры гидроуретической функции у крыс линий WAG и Brattleboro в условиях моделирования гипотиреоза
| Параметр | Экспериментальные группы | |||||
|---|---|---|---|---|---|---|
| WAG | Brattleboro | |||||
| контроль | метимазол | метимазол + L-NAME | контроль | метимазол | метимазол + L-NAME | |
| Диурез (V), мкл/мин | 1.66 ± 0.25 | 1.25 ± 0.1 | 2.04 ± 0.16 | 31.23 ± 1.49*** | 20.32 ± 1.41### | 12.27 ± 2.89^ |
| Реабсорбция осмотически свободной воды $T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{C}$, мкл/мин | 9.04 ± 1.1 | 7.38 ± 0.3 | 5.06 ± 0.61&& | –13.6 ± 1.5*** | –7.4 ± 1.1## | –1.9 ± 1.5^ |
Все значения представлены как M ± SEM. Различия достоверны при *** p < 0.001 – сравнение с контрольной группой крыс линии WAG; &&p < 0.01 – сравнение с гипотиреоидной группой WAG; ##p < 0.01, ### p < 0.001 – сравнение с контрольными показателями линии Brattleboro; ^ p < 0.05 – сравнение с гипотиреоидной группой крыс линии Brattleboro.
Рис. 1.
Скорость клубочковой фильтрации (СКФ) в условиях блокады синтеза NO введением L-NAME на фоне моделирования гипотиреоза у крыс линий WAG и Brattleboro (M ± SEM). Достоверность различий: ***p < 0.001 – сравнение с контрольной группой WAG; ###p < 0.001 – сравнение с контрольной группой Brattleboro.
С изменением параметров осмотического концентрирования у экспериментальных крыс коррелируют морфологические перестройки эпителиоцитов собирательных трубок гормон-чувствительной области средней трети сосочка, анализ состояния которых представляет существенный интерес, поскольку высота клеток зависит от осмоляльности интерстициальной и внутриканальцевой жидкости и является отражением изменений уровня осмотического концентрирования. Высота эпителиоцитов собирательных трубок различалась у контрольных групп: у крыс линии WAG эпителий был заметно уплощен (5.51 ± 0.03 мкм) по сравнению с особями линии Brattleboro (5.88 ± 0.04 мкм). У гипотиреоидных крыс WAG при отсутствии изменений параметров гидроуреза высота эпителиоцитов не изменялась (5.51 ± 0.03 мкм в контроле; 5.62 ± 0.04 мкм при гипотиреозе), тогда как блокада синтеза NO на фоне диуретического ответа приводила к увеличению высоты эпителиоцитов собирательных трубок почечной медуллы (6.03 ± 0.06 мкм, р < 0.001). Между тем у крыс Brattleboro при гипотиреозе антидиуретическая реакция сопровождалась уплощением эпителиоцитов собирательных трубок (5.88 ± 0.04 мкм в контроле; 4.67 ± 0.04 мкм при гипотиреозе, р < 0.001), которое частично нивелировалось при введении L-NAME (5.44 ± 0.03 мкм, р < 0.001).
Барьер на пути движения воды и солей из почечных канальцев в кровоток представлен не только эпителием, но также внеклеточным матриксом, основным компонентом которого является ГН, разделяющий элементы концентрирующей системы и определяющий скорость диффузии воды и солей по осмотическому градиенту [1, 10]. У контрольных крыс WAG, экскретирующих мочу с осмоляльностью выше 2000 мОсм/кг H2O, выявлена типичная для высокого уровня секреции вазопрессина структура медуллярной зоны почек: уплощенный эпителий собирательных трубок, открытая дренажная сеть множества капилляров и окрашивание кислых ГАГ интерстиция почечной медуллы (рис. 2a). Между тем гомозиготные вазопрессин-дефицитные крысы Bralleboro, экскретирующие гипотоничную мочу, характеризовались практически полным отсутствием ГАГ в интерстиции гормон-чувствительной части средней трети сосочка почки (рис. 2b).
Рис. 2.
Локализация гиалуронана (ГН) средней трети сосочка в условиях блокады синтеза NO введением L-NAME на фоне гипотиреоза у крыс линий WAG и Brattleboro. (a) – WAG контроль (2050 мОсм/кг Н2О); (b) – Brattleboro контроль (197 мОсм/кг Н2О); (c) – гипотиреоидная группа WAG (2130 мОсм/кг Н2О); (d) – гипотиреоидная группа Brattleboro (300 мОсм/кг Н2О); (e) – гипотиреоидные WAG + L-NAME (1083 мОсм/кг Н2О); (f ) – гипотиреоидные Brattleboro + L-NAME (458 мОсм/кг Н2О). Примечание: в скобках дано значение осмоляльности мочи; окрашивание срезов алциановым синим, увеличение объектива ×63. Снимки выполнены с помощью цифровой фотонасадки AxioCam.
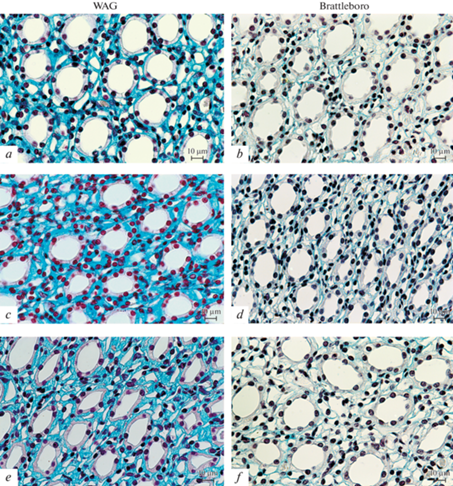
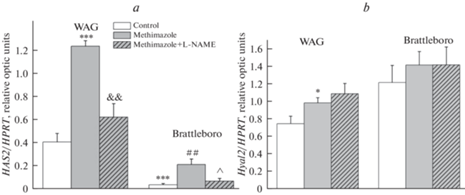
Подавление синтеза тиреоидной системы при потреблении раствора метимазола сопровождалось структурными перестройками интерстиция почечной медуллы только у крыс WAG с высоким уровнем эндогенного вазопрессина в крови. Согласно качественному гистохимическому анализу у гипотиреоидных крыс WAG, несмотря на отсутствие изменений параметров гидроуреза, установлено увеличение интенсивности окрашивания ГН в интерстиции сосочка по сравнению с контролем (рис. 2с). Качественные изменения экстрацеллюлярного матрикса почки у крыс WAG сопровождались увеличением содержания мРНК HAS2 гена, кодирующего фермент синтеза ГН (рис. 3a), в то время как уровень экспрессии гена Hyal2, ключевого фермента его катаболизма, увеличился незначительно (рис. 3b). Вместе с тем блокада синтеза NO с помощью L-NAME приводила к восстановлению внеклеточного матрикса до базального эутиреоидного состояния у гипотиреоидных крыс WAG (рис. 2e) в связи со снижением уровня экспрессии HAS2 в сосочке почки до базальных значений контрольной группы с нормальным уровнем секреции ТГ (рис. 3a). Моделирование гипотиреоза у крыс Brattleboro не вызывало существенных изменений состояния интерстиция почечной медуллы (рис. 2d), несмотря на снижение уровня экспрессии HAS2 в сосочке почки, устранявшееся при блокаде синтеза NO (рис. 3a). Вместе с тем при введении L-NAME крысам Brattleboro на фоне потребления метимазола не установлено качественных изменений интерстициального матрикса сосочка почки по сравнению с гипотиреоидной группой (рис. 2f).
Рис. 3.
Влияние блокады синтеза NO (L-NAME) на уровень экспрессии мРНК генов гиалуронансинтазы-2 (HAS2) (a), гиалуронидазы-2 (Hyal2) (b) в сосочке почки у гипотиреоидных крыс WAG и Brattleboro. Уровень экспрессии мРНК HAS2, Hyal2 приведен относительно гена домашнего хозяйства HPRT1. Данные представлены как M ± SEM. Достоверность различий: *p < 0.05; ***p < 0.001 – сравнение с контрольной группой WAG; &&p < 0.01 – сравнение с гипотиреоидной группой WAG; ##p < 0.01 – сравнение с контрольной группой Brattleboro; ^p < 0.05 – сравнение с гипотиреоидной группой крыс линии Brattleboro.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В осморегулирующий процесс вовлекается не только эпителий почечных канальцев и сосудистая система почки, но также интерстициальный матрикс, разделяющий элементы концентрирующего механизма и определяющий внеклеточную проницаемость для воды и ионов [1]. Учитывая ранее полученные данные об увеличении содержания ГН в почечной медулле на фоне диуретического ответа и его снижении при дегидратации [34, 35], в последние годы активно обсуждается вопрос о роли внеклеточного матрикса в регуляции диффузии воды между структурами концентрирующего механизма [12, 36]. ТГ участвуют в регуляции осмотического концентрирования, и нарушение уровня их секреции приводит к существенным перестройкам этого процесса вследствие изменений почечной гемодинамики [14] и экскреции солей и воды [16]. Несмотря на прогресс в понимании молекулярных событий, индуцируемых ТГ в эпителии почечных канальцев [37], выявление новых звеньев в регуляции концентрирующей функции почек представляется актуальным, поскольку дает возможность разработки новых подходов к коррекции тубуло-интерстициальных нарушений в почках при дисфункции щитовидной железы.
При снижении уровня ТГ повышается чувствительность эпителиоцитов собирательных трубок к вазопрессину, что приводит к усилению реабсорбции воды [38] вследствие увеличения экспрессии AQP1-3 в ткани почки [25, 39]. Как известно, при связывании вазопрессина с V2-рецепторами стимулируется по цАМФ-зависимому каскаду транслокация тканеспецифичного белка AQP2 в апикальную мембрану эпителиоцитов собирательных трубок [40]. Вместе с тем при гипотиреозе усиливается секреция тиреотропного гормона (ТТГ), рецепторы к которому экспрессируются в почечной ткани [41] и сопряжены с Gs-белком, стимулирующим цАМФ-путь [42]. Предполагается, что механизм, стимулирующий транскрипцию AQP2 в почечной ткани при гипотиреозе, обусловлен не только увеличением секреции вазопрессина, но также действием ТТГ. В то же время нами было выявлено, что изменения параметров гидроуреза при моделировании гипотиреоза были существенны лишь у крыс линии Brattleboro, лишенных эндогенного вазопрессина. У гипотиреоидных крыс WAG с высоким уровнем вазопрессина в крови параметры гидроуреза оставались на уровне контрольной группы, тогда как у вазопрессина-дефицитных крыс Brattleboro был установлен антидиуретический ответ вследствие усиления реабсорбции осмотически свободной воды. С изменением гидроуретической функции у гипотиреоидных крыс Brattleboro коррелирует реакция эпителия собирательных трубок гормон-чувствительной зоны сосочка: зафиксировано уплощение эпителиоцитов, обусловленное увеличением гипертоничности внутриканальцевой жидкости [43]. В то же время у крыс WAG в условиях гипотиреоза высота эпителия собирательных трубок не изменялась вследствие отсутствия достоверной реакции диуретической функции и осмоляльности внутриканальцевой жидкости. Следует заметить, что у гипотиреоидных крыс Brattleboro осмотическое концентрирование оставалось на достаточно низком уровне, что, по всей видимости, связано со сниженным базальным уровнем экспрессии AQP2. Известно, что введение крысам Brattleboro агониста V2R, DDAVP, приводит к увеличению транслокации AQP2 в апикальную мембрану, при этом общее содержание AQP2 в клетке не изменяется [44].
Недостаток гормонов щитовидной железы нередко сопровождается развитием микседемы, которая характеризуется накоплением ГН в межклеточном пространстве [21] и является одной из причин задержки жидкости в организме при гипотиреозе [45, 46]. В почке млекопитающих высокая концентрация ГН характерна для мозговой зоны [47], где в интерстиции почечной медуллы формируется гель, физико-химические свойства которого определяют возможность связывания больших объемов воды и положительно заряженных ионов [1]. Подавление синтеза ТГ у крыс WAG раствором метимазола приводило к увеличению интенсивности окрашивания ГН интерстиция гормон-чувствительной средней трети сосочка почки. Такая реакция интерстиция у гипотиреоидных крыс WAG может свидетельствовать о количественном росте компонентов внеклеточного матрикса, что подтверждается увеличением в сосочке мРНК HAS2 вследствие устранения ингибирующего влияния ТГ на экспрессию гена HAS2, кодирующего фермент синтеза ГН. В исследованиях in vitro на неонатальных фибробластах ранее было найдено, что добавление в среду трийодтиронина (Т3) приводит к подавлению синтеза ГН путем снижения уровня экспрессии HAS2 [48, 49]. Предполагается, что у крыс WAG в условиях гипотиреоза при нарастании в сосочке почки гистохимически выявляемого ГН формируется барьер на пути диффузии воды из просвета собирательных трубок в почечный кровоток, снижая стимулирующий эффект гипотиреоза на реабсорбцию воды. Одной из наиболее существенных морфологических особенностей почек гомозиготных вазопрессин-дефицитных крыс Brattleboro является снижение плотности ГН в интерстиции почечной медуллы [50], которое, как предполагают, является следствием повышенной гиалуронидазной активности в почечной ткани [10, 51]. Нами было установлено, что подавление синтеза ТГ раствором метимазола не вызывает у крыс Brattleboro качественных изменений состояния интерстиция сосочка почки, несмотря на увеличение мРНК HAS2, уровень экспрессии которого, тем не менее, оставался на достаточно низком уровне. Учитывая, что содержание ГН может регулироваться не только на уровне экспрессии генов, а также на посттранскрипционном и посттрансляционном уровне [52], отсутствие качественных изменений внеклеточного матрикса у гипотиреоидных крыс Brattleboro связано, по всей видимости, со сниженной активностью HAS2.
При снижении уровня ТГ помимо возникновения синдрома неадекватной секреции вазопрессина, приводящего к гипонатриемии в связи с задержкой воды в организме [19], установлено увеличение уровня NO в сосочке почки [23], который, как известно, является почечным аутакоидом, модулирующим процесс осмотического концентрирования [53]. Ранее нами было выявлено, что в модуляцию осморегулирующего эффекта вазопрессина оксидом азота вовлекаются структуры интерстиция почки, реструктуризация которых приводит к модуляции концентрирующей функции почек вследствие изменений внеклеточной диффузии [54]. Установлено, что NO играет существенную роль в преобразованиях почечного интерстиция у крыс WAG в условиях гипотиреоза: введение ингибитора синтеза NO (L-NAME) приводит у крыс WAG к восстановлению внеклеточного матрикса почки до контрольного эутиреоидного состояния. Снижение интенсивности окрашивания альциановым синим ГН у гипотиреоидных крыс WAG в условиях введения L-NAME, вероятно, явилось следствием установленного снижения мРНК HAS2 до значений контрольной группы. Предполагается, что увеличение уровня NO в условиях подавления синтеза ТГ является ключевым фактором, стимулирующим ферментную активность и уровень экспрессии HAS2, способствуя увеличению биосинтеза ГН экстрацеллюлярного матрикса почки у крыс WAG.
Поскольку, как известно, синтез NO в почечной медулле стимулируется вазопрессином [55], представляло интерес сравнить морфофункциональные особенности почек крыс WAG и вазопрессин-дефицитных особей Brattleboro в условиях блокады синтеза NO с помощью введения L-NAME на фоне гипотиреоза. У крыс Brattleboro при гипотиреозе введение L-NAME не приводило к качественным изменениям внеклеточного матрикса сосочка почки, что, по-видимому, явилось следствием сниженного базального уровня активности синтеза NO в сосочке почки у данной линии крыс [56]. Отсутствие существенных качественных изменений интерстиция почки у крыс Brattleboro при введении L-NAME на фоне гипотиреоза предполагает важность вазопрессин-зависимого механизма в регуляции оксидом азота внеклеточной проницаемости почечной медуллы при подавлении синтеза ТГ.
Таким образом, результаты исследований позволяют заключить, что ключевую роль в нарастании содержания ГН в интерстициальном матриксе почечной медуллы в условиях гипотиреоза играет NO, базальная активность которого в сосочке почки зависит от уровня эндогенного вазопрессина в крови.
Список литературы
Stridh S, Palm F, Hansell P (2012) Renal interstitial Hyaluronan: functional aspects during normal and pathological conditions. Am J Physiol Regul Integr Comp Physiol 302: R1235–R1249. https://doi.org/10.1152/ajpregu.00332.2011
Lee JY, Spicer AP (2000) Hyaluronan: a multifunctional, megaDalton, stealth molecule. Curr Opin Cell Biol 12(5): 581–586. https://doi.org/10.1016/S0955-0674(00)00135-6
Cowman MK (2017) Hyaluronan and Hyaluronan Fragments. Adv Carbohydr Chem Biochem 74: 1–59.https://doi.org/10.1016/bs.accb.2017.10.001
Laurent TC, Laurent UB, Fraser JR (1996) The structure and function of Hyaluronan: An overview. Immunol Cell Biol 74: A1–A7. https://doi.org/10.1038/icb.1996.32
Itano N (2008) Simple Primary Structure, Complex Turnover Regulation and Multiple Roles of Hyaluronan. J Biochem 144: 131–137.https://doi.org/10.1093/jb/mvn046
Erickson M, Stern R (2012) Chain gangs: new aspects of hyaluronan metabolism. Biochem Res Int 2012: 893947.https://doi.org/10.1155/2012/893947
Agre P, King LS, Yasui M, Guggino WB, Ottersen OP, Fujiyoshi Y, Engel A, Nielsen S (2002) Aquaporin water channels–from atomic structure to clinical medicine. J Physiol 542(1): 3–16. https://doi.org/10.1113/jphysiol.2002.020818
Ivanova LN, Melidi NN (2001) Effects of vasopressin on hyaluronate hydrolase activities and water permeability in the frog urinary bladder. Pflugers Arch 443: 72–77. https://doi.org/10.1007/s004240100575
Dzgoev SG (2015) Selective V2-Agonist of Vasopressin Desmopressin Stimulates Activity of Serum Hyaluronidase. Bull Exp Biol Med 159(4): 424–426. https://doi.org/10.1007/s10517-015-2981-y
Ivanova LN, Babina AV, Baturina GS, Katkova LE (2013) Effect of vasopressin on the expression of genes for the key enzymes of hyaluronan turmover in WAG and Brattleboro rat kidney. J Exp Physiol 98(11): 1608–1619. https://doi.org/10.1113/expphysiol.2013.073163
Rügheimer L, Johnsson C, Maric C, Hansell P (2008) Hormonal regulation of renomedullary hyaluronan. Acta Physiol (Oxf) 193: 191–198. https://doi.org/10.1111/j.1748-1716.2007.01795.x
Stridh S, Palm F, Takahashi T, Ikegami-Kawai M, Friederich-Persson M, Hansell P (2017) Hyaluronan Production by Renomedullary Interstitial Cells: Influence of Endothelin, Angiotensin II and Vasopressin. Int J Mol Sci 18(12): 2701. https://doi.org/10.3390/ijms18122701
Pinter GG, Shohet JL (2009) An inner medullary concentrating process activated by renal pelviccalyceal muscle contractions: assessment and hypothesis. J Nephr Physiol 113: 1–6. https://doi.org/10.1159/000228082
den Hollander JG, Wulkan RW, Mantel MJ, Berghout A (2005) Correlation between severity of thyroid dysfunction and renal function. Clin Endocrinol 62: 423–427. https://doi.org/10.1111/j.1365-2265.2005.02236.x
Mariani LH, Berns JS (2012) The renal manifestations of thyroid disease. J Am Soc Nephrol 23(1): 22–26. https://doi.org/10.1681/ASN.2010070766
Iglesias P, Bajo MA, Selgas R, Diez JJ (2009) Thyroid dysfunction and kidney disease. Eur J Endocrinol 160: 503–515. https://doi.org/10.1007/s11154-016-9395-7
Vargas F, Moreno JM, Rodriguez-Gomez I, Wangensteen R, Osuna A, Alvarez Guerra M, Garcia-Estan J (2006) Vascular and renal function in experimental thyroid disorders. Eur J Endocrinol 2: 197–212. https://doi.org/10.1530/eje.1.02093
Skowsky WR, Kikuchi TA (1978) The role of vasopressin in the impaired water excretion of myxedema. Am J Med 64(4): 613–621. https://doi.org/10.1016/0002-9343(78)90581-8
Chen YC, Cadnapaphornchai MA, Yang J, Summer SN, Falk S, Li C, Wang W, Schrier RW (2005) Nonosmotic release of vasopressin and renal aquaporins in impaired urinary dilution in hypothyroidism. Am J Physiol: Renal Physiol 289: 672–678. https://doi.org/10.1152/ajprenal.00384.2004
Menzinger S, Kaya A, Saurat JH, Kaya G (2016) Injected Hyaluronidase Reduces the Volume of Exogenous Hyaluronate Fillers in Mice and Results in Clinical Improvement in a Patient with Pretibial Myxedema. Dermatopathology (Basel) 3(3): 61–67. https://doi.org/10.1159/000446699
Hoesly PM, Tolaymat LM, Sluzevich JC, Keeling JH (2018) Pretibial myxedema successfully treated with intralesional hyaluronidase. JAAD Case Rep 4(9): 874–876. https://doi.org/10.1016/j.jdcr.2018.08.018
Leipziger J, Praetorius H (2020) Renal Autocrine and Paracrine Signaling: A Story of Self-protection. Physiol Rev 100(3): 1229–1289. https://doi.org/10.1152/physrev.00014.2019
Sarati LI, Toblli JE, Martinez CR, Uceda A, Feldman M, Balaszczuk AM, Fellet AL (2013) Nitric oxide and aqp2 in hypothyroid rats: A link between aging and water homeostasis. Metabolism 62: 1287–1295. https://doi.org/10.1016/j.metabol.2013.04.013
Valtin H, Schroeder HA (1997) Familial hypothalamic diabetes insipidus in rats (Brattleboro rata).1964 [classical article]. J Am Soc Nephrol 8: 1333–1341. https://doi.org/10.1681/ASN.V881333
Schmitt R, Klussmann E, Kahl T, Ellison DH, Bachmann S (2003) Renal expression of sodium transporters and aquaporin-2 in hypothyroid rats. Am J Physiol Renal Physiol 284: 1097–1104. https://doi.org/10.1152/ajprenal.00368.2002
Rong S, Gao Y, Yang Y, Shao H, Okekunle AP, Lv C, Du Y, Sun H, Jiang Y, Darko GM, Sun D (2018) Nitric oxide is involved in the hypothyroidism with significant morphology changes in female Wistar rats induced by chronic exposure to high water iodine from potassium iodate. Chemosphere 206: 320–329. https://doi.org/10.1016/j.chemosphere.2018.05.015
Zhou J, Cheng G, Pang H, Liu Q, Liu Y (2018) The effect of 131I-induced hypothyroidism on the levels of nitric oxide (NO), interleukin 6 (IL-6), tumor necrosis factor alpha (TNF-α), total nitric oxide synthase (NOS) activity, and expression of NOS isoforms in rats. Bosn J Basic Med Sci 18(4): 305–312. https://doi.org/10.17305/bjbms.2018.2350
Tain YL, Huang LT, Lee CT, Chan JY, Hsu CN (2015) Maternal citrulline supplementation prevents prenatal NG-nitro-l-arginine-methyl ester (l-NAME)-induced programmed hypertension in rats. Biol Reprod 92: 1–7. https://doi.org/10.1095/biolreprod.114.121384
Bancroft JD, Gamble M, Jones ML, Totty BA (2004) Theory and practice of histological techniques. Connective tissues and stains, 15th edn. Churchill Livingstone Publications 139–200.
Bookout AL, Cummins CL, Mangelsdorf DJ, Pesola JM, Kramer MF (2006) High-throughput real-time quantitative reverse transcription PCR. Curr Protoc Mol Biol 15: Unit 15.8. https://doi.org/10.1002/0471142727.mb1508s73
Ivanova LN, Babina AV, Baturina GS, Katkova LE (2017) The effect of vasopressin on the expression of genes of key enzymes of the interstitial hyaluronan turnover and concentration ability in WAG rat kidneys. Russ J Genet Appl Res 7: 249–257. https://doi.org/10.1134/S2079059717030066
Rügheimer L, Olerud J, Johnsson C, Takahashi T, Shimizu K, Hansell P (2009) Hyaluronan synthases and hyaluronidases in the kidney during changes in hydration status. Matrix Biol 28: 390–395. https://doi.org/10.1016/j.matbio.2009.07.002
Kabilova NO, Bondar AA, Ivanova LN (2009) Expression of type II hyaluronan-synthase gene in kidneys Wistar and Brattleboro rats with diabetes insipidus: effect of vasopressin and its analogues. Dokl Biochem Biophys 425: 61–64. https://doi.org/10.1134/S160767290902001X
Hansell P, Göransson V, Odlind C, Gerdin B, Hällgren R (2000) Hyaluronan content in the kidney in different states of body hydration. Kidney Int 58(5): 2061–2068. https://doi.org/10.1111/j.1523-1755.2000.00378.x
Göransson V, Johnsson C, Nylander O, Hansell P (2002) Renomedullary and intestinal hyaluronan content during body water excess: a study in rats and gerbils. J Physiol 542(Pt 1): 315–322. https://doi.org/0.1113/jphysiol.2001.014894
Colombaro V, Jadot I, Declèves AE, Voisin V, Giordano L, Habsch I, Malaisse J, Flamion B, Caron N (2015) Lack of hyaluronidases exacerbates renal post-ischemic injury, inflammation, and fibrosis. Kidney Int 88: 61–71. https://doi.org/10.1038/ki.2015.53
Iglesias P, Bajo MA, Selgas R, Díez JJ (2017) Thyroid dysfunction and kidney disease: An update. Rev Endocr Metab Disord 18(1): 131–144. https://doi.org/10.1007/s11154-016-9395-7
Hanna FW, Scanlon MF (1997) Hyponatraemia, hypothyroidism, and role of arginine-vasopressin. Lancet 350(9080): 755–756. https://doi.org/10.1016/S0140-6736(05)62563-9
Yeum CH, Kim SW, Kim NH, Choi KC, Lee J (2002) Increased expression of aquaporin water channels in hypothyroid rat kidney. Pharmacol Res 46: 85–88. https://doi.org/10.1016/S1043-6618(02)00036-1
Fenton RA, Murali SK, Moeller HB (2020) Advances in Aquaporin-2 trafficking mechanisms and their implications for treatment of water balance disorders. Am J Physiol Cell Physiol 319(1): C1–C10. https://doi.org/10.1152/ajpcell.00150.2020
Sellitti DF, Akamizu T, Doi SQ, Kim GH, Kariyil JT, Kopchik JJ, Koshiyama H (2000) Renal expression of two ‘thyroid-specifific’ genes: thyrotropin receptor and thyroglobulin. Exp Nephrol 8: 235–243. https://doi.org/10.1159/000020674
Boutin A, Krieger CC, Marcus-Samuels B, Klubo-Gwiezdzinska J, Neumann S, Gershengorn MC (2020) TSH Receptor Homodimerization in Regulation of cAMP Production in Human Thyrocytes in vitro. Front Endocrinol (Lausanne) 11: 276. https://doi.org/10.3389/fendo.2020.00276
Bhave G, Neilson EG (2011) Body fluid dynamics: back to the future. J Am Soc Nephrol 22(12): 2166–2181. https://doi.org/10.1681/ASN.2011080865
Christensen BM, Zelenina M, Aperia A, Nielsen S (2000) Localization and regulation of PKA-phosphorylated AQP2 in response to V(2)-receptor agonist/antagonist treatment. Am J Physiol Renal Physiol 278(1): F29–F42. https://doi.org/10.1152/ajprenal.2000.278.1.F29
Smith TJ, Bahn RS, Gorman CA (1989) Connective tissue, glycosaminoglycans, and diseases of the thyroid. Endocr Rev 10(3): 3663–3691. https://doi.org/10.1210/edrv-10-3-366
Wiederhielm CA, Black LL (1976) Osmotic interaction of plasma proteins with interstitial macromolecules. Am J Physiol 231(2): 638–641. https://doi.org/10.1152/ajplegacy.1976.231.2.638
Mcauliffe WG (1980) Histochemistry and ultrastructure of the interstitium of the renal papilla in rats with hereditary diabetes insipidus (Brattleboro strain). Am J Anat 157(1): 17–26. https://doi.org/10.1002/aja.1001570103
Pouyani T, Sadaka BH, Papp S, Schaffer L (2013) Triiodothyronine (T3) inhibits hyaluronate synthesis in a human dermal equivalent by downregulation of HAS2. In Vitro Cell Dev Biol Anim 49(3): 178–188. https://doi.org/10.1007/s11626-013-9583-7
Deshpande M, Papp S, Schaffer L, Pouyani T (2015) Hydrocortisone and triiodothyronine regulate hyaluronate synthesis in a tissue-engineered human dermal equivalent through independent pathways. J Biosci Bioeng 119(2): 226–236. https://doi.org/10.1016/j.jbiosc.2014.08.001
Ivanova LN, Lavrinenko VA, Shestopalova LV, Korotkova SM (2007) Structural and functional changes in epitheliocytes of collecting tubes in renal papilla of Brattleboro rats treated with vasopressin. Bull Exp Biol Med 143(1): 94–98. https://doi.org/10.1007/s10517-007-0026-x
Ivanova LN, Goryunova TE, Nikiforovskaya LF, Tishchenko NI (1982) Hyaluronate hydrolase activity and glycosaminoglycans in the Brattleboro rat kidney. Ann NY Acad Sci 394: 503–508. https://doi.org/10.1111/j.1749-6632.1982.tb37462.x
Tammi RH, Passi AG, Rilla K, Karousou E, Vigetti D, Makkonen K, Tammi MI (2011) Transcriptional and post-translationalregulation of hyaluronan synthesis. FEBS J 278: 1419–1428. https://doi.org/10.1111/j.1742-4658.2011.08070.x
Bouley R, Hasler U, Lu HA, Nunes P, Brown D (2008) Bypassing vasopressin receptor signaling pathways in nephrogenic diabetes insipidus. Semin Nephrol 28: 266–278. https://doi.org/10.1016/j.semnephrol.2008.03.010
Pravikova PD, Lavrinenko VA, Ivanova LN (2019) Effect of NO Synthesis Blockade on the Hydrouretic Function and Extracellular Matrix of the Kidneys in Rats with Different Blood Vasopressin Levels. Bull Exp Biol Med 167(2): 233–236. https://doi.org/10.1007/s10517-019-04498-w
O’Connor PM, Cowley AW Jr (2007) Vasopressin-induced nitric oxide production in rat inner medullary collecting duct is dependent on V2 receptor activation of the phosphoinositide pathway. Am J Physiol Renal Physiol 293(2): F526–F532. https://doi.org/10.1152/ajprenal.00052.2007
Martin PY, Bianchi M, Roger F, Niksic L, Féraille E (2002) Arginine vasopressin modulates expression of neuronal NOS in rat renal medulla. Am J Physiol Renal Physiol 283(3): F559–F568. https://doi.org/10.1152/ajprenal.00309.2001
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


