Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1468-1481
Вклад IKCa-каналов в дилатацию пиальных артериий у молодых крыс после ишемии/реперфузии
В. Н. Шуваева 1, *, О. П. Горшкова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: shuvaevavn@infran.ru
Поступила в редакцию 13.07.2022
После доработки 23.09.2022
Принята к публикации 27.09.2022
- EDN: PFZSRH
- DOI: 10.31857/S0869813922110127
Аннотация
Исследование взаимосвязи между первичным ишемическим поражением и последующими изменениями в церебральной сосудистой сети остается актуальным. Нарушение мозгового кровотока после ишемии/реперфузии (И/Р) может быть обусловлено эндотелиальной дисфункцией, которая характеризуется дисбалансом в высвобождении вазоактивных факторов, что приводит к изменению сосудистого тонуса. Изменение функциональной активности кальций-чувствительных калиевых каналов промежуточной проводимости (IКCa) может влиять на эндотелий сосудов, но данные о вазоактивной роли IКCa-каналов в сосудах головного мозга после И/Р немногочисленны. Целью данной работы являлось изучение вклада IKCa-каналов в регуляцию тонуса пиальных артерий после перенесенной ишемии/реперфузии у молодых крыс. Изучали изменение вклада IКCa-каналов в поддержание сосудистого тонуса и индуцированную ацетилхолином (АХ) дилатацию пиальных артерий крыс Вистар в возрасте 4 месяцев после однократной И/Р (пережатие обеих сонных артерий с одновременным снижением и строгим поддержанием среднего АД на уровне 45 ± 2 мм рт. ст. в течение 12 мин) в разные сроки постишемического периода. Исследование сосудов проводили на 2-, 7-, 14- и 21-е сутки после И/Р. Методом прижизненной микрофотосъемки оценивали реакции артерий у крыс, перенесших ишемию, и ложнооперированных крыс. Изменение вклада IКCa-каналов в поддержание тонуса пиальных артерий оценивали по изменению числа артерий, сузившихся в ответ на действие блокатора IКCa-каналов (клотримазол, 10–7 М, 5 мин). Изменение вклада IКCa-каналов в дилатацию сосудов оценивали, сравнивая число и степень АХ-индуцированной (ацетилхолин хлорид, 10–7 М, 8 мин) дилатации артерий до и на фоне блокады IКCa-каналов. Установлено, что однократная глобальная И/Р коры головного мозга ведет к изменению вклада IKCa-каналов в поддержание базального тонуса пиальных артерий крыс, сохраняющемуся в течение 21 сут после восстановления кровотока. Через 2 сут снижается вклад IKCa-каналов в тонус крупных пиальных артерий. А в последующий постишемический период наблюдается последовательное усиление вклада этих каналов в поддержание тонуса сосудов всех исследованных диаметров. Вклад IKCa-каналов в АХ-опосредованную дилатацию пиальных артерий у перенесших ишемию крыс в разные сроки постишемического периода также меняется и в большой степени зависит от диаметра артериальных сосудов. Через 2 сут после И/Р увеличивается вклад IKCa-каналов в дилатацию на АХ артерий среднего калибра. На 7-е сутки число IKCa-опосредованных дилатаций снижается, и эти изменения наблюдаются в группах средних и крупных артерий. В последующие 14 сут роль IKCa-каналов в АХ-индуцированной дилатации крупных пиальных артерий восстанавливается до уровня показателей у ложнооперированных крыс, а в группах мелких и средних артерий усиливается. Таким образом, разная активность IKCa-каналов в АХ-опосредованной вазодилатации продемонстрирована не только в артериях разного калибра, но и в разные сроки постишемического периода.
Сосудистые заболевания головного мозга – актуальная медицинская и социальная проблема. Ишемия головного мозга становится все более распространенным заболеванием, которое поражает не только пожилых, но и более молодых людей. Данной проблеме уделяется много внимания, поскольку это заболевание является одной из причин, ведущих к инсульту, деменции и инвалидности [1]. Даже кратковременное прекращение кровоснабжения головного мозга вызывает тканевую гипоксию. Последующая реперфузия хотя и восстанавливает кровоток, но не всегда полностью, и часто приводит к дополнительным повреждениям ткани. Поэтому исследование взаимосвязи между первичным ишемическим поражением и последующими изменениями в церебральной сосудистой сети остается актуальным.
Церебральные коллатерали являются дублирующими сосудистыми путями, которые при блокировании магистральных сосудов могут частично поддерживать приток крови к подвергшейся ишемии ткани [2, 3]. В изменениях мозгового кровотока после ишемии/реперфузии (И/Р) большую роль играет эндотелиальная дисфункция мозговых сосудов, обусловленная нарушениями NO-опосредованных механизмов сосудистой регуляции [4–6]. Компенсаторным сосудорасширяющим механизмом в этом случае может являться эндотелиальная гиперполяризация (EDH) [4, 7, 8], механизм которой пока до конца не выяснен, а на роль продуцируемых эндотелием факторов EDH претендуют различные вещества. Считается, что значительный вклад в эндотелиальную гиперполяризацию вносят кальций-чувствительные калиевые каналы промежуточной проводимости (IKСa) [4, 7, 8]. Однако некоторые исследователи считают, что EDH может вызвать электрическая связь, возникающая между эндотелием и мышечной тканью через электрические щелевые каналы, без участия химических медиаторов [9]. Можно ли нарушение перфузии мозговой ткани в результате перенесенной И/Р объяснить изменением вклада IKCa-каналов в эндотелий-зависимую дилатацию сосудов головного мозга, предстоит выяснить. Авторы работы [4] полагают, что EDH и, следовательно, IKCa-каналы играют большую сосудорасширяющую роль в сосудах малого и большого калибра, однако необходимы дальнейшие исследования для изучения различий между реакциями мозговых сосудов различного диаметра.
Целью данной работы являлось изучение вклада IKCa-каналов в регуляцию тонуса пиальных артерий после перенесенной ишемии/реперфузии у молодых крыс. Задачей исследования было выяснить, как изменяется вклад IKCa-каналов в базальный тонус и в опосредованную ацетилхолином (АХ) дилатацию пиальных артерий разных калибров у крыс в возрасте 4 месяцев в разные сроки постишемического периода – на 2-, 7-, 14- и 21-е сутки после перенесенной животными ишемии коры головного мозга.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на 4-месячных самцах крыс Вистар (n = 44) массой 250–350 г из ЦКП “Биоколлекция ИФ РАН”. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
Ишемию коры головного мозга воспроизводили путем окклюзии обеих сонных артерий, сопровождавшейся управляемой гипотензией – техники, известной в англоязычной литературе как “2-vessel occlusion + hypotention model”, в авторской модификации [10]. Наркотизированные хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крысы подвергались 12-минутной окклюзии обеих сонных артерий с одновременным снижением и точным поддержанием артериального давления (АД) на уровне 45 ± 2 мм рт. ст. путем забора/реинфузии крови (1.2–1.7 мл/100 г массы тела) в гепаринизированный шприц. АД измеряли инвазивно через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), подключенным к микроконтроллеру (STMicroelectronics, США), выход которого был соединен с компьютером через порт USB. Визуализация значений АД осуществлялась с помощью оригинальной программы, разработанной в нашей лаборатории. Расчет среднего АД в реальном времени производился программой по классической формуле:
По окончании периода ишемии производились полная реинфузия забранной крови и ушивание операционных ран. До выхода из наркоза крысы содержались на электрогрелках (S315, EcoSapiens, Россия) при температуре 38°С. Затем их возвращали в клетки обычного содержания.
Постишемические изменения исследовали в отдельных группах крыс: на 2-, 7-, 14- и 21-е сутки после ишемии. Контролем служили ложнооперированные животные (ЛО). Этих крыс подвергали аналогичному оперативному вмешательству, но без проведения ишемии. Исследования на ЛО крысах проводили в отдельных группах также на 2-, 7-, 14- и 21-е сутки после операции.
Для прижизненного исследования реакций пиальных артерий крыс наркотизировали хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела). В теменной области черепа животного высверливали отверстие (S ≈ 1 см2), твердую мозговую оболочку в пределах которого удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2PO4 1.2; глюкоза 11.5; pH 7.4), аэрированного карбогеном. Раствор для орошения, как и все другие применяемые растворы, в течение всего эксперимента содержали в медицинском водяном термостате (TW-2, SIA “ELMI”, Латвия) при температуре 37°C. На протяжении всего эксперимента контролировали среднее АД, показатели которого оставались примерно на одном уровне и составляли 127 ± 4 мм рт. ст. Температуру тела животного поддерживали на уровне 38°C. Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (“Микромед”, Россия), камеру-видеоокуляр для микроскопа Basler acA 4600-10uc (Германия) и персональный компьютер.
При проведении эксперимента крыс разделяли на 8 отдельных групп: крысы на 2-, 7- (n = 5 в каждой группе), 14- (n = 6) и 21-е (n = 7) сутки после перенесенной ишемии и ЛО крысы на 2-, 7-, 14- (n = 5 в каждой группе) и 21-е (n = 6) сутки после оперативного вмешательства. Исследовали реакции сосудов на орошение поверхности головного мозга раствором ацетилхолин хлорида (Acetylcholine chloride, Sigma-Aldrich, 10–7 М, 5 мин) в отсутствие и на фоне блокады IKCa-каналов раствором клотримазола (Акрихин, Польша) в концентрации 10–5 М (предварительное орошение поверхности головного мозга в течение 5 мин с последующим добавлением АХ в раствор блокатора). Фоновую реакцию на воздействие АХ в каждой группе принимали за 100%. Проверка по критерию Краскела–Уоллеса показала отсутствие значимых различий между отдельными животными в фоновых реакциях на воздействие АХ внутри каждой из исследованных групп. Общая продолжительность эксперимента составляла 50–80 мин, после чего животных выводили из эксперимента передозировкой раствора хлоралгидрата (60 мг/100 г массы тела).
Диаметр сосудов измеряли на статических изображениях с помощью оригинальной компьютерной программы “Blood Vessel Media Analyzer” (© Denis Chouvaev, Швеция). В программе предусмотрен режим контраста и увеличения изображения, а также калибровки для пересчета всех координат в метрические единицы. С использованием программы измеряли ширину потока эритроцитов, соответствующую внутреннему диаметру сосуда. Об изменении вклада IKCa-каналов в тонус сосудов судили по изменению числа артерий, сузившихся в ответ на воздействие клотримазола, блокатора IKCa-каналов. Изменение вклада данных каналов в дилатацию артерий оценивали, сравнивая число дилатированных сосудов и степень их дилатации в ответ на воздействие АХ до и после применения блокатора.
У каждой крысы было измерено от 20 до 75 участков сосудов. В литературе имеются сведения о том, что вклад EDH в эндотелий-зависимые релаксации неоднороден и варьирует в зависимости от размера сосудов [11–13]. Поэтому для последующего анализа сосуды были разделены на группы в соответствии с их диаметрами: мелкие артерии (диаметром менее 20 мкм), средние артерии (от 20 до 40 мкм) и крупные артерии (более 40 мкм). Данные по отдельной группе сосудов усредняли для каждого животного и использовали для статистических сравнений.
Изменение количества расширившихся и сузившихся артерий на воздействие препарата выражали в процентах относительно общего числа исследованных артерий в группе. Степень дилатации ΔД %: рассчитывали по формуле:
Изменения диаметра в покое не превышали 5.0 ± 0.5%, поэтому при таких значениях считали, что реакция на воздействие отсутствует.
Статистический анализ данных проводили с использованием пакета статистических программ Microsoft Excel 2019 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Для проверки выборки на нормальность распределения использовали тест Колмогорова–Смирнова, уровень значимости составлял р ≥ 0.2, это свидетельствует о том, что групповые выборки данных подчинялись закону нормального распределения. Затем оценивали значения до и после аппликации препаратов, используя парный критерий Стьюдента и двухфакторный дисперсионный анализ (ANOVA) для факторов “контроль–препарат” и “подвергшиеся ишемии–ложнооперированные”. При распределении вариант в выборке отличном от нормального, при сравнении двух групп использовали U-критерий Манна–Уитни. Различия считали достоверными при p < 0.05. Данные представлены в виде среднего арифметического значения и его ошибки (M ± SE).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На 2-е сутки постишемического периода у крыс наблюдалось угнетение АХ-индуцированной дилатации только крупных артерий, число дилатаций снизилось на 45% относительно показателей у ЛО крыс (ЛО: 56.8 ± 6.1 и И/Р: 31.2 ± 1.5%, р = 0.04, U-критерий = 36) (рис. 1а). На 7-е сутки после И/Р у перенесших это воздействие крыс, по сравнению с ЛО, число АХ-индуцированных дилатаций снизилось на 40% в группе крупных артерий и на 30% в остальных группах исследованных артерий. Уменьшение числа АХ-индуцированных дилатаций у подвергнутых И/Р крыс, по сравнению с ЛО, наблюдалось также на 14-е (на 22, 32 и 42% у мелких, средних и крупных артерий соответственно) и 21-е сутки (на 21, 19 и 28% у мелких, средних и крупных артерий соответственно) постишемического периода во всех группах исследованных артерий (рис. 1b–d). Достоверных изменений амплитуды дилатаций артерий на АХ в течение исследованного постишемического периода (2–21-е сутки) не отмечено.
Рис. 1.
Дилатация пиальных артерий на воздействие АХ. Косая штриховка – ЛО крысы; серая заливка – крысы после И/Р (а – 2 сут; b – 7 сут; c – 14 сут; d – 21 сут). Различия статистически значимы: * – p < 0.05, ** – p < 0.01 (U-критерий Манна–Уитни).

Аппликация клотримазола у ЛО крыс на 2-е сутки после операции вызывала констрикцию 58–64% артерий во всех группах исследованных сосудов (рис. 2а). При блокировании IKCa-каналов уменьшалось число АХ-индуцированных дилатаций во всех группах артерий: мелких – на 70%, средних – на 45% и крупных – на 80% (рис. 3а). Амплитуда дилатации в группе мелких и крупных сосудов также значительно снижалась (примерно на 40 и 60% соответственно), тогда как у средних артерий она увеличивалась примерно на 16% (рис. 4a). У крыс, перенесших ишемию, на 2-е сутки после И/Р, по сравнению с ЛО животными, аппликация клотримазола вызывала достоверно меньшее число констрикций только в группе крупных сосудов (24.3 ± 4.5 по сравнению с 57.9 ± 8.4% у ЛО крыс; p = 0.03, U-критерий = 16) (рис. 2а). Число АХ-индуцированных дилатаций на фоне введения клотримазола во всех группах артерий снижалось примерно на 55–75% (рис. 3а). Амплитуда дилатации снижалась на 30–60% (рис. 4а).
Рис. 2.
Констрикция пиальных артерий различных диаметров на воздействие блокатора IKCa-каналов (клотримазола). Косая штриховка – ЛО крысы; серая заливка – крысы после И/Р (а – 2 сут; b – 7 сут, с – 14 сут; d – 21 сут). Различия статистически значимы: * – p < 0.05, *** – p < 0.001 (U-критерий Манна–Уитни).
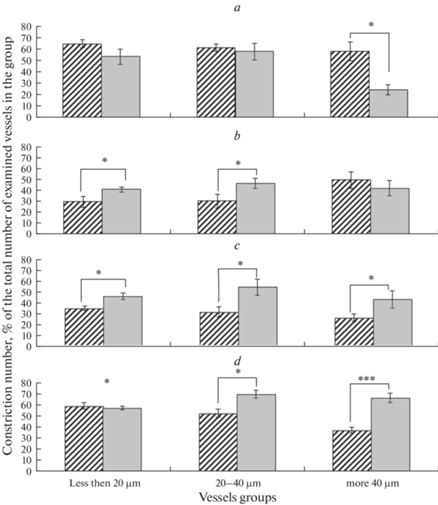
Рис. 3.
Число дилатаций пиальных артерий на воздействие АХ на фоне блокады IKCa-каналов. Косая штриховка – ЛО крысы; серая заливка – крысы после И/Р (а – 2 сут; b – 7 сут; c – 14 сут; d – 21 сут). Горизонтальная линия — дилатация артерий в группе на воздействие АХ без применения блокатора, принятая за 100%. Различия статистически значимы: * – p < 0.05, *** – p < 0.001 (U-критерий Манна–Уитни).
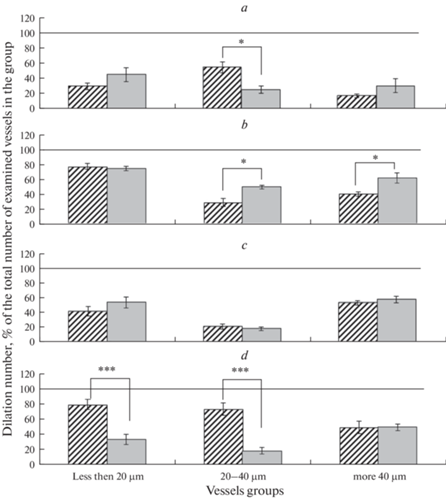
Рис. 4.
Амплитуда дилатаций пиальных артерий на воздействие АХ на фоне блокады IKCa-каналов. Косая штриховка – ЛО крысы; серая заливка – крысы после И/Р (а – 2 сут; b – 7 сут; c – 14 сут; d – 21 сут). Горизонтальная линия – дилатация артерий в группе на воздействие АХ без применения блокатора, принятая за 100%. Различия статистически значимы: * – p < 0.05, ** – p < 0.01, *** – p < 0.001 (U-критерий Манна–Уитни).

Аппликация клотримазола у ЛО крыс на 7-е сутки после операции приводила к констрикции примерно 30% мелких и средних и 50% крупных артерий (рис. 2b). На фоне введения клотримазола число дилатаций мелких артерий на воздействие АХ уменьшалось на 22%, а в группах средних и крупных артерий – в среднем на 70 и 60% соответственно. Амплитуда АХ-индуцированной дилатации снижалась во всех группах артерий (рис. 4b) по сравнению с реакцией на АХ в отсутствие блокады IKCa-каналов. У подвергнутых ишемии крыс на 7-е сутки после И/Р орошение поверхности головного мозга раствором клотримазола приводило к констрикции примерно 40–47% всех исследованных артерий (рис. 2b). Число дилатаций на воздействие АХ на фоне блокады IKCa-каналов клотримазолом по сравнению с реакцией на АХ в отсутствие блокады в группе мелких сосудов снижалось в среднем на 25% (рис. 3b). Число АХ-индуцированных дилатаций средних артерий на фоне блокады было в 2 раза ниже, чем в ее отсутствие, а число дилатаций крупных артерий снизилось на 40% (рис. 3b). Амплитуда АХ-индуцированной дилатации мелких артерий на фоне блокады IKCa-каналов примерно соответствовала значениям, полученным без применения блокатора, была снижена на 40% у средних артерий и увеличилась на 17% у крупных артерий (рис. 4b). У подвергнутых И/Р и ЛО крыс число и амплитуда АХ-индуцированных дилатаций мелких артерий на фоне предварительного введения клотримазола были выражены в равной степени; в группе средних артерий при одинаковой амплитуде число дилатаций у И/Р крыс было выше, чем у ЛО (50.2 ± 2.9 по сравнению с 29.7 ± 5.6%, р = 0.02, U-критерий = 12), а в группе крупных артерий у перенесших ишемию крыс и число (62.5 ± 6.7 по сравнению с 41.1 ± 3.0%, р = 0.03, U-критерий = 48), и амплитуда (117.1 ± 2.0 по сравнению с 63.1 ± 5.9, р < 0.001, U-критерий = 10) дилатаций были больше, чем у ЛО крыс (рис. 3b, 4b).
Аппликация клотримазола у ЛО крыс на 14-е сутки после операции вызывала констрикцию 35.4 ± 2.2% мелких артерий и около 30% средних и крупных артерий (рис. 2с). На фоне блокады IKCa-каналов во всех группах артерий снижалось число дилатаций на воздействие АХ (примерно на 58, 80 и 46%, у мелких, средних и крупных артерий соответственно) относительно реакции в отсутствие блокады (рис. 3с). Также снижалась амплитуда дилатации мелких и средних артерий (примерно на 25%), но амплитуда дилатации крупных артерий увеличилась на 16% (рис. 4с). У перенесших ишемию крыс на 14-е сутки после И/Р орошение поверхности головного мозга раствором клотримазола приводило к констрикции от 46 до 55% артерий в разных группах (рис. 2с). Число дилатаций на воздействие АХ на фоне блокады IKCa-каналов уменьшилось во всех группах артерий (примерно на 46–42% у мелких и крупных артерий и на 82% у средних артерий) относительно реакции в отсутствие блокады (рис. 3с). Амплитуда дилатаций после И/Р также снижалась во всех группах артерий (рис. 4с). У подвергнутых И/Р и ЛО крыс число АХ-индуцированных дилатаций на фоне предварительного введения клотримазола были выражены в равной степени во всех группах артерий; при этом амплитуды дилатаций также снижались и были одинаково выражены у И/Р и ЛО крыс у мелких и средних артерий, а в группе крупных артерий амплитуда дилатации у И/Р крыс была примерно в 2 раза меньше, чем у ЛО (53.8 ± 7.5 по сравнению с 115.6 ± 8.5%, р = 0.002, U-критерий = 4) (рис. 4с).
На 21-е сутки после операции аппликация клотримазола вызывала у ЛО крыс констрикцию всех исследованных артерий: 60% мелких, 53% средних и 38% крупных (рис. 2d). Число АХ-индуцированных дилатаций на фоне блокады IKCa-каналов у мелких и средних сосудов снижалось в среднем на 20 и 27% соответственно, а у крупных артерий снизилось в 2 раза (рис. 3d). Амплитуда дилатации у ЛО крыс не изменялась (рис. 4d). У подвергнутых И/Р крыс в ответ на аппликацию клотримазола сужалось 57% мелких артерий и около 70% средних и крупных артерий (рис. 2d). Число дилатаций на воздействие АХ на фоне блокады IKCa-каналов у подвергнутых И/Р крыс снижалось во всех группах артерий относительно реакции в отсутствие блокады: примерно на 66% у мелких артерий, на 80% у средних и на 50% у крупных (рис. 3d). Это снижение было наиболее выраженным (относительно числа дилатаций у ЛО крыс) в группах мелких (33.8 ± 6.9 по сравнению с 80.0 ± 6.5%, р = 0.0002, U-критерий = 4) и средних артерий (18.8 ± 4.4 по сравнению с 73.7 ± 8.4, р = 0.0002, U-критерий = 4). Амплитуда дилатаций также снижалась во всех группах артерий (рис. 4d).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ишемия изменяла дилатацию пиальных артериальных сосудов крыс на воздействие АХ. На 2-е сутки после И/Р наблюдалось снижение числа АХ-индуцированных дилатаций относительно аналогичных показателей у ЛО крыс в группе крупных артерий (в среднем на 45%, рис. 1а). На 7–21-е сутки у крыс, подвергнутых И/Р, число дилатаций было снижено во всех группах исследованных артерий (рис. 1b–d). Степень дилатации во всех группах сосудов в течение 21 сут постишемического периода не отличалась от показателей у ЛО крыс. Данные результаты показывают, что однократная глобальная И/Р коры головного мозга ведет к угнетению АХ-индуцированной дилатации пиальных артериальных сосудов крыс, сохраняющемуся в течение 21 сут после восстановления кровотока. Основной механизм вазодилататорного эффекта АХ связывают с его воздействием на мускариновые рецепторы ЭК, в результате чего повышается ток Са2+ и активируется выработка NO по пути TRPV4 (канал транзиторного рецепторного потенциала валлиноидного типа) → eNOS → NO [14, 15]. Угнетение вазодилатации после И/Р может быть обусловлено дисфункцией сосудистого эндотелия [16] вследствие снижения синтеза и биодоступности NO. Это, в свою очередь, может усилить вклад других механизмов в осуществление АХ-опосредованной вазодилатации, в частности механизма эндотелиальной гиперполяризации, связанной с активацией IKCA-каналов [4, 6]. AХ индуцирует эндотелиальную гиперполяризацию и последующую релаксацию сосудов через сигнальный путь TRPV4 + Са2+→ IKCa [17].
Применение блокатора IKCa-каналов клотримазола в наших экспериментах на 2-е сутки после оперативного вмешательства у ЛО крыс вызывало сужение примерно 60% пиальных артерий во всех группах сосудов. У подвергнутых ишемии крыс на 2-е сутки после И/Р изменение числа констрикций по сравнению с показателями у ЛО крыс было обнаружено только в группе крупных артерий (снизилось примерно вдвое относительно ЛО, рис. 2а). Отсюда следует, что IKCa-каналы участвуют в поддержании базального тонуса пиальных артерий крыс, а И/Р снижает их вклад в поддержание тонуса только крупных пиальных артерий, что согласуется с данными других исследований [18, 19]. Одним из факторов, вызывающих снижение роли IKCa-каналов в поддержании тонуса крупных артерий, может быть наличие более выраженного слоя гладкомышечных клеток, что затрудняет перенос гиперполяризации [12]. Также это может быть связано с различиями в экспрессии IKCa-каналов [6]. На 7-е сутки после И/Р у крыс, перенесших ишемию, по сравнению с ЛО крысами число констрикций на воздействие клотримазола увеличивалось. Эти изменения наблюдались в группах мелких и средних артерий. Через 14 сут увеличение числа констрикций на аппликацию клотримазола, по отношению к аналогичным показателям у ЛО крыс наблюдалось во всех группах исследованных артерий, а на 21-е сутки увеличение отмечалось преимущественно в группах средних и крупных сосудов. Эти результаты свидетельствуют об усилении роли IKCa-каналов в поддержании тонуса данных сосудов в период с 7-х по 21-е сутки после И/Р и не противоречат данным других исследований [18, 19]. Считается, что IKCa-каналы выполняют защитную функцию в поддержании базального тонуса после И/Р [18, 20]. Например, блокада этих каналов в паренхиматозных артериолах вызывала значительное повышение базального тонуса, который сохранялся после повреждений, вызванных И/Р [20]. В большинстве исследований изменения тонуса артерий после И/Р оценивались однократно, мы же предприняли попытку оценить вклад IKCa-каналов в поддержание базального тонуса артерий на протяжении 3 недель постишемического периода, что позволило продемонстрировать различный вклад IKCa-каналов в тонус артерий разного калибра и в разные сроки после И/Р.
Число и амплитуда АХ-индуцированных дилатаций артерий на фоне применения клотримазола по сравнению с реакцией на АХ в отсутствие блокады IKCa-каналов у ЛО крыс снижались во все отрезки послеоперационного периода. Клотримазол блокирует Са2+-чувствительные К+-каналы промежуточной проводимости по пути воздействия на систему цитохрома Р450 →5,6-эпоксиэйкозатриеновая кислота → TRPV4 → IKCa [21–24], увеличивая выход К+ из клетки и тем самым снижая гиперполяризацию мембраны, что в итоге приводит к ослаблению вазодилатации. Наши результаты указывают на то, что вклад IKCa-каналов в АХ-индуцированную дилатацию пиальных артерий ЛО крыс весьма значителен.
В наших экспериментах у крыс, перенесших ишемию, число АХ-опосредованных дилататорных реакций пиальных артерий на фоне предварительной блокады IKCa-каналов снижалось относительно показателей в отсутствие блокады. Однако по сравнению с показателями у ЛО крыс достоверные отличия наблюдались только на 2-, 7- и 21-е сутки постишемического периода. На 2-е сутки после И/Р уменьшались число и амплитуда дилатаций в группе средних артерий относительно ЛО. Через 7 сут после И/Р уменьшение числа АХ-дилатаций на фоне применения блокатора IKCa-каналов у крыс, перенесших ишемию, по сравнению с ЛО крысами было выражено в меньшей степени, что указывает на снижение роли EDHF-опосредованной дилатации в этот отрезок постишемического периода. Механизм, реализуемый АХ для активации IKCa каналов, осуществляется через активацию TRPV4, вызванную притоком Са2+. TRPV4 опосредуют АХ-индуцированную дилатацию в мозговых артериях, но их функция нарушается при И/Р. Увеличение уровня внутриклеточного Са2+ после И/Р может быть причиной активации TRPV4 каналов, и связанной с этим гиперактивации IKCa-каналов [25, 26]. Гиперактивация IKCa-каналов, в свою очередь, может уменьшать сопротивление клеточной мембраны и снижать возможности эндотелия при проведении электрического сигнала [11], тем самым уменьшая вклад IKCa-каналов в АХ-индуцированную дилатацию артерий. Кроме того, известно, что TRPV4 помимо вазодилатации могут также регулировать вазоконстрикцию по механизму отрицательной обратной связи [17, 27]. Это, в свою очередь, также может служить причиной угнетения АХ-опосредованной вазодилатации у крыс, перенесших ишемию. К 14-м суткам постишемического периода на фоне блокады IKCa-каналов число АХ-индуцированных дилатаций у крыс, перенесших ишемию, снижалось значительно, но достоверных отличий между этими группами у ЛО животных и крыс после И/Р не отмечено. Однако к 21-м суткам постишемического периода вклад IKCa-каналов в АХ-индуцированную дилатацию мелких и средних артерий значительно усиливался по сравнению с аналогичным вкладом у ЛО крыс, тогда как у более крупных сосудов он не менялся, это согласуется с утверждением [4], что сосудорасширяющие эффекты EDHF наиболее важны в сосудах малого калибра. Полученные нами результаты позволяют утверждать, что в разные сроки постишемического периода изменение активности IKCa-каналов в АХ-опосредованной дилатации артерий разного калибра выражены в различной степени.
Таким образом, мы установили, что однократная глобальная И/Р коры головного мозга ведет к изменению вклада IKCa-каналов в поддержание базального тонуса пиальных артерий крыс, сохраняющемуся в течение 21 сут после восстановления кровотока. Через 2 сут снижается вклад IKCa-каналов в тонус крупных пиальных артерий. А в последующий постишемический период наблюдается последовательное усиление вклада этих каналов в поддержание тонуса сосудов всех исследованных диаметров. Вклад IKCa-каналов в АХ-опосредованную дилатацию пиальных артерий у перенесших ишемию крыс в разные сроки постишемического периода также меняется и в большой степени зависит от диаметра артериальных сосудов. Через 2 сут после И/Р наблюдается увеличение вклада IKCa-каналов в дилатацию на АХ артерий средних диаметров. К 7-м суткам число IKCa-опосредованных дилатаций снижается, и эти изменения наблюдаются в группах средних и крупных артерий. В последующие 14 сут роль IKCa-каналов в АХ-индуцированной дилатации крупных пиальных артерий восстанавливается до уровня показателей у ЛО крыс, а в группах мелких и средних артерий усиливается.
Список литературы
Мусхаджиева АШ, Евзельман МА (2018) Хроническая ишемия головного мозга. Молодой ученый 27 (213): 54-58. [Muskhadzhieva ASh, Evzelman MA (2018) Chronic cerebral ischemia. Young scientist 27 (213): 54–58. (In Russ)]. https://moluch.ru/archive/213/51990/
Winship IR (2015) Cerebral collaterals and collateral therapeutics for acute ischemic stroke. Microcirculation 22(3): 228–236. https://doi.org/10.1111/micc.12177
Van der Worp HB, Van Gijn J (2007) Acute ischemic stroke. New Engl J Med 357(6): 572–579.
Davis CM, Siler DA, Alkayed NJ (2011) Endothelium-derived hyperpolarizing factor in the brain: influence of sex, vessel size and disease state. Womens Health (Lond) 7(3): 293–303. https://doi.org/10.2217/whe.11.26
Ma J, Ma Y, Shuaib A, Winship IR (2020) Impaired collateral flow in pial arterioles of aged rats during ischemic stroke. Transl Stroke Res 11(2): 243–253. https://doi.org/10.1007/s12975-019-00710-1
Yang Q, He GW, Underwood MJ, Yu CM (2016) Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: perspectives and implications for postischemic myocardial protection. Am J Transl Res 8(2): 765–777.
Goto K, Ohtsubo T, Kitazono T (2018) Endothelium-dependent hyperpolarization (EDH) in hypertension: The role of endothelial ion channels. Int J Mol Sci 19(1): 315. https://doi.org/10.3390/ijms19010315
Tano JY, Gollasch M (2014) Calcium-activated potassium channels in ischemia reperfusion: a brief update. Front Physiol 5: 381. https://doi.org/10.3389/fphys.2014.00381
Garland CJ, Bagher P, Powell C, Ye X, Lemmey HAL, Borysova L, Dora KA (2017) Voltage-dependent Ca2+ entry into smooth muscle during contraction promotes endothelium-mediated feedback vasodilationin arterioles. Sci Signal 10: eall3806. https://doi.org/doi:10.1126/scisignal.aal3806
Lensman M, Korzhevskii D, Mourovets VO, Kostkin V, Izvarina N, Perasso L, Gandolfo C, Otellin V, Polenov S, Balestrino M (2006) Intracerebroventricular administration of creatine protects against damage by global cerebral ischemia in rat. Brain Res 1114(1): 187–194. https://doi.org/10.1016/j.brainres.2006.06.103
Behringer EJ, Hakim MA (2019) Functional interaction among KCa and TRP channels for cardiovascular physiology: modern perspectives on aging and chronic disease. Int J Mol Sci 20(6): 1380. https://doi.org/10.3390/ijms20061380
Cipolla MJ, Smith J, Kohlmeyer MM, Godfrey JA (2009) SKCa and IKCa channels, myogenic tone, and vasodilator responses in middle cerebral arteries and parenchymal arterioles: effect of ischemia and reperfusion. Stroke 40(4): 1451–1457. https://doi.org/10.1161/STROKEAHA.108.535435
Shimokawa H, Yasutake H, Fujii K, Owada MK, Nakaike R, Fukumoto Y, Takayanagi T, Nagao T, Egashira K, Fujishima M, Takeshita A (1996) The importance of the hyperpolarizing mechanism increases as the vessel size decreases in endothelium-dependent relaxations in rat mesenteric circulation. J Cardiovasc Pharmacol 28(5): 703–711. https://doi.org/10.1097/00005344-199611000-00014
Tran QK, Watanabe H (2006) Calcium signalling in the endothelium. Handb Exp Pharmacol 176 (Pt 1): 145–187. https://doi.org/10.1007/3-540-32967-6_5
Chen M, Li X (2021) Role of TRPV4 Channel in Vasodilation and Neovascularization. Microcirculation 28(6): e12703. https://doi.org/10.1111/micc.12703
Горшкова ОП, Шуваева ВН, Ленцман МВ, Артемьева АИ (2016) Постишемические изменения вазомоторной функции эндотелия. Совр пробл науки и образов 5. [Gorshkova OP, Shuvaeva VN, Lentsman MV, Artemyeva AI (2016) Postischemic changes in the vasomotor function of the endothelium. Modern Problems Sci Educat 5. (In Russ)].
Xin Ma, Juan Du, Peng Zhang, Jianxin Deng, Jie Liu, Francis Fu-Yuen Lam, Ronald A Li, Yu Huang, Jian Jin, Xiaoqiang Yao (2013) Functional role of TRPV4-KCa2.3 signaling in vascular endothelial cells in normal and streptozotocin-induced diabetic rats. Hypertension 62(1): 134–139. https://doi.org/10.1161/HYPERTENSIONAHA.113.01500
Palomares SM, Cipolla MJ (2011) Vascular protection following cerebral ischemia and reperfusion. J Neurol Neurophysiol 2011: S1–S004. https://doi.org/10.4172/2155-9562.s1-004
Cipolla MJ, Bullinger LV (2008) Reactivity of brain parenchymal arterioles after ischemia and reperfusion. Microcirculation 15(6): 495–501. https://doi.org/10.1080/10739680801986742
Cipolla MJ, Smith J, Kohlmeyer MM, Godfrey JA (2009) SKCa and IKCa Channels, myogenic tone, and vasodilator responses in middle cerebral arteries and parenchymal arterioles: effect of ischemia and reperfusion. Stroke 40: 1451–1457. https://doi.org/10.1161/STROKEAHA.108.535435
Feletou M, Kohler R, Vanhoutte PM (2012) Nitric oxide: Orchestrator of endothelium-dependent responses. Ann Med 44: 694–716. https://doi.org/10.3109/07853890.2011.585658
Lopez-Canales JS, Lozano-Cuenca J, Munoz-Islas E, Aguilar-Carrasco JC, Lopez-Canales OA, Lopez-Mayorga RM, Castillo-Henkel EF, Valencia-Hernandez I, Castillo-Henkel C (2015) Mechanisms involved in the vasorelaxant effects produced by the acute application of amfepramone in vitro to rat aortic rings. Braz J Med Biol Res 48(6): 537–544. https://doi.org/10.1590/1414-431X20144261
Кузнецова ЭЭ, Горохова ВГ, Горохов АГ, Сергеева АС, Курильская ТЕ, Пивоваров ЮИ, Рунович АА (2007) Микросомальное окисление в физиологических и патологических процессах. Бюл ВСНЦ СО РАМН 4(56): 170–180. [Kuznetsova EE, Gorokhova VG, Gorokhov AG, Sergeeva AS, Kurilskaya TE, Pivovarov YuI, Runovich AA (2007) Microsomal oxidation in physiological and pathological processes. Bull East-Siber Scient Center Russ Acad Med Sci 4(56): 170–180. (In Russ)].
Meves H (2008) Arachidonic acid and ion channels: an update. Br J Pharmacol 155(1): 4–16. https://doi.org/10.1038/bjp.2008.216
Butenko O, Dzamba D, Benesova J, Honsa P, Benfenati V, Rusnakova V, Ferroni S, Anderova M (2012) The increased activity of TRPV4 channel in the astrocytes of the adult rat hippocampus after cerebral hypoxia/ischemia. PLoS One 7(6): e39959. https://doi.org/10.1371/journal.pone.0039959
Audero MM, Prevarskaya N, Fiorio Pla A (2022) Ca2+ Signalling and Hypoxia/Acidic Tumour Microenvironment Interplay in Tumour Progression. Int J Mol Sci 23(13): 7377. https://doi.org/10.3390/ijms23137377
Kwangseok Hong, Eric L Cope, Leon J DeLalio, Corina Marziano, Brant E Isakson, Swapnil K Sonkusare (2018) TRPV4 (Transient Receptor Potential Vanilloid 4) Channel-Dependent Negative Feedback Mechanism Regulates Gq Protein–Coupled Receptor-Induced Vasoconstriction. Arterioscler Thromb Vasc Biol 38: 542–554. https://doi.org/10.1161/ATVBAHA.117.310038
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


