Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 12, стр. 1725-1732
Простой регулятор подачи CO2 для лабораторного инкубатора клеток из доступных компонентов
М. А. Суслов 1, Г. В. Сибгатуллина 1, Д. В. Самигуллин 1, 2, *
1 Казанский институт биохимии и биофизики Казанского научного центра РАН
Казань, Россия
2 Казанский национальный исследовательский технический университет им. А.Н. Туполева
Казань, Россия
* E-mail: samid75@mail.ru
Поступила в редакцию 10.10.2022
После доработки 20.10.2022
Принята к публикации 24.10.2022
- EDN: PRRZNU
- DOI: 10.31857/S0869813922120135
Аннотация
В настоящей работе описывается система автоматизации подачи CO2 для лабораторного инкубатора клеток, которая позволит изготовить инкубатор с контролируемым уровнем CO2 из доступного лабораторного оборудования. Регулятор CO2 сконструирован в лабораторных условиях из простых компонентов с использованием аппаратно-программной платформы Arduino и может быть интегрирован в лабораторный термостат. В статье описаны результаты тестовых экспериментов на культурах клеток, которые демонстрируют работоспособность конструкции. Поскольку CO2-инкубаторы являются важным и распространенным научным оборудованием, представленная в статье информация о нашей разработке будет полезна широкому кругу исследователей.
ВВЕДЕНИЕ
Клеточные культуры в последние годы используются для множества различных научных и медицинских исследований. Культивирование стволовых клеток открывает широкие возможности для регенерации поврежденных тканей, восстановлению утраченных органов [1]. В научно-исследовательских целях культивирование клеток позволяет исследовать процессы онтогенеза и взаимодействие между клетками различных тканей [2, 3]. Культивирование различных линий раковых клеток позволяет увеличить эффективность поиска методов и подходов для борьбы с заболеванием раком, вести персонализированное лечение больных, проводить исследования новых лекарственных препаратов [4]. Также клеточные культуры позволяют исследовать взаимодействие наночастиц с клетками [5]. Клетки в культуре легко доступны для различных манипуляций и прижизненного наблюдения с помощью микроскопа. Для выращивания культур клеток используют биологические инкубаторы. Инкубаторы применяются в научных и медицинских лабораториях для культивирования бактерий и клеток различных тканей при контроле содержания углекислого газа, определенном значении температуры и при заданном уровне влажности в инкубаторе. Инкубаторы для бактериальных культур более простые и дешевые приборы и представляют собой простые термостатируемые шкафы. Существует множество конструкций подобных термостатов, и во многих лабораториях имеется подобное оборудование, которое широко применяется в лабораторной работе. Эти инкубаторы отлично подходят для выращивания и различных манипуляций с бактериями. Однако для работы с клетками млекопитающих (например, опухолевыми клетками человека, клетками мыши или крысы и т.д.), требуются инкубаторы, которые контролируют как температуру, так и содержание CO2 в окружающем воздухе. Поддержание концентрации CO2 на уровне 5% необходимо для поддержания pH обычных сред для культивирования клеток млекопитающих (например, ДМЕМ) [6]. Цена таких инкубаторов значительна. Задача данного исследования состояла в разработке простой системы контроля подачи CO2, которая позволила бы превратить обычный термостат в инкубатор с автоматическим контролем уровня этого газа. Есть несколько публикаций, описывающих сравнительно простые СО2-инкубаторы, но они описывают изготовление новых специализированных устройств [7–9]. Здесь мы предлагаем доработать уже имеющееся в лаборатории оборудование, что намного проще, дешевле и не займет много времени. Поскольку CO2-инкубаторы являются важным научным оборудованием, представленная в статье информация о нашей разработке будет полезна широкому кругу исследователей.
МЕТОДЫ ИССЛЕДОВАНИЯ
Разработанная система контроля концентрации CO2 реализована на базе промышленного CO2-инкубатора ULAB модели UT-8050. В исходной комплектации в данной модели отсутствует датчик концентрации CO2, а система подачи газа регулируется по определенному алгоритму, исходя из временных промежутков, на которые открывалась дверь инкубатора, без контроля содержания концентрации CO2 в газовой смеси во внутренней камере инкубатора. Несмотря на установленный уплотнитель на двери инкубатора, в течение суток происходила утечка СО2, которую не удавалось скомпенсировать. Это сказывалось на качестве роста клеточных культур. Было решено полностью заменить штатную систему подачи газа. Штатная система термостабилизации была оставлена без изменений, так как она неплохо справлялась со своей задачей.
Основные компоненты системы контроля подачи представлены на рис. 1.
Рис. 1.
Общая схема инкубатора с регулятором концентрации CO2. Аппаратно-программная платформа (Arduino Uno), камера инкубатора (Incubator), жидкокристаллический дисплей (LCD), сенсор CO2 (CO2 sensor), адаптер сенсора CO2 (I2C/UART adapter), электромагнитный клапан (solenoid valve), баллон CO2 c редуктором.

Регулятор концентрации СО2 в камере инкубатора
В качестве анализатора концентрации СО2 был использован недисперсионный инфракрасный сенсор MH-Z16 с отдельным интерфейсным адаптером I2C/UART (Winsen, Китай). Ключевыми компонентами датчика являются инфракрасный источник (светодиод), измерительная камера или световая трубка, фильтр длины волны и инфракрасный детектор. Окружающий воздух естественным образом попадает в измерительную камеру, затем концентрация СО2 в воздухе измеряется электрооптическим путем благодаря поглощению определенной длины волны в инфракрасном спектре. Интенсивность инфракрасного излучения, с которой луч от источника достигает детектора, обратно пропорциональна концентрации СО2 в измерительной камере датчика. Молекулы других газов не поглощают свет на выбранной длине волны, так что они не могут повлиять на количество света, попадающего на детектор. Данный сенсор СО2 был выбран исходя из следующих его преимуществ:
1) хорошая селективность и отсутствие зависимости от содержания кислорода, быстрое время отклика (<30 с), достаточно высокая точность (±50 ppm и длительный срок службы (более 5 лет);
2) в отличие от химических датчиков CO2, этот датчик не нуждается в постоянно включенном нагревательном элементе и поэтому имеет низкое энергопотребление;
3) датчик имеет заводскую калибровку и настроен на необходимый диапазон концентраций СО2 (0–10%), при этом в датчике предусмотрена легкая самостоятельная калибровка, которая осуществляется путем нажатия специальной кнопки на интерфейсном адаптере I2C/UART;
4) инфракрасный сенсор и адаптер I2C/UART изготовлены в виде отдельных блоков, что позволило разместить внутри камеры СО2-инкубатора непосредственно сам инфракрасный сенсор, а остальную часть, включая соединительные провода, вынести наружу;
5) датчик имеет приемлемый для наших условий эксплуатации диапазон рабочих температур (0–50°С) и влажности (0–95%), а также устойчив к кратковременному повышению температуры в СО2 инкубаторе до 100°С, необходимому для периодической стерилизации камеры.
Автоматизация контроля концентрации СО2 в камере инкубатора была реализована на базе аппаратно-программной платформы Arduino Uno R3. Управление датчиком концентрации СО2 MH-Z16 осуществляется с помощью последовательного интерфейса передачи данных (UART). Данные о концентрации СО2 в камере инкубатора выводятся на ЖК-дисплей LCD 1602 по шине I2C. При снижении порогового значения концентрации СО2 в камере, который задается программным путем, производится подача СО2 из баллона по пневмомагистрали через электромагнитный клапан Burkert 6105 (Fluidcontrolsystems, Германия). Давление на входе электромагнитного клапана устанавливалось при помощи стандартного редуктора на баллоне и составляло 0.05 MPa. Открытие электромагнитного клапана производится путем подачи на него сигнала с цифрового порта Arduino, усиленного на биполярном транзисторе КТ829А.
Блок-схема автоматизации контроля концентрации СО2 в камере инкубатора приведена на рис. 1. Программный код для автоматизации контроля концентрации углекислого газа в камере инкубатора представлен в Приложении.
Культура клеток
Для тестирования работы регулятора СО2 были использованы первичные культуры мотонейронов крысы. Получение культур проводили по методу, описанному нами ранее [10]. Клетки высаживали на культуральные 6-луночные планшеты и выращивали до проведения эксперимента в течение 7 дней в среде ДМЕМ, содержащей феноловый красный.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Известно, что оптимальные показатели pH среды для выращивания культивируемых клеток составляют 7.2–7.4 [11]. Повышение или понижение уровня кислотности крайне нежелательно. Для нейтрализации избытка ионов водорода и поддержания оптимального уровня кислотности среды культивирования принято использовать буферную систему на основе бикарбоната натрия. Для поддержания правильного баланса в данной системе необходим СО2 в концентрации 5–10%.
Бикарбонатная буферная система обеспечивает постоянный уровень рН равновесным соотношением между бикарбонатом натрия (NaHCO3) в культуральной среде и CO2 в инкубаторе, при этом она является недорогой и нетоксичной для клеток. В результате повышения концентрации CO2 в газовой фазе увеличивается количество CO2, растворенного в питательной среде, что ведет к росту концентрации H2CO3 и понижению рН. Напротив, если концентрация CO2 газовой фазы снижена, то рН повышается за счет обратной реакции [12, 13]
Для отслеживания изменений рН в процессе культивирования используют феноловый красный – кислотно-основный индикатор, добавляемый в питательные среды. При низком уровне рН феноловый красный приобретает желтую окраску, тогда как при высоких уровнях рН он имеет пурпурный цвет, ярко-красный цвет среды соответствует рН 7.4, оптимальному для культивирования клеток животных [11].
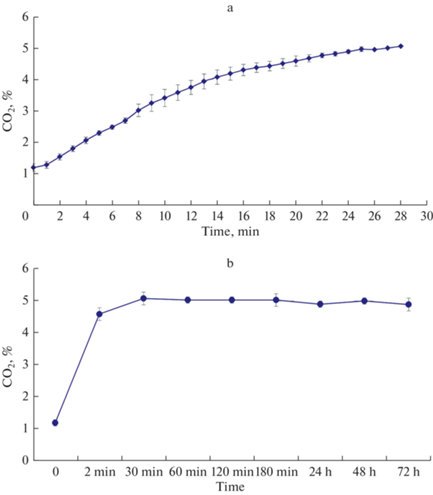
При работе с культивируемыми клетками снижение уровня СО2 в инкубаторе связано не только с его расходованием в ходе вышеупомянутой реакции при активации клеточного метаболизма, но и с его выходом из камеры при открывании дверцы инкубатора. По нашим данным, открытие дверцы на 30 с приводит к снижению содержания CO2 с исходных 5% до 1.2 ± 0.1%. При установленных настройках регулятора СО2 восстановление базового уровня CO2 происходит в среднем за 25 мин (рис. 2a). При дальнейшей работе без открывания дверцы инкубатора базовый уровень поддерживается длительное время (рис. 2b). Процесс восстановления концентрации CO2 после открытия дверцы можно ускорить программным методом, увеличивая время открывания клапана. В нашем случае 25 мин являлось достаточным временем для установления стационарных условий и точности концентрации CO2.
Рис. 2.
Динамика содержания СО2 в инкубаторе. (a) – после снижения содержания СО2 при открывании дверцы инкубатора. (b) – в течение трех суток без открывания дверцы инкубатора.
Для проверки работоспособности регулятора СО2 нами был проведен ряд контрольных экспериментов.
Инкубирование питательных сред в термостате в течение 12 ч при отключенном регуляторе СО2 не вызывало изменения цвета индикатора (рис. 3a), тогда как при подключенном регуляторе СО2 наблюдали изменение окрашивания раствора с пурпурного до бледно-розового (рис. 3b). Анализ рН показал, что пурпурный цвет соответствовал значению 8.7, тогда как бледно-розовый – 7.0.
Рис. 3.
Изменение цвета питательной среды, содержащей индикатор уровня рН, через 12 ч инкубации в термостате с выключенным (a) и включенным (b) регулятором CO2.

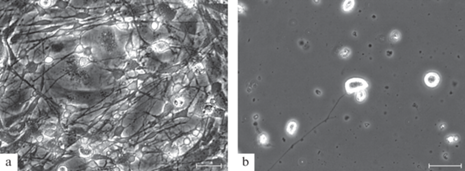
Далее эксперимент был повторен с первичной культурой мотонейронов. Инкубирование клеток в термостате в течение 12 ч при подключенном регуляторе СО2 способствовало сохранению плотности и уровня жизнеспособности культуры (рис. 4a), тогда как отключение регулятора СО2 приводило к гибели клеток и отрыванию их от субстрата (рис. 4b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе мы предложили простую систему для автоматизации контроля концентрации СО2, которую можно использовать для изготовления простого и недорогого СО2-инкубатора для выращивания клеточных культур. Регулятор концентрации СО2 реализован на доступной платформе Arduino, легко настраивается и может использоваться в лабораторной практике в учебных заведениях и исследовательских лабораториях. В отличие от уже описанных устройств, наш инкубатор отличается более простой и гибкой конструкцией за счет того, что мы предлагаем усовершенствование уже имеющегося в лаборатории оборудования [7–9]. Стоит отметить, что для стабильной работы инкубатора клеток необходимо обеспечить равномерный нагрев и распределение газа по всему объему камеры. Это обеспечивается наличием вентилятора, им обычно оборудуются стандартные термостаты. При этом необходимо следить за герметичностью камеры инкубатора. Обычно термостаты имеют стеклянную дверь с уплотнителем. Наличие утечек газовой смеси будет компенсироваться автоматически, но повлияет на расход CO2. Если необходимо поддерживать определенную влажность в камере инкубатора, можно использовать естественное испарение. Для этого расположить на нижней полке камеры открытую емкость с водой и, изменяя площадь испарения, регулировать влажность. Мы протестировали собранный СО2-инкубатор и продемонстрировали эффективность его работы на примере выращивания первичной культуры мотонейронов. При помощи разработанного регулятора возможно поддерживать необходимую концентрацию СО2 в инкубаторе в автоматическом режиме в течение длительного времени. Система позволяет регулировать подачу газа за счет перепрограммирования контроллера и адаптировать ее для различных экспериментальных задач. Например, процесс восстановления концентрации CO2 после открытия дверцы можно ускорить программным методом, увеличивая время открывания клапана. Было показано, что в инкубаторе с 5% СО2 первичная культура мотонейронов нормально развивается, в то время как та же культура не продемонстрировала рост в обычном инкубаторе без регулятора содержания СО2. Таким образом, предлагаемый нами подход позволяет изготовить недорогой СО2-инкубатор для выращивания клеточных культур и существенно сэкономить бюджет исследований.
Список литературы
Чепелева Е, Павлова С, Малахова А, Покушалов Е, Закиян С (2016) Получение культуры клеток из скелетной мускулатуры крысы для применения в клеточной терапии ишемических поражений сердца. Патол кровообращ и кардиохир 19: 28–32. [Chepeleva E, Pavlova S, Malahova A, Pokushalov E, Zakijan S (2016) Obtaining cell culture from rat skeletal muscles for use in cell therapy of ischemic heart lesions. Patol Krovoobrash Kardiohir 19: 28–32. (In Russ)]. https://doi.org/10.21688/1681-3472-2015-4-2-28-32
Sibgatullina GV, Malomouzh AI (2020) GABA in developing rat skeletal muscle and motor neurons. Protoplasma 257 (3): 1009–1015. https://doi.org/10.1007/s00709-020-01485-1
Das M, Rumsey JW, Bhargava N, Stancescu M, Hickman JJ (2010) A defined long-term in vitro tissue engineered model of neuromuscular junctions. Biomaterials 31: 4880–4888. https://doi.org/10.1016/J.BIOMATERIALS.2010.02.055
Мингалеева РН, Соловьева ВВ, Блатт НЛ, Ризванов АА (2013) Применение культур клеток и тканей для скрининга противоопухолевых препаратов in vitro. Клеточн трансплантол и тканев инженерия VIII: 20–28. [Mingaleeva RN, Solov’eva VV, Blatt NL, Rizvanov AA (2013) The use of cell and tissue cultures for screening of antitumor drugs in vitro. Kletochn transplantol i tkanev inzhenerija VIII: 20–28. (In Russ)].
Fedorenko S, Stepanov A, Sibgatullina G, Samigullin D, Mukhitov A, Petrov K, Mendes R, Rümmeli M, Giebeler L, Weise B, Gemming T, Nizameev I, Kholin K, Mustafina A (2019) Fluorescent magnetic nanoparticles for modulating the level of intracellular Ca2+ in motoneurons. Nanoscale 11: 16103–16113. https://doi.org/10.1039/C9NR05071J
McLimans WF (1972) The gaseous environment of the mammalian cell in culture. In: Growth, Nutrition, and Metabolism of Cells in Culture. Elsevier 137–170.
DIY CO2 Incubator Bioreactor for Mammalian Cell Culture. https://www.pellinglab.net/post/diy-incubator Accessed 13 Sep 2022
Tayebi-Khorami M, Chegeni N, Birgani MT, Danyaei A, Fardid R, Zafari J (2022) Construction a CO2 Incubator for Cell Culture with Capability of Transmitting Microwave Radiation. J Med Signals and Sensors 12: 127–132. https://doi.org/10.4103/jmss.jmss_113_21
Arumugam A, Markham C, Aykar SS, Van Der Pol B, Dixon P, Wu M, Wong S (2021) PrintrLab incubator: A portable and low-cost CO2 incubator based on an open-source 3D printer architecture. PLoS One 16: e0251812. https://doi.org/10.1371/journal.pone.0251812
Sibgatullina GV, Malomouzh AI (2020) GABA in developing rat skeletal muscle and motor neurons. Protoplasma 257: 1009–1015. https://doi.org/10.1007/s00709-020-01485-1
Pörtner R (2009) Characteristics of Mammalian Cells and Requirements for Cultivation BT-Cell and Tissue Reaction Engineering: With a Contribution by Martin Fussenegger and Wilfried Weber. In: Eibl R, Eibl D, Pörtner R, Catapano G, Czermak P (eds). Springer Berlin Heidelberg. 13–53.
Eisenblätter T, Psathaki K, Nitz T, Galla H-J, Wegener J (2002) Cell culture media: selection and standardization. In: Claus-Michael Lehr (ed) Cell Culture Models of Biological Barriers. CRC Press. London. 46–66.
Фрешни РЯ (2017) Культура животных клеток. 5th ed. БИНОМ. Лаборатория знаний. М. [Freshni RJa (2017) Animal Cell Culture. 5th ed. BINOM. Laboratory of Knowledge. M. (In Russ)].
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Программный код для автоматизации контроля концентрации углекислого газа в камере биоинкубатора
Инструменты
Российский физиологический журнал им. И.М. Сеченова