Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 235-248
Влияние пола на размер инфаркта миокарда и поведенческие реакции у крыс с ожирением и системным воспалительным ответом в условиях пробиотической коррекции
Ю. Ю. Борщев 1, И. Ю. Буровенко 1, С. М. Минасян 1, Е. С. Процак 1, В. Ю. Борщев 2, О. В. Борщева 1, И. Г. Зубков 1, М. М. Галагудза 1, 2, *
1 Институт экспериментальной медицины Национального медицинского исследовательского центра им. В.А. Алмазова
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
им. академика И.П. Павлова
Санкт-Петербург, Россия
* E-mail: galagudza@almazovcentre.ru
Поступила в редакцию 23.11.2021
После доработки 26.11.2021
Принята к публикации 30.11.2021
- EDN: NIMOOA
- DOI: 10.31857/S0869813922020030
Аннотация
исследование устойчивости миокарда к ишемии–реперфузии и поведенческих реакций с учетом половых различий у крыс в экспериментальной модели ожирения и синдрома системного воспалительного ответа (ССВО). Материал и методы: эксперименты были выполнены на крысах-самцах и самках линии Sprague-Dawley в возрасте 3 мес. с первичным висцеральным ожирением. ССВО моделировали путем однократного введения уксусной кислоты в прямую кишку, после чего внутрижелудочно вводили смесь антимикробных препаратов в течение 3 дней. Крысам другой группы с момента моделирования ССВО в течение 8 дней перорально вводили смесь пробиотических штаммов Lactobacillus acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (BB-12) в концентрации КОЕ 108 на одно животное. Поведенческие тесты “открытое поле”, “приподнятый крестообразный лабиринт”, “темно-светлая камера” проводили поочередно перед окончанием опыта. По завершении опыта проводили оценку уровня фактора некроза опухолей-α, интерлейкина-2, лептина, липополисахарида, трансформирующего фактора роста-β и мозгового нейротрофического фактора в крови, изучали гемодинамические параметры и устойчивость миокарда к ишемии–реперфузии на модели изолированного сердца. Результаты: в группе самок после моделирования ССВО наблюдали большее потребление корма из расчета на 1 г массы тела и более выраженные тромбоцитоз и гранулоцитоз по сравнению с самцами. В сыворотке крови у самок отмечались более высокие уровни фактора некроза опухоли-α, лептина, интерлейкина-2 и липополисахарида по сравнению с самцами, а также более низкий уровень трансформирующего фактора роста-β. У самцов отмечено пробиотическое модулирование ориентировочно-исследовательского поведения и тревожности, тогда как у самок пробиотиками корректировалась скорость выработки условных рефлексов. Значимых различий гемодинамических параметров, а также размера инфаркта между исследованными группами не наблюдалось. Заключение: полученные данные свидетельствуют о значимой роли половых гормонов в патогенезе ССВО, а также о различном ответе самок и самцов на пробиотическую терапию. Результаты в целом показывают более высокую интенсивность компенсаторно-приспособительных реакций и большую эффективность пробиотической коррекции ССВО у самок крыс по сравнению с самцами. В то же время, размер инфаркта не отличался у самок и самцов.
ВВЕДЕНИЕ
Первоначальное понимание стресса как универсального адаптационного синдрома [1] в настоящее время рассматривается в патофизиологическом смысле как термин, характеризующий нейроэндокринную активацию гипоталамо-гипофизарно-надпочечниковой системы и возникающие при этом биохимические и структурные последствия. В связи с этим, к понятию стресса весьма близко современное понимание синдрома системного воспалительного ответа (ССВО), осложняющего воспаление и формирующегося при выраженной эндотоксинемии, сопровождающейся иммунопатологическими реакциями, системными нарушениями микроциркуляции, ДВС-синдромом и, при отсутствии лечения, полиорганной недостаточностью [2, 3]. В контексте стрессоустойчивости, помимо наследственных, возрастных, экологических и прочих факторов, необходимо учитывать половые (биологические) и полоролевые (социальные) аспекты [4]. Хорошо известно, что мальчики болеют аутизмом в 4.0–5.1 раза чаще, чем девочки [5]; женщины страдают депрессией и тревожными расстройствами в два раза чаще, чем мужчины [6]. У женщин чаще развивается посттравматическое стрессовое расстройство [7], болезнь Альцгеймера [8] и аутоиммунные заболевания, а у мужчин – сердечно-сосудистые [9] и некоторые инфекционные заболевания [10].
Исследователям хорошо известно, что крысы линии Sprague-Dawley (SD) являются генетически однородными и характеризуются поведенческой стабильностью, что зачастую предопределяет включение этой линии в эксперимент. Однако даже среди животных этой линии в зависимости от питомника имеется определенная вариабельность физиологических реакций. Например, крысы-самцы NTac:SD (Taconic (Ntac:SD, Germantown, NY) не являются адекватной моделью для исследования в условиях, вызывающих анксиогенный эффект, потому что они предрасположены к повышенному тревожному поведению, тогда как CRL:SD (Charles River, Raleigh, NC) или Hsd:SD male (Envigo, Frederick, MD) крысы являются более подходящими для подобных исследований [11].
В данной работе для определения половых различий при стрессирующем воздействии на различные системы организма была использована модель ССВО с пробиотической терапией у крыс линии SD. Экспериментальная модель включает в себя первичное висцеральное ожирение, химически индуцированное воспаление толстой кишки и антибиотик-индуцированный дисбиоз [12]. Ожирение, метаболический синдром, атерогенная дислипидемия и сахарный диабет являются важнейшими патогенетически и/или генетически взаимосвязанными между собой факторами риска сердечно-сосудистых заболеваний. Согласно современным представлениям, основные компоненты метаболического синдрома представляют собой нарушения углеводного обмена, возникающие, в частности, в результате дисбаланса кишечной микробиоты, что обусловливает концепцию терапевтического использования пробиотиков. Также в течение последних десятилетий активно изучается роль стресса в патофизиологии ожирения и метаболического синдрома [13], в том числе в связи с воспалением [14]. Имеются данные о влиянии качественного состава высокожировой диеты на цитокиновый профиль и устойчивость миокарда к ишемии–реперфузии у крыс с ССВО в связи с изменениями состава кишечной микробиоты [15]. При этом в литературе практически отсутствуют данные о влиянии половых гормонов на устойчивость миокарда к ишемическому-реперфузионному повреждению в условиях ССВО.
Целью работы являлось изучение влияния пола на устойчивость миокарда к ишемии–реперфузии, на уровень гормонов и цитокинов в крови, а также поведенческие реакции у крыс линии SD при экспериментальном моделировании ССВО на фоне пробиотической коррекции.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на крысах линии SD со статусом SPF (Specific Pathogen Free), полученных из питомника “Пущино”: самки массой 230–260 г, самцы массой 380–420 г, в возрасте 13–14 нед. Исследование проводилось в соответствии с Директивой Европейского Совета по соблюдению этических принципов в работе с лабораторными животными (Директива 2010/63/ЕС от 22 сентября 2010 г.). Животные случайным образом распределялись по группам: 1) контроль: самцы CTR-M (n = 8) и самки CTR-F (n = 8) – крысы находились на стандартной диете ad libitum и получали ежедневно per os в течение 28 дней по 4 мл физиологического раствора; 2) моделирование ССВО: самцы SIR-М (n = 8) и самки SIR-F (n = 8) – у крыс с предварительно индуцированным жироуглеводной диетой ПВО (28-дневным внутрижелудочным введением 2 г полиненасыщенных жиров и 1 г сахарозы в дополнение к стандартной диете), моделировали ССВО путем воспроизведения химически индуцированного колита, что подробно описано ранее [12]. SIR – systemic inflammatory response (системный воспалительный ответ). Начиная со следующего дня, этим же животным внутрижелудочно вводили 1 мл физиологического раствора и 1 мл раствора смеси антимикробных препаратов (АМП: амоксициллин, метронидазол и кларитромицин) в суточной дозе по 15 мг каждого АМП на крысу в течение 3 дней; 3) пробиотическая коррекция: самцы PRC-М (n = 8) и самки PRC-F (n = 8) – крысам, прошедшим процедуры согласно предыдущему протоколу, вместо 1 мл физиологического раствора в течение 8 дней вводили 1 мл раствора смеси пробиотических штаммов Lactobacillus acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (BB-12), в концентрации 108 колониеобразующих единиц (КОЕ) на одно животное. Все манипуляции с самками начинали в начале стадии диэструса. В течение 2-х нед., ежедневно, в утреннее время тонкой глазной пипеткой брали мазки (влагалищные смывы), помещали на предметное стекло и рассматривали под микроскопом при увеличении в 300 раз в слегка затемненном поле. Фаза диэструса характеризуется множеством лейкоцитов, единичных эпителиальных клеток и значительным количеством слизи. После нескольких циклов формировались группы с совпадающими фазами для начала эксперимента.
Через 8 дней после моделирования ССВО на фоне соответствующей диеты, крыс экспериментальных групп наркотизировали золетил-ксилазиновым наркозом: золетил 0.3 мг в/м (Virbac, Франция), ксиланит 0.8 мг в/м (ЗАО НИТА-ФАРМ, Россия, г. Саратов), атропина сульфат 0.1%-ный раствор – 0.01 мл п/к из расчета на 100 г массы тела животного. Наркотизировали изофлураном, брали цельную кровь из задней полой вены для гематологического, биохимического и иммунологического анализа. Клинический анализ крови выполняли на автоматическом ветеринарном гематологическом анализаторе (URIT-3000 Vet Plus, URIT Medical Electronic, Китай). Уровень фактора некроза опухоли-α (TNF-α), лептина (LEP), интерлейкина-2 (IL-2), трансформирующего фактора роста-β (TGF-β) и липополисахарида (LPS) оценивали иммуноферментным методом (MR-96A, Mindray, Китай). Ориентировочно-исследовательское поведение оценивали в тесте “открытое поле” (ОП), тревожность – в тесте “приподнятый крестообразный лабиринт” (ПКЛ), формирование условного рефлекса активного избегания (УРАИ) проводились с помощью аппаратно-программных комплексов – АПК “Минотавр” и АПК “Шелтер” (Нейроботикс, Россия). Посмертно измерялась масса внутренних органов. Сравнение массы внутренних органов посредством коэффициентов их отношения к массе тела за вычетом массы слепой кишки вычисляли по формуле Кмо = (МО/МТ – МСЛК) × 100%, где МО – масса органа, МТ – масса тела, МСЛК – масса слепой кишки. На протяжении всего эксперимента, ежедневно с 9 до 10 ч утра проводили оценку клинического статуса животных, потребления корма и воды, а также массы тела животных. После торакотомии сердце извлекали из грудной клетки и подключали к модернизированному аппарату Лангендорфа. Перфузию осуществляли ретроградно через аорту оксигенезированным буфером Кребса–Хинзелайта при постоянном давлении 80 мм рт. ст. В течение всего эксперимента температура сердца и растворов поддерживалась на уровне 37°С. В полость левого желудочка вводили полиэтиленовый баллон для регистрации давления в изоволюметрическом режиме [16]. В ходе перфузии изолированного сердца регистрировали частоту сердечных сокращений (уд./мин.), коронарный поток (мл/мин), величины конечно-диастолического и систолического давления в левом желудочке на персональном компьютере с помощью программы PhysExp 3.0 [17]. После завершения реперфузии осуществляли планиметрическую оценку размера инфаркта путем окраски срезов сердца 1%-ным раствором трифенилтетразолия хлорида. Размер инфаркта выражали в процентах от общей площади среза и вычисляли среднее значение для данного сердца по результатам анализа 5 срезов.
Для каждого из определяемых показателей рассчитывали среднее значение (M) и стандартное отклонение (±SD). После проверки выборки на нормальность распределения статистический анализ полученных результатов проводился с использованием непараметрического критерия Манна–Уитни (программный пакет STATISTICA 9.0). Статистическая значимость различий считалась достоверной при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела, потребление воды и корма
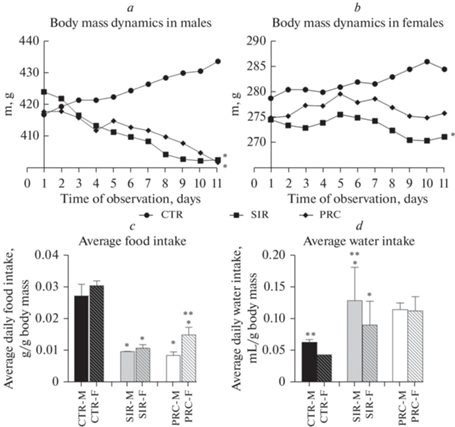
Существенные изменения динамики массы тела в опытных группах с моделированием ССВО по отношению к CTR на протяжении последних 8 дней были отмечены для крыс обоих полов. У крыс в группе CTR-F масса тела от начала до конца наблюдения увеличилась с 278 ± 5 до 285 ± 1 г (р < 0.05); в группе SIR-F уменьшилась с 275 ± 4 до 271 ± 6 г (р < 0.05), а в PRC-F не изменилась (275 ± 13 и 276 ± 9 г, р > 0.05), что показывает эффективность пробиотической терапии для этой группы. В группе CTR-М масса тела увеличилась с 417 ± 19 до 434 ± 23 г, в группе CBO-M уменьшилась с 424 ± 2 до 403 ± 5 г (р < 0.05), а в группе PRC-М – с 418 ± 8 г до 393 ± 14 г (р < 0.05) (рис. 1a, b). У крыс групп SIR-F и SIR-М, а также групп PRC-F и PRC-M потребление корма в течение 8 дней после моделирования ССВО по сравнению с соответствующими контролями снижалось многократно (р < 0.05). В условиях ССВО самки потребляли корм несколько больше, чем самцы, причем для группы PRC-F эта разница была статистически значимой (р < 0.05). Среднее потребление воды из расчета на 1 г массы тела в группе CTR-М было больше на 30%, чем в группе CTR-F (р < 0.05). В группах SIR для самцов и самок отмечено 2-кратное увеличение потребления воды по отношению к CTR при сохранении значимых различий между самцами и самками (р < 0.05). В группах PRC-F и PRC-М потребление воды не отличалось (рис. 1c, d).
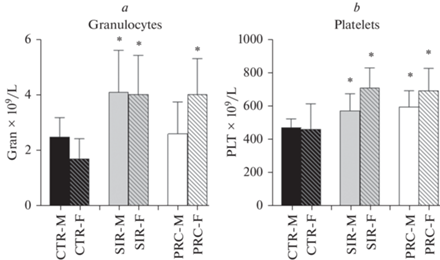
Рис. 1.
Динамика изменения массы тела (a, b), среднее потребление корма (c) и воды (d). CTR – контрольная группа, SIR – группа с моделированным синдромом системного воспалительного ответа, PRC – группа с пробиотической терапией, M – самцы, F – самки. * – р < 0.05 по отношению к соответствующему полу CTR, ** – р < 0.05 различия между самками и самцами.
В группах самок (SIR-F и PRC-F) произошло существенное увеличение массы селезенки (р < 0.05) по сравнению с группой CTR-F. Значимое кратное увеличение массы желудка и слепой кишки с содержимым наблюдали в группах PRC-F, PRC-М, SIR-М, SIR-F (р < 0.05). В группах SIR-М и PRC-М в отличие от SIR-F и PRC-F отмечено значимое увеличение депозитов висцерального жира по отношению к соответствующим контролям (р < 0.05) вследствие индуцированного жироуглеводной диетой первичного висцерального ожирения. Также масса жировой ткани была значимо выше в группе CTR-М, чем в группе CTR-F (р < 0.05) (табл. 1).
Таблица 1.
Коэффициенты отношения массы внутренних органов к массе тела
| Группа | Печень | Почки | Селезенка | Висцеральный жир | Желудок с содержимым | Слепая кишка |
|---|---|---|---|---|---|---|
| CTR-М | 2.98 ± 0.24 | 0.513 ± 0.033 | 0.194 ± 0.004 | 3.90 ± 1.25 | 0.95 ± 0.35 | 1.36 ± 0.24 |
| CTR-F | 2.51 ± 0.74 | 0.537 ± 0.03 | 0.226 ± 0.002 | 2.18 ± 0.36** | 1.11 ± 0.15 | 1.67 ± 0.41 |
| SIR-М | 2.79 ± 0.25 | 0.512 ± 0.06 | 0.197 ± 0.004 | 4.97 ± 1.49* | 1.76 ± 0.24 * | 2.29 ± 0.45* |
| SIR-F | 2.93 ± 0.29 | 0.538 ± 0.05 | 0.263 ± 0.007* | 2.88 ± 0.76 | 2.22 ± 0.46* | 3.69 ± 1.20* |
| PRC-М | 2.73 ± 0.34 | 0.529 ± 0.05 | 0.225 ± 0.006 | 4.89 ± 1.12* | 1.40 ± 0.48* | 2.82 ± 0.38* |
| PRC-F | 2.99 ± 0.21 | 0.544 ± 0.05 | 0.258 ± 0.028* | 2.78 ± 0.46 | 2.66 ± 0.20* | 3.94 ± 0.73* |
Клинический анализ крови
В группах SIR-M и SIR-F отмечен лейкоцитоз (р < 0.05) за счет увеличения фракции гранулоцитов. Необходимо отметить, что в группе PRC-F этот показатель не изменился, тогда как для PRC-М не отличался от группы CTR-M. В группах PRC-F, PRC-М, SIR-М, SIR-F отмечен тромбоцитоз (р < 0.05) (рис. 2а, b). Существенных изменений количества эритроцитов не отмечено.
Уровень лептина, цитокинов и липополисахарида
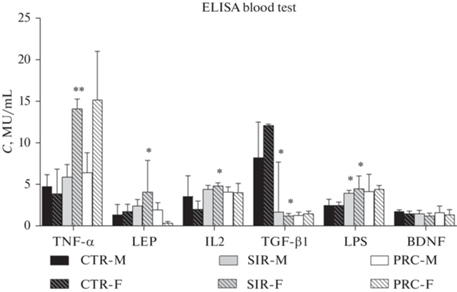
Наиболее значимые различия между самцами и самками были обнаружены при моделировании ССВО и оценке уровней TNF-α, LEP, IL-2, LPS и TGF-β1 в крови (рис. 3). Уровень TNF-α в сыворотке крови в группе SIR-F был более чем в 2 раза больше, чем в группе SIR-М (р < 0.05), несмотря на отсутствие различий между группами CTR-F и CTR-М, что указывает на большую лабильность воспалительного ответа у самок. Влияния пробиотиков на показатель TNF-α для обоих полов не обнаружено. В группе SIR-F отмечено двукратное увеличение концентрации лептина и IL-2 (р < 0.05). Существенное уменьшение уровня TGF-β1 в группах SIR-F и SIR-M (в 8 и 5 раз соответственно) и двукратное (р < 0.05) увеличение концентрации LPS носили общий характер для обоих полов. Влияние пробиотиков на измеряемые параметры отсутствовало за исключением снижения уровня лептина в группе PRC-F. Уровень BDNF не различался во всех исследованных группах.
Рис. 3.
Уровень TNF-α, LEP, IL-2, TGF-β, LPS и BDNF в крови. CTR – контрольная группа, SIR – группа с моделированным синдромом системного воспалительного ответа, PRC – группа с пробиотической терапией, M – самцы, F – самки. * – р < 0.05 по отношению к соответствующему полу CTR, ** – р < 0.05 различия между самками и самцами.
Поведенческие реакции
Анализ параметров ориентировочно-исследовательского поведения в новых стрессогенных условиях в тесте “открытое поле” представлен в табл. 2. Отмечено большее количество стоек и заглядываний в группе CTR-F по сравнению с группой CTR-M (р < 0.05) при отсутствии различий между этими группами по другим параметрам ОИП. В группе SIR-M по сравнению с группой CTR-M обнаружено большее значение времени пассивности (р < 0.05). В группе SIR-F отмечено большее значение времени активности в сравнении как с группой CTR-F, так и с SIR-М, а также большее значение пройденного пути и заглядываний в сравнении с группой SIR-М (р < 0.05). В группе PRC-F получено более высокое значение времени активности, пройденного пути, количества стоек и заглядываний по сравнению с группой PRC-М (р < 0.05).
Таблица 2.
Средние значения и их стандартные отклонения (M ± SD) показателей поведения крыс в тесте “открытое поле”: время активности, Т (акт), с; время пассивности, Т (пас), с; пройденный путь, (S), м; количество стоек, n (стойки); количество заглядываний, n (норки)
| Группа | Т (акт), с | Т (пас), с | Путь (S), м | Стойки, n | Норки, n |
|---|---|---|---|---|---|
| CTR-М | 64 ± 22 | 207 ± 23 | 10 ± 3 | 6 ± 4 | 1 ± 1 |
| CTR-F | 81 ± 13 | 200 ± 21 | 14 ± 2 | 11 ± 10** | 3 ± 2** |
| SIR-М | 52 ± 5 | 245 ± 12* | 9 ± 1 | 16 ± 4 | 0 ± 0 |
| SIR-F | 124 ± 12* | 171 ± 10 | 18 ± 2* | 23 ± 10 | 5 ± 1* |
| PRC-М | 33 ± 7 | 261 ± 9* | 7 ± 1 | 6 ± 1 | 1 ± 1 |
| PRC-F | 108 ± 14** | 187 ± 11** | 16 ± 2** | 20 ± 4** | 4 ± 3** |
Оценку степени тревожности, возникающей в результате стресса, вызванного высотой и необычностью ситуации, проводили помещением на открытое освещенное пространство в тесте ПКЛ. Наиболее выраженные различия по группам отмечены в центральной зоне испытательной площадки. Время активности Т (акт) и пройденный путь (S) в группах SIR-М и SIR-F многократно уменьшились по отношению к CTR-М и CTR-F (р < 0.05). Характер изменений количества стоек в группах аналогичен предыдущему описанию. Время пассивного нахождения Т (пас) в этой зоне у крыс группы SIR-F значимо уменьшилось в связи с нахождением в других зонах (р < 0.05). В группе PRC-М все значения максимально приблизились к CTR-М, а в группе PRC-F остались близки к SIR-F (табл. 3).
Таблица 3.
Средние значения и их стандартные отклонения (M ± SD) показателей поведения крыс в центральной зоне в тесте ПКЛ: время активности Т (акт), с; время пассивности Т (пас), с; пройденный путь (S), м; количество стоек, n (стойки)
| Группа | Т (акт), с | Т (пас), с | Путь (S), м | Стойки, n |
|---|---|---|---|---|
| CTR-М | 20 ± 11 | 50 ± 8 | 3.2 ± 1.2 | 11 ± 8 |
| CTR-F | 23 ± 5 | 88 ± 43 | 3.8 ± 0.2 | 8 ± 1 |
| SIR-М | 4 ± 1* | 40 ± 32 | 0.9 ± 0.4* | 3 ± 2* |
| SIR-F | 7 ± 3* | 11 ± 1* | 0.8 ± 0.2* | 1 ± 0.5* |
| PRC-М | 22 ± 4 | 73 ± 63 | 3.3 ± 2.5 | 5 ± 4 |
| PRC-F | 4 ± 2* | 6 ± 5* | 0.6 ± 0.4* | 0.2 ± 0.1* |
Время реакции в цикле (УРАИ, АПК “Шелтер”): звуковой сигнал–свет–электрический стимул–переход в темную камеру; в группе CTR-М составило 21.7 ± 1.1 с, а в CTR-F – 23.2 ± 1.7 с. После моделирования ССВO время цикла увеличилось в группе SIR-М до 25.9 ± 1.1 с (р < 0.05), а в SIR-F до 25.6 ± 1.9 с, а после пробиотической терапии в группе PRC-М уменьшилось до 23.7 ± 0.8 с (р < 0.05), а в группе PRC-F – до 22.4 ± 0.8 с (р > 0.05). Среднее перемещение по клетке при переходе из одной клетки в другую у самцов в контроле составило 5.6 ± 1.2 м, а у самок 9.4 ± 1.2 м, т.е. значимо различалось между собой (р < 0.05). Изменение этого параметра в группах SIR-М и PRC-М оказалось недостоверным, а у самок наблюдали значимое уменьшение – с 10.1 ± 2.4 для SIR-F до 7.1 ± 1.7 в PRC- F (р < 0.05, рис. 4a, b).
Рис. 4.
Результаты измерений в тесте “темно-светлая камера”, АПК “Шелтер”: время реакции в цикле (a), среднее перемещение (b). CTR – контрольная группа, SIR – группа с моделированным синдромом системного воспалительного ответа, PRC – группа с пробиотической терапией, M – самцы, F – самки. * – р < 0.05 по отношению к соответствующему полу CTR, ** – р < 0.05 различия между самками и самцами.
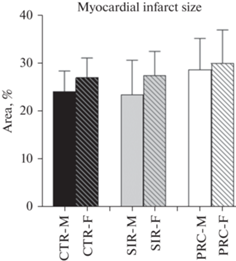
Гемодинамические параметры изолированного сердца в данном исследовании не отличались между группами в периоде стабилизации и в ходе реперфузии. Более того, размер инфаркта в группах CTR, SIR и PRC для обоих полов значимо не различался, имея некоторую тенденцию к увеличению в группах с введением пробиотиков (рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Каскад сложных молекулярных, эпигенетических, биохимических, гормональных, нервно-гуморальных и иных реакций при ССВО может иметь существенные половые различия, которые находят свое отражение в реактивности иммунной системы, особенностях внутриклеточного сигналинга, влиянии половых гормонов и гормонов стресса на систему нейровоспаления и т.д. [18–20]. Наиболее часто в эксперименте используется модель нейровоспаления, вызванная провоспалительным стрессом, индуцированным инъекцией LPS [21]. LPS является составным компонентом клеточной стенки различных грамотрицательных бактерий. Первичными клетками-мишенями для LPS являются фагоциты, которые экспрессируют связанный с мембраной антиген CD14 (mCD14) и толл-подобные рецепторы 4. LPS-связывающий протеин катализирует переход мономерного LPS из агрегатных комплексов к связывающему рецептору CD14 (mCD14) на поверхности фагоцитов, который в свою очередь ведет к активации ядерного транскрипционного фактора κВ и экспрессии большого числа эндогенных провоспалительных медиаторов (цитокины, хемокины и др.) через TLR4*MD-2 комплекс [22]. В этой работе обнаружено значимое снижение продукции TGF-β1 при повышении концентрации LPS в крови, показанное ранее в литературе [23]. Известная лимитирующая роль эстрогенов для ожирения в данной работе подтверждена меньшим содержанием висцерального жира у самок во всех опытных группах по сравнению с самцами, при незначительном увеличении показателя у крыс-самок с первичным висцеральным ожирением по отношению к контролю при указанном сроке жироуглеводной диеты. Вероятно, снижением уровня эстрогенов при моделировании ССВР можно объяснить существенное увеличение концентрации TNF-α [24]. Необходимо заметить, что введение пробиотиков не вызвало существенных изменений показателей исследуемых цитокинов в опытных группах, в связи с чем модулирование уровня лептина у крыс-самок с пробиотической терапией вызывает особый интерес при исследовании молекулярных мишеней, учитывая сведения о синергичном снижении уровня эстрадиола (Е2) и лептина у овариоэктомированных крыс, при увеличении показателя TNF-α [25].
Предложенная нами модель ССВО, включающая химически индуцированный колит и антибиотик-индуцированный дисбиоз, разработана с учетом использования в эксперименте животных со статусом SPF или улучшенных конвенциональных животных в виварии барьерного типа. Проведенные нами ранее исследования изменений состава кишечной микробиоты на данной модели показали существенное снижение представительства Lactobacillus spp. и Bifidobacterium spp. при увеличении грамотрицательных E. coli и Proteus spp., что согласуется с данными о существующем антагонизме между некоторыми штаммами Lactobacillus spp. и E. coli в единой экосистеме. В этой же работе показано существенное увеличение концентрации LPS в крови, модулируемое применением АМП широкого спектра действия [12].
В данном исследовании основной целью являлось изучение устойчивости миокарда к ишемии–реперфузии и поведенческих реакций у крыс линии SD обоих полов. В отличие от полученных ранее данных об увеличении размера инфаркта миокарда на модели ССВО у самцов стока Wistar в зависимости от возраста с демонстрацией пробиотического кардиопротективного эффекта [26], в данной работе как у самцов, так и у самок мы не обнаружили значимых различий в исследуемых группах. Возникает предположение, что обнаруженные существенные различия в эмоциональной реактивности, когнитивных способностях, стрессоустойчивости и тревожном поведении между крысами стока Wistar и линии Sprague-Dawley [27–29] распространяются в широком смысле на стрессоустойчивость и в отношении исследования сердечно-сосудистой системы, что подтверждается рекомендациями по использованию данной линии в отличных от кардиологических целей. Представляется полезным более глубокий анализ молекулярно-генетических основ устойчивости миокарда на модели изолированного сердца в зависимости от генетического разнообразия экспериментальных животных. Также в модифицированной нами модели ССВО, основанной на химически индуцированном воспалении кишечника [30], нами получены новые сведения о поведенческих реакциях самок и самцов линии SD. На белых беспородных крысах-самцах ранее было показано, что при действии длительного неконтролируемого стресса у активных доминантов в отличие от неактивных субординантов наблюдаются признаки депрессивно-подобного состояния, выраженного в достоверном снижении показателей динамики массы тела, увеличении уровня ангедонии, тревожности, снижении двигательной и исследовательской активности на 5-й день воздействия, увеличении болевого порога по сравнению с фоном [31]. У субординантов с неактивным типом стрессорной реакции на 5-й день воздействия наблюдается реакция, выраженная в снижении двигательной и исследовательской активности и увеличении тревожности [31]. Объяснение различной реакции на стресс, имеющее отношение к условиям данного эксперимента, можно найти в работе о протективном действии эстрогенов на LPS-индуцированное нейровоспаление [32].
ЗАКЛЮЧЕНИЕ
Длительный неконтролируемый стресс неоднозначно влияет на крыс линии SD различного пола. В группе самок после моделирования ССВО наблюдали более значимые изменения ряда параметров по сравнению с самцами, а именно, большее потребление корма из расчета на 1 г массы тела и более выраженные тромбоцитоз и гранулоцитоз. Уровень TNF-α в сыворотке крови у самок с моделированием ССВО по сравнению с контрольными самками повысился на 250%, лептина – на 120%, IL-2 – на 130%, LPS – на 74%. При этом концентрация TGF-β в этих же группах снизилась более чем в 10 раз. Ориентировочно-исследовательское поведение крыс-самок отличалось большей активностью по сравнению с самцами после моделирования ССВО, у которых после пробиотической терапии оно приблизилось к контролю. Такой же характер изменений тревожности отметили в тесте ПКЛ при сравнении самок с самцами, однако скорость выработки условных рефлексов в тесте УРАИ у самок была существенно выше. Значимых различий гемодинамических параметров изолированного сердца, а также размера инфаркта у самок и самцов линии SD отмечено не было.
Полученные данные дают дополнительные основания для понимания роли пола и половых гормонов в развитии системного воспалительного ответа и стресса, что лежит в основе различной реакции на течение болезни и на лекарственные препараты, а также определяет различную эффективность реабилитации.
Список литературы
Селье Г (1960) Очерки об адаптационном синдроме. М. Медгиз. [Sel‘e G (1960) Essays on Adaptation Syndrome. Moscow. Medgiz. (In Russ)].
Иващенко ВВ, Чернышев ИВ, Перепанова ТС, Никонова ЛМ, Казаченко АВ (2012) Стресс и синдром системного воспалительного ответа. Экспер и клин урол 4: 20–22. [Ivashchenko VV, Chernyshev IV, Perepanova TS, Nikonova LM, Kazachenko AV (2012) Stress and Systemic Inflammatory Response Syndrome. Exp Clin Urol 4: 20–22 (In Russ)].
Савельев ВС, Гельфанд БР (ред) (2006) Сепсис в начале XXI века. М. Изд-во Литтерра. [Savelyev VS, Gelfand BR (eds) Sepsis at the beginning of the XXI century M. Publ House Litterra. (In Russ)].
Дмитриева ТБ, Дроздов АЗ (2010) Половые и гендерные аспекты стрессоустойчивости (аналитический обзор). Часть 1. Рос психиатр журн 1: 18–24. [Dmitrieva TB, Drozdov AZ (2010) Sexual and gender aspects of resistance to stress (analytical review). Part 1. Russ Psychiatr J 1: 18–24. (In Russ)].
Custódio CS, Mello BSF, Filho AJMC, de Carvalho Lima CN, Cordeiro RC, Miyajima F, Réus GZ, Vasconcelos SMM, Barichello T, Quevedo J, de Oliveira AC, de Lucena DF, Macedo DS (2018) Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol Neurobiol 55(5): 3775–3788. https://doi.org/10.1007/s12035-017-0616-1
Parker G, Brotchie H (2010) Gender differences in depression. Int Rev Psychiatry 22(5): 429–436. https://doi.org/10.3109/09540261.2010.492391
Kessler RC, Petukhova M, Sampson NA, Zaslavsky AM, Wittchen H-U (2012) Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. Int J Methods Psychiatr Res 21(3): 169–184. https://doi.org/10.1002/mpr.1359
Laws KR, Irvine K, Gale TM (2018) Sex differences in Alzheimer’s disease. Curr Opin Psychiatry 31(2): 133–139. https://doi.org/10.1097/YCO.0000000000000401
Kudielka BM, Kirschbaum C (2005) Sex differences in HPA axis responses to stress: a review. Biol Psychol 69(1): 113–132. https://doi.org/10.1016/j.biopsycho.2004.11.009
Snider H, Lezama-Davila C, Alexander J, Satoskar AR (2009) Sex hormones and modulation of immunity against leishmaniasis. Neuroimmunomodulation 16(2): 106–113. https://doi.org/10.1159/000180265
Tsuda MC, Mahdi S, Namchuk A, Wu TJ, Lucki I (2020) Vendor differences in anxiety-like behaviors in female and male Sprague Dawley rats. Physiol Behav 227: 113131. https://doi.org/10.1016/j.physbeh.2020.113131
Борщев ЮЮ, Буровенко ИЮ, Карасева АБ, Минасян СМ, Борщев ВЮ, Семенова НЮ, Борщева ОВ, Половинкин ВВ, Родионов ГГ, Суворов АН, Галагудза ММ (2020) Моделирование синдрома системной воспалительной реакции химической индукцией травмы толстого кишечника у крыс. Мед иммунол 22(1): 87–98. [Borschev YuYu, Burovenko IYu, Karaseva AB, Minasyan SM, Borschev VYu, Semenova NYu, Borshcheva OV, Polovinkin VV, Rodionov GG, Suvorov AN, Galagudza MM (2020) Modeling of systemic inflammatory response syndrome by chemical induction of colon injury in rats. Med Immunol 22(1): 87–98. (In Russ)]. https://doi.org/10.15789/1563-0625-MOS-1839
Brindley D (1995) Role of glucocorticoids and fatty acids in the impairment of lipid metabolism observed in the metabolic syndrome. Int J Obes Relat Metab Disord 19 Suppl 1: S69–S75.
Brunner EJ, Hemingway H, Walker BR, Page M, Clarke P, Juneja M, Shipley MJ, Kumari M, Andrew R, Seckl JR, Papadopoulos A, Checkley S, Rumley A, Lowe GD, Stansfeld SA, Marmot MG (2002) Adrenocortical, autonomic, and inflammatory causes of the metabolic syndrome: nested case-control study. Circulation 106(21): 2659–2665. https://doi.org/10.1161/01.cir.0000038364.26310.bd
Борщев ЮЮ, Буровенко ИЮ, Карасева АБ, Минасян СМ, Процак ЕС, Борщев ВЮ, Семенова НЮ, Борщева ОВ, Суворов АН, Галагудза ММ (2021) Влияние качественного состава высокожировой диеты на уровень цитокинов и устойчивость миокарда к ишемии-реперфузии у крыс с синдромом системного воспалительного ответа. Мед иммунол 23(5): 1091–1106. [Borshchev YuYu, Burovenko IYu, Karaseva AB, Minasyan SM, Protsak ES, Borshchev VYu, Semenova NYu, Borshcheva OV, Suvorov AN, Galagudza MM (2021) Influence of the qualitative composition of a high-fat diet on the level of cytokines and myocardial resistance to ischemia-reperfusion in rats with systemic inflammatory response syndrome. Med Immunol 23(5): 1091–1106. (In Russ)]. https://doi.org/10.15789/1563-0625-EOT-2166
Минасян СМ, Бадриханова ЛР, Галагудза ММ, Курапеев ДИ (2008) Сравнительное исследование защитного эффекта гипотермии, ишемического прекондиционирования и модифицированных кардиоплегических растворов при ишемии-реперфузии изолированного сердца крысы. Регионар кровообращ и микроциркул 7(2): 72–78. [Minasyan SM, Badrikhanova LR, Galagudza MM, Kurapeev DI (2008) Comparative study of the protective effect of hypothermia, ischemic preconditioning and modified cardioplegic solutions in ischemia-reperfusion of an isolated rat heart. Region Blood Circulat and Microcircul 7(2): 72–78. (In Russ)].
Королев ДВ, Александров ИВ, Галагудза ММ, Сыренский АВ, Сонин ДЛ, Егорова ЕИ (2008) Автоматизация получения и обработки данных физиологического эксперимента. Регионар кровообращ и микроциркул 7(2): 79–84. [Korolev DV, Aleksandrov IV, Galagudza MM, Syrenskiy AV, Sonin DL, Egorova EI (2008) Automation of receiving and processing data from a physiological experiment. Region Blood Circulat and Microcircul 7(2): 79–84. (In Russ)].
Berkiks I, Garcia-Segura LM, Nassiri A, Mesfioui A, Ouichou A, Boulbaroud S, Bahbiti Y, Lopez-Rodriguez AB, Hasnaoui E, El Hessni A (2019) The sex differences of the behavior response to early Life immune stimulation: Microglia and astrocytes involvement. Physiol Behav 199: 386–394. https://doi.org/10.1016/j.physbeh.2018.11.037
Tchessalova D, Tronson NC (2019) Memory deficits in males and females long after subchronic immune challenge. Neurobiol Learn Mem 158: 60–72. https://doi.org/10.1016/j.nlm.2019.01.003
Villa A, Rizzi N, Vegeto E, Ciana P, Maggi A (2015) Estrogen accelerates the resolution of inflammation in macrophagic cells. Sci Rep 5: 15224. https://doi.org/10.1038/srep15224
Брошевицкая НД, Павлова ИВ, Зайченко МИ, Онуфриев МВ, Моисеева ЮВ, Григорьян ГА (2020) Половые различия в оборонительном поведении взрослых крыс в ответ на ранний нейровоспалительный стресс. Журн высш нервн деятельн им ИП Павлова 70(2): 259–276. [Broshevitskaya ND, Pavlova IV, Zaychenko MI, Onufriyev MV, Moiseyeva YuV, Grigor’yan GA (2020) Sex differences in the defensive behavior of adult rats in response to early neuroinflammatory stress. IP Pavlov J Higher Nerv Activity 70 (2): 259–276. (In Russ)]. https://doi.org/10.31857/S0044467720020057
Alexander C, Rietschel ET (2001) Bacterial lipopolysaccharides and innate immunity. J Endotoxin Res 7 (3): 167–202.
Grotenhuis N, De Witte SF, van Osch GJ, Bayon Y, Lange JF, Bastiaansen-Jenniskens YM (2016) Biomaterials influence macrophage-mesenchymal stem cell interaction in vitro. Tissue Eng Part A 22(17–18): 1098–1107. https://doi.org/10.1089/ten.TEA.2016.0162
Knowlton AA, Lee AR (2012) Estrogen and the cardiovascular system. Pharmacol Ther 135(1): 54–70. https://doi.org/10.1016/j.pharmthera.2012.03.007
Saral S, Saydam F, Dokumacioglu E, Atak M, Tümkaya L, Uydu HA (2021) Effect of white tea consumption on serum leptin, TNF-α and UCP1 gene expression in ovariectomized rats. Eur Cytokine Netw 32(2): 31–38. https://doi.org/10.1684/ecn.2021.0467
Borshchev YY, Sinitsa AV, Zakharchenko MM, Borshchev VY, Burovenko IY, Galagudza MM (2018) Effect of Antiobiotic-Induced Disbiosis and Its Correction with Probiotics on Myocardial Tolerance to Ischemia-Reperfusion Injury in SPF Rats. Bull Exp Biol Med 166(4): 440–443. https://doi.org/10.1007/s10517-019-04368-5
Goepfrich AA, Gluch C, Friemel CM, Schneider M (2013) Behavioral differences in three Wistar Han rat lines for emotional reactivity, cognitive processing and ethanol intake. Physiol Behav 110–111: 102–108. https://doi.org/10.1016/j.physbeh.2012.12.019
Honndorf S, Lindemann C, Töllner K, Gernert M (2011) Female Wistar rats obtained from different breeders vary in anxiety-like behavior and epileptogenesis. Epilepsy Res 94(1–2): 26–38. https://doi.org/10.1016/j.eplepsyres.2010.12.012
Langer M, Brandt C, Löscher W (2011) Marked strain and substrain differences in induction of status epilepticus and subsequent development of neurodegeneration, epilepsy, and behavioral alterations in rats [corrected]. Epilepsy Res 96(3): 207–224. https://doi.org/10.1016/j.eplepsyres.2011.06.005
Клёсов РА, Каркищенко ВН, Степанова ОИ, Баранова ОВ (2020) Сравнительное экспериментальное биомоделирование нпвс-индуцированного энтероколита. Биомедицина 16(1): 65–81. [Klyosov RA, Karkishchenko VN, Stepanova OI, Baranova OV (2020) Comparative experimental biomodelling of NSAID-induced enterocolitis. Biomedicine 16(1): 65–81. (In Russ)].
Немец ВВ, Шмурак ВИ, Соболев ВЕ, Гарнюк ВВ, Рован ЕД, Виноградова ЕП (2019) Влияние кратковременного и длительного неконтролируемого стресса на животных доминантного и субординантного социального статуса с различным типом стрессорной реакции. Рос физиол журн им. И.М. Сеченова 105(5): 608–618. [Nemets VV, Shmurak VI, Sobolev VE, Garnyuk VV, Rovan ED, Vinogradova EP (2019) Influence of short-term and long-term uncontrolled stress on animals of dominant and subordinate social status with different types of stress reaction. Russ J Physiol 105(5): 608–618. (In Russ)].
Vegeto E, Bonincontro C, Pollio G, Sala A, Viappiani S, Nardi F, Brusadelli A, Viviani B, Ciana P, Maggi A (2001) Estrogen prevents the lipopolysaccharide-induced inflammatory response in microglia. J Neurosci 21 (6): 1809–1818. https://doi.org/10.1523/JNEUROSCI.21-06-01809.2001
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова