Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 249-261
Реципрокность М- и N-холинергических механизмов при изменениях микроциркуляции легких в условиях экспериментальной тромбоэмболии легочной артерии
В. И. Евлахов 1, *, И. З. Поясов 1, Т. П. Березина 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: viespbru@mail.ru
Поступила в редакцию 24.11.2021
После доработки 09.12.2021
Принята к публикации 10.12.2021
- EDN: SFCKQU
- DOI: 10.31857/S0869813922020042
Аннотация
В острых опытах на изолированных перфузируемых легких кроликов изучали изменения легочной микрогемодинамики при моделировании тромбоэмболии легочной артерии в группе сравнения и в условиях блокады или активации М- и N-холинорецепторов. При тромбоэмболии легочной артерии на фоне инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов пирензепином давление в легочной артерии возрастало примерно так же, как и в группе сравнения. Однако капиллярное гидростатическое давление и посткапиллярное сопротивление не изменялись, что свидетельствует об уменьшении симпатических констрикторных влияний преимущественно на легочные венозные сосуды. Коэффициент капиллярной фильтрации возрастал в большей степени, чем в группе сравнения, что обусловлено повышением проницаемости эндотелия сосудов легких. В ответ на эмболизацию легочной артерии в условиях инфузии N-миметика цитизина в сочетании с блокадой альфа-адренорецепторов фентоламином и М-холинорецепторов атропином прирост давления в легочной артерии и прекапиллярного сопротивления был менее выражен, чем при инфузии ацетилхолина в условиях блокады М1-холинорецепторов и в группе сравнения. Это свидетельствует о преимущественном дилататорном влиянии активации N-холинорецепторов эндотелия на легочные артериальные сосуды. В указанных условиях капиллярное гидростатическое давление и посткапиллярное сопротивление повышались примерно так же, как и в группе сравнения. Однако коэффициент капиллярной фильтрации возрастал в меньшей степени, чем при тромбоэмболии легочной артерии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов, что свидетельствует об уменьшении проницаемости эндотелия. Результаты опытов позволяют полагать о реципрокном характере взаимодействия M- и N-холинергических механизмов регуляции проницаемости легочных сосудов: активация М-холинорецепторов эндотелия в условиях легочной тромбоэмболии способствует повышению коэффициента капиллярной фильтрации, тогда как активация N-холинорецепторов приводит к его снижению.
Острая тромбоэмболия легочной артерии является неотложным жизнеугрожающим состоянием. Развитие в указанных условиях легочной гипертензии и “легочного сердца” приводит к резким нарушениям легочной и системной гемодинамики [1]. Поэтому, наряду с проводимым в клинической практике тромболизисом, важной задачей является снижение легочного сосудистого сопротивления. Однако эффективность используемого при указанной патологии, например, внутривенного введения эпопростенола и применяемой ингаляции оксида азота невысока [2, 3]. Следовательно, поиск и изучение механизмов, способствующих уменьшению сопротивления сосудов легких при легочной тромбоэмболии, является актуальной задачей. Возможным способом снижения легочного сосудистого сопротивления в условиях тромбоэмболии легочной артерии могло бы быть воздействие на холинергические механизмы. Ранее нами показано, что активация тормозных пресинаптических М2-холинорецепторов в условиях легочной тромбоэмболии способствует уменьшению симпатических вазоконстрикторных влияний, что особенно выражено в реакциях легочных венозных сосудов [4]. В литературе также представлены сведения о том, что на эндотелиальных клетках сосудов имеются никотинчувствительные холинорецепторы, сходные по строению с таковыми в нейронах вегетативных симпатических и парасимпатических ганглиев [5, 6]. Активация эндотелиальных N-холинорецепторов сопровождается снижением тонуса сосудов посредством усиления эндотелийзависимого механизма синтеза оксида азота [5, 6]. Вместе с тем, возбуждение указанных рецепторов способствует ускорению пролиферации гладкомышечных клеток и неоангиогенеза [7–9]. Однако вопрос о роли холинергических механизмов в реакциях легочных сосудов и возникающих в результате сдвигах микроциркуляции легких в условиях тромбоэмболии легочной артерии в литературе практически не освещен. Важно также подчеркнуть, что исследования, проводимые на культуре эндотелиальных клеток или изолированных колечках легочных сосудов, не позволяют выяснить значимость этих механизмов в регуляции проницаемости сосудов легких и сдвигах фильтрационно-абсорбционного равновесия при указанной патологии. Целью исследования явилось проведение сравнительного анализа изменений легочной микрогемодинамики в условиях перфузии изолированных легких при экспериментальной тромбоэмболии легочной артерии в группе сравнения, на фоне блокады или активации M- и N-холинорецепторов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 37 кроликах массой 3.0–4.0 кг (питомник “Рапполово”, Ленинградская область) в условиях общей анестезии (уретан + хлоралоза (Sigma Chemical Co., США) 500 и 50 мг/кг соответственно, внутрибрюшинно) при искусственной вентиляции легких (частота дыхания 30–40 циклов/мин, дыхательный объем 15–20 см3/кг) с помощью аппарата “Фаза-9” (Россия) и вскрытой грудной клетке. Контроль газового состава и кислотно-щелочного состояния крови осуществляли газоанализатором ABL-50 (Radiometer, Дания) [10]. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтического комитета Института экспериментальной медицины.
В исследовании проведено 5 серий опытов на перфузируемых изолированных легких in situ двухканальным насосом постоянного расхода (136 мл/мин) производства ФГБНУ “ИЭМ”. Капиллярное гидростатическое давление и коэффициент капиллярной фильтрации определяли с помощью методики волюмометрии экстракорпорально циркулирующей крови [10]. Величины перфузионного давления в легочной артерии, левом предсердии и экстракорпоральном резервуаре измеряли тензодатчиками MLT0699 (AD Instruments, Австралия).
В первой серии экспериментов (7 кроликов, группа сравнения) для моделирования тромбоэмболии легочной артерии в нее через Т-образный тройник, соединенный с перфузионным насосом, вводили 10–15 аутологичных эмболов цилиндрической формы диаметром 0.8 мм и длиной 1–1.5 мм, приготовленных по методике [10]. Во второй и третьей сериях опытов (7 и 8 кроликов соответственно) легочная тромбоэмболия моделировалась после предварительного применения неселективного блокатора М-холинорецепторов атропина (0.01 мг/кг) и блокатора N-холинорецепторов вегетативных ганглиев пентамина (1 мг/кг) [11]. В четвертой серии опытов (8 кроликов) эмболы вводили в легочную артерию в условиях инфузии ацетилхолина (0.001 мкг/кг/мин) в физиологическом растворе (0.9%-ный раствор хлорида натрия) при помощи микродозатора (ФБГНУ “ИЭМ”) на фоне блокады М1-холинорецепторов пирензепином (гастроцепин, Boehringer Ingelheim, ФРГ) (1 мг/кг) [11]. В пятой серии опытов (7 кроликов) тромбоэмболию моделировали в условиях инфузии N-миметика цитизина (цититон, 0.02 мг/кг/мин) в физиологическом растворе после блокады альфа-адренорецепторов фентоламином (1.5–2 мг/кг) и атропином (0.01 мг/кг) [11] с целью исключения активации констрикторных адренергических и М-холинергических механизмов. Все препараты, как и эмболы, вводили непосредственно в легочную артерию. Ацетилхолин, цититон, фентоламин и атропин произведены в России. В конце опытов на электронных весах МАССА-К BK-300 (Россия) измеряли массу легких кроликов, которая составила 25 ± 3 г.
Концентрацию катехоламинов в плазме крови, оттекающей от легких, определяли методом Фолина–Чокалтеу [4, 12]. Для отделения плазмы 3 мл гепаринизированной крови центрифугировали (центрифуга LMC-3000 (Латвия), 1000 об./мин) в течение 20 мин. Для осаждения белков 0.1 мл плазмы добавляли к 1 мл 5%-ного раствора трихлоруксусной кислоты и снова центрифугировали (2000 об./мин) в течение 10 мин. Затем к супернатанту добавляли 4 мл 10%-ного раствора карбоната натрия и 0.5 мл реактива Фолина–Чокалтеу. Через 5–10 мин определяли концентрацию катехоламинов на фотометре КФК-3-01 (Россия) при длине волны 650 нм после предварительной калибровки фотометра стандартным 0.1%-ным раствором адреналина (Россия). Реактив Фолина–Чокалтеу, трихлоруксусная кислота и карбонат натрия были приобретены в “Ленреактив” (Россия).
Электрические сигналы измеряемых показателей записывали на жесткий диск компьютера IBM PC Pentium после аналого-цифрового преобразования платой L-Сard L-783 с последующим определением расчетных гемодинамических параметров и анализом по программе АСТest (версия 1.6.59, ООО “Лаборатория автоматизированных систем”, Россия). Изменения исследуемых показателей микроциркуляции легких и концентрацию катехоламинов сравнивали на 5-й минуте после применения указанных выше препаратов и эмболов при достижении максимальных сдвигов давления в легочной артерии. Для статистической обработки результатов опытов с помощью программы Axum 5.0 (Math Soft Inc., США) при проверке гипотезы отличий сдвигов исследуемых показателей от нуля применяли t-критерий Стьюдента. Достоверными считали отличия при p < 0.05; проверка экспериментальных данных на нормальное распределение проводилась с использованием критерия Колмогорова–Смирнова.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исходные значения исследуемых показателей микроциркуляции легких, а также концентрация катехоламинов в проведенных сериях экспериментов представлены в табл. 1.
Таблица 1.
Исходные значения показателей микрогемодинамики перфузируемых легких кроликов в проведенных опытах
| Показатель, размерность |
Исходные значения в сериях экспериментов: | ||||
|---|---|---|---|---|---|
| I n = 7 |
II n = 7 |
III n = 8 |
IV n = 8 |
V n = 7 |
|
| Перфузионное давление в легочной артерии, мм рт. ст. | 30 ± 2 | 30 ± 3 | 25 ± 2 | 25 ± 4 | 28 ± 4 |
| Давление в левом предсердии, мм рт. ст. |
5.6 ± 0.3 | 4.8 ± 0.2 | 4.3 ± 0.2 | 4.6 ± 0.2 | 5.1 ± 0.3 |
| Капиллярное гидростатическое давление (Pc), мм рт. ст. | 8.9 ± 0.4 | 9.4 ± 0.1 | 7.9 ± 0.1 | 8.8 ± 0.4 | 8.5 ± 0.3 |
| Легочное сосудистое сопротивление, дин с см–5 | 239 ± 8 | 305 ± 8 | 202 ± 9 | 200 ± 12 | 224 ± 22 |
| Прекапиллярное сопротивление (Ra), дин с см–5 |
207 ± 7 | 260 ± 9 | 167 ± 9 | 159 ± 10 | 191 ± 19 |
| Посткапиллярное сопротивление (Rv), дин с см–5 |
32 ± 4 | 45 ± 3 | 35 ± 3 | 41 ± 4 | 33 ± 7 |
| Отношение Ra/Rv | 6.5 ± 0.5 | 5.8 ± 0.3 | 4.8 ± 0.3 | 3.9 ± 0.2 | 5.8 ± 0.7 |
| Коэффициент капиллярной фильтрации (CFC), мл/мин/100 г/мм рт. ст. | 0.04 ± 0.01 | 0.05 ± 0.01 | 0.04 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.01 |
| Масса легких, г | 26 ± 4 | 28 ± 2 | 24 ± 2 | 26 ± 5 | 19 ± 3 |
| Концентрация катехоламинов, мкг/л | 365 ± 26 | 341 ± 14 | 398 ± 12 | 342 ± 16 | Не определяли |
Данные этой таблицы свидетельствуют об отсутствии статистически достоверных различий между исходными значениями исследуемых показателей микрогемодинамики легких кроликов в проведенных опытах.
В ответ на применение блокатора М-холинорецепторов атропина большинство исследуемых показателей легочной микроциркуляции возрастало, что могло явиться результатом усиления высвобождения катехоламинов из симпатических нервных окончаний в результате блокады атропином тормозных пресинаптических М2-холинорецепторов [13]. Об этом свидетельствовало повышение концентрации катехоламинов на 9 ± 3% (p < 0.05) (табл. 2). Применение блокатора N-холинорецепторов вегетативных ганглиев пентамина в условиях перфузии изолированных легких сопровождалось снижением большинства исследуемых показателей микроциркуляции легких и концентрации катехоламинов на 12 ± 3% (p < 0.01) (табл. 2). При этом прекапиллярное сопротивление уменьшалось в большей степени, чем посткапиллярное (соответственно 28 ± 4% (p < 0.01) и 6 ± 2% (p < 0.05)), что свидетельствует о преимущественном влиянии нейрогенных констрикторных механизмов на легочные артериальные сосуды.
Таблица 2.
Характер и величина изменений показателей микрогемодинамики перфузируемых легких кроликов после применения блокаторов и агонистов М- и N-холинорецепторов
| Показатель | Изменение показателей в процентах относительно исходного уровня после применения: | ||||
|---|---|---|---|---|---|
| атропина | пентамина | пирензепина | ацетилхолин + пирензепин |
цитизин + фентоламин + атропин | |
| II серия n = 7 |
III серия n = 8 |
IV серия n = 8 |
V серия n = 7 |
||
| Перфузионное давление в легочной артерии | 20 ± 6* | –20 ± 6* | 8 ± 2** | –7 ± 2** | –10 ± 2** |
| Давление в левом предсердии | 0 ± 2 | –1 ± 2 | 0 ± 2 | 1± 3 | –2 ± 2 |
| Капиллярное гидростатическое давление (Pc) | 11 ± 3** | –4 ± 1** | 8 ± 3* | –1 ± 2 | –1 ± 2 |
| Легочное сосудистое сопротивление | 24 ± 5** | –24 ± 4** | 10 ± 2** | –9 ± 2** | –13 ± 4* |
| Прекапиллярное сопротивление (Ra) | 24 ± 6** | –28 ± 4** | 8 ± 2** | –10 ± 2** | –16 ± 4** |
| Посткапиллярное сопротивление (Rv) | 25 ± 4** | –6 ± 2* | 17 ± 6* | –2 ± 2 | –2 ± 3 |
| Отношение Ra/Rv | 0 ± 2 | –23 ± 5** | –7 ± 4 | –8 ± 4 | –15 ± 4** |
| Коэффициент капиллярной фильтрации (CFC) | 25 ± 6** | –16 ± 5* | 2 ± 3 | –16 ± 6* | –38 ± 9** |
| Концентрация катехоламинов | 9 ± 3* | –12 ± 3** | 13 ± 4* | 5 ± 3 | Не определяли |
Результаты проведенных экспериментов позволяют также полагать о сохранении нейрогенного компонента регуляции тонуса легочных сосудов в условиях перфузии изолированных легких in situ.
В опытах отмечено, что коэффициент капиллярной фильтрации в случае применения атропина возрастал, а в ответ на введение пентамина – снижался. Однако оставалось неясным, обусловлено ли это разнонаправленными сдвигами показателей легочной микроциркуляции или изменениями проницаемости эндотелия легочных сосудов.
Для ответа на этот вопрос нами были проведены опыты с активацией М- и N-холинорецепторов. Как отмечено выше, в четвертой серии опытов осуществляли инфузию ацетилхолина на фоне блокады M1-холинорецепторов пирензепином, поскольку констрикция легочных сосудов в случае применения ацетилхолина обусловлена преимущественно активацией М1-холинорецепторов [13]. В пятой серии опытов проводили инфузию N-миметика цитизина после блокады альфа-адренорецепторов фентоламином и М-холинорецепторов атропином с целью исключения активации констрикторных адренергических и М-холинергических механизмов в ответ на возбуждение цитизином N-холинорецепторов вегетативных ганглиев.
Инфузия ацетилхолина на фоне блокады М1-холинорецепторов приводила к снижению большинства параметров микроциркуляции легких. При этом коэффициент капиллярной фильтрации уменьшался на 16 ± 6% (p < 0.05). В условиях инфузии N-миметика цитизина после блокады альфа-адренорецепторов и М-холинорецепторов коэффициент капиллярной фильтрации снижался на 38 ± 9% (p < 0.01), т.е. в большей степени, хотя в обоих случаях показатели легочной микроциркуляции уменьшались примерно одинаково (табл. 2). Следовательно, активация N-холинорецепторов эндотелия способствует снижению проницаемости легочных сосудов, что может иметь значение в условиях легочной тромбоэмболии. Для проверки этого предположения нами были проведены эксперименты, в которых указанную патологию моделировали на фоне инфузии ацетилхолина в условиях блокады М1-холинорецепторов или при инфузии цитизина в сочетании с применением фентоламина и атропина. Результаты этих опытов представлены в табл. 3.
Таблица 3.
Направленность и величина изменений показателей микрогемодинамики перфузируемых легких кроликов при тромбоэмболии легочной артерии на фоне применения блокаторов и агонистов М- и N-холинорецепторов
| Показатель | Изменение показателей при тромбоэмболии легочной артерии | ||||
|---|---|---|---|---|---|
| в группе
сравнения (I серия) n = 7 |
на фоне применения: | ||||
| атропина n = 7 |
пентамина n = 8 |
ацетилхолина +
пирензепина n = 8 |
цитизина +
фентоламина + атропина n = 7 |
||
| Перфузионное давление в легочной артерии | 90 ± 10** | 130 ± 6** | 145 ± 16** | 96 ± 4** | 56 ± 8** |
| Давление в левом предсердии | –4 ± 2 | 14 ± 5* | 5 ± 4 | 1 ± 2 | 2 ± 3 |
| Капиллярное гидростатическое давление (Pc) | 17± 4** | 23 ± 4** | 37 ± 4** | 1 ± 2 | 14 ± 3** |
| Легочное сосудистое сопротивление | 111± 18** | 149± 7** | 183 ± 20** | 118 ± 5** | 77 ± 12** |
| Прекапиллярное сопротивление (Ra) | 120± 22** | 169± 6** | 212 ± 26** | 152 ± 7** | 91 ± 14** |
| Посткапиллярное сопротивление (Rv) | 53 ± 6** | 33 ± 5** | 76 ± 13** | 2 ± 5 | 36 ± 8** |
| Отношение Ra/Rv | 43 ± 7** | 102 ± 18** | 76 ± 21** | 142 ± 16** | 43 ± 14* |
| Коэффициент капиллярной фильтрации (CFC) | 25 ± 4** | 40 ± 7** | 52 ± 14** | 67± 12** | 33 ± 8** |
| Концентрация катехоламинов (относительно исходного уровня) | 14 ± 3** | 15 ± 4** | –5 ± 2 | 3 ± 2 | Не определяли |
Изменения показателей микроциркуляции представлены в процентах к исходному уровню для животных в группе сравнения или к фону после применения препаратов в виде M ± m, где М – среднее арифметическое значение показателей, m – стандартная ошибка среднего значения. Цифры со знаком (–) – снижение показателя; * – p < 0.05; ** – p < 0.01. Отсутствие звездочки – недостоверные изменения показателя. n – количество животных.
У животных в группе сравнения тромбоэмболия легочной артерии вызывала повышение давления в ней, увеличение пре- и посткапиллярного сопротивлений, легочного сосудистого сопротивления, капиллярного гидростатического давления и коэффициента капиллярной фильтрации.
При легочной эмболии у кроликов на фоне применения атропина давление в легочной артерии, а также легочное сосудистое и прекапиллярное сопротивление возрастали в большей степени, чем в группе сравнения (табл. 3).
Однако сдвиги капиллярного гидростатического давления и посткапиллярного сопротивления в обоих случаях были близкими, что свидетельствует о превалировании констрикторных нейрогенных и гуморальных влияний на артериальные сосуды легких.
При эмболизации легочной артерии в условиях блокады N-холинорецепторов пентамином все исследуемые параметры микроциркуляции легких возрастали в большей степени по сравнению с группой сравнения. В опытах также отмечено, что коэффициент капиллярной фильтрации увеличивался более выражено, чем при указанном воздействии на фоне применения атропина и практически в два раза больше, чем в группе сравнения (табл. 3).
При моделировании легочной тромбоэмболии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов прирост давления в легочной артерии был меньше, чем на фоне действия атропина, но близок к таковому в группе сравнения. Вместе с тем, капиллярное гидростатическое давление и посткапиллярное сопротивление не изменялись, а концентрация катехоламинов не повышалась. Однако коэффициент капиллярной фильтрации возрастал на 67 ± 12% (p < 0.01), т.е. в большей степени, чем в группе сравнения (25 ± 4% (p < 0.01)), что могло свидетельствовать о повышении проницаемости эндотелия сосудов легких.
В условиях же эмболизации легочной артерии на фоне активации N-холинорецепторов цитизином в сочетании с применением фентоламина и атропина давление в легочной артерии возрастало меньше, чем при инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов, а капиллярное гидростатическое давление и посткапиллярное сопротивление возрастали (табл. 3). При этом коэффициент капиллярной фильтрации увеличивался на 33 ± 8% (p < 0.01), т.е. практически в 2 раза меньше, чем при легочной тромбоэмболии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов. Можно поэтому полагать, что активация N-холинорецепторов эндотелия способствует снижению проницаемости легочных сосудов при указанной патологии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для выяснения возможности активации холинергических механизмов с целью уменьшения констрикторных реакций сосудов легких и проницаемости эндотелия в условиях тромбоэмболии легочной артерии в проведенном исследовании изучали изменения микроциркуляции легких при моделировании легочной тромбоэмболии на перфузируемых изолированных легких кроликов в условиях блокады или активации M- и N-холинорецепторов.
В ответ на применение М-блокатора атропина и N-блокатора пентамина показатели легочной гемодинамики изменялись разнонаправленно: они повышались в случае применения атропина и уменьшались на фоне блокады N-холинорецепторов пентамином, что коррелировало со сдвигами концентрации катехоламинов в плазме крови, оттекающей от легких (табл. 2). Как отмечено выше, возрастание исследуемых показателей легочной микроциркуляции в случае применения атропина могло явиться результатом усиления высвобождения катехоламинов из симпатических нервных окончаний в результате блокады атропином тормозных пресинаптических М2-холинорецепторов [13]. В ответ на применение пентамина в результате блокады N-холинорецепторов вегетативных ганглиев уменьшались симпатические констрикторные влияния преимущественно на легочные артериальные сосуды, о чем свидетельствовало более выраженное уменьшение прекапиллярного сопротивления по сравнению с посткапиллярным (табл. 2).
Таким образом, разнонаправленный характер сдвигов показателей легочной микрогемодинамики в случае применения М-блокатора атропина и N-блокатора пентамина свидетельствует о реципрокных взаимоотношениях М- и N-холинергических механизмов в нейрогенной регуляции легочного микроциркуляторного русла, что было отмечено нами в ранее проведенных исследованиях для показателей системного кровообращения у кошек [14] и легочной макрогемодинамики у кроликов [15].
Для ответа на вопрос о роли холинергических механизмов в регуляции проницаемости эндотелия легочных сосудов нами были проведены опыты с активацией М- и N-холинорецепторов. С этой целью применяли инфузию ацетилхолина на фоне блокады M1-холинорецепторов пирензепином и инфузию N-миметика цитизина после блокады альфа-адренорецепторов фентоламином и М-холинорецепторов атропином. Указанные способы активации холинорецепторов позволили исключить констрикторные реакции легочных сосудов в ответ на возбуждение ацетилхолином М1-холинорецепторов, равно как и активацию цитизином N-холинорецепторов вегетативных ганглиев и в результате – адренергических и М-холинергических механизмов.
Инфузия ацетилхолина на фоне блокады М1-холинорецепторов вызывала снижение большинства параметров микроциркуляции легких, что могло быть обусловлено активацией М-холинорецепторов других подтипов (M2–M5) и усилением синтеза оксида азота [16, 17]. В ответ на инфузию цитизина в сочетании с блокадой альфа-адренорецепторов и М-холинорецепторов показатели легочной микрогемодинамики уменьшались примерно так же, как и при инфузии ацетилхолина в условиях блокады М1-холинорецепторов (табл. 2).
В опытах было отмечено, что при инфузии цитизина на фоне блокады альфа-адренорецепторов фентоламином и М-холинорецепторов атропином параметры микроциркуляции легких снижались в меньшей степени, чем в ответ на применение только фентоламина. Ранее при перфузии изолированных легких кроликов нами было показано [18], что в случае применения этого препарата давление в легочной артерии уменьшалось на 21 ± 6%, а легочное сосудистое сопротивление – на 17 ± 6%, тогда как в условиях инфузии цититона в сочетании с блокадой альфа-адренорецепторов и М-холинорецепторов указанные показатели уменьшались соответственно на 10 ± 2% и 13 ± 4%. Это можно объяснить тем, что цитизин мог активировать N-холинорецепторы легочных нейроэндокринных клеток и усиливать высвобождение из них серотонина, т.е. способствовать легочной вазоконстрикции [19]. В литературе также представлены работы, касающиеся значимости нейроэндокринной системы легких в развитии легочной гипертензии [20].
Коэффициент капиллярной фильтрации в случае инфузии ацетилхолина на фоне блокады M1-холинорецепторов уменьшался на 16 ± 6% (p < 0.05), тогда как при инфузии N-миметика цитизина в сочетании с блокадой альфа-адренорецепторов и М-холинорецепторов указанный показатель уменьшался на 38 ± 9% (p < 0.01), т.е. в большей степени (табл. 2).
При эмболизации легочной артерии после применения N-блокатора пентамина коэффициент капиллярной фильтрации возрастал более выражено, чем при тромбоэмболии на фоне действия M-блокатора атропина и практически в два раза больше, чем в группе сравнения (табл. 3). Полученные данные позволяют полагать, что активация N-холинорецепторов эндотелия в условиях указанной патологии может способствовать снижению проницаемости легочных сосудов.
Для проверки этого предположения нами были проведены эксперименты, в которых легочную тромбоэмболию моделировали на фоне активации М- и N-холинорецепторов. Результаты опытов показали, что при эмболизации легочной артерии на фоне инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов пирензепином прирост давления в легочной артерии был близок к таковому у животных в группе сравнения, но меньше, чем на фоне действия атропина. Вместе с тем, капиллярное гидростатическое давление и посткапиллярное сопротивление не изменялись, а концентрация катехоламинов не повышалась (табл. 3). Результаты этих экспериментов согласуются с ранее проведенными нами исследованиями, в которых показано, что активация тормозных пресинаптических М2-холинорецепторов в условиях тромбоэмболии легочной артерии способствует уменьшению симпатических вазоконстрикторных влияний преимущественно на легочные венозные сосуды [4].
Однако в ответ на эмболизацию легочной артерии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов коэффициент капиллярной фильтрации увеличивался на 67 ± 12% (p < 0.01), т.е. в большей степени, чем у кроликов в группе сравнения (25 ± 4%, p < 0.01). Это могло быть обусловлено как большим возрастанием соотношения пре- к посткапиллярному сопротивлению, так и повышением проницаемости эндотелия. В работе [21] на перфузируемых легких кроликов показано, что при введении ацетилхолина в легочную артерию увеличивается синтез эндотелина-I и тромбоксана А2, которые способствуют повышению проницаемости эндотелия [22, 23].
При легочной тромбоэмболии на фоне активации N-холинорецепторов цитизином в сочетании с применением фентоламина и атропина давление в легочной артерии возрастало меньше, чем в группе сравнения и в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов.
Как отмечено выше, в ответ на эмболизацию легочной артерии в условиях применения цитизина в сочетании с фентоламином и атропином капиллярное гидростатическое давление и посткапиллярное сопротивление возрастали. Однако коэффициент капиллярной фильтрации увеличивался на 33 ± 8% (p < 0.01), т.е. практически в 2 раза меньше, чем при легочной тромбоэмболии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов (табл. 3). Из данных этих опытов следует, что активация N-холинорецепторов эндотелия может способствовать снижению проницаемости легочных сосудов при указанной патологии.
В литературе представлены сведения об участии N-холинорецепторов в регуляции проницаемости эндотелия коронарных и мозговых сосудов [24–26]. Так, в работе [25] показано, что активация указанных рецепторов способствует увеличению проницаемости эндотелия, а в работе [26] – напротив, – уменьшению, т.е. данные литературы являются противоречивыми. В исследовании [27] установлено, что активация N-холинорецепторов эндотелия легочных сосудов снижает его проницаемость в условиях реперфузионного повреждения тонкой кишки.
Вместе с тем, наряду с проницаемостью эндотелия, сдвиги коэффициента капиллярной фильтрации определяются рядом показателей: величиной капиллярного гидростатического давления, количеством функционирующих капилляров, а также соотношением прекапиллярного сопротивления к посткапиллярному. Нами поэтому был проведен корреляционный анализ взаимосвязи между сдвигами соотношения пре- к посткапиллярному сопротивлению и коэффициента капиллярной фильтрации при всех указанных воздействиях (табл. 2 и 3), результаты которого представлены на рис. 1.
Рис. 1.
Зависимость изменений коэффициента капиллярной фильтрации от сдвигов соотношения пре- к посткапиллярному сопротивлению при блокаде и активации M- и N-холинорецепторов, а также легочной тромбоэмболии в группе сравнения и на фоне блокады или активации холинергических механизмов.
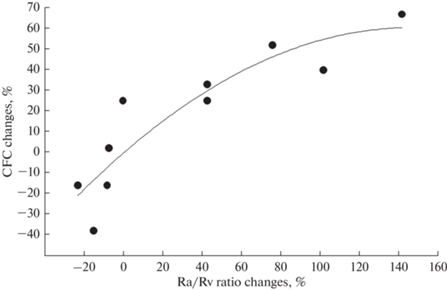
Проведенный анализ выявил высокую степень зависимости (коэффициент корреляции 0.88 ± 0.01) между изменениями соотношения пре- к посткапиллярному сопротивлению и коэффициента капиллярной фильтрации. Поэтому можно было полагать, что сдвиги этого соотношения являются определяющими в изменениях указанного показателя. Так, при тромбоэмболии легочной артерии на фоне инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов соотношение пре- к посткапиллярному сопротивлению возрастало на 142 ± 16% (p < 0.01), а коэффициент капиллярной фильтрации – на 67 ± 12% (p < 0.01). В случае же эмболизации легочной артерии в условиях применения цитизина на фоне блокады альфа-адренорецепторов и М-холинорецепторов указанные показатели возрастали соответственно на 43 ± 14% (p < 0.01) и 33 ± 8% (p < 0.01), т.е. в меньшей степени и практически так же как в контроле (табл. 3). Однако сопоставление данных этих опытов с ранее проведенными экспериментами, в которых тромбоэмболия моделировалась на фоне только блокады альфа-адренорецепторов фентоламином [18], показало, что в последнем случае соотношение пре- к посткапиллярному сопротивлению возрастало на 44 ± 10%, а коэффициент капиллярной фильтрации – на 50 ± 12%, т.е. в большей степени, чем при тромбоэмболии легочной артерии в условиях применения цитизина на фоне блокады альфа-адренорецепторов и М‑холинорецепторов (33 ± 8%). Таким образом, при равных сдвигах соотношения пре- к посткапиллярному сопротивлению в обоих случаях при тромбоэмболии легочной артерии в условиях применения цитизина на фоне блокады альфа-адренорецепторов и М-холинорецепторов коэффициент капиллярной фильтрации возрастал меньше, чем при легочной тромбоэмболии после блокады только альфа-адренорецепторов. Эти данные позволяют полагать, что активация N-холинорецепторов эндотелия легочных сосудов приводит к снижению проницаемости сосудов легких. Следовательно, существует реципрокный характер взаимодействия M- и N-холинергических механизмов регуляции проницаемости легочных сосудов: активация М-холинорецепторов способствует повышению коэффициента капиллярной фильтрации, тогда как активация N-холинорецепторов – его уменьшению.
Итак, результаты проведенных экспериментов показали, что при тромбоэмболии легочной артерии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов пирензепином прирост давления в легочной артерии был близок к таковому у животных в группе сравнения. Вместе с тем, капиллярное гидростатическое давление и посткапиллярное сопротивление не изменялись, что свидетельствует об уменьшении симпатических констрикторных влияний преимущественно на легочные венозные сосуды. При этом коэффициент капиллярной фильтрации возрастал в большей степени, чем у кроликов в группе сравнения, что можно объяснить повышением проницаемости эндотелия сосудов легких.
В ответ на указанное воздействие в условиях инфузии N-миметика цитизина в сочетании с блокадой альфа-адренорецепторов фентоламином и М-холинорецепторов атропином прирост давления в легочной артерии и прекапиллярного сопротивления был менее выражен, чем при инфузии ацетилхолина на фоне блокады М1-холинорецепторов и в группе сравнения. Это свидетельствует о преимущественном дилататорном влиянии активации N-холинорецепторов эндотелия на легочные артериальные сосуды. В указанных условиях капиллярное гидростатическое давление и посткапиллярное сопротивление возрастали, однако коэффициент капиллярной фильтрации увеличивался в меньшей степени, чем при тромбоэмболии легочной артерии в условиях инфузии ацетилхолина в сочетании с блокадой М1-холинорецепторов. Следовательно, реципрокный характер взаимодействия M- и N-холинергических механизмов проявляется не только в регуляции тонуса сосудов легких, но и проницаемости эндотелия: активация М-холинорецепторов эндотелия в условиях легочной тромбоэмболии способствует увеличению коэффициента капиллярной фильтрации, тогда как активация N-холинорецепторов – его уменьшению.
Список литературы
Aubry A, Paternot A, Vieillard-Baron A (2020) Cor pulmonale. Rev Mal Respir 37: 257–266. https://doi.org/10.1016/j.rmr.2019.10.012
Kline JA, Puskarich MA, Jones AE, Mastouri RA, Hall CL, Perkins A, Gundert EE, Lahm T (2019) Inhaled nitric oxide to treat intermediate risk pulmonary embolism: A multicenter randomized controlled trial. Nitric Oxide 84: 60–68. https://doi.org/10.1016/j.niox.2019.01.006
Zhao S, Friedman O (2020) Management of Right Ventricular Failure in Pulmonary Embolism. Crit Care Clin 36: 505–515. https://doi.org/10.1016/j.ccc.2020.02.006
Evlakhov VI, Berezina TP, Poyassov IZ, Ovsyannikov VI (2021) Pulmonary Microcirculation during Experimental Pulmonary Thromboembolism under Conditions of Activation and Blockade of Muscarinic Acetylcholine Receptors. Bull Exp Biol Med 171: 198–201. https://doi.org/10.1007/s10517-021-05194-4
Zou Q, Leung SW, Vanhoutte PM (2012) Activation of nicotinic receptors can contribute to endothelium-dependent relaxations to acetylcholine in the rat aorta. J Pharmacol Exp Ther 341: 756–763. https://doi.org/10.1124/jpet.112.192229
Fujii N, McGarr GW, Ghassa R, Schmidt MD, McCormick JJ, Nishiyasu T, Kenny GP (2020) Sex-differences in cholinergic, nicotinic, and β-adrenergic cutaneous vasodilation: Roles of nitric oxide synthase, cyclooxygenase, and K+ channels. Microvasc Res 131: 104030. https://doi.org/10.1016/j.mvr.2020.104030
Cooke JP, Ghebremariam YT (2008) Endothelial nicotinic acetylcholine receptors and angiogenesis. Trends Cardiovasc Med 18: 247–253. https://doi.org/10.1016/j.tcm.2008.11.007
Wessler I, Kirkpatrick CJ (2008) Acetylcholine beyond neurons: the non-neuronal cholinergic system in humans. Br J Pharmacol 154: 1558–1571. https://doi.org/10.1038/bjp.2008.185
Zoli M, Pucci S, Vilella A, Gotti C (2018) Neuronal and Extraneuronal Nicotinic Acetylcholine Receptors. Curr Neuropharmacol 16: 338–349. https://doi.org/10.2174/1570159X15666170912110450
Евлахов ВИ, Поясов ИЗ, Шайдаков ЕВ (2017) Роль реакций венозных сосудов легких в изменениях легочной гемодинамики при экспериментальной тромбоэмболии легочной артерии. Рос физиол журн им ИМ Сеченова 103: 778–788. [Evlakhov VI, Poyassov IZ, Shaidakov EV The role of venous vessels recations in the pulmonary hemodynamics changes following experimental pulmonary embolism. Russ J Physiol 103: 778–788. (In Russ)].
Машковский МД (2012) Лекарственные средства. 16-е изд. М. Новая волна. [Mashkovsky MD (2012) The medical drugs. 16-th ed. M. New Wave. (In Russ)].
Chen LY, Cheng CW, Liang JY (2015) Effect of esterification condensation on the Folin-Ciocalteu method for the quantitative measurement of total phenols. Food Chem 170: 10–15. https://doi.org/10.1016/j.foodchem.2014.08.038
Saternos HC, Almarghalani DA, Gibson HM, Meqdad MA, Antypas RB, Lingireddy A, AbouAlaiwi WA (2018) Distribution and function of the muscarinic receptor subtypes in the cardiovascular system. Physiol Genomics 50: 1–9. https://doi.org/10.1152/physiolgenomics.00062.2017
Лосев НА, Евлахов ВИ, Шалковская ЛН (2011) Реципрокный характер взаимодействия мускариновых и никотиновых холинергических механизмов в регуляции системной гемодинамики. Мед академ журн 11: 236–248. [Losev NA, Evlakhov VI, Shalkovskaya LN (2011) The reciprocal character of the muscarinic and nicotinic cholinergic mechanisms interaction in the systemic hemodynamics regulation. Med Acad J 11: 236–248. (In Russ)].
Евлахов ВИ, Поясов ИЗ, Березина ТП (2020) Особенности изменений макро- и микрогемодинамики легких в условиях применения агонистов и блокаторов холинорецепторов. Мед акад журн 20: 35–44. [Evlakhov VI, Poyassov IZ, Berezina TP (2020) The peculiarities of pulmonary macro- and microhemodynamics chahges after treatment with agonists and blockers of cholinoceptors. Med Acad J 20: 35–44. (In Russ)]. https://doi.org/10.17816/MAJ55326
Ding X, Murray PA (2005) Regulation of pulmonary venous tone in response to muscarinic receptor activation. Am J Physiol Lung Cell Mol Physiol 288: L131–L140. https://doi.org/10.1152/ajplung.00230.2004
Orii R, Sugawara Y, Sawamura S, Yamada Y (2010) M3-muscarinic receptors mediate acetylcholine-induced pulmonary vasodilation in pulmonary hypertension. BioScience Trends 2010 4: 260–266. https://www.biosciencetrends.com
Evlakhov VI, Poyassov IZ, Ovsyannikov VI (2019) Pulmonary Microcirculation in Experimental Model of Pulmonary Thromboembolism under Conditions of α-Adrenoceptor Blockade. Bull Exp Biol Med 166: 313–316. https://doi.org/10.1007/s10517-019-04340-3
Noguchi M, Furukawa KT, Morimoto M (2020) Pulmonary neuroendocrine cells: physiology, tissue homeostasis and disease. Dis Model Mech 13: dmm046920. https://doi.org/10.1242/dmm.046920
Kiyokawa H, Morimoto M (2020) Notch signaling in the mammalian respiratory system, specifically the trachea and lungs, in development, homeostasis, regeneration, and disease. Dev Growth Differ 62: 67–79. https://doi.org https://doi.org/10.1111/dgd.12628
Schmeck J., Konrad C., Schöffel S., Wendel-Wellner M., Gluth H., Koch T., Krafft P. (2000) Interaction of acetylcholine and endothelin-1 in the modulation of pulmonary arterial pressure. Crit Care Med 28: 3869–3875. https://doi.org/10.1097/00003246-200012000-00022
Maniatis NA, Kotanidou A, Catravas JD, Orfanos SE (2008) Endothelial pathomechanisms in acute lung injury. Vascul Pharmacol 49: 119–133. https://doi.org/10.1016/j.vph.2008.06.009
Rimoldi SF, Yuzefpolskaya M, Allemann Y, Messerli F (2009) Flash pulmonary edema. Prog Cardiovasc Dis 52: 249–259. https://doi.org/10.1016/j.pcad.2009.10.002
Moccia F, Frost C, Berra-Romani R,Tanzi F, Adams DJ (2004) Expression and function of neuronal nicotinic ACh receptors in rat microvascular endothelial cells. Am J Physiol Heart Circ Physiol 286: H486–H491. https://doi.org/10.1152/ajpheart.00620.2003
Hawkins BT, Egleton RD, Davis TP (2005) Modulation of cerebral microvascular per Meability by endothelial nicotinic acetylcholine receptors. Am J Physiol Heart Circ Physiol 289: H212–H219. https://doi.org/10.1152/ajpheart.01210.2004
Kimura I, Dohgu S, Takata F, Matsumoto J, Kawahara Y, Nishihira M, Sakada S, Saisho T, Yamauchi A, Kataoka Y (2019) Activation of the α7 nicotinic acetylcholine receptor upregulates blood-brain barrier function through increased claudin-5 and occludin expression in rat brain endothelial cells. Neurosci Lett 694: 9–13. https://doi.org/10.1016/j.neulet.2018.11.022
He Y, Ye ZQ, Li X, Zhu GS, Liu Y, Yao WF, Luo GJ (2016) Alpha7 nicotinic acetylcholine receptor activation attenuated intestine-derived acute lung injury. J Surg Res 201: 258–265. https://doi.org/10.1016/j.jss.2015.10.046
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


