Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 222-234
Исследование экспрессии рецепторов к ИЛ-4, генов ИЛ-4R и роли ИЛ-4 в сокращении бронхов крыс с овальбумин-индуцированной бронхиальной астмой
О. Е. Смирнова 1, *, Л. Е. Блажевич 1, В. М. Кирилина 1
1 Петрозаводский государственный университет
Петрозаводск, Республика Карелия, Россия
* E-mail: smmirnova.olga@yandex.ru
Поступила в редакцию 15.09.2021
После доработки 14.12.2021
Принята к публикации 21.12.2021
- EDN: VKTIBT
- DOI: 10.31857/S086981392202008X
Аннотация
ИЛ-4 играет одну из ключевых ролей в патогенезе бронхиальной астмы. Однако мало изученной остается роль ИЛ-4 и рецепторов ИЛ-4R в патогенезе бронхиальной астмы в участках респираторного тракта с ганглиями и без них. Целью данного исследования являлось изучение уровня экспрессии рецепторов ИЛ-4R, степени экспрессии генов ИЛ-4R в бронхах крыс с овальбумин-индуцированной бронхиальной астмой и роли ИЛ-4 в сокращении гладкой мышцы бронхов с интрамуральными ганглиями и без них. Всего было исследовано 22 крысы линии Вистар. Были сформированы две группы животных – контрольная и экспериментальная (крысы с овальбумин-индуцированной астмой). На препаратах бронхов крыс были проведены молекулярно-генетические, иммуногистохимические и механографические исследования. Установлено, что у крыс с овальбумин-индуцированной бронхиальной астмой по сравнению с контрольными животными значительно увеличивается экспрессия генов ИЛ-4R и экспрессия рецептора ИЛ-4R в тканях бронхов. В препаратах бронхов с ганглиями генная и молекулярная экспрессия была более выражена по сравнению с препаратами бронхов без ганглиев. ИЛ-4 вызывал увеличение сократительных ответов мышцы бронхов. В препаратах бронхов с ганглиями сократительные ответы были выше, чем в препаратах без ганглиев.
ИЛ-4 – провоспалительный цитокин, участвующий в патогенезе бронхиальной астмы. Che Xiao-wen и др. в своих исследованиях установили, что ИЛ-4 способен вызывать гиперреактивность респираторных путей у людей больных бронхиальной астмой, поэтому для того, чтобы предотвратить это – требуется блокирование синтеза ИЛ-4 [1].
Содержание ИЛ-4 в крови и лаважной жидкости значительно увеличивается у пациентов с бронхиальной астмой по сравнению с группой здоровых добровольцев [2].
IL-4 координирует иммунный ответ Th2-типа при воспалительной реакции, проявляющейся при бронхиальной астме [3]. IL-4 имеет решающее значение не только для контроля выработки иммуноглобулинов, но также связан с воспалением, фиброзом, аллергическими реакциями и противоопухолевой активностью [4]. ИЛ-4 способствует увеличению выработки IgE. IgE, взаимодействуя с Fcε рецепторами лаброцитов, активирует их, вследствии чего происходит выброс провоспалительных медиаторов (гистамина, лейкотриенов, простагландинов и цитокинов). В дальнейшем это приводит к развитию выраженного констрикторного эффекта в нижних дыхательных путях [6].
Чучалин, на основании проведенных экспериментов, называет ИЛ-4 “терапевтической мишенью” для моноклональных антител при лечении бронхоконстрикторных заболеваний респираторного тракта. При подавлении ИЛ-4 моноклональными антителами происходит снижение уровня IgE в сыворотке крови и уменьшение бронхо-констрикторного эффекта [7]. У ранее сенсибилизированных крыс наблюдалось достоверное увеличение экспрессии ИЛ-4 при повторном взаимодействии с овальбумином [8–10].
Влияние ИЛ-4 на генную экспрессию происходит с помощью транскрипционного фактора STAT6 (Signal transducer and activator of transcription) [10, 12–14]. STAT6 фосфорилируется по остатку Tyr641, димеризуется в цитоплазме и транслоцируется в ядро [14, 15].
Действие IL-4 осуществляется через два типа рецепторов, один из которых также используется IL-13 [4]. ИЛ-4R первого типа представляет собой структуру, состоящую из α-цепи (ИЛ-4Rα) и γ-цепи. Этот рецептор располагается на поверхности иммунных клеток. ИЛ-4R второго типа включает в свой состав 2 субъединицы – ИЛ-4Rα и ИЛ-13Rα1. Этот тип рецептора экспрессируется некроветворными клетками и обладает возможностью связывать как ИЛ-4, так и ИЛ-13 [16, 17]. По данным Deimel, Li и Charani экспрессия IL-4Rα зависит от концентрации ИЛ-4 [5].
Рецептор ИЛ-4 представляет собой гетеродимерный комплекс с цепью ИЛ‑4Rα [11], который существует как в мембраносвязанной, так и в растворимой форме [10, 12–14].
Рецепторы к ИЛ-4 играют одну из ключевых ролей в патогенезе астмы. Установлена связь этого заболевания с полиморфизмом генов рецепторов ИЛ-4 [20]. Блокаторы рецептов к ИЛ-4 приводят к уменьшению обострения бронхиальной астмы у пациентов и к улучшению функций внешнего дыхания [18].
При астме сигнальные пути, связанные с ИЛ-4Rα, опосредуют воспаление дыхательных путей, ремоделирование и гиперреактивность, гиперсекрецию слизи, повышение IgE и субэпителиальный фиброз в дыхательных путях. Лечение мышей нейтрализующими антителами к ИЛ-4Rα предотвращало развитие фенотипа астмы [6, 19].
Таким образом, ИЛ-4 и ИЛ-4R могут быть рассмотрены как факторы, играющие значительную роль в сенсибилизации и патогенезе бронхиальной астмы. С учетом того, что большинство работ, посвященных цитокину ИЛ-4, позволяют оценить его роль в реакции воспаления при бронхиальной астме, исследования непосредственного влияния ИЛ-4 на бронхоконстрикцию в условиях нормы и в условиях сенсибилизации могут быть особенно актуальны. Также интересным является проведение сравнительного исследования, выявляющего уровень экспрессии гена к ИЛ-4R и уровень экспрессии рецептора ИЛ-4R в норме и патологии. Особую значимость представляет сравнение этих процессов в препаратах бронхов с ганглием и без ганглия. Такие исследования проводятся впервые и могут иметь большое значение в раскрытии механизмов патогенеза астмы, поскольку присутствие интрамурального метасимпатического ганглия может оказывать влияние на уровень экспрессии рецепторов. Также большое значение в экспериментах на изолированных препаратах имеет электрическая стимуляция постганглионарных нервов, что максимально приближает исследуемую систему к естественным физиологическим условиям. Поэтому целью настоящего исследования являлось изучение уровня экспрессии гена ИЛ-4 (кодирующего α-субъединицу), уровня экспрессии ИЛ-4 и влияния цитокина ИЛ-4 на сокращение гладкой мышцы бронхов крысы с применением электрической стимуляции постганглионарных нервов в условиях физиологической нормы и экспериментальной модели бронхиальной астмы.
В данной статье рассматривается влияние ИЛ-4 на сокращение мышцы бронхов крысы, демонстрируются результаты исследований уровней экспрессии гена ИЛ-4R и уровней экспрессии ИЛ-4R в бронхах контрольных крыс и крыс с овальбумин-индуцированной бронхиальной астмой.
МЕТОДЫ ИССЛЕДОВАНИЯ
Оборудование
В экспериментах использовался физиологический комплекс, поддерживающий нормальное протекание физиологических процессов в изолированных препаратах. Комплекс включал в себя специальные камеры для помещения в них препаратов бронхов, ультратермостат, аэратор, насос перистальтический (ML0146/C-V, Multi Chamber Organ Baths, Panlab, Германия), электромеханические датчики (Grass FT-03 force displacement transducer, Astro Med, West Warwick, RI, США), электростимулятор (direct-current stimulator, Grass S44, Quincy, MA, США), персональный компьютер, специальное программное обеспечение (Chart v 4.2 software, Power Lab, AD Instruments, Colorado Springs, CO, США).
Процедура с животными
Было обследовано 22 животных (самцы и самки крыс линии Вистар). Респираторная мышца самцов и самок давала одинаковые сократительные ответы на электрические стимулы (р < 0.05 – заключение сделано на ранее проведенных экспериментах на фоне физиологического раствора). Виварий, где содержались животные, соответствовал требованиям СП 2.2.1.3218-14. С целью получения образцов респираторного тракта производилась декапитация. Общую анестезию проводили при помощи инъекций золетила (Virbac S.A., Франция, 20 мг/кг, внутримышечно). Такой подход обеспечивал быструю эвтаназию животного (удовлетворяющий рекомендациям по эвтаназии экспериментальных животных, Европейской комиссии, Приказу Минздрава РФ от 01.04.16 г. № 199н) [21]. Далее животное закреплялось на столе для вскрытия. После этого вскрывали грудную клетку и затем производили операцию с извлечением дыхательных путей животного. Паренхиматозную ткань легких удаляли механически деревянным шпателем [22]. Далее готовили препараты бронхов длиной 0.4–0.6 см и шириной 0.5–0.7 см. Образцы с ганглиями брались из зон бифуркаций, а образцы без ганглиев – из прямых участков бронхов.
Схема эксперимента
Были сформированы две группы животных: контрольная группа n = 11 (получала физиологический раствор) и экспериментальная группа n = 11 с овальбумин-индуцированной бронхиальной астмой. В исследуемых группах от каждого животного брали биологический материал для препаратов (правый бронх с ганглием, правый бронх без ганглия, левый бронх с ганглием, левый бронх без ганглия). Далее проводились оценка сокращения мышцы бронхов, уровень экспрессии гена ИЛ-4R и уровень экспрессии рецепторов к ИЛ-4 в препаратах бронхов контрольной и экспериментальной групп. В экспериментах учтены принципы Базельской декларации и рекомендациями Европейской комиссии по эвтаназии экспериментальных животных.
Экспериментальная модель бронхиальной астмы
В исследовании была применена модифицированная методика Masakazu и соавт. [26], прошедшая верификацию в ранее проведенных экспериментах на крысах. Крысы были сенсибилизированы введением овальбумина (Sigma-Aldrich, Германия). Для одноразовой процедуры сенсибилизации 0.5 мг овальбумина растворяли в 1 мл физиологического раствора. Далее раствор овальбумина вводили подкожно по 0.1 мл в шею, спину, обе ступни, пах и 0.5 мл раствора овальбумина дополнительно вводили внутрибрюшинно (общий объем раствора овальбумина вводимого одному животному равнялся 1 мл). Процедуру сенсибилизации инъекциями овальбумина проводили на 1-й, 14-й и 21-й день.
Параллельно с инъекциями раствора овальбумина проводили ингаляцию овальбумином при помощи небулайзера на 14-й, 16-й, 18-й, 21-й и 24-й дни. Для этого крыс помещали в экспозиционную камеру, подключенную к небулайзеру (Omron, NE C29-E, Япония). Овальбумин в количестве 1 г растворяли в 100 мл физиологического раствора. Раствор овальбумина распыляли в течение 30 мин с выходом 3 мл/мин и со средним размером частиц 3.2 мкм. Последняя ингаляция раствором овальбумина проводилась за 72 ч до эвтаназии животных. Несенсибилизированной группе вводили физиологический раствор внутрибрюшинно в качестве контроля.
Верификация применяемой в исследовании модели бронхиальной астмы с моделью астмы Masakazu и соавт. [23]
Предложенная в данной работе методика формирования астмы у крыс проходила верификацию в ранее проведенных сериях экспериментов на 90 животных (30 контрольных крыс (1-я группа), 30 крыс с астмой по методике модели Masakazu и соавт. [23] (2-я группа) и 30 крыс с астмой по методике, предложенной в данном исследовании (3-я группа). Готовились гистологические препараты респираторного тракта и окрашивались толуидиновым синим (окраска мастоцитов), эозином (окраска эозинофилов), альциановым синим (окраска гликопротеидов слизи). Количество клеток и площадь слизи в бронхах оценивали при помощи программы ImageJ. Оценивались такие ключевые критерии развития астмы, как показатели количества эозинофилов, количества тучных клеток в перибронхиальном пространстве, показатели количества слизи в малых бронхах, показатели количества тучных клеток в лаважной жидкости у крыс. Обозначенные показатели возрастали у крыс с астмой в группах № 2 и № 3 и достоверно (р < 0.05) отличались от контроля, что говорит о развитии астмы у животных. Достоверных различий в указанных показателях между группами № 2 и № 3 не было, что свидетельствует о равнозначной эффективности этих методик в выработке астмы у крыс.
Проведение механографического исследования
Проводилась электростимуляция препаратов бронхов электрическим полем. Далее регистрировались сократительные реакции мышц. Эти ответы были приняты за базовый уровень (или 100%). После этого добавляли раствор ИЛ-4 и регистрировали сократительные реакции мышц. Таким образом, регистрировались реакции бронхиальной мускулатуры с учетом электростимуляции и влияния ИЛ-4. Методы электростимуляции постганглионарных нервов взяты из методов исследования, предложенных Фединым [24].
Статистический анализ
Сравнение между группами контрольных и экспериментальных результатов проводили с использованием независимых t-тестов Стьюдента (t-критерий Стьюдента). Значение р < 0.05 считалось статистически значимым. Данные были выражены в виде среднего значения, стандартного отклонения (использовалась SPSS Inc., Chicago, Illinois, США).
Фармакологическая процедура
Приток свежего раствора Кребса–Хензелайта обеспечивался регулярно, как и отток использованного [24]. В ходе экспериментов экзогенно в камеры с препаратами вводили ИЛ-4 (Sigma-Aldrich, США). Концентрация фармакологического вещества была подобрана в лаборатории при проведении предварительных опытов, в которых физиологический эффект действия препарата был наиболее выражен. ИЛ-4 поступал в камеры с препаратами при помощи перфузии в течение 120 мин, в концентрации 150 нг/мл, после чего производилась регистрация сократительной активности.
Молекулярно-генетические методы
Для определения уровня транскриптов генов были использованы образцы тканей бронхов с ганглием и бронхов без ганглия. Выделение тотальной РНК осуществляли с помощью PureZOLTM RNA Isolation Reagent (Bio-Rad, США). После центрифугирования (время 15 мин, при температуре 4°С, 14.000 g) осадок тотРНК промывали 80%-ным раствором этанола и снова центрифугировали (время 8 мин, при температуре 4°С, 12.000 g). Далее осадок тотальной РНК подсушивали. Количество и качество тотальной РНК определяли спектрофотометрически на приборе SmartSpecPlus (Bio-Rad, США). Далее синтезировалась первая комплементарная цепь ДНК (кДНК) при помощи набора MMLVRT kit (Евроген, Россия). Прибор LightCycler®96 (Roche, Швейцария) позволял оценить уровень экспрессии генов с помощью ПЦР в режиме реального времени. Для амплификации использовали наборы qPCRmix HS SYBR (Евроген, Россия). Протокол ПЦР был следующим: кДНК денатурировалась при 95°С в течение 5 мин на протяжении 35 циклов; далее денатурация продолжалась при 95°С в течение 15 с; после денатурации производился отжиг при 60°С в течение 15 с; последним этапом была элонгация при 72°С в течение 15 с. Программа Beacon Designer помогала конструировать праймеры для ПЦР.
Нуклеотидные последовательности и размер ПЦР-фрагментов для гена IL4R был следующим: 5' AGCTGCATTCCAGTCTCTCC 3' (exon 2) и 5' CTCACACGTAGAAGTGCGGA 3' (exon 4), 185 н. п. соответственно [25].
Иммуногистохимические методы
Для иммуногистохимических исследований с флуоресцентной меткой использовали парафиновые срезы бронхов, изготовленные по стандартной методике. Кусочки ткани после предварительной подготовки проходили дегидратацию в спиртах, далее помещались в ксилол и парафин и готовились срезы. Депарафинизацию, регидратацию и демаскировку антигенов проводили с применением раствора TrilogyTM (Cell Marque, Merck, США). Далее срезы промывались в дистиллированной воде и в фосфатно-солевом растворе (PBS). В исследовании использовались неконьюгированные первичные мышиные моноклональные антитела против рецепторов к ИЛ-4 (моноклональное антитело мыши IL4R, клон 25463, BioVitrum, США). Препараты трахей и бронхов были оставлены для реакции с первичными антителами в течение 18 ч при температуре 4°С. После этого образцы трахей и бронхов промывались в PBS и направлялись на инкубацию со вторичным антителами, конъюгированными с флуорохромом Alexa Fluor 488 (Thermo Fisher Scientific, США). Ядра всех клеток препарата окрашивались Hoechst 33342 (Invitrogen, Thermo Fisher Scientific, США). Флуоресцентный микроскоп Olympus (Япония) позволил визуализировать полученные результаты, а программа ImageJ – произвести их количественный анализ [26].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Результаты иммуногистохимических исследований
В контрольных препаратах бронхов с ганглиями 367.7 ± 112.8 клеток экспрессировали рецептор к ИЛ-4 (этот показатель составил 30.1 ± 9.2 ИЛ-4R-содержащих клеток на 100 клеток в срезе). В экспериментальных препаратах бронхов с ганглиями 1133.7 ± ± 97.2 клеток экспрессировали рецептор к ИЛ-4 (88.1 ± 7.6 ИЛ-4R-содержащих клеток на 100 клеток в срезе) (рис. 1 и 2 ). Различия в уровнях экспрессии ИЛ-4R между клетками в контрольных и экспериментальных препаратах достоверны (p = 0.02).
Рис. 1.
Фотографии, полученные с помощью светового микроскопа. Красным свечением обозначены клетки, содержащие рецептор к ИЛ-4.
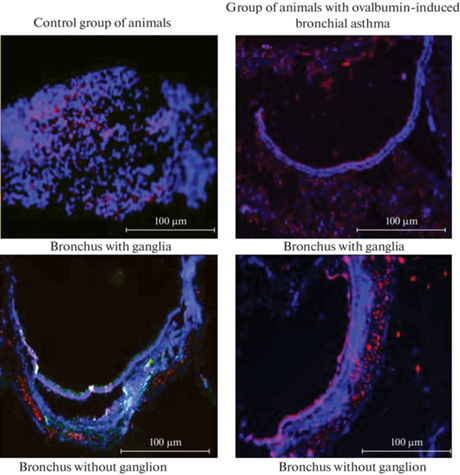
Рис. 2.
Количество клеток, содержащих рецептор к ИЛ-4. * – достоверное отличие в количестве клеток, содержащих рецептор к ИЛ-4 между контрольными и экспериментальными препаратами. ^ – достоверное отличие в количестве клеток, содержащих рецептор к ИЛ-4 между экспериментальными препаратами бронхов с ганглиями и бронхов без ганглиев.
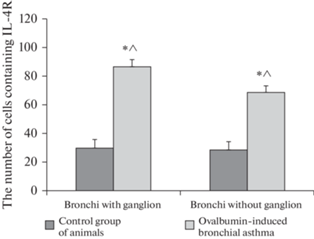
В контрольных препаратах бронхов без ганглия 345.7 ± 111.4 клеток экспрессировали рецептор к ИЛ-4 (этот показатель составил 28.3 ± 9.1 ИЛ-4R-содержащих клеток на 100 клеток в срезе). В экспериментальных препаратах бронхов без ганглия 899 ± 104.6 клеток экспрессировали рецептор к ИЛ-4 (70.2 ± 8.2 ИЛ-4R-содержащих клеток на 100 клеток в срезе) (рис. 1 и 2 ). Различия в уровнях экспрессии ИЛ-4R между клетками в контрольных и экспериментальных препаратах достоверны (p = 0.03).
Результаты молекулярно-генетических исследований
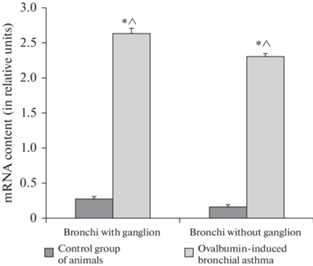
Уровень экспрессии гена ИЛ-4R в контрольных препаратах бронхов с ганглиями составил 0.3 ± 0.1 отн. ед. (принято за 100 ± 14.3%). В экспериментальных препаратах бронхов с ганглием уровень экспрессии гена ИЛ-4R возрастал до 2.6 ± 0.1 (939.3 ± 32.1% от нормы) (рис. 3 ). Различия в уровнях экспрессии гена ИЛ-4R между контрольными и экспериментальными препаратами достоверны (p = 0.001).
Уровень экспрессии гена ИЛ-4R в контрольных препаратах бронхов без ганглия составил 0.2 ± 0.1 отн. ед. (принято за 100 ± 23.5%). В экспериментальных препаратах бронхов без ганглиев уровень экспрессии гена ИЛ-4R возрастал до 2.3 ± 0.1 (750 ± 26% от нормы) (рис. 3 ). Различия в уровнях экспрессии гена ИЛ-4R между контрольными и экспериментальными препаратами достоверны (p = 0.001).
Рис. 3.
Уровень экспрессии гена ИЛ-4R в препаратах бронхов контрольных крыс и крыс с овальбумин-индуцированной бронхиальной астмой. * – достоверное отличие в уровне экспрессии гена ИЛ-4R между контрольными и экспериментальными препаратами. ^ – достоверное отличие в уровне экспрессии гена ИЛ-4R между экспериментальными препаратами бронхов с ганглиями и бронхов без ганглиев.
Результаты механографических исследований
Сокращения гладкой мышцы бронхов с ганглием в условиях физиологической нормы составляли 1.5 ± 0.1 мН, что было принято за 100 ± 7.2%. Ответы гладкой мышцы бронхов с ганглием в условиях экспериментальной модели овальбумин-индуцированной бронхиальной астмы повышались до 2.9 ± 0.5 мН (200.3 ± 4.9%). Сокращения гладкой мышцы у крыс с овальбумин-индуцированной бронхиальной астмой при дополнительном поступлении в камеры с изолированными препаратами ИЛ-4 повышались до 3.3 ± 0.1 мН (225.2 ± 5.2%) (рис. 4 ). Различия между сократительными ответами мышцы бронхов в норме, патологии и на фоне аппликации ИЛ-4 достоверны (p = 0.04).
Рис. 4.
Влияние ИЛ-4 на сокращение мышцы бронхов. * – достоверное отличие в сокращениях мышцы в ответ на введение ИЛ-4 между контрольными и экспериментальными препаратами. ^ – достоверное отличие в сокращениях мышцы в ответ на введение ИЛ-4 между экспериментальными препаратами бронхов с ганглиями и бронхов без ганглиев.
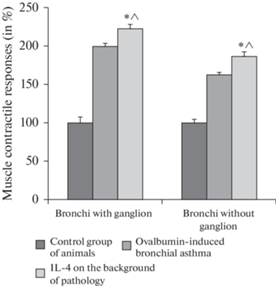
Сокращения гладкой мышцы бронхов без ганглия в условиях физиологической нормы составляли 1.3 ± 0.1 мН, что было принято за 100 ± 6.9%. Ответы гладкой мышцы бронхов без ганглия в условиях экспериментальной модели овальбумин-индуцированной бронхиальной астмы повышались до 2.1 ± 0.1 мН (162.2 ± 5.2%). Сокращения гладкой мышцы у крыс с овальбумин-индуцированной бронхиальной астмой при дополнительном поступлении в камеры с изолированными препаратами ИЛ-4 повышались до 2.4 ± 0.1 мН (188.3 ± 5.3%) (рис. 4 ). Различия между сократительными ответами мышцы бронхов в норме, патологии и на фоне аппликации ИЛ-4 достоверны (p = 0.04).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Общее количество клеток, экспрессирующих рецептор ИЛ-4R достоверно повышалось в тканях бронхов крыс с астмой по сравнению с тканями бронхов здоровых животных. В препаратах бронхов с ганглием количество таких клеток возрастало с 30.1 ± 9.2 у контрольных животных до 88.1 ± 7.5 у крыс с овальбумин-индуцированной бронхиальной астмой. В препаратах бронхов без ганглия количество клеток, содержащих рецептор к ИЛ-4, также было выше в образцах тканей животных с астмой (70.2 ± 8.2 клеток) по сравнению с бронхами контрольных животных (28.3 ± 9.1 клеток). Таким образом, в условиях экспериментальной модели овальбумин-индуцированной бронхиальной астмы в бронхах у крыс происходит увеличение экспрессии рецептора к ИЛ-4, значительно увеличивается количество клеток, содержащих этот рецептор.
Если сравнивать между собой препараты бронхов с ганглием и препараты бронхов без ганглия, то у крыс с овальбумин-индуцированной бронхиальной астмой обнаруживается достоверное различие по числу клеток, экспрессирующих ИЛ-4R. В образцах бронхов с ганглием число таких клеток было выше, чем в образцах без ганглия (88.1 ± 7.6 клеток в срезе бронхов с ганглием и 70.2 ± 8.2 клеток в срезе бронхов без ганглия). У контрольных животных разницы в количестве ИЛ-4R-содержащих клеток не было. Можно предположить, что нейроны интрамурального ганглия способствуют повышению экспрессии рецептора в условиях патологии.
Уровень экспрессии гена ИЛ-4R также был значительно выше в препаратах бронхов животных с овальбумин-индуцированной бронхиальной астмой. В образцах бронхов с ганглиями количество мРНК составляло 0.3 ± 0.1 отн. ед. у контрольных животных, 2.6 ± 0.1 отн. ед. у экспериментальных животных. В препаратах бронхов без ганглиев количество мРНК составляло 0.2 ± 0.1 отн. ед. у контрольных животных и 2.3 ± 0.1 отн. ед. у экспериментальных животных. Можно заключить, что в условиях овальбумин-индуцированной бронхиальной астмы в тканях бронхов происходит увеличенная экспрессия генов, кодирующих ИЛ-4R. Также следует отметить, что уровень экспрессии гена ИЛ-4R в образцах бронхов с ганглиями выше, чем в препаратах бронхов без ганглия. Возможно, это связано с тем, что препараты с ганглиями усиливают нейрогенное воспаление, которое сопровождается атакой бронхов провоспалительными агентами, в том числе, цитокином ИЛ-4, который, как известно, сам индуцирует генную экспрессию ИЛ-4R через сигнальную молекулу STAT-6. Эти результаты находят косвенное подтверждение в работах Mikita и соавт. [14] и Schindler и соавт. [15]. Возможно, что медиаторы, продукты метаболизма нервных клеток или иные выделяемые ими сигнальные молекулы прямо или косвенно (через процессы нейрогенного воспаления) служат сигналом для начала экспрессии гена ИЛ-4R.
Исследования по влиянию ИЛ-4 на сокращения гладкой мышцы бронхов показали, что этот цитокин приводит к достоверному повышению сократительных ответов мышцы, усиливая обструктивные явления. На фоне выраженных сократительных ответов у крыс с овальбумин-индуцированной бронхиальной астмой ИЛ-4 вызывал дополнительное возрастание сократительных ответов с 2.9 ± 0.1 до 3.3 ± 0.1 мН в мышце бронхов с ганглием. Большие значения сократительных ответов мышцы бронхов с ганглием можно связать с увеличенной экспрессией в этих участках респираторного тракта рецепторов ИЛ-4R по сравнению с участками бронхов без ганглиев. Также отделы бронхов с ганглием могут отличаться повышенной сократительной активностью в связи с присутствием в этих отделах локальных интрамуральных метасимпатических рефлекторных дуг. Полученные нами данные о влиянии ИЛ-4 на сократительные ответы гладкой мышцы крысы находят косвенное подтверждение в исследованиях Xiao-wen Che [1] и Чучалина [7].
В исследованиях, проведенных Cooper, Lamb, Khaddaj-Mallat, Sirois, Willis, Siegel, Danov, Jimenez Delgado и др. установлено, что IL-4, как и IL-5, IL-17A и IL-13 усиливает сокращение дыхательных путей грызунов [27–30].
Manson и соавт. обнаружили, что IL-4 вызывает увеличение силы сокращения нижних дыхательных путей, а также, что антитела против IL4Rα и дупилумаб заметно блокируют констрикторные эффекты, индуцированные как IL-4 так и IL-13. Это предполагает, что IL4Rα опосредует эффекты IL-4 и IL-13 посредством димеризации с IL13Rα1 [31], это согласуется с результатами наших данных.
Таким образом, можно заключить, что в условиях сенсибилизации в тканях бронхов крысы происходит увеличение экспрессии генов ИЛ-4R, значительная экспрессия рецептора к ИЛ-4 и усиление констрикторного эффекта на гладкую мышцу вследствие влияния на нее цитокина ИЛ-4. В участках бронхов, содержащих интрамуральные ганглии (область бифуркации), уровень экспрессии генов ИЛ-4R, уровень экспрессии рецептора ИЛ-4R и величина сократительных ответов мышцы в ответ на введение ИЛ-4 были значительно выше, чем в образцах бронхов без ганглиев. Предполагается, что данные отличия обусловлены присутствием в этих отделах бронхов локальных интрамуральных метасимпатических рефлекторных дуг, проходящих через ганглии, и возможным влиянием нейрональных биологически активных молекул (медиаторы, сигнальные молекулы, продукты обмена или иные соединения) на интенсивность экспрессии гена ИЛ-4R.
Список литературы
Xiao-wen C, Zhang Y, Wang H, Wang W (2008) Effect of ligustrazine injection on levels of interleukin-4 and interferon-γ in patients with bronchial asthma. Chinese J Integrat Med 14: 217–220. https://doi.org/10.1007/s11655-008-0217-y
Liu XJ, Xin ZL (1996) A study on using IL-4 and IFN-gamma to regulate IgE synthesis in bronchial asthma patients in vitro. Chin J Tubercul Respir Dis 19: 186–189. https://pubmed.ncbi.nlm.nih.gov/9596842
Pereira ABM, de Oliveira JR, Teixeira MM, da Silva PR, Rodrigues Junior V, Rogerio AP (2021) IL-27 regulates IL-4-induced chemokine production in human bronchial epithelial cells. Immunobiology 226(1): 152029. https://doi.org/10.1016/j.imbio.2020.152029
Keegan AD, Leonard WJ, Zhu J (2021) Recent advances in understanding the role of IL-4 signaling. Fac Rev 7.10: 71. https://doi.org/10.12703/r/10-71
Deimel LP, Li Z, Roy S, Ranasinghe C (2021) STAT3 determines IL-4 signalling outcomes in naïve T cells. Sci Rep11(1): 10495. https://doi.org/10.1038/s41598-021-89860-7
Yuchen F, Shengchong C, Chenli C, Wenliang W, Dian C, Jiali G, Gongqi C, Lingling Y, Guohua Z (2020) CDH26 amplifies airway epithelial IL-4 receptor α signaling in asthma. MedRxiv preprint 2: 1–37. https://doi.org/10.1101/2020.12.01.20241752
Чучалин АГ (2011) Бронхиальная астма: новые перспективы в терапии. Казанск мед журн 92: 676–684. [Chuchalin AG (2011) Bronchial asthma: new perspectives in therapia. Kazan Med J 92: 676–684. (In Russ)]. https://doi.org/10.18093/0869-0189-2011-0-4-5-12
Ahmadi M (2018) Bone marrow mesenchymal stem cells modified pathological changes and immunological responses in ovalbumin-induced asthmatic rats possibly by the modulation of miRNA155 and miRNA133. Gen Physiol Biophys J 37: 263–274. https://doi.org/10.4149/gpb_2017052
Guo HW (2014) Mangiferin attenuates Th1/Th2 cytokine imbalance in an ovalbumin-induced asthmatic mouse model. PLoS J 9: 78–94. https://doi.org/10.1371/journal.pone.0100394
Ahmadi M (2018) Monitoring IL-13 expression in relation to miRNA-155 and miRNA-133 changes following intra-tracheal administration of mesenchymal stem cells and conditioned media in ovalbumin-sensitized rats. Thai Vet Med J 48: 347–355. https://he01.tci-thaijo.org/index.php/tjvm/article/view/146545
Luzina IG, Keegan AD, Heller NM, Rook GA, Shea-Donohue T, Atamas SP (2012) Regulation of inflammation by interleukin-4: a review of “alternatives”. J Leukocyte Biol 92: 753–764. https://doi.org/10.1189/jlb.0412214
Лысян НИ, Маркова ОВ (2004) Применение интерлейкина-4 и его генов для биотерапии злокачественных глиом головного мозга. Укр нейрохирург журн 1: 20–25. [Lysyan NI, Markova O.V. (2004) The use of interleukin-4 and its genes for biotherapy of malignant brain gliomas. Ukr Neurohirurg J 1: 20–25. (In Russ)]. http://theunj.org/article/view/137787
Hershey GK (2003) IL-13 receptors and signaling pathways : An evolving web. J Allergy Clin Immunol 111: 677–690. https://doi.org/10.1067/mai.2003.1333
Mikita T, Campbell D, Wu P, Williamson K, Schindler U (1996) Requirements for interleukin-4-induced gene expression and functional characterization of Stat6. Mol Cell Biol 16: 11–20. https://doi.org/10.1128/MCB.16.10.5811
Schindler U, Wu P, Rothe M, Brasseur M, McKnight SL (1995) Components of a Stat recognition code: evidence for two layers of molecular selectivity. Immunity J 6: 689–697. https://doi.org/10.1016/1074-7613(95)90013-6
McCormick SM, Heller NM (2015) Commentary: IL-4 and IL-13 receptors and signaling. Cytokine J 75: 38‒50. https://doi.org/10.1016/j.cyto.2015.05.023
May RD, Fung M (2015) Strategies targeting the IL-4/ IL-13 axes in disease. Cytokine J 75: 89–116. https://doi.org/10.1016/j.cyto.2015.05.018
Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, Wang L, Kirkesseli S, Rocklin R, Bock B, Hamilton J, Ming JE, Radin A, Stahl N, Yancopoulos GD, Graham N, Pirozzi G (2013) Dupilumab in persistent asthma with elevated eosinophil levels. N Engl Med J 368: 2455–2466. https://doi.org/10.1056/NEJMoa1304048
Wei Q, Sha Y, Bhattacharya A, Fattah EA, Bonilla D, Jyothula SS, Pandit L, Hershey KK, Eissa NT (2014) Regulation of IL-4 receptor signaling by STUB1 in lung inflammation. Am J Resp Crit Care Med 189: 16‒29. https://doi.org/10.1164/rccm.201305-0874OC
Фрейдин МБ, Брагина ЕЮ, Огородова ЛМ, Пузырев ВП (2006) Генетика атопии: Современное состояние. Вавиловский журн генетики и селекции 3:492–503. [Freidin MB, Bragina EY, Ogorodova LM, Puzyrev VP (2006) Genetics of atopy: Current state. Vavilov J Genet and Breeding 3: 492–503. (In Russ)].
Close B, Banister K, Baumans V, Warwick C (1997) Recommendations for euthanasia of experimental animals. DGXT of the Eur Commission. Lab Animals J 31: 1–32. https://doi.org/10.1258/002367797780600297
Hatziefthimiou A, Karetsi E, Pratzoudis E, Gourgoulianis K, Molyydas P (2005) Resting tension on airway smooth muscle: the involvement of epithelium. Respir Physiol Neurobiol J 145: 201–208. https://doi.org/10.1016/j.resp.2004.06.004
Masakazu Y, Osamu S, Kenji N, Tetsuji M, Koji S (2006) Propofol Attenuates Ovalbumin-Induced Smooth Muscle Contraction of the Sensitized Rat Trachea: Inhibition of Serotonergic and Cholinergic Signaling. Anesthesia & Analgesia J 3: 594–600. https://doi.org/10.1213/01.ane.0000229853.01875.60
Федин АН, Алиева ЕВ, Ноздрачев АД (1997) Реакции гладкой мышцы трахеи на гистамин. Рос физиол журн им ИМ Сеченова 83: 102–108. [Fedin AN, Alieva EV, Nozdrachev AD (1997) Reactions of the smooth muscle of the trachea to histamine. Russ J Physiol 83: 102–108. (In Russ)].
Yilmaz A, Onen H, Alp E, Menevse S (2012) Real-Time PCR for Gene Expression Analysis. Polymerase Chain React J 12: 229–254. https://doi.org/10.5772/37356
Masuda N, Mantani Y, Yoshitomi C, Yuasa H, Nishida M, Aral M, Kawano J, Yokoyama T, Hoshi N, Kitagawa H (2018) Immunohistochemical study on the secretory host defense system with lysozyme and secretory phospholipase A2 throughout rat respiratory tract. J Vet Med Sci 80: 323–332. https://doi.org/10.1292/jvms.17-0503
Cooper PR, Lamb R, Day ND, Branigan PJ, Kajekar R, San Mateo L (2009) TLR3 activation stimulates cytokine secretion without altering agonist-induced human small airway contraction or relaxation. Am J Physiol Lung Cell Mol Physiol 297: L530–L537. https://doi.org/10.1152/ajplung.00133.2009
Khaddaj-Mallat R, Sirois C, Sirois M, Rizcallah E, Morin C, Rousseau E (2015) Reversal of IL-13-induced inflammation and Ca(2+) sensitivity by resolvin and MAG-DHA in association with ASA in human bronchi. Prostaglandins Other Lipid Mediat 121: 145–154. https://doi.org/10.1016/j.prostaglandins.2015.04.005
Willis CR, Siegel L, Leith A, Mohn D, Escobar S, Wannberg S, et al. (2015) IL-17RA Signaling in Airway Inflammation and Bronchial Hyperreactivity in Allergic Asthma. Am J Respir Cell Mol Biol 53: 810–821. https://doi.org/10.1165/rcmb.2015-0038OC
Danov O, Jimenez Delgado SM, Obernolte H, Seehase S, Dehmel S, Braubach P, et al. (2018) Human lung tissue provides highly relevant data about efficacy of new anti-asthmatic drugs. PLoS One 13: e0207767. https://doi.org/10.1371/journal.pone.0207767
Manson ML, Säfholm J, James A, Johnsson AK, Bergman P, Al-Ameri M, Orre AC, Kärrman-Mårdh C, Dahlén SE, Adner M (2020) IL-13 and IL-4, but not IL-5 nor IL-17A, induce hyperresponsiveness in isolated human small airways. J Allergy Clin Immunol 145(3): 808–817.e2. https://doi.org/10.1016/j.jaci.2019.10.037
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


