Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 202-221
Экспериментальный поиск новых средств патогенетической терапии COVID-19: ингибитор Н2-рецепторов фамотидин усиливает эффект осельтамивира на выживаемость и иммунный статус мышей, инфицированных A/PR/8/34 (H1N1)
Н. В. Гончаров 1, 2, *, К. А. Васильев 3, И. В. Кудрявцев 4, П. П. Авдонин 5, Д. А. Белинская 1, М. А. Стукова 3, О. В. Шамова 4, П. В. Авдонин 5
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 НИИ гигиены, профпатологии и экологии человека ФМБА России
Ленинградская обл., Кузьмоловский, Россия
3 НИИ гриппа им. А.А. Смородинцева МЗ РФ
Санкт-Петербург, Россия
4 Институт экспериментальной медицины
Санкт-Петербург, Россия
5 Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 14.12.2021
После доработки 23.12.2021
Принята к публикации 23.12.2021
- EDN: GPXJNI
- DOI: 10.31857/S0869813922020054
Аннотация
Разработка препаратов для терапии COVID-19 – одна из главных проблем современной физиологии, биохимии и фармакологии. Принимая во внимание имеющиеся сведения об участии тучных клеток и роли гистамина в патогенезе COVID-19, а также сведения о позитивной роли фамотидина в профилактике и терапии коронавирусной инфекции, проведен эксперимент с применением фамотидина в модели на мышах. В работе использовали вирус типа А/PR/8/34 (H1N1), адаптированный к мышам. В качестве препарата сравнения использован противовирусный препарат осельтамивир (Тамифлю), относящийся к группе ингибиторов нейраминидазы. Применение фамотидина в сочетании с осельтамивиром позволяет повысить выживаемость, улучшить динамику массы тела животных, способствует снижению уровня NKT-клеток и повышению уровня наивных Т-хелперов. Дальнейшие исследования фамотидина in vivo должны быть направлены на оптимизацию схемы применения препаратов при более высокой вирусной нагрузке, а также при более продолжительном применении фамотидина.
Пандемия коронавирусной инфекции стимулировала проведение исследований роли эндотелиальных клеток (ЭК) в патогенезе COVID-19. Повреждение ЭК, вызванное SARS-CoV-2, усугубляет эндотелиальную дисфункцию, которая обычно возникает при старении, гипертонии и ожирении. Резкое усиление эндотелиальной дисфункции в результате поражения SARS-CoV-2 вызывает развитие острого респираторного дистресс-синдрома (ОРДС). Одной из главных проблем при изучении патогенетических механизмов развития COVID-19 являются молекулярно-биологические особенности ЭК как в разных органах, так и в пределах одного органа (в первую очередь, в легких, но также в почках, сердце и головном мозге), т.к. в разные клетки вирус проникает с разной степенью вероятности и вызывает разные по своему характеру и интенсивности своего проявления последствия [1]. При этом главным патогенетическим последствием, во многом определяющим исход заболевания, является гиперкоагуляция крови в результате массированного выделения эндотелиальными клетками фактора Виллебранда (vWF) [2, 3]. Ангиотензин-превращающий фермент 2 (angiotensin converting enzyme 2, ACE2) – это основной гликопротеин, используемый SARS-CoV-2 для проникновения в клетки. Проникновение вируса в клетки сопряжено с уменьшением количества экспрессирующихся молекул ACE2, с последующим нарушением функционального баланса функциональных осей ACE/AngII/AТ1 и ACE2/Ang(1–7)/Mas [4]. Установлены и другие “рецепторы” коронавируса на ЭК, такие как CD209L (L-SIGN), CD209 (DC-SIGN) [5], рецепторы нейропилина (NRP) [6] и CD147/базигин [7]. CD209L особенно сильно экспрессируется в эпителиальных и эндотелиальных клетках легких и почек, опосредуя проникновение в клетки SARS-CoV-2 [5]. Также хорошо известно, что для входа в клетки SARS-CoV-2 требуется протеолитическая активация спайкового белка, в которой участвуют пептидазы TMPRSS2, фурин и катепсины [1].
Согласно мнению некоторых ученых, два основных патогенетических фактора, которые обусловливают альвеолярный отек при COVID-19, – это собственно инфицирование клеток вирусом SARS-CoV-2 и дегрануляция тучных клеток с высвобождением множества соединений, которые могут влиять на функции клеточных и базальных мембран, гликокаликс и целостность плотных контактов [8]. Из этих соединений наибольший интерес с точки зрения патогенеза COVID-19 представляют гистамин, брадикинин, гепарин, триптаза и цитокины. В амбулаторных условиях ранний COVID-19 обычно неотличим от других “гриппоподобных заболеваний”, проявляясь различными неспецифическими симптомами – от боли в горле, головной боли и диареи до лихорадки, кашля и миалгии. Однако в эти первые несколько дней COVID-19 может быть связанным с аносмией [9]. Тяжелые формы COVID-19 характеризуются не только воспалением легких и ОРДС, но также развитием системной полиорганной недостаточности, в результате неуправляемого “цитокинового шторма”, включающего выброс провоспалительных цитокинов (таких как TNF-α, IL-6, IL-1, IL-8 и MCP-1) [10]. Однако этот шторм не является единственным, предопределенным и необратимым событием. Во-первых, SARS-CoV-2 вызывает массовую гибель клеток с образованием клеточного дебриса, который активирует инфламмасомы не только в клетках врожденного иммунитета, но и в ЭК, запуская т.н. “эйкозаноидный шторм” – всплеск провоспалительных биоактивных липидных медиаторов, таких как простагландины и лейкотриены, которые подпитывают местное воспаление [11, 12]. Во-вторых, относительно недавно произошел сдвиг парадигмы в представлениях о воспалении, заключающийся в том, что в самом процессе воспаления заложен механизм его прекращения благодаря специализированным эндогенным липидным аутокоидам (ЭЛА) – резолвинам, липоксинам и протектины, выполняющим не столько противовоспалительные, сколько ограничительные функции. ЭЛА способствуют удалению клеточного “мусора” макрофагами и противодействуют избыточному высвобождению провоспалительных цитокинов/хемокинов [13]. Считается, что нарушение механизма ограничения и прекращения воспаления играет определяющую роль в поддержании патологического воспаления при COVID-19 и других вирусных инфекциях [14]. Нарушение может быть вызвано обычными противовоспалительными агентами, такими как нестероидные противовоспалительные препараты (НПВП) и ингибиторами циклооксигеназы-2 (ЦОГ-2, COX-2), поскольку они без разбора ингибируют эйкозаноидные пути, которые продуцируют эти “медиаторы контроля”, и тем самым препятствуют процессу активного ограничения воспаления [13, 14]. Роль ЭК и активных форм кислорода (АФК) в генерации этих липидных аутокоидов не изучена.
Действие гистамина опосредовано рецепторами четырех типов – H1, H2, H3 и H4. Наиболее известными функциями рецептора H1 являются регуляция расширения сосудов и сужения бронхов, т.к. рецепторы этого типа локализованы преимущественно на эндотелиальных и гладкомышечных клетках сосудов. Рецептор H2 в основном участвует в модуляции желудочной секреции париетальных клеток [15]. При сепсисе гистамин через активацию H1- и H2-рецепторов способствует развитию недостаточности органов-мишеней. Применение антагонистов H1- и H2-рецепторов показало, что H1- и H2-рецепторы участвуют в септическом поражении легких и печени, но только H2-рецепторы вносят вклад в септическое повреждение почек [16].
Большинство текущих обзоров объясняют клинические и патогенетические сведения о COVID-19 на основе стандартных моделей противовирусных врожденных и адаптивных иммунных ответов, которые не учитывают роль гистамина и тучных клеток как его основного источника. Существующие схемы описывают клеточный ответ, связанный с воспалением и участием в нем моноцитов, макрофагов, адаптивных Т- и В-клеток [17, 18]. Такой тип иммунного ответа используется и для объяснения легочной внутрисосудистой коагулопатии, связанной с COVID-19 [19]. Мы являемся сторонниками альтернативной парадигмы, согласно которой активация тучных клеток, вызванная инфекцией SARS-CoV-2, выброс ими гистамина и провоспалительных цитокинов (главным образом TNF-α) является важнейшим звеном патологического каскада и обусловливает большую часть нетипичной симптоматики, связанной с COVID-19 [8, 20, 21]. Эта модель согласуется с гистопатологическими данными и подтверждается клиническими и фармакологическими данными, предполагающими потенциальные преимущества блокады гистаминовых Н2-рецепторов с использованием фамотидина. Эта модель также подтверждается значительным совпадением клинических признаков начальной фазы COVID-19 и синдрома активации тучных клеток (MCAS) [22–24], сходством с клиническими признаками геморрагической лихорадки Денге и шокового синдрома (включая истощение Т-лимфоцитов) на более поздних стадиях COVID-19 [25, 26]. Кроме того, такие последствия COVID-19 как инсульт и сердечно-сосудистые заболевания соответствуют синдрому Куниса [27], что подтверждается данными о повышенном количестве тучных клеток в стенках альвеолярных перегородок и легочной паренхиме инфицированных SARS-CoV-2 [28].
Целью настоящей работы было теоретическое обоснование и экспериментальная проверка эффективности ингибитора Н2-рецепторов фамотидина в качестве потенциального компонента комплекса для патогенетической терапии COVID-19. При экспериментальном поиске новых средств патогенетической терапии коронавирусной инфекции важно понимать, что мыши являются лишь переносчиками коронавирусной инфекции. Однако эта проблема решается путем использования других штаммов гриппа, которые вызывают у мышей аналогичное состояние, в особенности развитие иммунного дисбаланса, цитокинового шторма и ОРДС в терминальной стадии заболевания, являющегося непосредственной причиной летального исхода. Одним из вирусных штаммов, вызывающих такое заболевание у мышей, является A/PR/8/34 (H1N1) [29].
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты с животными проведены в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 1986), приказом Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н “Об утверждении правил лабораторной практики”.
Беспородные мыши-самки с массой тела 19–23 г были приобретены в питомнике Рапполово (Ленинградская обл.). В работе использовали вирус типа А/PR/8/34 (H1N1), адаптированный к мышам. Вирус накапливали в аллантоисной полости 10-дневных эмбрионов кур (РКЭ) при 34°С в течение 48 ч, готовили аликвоты и хранили при температуре –70°С. Мышей заражали интраназально, под легкой эфирной анестезией. Животным вводили 30 мкл аллантоисной жидкости, содержащей заражающую дозу 5lg[TCID50] вируса гриппа типа A/PR/8/34 (H1N1). Работа с объектами проведена в соответствии с cанитарно-эпидемиологическими правилами СП 1.3.2322-08 “Безопасность работы с микроорганизмами III–IV групп патогенности (опасности) и возбудителями паразитарных болезней” (введен в действие с 1 мая 2008 г., с изменениями 29 июня 2011 г.).
Из 45 мышей было сформировано 5 групп: 1) отрицательный контроль (интактные животные), введение физраствора, n = 5; 2) положительный контроль, инфицирование и введение физраствора внутрижелудочно (в/ж), n = 10; 3) инфицирование и введение осельтамивира в/ж, n = 10; 4) инфицирование и введение фамотидина в/ж, n = 10; 5) инфицирование и введение осельтамивира с фамотидином в/ж, n = 10.
20 мг фамотидина разводили в 2 мл смеси ДМСО + пропиленгликоль, маточный раствор 10 мг/мл хранили в холодильнике. Рабочие растворы для внутрижелудочного введения готовили extempore: 100 мкл маточного раствора разводили в 2.4 мл физраствора или раствора осельтамивира, каждой мыши через зонд вводили объем из расчета 100 мкл на 10 г, что соответствует дозе фамотидина 4 мг/кг. Начинали введение препаратов в день инфицирования (за 2 ч) и продолжали в течение следующих 4 дней. Длительность эксперимента составила 14 дней. Более подробное описание аналогичной модели дано в работе [30].
Забор крови для анализа осуществляли на 4-е сутки после заражения. Кровь забирали из щеки при помощи скарификатора, как описано в работе [31].
Для проведения проточной цитометрии к 50 мкл периферической крови добавляли смесь моноклональных антител следующего состава: анти-CD44, конъюгированные с FITC (кат. № 103022, клон IM7, Biolegend Inc., США), анти-CD49b, конъюгированные с РЕ (кат. № 108908, клон DX5, Biolegend Inc., США), анти-CD8a, конъюгированные с PerCP-Cy5.5 (кат. № 100734, клон 53-6.7, Biolegend Inc., США), анти-CD4, конъюгированные с PE-Cy7 (кат. № 116016, клон RM4-4, Biolegend Inc., США), анти-CD3, конъюгированные с АРС (кат. № 100236, клон 17A2, Biolegend Inc., США), анти-CD45б, конъюгированные с АРС-Cy7 (кат. № 103116, клон 30-F11, Biolegend Inc., США), анти-CD19, конъюгированные с Brilliant Violet 421™ (кат. № 115538, клон 6D5, Biolegend Inc., США), а также анти-CD62L, конъюгированные с Brilliant Violet 510™ (кат. № 104441, клон MEL-14, Biolegend Inc., США). Окраску антителами проводили по рекомендациям производителя. Время инкубации с антителами образцов цельной крови составляло 15 мин при комнатной температуре в защищенном от света месте. Далее проводили удаление эритроцитов из образцов при помощи коммерческого лизирующего раствора OptiLyseC (кат. № A11895, Beckman Coulter, Inc., США), по инструкции производителя. После удаления эритроцитов, образцы однократно отмывали избытком стерильного физраствора (7 мин при 330 g), надосадок удаляли, а клеточный осадок ресуспендировали в 200 мкл свежего физраствора. Полученную суспензию клеток крови анализировали на проточном цитофлуориметре CytoFlexS (Beckman Coulter, Inc., США). Для каждого из образцов анализировали не менее 20000 неповрежденных лимфоцитов. Чтобы отличить одиночные клетки от агрегатов и в последующем дискриминировать агрегаты из анализа, использовали следующие сочетания сигналов по прямому (величина, пропорциональная размеру клеток, FS) и боковому (величина, характеризующая структуру клеток, SS) светорассеянию – интенсивность пикового против интенсивности интегрального сигналов по FS или SS, а также время полета против интенсивности интегрального сигналов FS или SS. Анализ полученных результатов проводили при помощи программного обеспечения Kaluza™ (Beckman Coulter, США). Полученные данные выражали в процентах от популяции клеток интереса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
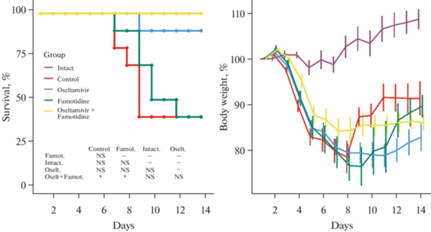
На рис. 1 представлены данные по выживаемости (слева) и динамике массы тела (справа) у мышей, инфицированных вирусом гриппа A/PR/8/34 и получавших осельтамивир, фамотидин и комбинацию обоих препаратов. Кривые Каплана–Мейера представляют процент выживших животных в разные моменты времени после заражения. Первая гибель животных было отмечена на 7-е сутки после заражения в группах (+) контроля (2 мыши из 10) и фамотидина (1 из 10). За 14 дней эксперимента в этих двух группах погибло по 6 животных в каждой, что соответствует выживаемости 40%. Через 9 суток была отмечена гибель одной мыши из группы осельтомивир, после чего не было отмечено ни одной гибели в этой группе животных, что соответствует выживаемости 90%. В группе животных, получавших смесь фамотидина и осельтамивира, за 14 дней не было зарегистрировано ни одной гибели, что соответствует 100%-й выживаемости. Животные этой группы показали наилучшую динамику массы тела (минимальное снижение) и внешне выглядели лучше, по сравнению с животными других экспериментальных групп.
Рис. 1.
Выживаемость (слева) и динамика массы тела (справа) у мышей, инфицированных вирусом гриппа A/PR/8/34 и получавших осельтамивир, фамотидин и комбинацию обоих препаратов. Кривые Каплана–Мейера представляют процент выживших животных в разные моменты времени после заражения. Кривые сравнивали с использованием теста Log-Rank. P-значения представлены на графике. На графике динамики массы тела показаны средние значения и стандартные отклонения для каждой временной точки.
Для выявления основных субпопуляций лимфоцитов использовали многоцветную проточную цитометрию. Т-лимфоциты выделяли на основании наличия на поверхности клеток CD3, после чего общий пул Т-клеток разделяли на Т-хелперы с фенотипом CD3+CD4+, цитотоксические Т-лимфоциты с фенотипом CD3+CD8+ и “NKT-клетки” с фенотипом CD3+CD49b+. Кроме того, в рамках общего пула лимфоцитов выделяли популяции В-лимфоцитов (CD19+ клетки) и естественных киллеров (CD3–CD49b+). Результаты анализа относительного содержания указанных типов лимфоцитов приведены на рис. 2. Так, были отмечены различия по содержанию “NKT-клеток” между группой интактных животных и животных, получавших оба препарата (14.4 ± 4.6 против 9.1 ± 3.0 при р = 0.012 соответственно).
Рис. 2.
Анализ относительного содержания основных субпопуляций лимфоцитов периферической крови. Здесь и далее на рис. 3: квадраты – интактные животные (n = 5); треугольник – животные контрольной группы (n = 10); перевернутые треугольники – группа животных, получавшая осельтамивир (n = 10); ромбы – группа животных, получавшая фамотидин (n = 10); круги – группа животных, получавшая осельтамивир и фамотидин (n = 10). Результаты приведены в виде медианы и интерквартильного размаха Med (Q25; Q75). Различия между группами достоверны согласно дисперсионному анализу (ANOVA) и тесту Тьюки. * p < 0.05.
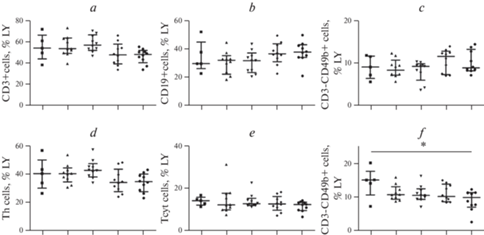
Известно, что после активации NKT-клетки способны продуцировать большие количества гамма-интерферона, IL-4 и колониестимулирующего фактора гранулоцитов и макрофагов, а также многих других цитокинов и хемокинов (IL-2, IL-13, IL-17, IL-21 и TNF-альфа). NKT-клетки обеспечивают поддержку и помощь B-клеткам [32]. В то же время, в легких пациентов с COVID-19 наблюдается воспаление, опосредованное эозинофилами, а также повышенный ответ NKT-клеток, связанный с ОРДС и пневмонией [33].
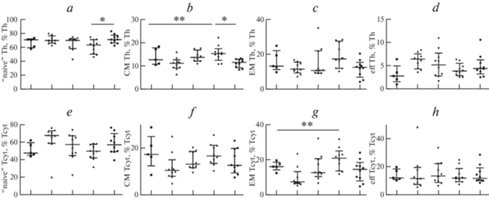
В ходе дальнейших исследований Т-хелперы и цитотоксические Т-лимфоциты были разделены на четыре основные субпопуляции клеток – “наивные” CD44low-to-dim CD62L+ клетки, клетки центральной памяти с фенотипом CD44hiCD62L+, клетки эффекторной памяти CD44hiCD62L– и дифференцированные эффекторные клетки CD44low-to-dimCD62L–. Результаты приведены на рис. 3. Было установлено, что комбинированное применение осельтамивира и фамотидина сопровождается увеличением в циркуляции “наивных” Т-хелперов, способных к распознаванию широкого спектра внедряющихся патогенов, относительно значений, полученных для животных, получавших только фамотидин (72 ± 6.4 против 61.4 ± 10 при р = 0.040 соответственно). Кроме того, у животных, получавших фамотидин, возрастала доля Т-хелперов центральной памяти (CM Tx) относительно контрольных животных и животных из группы осельтамивир + фамотидин (15.3 ± 3.4 против 10.8 ± 2.7 и 11.1 ± 1.8 при р = 0.004 и р = 0.012 соответственно). Более того, при анализе субпопуляционного состава цитотоксических Т-лимфоцитов (Тцит) нами также были отмечены достоверные различия по содержанию ЕМ клеток (клеток эффекторной памяти) между контролем и группой животных, получавших фамотидин (16.2 ± 2.6 против 20.2 ± 6.4 при р = 0.004 соответственно).
Рис. 3.
Анализ относительного содержания основных субпопуляций Т-хелперов и цитотоксических Т-лимфоцитов периферической крови. Обозначения те же, что на рис. 2. * p < 0.05, ** p < 0.01.
В тяжелых случаях COVID-19 наблюдается снижение количества лимфоцитов, но повышение количества лейкоцитов и соотношения нейтрофилов к лимфоцитам (NLR). В наиболее тяжелых случаях повышенный уровень воспалительных цитокинов сопряжен со значительным уменьшением количества Т-лимфоцитов, особенно T-хелперов [34]. В другом исследовании установлено, что в тяжелых случаях COVID-19 клеточный ответ характеризуется лимфоцитопенией с низким содержанием наивных Т-хелперов, наряду с CD8+ Т-клетками (Тцит) и естественными киллерами [35]. Важно отметить, что CD8+ и NK-клетки у выживших пациентов восстанавливались через 8–14 дней, тогда как восстановления наивных Th-клеток не наблюдалось.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Патофизиологический эффект коронавируса SARS-CoV-2 зависит от целого ряда эпигенетических факторов (образ жизни, характер питания, курение и др.), которые влияют на баланс активности функциональных осей ACE/AngII/AТ1 (вазоконстрикция, генерация АФК, воспаление) и ACE2/Ang(1–7)/Mas (вазодилатация, антиоксидантный и антивоспалительный эффекты) [36]. SARS-CoV-2 по сравнению с SARS-CoV обладает большей контагиозностью, однако меньшей вирулентностью [37], что связано с разной тропностью вирусов к разным рецепторам, спектром и экспрессией рецепторов в разных органах и тканях [5]. Активация рецепторов AT1 ангиотензином-II обусловливает генерацию АФК в клетках эндотелия и гладкомышечных клетках сосудов, а также в паравентрикулярных ядрах гипоталамуса [38]. Активность ACE связана не только с образованием антиотензина-II: установлена взаимосвязь между активностью этого фермента и степенью мобилизации врожденного клеточного иммунитета при опухолевом росте и инфекционном заражении, а также степенью экспрессии белков главного комплекса гистосовместимости I и II класса [39].
Имеющиеся скудные данные о патологических изменениях тканей на ранних стадиях COVID-19 свидетельствуют в пользу предположений о сочетанном действии вирусной инфекции и эффектов гистамина в легких. Так, при исследовании ткани легкого, удаленного у онкобольного, находящегося на ранней стадии COVID-19, выявлены два разных паттерна болезни [40]. В одних образцах легочной ткани имеет место обычный мононуклеарный воспалительный паттерн интерстициального пневмонита с фибринозным экссудатом, который обусловлен вирусной инфекцией. Заслуживает внимания тот факт, что в воспалительном инфильтрате практически отсутствуют нейтрофилы или эозинофилы. Одно из объяснений состоит в том, что активация гистамином H2-рецепторов нейтрофилов подавляет их эффекторные функции, в числе которых – генерация супероксид-аниона [41, 42], PAF-индуцируемый хемотаксис [43] и биосинтез лейкотриенов [44]. Функциональная активность эозинофилов также подавляется при активации H2-рецепторов: связывание гистамина подавляет дегрануляцию, снижая высвобождение пероксидазы эозинофилов [45], а при более высоких концентрациях подавляет хемотаксис эозинофилов [46]. В других образцах легочной ткани онкобольных с COVID-19 имеет место интерстициальный и альвеолярный отек, в то время как альвеолярные перегородки сохраняют нормальную архитектуру [47, 48]. Это нетипичная картина, наблюдаемая при вирусной инфекции, так как воспаление отсутствует, а жидкость представляет собой транссудат. Это согласуется с представлением о нарушении регуляции жидкостного барьера из-за эффекта гистамина или других продуктов тучных клеток на ЭК, перициты или пневмоциты II типа. Предполагается, что повышенная проницаемость эндотелия обусловлена активацией рецептора H1 гистамином, хотя никто не исследовал степень экспрессии других типов гистаминовых рецепторов на ЭК, гладкомышечных или других клетках. Имеет значение наличие Н2-рецепторов на тучных клетках: увеличение внутриклеточного уровня цАМФ – например, с помощью форсколина – используется для ингибирования высвобождения гистамина из базофилов и тучных клеток человека [49]. Гистамин может действовать как аутокринный регулятор тучных клеток при PGE2-зависимом высвобождении цитокинов и TNF-α; эта аутокринная обратная связь опосредуется H2- и H3-рецепторами [50]. Отек легких, связанный с дегрануляцией тучных клеток, может коррелировать с ранней фазой т.н. “тихой” или “счастливой” гипоксии [51]. У инфицированных SARS-CoV-2 обезьян (африканские зеленые мартышки) существенно увеличивается количество тучных клеток в паренхиме легких, коррелируя со степенью тяжести пневмонии [8]. Эти результаты подтверждаются данными вскрытия трупа пациента, умершего через 5 дней после появления симптомов COVID-19: на микрофотографиях отчетливо виден невоспалительный отек транссудативного типа [52]. В обоих случаях невоспалительному отеку легких на ранней стадии заболевания COVID-19 сопутствует высвобождение гистамина тучными клетками [52]. Дегрануляция тучных клеток коррелирует с естественным течением COVID-19, которое проходит через функционально и клинически разные ранние и поздние фазы. Большинство инфекций SARS-CoV-2 протекают по типичной ранней фазе любого вируса нижних дыхательных путей, при которой у большинства пациентов заболевание протекает бессимптомно или с минимальной степенью тяжести, а у меньшинства развивается ОРДС на более поздней стадии. Ближе к концу первой недели появления симптомов у пациентов с COVID-19 появляется одышка. Это происходит через несколько дней после кашля и лихорадки, что не характерно для других вирусов гриппа [53]. При обследовании пациентов с COVID-19, имеющих одышку, сатурация резко падает при физической нагрузке. Компьютерная томография (КТ) в таких случаях обычно показывает двустороннее помутнение в нижне-базальных отделах легких по типу “матового стекла”, свидетельствующее об отеке. Некоторые авторы связывают это с потерей легочной вазоконстрикции, одной из причин которой может быть действие гистамина на H2-рецепторы перицитов и/или на гладкомышечные клетки сосудов. Дополнительными причинами могут быть отек, обусловленный активацией H1-рецепторов, и микротромбоз сосудов легких. Таким пациентам помогает прон-позиция (лежание на животе), тогда как вентиляция с положительным давлением в конце выдоха (ПДКВ) не может помочь из-за отсутствия рекрутируемых альвеол [54]. Именно на этом этапе пациент подвергается наибольшему риску развития серьезных осложнений, в первую очередь ОРДС с его 60–80%-ной летальностью. Кроме того, у пациентов могут появиться неврологические симптомы и осложнения, включая ишемический инсульт [55–57]. Осложнения сердечно-сосудистой системы на более поздних стадиях заболевания COVID-19 включают миокардит, острый инфаркт миокарда, сердечную недостаточность, аритмии и венозные тромбоэмболические явления [58, 59].
Паттерны экспрессии генов собственно легочных клеток и некоторых клеток крови дают представление о том, какие клетки могут быть инфицированы и какие из них подвержены действию гистамина [60]. Согласно этим данным эпителиальные клетки (воздухопроводящих путей, пневмоциты 1 и 2 типа) и ЭК сосудов (в т.ч. лимфатических) с большей вероятностью будут инфицированы, на основании паттернов экспрессии ACE2 и TMPRSS2 в этих типах клеток. Клетки с наибольшей экспрессией Н1-рецепторов – артериальный эндотелий. Существенно меньше экспрессия H1-рецепторов на эндотелии других сосудов (при полном отсутствии в венозных), перицитах, пневмоцитах 1-го типа, гладкомышечных клетках сосудов и миелоидных гранулоцитах (в их числе тучные клетки, нейтрофилы и эозинофилы). Клетки с наибольшей экспрессией Н2-рецепторов – перициты 1-го типа, далее следуют гладкомышечные клетки, миелоидные гранулоциты и перициты 2-го типа, пневмоциты 2-го типа, и лишь потом эндотелий сосудов (также полное отсутствие в венозных сосудах). Еще отметим Н4-рецепторы в ЭК сосудов (максимальный уровень экспрессии – в лимфатических), пневмоцитах 1-го типа и в гладкомышечных клетках [60]. К этим данным нужно относиться с большой осторожностью, т.к. они получены на эмбрионах мышей, а динамика экспрессии этих белков или соответствующих генов при действии вирусов, АФК, гистамина и других патогенетических факторов или биологически активных веществ не была исследована.
Взаимодействие с рецепторами гистамина и брадикинина обусловливает увеличение проницаемости эндотелия через сигнальные пути, активирующие киназу Akt1 [61]. Кроме того, Н2-рецептор через белки Gq/11 активирует инозитольный обмен, что обусловливает увеличение концентрации Ca2+ в цитозоле и повышение проницаемости эндотелиального монослоя; этот эффект снижается в случае предварительной обработки ЭК фамотидином [62, 63]. Гистамин оказывает определяющее влияние на состояние ЭК микрососудов и гематотканевых барьеров, особенно в таких органах, как легкие и мозг. Воздействие на гистаминовые Н1- и Н2-рецепторы приводит к снижению экспрессии клаудина-1, важнейшего белка плотных контактов, и как следствие – повышению проницаемости эндотелиального монослоя [64]. Помимо функционального ответа через воздействие на гистаминовые рецепторы, большое значение имеет способность ЭК метаболизировать гистамин посредством моноаминоксидазы (одним из продуктов этого метаболизма является пероксид водорода), наряду со способностью захватывать гистидин (захват можно усилить добавлением сульфата цинка) и синтезировать гистамин с помощью гистидиндекарбоксилазы [64]. В наших работах установлено, что ингибиторы NADPН-оксидазы подавляют избыточную секрецию фактора Виллебранда эндотелиальными клетками, индуцированную гистамином [65]. Ранее было показано, что ингибирование генерации АФК NADPH-оксидазой 2 типа (NOX2) снижает интенсивность воспалительных процессов в легких при поражении организма вирусом гриппа А [66].
В многочисленных исследованиях у пациентов с COVID-19 отмечена гиперкоагуляция, даже выделен новый тип легочной коагулопатии, которая проявляется как микротромбоз мелких сосудов. Установлено, что более 50% пациентов, умирающих от COVID-19, имеют микротромбоз легких [67]. Такого рода тромбоз выявлен не только в артериальных сосудах, но также в альвеолярных капиллярах, при отсутствии воспаления и ОРДС [68]. Поскольку небольшие микротромбы трудно идентифицировать на КТ, предварительная диагностика затруднена. Лабораторные тесты на коагуляцию обычно показывают нормальное или слегка увеличенное протромбиновое время и активированное частичное тромбопластиновое время (АЧТВ), нормальное, повышенное или слегка пониженное количество тромбоцитов, но заметно повышенный уровень фибриногена и особенно D-димеров [69]. Некоторые авторы называют это состояние вариантом ДВС-синдрома, но на самом деле микротромбоз легких при COVID-19 не сопряжен с кровотечением, что является одним из признаков ДВС-синдрома, а скорее напоминает гиперкоагулируемое состояние. Эта коагулопатия, по-видимому, является основным компонентом патогенеза при COVID-19, поскольку повышенный уровень D-димеров, наряду с повышенным уровнем IL-6 и CRP, коррелирует с тяжестью прогноза. Однако в целом механизм формирования микротромбоза легких при COVID-19 остается непонятным.
Важно отметить, что уровень IgG начинает расти в течение 4-х дней после появления симптомов COVID-19, что свидетельствует о вторичном воздействии антигена. Быстрое нарастание специфических нейтрализующих антител, начинающееся менее чем через 7 дней после воздействия SARS-CoV-2, свидетельствует о вторичной мобилизации уже существующей популяции клеток памяти, а не о первичном ответе B-клеток. SARS-CoV-2-реактивные CD4+ Т-клетки были обнаружены примерно у 40–60% людей, не контактировавших с ним, что позволяет предположить перекрестное распознавание клетками памяти как обычных “простудных” коронавирусов, так и SARS-CoV-2 [70]. Если в крови также присутствуют ранее возникшие перекрестно-реактивные IgE-антитела к “простудным” вирусам и/или релевантные популяции В-клеток памяти, это может усилить дисфункциональную дегрануляцию тучных клеток. Антитела, продуцируемые в результате раннего и быстрого гуморального ответа, также могут стимулировать дегрануляцию тучных клеток. Во время этой фазы повышение уровня D-димеров коррелирует с уровнем CRP и IL-6, в конечном счете – с тяжелым исходом заболевания.
Сотрудниками отдела иммунологии Института экспериментальной медицины было показано, что Fc-gamma-рецепторы тучных клеток обеспечивают их активацию и выброс гистамина не только под влиянием IgG-содержащих иммунных комплексов, но и под влиянием CRP, связывающегося с этими рецепторами, что объясняет механизм развития аллергических реакций при воспалительных процессах не-иммунокомплексным путем [71]. Т.о., любая острофазовая реакция чревата активацией тучных клеток и возникновением аллергических, а возможно, и анафилактических реакций. Этот вывод важен и в теоретическом, и в практическом отношении, т.к. указывает направление для разработки новых способов медикаментозной профилактики аллергических осложнений при воспалительных заболеваниях детей и взрослых. К числу факторов риска возникновения таких осложнений, безусловно, относится вакцинация, т.к. воспалительный ответ организма на вакцину при наличии относительно высокого титра антител IgG может спровоцировать перераспределение тучных клеток и выброс гистамина, что может привести к активации ЭК, выбросу vWF с последующим тромбозом.
Разработка препаратов для терапии COVID-19 – одна из главных проблем современной фармакологии. Основные усилия направлены на разработку этиотропной терапии, т.к. имеющиеся в распоряжении фармакологов препараты из этой серии (ремдесивир и разнообразные моноклональные антитела) обладают существенным недостатком: их необходимо вводить внутривенно. В начале 2021 г. было показано, что рибонуклеозидный аналог молнупиравир блокирует передачу SARS-CoV-2 у хорьков [72]. А уже в начале октября 2021 г. компании Ridgeback Biotherapeutics и Merck объявили, что их лекарство молнупиравир на 50% сокращает число госпитализаций среди пациентов с COVID-19 из групп риска, а также значительно снижает смертность [73]. Молнупиравир можно принимать перорально, дважды в сутки в течение пяти дней. Совсем недавно компания Astra Zeneca заявила, что ее “коктейль из антител” предотвращает тяжелую форму COVID-19 [74]. Эффективность этиотропной терапии, как известно, во многом зависит от своевременного начала.
Принимая во внимание имеющиеся сведения об участии тучных клеток и роли гистамина в патогенезе COVID-19, разработка патогенетической терапии с применением антагонистов Н2-рецепторов представляется намного более надежной перспективой. Согласно первым сообщениям, опубликованным в научно-популярной прессе и основанным на непроверенных данных из КНР [75], только фамотидин обеспечивал клинический эффект при лечении COVID-19, тогда как другие антагонисты H2-рецепторов (напр., циметидин) – не оказывали такого эффекта. Это позволило предположить, что фамотидин действует не только на H2-рецепторы. В частности, проверяли его связывание с сигма-рецепторами, наряду с возможным ингибированием репликации SARS-CoV-2 [8]. Обсуждался также механизм нейтрализации вируса SARS-CoV-2 посредством прямого взаимодействия фамотидина с активными центрами вирусных протеаз, в частности, с папаин-подобной протеазой PLpro и 3-химотрипсин-подобной протеазой Mpro [76, 77]. По мнению других исследователей, такой механизм действия фамотидина в качестве составляющей этиотропной терапии не является доказанным, а поиск реальных механизмов его позитивного эффекта необходимо вести с позиций патогенетической терапии, принимая во внимание в первую очередь взаимодействие фамотидина с Н2-рецепторами [78]. При этом обсуждение эффективности фамотидина как антагониста Н2-рецепторов часто сводится к обсуждению его антацидных свойств, связанных с ингибированием протонной помпы [79–81].
В результате комплексного исследования было установлено, что фамотидин не связывается с протеазами SARS-CoV-2 и не подавляет активность вируса SARS-CoV-2 иным способом, в результате прямого взаимодействия с ним. Также действие фамотидина не опосредовано рецепторами сигма-1/2, однако подтверждена высокая селективность фамотидина в отношении H2-рецепторов с аффинностью около 14 нМ, что значительно превышает аффинность циметидина к H2-рецепторам (590 нМ). Дополнительно было установлено, что фамотидин является обратным агонистом Н2-рецептора, и в отличие от циметидина блокирует передачу сигналов Gs-белка посредством рекрутирования аррестина [8, 82]. Эти особенности фамотидина принципиально отличают его от циметидина и, возможно, от других блокаторов H2-рецепторов; ярко выраженная активация аррестина антагонистами рецепторов, сопряженных с G-белками (GPCR) хотя и не является уникальной, но и не является широко распространенной. Кроме того, фамотидин устранял опосредованные Н2-рецепторами негативные эффекты на продукцию цитокинов, особенно TNF-α и интерферона-γ, снижая индуцированную липополисахаридом продукцию TNF-α и экспрессию B7-1 на моноцитах, а также ингибирующие эффекты гистамина на производство Th1-опосредованного высвобождения цитокинов.
Другая точка приложения фамотидина – снижение реактивности нейтрофилов [83]. Врожденный клеточный иммунитет – важнейший элемент противовирусной защиты. Нейтрофилы не только служат маркером острой инфекции, но и служат источником нейтрофильных внеклеточных ловушек (НВЛ, NET), играя ключевую роль в развитии тромботических осложнений вследствие т.н. нетозной трансформации. В образцах легких, почек и сердца больных, умерших вследствие COVID-19, микрососудистые тромбы содержали большое количество нейтрофилов [83, 84]. АФК нейтрофилов считаются триггером нетоза, однако антагонисты H2-рецепторов, включая фамотидин и циметидин, снижают активацию нейтрофилов и ее последствия [85]. Фамотидин дозозависимо снижает уровень внутриклеточного кальция в нейтрофилах и степень генерации АФК [86]. Это объясняет клинические наблюдения, согласно которым фамотидин снижает уровень D-димеров и вероятность развития легочной эмболии при COVID-19 [83, 86].
Тем не менее, сведения об эффективности фамотидина при лечении больных COVID-19 в клинических условиях довольно противоречивы: наряду с достаточно убедительными данными о его позитивном действии [87, 88] имеются не менее убедительные сведения об отсутствии эффективности этого препарата [89–92]. При этом важно отметить, что дозировка фамотидина для внутривенного введения, использованная в многоцентровом клиническом исследовании MATCH (Molecular Analysis for Therapy Choice), составляла 360 мг/день. Это почти в 10 раз превышает пероральную дозу фамотидина, обычно используемую при лечении язвенной болезни [75, 93], тогда как его позитивные эффекты отмечены при пероральном приеме в дозах 20–40 мг/день [87]. Более того, в исследовании MATCH применение фамотидина сопровождалось применением 200 мг гидроксихлорохина в контрольной и экспериментальной группах. Хотя фамотидин – проверенный временем безопасный препарат, чрезмерное подавление секреции желудочной кислоты может спровоцировать пневмонию [94].
Если патогенез COVID-19 сопряжен с дисфункциональной дегрануляцией тучных клеток, тогда использование самых разных фармпрепаратов, применяемых для лечения заболеваний, ассоциированных с тучными клетками, поможет снизить смертность и тяжесть заболеваний, связанных с инфекцией SARS-CoV-2. К ним относятся препараты, стабилизирующие активность тучных клеток, такие как: антагонисты бета-2-адренорецепторов [95] и кромолин-натрий (кромоглициевая кислота) [96, 97], другие антагонисты гистамина (например, H1 и H4) [49, 98, 99], антагонисты лейкотриеновых рецепторов [100], противовоспалительные агенты, применяемые при заболеваниях кишечника и являющиеся ингибиторами активации тучных клеток [101, 102]. Если такие средства применять в сочетании с фармпрепаратами, которые непосредственно подавляют репликацию SARS-CoV-2, тогда можно будет разработать действенные, безопасные и эффективные амбулаторные методы профилактики и патогенетической терапии COVID-19.
ЗАКЛЮЧЕНИЕ
Применение фамотидина в сочетании с осельтамивиром в качестве средств патогенетической терапии при инфицировании мышей вирусным штаммом A/PR/8/34, вызывающим у мышей заболевание, аналогичное COVID-19 у человека, позволяет повысить выживаемость, улучшить динамику массы тела животных, способствует снижению уровня NKT-клеток и повышению уровня наивных Т-хелперов. Дальнейшие исследования фамотидина in vivo должны быть направлены на оптимизацию схемы применения препаратов при более высокой вирусной нагрузке, исходя из того, что влияние на выживаемость животных будет более заметным при соответствующих показателях в группах сравнения не более 50%, а также при более продолжительном применении фамотидина.
Список литературы
Amraei R, Rahimi N (2020) COVID-19, Renin-Angiotensin System and Endothelial Dysfunction. Cells 9: 1652. https://doi.org/10.3390/cells9071652
Spiezia L, Boscolo A, Poletto F, Cerruti L, Tiberio I, Campello E, Navalesi P, Simioni P (2020) COVID-19-Related Severe Hypercoagulability in Patients Admitted to Intensive Care Unit for Acute Respiratory Failure. Thromb Haemost 120: 998–1000. https://doi.org/10.1055/s-0040-1710018
Tang N, Li D, Wang X, Sun Z (2020) Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 18: 844−847. https://doi.org/10.1111/jth.14768
Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA, Solomon SD (2020) Renin-Angiotensin-Aldosterone System Inhibitors in Patients with Covid-19. N Engl J Med 382: 1653−1659. https://doi.org/10.1056/NEJMsr2005760
Amraei R, Yin W, Napoleon MA, Suder EL, Berrigan J, Zhao Q, Olejnik J, Chandler KB, Xia C, Feldman J, Hauser BM, Caradonna TM, Schmidt AG, Gummuluru S, Mühlberger E, Chitalia V, Costello CE, Rahimi N (2021) CD209L/L-SIGN and CD209/DC-SIGN Act as Receptors for SARS-CoV-2. ACS Cent Sci 7: 1156−1165. https://doi.org/10.1021/acscentsci.0c01537
Daly JL, Simonetti B, Klein K, Chen KE, Williamson MK, Antón-Plágaro C, Shoemark DK, Simón-Gracia L, Bauer M, Hollandi R, Greber UF, Horvath P, Sessions RB, Helenius A, Hiscox JA, Teesalu T, Matthews DA, Davidson AD, Collins BM, Cullen PJ, Yamauchi Y (2020) Neuropilin-1 is a host factor for SARS-CoV-2 infection. Science 370: 861−865. https://doi.org/10.1126/science.abd3072
Wang K, Chen W, Zhang Z, Deng Y, Lian JQ, Du P, Wei D, Zhang Y, Sun XX, Gong L, Yang X, He L, Zhang L, Yang Z, Geng JJ, Chen R, Zhang H, Wang B, Zhu YM, Nan G, Jiang JL, Li L, Wu J, Lin P, Huang W, Xie L, Zheng ZH, Zhang K, Miao JL, Cui HY, Huang M, Zhang J, Fu L, Yang XM, Zhao Z, Sun S, Gu H, Wang Z, Wang CF, Lu Y, Liu YY, Wang QY, Bian H, Zhu P, Chen ZN (2020) CD147-spike protein is a novel route for SARS-CoV-2 infection to host cells. Signal Transduct Target Ther 5: 283. https://doi.org/10.1038/s41392-020-00426-x
Malone RW, Tisdall P, Fremont-Smith P, Liu Y, Huang XP, White KM, Miorin L, Moreno E, Alon A, Delaforge E, Hennecker CD, Wang G, Pottel J, Blair RV, Roy CJ, Smith N, Hall JM, Tomera KM, Shapiro G, Mittermaier A, Kruse AC, García-Sastre A, Roth BL, Glasspool-Malone J, Ricke DO (2021) COVID-19: Famotidine, Histamine, Mast Cells, and Mechanisms. Front Pharmacol 12: 633680. https://doi.org/10.3389/fphar.2021.633680
Eliezer M, Hautefort C, Hamel AL, Verillaud B, Herman P, Houdart E, Eloit C (2020) Sudden and Complete Olfactory Loss of Function as a Possible Symptom of COVID-19. JAMA Otolaryngol Head Neck Surg 146: 674−675. https://doi.org/10.1001/jamaoto.2020.0832
Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ, HLH Across Speciality Collaboration UK (2020) COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 395: 1033−1034. https://doi.org/10.1016/S0140-6736(20)30628-0
Fung SY, Yuen KS, Ye ZW, Chan CP, Jin DY (2020) A tug-of-war between severe acute respiratory syndrome coronavirus 2 and host antiviral defence: lessons from other pathogenic viruses. Emerg Microbes Infect 9: 558−570. https://doi.org/10.1080/22221751.2020.1736644
von Moltke J, Trinidad NJ, Moayeri M, Kintzer AF, Wang SB, van Rooijen N, Brown CR, Krantz BA, Leppla SH, Gronert K, Vance RE (2012) Rapid induction of inflammatory lipid mediators by the inflammasome in vivo. Nature 490: 107−111. https://doi.org/10.1038/nature11351
Serhan CN (2014) Pro-resolving lipid mediators are leads for resolution physiology. Nature 510: 92–101. https://doi.org/10.1038/nature13479
Panigrahy D, Gilligan MM, Huang S, Gartung A, Cortés-Puch I, Sime PJ, Phipps RP, Serhan CN, Hammock BD (2020) Inflammation resolution: a dual-pronged approach to averting cytokine storms in COVID-19? Cancer Metastasis Rev 39: 337−340. https://doi.org/10.1007/s10555-020-09889-4
Obara I, Telezhkin V, Alrashdi I, Chazot PL (2020) Histamine, histamine receptors, and neuropathic pain relief. Br J Pharmacol 177: 580−599. https://doi.org/10.1111/bph.14696
Hattori M, Yamazaki M, Ohashi W, Tanaka S, Hattori K, Todoroki K, Fujimori T, Ohtsu H, Matsuda N, Hattori Y (2016) Critical role of endogenous histamine in promoting end-organ tissue injury in sepsis. Intensive Care Med Exp 4: 36. https://doi.org/10.1186/s40635-016-0109-y
Merad M, Martin JJC (2020) Pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol 20: 355. https://doi.org/10.1038/s41577-020-0331-4
Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, Levantovsky R, Malle L, Moreira A, Park MD, Pia L, Risson E, Saffern M, Salomé B, Esai Selvan M, Spindler MP, Tan J, van der Heide V, Gregory JK, Alexandropoulos K, Bhardwaj N, Brown BD, Greenbaum B, Gümüş ZH, Homann D, Horowitz A, Kamphorst AO, Curotto de Lafaille MA, Mehandru S, Merad M, Samstein RM, Sinai Immunology Review Project (2020) Immunology of COVID-19: Current State of the Science. Immunity 52: 910−941. https://doi.org/10.1016/j.immuni.2020.05.002
McGonagle D, O’Donnell JS, Sharif K, Emery P, Bridgewood C (2020) Immune mechanisms of pulmonary intravascular coagulopathy in COVID-19 pneumonia. Lancet Rheumatol 2: 437–445. https://doi.org/10.1016/S2665-9913(20)30121-1
Kritas S, Ronconi G, Caraffa A, Gallenga C, Ross R, Conti P (2019) Mast cells contribute to coronavirus-induced inflammation: new anti-inflammatory strategy. J Biol Regul Homeost Agents 34: 9–14. https://doi.org/10.23812/20-Editorial-Kritas
Conti P, Caraffa A, Tetè G, Gallenga CE, Ross R, Kritas SK, Frydas I, Younes A, Di Emidio P, Ronconi G (2020) Mast cells activated by SARS-CoV-2 release histamine which increases IL-1 levels causing cytokine storm and inflammatory reaction in COVID-19. J Biol Regul Homeost Agents 34: 1629−1632. https://doi.org/10.23812/20-2EDIT
Afrin LB, Ackerley MB, Bluestein LS, Brewer JH, Brook JB, Buchanan AD, Cuni JR, Davey WP, Dempsey TT, Dorff SR, Dubravec MS, Guggenheim AG, Hindman KJ, Hoffman B, Kaufman DL, Kratzer SJ, Lee TM, Marantz MS, Maxwell AJ, McCann KK, McKee DL, Menk Otto L, Pace LA, Perkins DD, Radovsky L, Raleigh MS, Rapaport SA, Reinhold EJ, Renneker ML, Robinson WA, Roland AM, Rosenbloom ES, Rowe PC, Ruhoy IS, Saperstein DS, Schlosser DA, Schofield JR, Settle JE, Weinstock LB, Wengenroth M, Westaway M, Xi SC, Molderings GJ (2020) Diagnosis of mast cell activation syndrome: a global “consensus-2". Diagnosis (Berl) 8: 137−152. https://doi.org/10.1515/dx-2020-0005
Weiler CR (2020) Mast cell activation syndrome: tools for diagnosis and differential diagnosis. J Allergy Clin Immunol Pract 8: 498–506. https://doi.org/10.1016/j.jaip.2019.08.022
Weinstock LB, Pace LA, Rezaie A, Afrin LB, Molderings GJ (2020) Mast cell activation syndrome: a primer for the gastroenterologist. Dig Dis Sci 66: 965−982. https://doi.org/10.1007/s10620-020-06264-9
Mongkolsapaya J, Dejnirattisai W, Xu XN, Vasanawathana S, Tangthawornchaikul N, Chairunsri A, Sawasdivorn S, Duangchinda T, Dong T, Rowland-Jones S, Yenchitsomanus PT, McMichael A, Malasit P, Screaton G (2003) Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever. Nat Med 9: 921−927. https://doi.org/10.1038/nm887
Redoni M, Yacoub S, Rivino L, Giacobbe DR, Luzzati R, Di Bella S (2020) Dengue: status of current and under-development vaccines. Rev Med Virol 30: 2101. https://doi.org/10.1002/rmv.2101
Kounis NG (2016) Kounis syndrome: an update on epidemiology, pathogenesis, diagnosis and therapeutic management. Clin Chem Lab Med 54: 1545–1559. https://doi.org/10.1515/cclm-2016-0010
Motta Junior JDS, Miggiolaro AFRDS, Nagashima S, de Paula CBV, Baena CP, Scharfstein J, de Noronha L (2020) Mast Cells in Alveolar Septa of COVID-19 Patients: A Pathogenic Pathway That May Link Interstitial Edema to Immunothrombosis. Front Immunol 11: 574862. https://doi.org/10.3389/fimmu.2020.574862
de Wit E, Munster VJ, Spronken MI, Bestebroer TM, Baas C, Beyer WE, Rimmelzwaan GF, Osterhaus AD, Fouchier RA (2005) Protection of mice against lethal infection with highly pathogenic H7N7 influenza A virus by using a recombinant low-pathogenicity vaccine strain. J Virol 79: 12401–12407. https://doi.org/10.1128/JVI.79.19.12401-12407.2005
Li C, Xu LJ, Lian WW, Pang XC, Jia H, Liu AL, Du GH (2018) Anti-influenza effect and action mechanisms of the chemical constituent gallocatechin-7-gallate from Pithecellobium clypearia Benth. Acta Pharmacol Sin 39: 1913–1922. https://doi.org/10.1038/s41401-018-0030-x
Golde W, Gollobin P, Rodriguez L (2005) A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim 34: 39–43. https://doi.org/10.1038/laban1005-39
Bai L, Deng S, Reboulet R, Mathew R, Teyton L, Savage PB, Bendelac A (2013) Natural killer T (NKT)-B-cell interactions promote prolonged antibody responses and long-term memory to pneumococcal capsular polysaccharides. Proc Natl Acad Sci USA 110: 16097–16102. https://doi.org/10.1073/pnas.1303218110
Kim DM, Seo JW, Kim Y, Park U, Ha NY, Park H, Yun NR, Kim DY, Yoon SH, Na YS, Moon DS, Lim SC, Kim CM, Kim YS, Cho NH (2021) Eosinophil-mediated lung inflammation associated with elevated natural killer T cell response in COVID-19 patients. Korean J Intern Med Online ahead of print. https://doi.org/10.3904/kjim.2021.093
Qin C, Zhou L, Hu Z, Zhang S, Yang S, Tao Y, Xie C, Ma K, Shang K, Wang W, Tian DS (2020) Dysregulation of Immune Response in Patients With Coronavirus 2019 (COVID-19) in Wuhan, China. Clin Infect Dis 71: 762–768. https://doi.org/10.1093/cid/ciaa248
Notz Q, Schmalzing M, Wedekink F, Schlesinger T, Gernert M, Herrmann J, Sorger L, Weismann D, Schmid B, Sitter M, Schlegel N, Kranke P, Wischhusen J, Meybohm P, Lotz C (2020) Pro- and Anti-Inflammatory Responses in Severe COVID-19-Induced Acute Respiratory Distress Syndrome-An Observational Pilot Study. Front Immunol 11: 581338. https://doi.org/10.3389/fimmu.2020.581338
Li Y, Zhou W, Yang L, You R (2020) Physiological and pathological regulation of ACE2, the SARS-CoV-2 receptor. Pharmacol Res 157: 104833. https://doi.org/10.1016/j.phrs.2020.104833
Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ, Zeng G, Yuen KY, Chen RC, Tang CL, Wang T, Chen PY, Xiang J, Li SY, Wang JL, Liang ZJ, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Zhong NS; China Medical Treatment Expert Group for Covid-19 (2020). Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 382: 1708−1720. https://doi.org/10.1056/NEJMoa2002032
Qiu Y, Zheng F, Ye C, Chen AD, Wang JJ, Chen Q, Li YH, Kang YM, Zhu GQ (2020) Angiotensin Type 1 Receptors and Superoxide Anion Production in Hypothalamic Paraventricular Nucleus Contribute to Capsaicin-Induced Excitatory Renal Reflex and Sympathetic Activation. Neurosci Bull 36:463−474. https://doi.org/10.1007/s12264-019-00460-y
Bernstein KE, Khan Z, Giani JF, Cao DY, Bernstein EA, Shen XZ (2018) Angiotensin-converting enzyme in innate and adaptive immunity. Nat Rev Nephrol 14: 325−336. https://doi.org/10.1038/nrneph.2018.15
Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY (2020) Pulmonary pathology of early-phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol 15: 700–704. https://doi.org/10.1016/j.jtho.2020.02.010
Gespach C, Abita JP (1982) Human polymorphonuclear neutrophils. Pharmacological characterization of histamine receptors mediating the elevation of cyclic AMP. Mol Pharmacol 21: 78–85.
Burde R, Seifert R, Buschauer A, Schultz G (1989) Histamine inhibits activation of human neutrophils and HL-60 leukemic cells via H2-receptors. Arch Pharmacol 340: 671–678. https://doi.org/10.1007/BF00717743
Rabier M, Damon M, Chanez P, Mencia-Huerta JM, Braquet P, Bousquet J, Michel FB, Godard P (1989) Inhibition by histamine of platelet-activating-factor-induced neutrophil chemotaxis in bronchial asthma. Int Arch Allergy Appl Immunol 89: 314−317. https://doi.org/10.1159/000234967
Flamand N, Plante H, Picard S, Laviolette M, Borgeat P (2004) Histamine-induced inhibition of leukotriene biosynthesis in human neutrophils: involvement of the H2 receptor and cAMP. Br J Pharmacol 141: 552–561. https://doi.org/10.1038/sj.bjp.0705654
Ezeamuzie CI, Philips E (2000) Histamine H(2) receptors mediate the inhibitory effect of histamine on human eosinophil degranulation. Br J Pharmacol 131: 482–488. https://doi.org/10.1038/sj.bjp.0703556
Wadee AA, Anderson R, Sher R (1980) In vitro effects of histamine on eosinophil migration. Int Arch Allergy Appl Immunol 63: 322–329. https://doi.org/10.1159/000232643
Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY (2020) Pulmonary pathology of early-phase 2019 novel coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac Oncol 15: 700–704. https://doi.org/10.1016/j.jtho.2020.02.010
Zeng Z, Xu L, Xie XY, Yan HL, Xie BJ, Xu WZ, Liu XA, Kang GJ, Jiang WL, Yuan JP (2020) Pulmonary pathology of early-phase COVID-19 pneumonia in a patient with a benign lung lesion. Histopathology 77: 823−831. https://doi.org/10.1111/his.14138
Marone G, Columbo M, Triggiani M, Vigorita S, Formisano S (1986) Forskolin inhibits the release of histamine from human basophils and mast cells. Agents Actions 18: 96–99. https://doi.org/10.1007/BF01987993
Bissonnette EY (1996) Histamine inhibits tumor necrosis factor alpha release by mast cells through H2 and H3 receptors. Am J Respir Cell Mol Biol 14: 620–626. https://doi.org/10.1165/ajrcmb.14.6.8652190
Couzin-Frankel J (2020) The mystery of the pandemic’s 'happy hypoxia. Science 368: 455–456. https://doi.org/10.1126/science.368.6490.455
Schweitzer W, Ruder T, Baumeister R, Bolliger S, Thali M, Meixner E, Ampanozi G (2020) Implications for forensic death investigations from first Swiss post-mortem CT in a case of non-hospital treatment with COVID-19. Forensic Imaging 21: 200378. https://doi.org/10.1016/j.fri.2020.200378
Cohen PA, Hall L, Johns JN, Rapoport AB (2020) The early natural history of SARS-CoV-2 infection: clinical observations from an urban, ambulatory COVID-19 clinic. Mayo Clin Proc 95: 1124. https://doi.org/10.1016/j.mayocp.2020.04.010
Gattinoni L, Chiumello D, Rossi S (2020) COVID-19 pneumonia: ARDS or not? Crit Care 24: 154. https://doi.org/10.1186/s13054-020-02880-z
Filatov A, Sharma P, Hindi F, Espinosa PS (2020) Neurological complications of coronavirus disease (COVID-19): encephalopathy. Cureus 12: 7352. https://doi.org/10.7759/cureus.7352
Mao L, Jin H, Wang M, Hu Y, Chen S, He Q, Chang J, Hong C, Zhou Y, Wang D, Miao X, Li Y, Hu B (2020) Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol 77: 683−690. https://doi.org/10.1001/jamaneurol.2020.1127
Qureshi AI, Abd-Allah F, Al-Senani F, Aytac E, Borhani-Haghighi A, Ciccone A, Gomez CR, Gurkas E, Hsu CY, Jani V, Jiao L, Kobayashi A, Lee J, Liaqat J, Mazighi M, Parthasarathy R, Steiner T, Suri MFK, Toyoda K, Ribo M, Gongora-Rivera F, Oliveira-Filho J, Uzun G, Wang Y (2020) Management of acute ischemic stroke in patients with COVID-19 infection: Report of an international panel. Int J Stroke 15: 540−554. https://doi.org/10.1177/1747493020923234
Long B, Brady WJ, Koyfman A, Gottlieb M (2020) Cardiovascular complications in COVID-19. Am J Emerg Med 38: 1504. https://doi.org/10.1016/j.ajem.2020.04.048
Mahmud E, Dauerman HL, Welt FGP, Messenger JC, Rao SV, Grines C, Mattu A, Kirtane AJ, Jauhar R, Meraj P, Rokos IC, Rumsfeld JS, Henry TD (2020) Management of Acute Myocardial Infarction During the COVID-19 Pandemic: A Position Statement From the Society for Cardiovascular Angiography and Interventions (SCAI), the American College of Cardiology (ACC), and the American College of Emergency Physicians (ACEP). J Am Coll Cardiol 76: 1375−1384. https://doi.org/10.1016/j.jacc.2020.04.039
Du Y, Guo M, Whitsett JA, Xu Y (2015) Lung GENS’: a web-based tool for mapping single-cell gene expression in the developing lung. Thorax 70: 1092–1094. https://doi.org/10.1136/thoraxjnl-2015-207035
Di Lorenzo A, Fernandez-Hernando C, Cirino G, Sessa WC (2009) Akt1 is critical for acute inflammation and histamine-mediated vascular leakage. Proc Natl Acad Sci USA 106: 14552–14557. https://doi.org/10.1073/pnas.0904073106
Panula P, Chazot PL, Cowart M, Gutzmer R, Leurs R, Liu WL, Stark H, Thurmond RL, Haas HL (2015) International union of basic and clinical pharmacology. XCVIII. Histamine receptors. Pharmacol Rev 67: 601–655. https://doi.org/10.1124/pr.114.010249
Luo T, Chen B, Zhao Z, He N, Zeng Z, Wu B, Fukushima Y, Dai M, Huang Q, Xu D, Bin J, Kitakaze M, Liao Y (2013) Histamine H2 receptor activation exacerbates myocardial ischemia/reperfusion injury by disturbing mitochondrial and endothelial function. Basic Res Cardiol 108: 342. https://doi.org/10.1007/s00395-013-0342-4
Sakurai E (2020) [Elucidation of New Function in Endothelial Cells for Efficient Delivery Strategy of Drug to Tissues]. Yakugaku Zasshi 140: 51−62. [In Japan]. https://doi.org/10.1248/yakushi.19-00179
Avdonin PV, Rybakova EY, Avdonin PP, Trufanov SK, Mironova GY, Tsitrina AA, Goncharov NV (2019) VAS2870 Inhibits Histamine-Induced Calcium Signaling and vWF Secretion in Human Umbilical Vein Endothelial Cells. Cells 8: 196. https://doi.org/10.3390/cells8020196
Vlahos R, Stambas J, Bozinovski S, Broughton BR, Drummond GR, Selemidis S (2011) Inhibition of Nox2 oxidase activity ameliorates influenza A virus-induced lung inflammation. PLoS Pathog 7: 1001271. https://doi.org/10.1371/journal.ppat.1001271
Carsana L, Sonzogni A, Nasr A, Rossi RS, Pellegrinelli A, Zerbi P, Rech R, Colombo R, Antinori S, Corbellino M, Galli M, Catena E, Tosoni A, Gianatti A, Nebuloni M (2020) Pulmonary post-mortem findings in a large series of COVID-19 cases from Northern Italy. medRxiv 20: 1132–1140. https://doi.org/10.1101/2020.04.19.20054262
Magro C, Mulvey JJ, Berlin D, Nuovo G, Salvatore S, Harp J, Baxter-Stoltzfus A, Laurence J (2020) Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: A report of five cases. Transl Res 220: 1−13. https://doi.org/10.1016/j.trsl.2020.04.007
Panigada M, Bottino N, Tagliabue P, Grasselli G, Novembrino C, Chantarangkul V, Pesenti A, Peyvandi F, Tripodi A (2020) Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost 18: 1738−1742. https://doi.org/10.1111/jth.14850
Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Dan JM, Moderbacher CR, Rawlings SA, Sutherland A, Premkumar L, Jadi RS, Marrama D, de Silva AM, Frazier A, Carlin AF, Greenbaum JA, Peters B, Krammer F, Smith DM, Crotty S, Sette A (2020) Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 181: 1489−1501.e15. https://doi.org/10.1016/j.cell.2020.05.015
Трулев АС, Кудрявцев ИВ, Назаров ПГ (2012) Факторы острой фазы воспаления как модуляторы взаимодействия тучных клеток и фиброблаcтов. Acta Biomed Scientif 3:319−322. [Trulioff SA, Kudryavtsev IV, Nazarov PG (2012) Factors of the acute phase of inflammation as modulators of the interaction of mast cells and fibroblasts. Acta Biomed Sci. 3: 319−322. (In Russ)].
Cox RM, Wolf JD, Plemper RK (2021) Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets. Nat Microbiol 6: 11–18. https://doi.org/10.1038/s41564-020-00835-2
Herper M (2021) What we know – and don’t know – about Merck’s new Covid-19 pill. https://www.statnews.com/2021/10/04/what-we-know-and-dont-know-about-mercks-new-covid-19-pill/. Accessed 18 Dec. 2021.
ТАСС (2021) AstraZeneca заявила, что ее “коктейль из антител” предотвращает тяжелую форму COVID-19 [TASS (2021) AstraZeneca stated that its “cocktail of antibodies” prevents the severe form of COVID-19. (In Russ)]. https://tass.ru/obschestvo/12627051. Accessed 18 Deс. 2021.
Borrell B (2020) New York clinical trial quietly tests heartburn remedy against coronavirus [Online]. Science Magazine. https://doi.org/10.1126/science.abc4739
Ortega JT, Serrano ML, Jastrzebska B (2020) Class A G Protein-Coupled Receptor Antagonist Famotidine as a Therapeutic Alternative Against SARS-CoV2: An In Silico Analysis. Biomolecules 10: 954. https://doi.org/10.3390/biom10060954
Wu C, Liu Y, Yang Y, Zhang P, Zhong W, Wang Y, Wang Q, Xu Y, Li M, Li X, Zheng M, Chen L, Li H (2020) Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods. Acta Pharm Sin B 10: 766–788. https://doi.org/10.1016/j.apsb.2020.02.008
Singh VP, El-Kurdi B, Rood C (2021) What Underlies the Benefit of Famotidine Formulations Used During COVID-19? Gastroenterology 160: 1899–1900. https://doi.org/10.1053/j.gastro.2020.07.051
Mura C, Preissner S, Preissner R, Bourne PE (2021) A Birds-Eye (Re)View of Acid-Suppression Drugs, COVID-19, and the Highly Variable Literature. Front Pharmacol 12: 700703. https://doi.org/10.3389/fphar.2021.700703
Jimenez L, Campos Codo A, Sampaio VS, Oliveira AER, Ferreira LKK, Davanzo GG, de Brito Monteiro L, Victor Virgilio-da-Silva J, Borba MGS, Fabiano de Souza G, Zini N, de Andrade Gandolfi F, Muraro SP, Luiz Proença-Modena J, Val FA, Cardoso Melo G, Monteiro WM, Nogueira ML, Lacerda MVG, Moraes-Vieira PM, Nakaya HI (2021) Acid pH Increases SARS-CoV-2 Infection and the Risk of Death by COVID-19. Front Med (Lausanne) 8: 637885. https://doi.org/10.3389/fmed.2021.637885
Shoaibi A, Fortin SP, Weinstein R, Berlin JA, Ryan P (2021) Comparative Effectiveness of Famotidine in Hospitalized COVID-19 Patients. Am J Gastroenterol 116: 692–699. https://doi.org/10.14309/ajg.0000000000001153
Alonso N, Zappia CD, Cabrera M, Davio CA, Shayo C, Monczor F, Fernández NC (2015) Physiological implications of biased signaling at histamine H2 receptors. Front Pharmacol 6: 45. https://doi.org/10.3389/fphar.2015.00045
Radermecker C, Detrembleur N, Guiot J, Cavalier E, Henket M, d’Emal C, Vanwinge C, Cataldo D, Oury C, Delvenne P, Marichal T (2020) Neutrophil extracellular traps infiltrate the lung airway, interstitial, and vascular compartments in severe COVID-19. J Exp Med 217: 20201012. https://doi.org/10.1084/jem.20201012
Nicolai L, Leunig A, Brambs S, Kaiser R, Weinberger T, Weigand M, Muenchhoff M, Hellmuth JC, Ledderose S, Schulz H, Scherer C, Rudelius M, Zoller M, Höchter D, Keppler O, Teupser D, Zwißler B, von Bergwelt-Baildon M, Kääb S, Massberg S, Pekayvaz K, Stark K (2020) Immunothrombotic Dysregulation in COVID-19 Pneumonia Is Associated With Respiratory Failure and Coagulopathy. Circulation 142: 1176–1189. https://doi.org/10.1161/CIRCULATIONAHA.120.048488
Mikawa K, Akamatsu H, Nishina K, Shiga M, Maekawa N, Obara H, Niwa Y (1999) The effects of cimetidine, ranitidine, and famotidine on human neutrophil functions. Anesth Analg 89: 218–224. https://doi.org/10.1097/00000539-199907000-00040
Tomera K, Malone R, Kittah J (2020) Hospitalized COVID-19 Patients Treated With Celecoxib and High Dose Famotidine Adjuvant Therapy Show Significant Clinical Responses [Online]. SSRN. https://doi.org/10.2139/ssrn.3646583
Freedberg DE, Conigliaro J, Wang TC, Tracey KJ, Callahan MV, Abrams JA, Famotidine Research Group (2020) Famotidine Use Is Associated With Improved Clinical Outcomes in Hospitalized COVID-19 Patients: A Propensity Score Matched Retrospective Cohort Study. Gastroenterology 159: 1129–1131.e3. https://doi.org/10.1053/j.gastro.2020.05.053
Mather JF, Seip RL, McKay RG (2020) Impact of Famotidine Use on Clinical Outcomes of Hospitalized Patients With COVID-19. Am J Gastroenterol 115: 1617–1623. https://doi.org/10.14309/ajg.0000000000000832
Kuno T, So M, Takahashi M, Egorova NN (2021) The association between famotidine and in-hospital mortality of patients with COVID-19. J Med Virol. Online ahead of print. https://doi.org/10.1002/jmv.27375
Sun C, Chen Y, Hu L, Wu Y, Liang M, Ayaz Ahmed M, Bhan C, Guo Z, Yang H, Zuo Y, Yan Y, Zhou Q (2021) Does Famotidine Reduce the Risk of Progression to Severe Disease, Death, and Intubation for COVID-19 Patients? A Systemic Review and Meta-Analysis. Dig Dis Sci 66: 3929–3937. https://doi.org/10.1007/s10620-021-06872-z
Cheung KS, Hung IFN, Leung WK (2021) Association Between Famotidine Use and COVID-19 Severity in Hong Kong: A Territory-wide Study. Gastroenterology 160: 1898–1899. https://doi.org/10.1053/j.gastro.2020.05.098
Shoaibi A, Fortin SP, Weinstein R, Berlin JA, Ryan P (2021) Comparative Effectiveness of Famotidine in Hospitalized COVID-19 Patients. Am J Gastroenterol 116: 692–699. https://doi.org/10.14309/ajg.0000000000001153
Conigliaro J (2020, April 7 – 2020, September 7) A Multi-site, Randomized, Double-Blind, Comparative Trial of the Safety and Efficacy of Standard of Care (SOC) Plus Famotidine vs SOC Plus Placebo for the Treatment of COVID-19 in Hospitalized Adults. Identifier NCT04370262. https://clinicaltrials.gov/ct2/show/NCT04370262. Accessed 18 Dec. 2021.
Eom CS, Jeon CY, Lim JW, Cho EG, Park SM, Lee KS (2011) Use of acid-suppressive drugs and risk of pneumonia: a systematic review and meta-analysis. CMAJ 183: 310–319.
Scola AM, Chong LK, Suvarna SK, Chess-Williams R, Peachell PT (2004) Desensitisation of mast cell beta2-adrenoceptor-mediated responses by salmeterol and formoterol. Br J Pharmacol 141: 163–171. https://doi.org/10.1038/sj.bjp.0705599
Zhang T, Finn DF, Barlow JW, Walsh JJ (2016) Mast cell stabilisers. Eur J Pharmacol 778: 158–168. https://doi.org/10.1016/j.ejphar.2015.05.071
Han D, Wei T, Zhang S, Wang M, Tian H, Cheng J, Xiao J, Hu Y, Chen M (2016) The therapeutic effects of sodium cromoglycate against influenza A virus H5N1 in mice. Influenza Other Respir Viruses 10: 57–66. https://doi.org/10.1111/irv.12334
Okayama Y, Benyon RC, Lowman MA, Church MK (1994) In vitro effects of H1-antihistamines on histamine and PGD2 release from mast cells of human lung, tonsil, and skin. Allergy 49: 246–253. https://doi.org/10.1111/j.1398-9995.1994.tb02657.x
Hogan Ii RB, Hogan Iii RB, Cannon T, Rappai M, Studdard J, Paul D, Dooley TP (2020) Dual-histamine receptor blockade with cetirizine – famotidine reduces pulmonary symptoms in COVID-19 patients. Pulm Pharmacol Ther 63: 101942. https://doi.org/10.1016/j.pupt.2020.101942
Fidan C, Aydogdu A (2020) As a potential treatment of COVID-19: Montelukast. Med Hypotheses 142: 109828. https://doi.org/10.1016/j.mehy.2020.109828
Castells M, Butterfield J (2019) Mast Cell Activation Syndrome and Mastocytosis: Initial Treatment Options and Long-Term Management. J Allergy Clin Immunol Pract 7: 1097–1106. https://doi.org/10.1016/j.jaip.2019.02.002
Theoharides TC, Tsilioni I, Ren H (2019) Recent advances in our understanding of mast cell activation – or should it be mast cell mediator disorders? Expert Rev Clin Immunol 15: 639–656. https://doi.org/10.1080/1744666X.2019.1596800
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


