Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 2, стр. 183-201
Электрофизиологические свойства кортикальных нейронов из эпилептического очага детей с рефрактерной височной эпилепсией
С. Л. Малкин 1, *, В. А. Хачатрян 2, Е. В. Федоров 2, А. В. Зайцев 1, 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр им. В.А. Алмазова Минздрава России
Санкт-Петербург, Россия
* E-mail: adresatt@gmail.com
Поступила в редакцию 05.12.2021
После доработки 20.12.2021
Принята к публикации 21.12.2021
- EDN: FSAVJG
- DOI: 10.31857/S0869813922020066
Аннотация
Височная эпилепсия – это тяжелое расстройство центральной нервной системы, связанное с нарушением баланса возбуждения и торможения в мозге, проявляющееся повторяющимися судорожными припадками. Примерно у 30% пациентов эпилепсия является фармакорезистентной (рефрактерной), то есть существующие противоэпилептические препараты не позволяют полностью купировать приступы. Одним из подходов к лечению рефрактерной височной эпилепсии является хирургическое удаление очагов генерации судорог, которые, как правило, расположены в височной коре, гиппокампе, или миндалине. Это позволяет добиться устойчивой ремиссии примерно в 60–75% случаев. Изучение морфологических и функциональных особенностей нейрональных сетей в эпилептических очагах пациентов с рефрактерной височной эпилепсией необходимо для понимания механизмов патогенеза этого заболевания и разработки новых подходов к его лечению. В данной работе мы проанализировали электрофизиологические свойства нейронов височной коры мозга, полученных в ходе хирургического удаления эпилептических очагов при рефрактерной височной эпилепсии у детей, и сравнили их со свойствами пирамидных нейронов коры мозга крысы. Свойства нейронов исследовались методом локальной фиксации потенциала в переживающих срезах. Мы обнаружили, что нейроны человека характеризуются гораздо более высокой возбудимостью, чем нейроны крысы. Они генерируют потенциалы действия в ответ на минимальную деполяризацию, и способны поддерживать высокую частоту разрядов. При этом для них было характерно высокое входное сопротивление мембраны. Выявленные биофизические особенности нейронов могут лежать в основе патологического процесса, приводящего к генерации фармакорезистентных судорог у детей с височной эпилепсией.
Эпилепсия является наиболее распространенным заболеванием центральной нервной системы, поражающим около 1% населения мира [1]. Несмотря на значительный прогресс в области фармакотерапии эпилепсии, до 30% ее случаев остаются устойчивы к доступным на сегодняшний день в медицинской практике противосудорожным препаратам [2]. Особенно актуальной является проблема детской рефрактерной эпилепсии, поскольку неконтролируемые судороги приводят к различным нарушениям умственного и психоэмоционального развития детей и значительному снижению качества их жизни [3]. В настоящее время основным подходом к лечению рефрактерной височной эпилепсии у детей является хирургическое удаление эпилептических очагов [4]. Хотя этот подход позволяет добиться устойчивой ремиссии приблизительно в 3/4 случаев, часть пациентов в дальнейшем испытывает рецидив судорог вследствие образования нового эпилептического очага [5]. В связи с этим, изучение патогенетических механизмов рефрактерной эпилепсии остается крайне актуальной задачей.
Развитие височной эпилепсии сопровождается такими морфологическими и нейросетевыми нарушениями, как склероз гиппокампа, аномальный спраутинг мшистых волокон, нарушение гематоэнцефалического барьера и астроглиоз [6, 7]. Также, одним из нарушений, часто ассоциированных с рефрактерной височной эпилепсией у детей, является фокальная кортикальная дисплазия (ФКД) [8]. На нейрональном уровне показано изменение возбудимости пирамидных клеток коры в модели эпилепсии на крысах [9]. Однако есть также данные, показывающие, что биофизические свойства нейронов в этой ткани могут быть не сильно изменены, тогда как возбуждающая синаптическая передача часто усиливается, а ГАМК-ергическое торможение остается неизменным [10]. Для нейронов височной коры детей с рефрактерной эпилепсией показаны характеристики, близкие к таковым у нейронов взрослых пациентов [11], однако опубликованных данных о биофизических свойствах нейронов при рефрактерной эпилепсии у детей на сегодняшний день крайне мало.
Недостаточно изученными остаются и возрастные особенности нейронов неокортекса как здоровых людей, так и пациентов с височной эпилепсией. В исследованиях на грызунах показано, что входное сопротивление нейронов коры значительно снижается в процессе постнатального онтогенеза [12], что позволяет предположить аналогичные изменения и для нейронов человека. Такие особенности могут серьезно повлиять на механизмы избыточного возбуждения и аномальной синхронизации в коре при эпилепсии, однако на сегодняшний день этот вопрос остается открытым. В данной работе мы исследовали мембранные свойства нейронов в височной коре пациентов с рефрактерной височной эпилепсией детского возраста. Полученные данные помогут раскрыть особенности протекания этого заболевания у детей.
МЕТОДЫ ИССЛЕДОВАНИЯ
Пациенты
Исследование проводилось в соответствии с протоколом, одобренным этической комиссией ФГБУ “Национальный медицинский исследовательский центр им. В.А. Алмазова” Минздрава России, который был разработан, опираясь на Хельсинкскую декларацию 1964 г. и ее последующие изменения. От родителей каждого из включенных в исследование участников было получено информированное добровольное согласие. В исследование были включены данные, полученные по результатам 4 операций (1 мальчик и 3 девочки, табл. 1). У всех пациентов была продиагностирована рефрактерная височная эпилепсия.
Таблица 1.
Данные о пациентах
| № | Пол | Возраст, лет | Длительность заболевания | Лечение | Удаленный участок |
|---|---|---|---|---|---|
| 1 | М | 11 | 4 года | Финлепсин, Пантогам | Передние 2/3 правой височной доли (4.3 × 3.7 × 3.1 см), гиппокамп |
| 2 | Ж | 10 | 1 год | Карбамазепин, Конвулекс | Передние отделы левой височной доли на расстоянии 4 см от полюса |
| 3 | Ж | 15 | 2 года | Трилептал, Левотирацетам, Ламиктал | Левая височная доля, задне-латеральные отделы нижней лобной извилины и верхне-передние отделы верхней теменной дольки |
| 4 | Ж | 8 | 3 месяца | Депакин, Кеппра | Полюс левой височной доли на расстоянии 3.5 см от полюса |
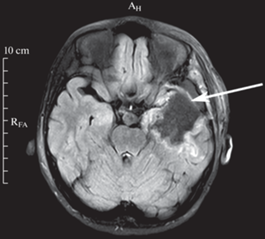
После смены двух или более режимов фармакотерапии, ни один из которых не позволил купировать судорожные припадки, пациентам было рекомендовано хирургическое удаление судорожного очага из височной коры. У пациента № 4 была обнаружена структурная аномалия коры и гиппокампа, связанная с фармакорезистентными судорогами, поэтому хирургическое лечение было рекомендовано несмотря на сравнительно малую длительность течения заболевания. Клиническое гистологическое исследование послеоперационного материала выявило наличие фокальной кортикальной дисплазии (ФКД) II или III типов у всех пациентов. Послеоперационное исследование включало получение МРТ (рис. 1), которое позволяло задокументировать точную локализацию удаленного участка мозга.
Приготовление переживающих срезов мозга человека
Образцы тканей мозга были получены в ходе нейрохирургических операций по удалению судорожного очага в височной доле у пациентов отделения детской нейрохирургии Национального медицинского исследовательского центра им. В.А. Алмазова. В процессе операции локализация патологических областей уточнялась при помощи электрокортикографического (ЭКоГ) исследования. Паталогические очаги характеризовались генерацией спайк-волновой активности, регистрируемой на ЭКоГ. Для минимизации гипоксического повреждения удаляемых участков коры хирург в процессе операции как можно дольше сохранял их кровоснабжение, коагулируя питающие их сосуды лишь непосредственно перед окончательным удалением. После удаления ткань мозга сразу помещали в охлажденную до 0°С искусственную спинномозговую жидкость (ИСМЖ, состав в мМ: 126 NaCl, 24 NaHCO3, 2.5 KCl, 2 CaCl2, 1.25 NaH2PO4, 1 MgSO4 и 10 D-глюкозы) и транспортировали в нейрофизиологическую лабораторию, расположенную в Институте эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Время транспортировки составляло 30–60 мин. Срезы толщиной 300 мкм изготавливались на вибротоме Microm HM 650 V (Microm International GmbH, Вальдорф, Германия) в охлажденной ИСМЖ, непрерывно насыщаемой карбогеном (5% CO2 и 95% O2). После приготовления срезы помещались в ИСМЖ комнатной температуры и инкубировались в течение 45 мин. Для экспериментов использовали от 5 до 10 срезов от одного пациента.
Приготовление переживающих срезов мозга крысы
Эксперименты проводили на самцах крыс Вистар в возрасте трех недель, который примерно соответствует подростковому возрасту у человека [13]. Экспериментальные процедуры проводились в соответствии с директивой Совета Европы Directive 86/609/EEC и регламентом использования лабораторных животных в Институте эволюционной физиологии и биохимии им. И.М. Сеченова РАН, принятым и утвержденным комиссией по биоэтике.
Крыс декапитировали, головной мозг быстро извлекали и помещали в раствор Рингера, аэрируемый газовой смесью 95% О2 + 5% СО2. Коронарные срезы мозга толщиной 350 мкм изготавливали аналогично описанной выше процедуре для срезов мозга человека. Регистрацию проводили с пирамидных нейронов медиальной префронтальной коры.
Электрофизиологическая регистрация
Электрофизиологическая регистрация свойств нейронов производилась методом локальной фиксации потенциала в режиме “целая клетка” в перфузируемой камере для срезов при температуре 30°C и скорости перфузии 5 мл/мин. Нейроны II–IV слоев височной коры визуализировали с использованием дифференциально-интерференционного контраста при помощи микроскопа Axioskop-2FS Plus (Carl Zeizz AG, Оберкохен, Германия) и видеокамеры Sanyo VCB-3512P (SANYO Electric Co., Ltd.; Moriguchi, Осака, Япония). Стеклянные электроды с сопротивлением 2–4 МОм заполняли раствором следующего состава (в мМ): 135 глюконата калия, 5 KCl, 5 NaCl, 5 EGTA, 10 HEPES, 4 АТФ-Mg и 0.3 ГТФ-Na, pH 7.25. Пассивные и активные мембранные свойства изучали, анализируя ответы нейронов на ступеньки тока длиной 1.5 с, подаваемые с интервалом в 3.5 с, в диапазоне амплитуд от –100 до +600 пА с шагом в 10 пА, что было достаточно для развития деполяризационного блока во всех исследованных нейронах.
Сигналы регистрировали при помощи усилителя EPC8, оцифровывали с частотой 50 кГц с помощью аналогово-цифрового преобразователя (ЦАП/АЦП) LIH 8 + 8 с использованием программного обеспечения PatchMaster 2 × 91 (HEKA Elektronik GmbH, Людвигсхафен-ам-Райн, Германия). Коррекция последовательного сопротивления в процессе записи не применялась.
Анализ данных
Электрофизиологические записи конвертировали в формат ABF при помощи программного обеспечения Review 5.0.2 (Bruxton Corp., Сиэтл, Вашингтон, США) и анализировали при помощи самостоятельно разработанной программы, написанной на языке программирования Python с использованием библиотек NumPy [14], SciPy [15], pyqtgraph [16] и pyABF (https://swharden.com/pyabf/).
Для анализа характеристик потенциалов действия (ПД) использовали ПД, генерируемые при токе реобазы, то есть при минимальном значении деполяризующего тока, достаточного для генерации ПД. Анализировали такие параметры ПД, как порог генерации, амплитуда, следовая деполяризация (СДП), амплитуды быстрой и средней гиперполяризации, время до пика средней следовой гиперполяризации, время нарастания, полуширина ПД и ширина ПД на уровне порога.
Порог определяли как точку, в которой значение первой производной от потенциала по времени (dV/dt) превышало порог в 5 мВ/мс. Амплитуду определяли как пиковое значение, которого достигал мембранный потенциал при генерации ПД, относительно порога. Амплитуду СДП рассчитывали как пиковое значение мембранного потенциала на участке между пиками быстрой и медленной следовой гиперполяризации, относительно пика быстрой следовой гиперполяризации.
Амплитуду быстрой следовой гиперполяризации определяли как точку, в которой спад мембранного потенциала значительно замедлялся и становился медленнее 5 мВ/мс. Пик средней следовой гиперполяризации замеряли в точке минимального значения, которое принимал мембранный потенциал, относительно пика быстрой следовой гиперполяризации. Время до средней следовой гиперполяризации измеряли между пиками быстрой и средней следовой гиперполяризации. Время нарастания измеряли между 10% и 90% пиковой амплитуды ПД относительно порога. Длительность (полуширину) ПД измеряли на половине его максимальной амплитуды.
Частотно-токовые характеристики нейронов сравнивали по: 1) току реобазы – минимальный ток, вызывающий генерацию ПД; 2) минимальному току, вызывающему максимальную частоту ПД; 3) минимальному току, вызывающему деполяризационный блок ПД; 4) времени от начала подачи деполяризационного тока на уровне реобазы до первого ПД; 5) максимальной частоте ПД; 6) максимальному наклону частотно-токовой характеристики; 7) величине ранней и поздней частотной адаптации.
Для каждого нейрона строили частотно-токовые характеристики – зависимость частоты генерации ПД от амплитуды подаваемого тока. По этим кривым определяли максимальную частоту генерации ПД, ток реобазы. Для определения максимального наклона частотно-токовой кривой проводили аппроксимацию с помощью функции Гомперца:
где a – верхняя асимптота (максимальная частота), b – смещение по оси x, c – темп роста, e – число Эйлера.Раннюю частотную адаптацию рассчитывали как соотношение второго межспайкового интервала к первому, а позднюю – как отношение последнего интервала к первому.
Оценивали ряд пассивных мембранных свойств нейронов: потенциал покоя (ПП), входное сопротивление (Ri) и мембранную константу (τ). Потенциал покоя измеряли как среднее значение мембранного потенциала на пробеге с нулевым подаваемым током. Ri рассчитывали как наклон линейной части вольт-амперной характеристики для гиперполяризующих ступенек тока. Потенциал измеряли на отрицательном пике в начале ступеньки. Мембранную константу рассчитывали как параметр моноэкспоненциальной функции, с помощью которой аппроксимировали фазу нарастания потенциала в ответ на ступеньку тока величиной 20 пА.
Статистический анализ
Статистический анализ производили с помощью скриптов, написанных на языке программирования Python с использованием библиотек Pandas (https://pandas.pydata.org/), Numpy и SciPy, для визуализации данных использовалась библиотека Matplotlib [17]. Для сравнения трех групп использовали однофакторный дисперсионный анализ, с последующим использованием апостериорного теста Тьюки для парных сравнений средних значений. Данные представлены как среднее ± стандартная ошибка.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Процент нейронов, пригодных для регистрации, в срезах коры мозга человека был относительно мал. Как правило, лучше выживали нейроны небольшого размера. При выборе нейронов для регистрации преимущество отдавали нейронам пирамидной формы с апикальным отростком. Однако не во всех случаях удавалось визуально оценить наличие апикального отростка. Таким образом, выборка изученных нейронов может быть неоднородной и состоять как из возбуждающих пирамидных нейронов, так и тормозных интернейронов. Всего в исследование было включено 26 нейронов человека. У всех включенных в анализ нейронов мембранный потенциал покоя был не выше –50 мВ, и наблюдался овершут потенциала действия.
Для сравнения электрофизиологических показателей мы включили в эту работу записи ответов пирамидных нейронов коры крысы (n = 10), полученных на этой же установке в сходных экспериментальных условиях.
Частотно-токовые характеристики нейронов
Примеры ответов нейронов человека и крысы на гиперполяризующий и деполяризующий ток приведены на рис. 2. Вначале мы построили для каждого нейрона частотно-токовые характеристики – зависимость частоты генерируемых ПД от амплитуды деполяризующего тока. При небольших амплитудах тока наблюдается линейная зависимость между его силой и частотой спайков, при дальнейшем увеличении силы тока частота ПД стабилизируется, а затем наблюдается срыв генерации ПД, и у нейрона развивается деполяризационный блок.
Рис. 2.
Паттерны ответов и частотно-токовые характеристики нейронов коры мозга крысы и человека. Репрезентативные примеры ответов нейронов крысы (а) и человека (b, c). Rat – пирамидный нейрон крысы, H1 – нейрон человека из 1-й группы, H2 – нейрон человека из 2-й группы. (d) – частотно-токовые характеристики двух подтипов нейронов человека (H1, n = 9; H2, n = 17), а также пирамидных клеток медиальной префронтальной коры крысы (n = 10).
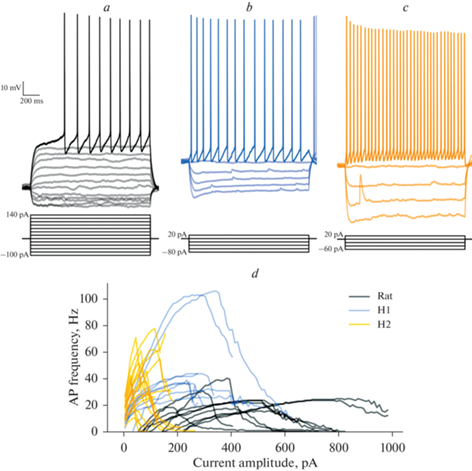
Мы обнаружили, что нейроны человека и крысы существенно различаются по частотно-токовым характеристикам (рис. 2d). Для нейронов крысы максимальная частота генерации спайков была ниже, однако срыв генерации ПД происходил при большей силе тока, чем у нейронов человека.
Исследуемая популяция нейронов человека оказалась неоднородной по частотно-токовым характеристикам, поэтому мы подразделили нейроны человека на две группы, одна из которых характеризовалась очень низким порогом деполяризационного блока ПД, а другая была способна генерировать ПД в более широком диапазоне подаваемых токов. В качестве условной границы мы использовали ток в 200 пА. Все нейроны, у которых деполяризационный блок развивался при амплитуде тока выше 200 пА, отнесли к первому подтипу (H1), а те, у которых деполяризационный блок развивался при меньших токах – ко второму подтипу (H2).
Для нейронов человека второго подтипа было характерно крайне быстрое нарастание частоты генерации ПД при увеличении амплитуды деполяризующего тока. Максимальный наклон частотно-токовой характеристики для этой группы нейронов был значительно выше, чем для нейронов H1 и пирамидных клеток крысы (крыса: 5.5 ± 0.8 Гц/мкА (n = 10); H1: 8.0 ± 0.6 Гц/мкА (n = 9); H2: 26.3 ± 3.4 Гц/мкА (n = 17)). При этом нейроны человека второго подтипа по этому параметру не отличались от пирамидных клеток крысы (рис. 2, 3c).
Рис. 3.
Статистические данные по биофизическим свойствам нейронов человека и крысы. (a) – ток реобазы, F2,33 = 42.7, p < 0.001; (b) – максимальная частота ПД, F2,33 = 5.0, p < 0.05; (c) – максимальный наклон частотно-токовой характеристики, F2,33 = 18, p < 0.001; (d) – минимальный ток, вызывающий максимальную частоту ПД, F2,33 = 43, p < 0.001; (e) – минимальный ток, вызывающий деполяризационный блок, F2,33 = 38, p < 0.001; (f) – ранняя частотная адаптация ПД, F2,33 = 2.7, p = 0.08; (g) – поздняя частотная адаптация ПД, F2,32 = 28, p < 0.001; * – p < 0.05, ** – p < 0.01 – различия между нейронами человека и крысы; ## – p < 0.01 – различия между нейронами подтипов H1 и H2 (апостериорный тест Тьюки).
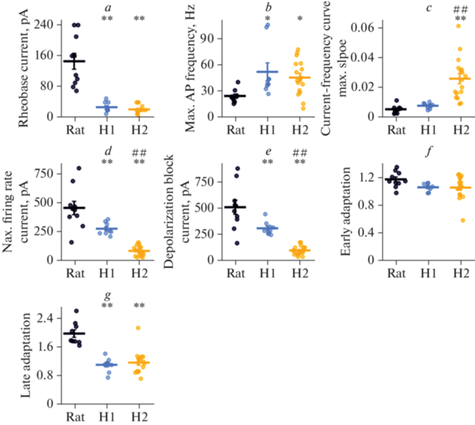
Ток реобазы был приблизительно одинаковым для обоих подтипов нейронов человека и в несколько раз меньше, чем у пирамидных нейронов крысы (крыса: 146 ± 21 пА; H1: 27 ± 4 пА; H2: 21 ± 3 пА; рис. 3a). Максимальная частота генерации ПД в обоих типах нейронов человека также была выше, чем в нейронах крысы (крыса: 25 ± 2 Гц; H1: 52 ± 10 Гц; H2: 46 ± 5 Гц; рис. 3b). При этом амплитуды тока, вызывающего генерацию ПД с максимальной частотой, были значительно ниже у нейронов человека (крыса: 456 ± 57 пА; H1: 278 ± 17 пА; H2: 84 ± 10 пА; рис. 3d).
В основе повышения частоты генерации ПД может лежать снижение частотной адаптации нейронов. Поэтому мы проанализировали величину ранней и поздней частотной адаптации ПД (отношение второго межспайкового интервала к первому, и последнего к первому соответственно). В обоих подтипах нейронов человека поздняя частотная адаптация практически отсутствовала и была значительно ниже, чем в пирамидных клетках коры крысы (крыса: 2.00 ± 0.10; H1: 1.10 ± 0.10; H2: 1.20 ± 0.10; рис. 3g). В то же время ранняя адаптация была не выражена во всех изученных типах нейронов (рис. 3f). Таким образом, низкая частотная адаптация может быть вовлечена в способность нейронов в эпилептических очагах височной коры человека генерировать ПД с высокой частотой.
Другими потенциальными факторами, опосредующими высокую возбудимость нейронов человека, являются характеристики потенциалзависимых токов, опосредующих различные фазы ПД, или особенности пассивных мембранных свойств этих нейронов. Для оценки особенностей потенциалзависимых токов, мы применили анализ характеристик одиночных ПД, генерируемых при токе реобазы в изученных нейронах.
Характеристики потенциалов действия нейронов человека и крысы
Можно предположить, что высокая возбудимость нейронов человека может быть связана с характеристиками потенциалзависимых токов, опосредующих различные фазы ПД, или с особенностями пассивных мембранных свойств этих нейронов. Для оценки особенностей потенциалзависимых токов, мы применили анализ характеристик одиночных ПД, генерируемых при токе реобазы в изученных нейронах. Примеры потенциалов действия нейронов из изучаемой выборки приведены на рис. 4 (левые панели). Также мы построили фазовые диаграммы для этих ПД, по которым проще сравнивать порог возникновения ПД и величину следовой гиперполяризации (рис. 4, правые панели). Для нейронов человека характерны более низкие пороги генерации ПД по сравнению с нейронами крысы (крыса: ‒36.6 ± 1.2 мВ; H1: –45.8 ± 2.0 мВ; H2: –47.3 ± 1.7 мВ; рис. 4, 5a).
Рис. 4.
Суперпозиции первых потенциалов действия, записанных при токе реобазы (слева) и фазовыедиаграммы этих же потенциалов действия (справа) для пирамидных клеток крысы (а), нейронов типа H1 (b) и H2 (c).
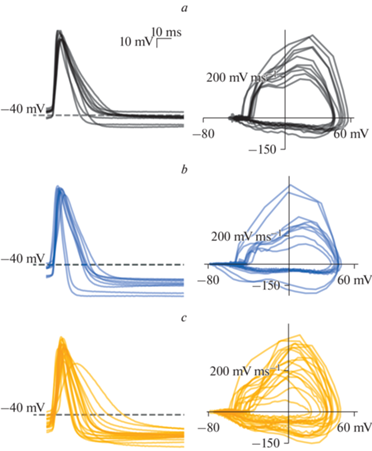
Рис. 5.
Статистический анализ свойств ПД у нейронов человека и крысы. (a) – порог генерации ПД, F2,33 = 10.4, p < 0.001; (b) – амплитуда ПД, F2,33 = 5.7, p < 0.01; (c) – амплитуда быстрой следовой гиперполяризации, F2,33 = 22, p < 0.001; (d) – амплитуда средней следовой гиперполяризации, F2,31 = 15.3, p < 0.001; (e) – время до пика средней следовой гиперполяризации, F2,31 = 1.7, p = 0.2; (f) – амплитуда следовой деполяризации, F2,33 = 4.8, p < 0.05; (g) – полуширина ПД, F2,33 = 0.37, p = 0.7; (h) – время нарастания ПД с 10% до 90% амплитуды, F2,33 = 4.23, p < 0.05; * – p < 0.05, ** – p < 0.01 – различия между нейронами человека и крысы; ## – p < 0.01 – различия между нейронами подтипов Н1 и H2 (апостериорный тест Тьюки).
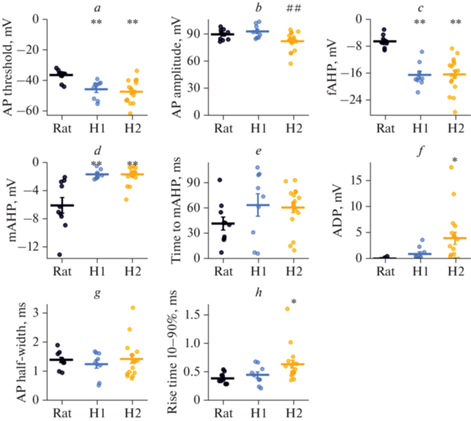
Такое смещение порогов может быть обусловлено активацией потенциалзависимых Na+-каналов при более низком потенциале. Также в этих нейронах наблюдалась увеличенная амплитуда быстрой следовой гиперполяризации (крыса: –6.3 ± 0.6 мВ; H1: –16.3 ± 1.2 мВ; H2: –16.2 ± 1.2 мВ; рис. 5c), тогда как средняя следовая гиперполяризация в них практически не проявлялась (крыса: –6.0 ± 1.1; H1: –1.7 ± 0.2; H2: –1.7 ± 0.3; рис. 4, 5d, 6). Быстрая следовая гиперполяризация, опосредованная кальций-зависимыми K+-каналами большой проводимости (BK-каналами), укорачивает межспайковые интервалы и приводит к повышению частоты генерации ПД в ответ на деполяризацию мембраны нейрона [18, 19]. Таким образом, это может быть одним из механизмов, приводящих к повышению возбудимости нейронов в эпилептических очагах человека.
Рис. 6.
Форма следовой гиперполяризации у нейронов человека и крысы. fAHP – быстрая следовая гиперполяризация; mAHP – средняя следовая гиперполяризация.

Также в нейронах человека 2-го подтипа наблюдалась следовая деполяризация, которая была не выражена в пирамидных клетках крысы и человека (крыса: 0.10 ± 0.10 мВ; H1: 1.0 ± 0.4 мВ; H2: 4.0 ± 1.2 мВ; рис. 5f). Другой особенностью ПД нейронов человека 2-го подтипа была относительно медленная фаза нарастания ПД. Время нарастания с 10 до 90% амплитуды ПД в этих нейронах было больше, чем в пирамидных клетках крысы (крыса: 0.40 ± 0.10 мс; H1: 0.5 ± 0.2 мс; H2: 0.60 ± 0.10 мс; рис. 5h), при этом полуширина ПД для всех трех изученных типов нейронов была одинакова (рис. 5g).
Пассивные биофизические мембранные свойства нейронов
Кроме параметров потенциалзависимых токов, опосредующих генерацию ПД, повышенная возбудимость нейронов в эпилептических очагах в височной коре пациентов с рефрактерной височной эпилепсией может быть связана с особенностями их пассивных мембранных свойств. Поэтому мы провели анализ таких мембранных свойств нейронов, как входное сопротивление, мембранная константа и потенциал покоя.
Мы обнаружили, что нейроны человека, как правило, имели более высокое входное сопротивление мембраны, чем у крысы, хотя достоверное отличие от пирамидных клеток крысы наблюдалось только в нейронах 2-го подтипа (крыса: 149 ± 24 МОм; H1: 543 ± 70 МОм; H2: 1172 ± 133 МОм, рис. 7a). Входное сопротивление определяет величину деполяризации, которой мембрана нейрона отвечает на входящий ток определенной амплитуды, поэтому чем оно выше, тем более возбудимым должен быть такой нейрон.
Рис. 7.
Статистический анализ пассивных мембранных свойств нейронов человека и крысы. (a) – входное сопротивление мембраны, F2,33 = 21.9, p < 0.001; (b) – мембранная константа, F2,31 = 4.5, p < 0.05; (c) – потенциал покоя, F2,33 = 2.6, p = 0.09; * – p < 0.05, ** – p < 0.01 – различия между нейронами человека и крысы; ## – p < 0.01 – различия между нейронами подтипов H1 и H2 (апостериорный тест Тьюки).
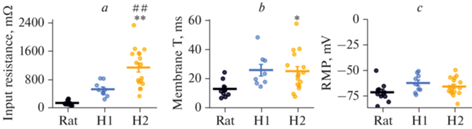
Высокое входное сопротивление может быть связано с уменьшением площади мембраны нейронов или со снижением плотности активных ионных каналов на ней. Так, значительное снижение площади мембраны может происходить при отсечении части дендритного дерева нейрона при изготовлении срезов мозга. Оценить площадь мембраны нейрона можно по ее емкости, которая влияет на мембранную константу. Нейроны человека имели более высокую мембранную константу, чем пирамидные клетки коры крысы, что указывает на большую площадь мембраны нейрона (крыса: 13.2 ± 1.8 с; H1: 26.1 ± 4.0 c; H2: 25.4 ± 3.3 c; рис. 7b). Эти значения также хорошо соотносятся с литературными данными для нейронов человека [11, 20–24] и крысы [9]. Это указывает на то, что усечение дендритного дерева нейронов вряд ли является причиной их высокого наблюдаемого входного сопротивления.
Основную проводимость, определяющую входное сопротивление мембраны нейронов в покое, обеспечивают K+-каналы утечки, которые определяют потенциал покоя нейронов. Поэтому изменение плотности активных K+-каналов может приводить к смещению ионного баланса и влиять на потенциал покоя мембраны, однако в обоих типах нейронов человека потенциал покоя не отличался от такового в пирамидных клетках префронтальной коры крысы (рис. 7c) и соответствовал опубликованным ранее данным для нейронов человека [11, 23–25].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе данной работы были получены образцы ткани мозга от 4 пациентов с рефрактерной височной эпилепсией детского возраста, а также от 4 крыс. В переживающих срезах, приготовленных из этих образцов, были зарегистрированы мембранные свойства для 26 нейронов человека и 10 пирамидных клеток крысы. Нейроны человека по паттерну ответа на деполяризующий ток были разделены на два электрофизиологических типа. Первый тип характеризовался медленным нарастанием частоты потенциалов действия при увеличении деполяризующего тока и ее меньшими максимальными значениями. В нейронах второго типа наблюдалась более выраженная следовая деполяризация после ПД, а время нарастания ПД было больше, чем у первого типа. Также, нейроны второго типа в височной коре человека имели более высокое входное сопротивление. В отличие от ранее опубликованных данных, входное сопротивление в зарегистрированных нейронах человека было крайне высоким, в 4–10 раз выше, чем в пирамидных клетках крысы.
Методические ограничения
Ограничения на интерпретацию результатов данной работы накладывает гетерогенность материалов, вошедших в исследование. Образцы мозга были получены от пациентов разного пола и возраста, с различной этиологией эпилепсии. По этой причине, характеристики нейронов у разных пациентов могут быть неоднородными. В нашей работе мы выделили два электрофизиологических типа нейронов, но связи между клиническими данными пациентов и свойствами их нейронов не наблюдалось, поэтому мы предполагаем, что такая классификация не связана с разделением пациентов на две группы по каким-либо параметрам.
Методика приготовления переживающих срезов из послеоперационного материала также может быть источником определенной вариации в регистрируемых свойствах нейронов. Во-первых, область коры, подлежащая удалению, выбирается исходя из локализации эпилептического очага, и различается для каждого пациента. Во-вторых, во время операции удаляемый участок подвергается механической деформации, воздействию высокой температуры от электрокоагулятора, а также неизбежной ишемии. Все эти воздействия по возможности минимизируются в ходе операции, но полностью избежать их невозможно. После удаления участок мозга транспортируется в лабораторию для приготовления переживающих срезов, что занимает 30–60 мин. Все это приводит к гибели нейронов в ткани мозга, и нейрофизиологические эксперименты выполняются на популяции нейронов, которые сохранили жизнеспособность в описанных условиях. Существует определенная вероятность того, что полученная выборка нейронов не является репрезентативной, так как различные типы нейронов обладают различной жизнеспособностью. Однако это вряд ли может объяснить такие наблюдаемые параметры нейронов, как высокое входное сопротивление и высокую частоту генерации ПД, поскольку нейроны с описанными свойствами практически не встречаются в описанных выборках как для человека, так и для крысы, и вероятность того, что это результат специфического отбора, крайне низка. Хотя большинство авторов использовали при приготовлении срезов и транспортировке раствор на основе сахарозы [26–30], а не ИСМЖ, в целом используемая нами методика приготовления переживающих срезов существенно не отличается от применяемой в других работах.
Особенности рефрактерной эпилепсии у детей
Всем пациентам, от которых были получены образцы ткани мозга в ходе данного исследования, было рекомендовано хирургическое удаление судорожных очагов для лечения рефрактерной височной эпилепсии. Применение такого метода считается оправданным в случаях, когда приступы оказываются устойчивы как минимум к двум различным фармакологическим протоколам, и продолжают наносить существенный ущерб качеству жизни пациента. Хирургическое лечение эпилепсии в раннем возрасте обеспечивает более благоприятный прогноз для качества жизни и умственного развития ребенка в дальнейшем [4]. На сегодняшний день в литературе описан ряд потенциальных механизмов, которые могут приводить к фармакорезистентности эпилептических судорог, в их числе генетический, транспортерный, нейросетевой и ряд других [31]. Так, в ткани мозга пациентов с рефрактерной эпилепсией показана увеличенная экспрессия P-гликопротеидов в клетках эндотелия и астроцитах [32]. P-гликопротеиды обеспечивают транспорт различных фармакологических агентов, включая противосудорожные препараты, в кровь, снижая таким образом проницаемость гематоэнцефалического барьера для этих веществ [2]. Это может приводить к снижению концентрации противосудорожных препаратов в ткани мозга ниже эффективной для подавления судорог, и развитию фармакорезистентности. Другим потенциальным механизмом являются вызванные судорогами изменения свойств или распределения фармакологических мишеней противоэпилептических препаратов [33]. Так, показано, что в нейронах височной коры пациентов с судорогами, устойчивыми к карбамазепину, блокада открытых Na+-каналов карбамазепином не наблюдалась, в отличие от пациентов, для которых этот препарат был эффективен [34]. В то же время, такие сведения имеются далеко не для всех препаратов, которые получали вошедшие в данное исследование пациенты. Ранний возраст проявления рефрактерной эпилепсии может свидетельствовать в пользу ее генетического механизма. Однако у большинства пациентов, от которых в ходе данной работы были получены образцы ткани мозга, эпилепсия носила приобретенный характер и была связана с такими факторами, как травма, воспалительные заболевания и новообразования в мозге, поэтому общий генетический механизм для этих случаев кажется маловероятным.
Электрофизиологические типы нейронов, выявленные в височной коре человека
Все зарегистрированные в височной коре человека нейроны мы разделили на два электрофизиологических подтипа. В рамках данной работы не производилась морфологическая реконструкция изученных нейронов, поэтому определить их принадлежность к тому или иному морфологическому типу не представляется возможным. Можно предположить, что одна из этих групп соответствует популяции возбуждающих пирамидных клеток, а вторая представляет собой выборку различных нейронов других типов, вероятно, тормозных. У крыс свойства потенциалов действия пирамидных клеток и интернейронов значительно различаются. Интернейроны коры крыс демонстрируют более высокую частоту потенциалов действия по сравнению с пирамидными клетками, а также более быструю кинетику ПД и более выраженную следовую гиперполяризацию [35]. Аналогичные различия в мембранных свойствах возбуждающих и тормозных нейронов наблюдаются и у приматов, что показано для длиннохвостой макаки [36]. Ранее было показано, что интернейроны в височной коре пациентов с височной эпилепсией также демонстрируют относительно высокую частоту генерации ПД и высокое входное сопротивление по сравнению с пирамидными клетками в той же области [37]. В то же время мы наблюдали высокую амплитуду следовой гиперполяризации и отсутствие частотной адаптации в обоих типах исследованных нейронов, что не позволяет уверенно соотнести эти две группы с теми или иными популяциями нейронов, известными по данным литературы. Вероятно, данные особенности связаны с физиологической незрелостью нейронов в мозге детей, из-за чего их свойства отличаются от наблюдающихся у взрослых пациентов. Другим возможным объяснением может быть то, что оба выделенных типа нейронов относятся к одному морфофизиологическому типу, но различаются либо по подтипу, либо по физиологическому состоянию, либо по степени зрелости. Для ответа на этот вопрос требуются дальнейшие эксперименты с применением морфологической реконструкции исследованных нейронов.
Нейроны в эпилептических очагах мозга человека обладают высоким входным сопротивлением
В нейронах височной коры пациентов с рефрактерной эпилепсией мы наблюдали крайне высокое входное сопротивление, в 4–10 раз выше, чем в пирамидных клетках крысы. Данная особенность приводила к высокой возбудимости нейронов в эпилептических очагах. Можно предположить, что высокая возбудимость нейронов является особенностью патологического изменения ткани мозга в эпилептических очагах, однако в ранее опубликованных работах, выполненных на послеоперационном материале, полученном от больных с рефрактерной эпилепсией, она не наблюдалась. Так, в работе Berg и соавт. был проведен кластерный анализ транскриптомно-физиологических подтипов пирамидных нейронов в височной коре человека и выделено пять различных подтипов, из которых один характеризовался входным сопротивлением порядка 300 МОм, тогда как для остальных подтипов пирамидных нейронов этот параметр имел значения около 100–150 МОм [26]. Banerjee и соавт. исследовали электрофизиологические свойства нейронов из областей с фокальной кортикальной дисплазией и сообщили о входном сопротивлении, равном 174 ± 21 МОм [20]. Очень близкие к этим значения (153.2 ± 27.3 МОм) наблюдались в нейронах 2–3-го слоев височной коры у взрослых пациентов с фармакорезистентной височной эпилепсией [21], а также с эпилепсией или опухолями мозга [22]. Сравнение кортикальных нейронов крысы и человека и ранее выявляло различия во входном сопротивлении, однако величина этих различий была либо умеренной (63.8 ± 4.5 МОм у крысы и 86.1 ± 8.1 МОм у человека) [23], либо незначительной (38.8 ± 21.4 МОм у крысы и 43.3 ± 24.5 МОм у человека) [24]. Другой возможной причиной для такой особенности является детский возраст вошедших в исследование пациентов. Большинство опубликованных в литературе данных получено на образцах ткани взрослых пациентов. Tasker и соавт. в своей работе [11] сообщают о величине входного сопротивления нейронов в образцах ткани мозга детей порядка 70 МОм, что ниже, чем у зарегистрированных нами нейронов крысы. Однако в этой работе применялась регистрация при помощи тонких внутриклеточных электродов. Ограничением такой методики является, с одной стороны, высокое последовательное сопротивление электродов, а с другой – значительный ток утечки в точке контакта с мембраной, что приводит к занижению измеряемой величины входного сопротивления мембраны нейронов. Можно предположить, что регистрируемые нами в нейронах височной коры значения входного сопротивления характерны именно для случаев эпилепсии детского возраста.
Нейроны человека демонстрировали высокую частоту потенциалов действия
Высокое входное сопротивление в нейронах коры мозга человека приводило к повышению их возбудимости. Так, низкие по сравнению с нейронами крысы значения тока реобазы, тока максимальной частоты и тока, приводящего к деполяризационному блоку, вероятнее всего, объясняются именно высоким входным сопротивлением. С другой стороны, нейроны человека демонстрировали такие особенности, как отсутствие частотной адаптации и высокая максимальная частота ПД. Частотная адаптация ПД в нейронах связана с работой BK-каналов, а также K+-каналов M-типа [38]. Таким образом, отсутствие частотной адаптации в нейронах может быть связано либо с отсутствием в них данных каналов, либо с их дисфункцией. Существуют сведения о связи наследственной дисфункции K+-каналов M-типа с идиопатической эпилепсией [39]. Дисфункции BK-каналов могут приводить к двигательным расстройствам [40], однако данных об их связи с эпилепсией на сегодняшний день в литературе нет. Не исключено, что отсутствие этих каналов в исследованных нейронах связано с их физиологическим подтипом, однако нам кажется маловероятным, что пирамидные нейроны, составляющие около 80% популяции нейронов коры, практически не вошли в случайную выборку. Вероятнее всего, как минимум значительная часть изученных нейронов являются пирамидными клетками, демонстрирующими отсутствие частотной адаптации.
В нейронах височной коры человека, содержащей эпилептические очаги, для ПД характерны низкие пороги генерации и быстрая следовая гиперполяризация
Большинство зарегистрированных нами нейронов в височной коре человека демонстрировали низкие по сравнению с нейронами крысы пороги генерации ПД. Порог генерации ПД определяется в первую очередь свойствами потенциалзависимых Na+-каналов в начальном сегменте аксона. Низкий порог генерации ПД означает, что Na+-каналы открываются в ответ на меньшую деполяризацию мембраны, что должно приводить к гипервозбудимости нейрона. Экспрессия различных изоформ потенциалзависимых Na+-каналов меняется в ходе онтогенеза, а с мутациями в изоформе Nav1.6 связаны различные патологии ЦНС, включая рефрактерную височную эпилепсию [41]. Ранее в литий-пилокарпиновой модели на крысах было показано повышение порогов генерации ПД в нейронах префронтальной коры на первые сутки после вызванного введением пилокарпина судорожного припадка [9]. Однако данные изменения относятся к острым последствиям судорожного припадка и раннему периоду эпилептогенеза, поэтому могут отличаться от изменений в эпилептизированном мозге. В работе Nomura и соавт., в которой проводилось сравнение параметров ПД в нейронах крысы и пациентов с височной эпилепсией, значимые различия между порогами генерации ПД в этих нейронах не наблюдались, для крысы они составили –33.0 ± 1.9 мВ, для нейронов в эпилептической височной коре с нормальной морфологией –31.1 ± 2.9 мВ и для нейронов человека в областях с фокальной кортикальной дисплазией –44.4 ± 6.1 мВ (p = 0.064) [42]. Таким образом, наблюдаемый нами негативный сдвиг порогов генерации потенциалов действия может быть свидетельством патологических изменений в работе Na+-каналов, как наследственных, так произошедших вследствие эпилептогенеза.
Другой характерной особенностью, выявленной нами в нейронах височной коры человека, является большая амплитуда быстрой следовой гиперполяризации, тогда как средняя следовая гиперполяризация (mAHP) в этих нейронах практически отсутствует. Можно предположить, что увеличение относительного вклада средней фазы следовой гиперполяризации, за которую отвечают BK-каналы, вносит вклад в гипервозбудимость нейронов за счет уменьшения межспайковых интервалов [18, 19]. С другой стороны, высокая амплитуда быстрой следовой гиперполяризации характерна для интернейронов коры как у грызунов [35], так и у приматов [36]. Однако, как говорилось выше, трудно предположить, что все исследованные клетки являются интернейронами, поэтому данная особенность, вероятно, свидетельствует о большом вкладе BK-каналов в следовую гиперполяризацию нейронов человека в эпилептических очагах, что может приводить к повышению их возбудимости.
Список литературы
Fiest KM, Sauro KM, Wiebe S, Patten SB, Kwon C-S, Dykeman J, Pringsheim T, Lorenzetti DL, Jetté N (2017) Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology 88: 296–303. https://doi.org/10.1212/WNL.0000000000003509
Löscher W, Potschka H, Sisodiya SM, Vezzani A (2020) Drug resistance in epilepsy: clinical impact, potential mechanisms, and new innovative treatment options. Pharmacol Rev 72: 606–638. https://doi.org/10.1124/pr.120.019539
Braun KPJ (2017) Preventing cognitive impairment in children with epilepsy. Curr Opin Neurol 30: 140–147. https://doi.org/10.1097/WCO.0000000000000424
Jayalakshmi S, Vooturi S, Gupta S, Panigrahi M (2017) Epilepsy surgery in children. Neurology India 65: 485. https://doi.org/10.4103/neuroindia.NI_1033_16
Englot DJ, Rolston JD, Wang DD, Sun PP, Chang EF, Auguste KI (2013) Seizure outcomes after temporal lobectomy in pediatric patients. J Neurosurg Pediatr 12: 134–141. https://doi.org/10.3171/2013.5.PEDS12526
Curia G, Lucchi C, Vinet J, Gualtieri F, Marinelli C, Torsello A, Costantino L, Biagini G (2014) Pathophysiogenesis of mesial temporal lobe epilepsy: Is prevention of damage antiepileptogenic? Curr Med Chem 21: 663–688.
Albrecht J, Zielińska M (2017) Mechanisms of excessive extracellular glutamate accumulation in temporal lobe epilepsy. Neurochem Res 42: 1724–1734. https://doi.org/10.1007/s11064-016-2105-8
Wong-Kisiel LC, Blauwblomme T, Ho M-L, Boddaert N, Parisi J, Wirrell E, Nabbout R (2018) Challenges in managing epilepsy associated with focal cortical dysplasia in children. Epilepsy Res 145: 1–17. https://doi.org/10.1016/j.eplepsyres.2018.05.006
Smirnova EY, Amakhin DV, Malkin SL, Chizhov AV, Zaitsev AV (2018) Acute changes in electrophysiological properties of cortical regular-spiking cells following seizures in a rat lithium–pilocarpine model. Neuroscience 379: 202–215. https://doi.org/10.1016/j.neuroscience.2018.03.020
Huberfeld G, Blauwblomme T, Miles R (2015) Hippocampus and epilepsy: Findings from human tissues. Rev Neurol (Paris) 171: 236–251. https://doi.org/10.1016/j.neurol.2015.01.563
Tasker JG, Hoffman NW, Kim YI, Fisher RS, Peacock WJ, Dudek FE (1996) Electrical properties of neocortical neurons in slices from children with intractable epilepsy. J Neurophysiol 75: 931–939. https://doi.org/10.1152/jn.1996.75.2.931
Kroon T, van Hugte E, van Linge L, Mansvelder HD, Meredith RM (2019) Early postnatal development of pyramidal neurons across layers of the mouse medial prefrontal cortex. Sci Rep 9: 5037. https://doi.org/10.1038/s41598-019-41661-9
Juraska JM, Drzewiecki CM (2020) Cortical reorganization during adolescence: What the rat can tell us about the cellular basis. Dev Cogn Neurosci 45: 100857. https://doi.org/10.1016/j.dcn.2020.100857
Harris CR, Millman KJ, van der Walt SJ, Gommers R, Virtanen P, Cournapeau D, Wieser E, Taylor J, Berg S, Smith NJ, Kern R, Picus M, Hoyer S, van Kerkwijk MH, Brett M, Haldane A, del Río JF, Wiebe M, Peterson P, Gérard-Marchant P, Sheppard K, Reddy T, Weckesser W, Abbasi H, Gohlke C, Oliphant TE (2020) Array programming with NumPy. Nature 585: 357–362. https://doi.org/10.1038/s41586-020-2649-2
Virtanen P, Gommers R, Oliphant TE, Haberland M, Reddy T, Cournapeau D, Burovski E, Peterson P, Weckesser W, Bright J, van der Walt SJ, et al. (2020) SciPy 1.0: Fundamental algorithms for scientific computing in Python. Nat Methods 17: 261–272. https://doi.org/10.1038/s41592-019-0686-2
Campagnola L, Kratz MB, Manis PB (2014) ACQ4: An open-source software platform for data acquisition and analysis in neurophysiology research. Front Neuroinform 8: 3. https://swharden.com/pyabf/https://doi.org/10.3389/fninf.2014.00003
Hunter JD (2007) Matplotlib: A 2D Graphics Environment. Comput Sci Eng 9: 90–95. https://doi.org/10.1109/MCSE.2007.55
Jaffe DB, Brenner R (2018) A computational model for how the fast afterhyperpolarization paradoxically increases gain in regularly firing neurons. J Neurophysiol 119: 1506–1520. https://doi.org/10.1152/jn.00385.2017
Gu N, Vervaeke K, Storm JF (2007) BK potassium channels facilitate high-frequency firing and cause early spike frequency adaptation in rat CA1 hippocampal pyramidal cells. J Physiol 580: 859–882. https://doi.org/10.1113/jphysiol.2006.126367
Banerjee J, Dey S, Dixit AB, Doddamani R, Sharma MC, Garg A, Chandra PS, Tripathi M (2020) GABAA receptor-mediated epileptogenicity in focal cortical dysplasia (FCD) depends on age at epilepsy onset. Front Cell Neurosci 14: 562811. https://doi.org/10.3389/fncel.2020.562811
Lehnhoff J, Strauss U, Wierschke S, Grosser S, Pollali E, Schneider UC, Holtkamp M, Dehnicke C, Deisz RA (2019) The anticonvulsant lamotrigine enhances Ih in layer 2/3 neocortical pyramidal neurons of patients with pharmacoresistant epilepsy. Neuropharmacology 144: 58–69. https://doi.org/10.1016/j.neuropharm.2018.10.004
Bocchio M, Lukacs IP, Stacey R, Plaha P, Apostolopoulos V, Livermore L, Sen A, Ansorge O, Gillies MJ, Somogyi P, Capogna M (2018) Group II metabotropic glutamate receptors mediate presynaptic inhibition of excitatory transmission in pyramidal neurons of the human cerebral cortex. Front Cell Neurosci 12: 508. https://doi.org/10.3389/fncel.2018.00508
Verhoog MB, Goriounova NA, Obermayer J, Stroeder J, Hjorth JJJ, Testa-Silva G, Baayen JC, de Kock CPJ, Meredith RM, Mansvelder HD (2013) Mechanisms underlying the rules for associative plasticity at adult human neocortical synapses. J Neurosci 33: 17197–17208. https://doi.org/10.1523/JNEUROSCI.3158-13.2013
Teichgräber LA, Lehmann T-N, Meencke H-J, Weiss T, Nitsch R, Deisz RA (2009) Impaired function of GABAB receptors in tissues from pharmacoresistant epilepsy patients. Epilepsia 50: 1697–1716. https://doi.org/10.1111/j.1528-1167.2009.02094.x
Tóth K, Hofer KT, Kandrács Á, Entz L, Bagó A, Erőss L, Jordán Z, Nagy G, Sólyom A, Fabó D, Ulbert I, Wittner L (2018) Hyperexcitability of the network contributes to synchronization processes in the human epileptic neocortex. J Physiol (Lond) 596: 317–342. https://doi.org/10.1113/JP275413
Berg J, Sorensen SA, Ting JT, Miller JA, Chartrand T, Buchin A, Bakken TE, Budzillo A, Dee N, Ding S-L, et al. (2021) Human neocortical expansion involves glutamatergic neuron diversification. Nature 598: 151–158. https://doi.org/10.1038/s41586-021-03813-8
Levinson S, Tran CH, Barry J, Viker B, Levine MS, Vinters HV, Mathern GW, Cepeda C (2020) Paroxysmal discharges in tissue slices from pediatric epilepsy surgery patients: critical role of GABAB receptors in the generation of ictal activity. Front Cell Neurosci 14: 54. https://doi.org/10.3389/fncel.2020.00054
Kraus L, Monni L, Schneider UC, Onken J, Spindler P, Holtkamp M, Fidzinski P (2020) Preparation of acute human hippocampal slices for electrophysiological recordings. J Vis Exp 159: e61085. https://doi.org/10.3791/61085
Kandrács Á, Hofer KT, Tóth K, Tóth EZ, Entz L, Bagó AG, Erőss L, Jordán Z, Nagy G, Fabó D, Ulbert I, Wittner L (2019) Presence of synchrony-generating hubs in the human epileptic neocortex. J Physiol 597.23: 5639–5670. https://doi.org/10.1113/JP278499
Holtkamp D, Opitz T, Niespodziany I, Wolff C, Beck H (2017) Activity of the anticonvulsant lacosamide in experimental and human epilepsy via selective effects on slow Na+ channel inactivation. Epilepsia 58: 27–41. https://doi.org/10.1111/epi.13602
Tang F, Hartz AMS, Bauer B (2017) Drug-resistant epilepsy: multiple hypotheses, few answers. Front Neurol 8: 301. https://doi.org/10.3389/fneur.2017.00301
Kwan P, Brodie MJ (2005) Potential role of drug transporters in the pathogenesis of medically intractable epilepsy. Epilepsia 46: 224–235. https://doi.org/10.1111/j.0013-9580.2005.31904.x
Remy S, Beck H (2006) Molecular and cellular mechanisms of pharmacoresistance in epilepsy. Brain 129: 18–35. https://doi.org/10.1093/brain/awh682
Remy S, Gabriel S, Urban BW, Dietrich D, Lehmann TN, Elger CE, Heinemann U, Beck H (2003) A novel mechanism underlying drug resistance in chronic epilepsy. Ann Neurol 53: 469–479. https://doi.org/10.1002/ana.10473
Malkin SL, Kim KK, Tikhonov DB, Zaitsev AV (2014) Properties of spontaneous and miniature excitatory postsynaptic currents in neurons of the rat prefrontal cortex. J Evol Biochem Physiol 50: 506–514. https://doi.org/10.1134/S0022093014060052
Krimer LS, Zaitsev AV, Czanner G, Kröner S, González-Burgos G, Povysheva NV, Iyengar S, Barrionuevo G, Lewis DA (2005) Cluster analysis–based physiological classification and morphological properties of inhibitory neurons in layers 2–3 of monkey dorsolateral prefrontal cortex. J Neurophysiol 94: 3009–3022. https://doi.org/10.1152/jn.00156.2005
Menendez de la Prida L, Benavides-Piccione R, Sola R, Pozo MA (2002) Electrophysiological properties of interneurons from intraoperative spiking areas of epileptic human temporal neocortex. Neuroreport 13: 1421–1425. https://doi.org/10.1097/00001756-200208070-00015
Benda J, Herz AVM (2003) A universal model for spike-frequency adaptation. Neural Comput 15: 2523–2564.https://doi.org/10.1162/089976603322385063
Neubauer BA, Waldegger S, Heinzinger J, Hahn A, Kurlemann G, Fiedler B, Eberhard F, Muhle H, Stephani U, Garkisch S, Eeg-Olofsson O, Müller U, Sander T (2008) KCNQ2 and KCNQ3 mutations contribute to different idiopathic epilepsy syndromes. Neurology 71: 177–183. https://doi.org/10.1212/01.wnl.0000317090.92185.ec
Miller JP, Moldenhauer HJ, Keros S, Meredith AL (2021) An emerging spectrum of variants and clinical features in KCNMA1-linked channelopathy. Channels (Austin) 15: 447–464. https://doi.org/10.1080/19336950.2021.1938852
Zybura A, Hudmon A, Cummins TR (2021) Distinctive Properties and Powerful Neuromodulation of Nav1.6 Sodium Channels Regulates Neuronal Excitability. Cells 10: 1595. https://doi.org/10.3390/cells10071595
Nomura S, Kida H, Hirayama Y, Imoto H, Inoue T, Moriyama H, Mitsushima D, Suzuki M (2019) Reduction of spike generation frequency by cooling in brain slices from rats and from patients with epilepsy. J Cereb Blood Flow Metab 39: 2286–2294. https://doi.org/10.1177/0271678X18795365
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова