Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 339-353
Значение йодсодержащих тиреоидных гормонов в постфрактурных изменениях функции и структуры нижней челюсти крыс при стрессе
И. В. Городецкая 1, Т. Н. Маркевич 1, *
1 Витебский государственный ордена Дружбы народов медицинский университет
Витебск, Беларусь
* E-mail: tanya.markevich86@mail.ru
Поступила в редакцию 15.12.2021
После доработки 19.01.2022
Принята к публикации 21.01.2022
- EDN: YYKOWF
- DOI: 10.31857/S0869813922030025
Аннотация
Перелом нижней челюсти – самая распространенная травма челюстно-лицевой области, инициирующая помимо нарушения функции жевания стресс-реакцию. Предыдущие исследования протекторной роли йодсодержащих тиреоидных гормонов при стрессе не были сфокусированы на костной ткани, несмотря на то, что стресс оказывает на нее негативное влияние. Цель работы – установить воздействие йодсодержащих гормонов щитовидной железы на изменение функции и структуры мандибулярной кости, вызванное ее травматическим повреждением при стрессе. Работа выполнена на 130 беспородных половозрелых крысах-самцах. Стресс – “свободное плавание в клетке”, перелом – моделирование отверстия d 2.0 мм в теле нижней челюсти. Модуляция тиреоидного статуса: гипотиреоз – мерказолил (внутрижелудочно, 25 мг/кг, 20 дней); малые дозы L-тироксина (таким же способом 1.5–3.0 мкг/кг, 28 дней). Функцию нижней челюсти оценивали по скорости обработки пищи разной степени жесткости, жевательной эффективности, времени жевания, глубине укуса; структуру – морфологически и рентгенологически. Гипотиреоз замедляет процесс ремоделирования после травматического повреждения нижней челюсти – изолированного и в комбинации со стрессом, в результате чего ухудшает функцию жевания в этих условиях. Введение L-тироксина способствует интенсификации репаративной регенерации в костной ткани, что ускоряет темп восстановления жевательного аппарата. Полученные результаты свидетельствуют о существенном значении тиреоидного статуса в постфрактурной реабилитации жевательной функции и восстановлении микроструктуры нижнечелюстной кости в условиях стресса.
Исследование регуляции ремоделирования костной ткани в норме и патологии является важной задачей не только физиологии, но и медицины в связи с участием скелета в опорно-механической и защитной функциях, процессе гемопоэза, минеральном обмене. Существенное и непосредственное влияние, сдвигающее баланс процессов резорбции и регенерации кости, оказывает стресс [1], вызывая нарушение активности всех типов костных клеток. В свою очередь, это приводит к структурным изменениям минеральных и органических составляющих матрикса [2]. Важное значение в антистрессовой защите имеют йодсодержащие тиреоидные гормоны (ЙТГ) [3, 4], оказывающие, в том числе, и прямое влияние на костный обмен: трийодтиронин стимулирует образование одной из субъединиц тиреотропного гормона (TТГ-β) макрофагами костномозгового происхождения, образующими своеобразный эндокринный комплекс с микросредой костного мозга. В свою очередь, ТТГ проявляет анаболическое и остеопротекторное действие в костной ткани, стимулируя дифференцировку остеобластов и ингибируя образование остеокластов [5].
И недостаток, и избыток ЙТГ негативно влияют на костный обмен, вызывая снижение плотности костной ткани и сужение просвета остеонов [6, 7]. Значимые последствия практически для всех функций организма влекут за собой нарушения в челюстно-лицевой области, закономерно развивающиеся при изменениях функции щитовидной железы [8]. Часто встречающейся патологией зубочелюстного комплекса является перелом нижней челюсти [9]. Повреждение мандибулярной кости само по себе является стрессовым фактором и существенно ухудшает процесс жевания.
Вместе с тем, влияние ЙТГ на жевательную функцию и строение нижней челюсти после ее перелома в условиях стресса не изучено. Цель работы – установить воздействие йодсодержащих гормонов щитовидной железы на изменение функции и структуры мандибулярной кости, вызванное ее травматическим повреждением при стрессе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования послужили 130 белых беспородных крыс-самцов массой 180–230 г. Эксперименты проводились в осенне-зимний период в одно и тоже время (утром). Крысы содержались на диете вивария с соблюдением стандартных условий в соответствии с нормами содержания лабораторных животных (СанПиН 2.1.2.12.-18-2006 “Устройство, оборудование и содержание экспериментально-биологических клиник (вивариев)”). При проведении экспериментов соблюдали требования гуманного обращения с животными, изложенные в методических указаниях “Положение о порядке использования лабораторных животных в научно-исследовательских работах и педагогическом процессе учреждения образования “Витебский государственный ордена Дружбы народов медицинский университет” и мерах по реализации требований биомедицинской этики” – 2010 г.
Были сформированы 13 групп: “Интактные”, “Контроль”, “Стресс”, “Перелом”, “Перелом + стресс”, “Мерказолил”, “Мерказолил + стресс”, “Мерказолил + перелом”, “Мерказолил + перелом + стресс”, “Тироксин”, “Тироксин + стресс”, “Тироксин + + перелом”, “Тироксин + перелом + стресс”.
Стресс осуществляли по методике “свободное плавание в клетке”: крыс по 5 особей помещали в пластиковую клетку размером 50 × 30 × 20 см, заполненную водой комнатной температуры на высоту 15 см. Процедуру проводили по 30 мин ежедневно в течение 14 суток [10].
Моделирование перелома: после фиксации животного за 4 конечности на специальном столике в положении на спине подавали эфирный наркоз. Минимально инвазивно проводили доступ к телу мандибулярной кости: скальпелем делали разрез кожи по краю нижней челюсти и частично отслаивали передне-нижний край жевательной мышцы. Шаровидным твердосплавным бором, используя портативную бормашину (УС-01 Селена-2000, Россия), производили дефект – отверстие диаметром 2.0 мм. Рану ушивали.
Комбинированное воздействие перелома и стресса: крыс подвергали процедуре “свободного плавания в клетке” (по вышеприведенной схеме) на следующий день после нанесения костной раны.
Подавление функции щитовидной железы у животных достигали введением тиреостатика мерказолила (ООО “Фармацевтическая компания “Здоровье”, Украина) в дозе 25 мг/кг в течение 20 суток в 1%-ном крахмальном клейстере внутрижелудочно с помощью зонда с шаровидным наконечником. L-тироксин (L-Т4) (Berlin-Chemie AG, “Менарини Групп”, Германия) вводили аналогичным способом в течение 28 суток в постепенно нарастающих дозах (от 1.5 до 3.0 мкг/кг), которые, как было установлено ранее, не оказывали влияния на прирост массы тела крыс, частоту сердечных сокращений и уровень ЙТГ в крови [3, 4], что позволило классифицировать их как малые, близкие к физиологическим.
Крыс выводили из эксперимента путем декапитации под уретановым наркозом (1 г/кг, внутрибрюшинно) на 14-й день через 1 ч после последней процедуры стрессирования (группы “Стресс”, “Мерказолил + стресс” и “Тироксин + стресс”), на 15-й день после травматического повреждения нижней челюсти – изолированного (группы “Перелом”, “Мерказолил + перелом” и “Тироксин + перелом”) и в сочетании со стрессом (группы “Перелом + стресс”, “Мерказолил + перелом + стресс” и “Тироксин + перелом + стресс”).
Чтобы исключить влияние на изучаемые показатели самой процедуры введения препаратов, крысам всех групп за исключением интактных вводили 1%-ный крахмальный клейстер таким же способом и в течение такого же времени (группы “Контроль”, “Стресс”, “Перелом”, “Перелом + стресс”). Животных забивали на следующие сутки после окончания введения крахмального клейстера (группа “Контроль”) или препаратов, модулирующих тиреоидный статус (группы “Мерказолил” и “Тироксин”).
Функцию жевания оценивали по: 1) скорости пережевывания пищи различной степени жесткости (мел, орех); 2) жевательной эффективности; 3) времени жевания; 4) глубине укуса. Для подготовки к проведению указанных проб животных на 2 суток пересаживали в индивидуальные пластиковые контейнеры размером 45 × 30 × 30 см, чтобы исключить влияние на указанные параметры стресса, который могла вызвать эта процедура. Все тесты осуществляли в этих же клетках. В группах “Стресс”, “Мерказолил + стресс” и “Тироксин + стресс” пробу с мелом проводили на 13-й день стрессирования, как и определение времени жевания и глубины укуса; пробу с орехом и исследование жевательной эффективности – на 14-й день. В группах “Перелом”, “Мерказолил + перелом”, “Тироксин + перелом”, “Перелом + стресс”, “Мерказолил + перелом + стресс” и “Тироксин + перелом + стресс” пробы проводились соответственно на 14-й и 15-й дни, в группах “Контроль”, “Мерказолил” и “Тироксин” – накануне и в день окончания введения крахмального клейстера (“Контроль”) или препаратов, влияющих на тиреоидный статус (группы “Мерказолил” и “Тироксин”). После окончания первого комплекса проб животных не кормили.
Скорость обработки пищи определяли, давая крысе в течение 2 мин грызть предварительно взвешенную (весы DIGITAL SCALE (CAPACITY: 200g × 0.01G)) меловую палочку (толщиной 7 мм и длиной 1.5 см) (пища средней жесткости) или миндальный орех (приблизительная масса 2 г) (жесткая пища). Учитывали лишь то время, которое животное производило жевательные движения, при их отсутствии секундомер останавливали. По истечении указанного времени палочку или орех повторно взвешивали. Скорость пережевывания устанавливали по разнице массы мела или миндального ореха до и после пробы.
Жевательную эффективность оценивали, используя собственную модификацию пробы Гельмана: после разжевывания ореха животное декапитировали, выделяли желудок и вскрывали по малой кривизне. Содержимое с помощью пипетки Пастера вымывали 0.9%-ным раствором NaCl на кусок марли, на котором его опускали на дно стеклянной колбы. Сосуд помещали в водяную баню (70°С). Содержимое просушивали в течение 15 мин. Полученную массу взвешивали и просеивали через сито с диаметром отверстий 0.3 мм. Остаток ореха на сите взвешивали, высчитывали отношение массы оставшегося ореха к массе пережеванного ореха, забранного из желудка, которое выражали в процентах.
Время жевания устанавливали с помощью секундомера, давая крысе грызть 1 г моркови. При этом учитывали лишь то время, которое животное ело морковь.
Глубину укуса определяли с помощью специальной слепочной ложки и периодонтального зонда по самому глубокому месту на отпечатке нижних левых моляров в силиконовой слепочной массе (Zhermack Zetaplus).
Гистологические препараты для морфологического исследования изготавливали следующим образом: нижнюю челюсть фиксировали в забуференном 10%-ном нейтральном формалине, подвергали декальцинации в 5%-ном растворе муравьиной кислоты, проводили через батарею спиртов для обезжиривания и заливали в парафин; срезы делали толщиной 5–7 мкм, окрашивали гематоксилином и эозином. Фотодокументирование осуществляли на оборудовании Leiсa Microsystems (Германия). Для получения сопоставимых данных строго выдерживали продолжительность фиксации, декальцинации, заливки, толщину срезов и технологию окрашивания. Обработку полученного от животных материала с момента фиксации и до заключения в парафин проводили параллельно.
В каждом препарате исследовали 5 полей зрения. Количество плотной неоформленной соединительной ткани (ПНСТ) оценивали следующим образом: 0 (не наблюдается ни в одном поле зрения), 1 (визуализируется в 1–2 полях), 2 (в 3–4) и 3 (во всех полях зрения); островков хрящевой (ОХТ) и незрелой костной ткани (ОНКТ) – как 0 (нет во всех полях), 1 (1–2 островка во всех 5 полях), 2 (3–4 во всех 5 полях) и 3 (5 и более островков во всех 5 полях). Количество коллагеновых волокон определяли с помощью измерительной сетки Автандилова для цитогистостереометрических исследований. Указанные исследования проводили в области костного дефекта. В ткани, прилежащей к ней, рассчитывали площадь гаверсовых каналов (ПГК) по формуле: S = πab, где S – площадь эллипса, π – 3.1415, a – длина большой полуоси, b – длина малой полуоси. Длины полуосей измеряли с помощью изготовленной самостоятельно сетки (квадрат из плотной прозрачной пленки с размером стороны 5 см), в центр которой были нанесены две перпендикулярные линии с миллиметровыми делениями. Точку их пересечения накладывали на середину длинной полуоси канала. С помощью помещенной на каждом препарате линейки (масштаб 10 мкм) производили перерасчет мм в мкм. На каждом препарате измеряли самый крупный и самый мелкий каналы и рассчитывали среднюю площадь.
Плотность костной ткани и размер дефекта исследовали рентгенологически с помощью визиографа (RIOSensor RIS500 Ray Co., Ltd., Корея) и программы Vidar Dicom Viewer 3 (HWID: nLjhdJWWQTmPHAeqKg3uiILRJCuafq8E). Измерения производили в области корней первого левого моляра на рентгенограммах нижних челюстей животных.
Расчеты и обработку результатов проводили с применением пакета прикладных программ “STATISTICA 10.0” (StatSoftinc., STA999K347156-W). Для определения характера распределения признака использовали тест Шапиро–Уилка. Характер распределения признака в наших экспериментах не соответствовал нормальному, поэтому применяли методы непараметрической статистики. В межгрупповом сравнении и проведении анализа различий по количественным параметрам использовали U-критерий Манна–Уитни. Количество ОНКТ, ПНСТ и ОХТ представляли в виде абсолютных и относительных частот, остальные параметры в виде Ме (LQ; UQ), где Ме – медиана, LQ – нижний квартиль, UQ – верхний квартиль. Критическим уровнем значимости был принят p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У интактных животных скорость обработки ореха составила 0.73 (0.72; 0.84) г/мин, мела 0.76 (0.61; 0.86) г/мин, жевательная эффективность 98 (100; 94)%, глубина укуса 1.44 (1.35; 1.6) мм, время жевания 0.35 (0.33; 0.40) мин, ПГК 0.31 (0.19; 0.49) мкм2, плотность мандибулярной костной ткани 1030 (1013; 1036) единиц Хаунсфилда (HU).
Введение крысам 1%-ного крахмального клейстера (группа “Контроль”) не оказало влияния на данные показатели (р > 0.05).
У крыс, подвергнутых стрессу, скорость обработки как твердой пищи, так и пищи средней жесткости упала на 19 и 29%, жевательная эффективность на 7%, однако время жевания и глубина укуса увеличились на 11 и 17% (рис. 1).
Рис. 1.
Влияние тиреоидного статуса на жевательный процесс при стрессе, переломе и их комбинации. Здесь и на рис. 2 и 3 группы животных: C – группа “Контроль”; F – группа “Перелом”; S – группа “Стресс”; F + S – группа “Перелом + Стресс”; M – группа “Мерказолил”; M + S – группа “Мерказолил + + Стресс”; M + F – группа “Мерказолил + Перелом”; M + F + S – группа “Мерказолил + Перелом + + Стресс”; T – группа “Тироксин”; T + S – группа “Тироксин + Стресс”; T + F – группа “Тироксин + Перелом”; T + F + S – группа “Тироксин + Перелом + Стресс”. Достоверность различий (р < 0.05) по сравнению с: * – группой “Контроль”; " – группой “Стресс”; ^ – группой “Перелом”; º – группой “Перелом + Стресс”; ˭ – группой “Мерказолил”; ꞌ – группой “Тироксин”; ꜛ– группами “Контроль”, “Стресс” и “Перелом”.
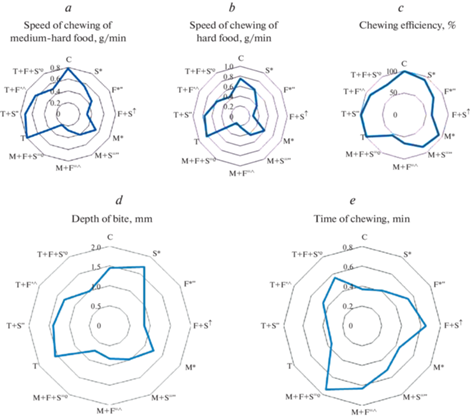
Плотность костной ткани снизилась на 13%. Исследованные нами гистологические признаки не отличались от таковых в группе “Контроль” (рис. 2).
Рис. 2.
Влияние йодсодержащих гормонов щитовидной железы на структуру мандибулярной кости после ее травматического повреждения без и в сочетании со стрессом. Обозначения как на рис. 1.
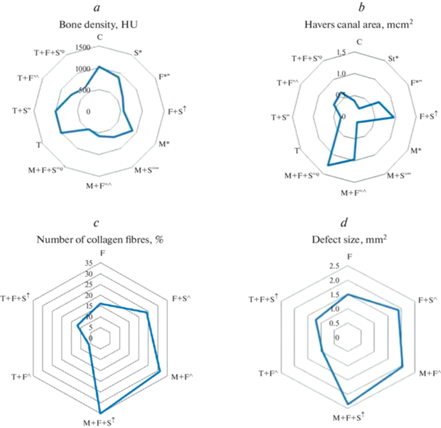
Следовательно, стресс уменьшает скорость обработки пищи различной степени жесткости и плотность нижнечелюстной кости. Интересны установленные нами факты 1) повышения продолжительности жевательного цикла и 2) увеличения глубины укуса у стрессированных животных. Мы полагаем, что это связано 1) с возрастанием агрессивности крыс в условиях стресса; 2) с лимитирующим влиянием жевания на выраженность стресс-реакции [11–13].
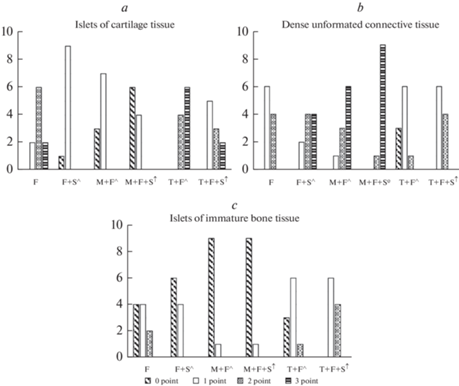
После перелома мандибулярной кости развивалось более выраженное ухудшение жевательного процесса: снижение скорости обработки ореха составило 45%, мела 42%, жевательной эффективности 22%. Время жевания увеличилось на 46%. Глубина укуса в отличие от таковой в группе “Стресс” не возрастала, а падала – на 32%. Этому соответствовали большие изменения рентгенологической и гистологической картины костной ткани нижней челюсти: ее плотность снизилась на 39%, ПГК выросла в 1.8 раза. Количество коллагеновых волокон составило 16 (10; 20)%, размер дефекта нижнечелюстной кости был равен 1.5 (1.3; 1.7) мм2. Число ПНСТ составило 1 балл у 60% и 2 балла у 40% крыс; ОХТ – 1 балл у 20%, 2 балла у 60%, 3 балла у 20% крыс; ОНКТ – 1 балл (20%) или 2 балла (тоже 20% крыс) (рис. 3).
Рис. 3.
Влияние тиреоидного статуса организма на гистологические показатели нижнечелюстной кости после ее перелома как изолированного, так и комбинированного со стрессом. Данные представлены по количеству животных, гистологические признаки области перелома нижнечелюстной кости которых соответствовали определенному количеству баллов. Обозначения как на рис. 1.
Следовательно, перелом мандибулярной кости закономерно приводит к существенному снижению жевательной функции, проявляющемуся падением скорости обработки пищи, увеличением продолжительности жевательного цикла, а также ухудшением силы сжатия челюстей и эффективности жевания. Указанные нарушения выражены в большей степени, чем после стресса. Этому соответствуют более значительные изменения на рентгенограммах и морфологических препаратах нижних челюстей, свидетельствующие об остеопении и перестройке костной ткани, отражающей процесс постфрактурного ремоделирования и соответствующей концу 2-й стадии.
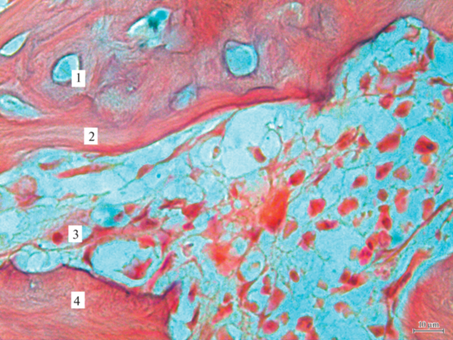
Стрессовое воздействие на животных, которым был смоделирован перелом мандибулярной кости, негативно повлияло на изменения жевательной функции: в бóльшей степени снизились скорость обработки жесткой пищи – на 64%, пищи средней жесткости – на 59%, жевательная эффективность – на 36%, глубина укуса – на 41%. Время жевания выросло более значительно – на 76%. Этому соответствовали более существенные структурные изменения кости нижней челюсти: ее плотность уменьшилась на 45%; количество ПНСТ, оцениваемое в 1 балл, наблюдалось у 20% крыс, в 2 и 3 балла – у 40%; ОХТ – в 1 балл у 80%, в 2 – у 10%; ОНКТ – в 1 балл у 40% животных. ПГК увеличилась в 2.5 раза. Количество коллагеновых волокон выросло на 8%. Площадь костной раны была больше, чем в группе “Перелом”, на 27% (рис. 4).
Рис. 4.
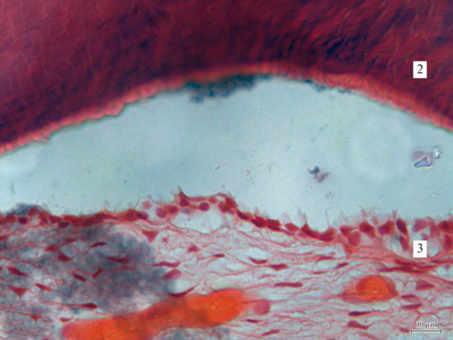
Гистоструктура области дефекта костной ткани нижней челюсти у животных группы “Перелом + стресс”. 1 – Гаверсов канал, 2 – хрящевая ткань, 3 – коллагеновые волокна, 4 – незрелая костная ткань. Окраска гематоксилин-эозином; увеличение 63×.
Следовательно, стресс значительно замедляет остеорегенерацию, индуцированную экспериментальным моделированием перелома нижнечелюстной кости, в связи с чем происходит замедление процесса заживления костной раны (2-я стадия), что приводит к более выраженному ухудшению функционирования жевательного аппарата в постфрактурном периоде.
Введение мерказолила привело к падению скорости обработки как твердой пищи, так и пищи средней жесткости – на 21 и 32%, жевательной эффективности на 8% и увеличению времени жевания на 19%, но не оказало влияния на глубину укуса. Данные изменения были обусловлены остеопоротическими изменениями в кости нижней челюсти: ее плотность снизилась на 13%, наблюдалось сужение просвета Гаверсовых каналов в 1.8 раза и изменение их формы.
Следовательно, гипотиреоз per se вызывает замедление жевательного акта, в том числе в результате уменьшения плотности мандибулярной кости и деформации каналов остеонов.
После стресса у животных, которым вводили тиреостатик, развились более значительные, чем у эутиреоидных крыс, изменения функции жевания: по отношению к таковым в группе “Мерказолил” скорость обработки ореха снизилась на 20%, мела на 17%, жевательная эффективность упала на 7%, время жевания увеличилось на 19%. В отличие от группы “Стресс” у гипотиреоидных животных после такого же воздействия глубина укуса не возросла, а уменьшилась – на 19%, ПГК упала в 1.5 раза. Плотность кости нижней челюсти снизилась на 20%.
Следовательно, гипофункция щитовидной железы усугубляет вызванные стрессом изменения жевательного процесса вследствие ухудшения трофики костной ткани нижней челюсти, что приводит к выраженной остеопении.
Моделирование перелома нижнечелюстной кости у крыс, получавших мерказолил, привело к более существенному снижению работы аппарата жевания, чем у крыс с интактным тиреоидным статусом: по сравнению с аналогичными параметрами в группе “Мерказолил” скорость измельчения ореха уменьшилась на 50%, мела на 33%, жевательная эффективность на 26%, глубина укуса на 29%, время жевания увеличилось на 51%. Это было обусловлено более значительными гистоструктурными изменениями костной ткани: количество ПНСТ в 1 балл визуализировалось у 10% крыс, в 2 балла – у 30%, в 3 балла – у 60%; ОХТ в 1 балл – у 70%. ПГК возросла в 4.6 раза. Плотность костной ткани уменьшилась на 31%. Количество коллагеновых волокон было больше, чем в группе “Перелом” на 15%, размер области дефекта нижнечелюстной кости на 37%.
Следовательно, гипотиреоз потенцирует снижение жевательной функции после травматического повреждения нижней челюсти за счет стимуляции остеопороза, замедления остеорегенерации, уменьшения скорости образования костной мозоли (начало 2-й стадии).
При протекании процесса заживления перелома мандибулярной кости в условиях стресса у гипотиреоидных животных были выявлены более выраженные, чем у эутиреоидных, изменения параметров, характеризующих жевательный процесс: cкорость разжевывания ореха по отношению к группе “Мерказолил” снизилась на 58%, мела на 41%, жевательная эффективность уменьшилась на 37%, глубина укуса на 36%, время жевания увеличилось на 81%. Это коррелировало с более существенным снижением плотности костной ткани – на 41% и ухудшением репаративных процессов в области костного дефекта: количество ПНСТ, оцениваемое в 2 балла, наблюдалось у 10% животных, в 3 балла – у 90%; ОХТ в 1 балл – у 40%. ПГК выросла в 6.1 раза. Число коллагеновых волокон было выше на 11%, площадь раны нижней челюсти на 30%, чем таковые у крыс группы “Перелом + стресс” (рис. 5).
Рис. 5.
Костная рана мандибулярной кости у гипотиреоидных крыс, подвергнутых стрессу. Обозначения те же, что на рис. 4.
Следовательно, гипотиреоз усугубляет снижение жевательной функции не только при изолированном воздействии травматического фактора и стресса, но и при их комбинации. Это обусловлено более существенными изменениями на рентгенограммах и гистопрепаратах кости нижней челюсти, отражающими процесс торможения костной регенерации в области костной раны (конец 1-й стадии).
Введение L-Т4 не привело к изменению показателей жевательного акта и строения мандибулярной костной ткани.
Стресс у животных, получавших L-Т4, в отличие от аналогичного воздействия без введения L-Т4 не повлиял ни на один из исследованных нами параметров процесса жевания и не привел к снижению плотности кости нижней челюсти. Вследствие этого скорость жевания ореха была выше на 20%, мела на 21%, жевательная эффективность была больше на 6%, глубина укуса и время жевания были меньше на 20 и 16%, чем в группе “Стресс”. Плотность костной ткани была больше на 11%.
Следовательно, введение L-тироксина в физиологических дозах улучшает работу зубочелюстного комплекса в условиях стресса, предупреждая неблагоприятное влияние последнего на гистоструктуру костной ткани.
После воспроизведения перелома мандибулярной кости у крыс после курсового введения L-Т4 изменение функции жевания было менее выраженным, чем у животных, не получавших препарат до аналогичного воздействия: по сравнению с их величиной в группе “Тироксин” скорость обработки жесткой пищи упала на 32%, пищи средней степени жесткости на 22%, жевательная эффективность снизилась на 11%, глубина укуса на 17%, время жевания выросло на 27%. Это сочеталось со значительным улучшением развития костной мозоли: количество ПНСТ, соответствующее 1 баллу, наблюдалось у 60% животных, 2 баллам – у 10%; ОХТ 2 балла – у 40%, 3 балла – у 60%; ОНКТ в 1 балл – у 50%, в 2 балла – у 40%, в 3 балла – у 10% животных. ПГК выросла в 1.3 раза. Плотность костной ткани упала на 27%. Количество коллагеновых волокон и размер костной раны были меньше, чем у крыс аналогичной группы, которым не вводили L-Т4, на 10 и 37% соответственно.
Следовательно, близкие к физиологическим дозы тироксина способствуют процессу заживления костной раны (3-я стадия), индуцированному экспериментальным переломом нижнечелюстной кости, вследствие чего интенсифицируя восстановление функции жевания.
Введение L-Т4 в малых дозах нормализовало функционирование жевательного аппарата и при сочетании перелома нижнечелюстной кости со стрессом: по отношению к таковым в группе “Тироксин” скорость жевания ореха снизилась лишь на 49%, мела на 39%, жевательная эффективность упала на 21%, глубина укуса на 38%, время жевания увеличилось на 54%. Это обусловлено минимизацией нарушения гистоструктуры кости нижней челюсти: количество ПНСТ, характеризующееся 1 и 2 баллами, визуализировалось у 60 и 40% животных соответственно; ОХТ в 1 балл – у 50%, в 2 балла – у 30%, в 3 балла – у 20%; ОНКТ в 1 и 2 балла – у 60 и 20% крыс. ПГК была больше в 1.5 раза. Плотность костной ткани уменьшилась на 37%. Количество коллагеновых волокон и размер дефекта нижней челюсти были меньше, чем в группе “Перелом + стресс”, на 12 и 47% (рис. 6).
Рис. 6.
Область дефекта нижнечелюстной кости у животных группы “Тироксин + перелом + стресс”. Обозначения те же, что на рис. 4.
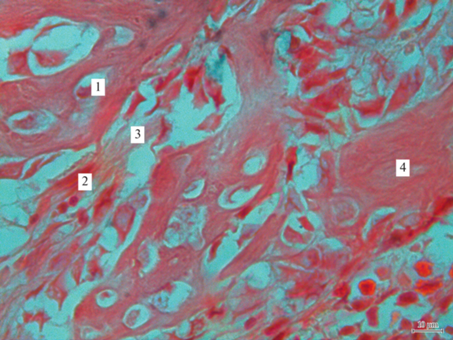
Следовательно, близкие к физиологическим дозы тироксина минимизируют негативное воздействие стресса на функцию нижней челюсти в постфрактурном периоде за счет интенсификации костного ответа, развитие которого доходит до начала 3-й стадии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами установлено, что стресс изменяет жевательную функцию (уменьшает скорость обработки пищи различной степени жесткости, увеличивает время жевания) и снижает плотность костной ткани нижней челюсти. Вместе с тем, глубина укуса после стресса повышается. Для того, чтобы определить место указанных изменений в общей картине стресс-реакции, необходимо отметить, что помимо традиционного понимания значения жевания для измельчения и гомогенизации пищи, в последние годы была открыта его новая функция – защитная, о чем свидетельствуют следующие данные:
1. Стимуляция жевательного акта, вызванная жеванием деревянной палочки (диаметр 2 мм) в течение стрессового воздействия (помещение самок мышей (BALB/c athymic nu/nu) в возрасте 7 нед. в прозрачный цилиндр (внутренний диаметр 3.5 см), в котором они могли двигаться вперед и назад, но не поворачиваться вокруг, по 45 мин 3 раза в день в течение 35 дней), снижала уровень глюкокортикоидов в сыворотке крови, экспрессию индуцибельной синтазы оксида азота, одного из продуктов перекисного окисления липидов 4-гидроксиноненала, глюкокортикоидных и β2-адренергических рецепторов, повышая экспрессию супероксиддисмутазы 2 в инокулированных в жировые подушечки молочной железы клетках линии рака молочной железы человека (MDA-MB-231), тем самым подавляя ангиогенез и пролиферацию опухолевых клеток, стимулируемые иммобилизационным стрессом. Это доказывает, что жевательное поведение ослабляет усиливающее воздействие психологического стресса на прогрессирование рака молочной железы, по крайней мере, частично, путем модуляции уровня гормонов стресса, экспрессии их рецепторов, сигнальных путей, включающих реактивные виды кислорода и азота [11].
2. Жевание деревянной палочки (крысы-самцы Sprague-Dawley 10-недельного возраста) во 2-й половине периода иммобилизации (фиксация к деревянной доске на спине с положением лап под углом 45° по отношению к средней линии тела на 2 ч после принудительного плавания в воде (T 25°C) в течение 20 мин и ингаляции паров эфира) предупреждает снижение амплитуды возбуждающих постсинаптических потенциалов на мембранах пирамидальных нейронов гиппокампа в области СА1, уменьшает тревожное поведение и реакцию страха (через 7 дней после стресса оценивали: 1) спонтанную локомоторную активность (по общему расстоянию, пройденному животным за 15 мин), 2) степень аверсивного поведения (по отношению ко времени, проведенному в открытых рукавах лабиринта, к общему времени, проведенному в обоих рукавах (тест приподнятого крестообразного лабиринта), исключая время, проведенное в центральном квадрате; 3) время замирания после помещения животного на 180 с в экспериментальную камеру через 24 ч после эмоционально-болевого стресса (footshock). По мнению авторов, эти данные свидетельствуют об ингибировании гипоталамо-гипофизарно-адреналовой оси [12].
3. Жевательная способность (4135 людей разного пола и возраста, самооценка с помощью анкеты) отрицательно коррелировала с уровнем депрессии и тревоги (оценивали по валидированной версии Госпитальной шкалы тревоги и депрессии), как и стресса (по Опроснику общего состояния здоровья). У мужчин уровень жевательной способности был значительно выше, чем у женщин [13].
После экспериментального перелома кости нижней челюсти происходит значительное снижение жевательной функции (уменьшение скорости обработки пищи, глубины укуса, жевательной эффективности, увеличение времени жевания), в основе которого лежит падение плотности мандибулярной кости. Ее гистологическая картина соответствует концу 2-й стадии постфрактурного ремоделирования.
При развитии вызванной переломом перестройки кости в условиях стресса функция жевания нарушается более существенно, что связано с уменьшением скорости процесса остеорепарации, который не достигает окончания 2-й стадии. Это означает, что стресс значительно замедляет репаративную регенерацию в постфрактурном периоде.
Гипофункция щитовидной железы сама по себе приводит к снижению скоростных показателей жевательного акта и падению жевательной эффективности, в том числе, в результате появления остеопенических изменений и уменьшения площади Гаверсовых каналов кости нижней челюсти. Гипотиреоз провоцирует большее падение показателей, характеризующих функцию жевания, при стрессе и препятствует повышению глубины укуса, которая, в отличие от эутиреоидных животных, подвергнутых стрессу, снижается. Морфологическая основа такого эффекта – уменьшение просвета центральных каналов остеонов, приводящее к ухудшению снабжения костной ткани кислородом и питательными веществами, что обусловливает снижение плотности мандибулярной кости.
После перелома нижней челюсти гипофункция щитовидной железы также определяет более существенное нарушение ее жевательной функции вследствие торможения процесса образования костной мозоли, который достигает лишь начала 2-й стадии, о чем свидетельствуют бóльшее количество плотной неоформленной соединительной ткани и коллагеновых волокон и, напротив, меньшее число ОХТ на фоне исчезновения ОНКТ.
Схожий эффект гипотиреоз оказывает и при заживлении перелома мандибулярной кости в условиях стресса, когда снижение жевательной функции и гистоструктурные нарушения костной ткани достигают наибольшей выраженности, а процесс образования тканевого регенерата на момент исследования находится на 1-й стадии.
Введение малых доз L-тироксина не влияет само по себе на исследованные нами параметры, предупреждает повышение глубины укуса при стрессе, обеспечивая более высокие значения скорости обработки пищи, жевательной эффективности и, напротив, меньшее время жевания, устраняя снижение плотности костной ткани в этих условиях.
У животных с переломом нижней челюсти – изолированным и комбинированным со стрессом – близкие к физиологическим дозы тироксина обеспечили сохранение функции жевания в постфрактурном периоде на более высоком уровне вследствие стимуляции процесса восстановления костного дефекта, достигающего 3-й стадии.
В целом, наши данные свидетельствуют о том, что гипотиреоз препятствует, тогда как введение близких к физиологическим доз тироксина способствует восстановлению функции и травматического дефекта нижней челюсти за счет ограничения негативного воздействия стресса на протекание репаративного ответа в нижней челюсти.
Полученные результаты доказывают, что функция жевания и реализация фаз восстановления костной ткани в области повреждения, изолированного и комбинированного со стрессом, зависит от тиреоидного статуса – замедляется при гипофункции щитовидной железы и, напротив, интенсифицируется при введении тироксина в дозах, близким к физиологическим.
Участие ЙТГ в процессе постфрактурной остеорегенерации может быть связано с 2 типами их влияний: 1) геномным [14], которое может привести к изменению содержания факторов, участвующих, с одной стороны, в новообразовании костной ткани (остеопротегерина – природного антагониста рецептора-активатора ядерного транскрипционного фактора каппа В (RANK) [15, 16], щелочной фосфатазы (маркерного фермента остеобластов) [17]), с другой стороны, в резорбции (маркерного фермента остеокластов кислой фосфатазы [17], катепсинов Д и К [18], матриксных металлопротеиназ [19]; 2) негеномным, заключающимся в повышении проницаемости клеточных мембран и стимуляции энергетических процессов в митохондриях [20], что создает условия для создания и эффективного использования ресурсов материнского запаса для формирования костного регенерата. Реализации протекторной роли ЙТГ, заключающейся в ограничении влияния стресса на процесс репарации костной раны в области травматического дефекта, может способствовать отмеченная выше стимуляция стресс-лимитирующих механизмов, приводящая к снижению интенсивности стресс-реакции [3, 4].
Результаты исследования, по нашему мнению, могут представлять интерес не только для фундаментальных биологических наук, но и для стоматологической клинической практики с учетом значительного негативного влияния, оказываемого на организм в целом дисфункцией щитовидной железы и заболеваниями челюстно-лицевой области, и частой встречаемостью указанных видов патологии.
Список литературы
Иванов ДГ, Александровская НВ (2018) Влияние социальной изоляции на стрессоустойчивость и резорбцию костной ткани крыс при термическом стрессе. Биомед 1: 71–83. [Ivanov DG, Alexandrovskaya NV (2018) The effect of social isolation on stress resistance and bone resorption in rats under thermal stress. Biomed 1: 71–83. (In Russ)].
Kohler JB, Junqueira JJM, Silva TCMD., Filho MAGP, Tibério IDFLC, Lopes FDTQS, Barbosa AP (2021) Smoking-induced oxidative stress in bone: The effects on bone turnover. J Orthopedics & Orthopedic Surg 2(2): 14–23. https://doi.org/10.29245/2767-5130/2021/2.1138
Городецкая ИВ, Гусакова ЕА (2021) Влияние малых доз L-тироксина на устойчивость к стрессу животных с экспериметально вызванным дефицитом симпатических нервных влияний. Рос физиол журн им ИМ Сеченова 107(3): 352–373. [Gorodetskaya IV, Gusakova EA (2021) The effect of low doses of L-thyroxine on the resistance to stress of animals with experimentally induced deficiency of sympathetic nervous influences. Russ J Physiol 107(3): 352–373. (In Russ)]. https://doi.org/10.31857/S0869813921030067
Городецкая ИВ, Гусакова ЕА (2019) Йодсодержащие гормоны щитовидной железы и защитный эффект глюкокортикоидов при стрессе. Рос физиол журн им ИМ Сеченова 105(12): 1535–1545. [Gorodetskaya IV, Gusakova EA (2019) Iodine-containing thyroid hormones and protective effect of glucocorticoids under stress. Russ J Physiol 105(12): 1535–1545. (In Russ)]. https://doi.org/10.1134/S0869813919120069
Baliram R, Latif R, Zaidi M, Davies TF (2017) Expanding the role of thyroid-stimulating hormone in skeletal physiology. Front Endocrinol 8: 252. https://doi.org/10.3389/fendo.2017.00252
Ганеев ТИ, Юнусов РР, Камилов ФХ (2017) Состояния фосфорно-кальциевого обмена и костной ткани при экспериментальном гипотиреозе. Наука Молодых (Eruditio Juvenium) 5(2): 158–164. [Ganeev TI, Yunusov RR, Kamilov FH (2017) The states of phosphorus-calcium metabolism and bone tissue in experimental hypothyroidism. Sci Young (Eruditio Juvenium) 5(2): 158–164. (In Russ)]. https://doi.org/10.23888/HMJ20172158-164
Поворознюк ВВ, Григорьева НВ, Гопкалова ИВ (2018) Показатели минеральной плотности костной ткани у самок-крыс Wistar различного возраста в условиях экспериментального гипертиреоза. Патол физиол эксп терапия 62(4): 150–156. [Povoroznyuk VV, Grigoryeva NV, Gopkalova IV (2018) Indices of bone mineral density in female Wistar rats of different age under experimental hyperthyroidism. Pathol Physiol Exp Therapy 62(4): 150–156. (In Russ)]. https://doi.org/10.25557/0031-2991.2018.04.150-156
Павлова ТВ, Пешкова ЭК, Колесников ДА (2012) Клинические наблюдения и анализ стоматологического статуса пациентов с заболеваниями щитовидной железы. Фунд иссл 4-1: 97–100. [Pavlova TV, Peshkova EK, Kolesnikov DA (2012) Clinical observations and analysis of the dental status of patients with thyroid diseases. Fund Stud 4-1: 97–100. (In Russ)].
Ефимов ЮВ, Стоматов ДВ, Ефимова ЕЮ Долгова ИВ, Стоматов АВ (2019) Лечение больных с односторонним косым переломом нижней челюсти. Мед вестн Северного Кавказа. 14(1.1): 94–97. [Efimov YV, Stomatov DV, Efimova EY Dolgova IV, Stomatov AV (2019)Treatment of patients with a unilateral mandibular oblique fracture. Med Bull North Caucasus 14(1.1): 94–97. (In Russ)].
Бондаренко СН, Манухина ЕБ (1999) Влияние различных методик стрессирования и адаптации на поведенческие и соматические показатели у крыс. Бюлл экспер биол мед 128(8): 157–160. [Bondarenko SN, Manukhina EB (1999) The influence of various methods of stress and adaptation on behavioral and somatic indicators in rats. Bull Exp Biol Med 128(8): 157–160. (In Russ)].
Zhou Q, Katano M, Zhang JH, Liu X, Wang KY, Iinuma M, Kubo K, Azuma K (2021) Chewing behavior attenuates the tumor progression-enhancing effects of psychologic stress in a breast cancer model mouse. Brain Sci 11: 479. https://doi.org/10.3390/brainsci11040479
Shinjiro M, So K, Kenichi S Toshitsugu K (2017) Chewing ameliorates stress-induced enhancement of anxiety behaviours in an animal model of post-traumatic stress disorder. Biomed Res (India) 28 (6): 2843–2847.
Roohafza H, Afshar H, Keshteli AH, Shirani MJ, Afghari P, Vali A, Peyman A (2016) Masticatory ability with depression, anxiety, and stress: Does there exist any association? Dent Res J 13: 211–216. https://doi.org/10.4103/1735-3327.182179
Bianco AC, Dumitrescu A, Gereben B, Ribeiro MO, Fonseca TL, Fernandes GW, Bocco BMLC (2019) Paradigms of dynamic control of thyroid hormone signaling. Endocr Rev 40(4): 1000–1047. https://doi.org/10.1210/er.2018-00275
Matthew CW, Yongwon C (2014) Biology of the RANKL–RANK–OPG system in immunity, bone, and beyond. Front Immunol 5(4): 511. https://doi.org/10.3389/fimmu.2014.00511
Chatziravdeli V, Katsaras GN, Lambrou GI (2019) Gene Expression in Osteoblasts and Osteoclasts Under Microgravity Conditions: A Systematic Review. Curr Genomics 20(3):184–198. https://doi.org/10.2174/1389202920666190422142053
Желнин ЕВ (2015) Динамика активности кислой и щелочной фосфатаз в ротовой жидкости при амбулаторных хирургических вмешательствах по поводу одонтогенных воспалительных заболеваниях челюсти и затрудненном прорезывании зубов мудрости. Усп cовр естествознания 1-4: 561–564. [Zhelnin EV (2015) Dynamics of acid and alkaline phosphatase activity in oral fluid during ambulatory surgical interventions for odontogenic inflammatory diseases of the jaw and wisdom teeth eruption difficulties. Succes Modern Nat Sci 1-4: 561–564. (In Russ)].
Fasanya HO, Siemann DW (2021) The role of cathepsins in the growth of primary and secondary neoplasia in the bone. Osteol 1: 3–28. https://doi.org/10.3390/osteology1010002
Ярмолинская МИ, Молотков АС, Денисова ВМ (2012) Матриксные металлопротеиназы и ингибиторы: классификация, механизм действия. Журн акуш и женск болезн 59(1): 113–125. [Yarmolinskaya MI, Molotkov AS, Denisova VM (2012) Matrix metalloproteinases and inhibitors: classification, mechanism of action. J Obstetrics Women’s Des 59(1): 113–125. (In Russ)].
Cayrol F, Sterle HA, Flaqué MCD, Arcos MLB, Cremaschi GA (2019) Non-genomic actions of thyroid hormones regulate the growth and angiogenesis of T cell lymphomas. Front Endocrinol (Lausanne) 10: 63. https://doi.org/10.3389/fendo.2019.00063
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


