Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 325-338
Реакция тиреоидной системы на кратковременный стресс у крыс линии Вистар с висцеральным ожирением и ограниченной социальной активностью
Т. А. Митюкова 1, *, Е. Н. Чудиловская 1, **, А. А. Басалай 1
1 Институт физиологии Национальной академии наук Беларуси
Минск, Беларусь
* E-mail: mityukovat@gmail.com
** E-mail: e.chudilovskaya@gmail.com
Поступила в редакцию 16.12.2021
После доработки 21.01.2022
Принята к публикации 22.01.2022
- EDN: GBNVLY
- DOI: 10.31857/S0869813922030062
Аннотация
Проблема ожирения требует изучения патофизиологических последствий, затрагивающих гормональную регуляцию и реактивность организма на экстремальные воздействия. Цель исследования – изучение влияния высококалорийной диеты и социальной изоляции на развитие ожирения, его метаболических и поведенческих последствий, особенностей тиреоидного статуса, и на втором этапе – оценка реакции гормональных показателей тиреоидного статуса на кратковременный стресс у крыс. Эксперименты проводились на крысах-самцах линии Вистар и включали: высококалорийную диету и социальную изоляцию, а также их сочетания в течение 4 мес. В конце эксперимента оценивали поведенческие реакции, показатели метаболического синдрома, тиреоидного статуса и уровень кортизола. На втором этапе эксперимента животные подвергались кратковременному острому стрессу, через 1 ч после которого регистрировали сдвиги гормональных показателей по сравнению с исходным фоном. Высококалорийная диета приводила к развитию метаболического синдрома, признаков депрессивности, повышению уровня тиреотропного гормона, тироксина и трийодтиронина в сыворотке крови, а также активности дейодиназы 1-го типа в печени крыс, при этом отмечалось снижение активности тиреопероксидазы и повышение уровня триглицеридов и малонового диальдегида в щитовидной железе крыс. Физиологическая реакция на стресс у крыс группы контроля включала повышение уровня кортизола и ТТГ в сыворотке крови, однако, на фоне высококалорийной диеты не был зарегистрирован выброс кортизола в кровь. Социальная изоляция не изменяла нормальную реактивность коры надпочечников, но снижала выброс тиреотропного гормона в ответ на острое стрессорное воздействие, поскольку содержание этого гормона было исходно несколько повышенным на фоне хронического стресса социальной изоляции. Таким образом, избыточное питание и дефицит социальной активности у крыс-самцов линии Вистар приводят к существенным изменениям в реакции организма на острый стресс.
Данные социологических исследований свидетельствуют о том, что во всем мире нарастает количество людей с избыточной массой тела и ожирением, причем, последнее повышает риск развития метаболического синдрома, сердечно-сосудистой патологии, нарушений функции щитовидной железы (ЩЖ), когнитивных и психоэмоциональных расстройств, включая депрессию [1–3]. Основными причинами ожирения, чаще всего, являются избыточное питание и нездоровый образ жизни, который включает в себя недостаточную физическую и социальную активность [1–3]. Состояние тиреоидного статуса имеет свои особенности при ожирении и привлекает внимание исследователей, поскольку тиреоидные гормоны участвуют в регуляции основного обмена, термогенеза и обмена липидов в организме [2]. В большинстве клинических и эпидемиологических исследований отмечается, что тиреоидная дисфункция связана с избыточной массой тела и ожирением. У эутиреоидных пациентов наблюдается положительная корреляция между индексом массы тела и тиреотропного гормона (ТТГ), однако данные об уровнях периферических гормонов при ожирении являются неоднозначными. Следует признать, что тиреоидный статус играет важную роль не только в патогенезе ожирения, но также и в системе регуляторных процессов, обеспечивающих адаптацию организма к физическим нагрузкам и к стрессу [2, 4, 5]. Тем не менее, вопрос о возможном модулирующем влиянии ожирения, а также ограниченной физической и социальной активности и их совместного воздействия на реактивность регуляторных систем, включая тиреоидный статус, остается малоизученным и требует соответствующих экспериментальных исследований.
Экспериментальные модели ожирения и метаболического синдрома у крыс подробно описаны в литературе, их выбор и проведение не вызывает затруднений [6]. Однако понятие нездорового образа жизни является более сложным и неоднозначным. В настоящее время привлекает внимание такой фактор, как снижение социальной активности, связанный с развитием дистанционных методов обучения и работы, расширением сферы виртуальных развлечений и изменениями образа жизни на фоне пандемии COVID-19. Данная модель может осуществляться в эксперименте путем содержания животных в индивидуальных клетках. По мнению Mumtaz и соавт. фактор социальной изоляции может действовать как хронический стрессор, приводящий к изменению социального поведения, функций нейрохимической и нейроэндокринной системы, а также реактивности на острый стресс [7]. Исходя из этого, индивидуальное содержание было принято нами как вариант ограничения социальной активности у крыс (социальная изоляция).
Цель исследования – изучение влияния высококалорийной диеты и социальной изоляции на развитие ожирения, его метаболических и поведенческих последствий, особенностей тиреоидного статуса, и на втором этапе – оценка реакции гормональных показателей тиреоидного статуса на кратковременный стресс у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все работы с экспериментальными животными проводили с соблюдением законодательства, в соответствии с положениями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS N 123) и принципов, утвержденных комиссией по биоэтике Института физиологии Национальной академии наук Беларуси. Опыты проводились на половозрелых крысах-самцах линии Вистар. Животные вводились в эксперимент в возрасте двух месяцев, масса тела составляла 180–200 г. Были изучены следующие виды экспериментальных воздействий: высококалорийная диета (ВКД) и социальная изоляция (СИ), а также их сочетания. Крысы были разделены на 4 группы: 1) Контроль (n = 20) – стандартный рацион вивария и оптимальные условия содержания (по 6–7 крыс в общей клетке); 2) Контроль-СИ (n = 20) – стандартный рацион вивария и содержание в индивидуальных клетках; 3) ВКД (n = 36) – рацион включал дополнительное количество жиров животного происхождения в виде свиного сала (45% от суточной калорийности пищи) и углеводов (питьевая вода замещалась на 10%-ный раствор фруктозы со свободным доступом к поилкам), крысы содержались в стандартных условиях (6–7 крыс в общей клетке); 4) ВКД-СИ (n = 36) – высококалорийная диета и содержание в индивидуальных клетках. В состав ВКД входило свиное сало, которое вводили в рацион в соответствии с массой тела животного, соблюдая 45% добавочного вклада к стандартному рациону вивария по мере нарастания массы тела и соответственно калорийности основной диеты. Проводили учет поедания сала в расчете на одно животное при групповом и индивидуальном содержании. Для группового содержания использовали клетки Techniplast с площадью пола 1500 см2 (габариты 48 × 38 × 21 см), а для индивидуального – клетки Zoonlab Gmbh с площадью пола 360 см2 (габариты 26 × 20 × 14 см). Оба варианта соответствовали требованиям ETS № 123, площадь пола – не менее 200–250 см2 на крысу.
Продолжительность эксперимента составляла 4 мес. На последней неделе проводили тест Порсолта на депрессивное поведение грызунов [8]. Каждую крысу помещали на 6 мин в сосуд, заполненный водой до отметки на высоте 30 см, температура воды составляла 24–25°С. Фиксировали длительность первого акта активного плавания, количество и длительность “замираний” (отсутствие плавательных движений). Отказ от активного плавания характеризует состояние “отчаяния”, т.е. является признаком депрессивности [8].
Массу тела крыс оценивали на весах Scout Pro (Китай), а также проводили измерение систолического артериального давления крови (САД) на установке PanLab (Испания). На заключительном этапе эксперимента половина животных каждой из четырех групп подвергалась острому кратковременному стрессу – принудительному плаванию в холодной воде, Т = 13°С в течение 5 мин. Животных выводили из эксперимента через 1 ч после стресса, под тиопенталовым наркозом. Всех остальных животных также подвергали декапитации с использованием тиопентала натрия. У крыс забирали висцеральную жировую ткань, печень, ЩЖ и кровь (для отделения сыворотки и последующего анализа биохимических и гормональных показателей).
Биохимические показатели сыворотки крови: общий холестерин, триглицериды, глюкоза, общий белок определяли ферментативными методами с использованием коммерческих наборов фирмы “Диасенс” (Республика Беларусь) на автоматическом биохимическом анализаторе BS-200 (Китай) с программным обеспечением BS-330. Определение гормонов в сыворотке крови проводили методом иммуноферментного анализа: трийодтиронин (Т3), тироксин (Т4) и свободный Т4 (св. Т4) – на наборах “Хема” (Россия), свободный Т3 (св. Т3) и кортизол – на наборах “Диагностические системы” (Россия), тиреотропный гормон (ТТГ) – на наборах FineTest (Китай).
Определение активности тиреопероксидазы (ТПО) в ткани щитовидной железы (ЩЖ) проводили по методу [9]. Ткань ЩЖ измельчали с использованием гомогенизатора IKA T10 basic Ultra-Turrax (Германия) и 0.05 М Na/фосфатного буфера (рН 7.4). Гомогенат (в разведении 1 : 80) центрифугировали с охлаждением при 4°С и 5000 об/мин (10 700 g) на центрифуге Allegra 64R Centrifuge Beckman Coulter (США). Супернатанты отбирали и определяли содержание белка биуретовым методом на автоматическом биохимическом анализаторе BS 200 (Китай) с использованием наборов “Диасенс” (Беларусь). Супернатанты для определения активности тиреопероксидазы (ТПО) находились на ледяной бане (температура тающего льда) и использовались в течение 3–4 ч. Спектрофотометрические исследования проводили на спектрофлуориметре SOLAR СМ 2203. В термостатируемую кювету (1 см) вносили буфер и другие компоненты. Состав инкубационной смеси: 0.05 М Na/фосфатный буфер рН 7.4–2.7 мл, раствор KI (0.6 М) – 75 мкл, супернатант – 200 мкл. Содержимое кюветы выдерживали в течение 3 мин при температуре 25°С. Реакцию инициировали путем внесения H2O2 (10 мкл 40 мМ раствора), пробу перемешивали и регистрировали оптическую плотность при длине волны 353 нм в течение 3 мин. Активность фермента выражали в международных единицах на мг белка за минуту инкубации (МЕ/мг мин).
Активность дейодиназы 1-го типа (D1) в печени определяли по методу [10] с некоторыми модификациями, малоновый диальдегид (МДА) – по реакции с тиобарбитуровой кислотой [11]. Метод определения D1 [10] основан на оценке дейодиназной активности печени по превращению Т4 в Т3 в присутствии кофактора дитиотрейтола (ДТТ). В работе использовали следующие реагенты: Tris-HCl буфер 0.05 М, рН 7.8; Na/фосфатный буфер 0.01 М, рН 7.6, содержащий бычий сывороточный альбумин (БСА) 0.25%; ДТТ 320 мМ на дистиллированной воде; стандарт Т4 (I) на метаноле – 1000 мкМ с добавлением 0.5 N NaOH (100 мкл на 5 мл раствора); стандарт Т4 (II) получали путем разбавления Т4-I в 20 раз на БСА-фосфатном буфере с добавлением 0.5 N NaOH до рН 8 – конечная концентрация 50 мкМ. Печеночный гомогенат готовили на трис-буфере (1 : 5) в условиях охлаждения при температуре тающего льда, затем центрифугировали 15 мин на центрифуге BioSan LMC-3000 при 3000 об/мин (1700 g).
Состав инкубационной смеси: супернатант – 700 мкл, ДТТ – 40 мкл, стандарт Т4 (II.) – 40 мкл. Инкубация при 37°С в течение 1 ч проводилась в дублях – 2 опытных и 2 контрольных пробы (контрольные пробы без ДТТ и Т4). Остановка реакции достигалась путем добавления этилового спирта 96% – 700 мкл, при этом в контрольные пробы добавляли ДТТ и Т4. После перемешивания пробы оставляли в холодильнике на 2 ч или на ночь для осаждения белка. Надосадочную жидкость отделяли путем центрифугирования и использовали для определения Т3 ИФА-методом (возможно хранение при –20°С до проведения анализа). Полученный супернатант содержал около 48% этанола. Установлено, что при определении Т3 ИФА-методом в спиртосодержащем супернатанте необходимо смешивать таковой с “нулевой сывороткой” (пуловая человеческая сыворотка, обработанная активированным углем), не допуская превышения концентрации этанола более 5% в пробе. Изучение влияния концентрации этанола на определение Т3 ИФА-методом было проверено на пуловой сыворотке людей. При внесении в эту сыворотку этанола с конечной концентрацией не более 5% содержание Т3 определялось как исходное, полученное на нативной сыворотке. В процессе выполнения методики супернатант вносили в “нулевую сыворотку” в соотношении 10/100 мкл таким образом, чтобы содержание этанола в пробе составляло около 4.8%, что являлось предельно допустимым.
Статистический анализ проводился в программе Statistica 6.0. Нормальность распределения данных проверяли с использованием критерия Шапиро–Уилка. При нормальном распределении применяли дисперсионный анализ ANOVA с использованием критерия Фишера (данные представляли как M ± SEM). При ненормальном распределении использовались непараметрические методы – критерий Краскера–Уоллеса (данные представляли как Me (25; 75)). Отличия считали достоверными при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе эксперимента было изучено влияние высококалорийной диеты и социальной изоляции. Показатели массы тела у крыс групп “Контроль” и “Контроль-СИ” по окончании эксперимента были практически одинаковыми (табл. 1). Высококалорийная диета приводила к достоверному нарастанию массы тела крыс в среднем на 10% по отношению к группе “Контроль”, а сочетанное влияние “ВКД-СИ” – на 12% по сравнению с группой “Контроль-СИ”. Эти группы крыс (“ВКД” и “ВКД-СИ”) практически не отличались между собой по средним значениям массы тела. Масса висцерального жира не давала достоверных отличий у крыс групп “Контроль” и “Контроль-СИ”. У крыс группы “ВКД” отмечалось 4-кратное нарастание массы висцерального жира по сравнению с контролем, а у крыс группы “ВКД-СИ” это нарастание носило менее выраженный характер – примерно в 2 раза по сравнению с “Контроль-СИ”. При этом масса висцерального жира в группе “ВКД” двукратно превышала таковую в группе “ВКД-СИ”. Очевидно, что при социальной изоляции нарастание висцерального жира у крыс было менее выраженным, чем при групповом, хотя потребление сала в этих группах крыс было практически одинаковым (6.7 и 6.8 г в день соответственно). Средние показатели САД в обеих группах, получавших стандартный рацион (группы 1, 2), были практически одинаковыми, а у крыс, получавших избыточное питание (группы 3, 4), достоверно нарастали на 11 и 15% соответственно, достигая сопоставимых величин (табл. 1).
Таблица 1.
Влияние высококалорийной диеты и социальной изоляции на массу тела, массу висцерального жира и систолическое артериальное давление (САД) у крыс экспериментальных групп (M ± SEM)
| Показатели | 1) Контроль | 2) Контроль-СИ | 3) ВКД | 4) ВКД-СИ |
|---|---|---|---|---|
| Масса тела, г | 373.9 ± 7.7 | 370.6 ± 8.6 | 411.1 ± 9.0*# | 416.2 ± 9.3*# |
| Масса висцерального жира, г | 5.5 ± 0.5 | 5.2 ± 0.5 | 21.8 ± 1.2*# | 10.7 ± 0.8*#^ |
| САД, мм рт. ст. | 131.1 ± 2.2 | 134.0 ± 1.4 | 145.3 ± 2.1*# | 153.6 ± 2.5*#^ |
Как видно из данных, представленных в табл. 2, значения биохимических показателей крови были практически идентичными в группах “Контроль” и “Контроль-СИ”. Потребление высококалорийного рациона приводило к повышению уровня общего холестерина в сыворотке крови у крыс группы “ВКД-СИ”. Содержание триглицеридов достоверно нарастало только в группе “ВКД”, но не “ВКД-СИ”. Уровень глюкозы достоверно увеличивался в обеих группах по сравнению с контролем.
Таблица 2.
Биохимические показатели сыворотки крови и ткани щитовидной железы у крыс экспериментальных групп (M ± SEM)
| Показатели | 1) Контроль | 2)Контроль-СИ | 3) ВКД | 4)ВКД-СИ |
|---|---|---|---|---|
| Сыворотка крови | ||||
| Общий холестерин, ммоль/л | 1.43 ± 0.09 | 1.50 ± 0.08 | 1.58 ± 0.07 | 1.65 ± 0.08* |
| Триглицериды, ммоль/л |
0.55 ± 0.05 | 0.57 ± 0.09 | 0.97 ± 0.09*# | 0.65 ± 0.07^ |
| Глюкоза, ммоль/л |
5.41 ± 0.30 | 5.86 ± 0.38 | 6.89 ± 0.27*# | 6.39 ± 0.28* |
| Ткань щитовидной железы | ||||
| Триглицериды, ммоль/г ткани |
4.52 ± 0.57 | 3.30 ± 0.63 | 9.63 ± 0.88*# | 6.23 ± 0.51#^ |
| МДА, ммоль/г ткани |
59.71 ± 5.13 | 60.85 ± 8.44 | 86.49 ± 5.22*# | 74.07 ± 5.15 |
Определение уровня триглицеридов в ткани ЩЖ показало сопоставимые величины в первых двух группах крыс, получавших стандартную диету, и выявило достоверное повышение показателя при высококалорийной диете независимо от условий содержания по сравнению с контролем. Однако накопление триглицеридов в ткани ЩЖ было наиболее выраженным в группе “ВКД” и достоверно превышало (в 1.5 раза) этот показатель у крыс, получавших сочетанное воздействие – “ВКД-СИ”. Содержание МДА в ткани ЩЖ достоверно нарастало при высококалорийном питании в 3-й группе в 1.4 раза по сравнению с контролем, а в 4-й группе отмечалась только тенденция к его повышению (табл. 2).
Учитывая нарастание массы висцерального жира, повышение САД и метаболические сдвиги, можно констатировать, что у животных, получавших высококалорийное питание, развился экспериментальный метаболический синдром. Потребление практически одинаковых количеств свиного сала в условиях социальной изоляции и при групповом содержании приводило к более выраженному накоплению висцерального жира и к большим метаболическим отклонениям в условиях группового содержания животных (табл. 1, 2).
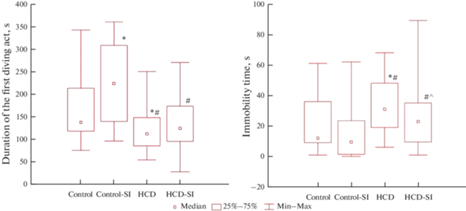
Оценка психо-эмоционального статуса крыс проводилась с использованием теста Порсолта, который предназначен для выявления депрессивного поведения у грызунов [8]. Как видно из рис. 1, крысы группы “Контроль-СИ” отличались достоверным, почти 2-кратным увеличением времени первого акта активного плавания по сравнению с группой контроля. У крыс, получавших высококалорийную диету, были выявлены сдвиги противоположной направленности – достоверное уменьшение длительности акта активного плавания и увеличение длительности замираний без движения, что свидетельствует о нарастании депрессивности.
Рис. 1.
Результаты теста Порсолта у экспериментальных животных (Ме (25; 75)). Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”.
На первом этапе эксперимента, наряду с гормональными показателями, были также изучены характеристики активности некоторых ферментов тиреоидного статуса (табл. 3). Активность ТПО в ткани ЩЖ была практически одинаковой в первых двух группах. На фоне высококалорийного питания было выявлено достоверное снижение активности фермента, почти наполовину от контрольного уровня, независимо от условий содержания животных (табл. 3). В противоположность этому активность D1 печени достоверно повышалась при избыточном питании.
Таблица 3.
Активность ТПО в ткани щитовидной железы и D1 в ткани печени у крыс экспериментальных групп
| Показатели | 1) Контроль | 2) Контроль-СИ | 3) ВКД | 4) ВКД-СИ |
|---|---|---|---|---|
| Щитовидная железа | ||||
| ТПО, МЕ/мг белка мин | 0.69 ± 0.12 | 0.70 ± 0.13 | 0.37 ± 0.04*# | 0.40 ± 0.08*# |
| Печень | ||||
| D1, нмоль/г ткани ч | 90.00 ± 8.27 | 71.33 ± 7.97 | 152.56 ± 20.29*# | 136.88 ± 14.33 |
Гормональные показатели тиреоидного статуса в сыворотке крови представлены на рисунках в виде светлых столбиков – крысы без стресса и в виде заштрихованных столбиков – крысы после стресса. В первую очередь необходимо рассмотреть влияние высококалорийной диеты и социальной изоляции на изучаемые показатели.
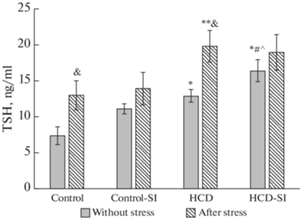
Как видно из рис. 2, значения ТТГ достоверно не отличались у животных первых двух групп (“Контроль” и “Контроль-СИ”) без стресса, хотя во 2-й группе наблюдалась тенденция к нарастанию уровня ТТГ (p > 0.05). Высококалорийное питание приводило к достоверному повышению уровня ТТГ по сравнению с контролем в 1.8 раза, а у крыс группы “ВКД-СИ” было отмечено нарастание показателя в 2 раза по сравнению с контролем и в 1.5 раза по сравнению с “Контроль-СИ”. Под влиянием кратковременного стресса в группе контроля наблюдалось достоверное (в 1.8 раза) повышение уровня ТТГ, выраженное повышение гормона было отмечено и в группе ВКД (в 1.5 раза). Однако у крыс, содержавшихся в условиях изоляции (“Контроль-СИ” и “ВКД-СИ”) сдвиги ТТГ не достигали статистической значимости (рис. 2).
Рис. 2.
Экспериментальные воздействия на уровень ТТГ в сыворотке крови крыс. Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”, & – сравнение с животными, которые не подвергались острому стрессу, ** – сравнение с группой “Контроль после стресса”; ## – сравнение с группой “Контроль-СИ после стресса”; ^^ – сравнение с группой “ВКД после стресса”.
На фоне избыточного питания было отмечено достоверное повышение уровня общего Т3 в 1.6 раза, общего Т4 – в 1.4 раза, что сочеталось с повышением активности печеночной D1 в 1.7 раза по сравнению с контролем (рис. 3–4, табл. 3). При ВКД в сочетании с социальной изоляцией содержание Т3 и Т4 оставалось в пределах контрольных величин, несмотря на достоверное повышение уровня ТТГ по сравнению с контролем. Содержание Т3 и Т4 в сыворотке крови при ВКД достоверно превосходило таковые при ВКД в сочетании с социальной изоляцией.
Рис. 3.
Экспериментальные воздействия на уровень Т3 у крыс экспериментальных групп. Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”, & – сравнение с животными, которые не подвергались острому стрессу, ** – сравнение с группой “Контроль после стресса”; ## – сравнение с группой “Контроль-СИ после стресса”; ^^ – сравнение с группой “ВКД после стресса”.
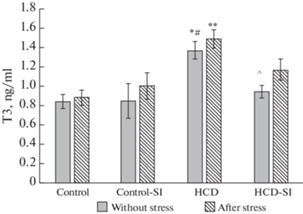
Рис. 4.
Экспериментальные воздействия на уровень Т4 у крыс экспериментальных групп. Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”, & – сравнение с животными, которые не подвергались острому стрессу, ** – сравнение с группой “Контроль после стресса”; ## – сравнение с группой “Контроль-СИ после стресса”; ^^ – сравнение с группой “ВКД после стресса”.
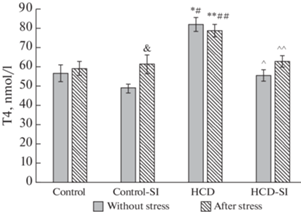
После стресса уровень Т3 (рис. 3) оставался относительно стабильным практически во всех экспериментальных группах, тогда как содержание Т4 в сыворотке крыс на фоне стресса достоверно повышалось в группе “Контроль-СИ” (рис. 4).
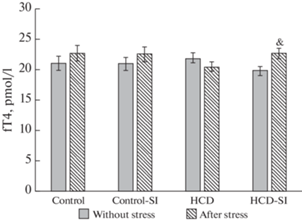
Как видно из рис. 5 и 6, характер питания и условия содержания животных не повлияли на уровни свободных фракций тиреоидных гормонов. Постстрессорное повышение св. Т3 отмечалось только в группе контроля (рис. 5), а св. Т4 ― только у крыс группы “ВКД-СИ” (рис. 6).
Рис. 5.
Экспериментальные воздействия на уровень св. Т3 у крыс экспериментальных групп. Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”, & – сравнение с животными, которые не подвергались острому стрессу, ** – сравнение с группой “Контроль после стресса”; ## – сравнение с группой “Контроль-СИ после стресса”; ^^ – сравнение с группой “ВКД после стресса”.
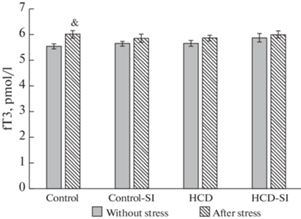
Рис. 6.
Экспериментальные воздействия на уровень св. Т4 у крыс экспериментальных групп. Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”, & – сравнение с животными, которые не подвергались острому стрессу, ** – сравнение с группой “Контроль после стресса”; ## – сравнение с группой “Контроль-СИ после стресса”; ^^ – сравнение с группой “ВКД после стресса”.
Высококалорийная диета и социальная изоляция не вызывали достоверных сдвигов содержания кортизола в сыворотке крови крыс (рис. 7), однако отмечалась тенденция к снижению показателя в группе “Контроль-СИ”.
Рис. 7.
Экспериментальные воздействия на уровень кортизола у крыс экспериментальных групп. Достоверность различий при p < 0.05: * – сравнение с группой “Контроль”; # – сравнение с группой “Контроль-СИ”; ^ – сравнение с группой “ВКД”, & – сравнение с животными, которые не подвергались острому стрессу, ** – сравнение с группой “Контроль после стресса”; ## – сравнение с группой “Контроль-СИ после стресса”; ^^ – сравнение с группой “ВКД после стресса”.
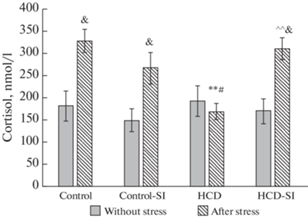
Кратковременное стрессорное воздействие вызывало резкое (в 1.8 раза) повышение уровня кортизола в сыворотке крови крыс контрольной группы по сравнению с таковым у животных, не подвергавшихся плаванию в холодной воде (рис. 7).
Следует охарактеризовать стресс-индуцированные изменения показателей в группе “Контроль” – повышение содержания ТТГ (в 1.8 раза), кортизола (в 1.8 раза) и незначительное нарастание концентрации св. Т3 в сыворотке крови, что, по-видимому, является адекватной физиологической реакцией на кратковременный острый стресс.
В группе “Контроль-СИ” также отмечалось достоверное повышение уровня кортизола в крови (в 1.8 раза), но отсутствовали изменения таких показателей, как ТТГ и св. Т3, характерные для группы “Контроль”. Среднее значение ТТГ в сыворотке крови крыс “Контроль-СИ” после плавания соответствовало таковому в группе “Контроль” после плавания. Но при этом размер ответа на острое стрессорное воздействие был снижен.
В группе “ВКД” при стрессе было отмечено только нарастание уровня ТТГ в сыворотке крови в 1.5 раза по отношению к животным, которые не плавали. Выброс кортизола в кровь через 1 ч после стресса не был зарегистрирован.
В группе “ВКД-СИ” отмечалось повышение уровня кортизола после стресса по аналогии с группой контроля (в 1.8 раза), но реакция со стороны ТТГ отсутствовала. Последнее может быть связано с исходно повышенным уровнем показателя, который более чем в 2 раза превышал значение контроля.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из литературы известно, что изоляция грызунов в раннем детском возрасте вызывает у них впоследствии выраженную тревожность и депрессивность, сопровождаемую снижением уровня кортикостерона в крови (хронический стресс изоляции) и изменениями показателей нейропластичности [12, 13]. При изоляции взрослых животных такие характерные сдвиги могут отсутствовать, но чаще всего отмечается гиперактивный фенотип [12, 13]. В наших экспериментах при испытании в тесте Порсолта у животных группы “Контроль-СИ” было выявлено достоверное увеличение времени первого акта активного плавания по отношению к группе контроля. У животных группы “ВКД” отмечались противоположные сдвиги – уменьшение времени первого акта активного плавания и нарастание длительности замираний. Эти характеристики, по-видимому, свидетельствуют о развитии активного фенотипа на фоне стресса изоляции и признаков депрессивности при высококалорийном питании в условиях группового содержания животных.
В литературе существуют неоднозначные сведения о влиянии социальной изоляции на массу тела животных. Одни авторы указывают на то, что при избыточном питании социальная изоляция у взрослых грызунов способствует нарастанию ожирения и соответствующему изменению метаболических функций [14], а другие – сообщают противоположные результаты [15, 16]. Используемая нами модель социальной изоляции ограничивала нарастание висцерального ожирения и характерных метаболических и гормональных сдвигов, сопутствующих ожирению, а также повышала активность животных в тесте Порсолта. Крысы группы “ВКД” имели наиболее выраженное висцеральное ожирение и проявляли склонность к развитию депрессивности в тесте Порсолта.
Что касается особенностей тиреоидного статуса при ВКД, то в нашей экспериментальной работе подтвердились клинические наблюдения, констатирующие повышение уровня ТТГ при ожирении [2]. Этот факт можно было бы интерпретировать,как показатель гипотиреоза у пациентов с ожирением, однако в наших экспериментах нарастание уровня ТТГ регистрировалось на фоне повышенных концентраций Т3 и Т4 в крови у крыс. Современные исследования свидетельствуют о том, что лептин, вырабатываемый адипоцитами, оказывает регулирующее влияние на секрецию ТТГ – активирует ось гипоталамус-гипофиз-ЩЖ путем влияния на нейроны паравентрикулярного ядра, ответственного за выработку тиреотропин-рилизинг гормона [17]. Высказывается мнение, что повышение уровня ТТГ при ожирении не является следствием гипотиреоза, а служит механизмом, направленным на активацию основного обмена [17]. В нашей работе были выявлены и другие адаптивные компоненты реакции, направленной на активацию метаболизма при избыточном высококалорийном питании и висцеральном ожирении – активация печеночной D1 и повышение уровней Т3 и Т4 в крови. Известно, что Т3 повышает интенсивность липолиза в жировой ткани посредством цАМФ-зависимых механизмов, и, таким образом, влияет на липолиз синергично с адренергической системой [17]. Однако в условиях социальной изоляции характерные для ВКД сдвиги Т3 и Т4 в сыворотке крови отсутствовали, несмотря на повышенный уровень ТТГ.
Заслуживает внимания факт снижения активности ТПО в ткани ЩЖ в группах “ВКД” и “ВКД-СИ”. Возможно, это объясняется накоплением триглицеридов в ткани ЩЖ при ожирении и их токсическим влиянием на функцию органа, что было отмечено и в других работах [18], либо связано с нарастанием свободно-радикальных процессов, это подтверждается повышением уровня МДА (табл. 2). Угнетение активности ТПО при длительном избыточном питании и висцеральном ожирении может свидетельствовать о тенденции к снижению функции ЩЖ, что в перспективе может привести к развитию гипотиреоза.
В литературе очень мало публикаций, рассматривающих проблему ожирения в плане влияния на реактивность регуляторных систем организма в условиях стресса, хотя известно, что при ожирении изменяется целый ряд нейроэндокринных процессов. Изучение реакции на кратковременный стресс в наших экспериментах показало, что у крыс с наиболее выраженным висцеральным ожирением (группа “ВКД”) отсутствует стресс-индуцированное повышения уровня кортизола в крови через 1 ч после воздействия. Можно предположить, что это связано с нейробиологическими механизмами депрессивности у животных с ожирением. По данным литературы пациенты с депрессией отличаются существенными изменениями в системе гипоталамус-гипофиз-кора надпочечников, причем, для пациентов с депрессией характерно притупление реакции гипоталамус-гипофиз-надпочечники и симпатической реакции на острый стресс [19–21]. Существуют сведения о биологической связи между диабетом 2-го типа, характерным для ожирения, депрессивностью и дисрегуляцией в системе гипоталамус-гипофиз-надпочечники, включая реакцию на стресс [22].
Что касается модели социальной изоляции, то у крыс группы “Контроль-СИ” отмечалось повышение активности в тесте Порсолта и тенденция к нарастанию уровня ТТГ, предположительно, в результате хронического стресса изоляции. На фоне длительной социальной изоляции (группы “Контроль-СИ” и “ВКД-СИ”) не проявлялся выброс ТТГ в ответ на кратковременный стресс, который был характерен для крыс группы контроля.
Таким образом, характер питания, а также дефицит социальной активности являются факторами, которые модулируют состояние регуляторных систем и изменяют их реактивность в ответ на острое стрессорное воздействие.
Выводы:
1. Высококалорийная четырехмесячная диета вызывает достоверное нарастание массы тела и массы висцерального жира, систолического артериального давления, уровня глюкозы и триглицеридов в сыворотке крови крыс-самцов линии Вистар. Висцеральное ожирение и повышение уровня триглицеридов наиболее выражено при групповом содержании животных по сравнению с их индивидуальным содержанием в условиях социальной изоляции.
2. Результаты теста Порсолта свидетельствуют о нарастании депрессивности у крыс, получавших высококалорийную диету и о проявлениях активного фенотипа у животных, содержащихся в условиях социальной изоляции.
3. Высококалорийная диета приводит к достоверному нарастанию уровня ТТГ, общих фракций тироксина и трийодтиронина в сыворотке крови крыс, а также к повышению активности печеночной D1, что, по-видимому, носит адаптивный характер, направленный на активацию метаболизма. В условиях сочетанного воздействия высококалорийной диеты и социальной изоляции повышение уровней тироксина и трийодтиронина в крови не наблюдается.
4. На фоне высококалорийной диеты в ткани щитовидной железы регистрируется уменьшение активности ТПО, а также повышение уровней триглицеридов и малонового диальдегида, что в перспективе может привести к снижению функции щитовидной железы.
5. Реакция на кратковременный острый стресс у животных контрольной группы включает резкое повышение содержания кортизола и ТТГ, а также и некоторое нарастание уровня свободного трийодтиронина в сыворотке крови.
6. У крыс, получавших высококалорийную диету, через 1 ч после стресса также отмечается повышенный выброс ТТГ в кровь, но при этом содержание кортизола остается практически без изменений.
7. При индивидуальном содержании животных (социальная изоляция), независимо от характера диеты, наблюдается типичная реакция на стресс в виде выброса кортизола в кровь через 1 ч после воздействия. Однако у этих животных реакция ТТГ на острый стресс не проявляется, поскольку уровень этого показателя является уже несколько повышенным на фоне хронического стресса социальной изоляции.
Таким образом, социальная изоляция и высококалорийная диета, вызывают у крыс-самцов линии Вистар противоположно направленные изменения поведенческих реакций. Эти воздействия, а также их сочетания приводят к специфическим сдвигам функциональной активности оси гипофиз-щитовидная железа и надпочечники, что, в свою очередь, вносит коррективы в физиологическую реакцию на кратковременное стрессорное воздействие.
Список литературы
Engin A (2017) The definition and prevalence of obesity and metabolic syndrome. Adv Exp Med Biol 960: 1–17. https://doi.org/10.1007/978-3-319-48382-5_1
Biondi B (2010) Thyroid and Obesity: An Intriguing Relationship. J Clin Endocrinol Metab 95(8): 3614–3617. https://doi.org/10.1210/jc.2010-1245
Blasco BV, García-Jiménez J, Bodoano I, Gutiérrez-Rojas L (2020) Obesity and Depression: Its Prevalence and Influence as a Prognostic Factor: A Systematic Review. Psychiatry Invest 17(8): 715–724. https://doi.org/10.30773/pi.2020.0099
Fortunato RS, Ignácio DL, Padron ÁS, Peçanha R, Marassi MP, Rosenthal D, Werneck-de-Castro JPS, Carvalho DP (2008) The effect of acute exercise session on thyroid hormone economy in rats. J Endocrinol 198(2): 347–353. https://doi.org/10.1677/JOE-08-0174
Helmreich DL, Tylee D (2011) Thyroid hormone regulation by stress and behavioral differences in adult male rats. Horm Behav 60(3): 284–291. https://doi.org/10.1016/j.yhbeh.2011.06.003
Wong1 S K, Chin K-Y, Suhaimi FH, Fairus A, Ima-Nirwana S (2016) Animal models of metabolic syndrome: a review. Nutrition and metabolism 13: 65–76. https://doi.org/10.1186/s12986-016-0123-9
Mumtaz F, Khan MI, Zubair M, Dehpour AR (2018) Neurobiology and consequences of social isolation stress in animal model-A comprehensive review. Biomed Pharmacother 105: 1205–1222. https://doi.org/10.1016/j.biopha.2018.05.086
Porsolt RD, Berlin A, Jalfre M (1977) Behavioral despair in mice: a primary screening test for antidepressants. Arch Intern Pharmacodyn 229: 327–336.
Митюкова ТА, Чудиловская ЕН, Мигалевич АС (2020) Определение активности тиреопероксидазы в ткани щитовидной железы (экспериментальное исследование). Лаб диагност. Восточн Европа 9(3): 285–293. [Mityukova ТА, Chudilovskaya EN, Migalevitch AS (2020) Determination of thyroid peroxidase activity in thyroid tissue (experimental study). Lab Diagnost. Eastern Europe 9(3): 285–293. (In Russ)].
Kaplan MM, Utiger RD (1978) Iodothyronine metabolism in rat liver homogenates. J Clin Invest 61:459–471. https://doi.org/10.1172/JCI108957
Müller GA, Mathias B (1986) Thiobarbituric acid positive substances as indicators of lipid peroxidation. Z Gesamte Inn Med 41(24): 673–676.
Ieraci A, Mallei A, Popoli M (2016) Social isolation stress induces anxious-depressive-like behavior and alterations of neuroplasticity-related genes in adult male mice. Neural Plast 2016: 6212983. https://doi.org/10.1155/2016/6212983
Begni V, Sanson A, Pfeiffer N, Brandwein C, Inta D, Talbot SR, Riva MA, Gass P, Mallien AS (2020) Social isolation in rats: Effects on animal welfare and molecular markers for neuroplasticity. PLoS One 15(10): e0240439. https://doi.org/10.1371/journal.pone.0240439
Sun M, Choi EY, Magee DJ, Stets CW, During MJ, Lin ED (2014) Metabolic effects of social isolation in adult C57BL/6 mice. Int Sch Res Notices 2014: 690950. https://doi.org/10.1155/2014/690950
Balsevich G, Uribe A, Wagner KV, Hartman J, Santarelli S, Labermaier C, Schmidt MV (2014) Interplay between diet-induced obesity and chronic stress in mice: potential role of FKBP51. J Endocrinol 222(1): 15–26.https://doi.org/10.1530/JOE-14-0129
Patterson ZR, Abizaid A (2013) Stress induced obesity: lessons from rodent models of stress. Front Neurosci 7: 130. https://doi.org/10.3389/fnins.2013.00130
Santini F, Marrullo P, Rotondi M, Ceccarini G, Pagano L, Ippolito S, Chiovato L, Biondi B (2014) The crosstalk between thyroid gland and adipose tissue: signal integration in health and disease. Eur J Endocrinol 171(4): R137–R152. https://doi.org/10.1530/EJE-14-0067
Shao S, Zhao Y, Song Y, Xu C, Yang J, Xuan S, Yan H, Yu C, Zhao M, Xu J, Zhao J (2014) Dietary high-fat lard intake induces thyroid dysfunction and abnormal morphology in rats. Acta Pharmacol Sin 35(11): 1411–1420. https://doi.org/10.1038/aps.2014.82
Yoon KL, Joormann J (2012) Stress reactivity in social anxiety disorder with and without comorbid depression. J Abnorm Psychol 121(1): 250–255. https://doi.org/10.1037/a0025079
Steudte-Schmiedgen S, Wichmann S, Stalder T, Hilbert K, Muehlhan M, Lueken U, Beesdo-Baum K (2017) Hair cortisol concentrations and cortisol stress reactivity in generalized anxiety disorder, major depression and their comorbidity. J Psychiatr Res 84: 184–190. https://doi.org/10.1016/j.jpsychires.2016.09.024
Funke R, Eichler A, Distler J, Golub Y, Kratz O, Moll GH (2017) Stress system dysregulation in pediatric generalized anxiety disorder associated with comorbid depression. Stress Health 33(5): 518–529. https://doi.org/10.1002/smi.273622
Joseph JJ, Golden SH (2017) Cortisol dysregulation: the bidirectional link between stress, depression, and type 2 diabetes mellitus. Ann NY Acad Sci 1391(1): 20–34. https://doi.org/10.1111/nyas.13217
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


