Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 354-368
Влияние йодсодержащих гормонов щитовидной железы на активность центрального отдела стресс-лимитирующей системы
И. В. Городецкая 1, Е. А. Гусакова 1, *
1 Витебский государственный ордена Дружбы народов медицинский университет
Витебск, Беларусь
* E-mail: elena-gusakova83@mail.ru
Поступила в редакцию 15.12.2021
После доработки 24.01.2022
Принята к публикации 27.01.2022
- EDN: OMMNAQ
- DOI: 10.31857/S0869813922030037
Аннотация
Несмотря на доказанное значение йодсодержащих тиреоидных гормонов (ЙТГ) в “антистресс-системе”, их воздействие на центральные стресс-лимитирующие системы не исследовано. Цель работы – изучить влияние ЙТГ на содержание глицина в больших полушариях головного мозга (БПГМ) при стрессе и установить его значимость в ограничении интенсивности стресс-реакции в этих условиях. Работа выполнена на 210 белых беспородных крысах-самцах. Стресс – ситуация “дефицита времени”. Модуляция тиреоидного статуса: введение синтетического тиреостатика мерказолила, нарушающего синтез тироксина и трийодтиронина (внутрижелудочно, 25 мг/кг, 20 дней), или малых доз L-тироксина (таким же образом 1.5–3.0 мкг/кг, 28 дней). Содержание глицина в БПГМ определяли хроматографически, концентрацию ЙТГ в крови – иммуноферментным методом. Стресс вызывал увеличение уровня ЙТГ в крови на 23–44%, повышение относительной массы надпочечников (на 28%), падение таковой тимуса и селезенки (на 26 и 13%), повреждение слизистой оболочки желудка (СОЖ) (у 80% животных с тяжестью 1 балл у 20% крыс, 2 балла у 30%, 3 балла у 30% животных, с индексом поражения 1.36) и не изменял содержание глицина в БГПМ. Введение L-тироксина не влияло на указанные показатели per se, лимитировало повышение уровня ЙТГ в крови на 9–3%, ограничивало рост относительной массы надпочечников на 12%, падение таковой тимуса и селезенки на 15 и 7%, минимизировало повреждение СОЖ при стрессе, определяя более высокий уровень глицина в БПГМ – на 59%. Гипотиреоз препятствовал активации тиреоидной функции при стрессе, вследствие чего он развивался на фоне сниженной на 17–22% концентрации ЙТГ в крови, устранял изменения относительной массы стресс-сенситивных органов, провоцировал большее повреждение СОЖ в этих условиях. Этому соответствовала более низкая концентрация глицина в БПГМ. Прямая корреляционная связь между уровнем глицина и содержанием ЙТГ в группах животных, перенесших стресс на фоне введения мерказолила или малых доз L-тироксина, означает, что чем выше концентрация ЙТГ в крови, тем больше уровень глицина в БПГМ. Таким образом, важную роль в ограничении интенсивности стресс-реакции и повышении устойчивости организма к стрессу под влиянием ЙТГ, возможно, имеет их стимулирующее воздействие на содержание глицина в БПГМ.
Стресс – это состояние, возникающее в результате нарушения гомеодинамического равновесия, которое может вызвать воздействие широкого спектра стрессоров (внутренних или внешних, реальных или ожидаемых) [1].
Деятельность “стресс-системы” (механизмы, участвующие в реализации стресс-реакции) ограничивает “антистресс-система” (механизмы, препятствующие реализации стресс-реакции: 1) механизм саморегуляции (компонентами самой системы по принципу отрицательной обратной связи); 2) механизм внешней регуляции (модуляторными регуляторными стресс-лимитирующими системами). Реализация центрального механизма “антистресс-системы” опосредована ГАМК-, глицин-, опиоид-, дофамин-, серотонинергическими нейронами головного мозга [2].
Роль глицина как важного тормозного нейромедиатора признана, начиная с конца 70-х годов прошлого века [3]. Глицинергическая трансмиссия играет ключевую роль в регуляции координации движений, сенсорной рефлекторной активности и дыхательных ритмов. Концентрация глицина в синаптической щели регулируется транспортерами глицина (GlyT1 и GlyT2), которые влияют на его обратный захват. Быстрая тормозная нейротрансмиссия в этих синапсах опосредована глициновыми рецепторами (GlyR). Комплекс GlyR-белок может находиться: 1) в закрытом (без лиганда), 2) открытом или десенситизированном (в связи с лигандом), 3) связанном с аллостерическим модулятором состоянии, что составляет структурную основу для управления и модуляции работы лиганд-зависимого ионного канала GlyR. Помимо способности связываться с собственными GlyR, глицин может служить лигандом и для ГАМКА-рецепторов, принадлежащих, как и GlyR, к суперсемейству пентамерных ионных каналов [4], повышая выделение основного тормозного медиатора центральной нервной системы (ЦНС) гамма-аминомасляной кислоты (ГАМК) после связывания с ними. Сложная регуляция внеклеточного уровня глицина, его взаимодействие с глутамат- и ГАМК-ергическими системами свидетельствуют об участии глицина в процессе объемной передачи информации в нервной системе [5].
Для хранения и высвобождения тормозных нейромедиаторов (ГАМК, глицина, иногда и того и другого в одних и тех же везикулах) важное значение имеют переносчики: везикулярный транспортер ингибиторов аминокислот (VIAAT) и везикулярный транспортер ГАМК (VGAT) [6]. Совместное высвобождение (co-release) ГАМК и глицина в одних и тех же пресинаптических терминалях было описано еще в 1997 г. Относительно недавно было установлено их взаимодействие на постсинаптическом уровне [3]. Глицин играет роль не только в тормозной (преимущественно в каудальных областях ЦНС – спинном мозге и стволе головного мозга), но и в возбуждающей глутаматергической нейротрансмиссии, действуя как коагонист NMDAR (рецептора N-Метил-D-аспартата), участвует в передаче сигналов в глутаматергических путях как на пресинаптическом, так и на постсинаптическом уровне, взаимодействуя с белками постсинаптического уплотнения (плотная зона с внутренней стороны постсинаптической мембраны, содержащая конструкцию GluR, молекулы клеточной адгезии, белки цитоскелета), конформация которых определяет тип и функцию GluR. Глицин влияет и на взаимодействие глутамата и дофамина. Регуляция активности дофамин- и глицинергических трансмиттерных путей в переднем мозге носит характер реципрокных отношений [7].
Глицин уменьшает активность c-Jun N-терминальной киназы, ограничивает оксидативный стресс и повышает экспрессию антиоксидантных ферментов, что лежит в основе его нейропротекторного эффекта: минимизации апоптотической нейродегенерации, воспаления, синаптической дисфункции, нарушения памяти [8]. Глицин защищает ЦНС от действия избытка катехоламинов [9], оказывает общеметаболическое действие [10], влияет на развитие нервной системы в онтогенезе [11], участвует в процессе обучения, улучшая ментальные способности [12].
Важная роль в регуляции активности механизмов “антистресс-системы” принадлежит йодсодержащим тиреоидным гормонам (ЙТГ), вследствие чего они оказывают защитное действие при стрессах различной природы и сложности – иммобилизационном, холодовом, тепловом, гипоксическом [13].
Предыдущие исследования механизмов антистрессорного эффекта ЙТГ были связаны с изучением их влияния на активность локальных стресс-лимитирующих факторов: адениннуклеотидов [14], простагландинов [15], антиоксидантных ферментов [16], белков теплового шока [17]. Затем было показано, что ЙТГ стимулируют экспрессию ранних генов c-fos и c-jun в миокарде [18], лимитируют избыточную интенсификацию активности трипсиноподобных протеиназ в печени и крови [19] при стрессе за счет их нормализующего влияния на активность основных ингибиторов протеиназ (α1-антитрипсина и α2-макроглобулина), проницаемость мембран лизосом гепатоцитов, микроструктуру печени в этих условиях [20]. Однако экспериментов, касающихся влияния тиреоидного статуса на центральные механизмы “антистрес-системы”, не проводилось. Вместе с тем, в литературе имеются сведения об изменении уровня тормозных медиаторов при нарушениях функции щитовидной железы: при гипотиреозе – глицина [21], серотонина [22], дофамина [23]; при тиреотоксикозе – ГАМК [24], глицина [25]. Это позволяет предполагать возможность участия ЙТГ в регуляции активности центрального отдела стресс-лимитирующей системы при стрессе.
Цель исследования: изучить влияние йодсодержащих гормонов щитовидной железы на содержание глицина в больших полушариях головного мозга при стрессе и установить его значимость в ограничении интенсивности стресс-реакции в этих условиях.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 210 белых половозрелых беспородных крысах-самцах (возраст 3 месяца, масса 220–240 г). Эксперименты проведены с соблюдением требований Директивы 2010/63/EU Европейского парламента и Совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Животные были разделены на следующие группы: “Интактные”, “Контроль”, “Стресс”, “Тироксин”, “Тироксин + стресс”, “Мерказолил”, “Мерказолил + стресс”.
Стресс вызывали, моделируя ситуацию “дефицита времени” – спиралевидный вертикально стоящий туннель, в начале которого находилась крыса, быстро заполняли холодной водой (T 4°C), что заставляло животное перемещаться вверх для предотвращения контакта с ней. После тестирования крыс обсушивали и помещали в индивидуальные клетки [26].
L-тироксин (Berlin-Chemie AG, “Менарини Групп”, Германия) вводили внутрижелудочно специальным металлическим зондом с шаровидным наконечником в 1%-ном крахмальном клейстере в течение 28 дней в малых дозах (1-я нед. – 1.5 мкг/кг массы тела; 2-я нед. – 2 мкг/кг; 3-я нед. – 2.5 мкг/кг; 4-я нед. – 3 мкг/кг), которые, как было установлено ранее, не влияли на прирост массы тела, частоту сердечных сокращений, концентрацию ЙТГ в крови [13].
Мерказолил (ООО “Фармацевтическая компания “Здоровье”, Украина), синтетический тиреостатик, нарушающий синтез тироксина и трийодтиронина, вводили таким же способом в течение 20 дней (25 мг/кг).
Крысам групп “Контроль” и “Стресс” внутрижелудочно вводили 1%-ный крахмальный клейстер в течение 28 дней.
Ситуацию “дефицита времени” воспроизводили на следующие сутки после окончания введения 1%-ного крахмального клейстера (группа “Стресс”), L-тироксина (группа “Тироксин + стресс”) или мерказолила (группа “Мерказолил + стресс”). Забой животных осуществляли под уретановым наркозом (внутрибрюшинно 1 г/кг) через 1 ч после стресса или на следующие сутки после курса введения крахмального клейстера (группа “Контроль”) или препаратов, модулирующих тиреоидный статус (группы “Тироксин”, “Мерказолил”). За сутки до забоя крыс подвергали пищевой депривации, сохраняя свободный доступ к воде. Это было связано с тем, что при голодании уменьшается продукция защитного слоя слизи, содержание неферментативного антиоксиданта глутатиона, повышается обратная диффузия ионов водорода и стимулируется процесс перекисного окисления липидов [27].
Интенсивность стресс-синдрома оценивали по изменениям относительной массы (отношение абсолютной массы органа к массе тела) стресс-сенситивных органов (надпочечников, селезенки, тимуса), состояния слизистой оболочки желудка (СОЖ) (в отраженном свете под малым увеличением). Оценивали: частоту поражения (отношениe числа животных, имевших кровоизлияния в слизистой, к общему количеству крыс в группе, выраженное в %); его тяжесть (в баллах: 0 – отсутствие кровоизлияний; 0.5 – гиперемия; 1 – единичные (1 или 2) точечные кровоизлияния; 2 – множественные (более 3) незначительные (площадью около 1 мм2) кровоизлияния; 3 – множественные значительные (площадью более 1 мм2) кровоизлияния; 4 – массивные кровоизлияния, охватывающие практически всю поверхность слизистой; индекс (произведение частоты и средней тяжести поражения (общее число баллов в группе, деленное на количество животных в ней) в группе, деленное на 100).
Уровень ЙТГ – трийодтиронина (Т3) и тироксина (Т4) (нмоль/л), их свободных фракций (Т3св и Т4св) (пмоль/л) в сыворотке крови определяли иммуноферментным методом с помощью набoров реактивов “ДС-ИФА-Тироид-Т3общий”, “ДС-ИФА-Тироид-Т4общий”, “ДС-ИФА-Тироид-Т3свободный”, “ДС-ИФА-Тироид-Т4свободный” (НПО Диагностические системы, Россия).
Определение содержания глицина в больших полушариях головного мозга (БПГМ, брали ткань обоих полушарий) проводили на высокоэффективном жидкостном хроматографе Eхion LC (Сингапапур) с тандемным высоэффективным жидкостным хромато-масс-спектрометром на базе тройного квадрополя QTRAP-5500 LC-MS/МS System (Сингапапур). Режим ионизации – электрораспылительная ионизация. Использовалась колонка Аgilent AdvanceВio ААА C18, 2.7 мкм (размер частиц), 4.6 × 100 мм (внутренний диаметр и длина) (США). Температура автосамплера 4°С, температура колонки 30°С. Использовали метод стандартных добавок, основанный на введении в анализируемую смесь известного количества определяемого вещества и сравнения сигналов, полученных от растворов со стандартной добавкой и без добавки определяемых веществ. Для составления программы градиента использовали 2 подвижные фазы: А – вода для высокоэффективной жидкостной хроматографии; В – ацетонитрил, содержащий 0.1% муравьиной кислоты (рН 3.4). Для проведения хроматографии ткань больших полушарий головного мозга крыс тщательно растирали в фарфоровой ступке пестиком, затем гомогенизировали в жидком азоте в этой же ступке. После испарения жидкого азота по 50 мг полученного гомогената переносили в 2 полимерные пробирки Precellys Lising kit СК-14 (Франция) для гомогенизации тканей. В 1-ю пробирку добавляли 10 мкл дистиллированной воды, во 2-ю – 10 мкл смеси аминокислот и биогенных аминов (содержание глицина 2.5 мкг). В качестве растворителя использовали дистиллированную воду. В обе пробирки добавляли по 1 мл ацетонитрила. Гомогенизацию проводили дважды в гомогенизаторе Precellys 24 (Франция) по программе 2 (5000-2*20-0.05). Затем пробирки помещали в ультразвуковую ванну на 5 мин (частота 35 кГц, мощность 99%). Далее проводили центрифугирование (Gyrozen mini, Корея) в течение 10 мин при 13500 оборотов/мин. 0.1 мл супернатанта добавляли к 1.9 мл 0.1%-ного раствора муравьиной кислоты. 1 мл полученной смеси переносили в стеклянный флакон. Концентрацию глицина в БПГ крыс определяли путем сравнения площади пика, соответствующего определяемому веществу на хроматограмме испытуемого раствора, и площади пика определяемого вещества на хроматограмме испытуемого раствора с известной добавкой определяемого вещества.
Статистическую обработку результатов проводили с помощью программы “Statistica 10.0” (StatSoftinc., STA999K347156-W), используя непараметрические методы. При межгрупповом сравнении для анализа различий по количественным параметрам применяли U-критерий Манна–Уитни. Данные по частоте поражения СОЖ, являющиеся качественными бинарными признаками, обрабатывали с использованием модулей “Непараметрические статистики”, “Таблицы 2 × 2” (точный критерий Фишера). Оценку силы связи между двумя количественными параметрами проводили непараметрическим методом ранговой корреляции Спирмена (r) для двухсторонней связи. При величине r ниже 0.3 делали заключение о слабой выраженности связи, от 0.3 до 0.69 – о средней, от 0.7 и выше – о сильной. Критическим уровнем значимости был принят при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У контрольных животных, которым вводили 1%-ный крахмальный клейстер, все исследованные нами показатели не отличались от таковых у интактных и составили: уровень Т3 1.50 (1.48; 1.56) нмоль/л, Т4 70.39 (63.39; 74.37) нмоль/л, Т3св 1.73 (1.66; 1.82) пг/мл, Т4св 11.56 (10.62; 12.32) пмоль/л, величина относительной массы надпочечников 0.18 (0.17; 0.20) мг/г, тимуса 2.17 (2.01; 2.28) мг/г, селезенки 4.03 (3.92; 4.24) мг/г; концентрация глицина в БПГМ 89.93 (74.94; 99.97) мкг/г ткани.
Воздействие ситуации “дефицита времени” привело к увеличению содержания ЙТГ в крови, особенно их свободных фракций: Т3 на 23%, Т4 на 28%, Т3св на 32%, Т4св на 44% (рис. 1). Относительная масса надпочечников повысилась на 28%, таковая тимуса и селезенки упала на 26 и 13% (табл. 1). Повреждение СОЖ наблюдалось у 80% животных с тяжестью 1 балл у 20% крыс, 2 балла у 30%, 3 балла у 30% животных. Индекс поражения был равен 1.36. Содержание глицина в БПГМ не изменилось. Между уровнем ЙТГ в крови и концентрацией глицина в БПГМ наблюдалась обратная корреляция: с Т3 средней степени (r = –0.68; р < 0.05), с Т4 и Т3св – сильной (r = –0.71; р < 0.01 в обоих случаях) (табл. 2).
Рис. 1.
Влияние введения L-тироксина или мерказолила на изменение концентрации (%) общего тироксина (Т4), общего трийодтиронина (Т3), свободного тироксина (fТ4), свободного трийодтиронина (fТ3) в крови крыс при стрессе. Каждая экспериментальная группа состояла из 6 животных; здесь и в таблицах 2 и 3 – группы животных: С – “Контроль”; S – “Стресс”; Т – “Тироксин”; ТS – “Тироксин + стресс”; М – “Мерказолил”; М – “Мерказолил + стресс”; р < 0.05 по отношению: * – к группе “Контроль”; # – к группе “Стресс”; + – к группам “Контроль” и “Стресс”; о – к группе “Тироксин”; ^ – к группе “Мерказолил”.
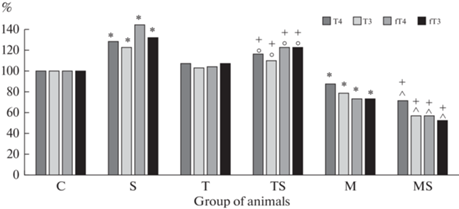
Таблица 1.
Влияние йодсодержащих тиреоидных гормонов на концентрацию глицина в больших полушариях головного мозга, относительную массу стресс-сенситивных органов, состояние слизистой оболочки желудка при стрессе
| Группа животных | Содержание
глицина, мкг/г ткани |
Относительная масса, мг/г | Поражение СОЖ | ||||
|---|---|---|---|---|---|---|---|
| надпочечников | тимуса | селезенки | частота, % | тяжесть, баллы | индекс поражения |
||
| 1. Контроль | 89.93 (74.94; 99.97) |
0.18 (0.17; 0.20) |
2.17 (2.01; 2.28) |
4.03 (3.92; 4.24) |
10 | 1 у 10% | 0.01 |
| 2. Стресс | 72.86 (56.32; 81.37) |
0.23 (0.22; 0.25) |
1.60 (1.34; 1.81) |
3.49 (3.32; 3.74) |
80 | 1 у 20%; 2 у 30%; 3 у 30% |
1.36 |
| p 1–2 | р > 0.05 | р < 0.01 | р < 0.01 | р < 0.01 | р < 0.01 | р < 0.01 | |
| 3. Тироксин | 91.76 (88.94; 103.15) |
0.19 (0.17; 0.20) |
2.23 (2.04; 2.38) |
4.11 (3.91; 4.36) |
10 | 1 у 10% | 0.01 |
| p 1–3 | р > 0.05 | р > 0.05 | р < 0.05 | р > 0.05 | p > 0.05 | p > 0.05 | |
| 4. Тироксин + стресс | 126.11 (109.62;147.89) |
0.21 (0.20; 0.22) |
1.93 (1.83; 1.98) |
3.79 (3.63; 3.85) |
30 | 1 у 20%; 2 у 10% | 0.12 |
| p 3–4 | р > 0.05 | р < 0.05 | р < 0.05 | р < 0.05 | р > 0.05 | р > 0.05 | |
| p 1–4 | р < 0.1 | р < 0.05 | р < 0.05 | р < 0.05 | р > 0.05 | р > 0.05 | |
| p 2–4 | р < 0.01 | р < 0.05 | р < 0.01 | р < 0.05 | p < 0.01 | p < 0.05 | |
| 5. Мерказолил | 79.34 (76.56. 83.05) |
0.15 (0.14; 0.15) |
1.79 (1.66; 1.93) |
3.42 (3.35; 3.68) |
20 | 1 у 20% | 0.04 |
| p 1–5 | р > 0.05 | р < 0.05 | р < .01 | р < 0.01 | p > 0.05 | р > 0.05 | |
| 6. Мерказолил + стресс | 52.89 (41.88; 56.76) |
0.14 (0.13; 0.15) |
1.62 (1.37; 1.69) |
3.38 (3.28; 3.67) |
100 | 2 у 20%; 3 у 80% | 2.80 |
| p 5–6 | р < 0.01 | р > 0.05 | р < 0.05 | р > 0.05 | р < 0.05 | р < 0.01 | |
| p 1–6 | р < 0.05 | р < 0.05 | р < 0.01 | р < 0.01 | р < 0.05 | р < 0.01 | |
| p 2–6 | р < 0.05 | р < 0.01 | р > 0.05 | р > 0.05 | p > 0.05 | р < 0.05 | |
| р 4–6 | р < 0.01 | р < 0.01 | р < 0.01 | р < 0.01 | р < 0.01 | р < 0.01 | |
Примечание: данные по уровню глицина, относительной массе стресс-сенситивных органов представлены в виде Ме (LQ; UQ) (Me – медиана, (LQ; UQ) – интерквартильный интервал: верхняя граница нижнего квартиля (LQ) и нижняя граница верхнего квартиля (UQ)), по тяжести поражения слизистой оболочки желудка в виде абсолютных и относительных частот; здесь и в табл. 2 и 3: р – обозначение достоверности различий; содержание глицина, относительную массу стресс-сенситивных органов определяли у 6 животных из каждой экспериментальной группы, тяжесть поражения СОЖ – у 10, частоту – у 30.
Таблица 2.
Коэффициент корреляции между содержанием глицина в больших полушариях головного мозга и концентрацией йодсодержащих тиреоидных гормонов в крови при стрессе
| Параметры | Группы животных | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| С-S | Т-S | Т-ТS | ТS-C | ТS-S | М-C | М-МS | МS-К | МS-S | МS-ТS | |
| Т3 | –0.68 p < 0.05 |
–0.49 p > 0.05 |
0.15 р > 0.05 |
0.17 р > 0.05 |
–0.83 р < 0.01 | 0.04 p > 0.05 |
0.82 p < 0.01 |
0.46 p > 0.05 |
0.54 p < 0.01 |
0.74 p < 0.01 |
| Т4 | –0.71 p < 0.01 |
–0.43 p > 0.05 |
0.28 p > 0.05 |
0.29 p > 0.05 |
–0.82 p < 0.01 |
-0.06 p > 0.05 |
0.69 p < 0.05 |
0.35 р > 0.05 |
0.37 р > 0.05 |
0.69 р < 0.05 |
| fT3 | –0.71 p < 0.01 |
–0.45 p > 0.05 |
0.28 p > 0.05 |
0.29 p > 0.05 |
–0.82 p < 0.01 |
-0.38 p > 0.05 |
0.82 p < 0.01 |
0.14 р > 0.05 |
0.52 р < 0.05 |
0.74 р < 0.01 |
| fT4 | –0.55 p > 0.05 |
–0.08 p > 0.05 |
0.19 p > 0.05 |
0.46 p > 0.05 |
–0.82 p < 0.01 |
0.08 p > 0.05 |
0.78 р < 0.01 |
0.51 р < 0.05 |
0.52 р < 0.05 |
0.74 р < 0.01 |
Следовательно, стресс, моделируемый нахождением крыс в ситуации “дефицита времени”, активирует функцию щитовидной железы и сопровождается развитием “триады” классических признаков. Содержание глицина в БГПМ в этих условиях не изменяется.
Для проверки высказанной нами гипотезы о возможности участия ЙТГ в регуляции активности центрального звена стресс-лимитирующей системы далее мы оценили, с одной стороны, влияние введения близких к физиологическим доз ЙТГ, с другой, гипотиреоза, на устойчивость организма к стрессу, сопоставив его с уровнем ЙТГ в крови и содержанием глицина в БПГМ.
Введение L-тироксина в избранных нами дозах (группа “Тироксин”) не повлияло на концентрацию ЙТГ в крови и глицина в БПГМ, как и на относительную массу изученных стресс-сенситивных органов, и состояние СОЖ. В связи с тем, что после курсового введения L-тироксина не изменилась ни концентрация ЙТГ в крови, ни уровень глицина в БПГМ, корреляция между ними отсутствовала.
После стресса у крыс, которым вводили L-тироксин, содержание ЙТГ в крови увеличилось как и у животных группы “Стресс”, не получавших L-тироксина, но в меньшей степени: по отношению к ее значению в группе “Тироксин” концентрация Т3 повысилась только на 7%, Т4 на 9%, Т3св на 16%, Т4св на 25%. Относительная масса стресс-сенситивных органов изменилась менее значительно, чем у животных, перенесших стресс без L-тироксина: по сравнению с ее величиной в группе “Тироксин” относительная масса надпочечников повысилась на 9%, тимуса и селезенки упала – на 14 и 8%. Повреждение СОЖ наблюдалось у меньшего по сравнению с группой “Стресс” числа животных – у 30%. Его тяжесть (1 балл у 20% и 2 у 10% животных) не отличалась от таковой в группе “Тироксин”. Индекс поражения составил 0.12. Менее существенным изменениям со стороны изученных нами стресс-сенситивных органов соответствовал более высокий уровень глицина в БПГМ – по сравнению с таковым у животных, подвергнутых стрессу и не получавших L-тироксин, в группе “Тироксин + стресс” он был выше на 59%. Между концентрацией ЙТГ (общих и свободных) в крови и уровнем глицина в БПГМ не было обнаружено корреляционной связи, что связано с изменением содержания ЙТГ на фоне отсутствия роста концентрации глицина.
По отношению к его величине в группе “Контроль” содержание Т3 в крови у животных, получавших L-тироксин и подвергнутых стрессу, было выше на 10%, Т4 на 16%, Т3св на 23%, Т4св на 29%. Относительная масса надпочечников была больше на 16%, таковая тимуса и селезенки, напротив, ниже – на 11 и 6%. Корреляционной связи между содержанием глицина и концентрацией ЙТГ в группах “Контроль” и “Тироксин + стресс” не выявлено.
По сравнению с его значением в группе “Стресс” содержание ЙТГ в крови было ниже: Т3 на 13%, Т4 на 12%, Т3св на 9%, Т4св на 11%. Относительная масса надпочечников была меньше на 12%, тимуса и селезенки, наоборот, выше – на 15 и 7%. Тяжесть поражения СОЖ была меньшей, как и частота – на 50%, и индекс поражения – в 11.3 раза. Это коррелировало, как уже отмечено, с более высокой концентрацией глицина в БПГМ. Между ее значением и уровнем всех форм ЙТГ была обнаружена обратная корреляционная связь, выраженная в сильной степени: для Т3r = –0.83, для Т4, Т3св и Т4св r = –0.82 (р < 0.01 во всех случаях).
Следовательно, введение L-тироксина лимитирует возрастание концентрации ЙТГ в крови и минимизирует интенсивность стресс-реакции, вследствие чего повышает устойчивость организма к стрессу. Одним из механизмов такого эффекта является увеличение уровня тормозного медиатора глицина в БПГМ, что ограничивает активность стресс-реализующих систем.
Далее в соответствии с нашим предположением о стимулирующем воздействии ЙТГ на содержание глицина в головном мозге при стрессе мы изучили влияние на него гипотиреоза и оценили корреляцию между указанным параметром и показателями, характеризующими тиреоидную функцию и интенсивность стресс-реакции.
Введение мерказолила привело к уменьшению содержания ЙТГ в крови: Т3 на 21%, Т4 на 13%, Т3св на 27%, Т4св на 26%. Относительная масса надпочечников также снизилась – на 17%, как и таковая селезенки и тимуса – на 18 и 15%. Повреждение СОЖ наблюдалось у 20% крыс с тяжестью 1 балл. Индекс поражения составил 0.04. Концентрация глицина в БПГМ не изменялась. Корреляционная связь между уровнем глицина и содержанием ЙТГ отсутствовала. Это связано с тем, что после введения мерказолила концентрация ЙТГ в крови снизилась, а уровень глицина в БПГМ не изменился.
Следовательно, примененные нами дозы мерказолила вызывают развитие гипотиреоидного состояния у экспериментальных животных, уменьшение относительной массы стресс-сенситивных органов и не влияют на концентрацию глицина в БГПМ.
После стресса у крыс, получавших мерказолил, содержание ЙТГ в крови не возросло, как у подвергнутых стрессу эутиреоидных животных, а уменьшилось: по отношению к ее значению в группе “Мерказолил” концентрация Т3 упала на 22%, Т4 на 16%, Т3св на 21%, Т4св на 17%. Относительная масса надпочечников и селезенки в отличие от таковой в группе “Стресс” не изменилась. Относительная масса тимуса снизилась, но в меньшей степени – на 7%. Повреждение СОЖ наблюдалось у всех животных с большей тяжестью – 2 балла у 20% и 3 у 80% крыс и индексом поражения 2.8. Уровень глицина в БПГМ в отличие от крыс, перенесших стресс и не получавших мерказолил, у которых он не изменился, в группе “Мерказолил + стресс” уменьшился – на 28%. Корреляционная связь между концентрацией ЙТГ в крови и уровнем глицина в БПГМ поменяла свое направление и стала прямой: коэффициент корреляции с концентрацией Т3, Т3св и Т4 св составил 0.82, 0.82 и 0.78 (р < 0.01, сильная связь), с содержанием Т4 0.69 (р < 0.05, средняя связь). Это свидетельствует о том, что чем выше уровень ЙТГ в крови, тем больше содержание глицина в БПГМ при стрессе.
По сравнению с его величиной в группе “Контроль” уровень Т3 в крови был ниже на 43%, Т4 на 29%, Т3св на 48%, Т4св на 43%. Относительная масса надпочечников, тимуса и селезенки также была меньше – на 22, 25 и 16%. Содержание глицина в БПГМ было ниже на 41%. Между ним и уровнем Т4св в группе “Контроль” зарегистрирована прямая корреляционная связь, выраженная в средней степени (r = 0.51; р < 0.05).
По отношению к ее значению в группе “Стресс” концентрация ЙТГ была ниже: Т3 на 98%, Т4 на 43%,и Т3св на 71%, Т4св на 61%. Относительная масса надпочечников была меньше на 50%. Тяжесть поражения СОЖ была большей, как и индекс поражения – в 2.1 раза. Уровень глицина в БПГМ был ниже 22%. Между содержанием Т3, Т3св и Т4св в крови и концентрацией глицина в БПГМ наблюдалась прямая корреляционная связь средней степени (r = 0.54; 0.52; 0.52; р < 0.05).
Следовательно, экспериментальный гипотиреоз предотвращает стимуляцию функции щитовидной железы при стрессе, вследствие чего уровень ЙТГ в крови в этих условиях снижается. Этому соответствует отсутствие возрастания относительной массы надпочечников и большее повреждение СОЖ. Указанные изменения развиваются на фоне более низкой концентрации глицина. Прямая корреляционная связь между уровнем глицина и содержанием ЙТГ у гипотиреоидных животных, подвергнутых стрессу, означает, что чем последнее ниже, тем меньше концентрация глицина в БПГМ.
Это означает, что результаты эксперимента доказали нашу гипотезу, так как концентрация глицина у животных группы “Мерказолил + стресс” была ниже, в то время как в группе “Тироксин + стресс”, напротив, выше, чем у крыс группы “Стресс”, что коррелировало с уровнем ЙТГ в крови и устойчивостью к стрессу.
При анализе корреляции между содержанием глицина и уровнем ЙТГ в группах “Мерказолил + стресс” и “Тироксин + стресс” выявлена прямая связь, выраженная в сильной степени для Т3 и свободных фракций ЙТГ (r = 0.74; р < 0.01), в средней – для Т4 (r = 0.69; р < 0.05) (табл. 2). Корреляция между концентрацией глицина в БПГМ и относительной массой надпочечников и тимуса была прямой, сильной (r = 0.75 и 0.85 соответственно; р < 0.01), тогда как между ней и параметрами поражения СОЖ обратной: средней степени – с частотой (r = –0.61; р < 0.05), сильной степени – с тяжестью (r = –0.83; р < 0.01) (табл. 3).
Таблица 3.
Коэффициент корреляции между уровнем глицина в головном мозге и относительной массой надпочечников (ОМН), тимуса (ОМТ) и селезенки (ОМС), частотой (ЧП) и тяжестью (ТП) поражения слизистой оболочки желудка в условиях стресса
| Параметры | Группы животных | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| С-S | Т-S | Т-ТS | ТS-C | ТS-S | М-C | М-МS | МS-К | МS-S | МS-ТS | |
| ОМН | –0.53 р > 0.05 |
0.15 р > 0.05 |
0.67 р < 0.05 |
0.42 р > 0.05 |
–0.57 р > 0.05 |
0.14 р > 0.05 |
0.07 р > 0.05 |
0.18 р > 0.05 |
0.21 р > 0.05 |
0.75 р < 0.01 |
| ОМТ | 0.39 р > 0.05 |
0.36 р > 0.05 |
–0.15 р > 0.05 |
–0.26 р > 0.05 |
0.65 р > 0.05 |
0.38 р > 0.05 |
0.73 р < 0.01 |
0.70 р < 0.01 |
0.03 р > 0.05 |
0.85 р < 0.01 |
| ОМС | 0.52 р > 0.05 |
0.21 р > 0.05 |
–0.14 р > 0.05 |
–0.27 р > 0.05 |
0.66 р > 0.05 |
0.28 р > 0.05 |
–0.05 р > 0.05 |
0.25 р > 0.05 |
–0.39 р > 0.05 |
0.52 р > 0.05 |
| ЧТ | –0.82 р < 0.01 |
–0.45 р > 0.05 |
0.08 р > 0.05 |
–0.02 р > 0.05 |
–0.56 р > 0.05 |
–0.52 р > 0.05 |
–0.81 р < 0.01 |
–0.86 р < 0.01 |
–0.48 р > 0.05 |
-0.61 р < 0.05 |
| ТП | –0.69 р < 0.05 |
–0.45 р > 0.05 |
0.08 р > 0.05 |
–0.02 р > 0.05 |
–0.63 р < 0.05 |
–0.52 р > 0.05 |
–0.88 р < 0.01 |
–0.78 р < 0.01 |
–0.44 р > 0.05 |
-0.83 р < 0.01 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Развивающаяся в результате воздействия стрессоров реакция изменяет гомеостаз. Это измененное состояние – аллостаз (греч. “другое состояние”) – инициирует физиологические реакции, конечный смысл которых – адаптация к стрессу. Они опосредованы активацией гипоталамо-гипофизарно-надпочечниковой оси и вегетативной нервной системы, а также их влиянием на метаболизм и иммунную систему. При нарушении регуляции указанных взаимодействий развивается изнашивание систем, ответственных за адаптацию, т.е. аллостатическая нагрузка может привести к перегрузке [28].
Вероятность такого события зависит от соотношения двух сил: нарушающих гомеостаз (физических и эмоциональных факторов) и инициирующих адаптивные реакции (специфические и неспецифические) [1]. ЙТГ являются эндокринными посредниками, необходимыми для нормального развития и функционирования каждого позвоночного животного. Механизмы действия ЙТГ позволяют предположить возможность их участия в реализации обоих типов адаптации.
Геномный механизм (реализующийся, во-первых, классическим путем – после связывания Т3 с ядерными рецепторами в специфических элементах ответа, расположенными в промоторах генов-мишеней [29]; во-вторых, неклассическим – за счет внутриклеточных сигнальных каскадов PI3K (фосфатидилинозитол-3-киназного), одного из МАРК-сигнальных путей (mitogen-activated protein kinase) – ERK1/2 (extracellular signaling related kinase, Akt/PKB (протеинкиназа В) сигнального пути [30]), этот путь приводит к синтезу специфических клеточных белков.
Негеномный механизм (заключающийся в увеличении проницаемости клеточных мембран и стимуляции энергетических процессов в митохондриях) создает субстратную и энергетическую базу для реализации адаптационных реакций.
Ситуация “дефицита времени”, смоделированная в наших опытах и вызывающая у животных развитие эмоционального стресса вследствие формирования отрицательных эмоций, возникающих из-за невозможности достижения полезного приспособительного результата, сопровождается появлением классических признаков стресс-реакции (увеличением относительной массы надпочечников, снижением таковой тимуса и селезенки, поражением СОЖ), изменением содержания стресс-гормонов (инсулина и кортикостерона) в крови [26] на фоне активации тиреоидной функции. Концентрация глицина в БГПМ в этих условиях не изменяется. Другими авторами описаны противоположно направленные, однако преимущественно в сторону возрастания, сдвиги уровня глицина после кратковременных стрессовых воздействий: 1) тепловой стресс (нахождение при T 38°С) – возрастание содержания глицина в коре больших полушарий и стволе мозга крыс после 1 ч, в гиппокампе и спинном мозге после 2 ч [31]; 2) комбинированный стресс (иммобилизация крыс в течение 2 ч, затем плавание в цилиндре (240 мм × 500 мм), заполненном на две трети водой (T 24°С), в течение 20 мин, через 15 мин воздействие диэтилового эфира до потери сознания, через 7-ми дней выработки условного рефлекса страха: нахождение в камере кондиционирования с решетчатым полом из нержавеющей стали в течение 180 с, затем footshock (нанесение разряда (0.8 мА, 4 с)), помещение на 24 ч в обычную клетку, реэкспозиция footshock в таком же режиме) – увеличение уровня мРНК переносчика глицина 1 (Gly-T1) в гиппокампе ([32]; 3) острый болевой стресс (подкожное введение формалина (0.3 мл 4%-ного раствора)) – двукратное повышение концентрации глицина в коре больших полушарий [33]; 4) водно-иммерсионный стресс (помещение крыс на 30 мин в клетку с водой (T 21°С)) – падение концентрации глицина в гиппокампе [34]. С другой стороны, при длительном воздействии стрессоров, как правило, выявлялось уменьшение уровня глицина: 1) комбинированный стресс (мягкое раздражение нижних конечностей, прерывистый шум и световое воздействие в течение 30 дней) – снижение содержания глицина в больших полушариях мозга крыс на 22% [35]; 2) хронический непредсказуемый умеренный стресс (воздействие различных по природе стрессоров (холод, иммобилизация, парное содержание, пищевая депривация, вращение клетки, белый шум, мерцающий свет, инверсия светового режима) в течение 4 нед.) – падение концентрации глицина в мозжечке при неизменном уровне в гиппокампе крыс [36].
Введение L-тироксина в близких к физиологическим дозах само по себе не повлияло на изученные нами показатели, однако ограничило интенсивность стресс-реакции и повысило устойчивость организма к стрессу, определив возрастание уровня глицина в БПГМ в отличие от животных, перенесших стресс без L-тироксина.
Обсуждая вопрос: стоит ли ограничивать реакцию организма на однократный умеренный стресс и в каком случае, отметим, что широко известно утверждение Г. Селье о том, что полная свобода от стресса означает смерть. Напротив, умеренные количества катехоламинов и глюкокортикоидов оказывают адаптивные эффекты. Повышение уровня глицина при стрессе, наблюдавшееся в наших опытах под влиянием L-тироксина, помимо ограничения активности стресс-реализующих систем, оказывает ряд других эффектов, минимизируюших стрессорное повреждение. Опосредованная глицином деактивация JNK-сигнального пути (стресс-активируемой киназы) лежит в основе его нейропротекторного эффекта: введение глицина мышам (1 г/кг/день, подкожно, в течение 60 дней) ограничивает индуцированные введением D-галактозы (100 мг/кг/день, внутрибрюшинно, 60 дней) окислительный стресс, апоптотическую нейродегенерацию, нейровоспаление, синаптическую дисфункцию и ухудшение памяти [8]. GlyNAC (комбинация глицина и N-ацетилцистеина) также лимитирует оксидативный стресс, дисфункцию эндотелия, улучшает функцию митохондрий, повышает работоспособность [37]. Кроме того, глицин улучшает память [38], что также может вносить вклад в оптимизацию ответа организма при повторном действии стрессоров.
В проведенном нами исследовании ограничение интенсивности стресс-реакции L-тироксином имело благоприятные последствия, поскольку наблюдалось ограничение возрастания относительной массы надпочечников, снижения таковой тимуса и селезенки, минимизация поражения СОЖ. Экспериментальный гипотиреоз вызвал уменьшение относительной массы надпочечников, тимуса, селезенки и не повлиял на концентрацию глицина в БГПМ. Вместе с тем, в работах других исследователей было установлено изменение уровня глицина при сдвигах тиреоидного статуса. По полученным ранее данным, в условиях гипертиреоза, вызванного введением L-тироксина (перорально в возрастающих дозах до 145 мкг на крысу в течение 2 нед.), уровень глицина в неокортексе увеличивался на 18% [25]. При гипотиреозе, вызванном введением пропилтиоурацила (0.02%-ный раствор в течение 14 суток из расчета 0.78 мг/100 г в сутки), содержание глицина в мозге крыс снижалось на 62% [21], однако при введении мерказолила (перорально в дозе 10 мг/кг в течение 2 нед.) концентрация глицина в неокортексе крыс возрастала на 17% [25].
При последующем стрессе у гипотиреоидных животных стимуляция тиреоидной функции, наблюдавшаяся у эутиреоидных, отсутствовала, в результате чего стресс развивался на фоне более низкой концентрации ЙТГ в крови. Гипофункция щитовидной железы ослабила реакцию на стресс тимиколимфоидного аппарата и исключила таковую системы гипоталамус-гипофиз-надпочечник, гормоны которой в умеренных дозах оказывают адаптивное действие, вследствие чего индуцировала большее повреждение СОЖ. Этому соответствовал более низкий уровень глицина в БГПМ. Проведенный нами корреляционный анализ выявил наличие прямой сильной корреляционной связи между концентрацией глицина и содержанием ЙТГ при стрессе у животных с измененным тиреоидным статусом. Эти результаты получены впервые и означают, что чем выше уровень ЙТГ в крови, тем больше концентрация глицина в БПГМ. Между уровнем последнего и относительной массой надпочечников и тимуса корреляция была прямой, это свидетельствует о том, что при возрастании содержания изученного нами нейромедиатора относительная масса этих стресс-сенситивных органов также оказывается более высокой. При объяснении направленности корреляции уровня глицина с относительной массой надпочечников следует учесть, что мерказолил сам по себе вызвал ее падение и предотвратил увеличение в условиях стресса, тогда как L-тироксин, не влияя per se, лишь ограничил его. В то же время мерказолил не препятствовал падению относительной массы тимуса в этих условиях, отражающему процесс тимико-лимфатической инволюции. Поэтому прямая корреляционная связь между указанным показателем стресс-реакции и содержанием глицина может означать, что интенсивность стресс-реакции обратно зависит от концентрации данного нейромедиатора. Это приводит к повышению устойчивости организма, доказываемому в наших опытах минимизацией поражения СОЖ и прямой корреляцией между частотой (средней степени) и тяжестью (сильной степени) поражения и уровнем глицина в БПГМ.
По нашему мнению, полученные нами данные могут указывать на то, что ЙТГ делают процесс адаптации к действию стрессовых факторов более “совершенным”, возможно, за счет ограничения изменений эмоциональной сферы животного, которая имеет значение в развитии аллостатической нагрузки и перегрузки в связи с тем, что ситуация “дефицита времени”, как указано выше, вызывает появление отрицательных эмоций.
В целом, полученные нами результаты доказывают, что определенную роль в ограничении интенсивности стресс-реакции и повышении устойчивости организма к стрессу под влиянием ЙТГ имеет их стимулирующее воздействие на содержание глицина в больших полушариях головного мозга, что увеличивает мощность центрального звена стресс-лимитирующей системы. Однако это не исключает параллельной реализации других механизмов защиты организма от действия стрессоров.
Данные о влиянии ЙТГ на уровень глицина помимо общебиологического значения, заключающегося в установлении нового аспекта антистрессорного эффекта ЙТГ, связанного с их влиянием на глицинергичесую трансмиссию, могут иметь выход в практическую медицину, поскольку глицин рассматривается в качестве одного из безопасных и многообещающих кандидатов для лечения нейродегенеративных болезней, в том числе возрастных [8], шизофрении, включая затяжные, устойчивые к любому лечению формы болезни [7] в связи с реципрокным регулированием содержания глицина и дофамина в переднем мозге, модуляцией глицином глутаматергической трансмиссии, взаимодействием глицина с белками постсинаптического уплотнения в глутаматергических синапсах.
Список литературы
Agorastos A, Chrousos G (2021) The neuroendocrinology of stress: the stress-related continuum of chronic disease development. Mol Psychiatry. https://doi.org/10.1038/s41380-021-01224-9
Крыжановский ГН (2011) Основы общей патофизиологии. М. Мед. информ. агентство. [Kryzhanovskij GN (2011) Fundamentals of general pathophysiology. Med. inform. agentstvo. (In Russ)].
Hernandes M, Troncone L (2009) Glycine as a neurotransmitter in the forebrain: A short review. J Neural Transm 116: 1551–1560. https://doi.org/10.1007/s00702-009-0326-6
Kumar A, Basak S, Rao S, Gicheru Y, Mayer M, Sansom M, Chakrapani S (2020) Mechanisms of activation and desensitization of full-length glycine receptor in lipid nanodiscs. Nat Commun 11: 3752. https://doi.org/10.1038/s41467-020-17364-5
Dopico J, González-Hernández T, Pérez I, García I, Abril A, Inchausti J, Rodríguez Díaz M (2006) Glycine release in the substantia nigra: Interaction with glutamate and GABA. Neuropharmacology 50(5): 548–557. https://doi.org/10.1016/j.neuropharm.2005.10.014
Aubrey KR (2016) Presynaptic control of inhibitory neurotransmitter content in VIAAT containing synaptic vesicles. Neurochem Int 98: 94–102. https://doi.org/10.1016/j.neuint.2016.06.002
Bartolomeis A, Manchia M, Marmo F, Vellucci L, Iasevoli F, Barone A (2020) Glycine Signaling in the Framework of Dopamine-Glutamate Interaction and Postsynaptic Density. Implications for Treatment-Resistant Schizophrenia. Front Psychiatry 11: 369. https://doi.org/10.3389/fpsyt.2020.00369
Ullah R, Jo M, Riaz M, Alam S, Saeed K, Ali W, Rehman I, Ikram M, Kim M (2020) Glycine, the smallest amino acid, confers neuroprotection against D-galactose-induced neurodegeneration and memory impairment by regulating c-Jun N-terminal kinase in the mouse brain. J Neuroinflammat 17: 303. https://doi.org/10.1186/s12974-020-01989-w
Russier M, Kopysova I, Ankri N, Ferrand N, Debanne D (2002) GABA and glycine co-release optimizes functional inhibition in rat brainstem motoneurons in vitro. J Physiol 541(Pt 1): 123–137. https://doi.org/10.1113/jphysiol.2001.016063
Aoyama K, Watabe M, Nakaki T (2008) Regulation of neuronal glutathione synthesis. J Pharmacol Sci 108(3):227–238. https://doi.org/10.1254/jphs.08r01cr
Li Y, Krupa B, Kang J, Bolshakov V, Liu G (2009) Glycine site of NMDA receptor serves as a spatiotemporal detector of synaptic activity patterns. J Neurophysiol 102(1): 578–589. https://doi.org/10.1152/jn.91342.2008
Waxman E, Baconguis I, Lynch D, Robinson M (2007) N-methyl-D-aspartate receptor-dependent regulation of the glutamate transporter excitatory amino acid carrier 1. J Biol Chem 282(24): 17594–15607. https://doi.org/10.1074/jbc.M702278200
Городецкая ИВ (2000) Значение малых доз экзогенных тиреоидных гормонов в сохранении свободнорадикального гомеостаза миокарда и тиреоидного статуса в условиях антагонистических стрессов. Здравоохранение 1: 13–15. [Gorodetskaya IV (2000) The role of small doses of exogenous thyroid hormones in maintaining free radical myocardial homeostasis and thyroid status under conditions of antagonistic stress. Healthcare 1: 13–15. (In Russ)].
Сухорукова ТА, Божко АП (1989) Нарушения сократительной функции сердца и адренореактивность миокарда при стрессе в зависимости от уровня тиреоидных гормонов. Пробл эндокринол 35: 71–75. [Sukhorukova TA, Bozhko AP (1989) Disorders of the contractile function of the heart and adrenoreactivity of the myocardium under stress, depending on the level of thyroid hormones. Probl Endocrinol 35 (4): 71–75. (In Russ)].
Божко АП, Солодков АП (1990) Зависимость адаптационного эффекта коротких стрессорных воздействий от тиреоидного статуса организма Пробл эндокринол 36(5): 74–78. [Bozhko AP, Solodkov AP (1990) Dependence of the adaptive effect of short stressors on the thyroid status of the body. Probl Endocrinol 36(5): 74–78. (In Russ)].
Божко АП, Городецкая ИВ (1998) Значение тиреоидных гормонов в предупреждении нарушений сократительной функции и антиоксидантной активности миокарда при тепловом стрессе Рос физиол журн им ИМ Сеченова 84(3): 226–232. [Bozhko AP, Gorodetskaya IV (1998) The role of thyroid hormones in the prevention of disorders of contractile function and antioxidant activity of the myocardium under thermal stress. Russ J Physiol 84(3): 226–232. (In Russ)].
Божко АП, Городецкая ИВ (2000) Роль белкового синтеза в реализации протекторных кардиальных эффектов тиреоидных гормонов при иммобилизационном стрессе у крыс. Рос физиол журн им ИМ Сеченова 86(3): 349–357. [Bozhko AP, Gorodetskaya IV (2000) The role of protein synthesis in the realization of the protective cardiac effects of thyroid hormones during immobilization stress in rats. Russ J Physiol 86(3): 349–357 (In Russ)].
Городецкая ИВ, Евдокимова ОВ (2014) Влияние йодсодержащих тиреоидных гормонов на экспрессию ранних генов c-fos и c-jun в миокарде крыс при стрессе. Известия НАН Беларуси Мед серия 2: 42–47. [Gorodetskaya IV, Evdokimova OV (2014) Effect of iodine-containing thyroid hormones on the expression of the early genes c-fos and c-jun in the myocardium of rats under stress. Proc Natl Acad Sci Belarus Med Series (2): 42–47. (In Russ)].
Гусакова ЕА, Городецкая ИВ (2019) Способ моделирования эмоционального стресса “дефицита времени”. Рос физиол журн им ИМ Сеченова 105(4): 520–530. [Gusakova YeA, Gorodetskaya IV (2019) A method of modeling the emotional stress of “time deficiency”. Russ J Physiol 105(4): 520–530. (In Russ)]. https://doi.org/10.1134/S0869813919040010
Гусакова ЕА, Городецкая ИВ (2014) Влияние изменения тиреоидного статуса на микроскопические изменения структуры печени крыс при стрессе. Вестник ВГМУ 13(1): 38–47. [Gusakova EA, Gorodetskaya IV (2014) The effect of changes in thyroid status on microscopic changes in the structure of the rat liver under stress. Bull VSMU 13(1): 38–47. (In Russ)].
Глинник СВ, Ринейская ОН, Романовский ИВ, Красненкова ТП (2007) Содержание свободных аминокислот в мозге и плазме крови крыс с экспериментальным гипотиреозом при тепловом стрессе. Мед журн 3: 1–6. [Glinnik SV, Rineyskaya ON, Romanovsky IV, Krasnenkova TP (2007) The content of free amino acids in the brain and blood plasma of rats with experimental hypothyroidism under heat stress. Med J 3: 1–6. (In Russ)].
Henley WN, Chen X, Klettner C, Bellush LL, Notestine MA (1991) Hypothyroidism increases serotonin turnover and sympathetic activity in the adult rat. Can J Physiol Pharmacol 69(2): 205–210. https://doi.org/10.1139/y91-030. PMID: 1711408
Масалова ОО (2008) Влияние экспериментального гипотиреоза на метаболизм биогенных аминов в структурах головного мозга крыс различного возраста. Психофармакол и биол наркол 8(1–2): 2370–2371. [Masalova OО (2008) The effect of experimental hypothyroidism on the metabolism of biogenic amines in the brain structures of rats of various ages. Psychopharmacol and Biol Narcol 8(1–2): 2370–2371. (In Russ)].
Оруджева АМ (2011) Влияние тироксина на метаболизм ГАМК в головном мозге крыс. Естеств и техн науки 56 (6): 154–157. [Orujeva AM (2011) The effect of thyroxine on GABA metabolism in the rat brain. Natural Technical Sci 56 (6): 154–157. (In Russ)].
Демченко ОМ (2014) Психо-емоцiйний статус щурiв за умов дисфункцii щитовидноi залозi. Теорет мед 19(1): 10–15. [Demchenko OM (2014) Psycho-emotional status of rats with thyroid dysfunction. Theoret Med 19(1): 10–15. (In Ukr)].
Гусакова ЕА, Городецкая ИВ (2019) Способ моделирования эмоционального стресса “дефицита времени”. Рос физиол журн им ИМ Сеченова 105(4): 520–530. [Gusakova ЕA, Gorodetskaya IV. (2019) A method of modeling the emotional stress of “time deficiency”. Rus J Physiol 105(4): 520–530. (In Russ)].
Hung C, Neu S (1997) Acid-Induced Gastric Damage in Rats Is Aggravated by Starvation and Prevented by Several Nutrients. J Nutrition 127(4): 630–636. https://doi.org/10.1093/jn/127.4.630
McEwen B, Bowles N, Gray J, Hill N, Hunter R, Karatsoreos N, Nasca C (2015) Mechanisms of stress in the brain. Nat Neurosci 18(10): 1353–1363. https://doi.org/10.1038/nn.4086
Giammanco M, Di Liegro CM, Schiera G, Di Liegro I (2020) Genomic and Non-Genomic Mechanisms of Action of Thyroid Hormones and Their Catabolite 3,5-Diiodo-L-Thyronine in Mammals. Int J Mol Sci 21(11): 4140. https://doi.org/10.3390/ijms21114140
Lin HY, Sun M, Tang HY, Lin C, Luidens MK, Mousa SA, Incerpi S, Drusano GL, Davis FB, Davis PJ (2009) L-Thyroxine vs 3,5,3'-triiodo-L-thyronine and cell proliferation: activation of mitogen-activated protein kinase and phosphatidylinositol 3-kinase. Am J Physiol Cell Physiol 296(5): 980–991. https://doi.org/10.1152/ajpcell.00305.2008
Sharma HS (2006) Hyperthermia influences excitatory and inhibitory amino acid neurotransmitters in the central nervous system. An experimental study in the rat using behavioural, biochemical, pharmacological, and morphological approaches. J Neural Transm (Vienna) 113(4): 497–519. https://doi.org/10.1007/s00702-005-0406-1
Iwamoto Y, Morinobu S, Takahashi T, Yamawaki S (2007) Single prolonged stress increases contextual freezing and the expression of glycine transporter 1 and vesicle-associated membrane protein 2 mRNA in the hippocampus of rats. Prog Neuropsychopharmacol Biol Psychiatry 31(3): 642–651. https://doi.org/10.1016/j.pnpbp.2006.12.010
Elekes I, Patthy A, Láng T, Palkovits M (1986) Concentrations of GABA and glycine in discrete brain nuclei. Stress-induced changes in the levels of inhibitory amino acids. Neuropharmacology 25(7): 703–709. https://doi.org/10.1016/0028-3908(86)90085-7
Ветрилэ ЛА, Захарова ИА, Кудрин ВС, Клодт ПМ (2016) Влияния антител к глутамату при интраназальном введении на содержание возбуждающих и тормозных аминокислот в гиппокампе и гипоталамусе крыс при комбинированном стрессорном воздействии. Патол физиол эксп терапия 1: 4–10. [Vetril LA, Zakharova IA, Kudrin VS, Klodt PM (2016) The effects of antibodies to glutamate during intranasal administration on the content of excitatory and inhibitory amino acids in the hippocampus and hypothalamus of rats under combined stress. Pathol Physiol Exp Therapy 1: 4–10. (In Russ)].
Надольник ЛИ (2010) Cтресс и щитовидная железа. Биомед химия 56(4): 443–456. [Nadolnik LI (2010) Stress and the thyroid gland. Biomed Chem 56(4): 443–456. (In Russ)].
Yang X, Wang G, Gong X, Huang C, Mao Q, Zeng L, Zheng P, Qin Y, Ye F, Lian B, Zhou C, Wang H, Zhou W, Xie P (2019) Effects of chronic stress on intestinal amino acid pathways. Physiol Behav 204: 199–209. https://doi.org/10.1016/j.physbeh.2019.03.001
Sekhar R (2021) GlyNAC Supplementation Improves Glutathione Deficiency, Oxidative Stress, Mitochondrial Dysfunction, Inflammation, Aging Hallmarks, Metabolic Defects, Muscle Strength, Cognitive Decline, and Body Composition: Implications for Healthy Aging. J Nutr 151(12): 3606–3616. https://doi.org/10.1093/jn/nxab309
File S, Fluck E, Fernandes C (2000) Beneficial Effects of Glycine (Bioglycin) on Memory and Attention in Young and Middle-Aged Adults. J Clin Psychopharmacol 19: 506–512.https://doi.org/10.1097/00004714-199912000-00004
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


