Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 296-303
Влияние ранней некрэктомии у беременных крыс с глубоким термическим ожогом кожи на кислородзависимые процессы в организме матери и дальнейшее течение беременности
Т. В. Ковальчук-Болбатун 1, *, В. В. Зинчук 1, С. М. Смотрин 1, И. Э. Гуляй 1
1 Гродненский государственный медицинский университет
г. Гродно, Республика Беларусь
* E-mail: 7881632@mail.ru
Поступила в редакцию 08.12.2021
После доработки 11.01.2022
Принята к публикации 13.01.2022
- EDN: ECCXHB
- DOI: 10.31857/S0869813922030049
Аннотация
Активная хирургическая тактика лежит в основе современного подхода к лечению пациентов с тяжелыми ожогами, вместе с тем у беременных с термическими ожогами последствия ранней некрэктомии не изучены. Исследование проводилось на 54 самках беспородных белых крыс, которым производился термический ожог кожи в раннем периоде беременности (3-и сутки беременности) и выполнялась ранняя некрэктомия (6-е сутки беременности). Исследовалась кислородтранспортная функция крови и процессы перекисного окисления липидов, изучалось влияние термической травмы и ранней некрэктомии на течение беременности. Глубокий термический ожог кожи у беременных крыс приводил к развитию гипоксии (снижение значений рO2 и SO2, а также уменьшение сродства гемоглобина к кислороду) и активации свободнорадикальных процессов (увеличение содержания ДК и МДА в плазме крови) на фоне истощения антиоксидантной защиты (уменьшение активности каталазы и уровня α-токоферола и ретинола). После выполнения ранней некрэктомии отмечалось умеренное усугубление выявленных нарушений, которое нивелировалось к 20-м суткам беременности. Термическая травма приводила к нарушению течения беременности, проявляющееся прерыванием беременности, преимплантационной и постимплантационной гибелью потомства и гипотрофией плодов. После выполнения ранней некрэктомии значения преимлантационной и постимплантационной гибели потомства и масса плодов существенно не изменились.
Проблема термических поражений продолжает оставаться одним из сложных и важных разделов медицины. Особого внимания заслуживают беременные с термическими ожогами кожи [1]. Именно эта группа пострадавших требует к себе наибольшего внимания медицинского персонала, привлечения большого числа специалистов различного профиля и современной диагностической базы [2, 3]. Сложность коррекции этой патологии определяется тем, что ожоговая травма оказывает патологическое влияние на уже измененную функцию всех органов и систем беременной, в этих условиях способность организма матери отвечать на повреждение резко снижается, что сопровождается быстрым истощением резервов и, зачастую, неспособноcтью обеспечить безопасное развитие плода. Поэтому термическая травма повышает риск самопроизвольных абортов и преждевременных родов [4]. В основе современного подхода к коррекции глубоких термических ожогов лежит активная хирургическая тактика, а именно ранняя некрэктомия с одномоментной или отсроченной аутодермопластикой [5, 6]. Гибель тканей в результате термического воздействия сопровождается образованием большого количества токсических продуктов, которые, инициируя медиаторный ответ, приводят к расстройству микроциркуляции, гипоксии, активации свободнорадикальных процессов, иммуносупрессии и развитию полиорганной недостаточности [7]. Раннее удаление ожогового струпа у обожженных уменьшает выраженность катоболических реакций, снижает интенсивность реакций перекисного окисления липидов, нарушений клеточного и гуморального звеньев иммунной защиты, предотвращает развитие сепсиса [8]. Однако иссечение некротизированных тканей является достаточно травматичной операцией, сопровождается значительной кровопотерей и может привести к ухудшению состояния беременной с термической травмой. В литературе не представлены данные о влиянии ранней некрэктомии на состояние гомеостаза беременной с термическими повреждениями, в том числе и на кислородзависимые процессы, а они играют основополагающую роль в патогенезе ожоговой травмы, также нет сведений о последствиях ранней некрэктомии для плода. В связи с этим целесообразным является изучение влияния ранней некрэктомии при глубоком термическом ожоге кожи у беременных крыс на кислородзависимые процессы в организме матери и дальнейшее течение беременности.
МЕТОДЫ ИССЛЕДОВАНИЯ
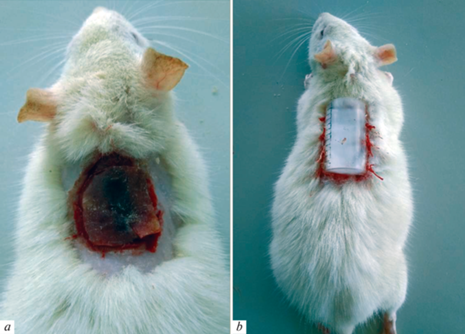
Экспериментальное исследование проведено на 54 беременных крысах массой 200–250 г, которые были разделены на три группы. Контрольная группа – беременные интактные крысы, первая опытная группа – беременные крысы с глубоким термическим ожогом кожи (3-и сутки беременности), вторая опытная группа – беременные крысы с глубоким термическим ожогом кожи, которым выполнялась ранняя некрэктомия (6-е сутки беременности). В соответствии с принципами Базельской декларации и с разрешения комитета по биомедицинской этике и деонтологии учреждения образования “Гродненский государственный медицинский университет” ожог наносили после введения тиопентала натрия (внутрибрюшинно, в дозе 50 мг/кг). Методика выполнения экспериментальной травмы предусматривала ожог III степени освобожденной от шерсти кожи спины. Ожог наносили на 3-и сутки беременности (первым днем беременности считался день обнаружения сперматозоидов во влагалищных мазках) горячей жидкостью (вода) 99–100°C в течение 15 с специально разработанным устройством [9]. В результате воздействия термического агента создавались стандартные по площади (около 12 см2) ожоговые раны. После нанесения термического ожога на рану крепили предохранительную камеру. Некрэктомию выполняли через трое суток после моделирования термической травмы, под обезболиванием (тиопентал натрия внутрибрюшинно, в дозе 40 мг/кг). Далее на рану накладывали D4 повязку и крепили предохранительную камеру (рис. 1).
Под адекватным наркозом (50–60 мг/кг тиопентала натрия, интраперитонеально) на 13-е и 20-е сутки беременности животные выводились из эксперимента, производился забор смешанной венозной крови путем интракардиальной пункции.
В крови на газоанализаторе StatProfilepHOxplus L при 37°С определяли показатели кислородтранспортной функции (КТФ): парциальное давление кислорода (рО2), степень оксигенации (SO2). Сродство гемоглобина к кислороду (СГК) оценивали по показателю р50реал. (рО2 крови при 50%-ном насыщении ее кислородом). По формулам Severinghaus [10] рассчитывали значение р50станд. Кислотно-основное состояние изучали по показателям: парциальное давление углекислого газа (рСО2), стандартный бикарбонат (SBC), реальный/стандартный недостаток (избыток) буферных оснований (АВЕ/SBE), гидрокарбонат (${\text{HCO}}_{3}^{ - }$), концентрация водородных ионов (рН), общая углекислота плазмы крови (ТСО2).
Активность свободнорадикальных процессов оценивали по содержанию первичных – диеновые конъюгаты (ДК) и промежуточных – малоновый диальдегид (МДА) продуктов перекисного окисления липидов (ПОЛ). Уровень ДК в плазме определяли по интенсивности поглощения липидным экстрактом монохроматического светового потока в области спектра 232–234 нм, характерного для конъюгированных диеновых структур гидроперекисей липидов. Оптическую плотность измеряли на спектрофлуориметре СМ 2203 “СОЛАР” (Беларусь) при длине волны 233 нм по отношению к контролю. Концентрацию ДК выражали в ΔD233/мл. Содержание МДА оценивали по взаимодействию с 2'-тиобарбитуровой кислотой, которая при нагревании в кислой среде приводит к образованию триметинового комплекса розового цвета. Интенсивность окраски измеряли спектрофотометрически на спектрофотометре PV1251C “СОЛАР” (Беларусь) при длине волны 535нм по отношению к контролю. Концентрацию МДА выражали в мкмоль/л. Для определения активности каталазы в плазме использовали метод Королюк [11], основанный на спектрофотометрической регистрации количества окрашенного продукта реакции Н2О2 с молибденовокислым аммонием, имеющим максимальное светопоглощение при длине волны 410 нм. Активность каталазы выражали в нмоль Н2О2/мин/мг белка. За единицу активности принимали количество фермента, катализирующее образование 1 нмоль продукта за 1 мин в условиях испытания. Для определения содержания церулоплазмина в плазме крови использовали модифицированный метод Равина, принцип метода которого основан на окислении р-фенилендамина при участии церулоплазмина. Концентрацию α-токоферола и ретинола определяли по методу Taylor [12], основанному на определении интенсивности флуоресценции гексанового экстракта при длине волны возбуждения 286 нм и испускания 350 нм (для α-токоферола) и при длине волны возбуждения 325 нм и испускания 470 нм (для ретинола) на спектрофлуориметре СМ 2203 “СОЛАР” (Беларусь). В контрольную пробу вместо исследуемого материала вносили аликвоту бидистиллированной воды, а в стандартную – рабочего раствора, приготовленного из стандартов α-токоферола и ретинола (“Sigma”).
Все показатели проверяли на соответствие признака закону нормального распределения с использованием критерия Шапиро–Уилка. С учетом этого были использованы методы непараметрической статистики при помощи функций базового пакета “base” расширения языка программирования “R”. Сравнение трех независимых групп проводили с помощью критерия Крускела–Уоллиса с последующими апостериорными попарными сравнения по критерию Стила–Дваса–Кричлоу–Флинера (пакет “NSM3” расширения языка “R”). Достоверность полученных данных с учетом размеров малой выборки, множественных сравнений оценивалась с использованием U-критерия Манна–Уитни. Результаты представлены как медиана (Me), 25-й и 75-й процентиль. Уровень статистической значимости принимали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
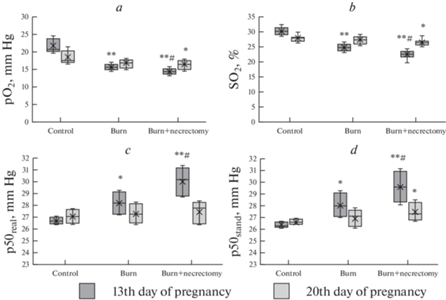
На рис. 2 представлены данные о характере изменения КТФ крови у беременных крыс после воспроизведения глубокого термического ожога кожи на 3-и сутки беременности и выполнения ранней некрэктомии. Термическая травма приводила к снижению значений рO2 (на 24.8%, p < 0.01 в первой опытной группе и на 30.5%, p < 0.01 во второй опытной группе в сравнении с контролем) и SO2 (на 18.2%, p < 0.01 в первой опытной группе и на 24.4%, p < 0.01 во второй опытной группе в сравнении с контрольной группой) на 13-е сутки беременности, которые достигали уровня контрольных цифр к 20-м суткам беременности, при этом в опытной группе животных, которым выполнялось оперативное лечение, отмечалось более выраженное снижение данных показателей. Показатель сродства гемоглобина к кислороду р50реал. был повышен в обеих опытных группах на 13-е сутки беременности (во второй опытной группе на 2 мм рт. ст. выше, чем в первой, p < 0.05), что свидетельствует о сдвиге кривой диссоциации оксигемоглобина вправо, соответственно большая степень сдвига фиксировалась после выполнения ранней некрэктомии. Схожая динамика изменений была и по показателю р50станд. Также на 13-е сутки беременности после хирургического удаления струпа было отмечено снижение уровня гемоглобина 109 (102; 114) г/л, p < 0.05 в сравнении с первой опытной группой 119 (114; 123) г/л, что может быть связано с кровопотерей во время операции.
Рис. 2.
Влияние ранней некрэктомии на кислородтранспортную функцию крови у беременных экспериментальных животных с глубоким термическим ожогом кожи. * – p < 0.05 изменения в сравнении с контролем, ** – p < 0.01 изменения в сравнении с контролем, # – p < 0.05 изменения в сравнении с группой “Ожог”.
Снижение таких показателей кислотно-основного состояния как рН, ${\text{HCO}}_{3}^{ - }$, ТСО2, SBC, АВЕ/SBE указывает на развитие ацидоза у беременных крыс с глубоким термическим ожогом кожи, выраженный в большей степени после проведения ранней некрэктомии (табл. 1). Однако к 20-м суткам беременности статистически значимых различий между первой и второй опытными группами животных не определялось.
Таблица 1.
Влияние ранней некрэктомии на кислотно-основное состояние у беременных экспериментальных животных с глубоким термическим ожогом кожи
| Показатель | 13-е сутки беременности | 20-е сутки беременности | ||||
|---|---|---|---|---|---|---|
| контроль | ожог | ожог + некрэктомия |
контроль | ожог | ожог + некрэктомия |
|
| рН, ед | 7.402 (7.395; 7.411) |
7.365 (7.358; 7.371)** |
7.339 (7.333; 7.352)**# |
7.391 (7.387; 7.398) |
7.387 (7.381; 7.398) |
7.379 (7.371; 7.389)* |
| рСО2, мм рт.ст. | 44.8 (44; 46.2) |
43.7 (42.5; 44.1)* |
43.4 (41.8; 44)* |
45.6 (43.8; 48.7) |
46.2 (43.5. 47.1) |
45.2 (44.1; 46.9) |
| $HCO_{3}^{ - }$, ммоль/л | 25.4 (24.5; 27.1) |
21.3 (20.1; 22)* |
20.4 (19.7; 20.9)*# |
26.8 (25.1; 27.4) |
25 (23.1; 25.4)* |
24.1 (22.7; 25.2)* |
| ТСО2, ммоль/л | 27.7 (26.2; 28.5) |
23.8 (22.4; 24.8)* |
22.9 (20.2; 23.2)*# |
28.1 (26.5; 29.3) |
26.9 (25.4; 28) |
26 (24.8; 26.8)* |
| ABE, ммоль/л | –2.9 (–3.3; –1.9) |
–3.9 (–4.5; –3.2)* |
–4.5 (–5.5; –4)*# |
–2.3 (–2.6; –1.8) |
–3 (–3.8; –2.1)* |
–3.2 (–4.1; –2.7)* |
| SBE, ммоль/л | –1.5 (–2.2; –0.5) |
–2.9 (–3.4; –2.1)* |
–3.1 (–4; –2.6)* |
–1.1 (–1.8; –0.9) |
–2.1 (–2.4; –1.5)* |
–2.2 (–2.7; –1.5)* |
| SBC, ммоль/л | 24.8 (23.9; 25.6) |
22.3 (21; 23.7)* |
21.9 (20.5; 22.5)* |
24.1 (23.7; 25) |
23 (21.2; 23.9)* |
22.7 (20.9; 23.7)* |
В табл. 2 представлены данные о характере изменения показателей процессов перекисного окисления липидов и состояния антиоксидантной защиты. На 13-е сутки беременности в результате моделирования термического ожога кожи у экспериментальных животных отмечался значительный подъем концентрации ДК в плазме крови – на 75% (р < 0.05), после проведения ранней некрэктомии на 116.7% (р < 0.05) в сравнении с контрольной группой. Уровень данного первичного продукта ПОЛ оставался увеличенным на 66,7% (p < 0.05) и на 20-е сутки беременности в обеих опытных группах в сравнении с контролем. Содержание МДА в обеих опытных группах на 13-е сутки беременности было повышено в сравнении с контрольной группой, на 20-е сутки не отличалось от контрольных значений. На фоне возросшей активности процессов ПОЛ отмечалось значительное угнетение механизмов антиоксидантной защиты в обеих опытных группах, проявляющееся уменьшением активности каталазы и уровня α-токоферола и ретинола. Более выраженным дисбаланс прооксидантно-антиоксидантного состояния наблюдался после выполнения ранней некрэктомии.
Таблица 2.
Влияние ранней некрэктомии на прооксидантный-антиоксидантный баланс у беременных экспериментальных животных с глубоким термическим ожогом кожи
| Показатель | 13-е сутки беременности | 20-е сутки беременности | ||||
|---|---|---|---|---|---|---|
| контроль | ожог | ожог + некрэктомия |
контроль | ожог | ожог + некрэктомия |
|
| ДК, ΔD233/мл | 1.2 (1.1;1.5) |
2.1 (1.3; 2.6)* |
2.6 (2; 3.1)* |
1.2 (1.1; 1.4) |
2 (1.9; 3.5)* |
2 (1.8; 3)* |
| МДА, мкмоль/л | 2.7 (2; 3) |
3.9 (2.8; 4.1)* |
4.3 (3.7; 4.8)* |
3 (2.5; 3.3) |
3 (2.2; 3.9) |
3.2 (2.9; 3.7) |
| Каталаза, нмоль Н2О2/мин/мг белка | 0.61 (0.56; 0.74) |
0.51 (0.5; 0.6)* |
0.35 (0.31; 0.37)**# |
0.64 (0.54; 0.75) |
0.52 (0.43; 0.56)* |
0.43 (0.39; 0.5)* |
| α-токоферол, мкмоль/л | 15.6 (11.4; 23.1) |
13 (11; 14.8) |
9.3 (9.1; 11.1)*# |
14.9 (12.3; 15.6) |
17.7 (14.5; 18.6) |
11 (10.1; 13.2)*# |
| Ретинол, мкмоль/л | 1 (0.71; 1) |
0.8 (0.65;0.98) |
0.7 (0.6; 0.8)* |
1 (0.9; 1.2) |
0.82 (0.81; 1.4) |
0.9 (0.85; 0.95) |
| Церулоплазмин, мг/л | 238 (202;246) |
282 (248; 319)* |
369 (339; 460)**# |
222 (160; 314) |
253 (193; 304) |
304 (281; 382) |
Прерывание беременности наблюдалось у 33.3% крыс как в первой, так и во второй опытной группе. Значения преимплантационной гибели плодов в первом и втором опыте составили 38.5% и 39.6% соответственно, постимплантационной гибели плодов – 25% и 28%, в контроле оба показателя равны 0%. У живых плодов опытных групп на 20-й день беременности масса тела была меньше (опыт 1 – 2 (1.6; 2.2) г, p < 0.05, опыт 2 – 2 (1.7; 2.3) г, p < 0.05) чем в контрольной группе (2.7 (2.3; 2.8) г). При осмотре плодов внешних аномалий в опытной группе не определялось.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Одним из путей повышения эффективности лечения глубоких термических ожогов признается выполнение ранней некрэктомии уже в остром периоде ожоговой болезни [13]. Однако хирургическое вмешательство является операционной травмой и может повлечь за собой ухудшение тяжести состояния, прогрессирование воспалительной реакции и интоксикации, развитие гнойно-септических осложнений, приводящих к синдрому полиорганной недостаточности, т.е. вызвать эффект “второго удара” [14, 15]. В нашем исследовании на 13-е сутки беременности после проведения ранней некрэктомии наблюдались более выраженные нарушения кислородтранспортной функции крови (снижение рO2, SO2, р50реал., р50станд., Нb, рН, ${\text{HCO}}_{3}^{ - }$, ТСО2, АВЕ) в сравнении с опытной группой крыс без хирургического лечения, это свидетельствовало об ухудшении кислородного снабжения организма беременных экспериментальных животных, включении анаэробного механизма метаболизма, что привело к образованию большого количества кислых продуктов и развитию ацидоза. Сдвиг кривой диссоциации оксигемоглобина вправо можно расценивать как попытку компенсировать кислородную недостаточность, но в условиях, когда нарушена утилизация кислорода тканями и значительная его часть используется в свободнорадикальных процессах, увеличение потока кислорода в ткани может привести к развитию окислительного стресса [16–19]. Во второй опытной группе в сравнении с первой наблюдалось более выраженное угнетение антиоксидантной защиты, проявлявляющееся низкой активностью каталазы, снижением уровня α-токоферола и ретинола. При этом отмечалась высокая концентрация церулоплазмина в плазме крови экспериментальных животных после выполнения ранней некрэктомии. Известно, что церулоплазмин – это антиоксидант, который относится к позитивным белкам острой фазы, главной задачей которых является организация репаративных процессов в зоне повреждения [20]. К 20-м суткам беременности отмечалось улучшение состояния экспериментальных животных обеих опытных групп и статистически значимых отличий между первой и второй опытными группами не наблюдалось.
Определено влияние термической травмы и хирургического лечения на плод. Глубокий термический ожог кожи, полученный в раннем периоде беременности крыс, приводил к нарушению течения беременности, проявляющегося прерыванием беременности, преимплантационной и постимплантационной гибелью потомства, гипотрофией плодов. Дополнительного эмбриотоксического влияния ранней некрэктомии не выявлено.
Таким образом, ранняя некрэктомия у беременных крыс с глубокими термическими ожогами кожи, вызывая временное ухудшение кислородтранспортной функции крови (снижение рO2, SO2, а также уменьшение сродства гемоглобина к кислороду) и активацию свободнорадикальных процессов (увеличение содержания ДК и МДА в плазме крови) на фоне истощения антиоксидантной защиты (уменьшение активности каталазы и уровня α-токоферола и ретинола) в организме матери, не приводит к достоверному количественному росту преимплантационной и постимплантационной гибели плодов.
Список литературы
Huls CK, Detlefs C (2018) Trauma in pregnancy. Semin Perinatol 42(1): 13–20. https://doi.org/10.1053/j.semperi.2017.11.004
Correia-Sá I, Marques M, Horta R, Costa-Ferreira A, Rodrigues AG, Silva A, Egipto P (2021) Experience in Management of Burn Injury During Pregnancy in a Burn Unit. J Burn Care Res 42(2): 232–235. https://doi.org/10.1093/jbcr/iraa141
Соколов ВА, Абашин ВГ, Адмакин АЛ, Петрачков СА, Степаненко АА (2016) Ожоги у беременных: распространенность, структура, исходы. Военно-мед журн 7: 38–43. [Socolow VA, Abashin VG, Admakin AL, Petrachkov SA, Stepanenko AA (2016) Burn injuries in pregnant women: prevalence, structure, outcomes. Voen Med Zh 7: 38–43. (In Russ)]. https://www.elibrary.ru/download/elibrary_27326388_66355416.pdf
Shi Y, Zhang X, Huang B, Wang W, Severe Y (2015) Burn injury in late pregnancy: a case report and literature review. Burns & Trauma 3: s41038-015-0002-z. https://doi.org/10.1186/s41038-015-0002-z
Gacto-Sanchez P (2017) Surgical treatment and management of the severely burn patient: Review and update. Med Intensiva 41(6): 356–364. https://doi.org/10.1016/j.medin.2017.02.008
Welling H, Ostrowski SR, Stensballe J, Vestergaard MR, Partoft S, White J, Johansson, PI (2019) Management of bleeding in major burn surgery. Burns 45(4): 755–762. https://doi.org/10.1016/j.burns.2018.08.024
Parihar A, Parihar MS, Milner S, Bhat S (2008) Oxidative stress and anti-oxidative mobilization in burn injury. Burns 34(1):6-17. https://doi.org/10.1016/j.burns.2007.04.009
Рева ИВ, Одинцова ИА, Усов ВВ, Обыденникова ТН, Рева ГВ (2017) Оптимизация хирургической тактики лечения больных с глубокими термическими ожогами. Вестн хирургии им ИИ Грекова 2: 45–50. [Reva IV, Odintsova IA, Usov VV, Obydennikova TN, Reva GV (2017) Optimization of surgical approach of treatment in patients with full-thickness thermal burns. Vestn Khirurgii im II Grekova 2: 45–50. (In Russ)]. https://doi.org/10.24884/0042-4625-2017-176-2-45-50
Глуткин АВ, Ковальчук ВИ, Островская ОБ (2012) Моделирование глубокого ожога у крысят. Журн Гродненск гос мед универ 2: 51–53. [Glutkin AV, Koval’chuk VI, Ostrovskaja OB (2012) Modelirovanie glubokogo ozhoga u krysjat. J Grodno State Med Univer 2: 51–53. (In Russ)]. http://journal-grsmu.by/index.php/ojs/article/view/507
Saveringhaus JW (1966) Blood gas calculator. J Appl Physiol 21(5): 1108–1116. https://doi.org/10.1152/jappl.1966.21.3.1108
Камышников ВС (2002) Справочник по клинико-биохимической лабораторной диагностике. Минск. [Kamyshnikov VS (2002) Handbook Clin Biochemi Lab Diagnostics. Minsk. (In Russ)].
Taylor SL, Lamden MP, Tappel AL (1976) Sensitive fluorometric method for tissue tocopherol analysis. Lipids 11(7): 530–538. https://doi.org/10.1007/bf02532898
Daigeler A, Kapalschinski N, Lehnhardt M (2015) Therapy of burns. Der Chirurg. Zeitschr fur alle Gebiete der operativen Med 86(4): 389–401. https://doi.org/10.1007/s00104-014-2919-3
Lasanianos NG, Kanakaris NK, Dimitriou R, Pape HC, Giannoudis PV (2011) Second hit phenomenon: existing evidence of clinical implications. Injury 42(7): 617–629. https://doi.org/10.1016/j.injury.2011.02.011
Dunlap BD, Voskuil RT, Cincere B, Nowotarski PJ (2019) Repeat posterior wall acetabular fracture-dislocation: high-energy trauma as a 'second hit phenomenon. Trauma Case Rep 22:100215. https://doi.org/10.1016/j.tcr.2019.100215
Kaufman DP, Kandle PF, Murray I, Dhamoon AS (2021) Physiology, Oxyhemoglobin Dissociation Curve. Stat Pearls Publ.
Min K, Yeo D, Yoo JK, Johnson BD, Kim CH (2020) Would a right shift of the oxy-hemoglobin dissociation curve improve exercise capacity in patients with heart failure? Med Hypotheses 134: 109423. https://doi.org/10.1016/j.mehy.2019.109423
Sinha N, Dabla PK (2015) Oxidative stress and antioxidants in hypertension-a current review. Curr Hypertens Rev 11(2): 132–142. https://doi.org/10.2174/1573402111666150529130922
Sies H (2015) Oxidative stress: a concept in redox biology and medicine. Redox Biol 4: 180–183. https://doi.org/10.1016/j.redox.2015.01.002
Linder MS (2016) Ceruloplasmin and other copper binding components of blood plasma and their functions: an update. Metallomics 8(9): 887–905. https://doi.org/10.1039/c6mt00103c
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова