Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 3, стр. 315-324
Структурно-функциональный анализ состояния экспериментальных животных под влиянием длительного приема рекомбинантного лактоферрина человека в сочетании с алкогольной интоксикацией
Ю. А. Рудниченко 1, С. А. Новаковская 1, В. С. Лукашевич 1, *
1 Институт физиологии НАН Беларуси
Минск, Беларусь
* E-mail: lukashvs@rambler.ru
Поступила в редакцию 16.12.2021
После доработки 19.01.2022
Принята к публикации 21.01.2022
- EDN: HPGUWW
- DOI: 10.31857/S0869813922030074
Аннотация
Известно, что алкоголь увеличивает риск возникновения большого числа заболеваний, не связанных с ним напрямую и затрагивающих практически все жизненно важные системы и органы человека. Цель настоящей работы – оценка биохимических показателей сыворотки крови и морфологическое исследование печени экспериментальных животных под влиянием длительного приема лактоферрина в сочетании с хронической алкогольной интоксикацией. Для моделирования длительной алкогольной интоксикации использовали метод принудительного спаивания, при котором животные были вынуждены употреблять 15%-ный раствор этанола в качестве единственного источника жидкости на протяжении 40 суток. Установлено, что у экспериментальных животных при длительной алкогольной интоксикации происходят достоверные изменения липидного, углеводного и белкового обмена, выражающиеся в изменении содержания триглицеридов, холестерина липопротеинов высокой плотности, глюкозы и общего белка в сыворотке крови. Выявлено увеличение активности аспартат-аминотрансферазы (АСТ), а также гамма-глютамилтрансферазы (ГГТ). Потребление 15%-ного раствора этанола крысами приводит к развитию хронического алкогольного поражения печени, сопровождающегося диффузной жировой дистрофией, некрозом печеночных клеток и циррозом. Введение рекомбинантного лактоферрина человека в сочетании с алкоголем показало восстановление ряда биохимических показателей сыворотки крови (уровня общего белка, активностей АСТ и ГГТ). Лактоферрин способствует восстановлению структурно-функциональной организации печени, уменьшает реактивный отек органа, снижает зоны фокальных некрозов гепатоцитов, сокращает очаги воспалительной инфильтрации периваскулярных пространств в области портальных трактов и центральных вен. Таким образом, установлено протективное действие лактоферрина на определеннные показатели состояния организма при хронической алкогольной интоксикации.
Несмотря на прилагаемые усилия в борьбе с алкоголизмом в большинстве экономически развитых стран наблюдается прогрессирующее увеличение употребления спиртных напитков.
Известно, что алкоголь увеличивает риск возникновения большого числа заболеваний, не связанных с ним напрямую и затрагивающих практически все жизненно важные системы и органы человека. Вместе с тем, первичными мишенями токсического поражения алкоголем являются желудочно-кишечный тракт (ЖКТ) и печень, в которой происходит основной метаболический распад (более 90%) этилового спирта сначала до ацетальдегида и далее до уксусной кислоты [1]. Поэтому от функционального состояния печени и ЖКТ напрямую зависит способность организма нейтрализовать и удалять алкоголь.
В настоящее время для комплексного лечения больных с хроническим гепатитом и циррозом печени используются гепатопротекторы. Для больных со стеатозом алкогольного генеза применение этих препаратов является основой лечения [2]. Большинство используемых гепатопротекторов – средства общеукрепляющего действия. Существуют и специальные целевые препараты, например, “эссенциале”, применение которого способствует сохранению фосфолипидного слоя мембран гепатоцитов [3].
В 2010 г. в рамках выполнения программы Союзного государства “БелРосТрансген-2” в Беларуси на базе РУП “НПЦ НАН Беларуси по животноводству” из молока трансгенных коз получен рекомбинантный лактоферрин человека (ЛФ). Он является одним из основных белковых компонентов грудного молока и представляет собой негемовый железосвязывающий гликопротеин, относимый к семейству трансферринов [4, 5].
ЛФ обладает антиоксидантной активностью, противоопухолевыми и противовоспалительными свойствами, участвует в регуляции роста и дифференцировки клеток и др. [6]. Также показано, что системное применение ЛФ приводит к повышению интенсивности углеводного и липидного обмена печени, выражающееся в увеличении числа гранул гликогена и липосом, активации иммунокомпетентных клеток синусоидальных капилляров (большие гранулярные лимфоциты), которые стимулируют обменные процессы и пролиферацию клеток печени [4]. Эти результаты показывают, что ЛФ обладает более широким спектром положительного воздействия на клетки печени, и его применение может оказаться более эффективным по сравнению с существующими гепатопротекторами.
Цель настоящей работы – оценка биохимических показателей сыворотки крови и морфологическое исследование печени экспериментальных животных под влиянием длительного приема ЛФ в сочетании с хронической алкогольной интоксикацией.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на половозрелых крысах-самцах линии Вистар (n = 30) массой 130 ± 20 г. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами Республики Беларусь, принципам Базельской декларации и рекомендациям комиссии по биоэтике Института физиологии НАН Беларуси.
Животные были разделены на 3 группы (n = 10 в каждой группе): 1-я группа – половозрелые самцы крыс, содержавшиеся в стандартных условиях с постоянным доступом к чистой воде и корму, контроль; 2-я группа – экспериментальные животные, которым ежедневно вводили per os 0.1 мл изотонического раствора NaCl на фоне длительной (хронической) алкогольной интоксикации на протяжении 40 суток; 3-я группа – экспериментальные животные, которые на фоне длительной алкогольной интоксикации получали ежедневно per os ЛФ в дозе 200 мг/кг массы тела животного в 0.1 мл изотонического раствора NaCl на протяжении 40 суток.
Для моделирования длительной алкогольной интоксикации использовали метод принудительного спаивания, при котором животные были вынуждены употреблять 15%-ный раствор этанола в качестве единственного источника жидкости на протяжении 40 суток.
После выведения животных из эксперимента собирали кровь в чистые сухие центрифужные пробирки и получали сыворотку, для чего кровь помещали в термостат при температуре 37°С в течение 30 мин, а после центрифугировали при 1600 g на центрифуге LMC-3000 (“Biosan”, Латвия) в течение 10 мин. Готовую сыворотку крови переносили в микропробирки и хранили в холодильнике при –20°С не более двух месяцев.
Уровень общего холестерина, триглицеридов, холестерина липопротеинов высокой и низкой плотности (ХС ЛПВП и ХС ЛПНП), общего белка, глюкозы, активность гамма-глутамилтрансферазы (ГГТ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ) определяли с помощью соответствующих наборов (НТПК “Анализ Х”, Республика Беларусь, ЧПУП “Диасенс”, Республика Беларусь).
Для проведения электронно-микроскопических исследований экспериментальный материал обрабатывался по общепринятой методике [7]. Кусочки печени размерами 1–2 мм фиксировались в растворе, состоящем из 3% глутарового альдегида и 1% параформа при температуре 4°C в течение 2 ч. Затем исследуемый материал дополнительно фиксировался в 1%-ном растворе четырехокиси осмия в течение 2 ч при температуре 4°С. После завершения альдегид-осмиевой фиксации экспериментальные образцы обезвоживались в спиртах восходящей крепости и заливались в аралдит. Для полимеризации материал помещался в термостат при температуре 37°C на 2 сут, а затем при температуре 56°C – на 3 сут. Срезы готовились на ультрамикротоме PTPC PowerTome (RMC Boeckeler, США) и просматривались в электронном микроскопе JEM-100В (Jeol, Япония).
Экспериментальные данные обработаны с помощью MS Excel и представлены в виде медианы (Ме) и интерквартильного размаха (25-й процентиль – 75-й процентиль) – (25; 75%). Статистическая значимость полученных результатов была оценена по U-критерию Манна–Уитни для непараметрических выборок с использованием пакета программ Statistica 6.0. Достоверным считали уровень значимости p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Анализ липидного профиля в сыворотке крови экспериментальных животных, которые подвергались длительной алкогольной интоксикации, показал, что содержание общего холестерина существенно не изменялось по сравнению с контрольными показателями (табл. 1). Вместе с тем, уровень триглицеридов достоверно повышался на 16% по сравнению с контролем, что может быть связано с подавлением липогенеза и окислением глюкозы в жировой ткани [8]. Известно, что алкоголь может также влиять на накопление триглицеридов в печени, что приводит к стеатозу. Это влияние алкоголя может быть частично объяснено изменением активности АМФ-активируемой протеинкиназы, играющей центральную роль в метаболизме жирных кислот в печени [9].
Таблица 1.
Влияние рекомбинантного лактоферрина человека на некоторые биохимические показатели в сыворотке крови крыс при длительной алкогольной интоксикации
| Показатели | Контроль | Этанол | Этанол + ЛФ (200 мг/кг) |
|---|---|---|---|
| Общий холестерин (ммоль/л) | 1.73 (1.64; 1.80) |
1.58 (1.52; 1.67) |
1.60 (1.52; 1.67)* |
| Триглицериды (ммоль/л) | 1.53 (1.48; 1.61) |
1.78 (1.64; 1.94)* |
1.98 (1.73; 2.39)* |
| ХС ЛПНП (ммоль/л) | 0.83 (0.72; 0.86) |
0.48 (0.43; 0.76) |
0.56 (0.41; 0.61)* |
| ХС ЛПВП (ммоль/л) | 0.23 (0.21; 0.25) |
0.18 (0.17; 0.20)* |
0.19 (0.18; 0.20)* |
| Глюкоза (ммоль/л) | 4.70 (4.46; 5.01) |
6.00 (5.04; 6.26)* |
6.37 (5.71; 6.47)* |
| Общий белок (г/л) | 60.92 (60.16; 61.68) |
66.22 (62.18; 69.24)* |
64.95 (60.67; 66.22) |
| ГГТ (Е/л) | 4.17 (3.82; 5.10) |
6.20 (5.44; 13.72)* |
5.33 (2.90; 5.91) |
| АЛТ (Е/л) | 24.74 (21.18; 25.78) |
24.74 (22.81; 33.64) |
20.40 (20.08; 22.99) |
| АСТ (Е/л) | 58.03 (56.10; 94.11) |
102.55 (92.65; 117.74)* |
81.60 (75.89; 82.29) |
| ЛДГ (Е/л) | 1168.46 (962.30; 1512.66) |
1270.24 (1117.10; 1389.70) |
1149.31 (1062.07; 1374.61) |
Концентрация ХС ЛПВП в сыворотке крови крыс, которые получали длительное время 15%-ный раствор этанола, снижалась на 22%. Полученные результаты согласуются с литературными данными и свидетельствуют о значительном изменении липидного профиля в сыворотке крови экспериментальных крыс [10].
Содержание глюкозы в сыворотке крови животных статистически значимо увеличилось на 28% по отношению к контролю.
Профиль гликемии – достаточно вариабельный показатель при хронической алкогольной интоксикации [11]. Его изменения могут определяться длительностью интоксикации и выбранной дозой этанола, состоянием основных путей метаболизма глюкозы, гормональным статусом, содержанием гликогена в печени, режимом питания и другими факторами. Развитие гипергликемии при длительной алкогольной интоксикации является следствием интоксикационного стресса [12]. При более длительном потреблении алкоголя может происходить формирование гипогликемии вследствие истощения запасов гликогена печени и торможения глюконеогенеза [13].
При длительном введении 15%-ного раствора этанола крысам наблюдалось достоверное повышение уровня общего белка по сравнению с контролем, что свидетельствует о нарушении белкового обмена в организме.
Если еще несколько лет назад в соответствии с рекомендациями ВОЗ при хронической алкогольной интоксикации определяли трансаминазы АЛТ и АСТ, то в настоящее время из-за установленной специфичности к алкогольному повреждению печени все более общепринятым становится определение активности ГГТ (КФ 2.3.2.1) – фермента класса трансфераз, катализирующего перенос гамма-глутамиловой группы глутатиона и других гамма-глутамилпептидов на пептиды или отдельные аминокислоты (метионин, цистеин и др.) [14]. В связи с обнаружившейся особой чувствительностью ГГТ к длительному воздействию алкоголя на печень предложено использовать определение ГГТ в качестве теста на нарушение функции печени у лиц с предполагаемым алкоголизмом [3].
При моделировании алкогольной интоксикации зафиксировано статистически значимое увеличение активности ГГТ на 49%. Активность других ферментов также была повышена (за исключением АЛТ), а в случае с АСТ – достоверно на 76%, что может быть свидетельством нарушения проницаемости клеточных мембран или цитолиза клеток печени крыс в условиях данного эксперимента.
Таким образом, у экспериментальных животных при длительной алкогольной интоксикации происходят значимые изменения липидного, углеводного и белкового обмена, выражающиеся в изменении содержания триглицеридов, ХС ЛПВП, глюкозы и общего белка. Установлено достоверное увеличение активности АСТ и ГГТ – специфического маркера алкоголь-индуцированного нарушения функции печени.
У животных, которые на фоне длительной алкогольной интоксикации получали дополнительно ЛФ, уровень общего холестерина статистически значимо снижался на 7.5% по сравнению с контролем. Зафиксированные изменения связаны со способностью ЛФ ингибировать накопление липидов в жировой ткани и печени [15, 16].
Пероральное введение ЛФ также способствовало достоверному уменьшению содержания ХС ЛПВП на 17%.
В этих же условиях наблюдалось статистически значимое падение уровня ХС ЛПНП на 33% по сравнению с контролем. Полученные результаты согласуются с литературными данными и свидетельствуют о возможности ЛФ снижать уровень ХС ЛПНП [16, 17].
Отмечено достоверное увеличение содержания триглицеридов в сыворотке крови крыс при влиянии ЛФ на 29% по отношению к контрольной группе. У животных, которые потребляли ЛФ также наблюдалось достоверное повышение содержания глюкозы на 36% по сравнению с контрольными значениями, что, возможно, связано со способностью ЛФ увеличивать абсорбцию глюкозы в тонком кишечнике [18].
Введение ЛФ при длительной алкогольной интоксикации не оказывало существенного влияния на содержание общего белка по отношению к контролю, что может указывать на восстановление белкового метаболизма.
Если при алкогольной интоксикации зафиксировано увеличение ферментативной активности ГГТ, АСТ и ЛДГ в сыворотке крови, то введение ЛФ нивелировало действие алкоголя, приводя значения активности ферментов практически к контрольному уровню, что может быть свидетельством нормализации функционального состояния мышечных и сердечных клеток и гепатоцитов.
Таким образом, при введении ЛФ на фоне длительной алкогольной интоксикации происходит существенное изменение содержания общего холестерина, триглицеридов, ХС ЛПВП и ХС ЛПНП в сыворотке крови крыс за счет непосредственного влияния данного белка на липидный метаболизм. Также наблюдается нормализация белкового обмена, активности ГГТ и АСТ.
Электронно-микроскопические исследования биоптатов печени при хронической алкогольной интоксикации выявили изменения, характерные для токсического поражения клеток органа. Отмечалось угнетение синтетической функции гепатоцитов и активизация процессов фиброобразования. Митохондриальный аппарат печеночных клеток представлен полиморфными структурами с уплотненным умеренно отечным матриксом и нечетко выраженными кристами, между которыми выявлялись расширенные цистерны гранулярной эндоплазматической сети с электронноплотными вкраплениями гранул гликогена. Среди митохондрий, окружающих ядра гепатоцитов, определялись светлые гомогенные включения, липидные капли (рис. 1а).
Рис. 1.
Ультраструктурная организация клеток печени и синусоидного капилляра при хронической алкогольной интоксикации. М – митохондрии, N – ядро, L – липидная капля, SR – гранулярный эндоплазматический ретикулум, SM – звездчатый макрофаг, PS – перисинусоидальное пространство (Диссе), K – коллаген. (×6000 a; ×8000 c, d; ×10000 b).
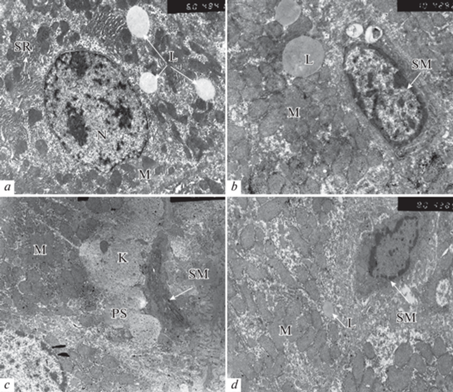
Отмечалось расширение синусоидных капилляров и активация клеток, формирующих их стенку – звездчатых макрофагов, или клеток Купфера. Часть клеток имело вытянутую фибробластоподобную форму, крупное гетерохромное ядро, вокруг которого концентрировались комплекс Гольджи, многочисленные цистерны гранулярного эндоплазматического ретикулума, митохондрии, лизосомы, вакуоли (рис. 1b). Другие клетки имели многочисленные цитоплазматические отростки, пересекающие просвет капилляра, крупные лизосомы и липидсодержащие капли, цистерны эндоплазматической сети (рис. 1c, d). Данные клетки обладают высокой фибротической активностью, в местах их локализации наблюдалось расширение перисинусоидальных пространств и разрастание коллагеновых волокон (рис. 1с).
Эндотелиальная выстилка синусоидных капилляров на большем протяжении проницаема для клеток крови – активированные клетки лимфо- и моноцитарного ряда мигрируют в пространство Диссе. Отмечается окклюзия капилляров синусоидов клетками крови.
Таким образом, электронно-микроскопическое исследование показало, что длительное поступление этанола в организм экспериментальных крыс способствует развитию хронического алкогольного поражения печени.
Электронно-микроскопическое исследование паренхимы печени экспериментальных крыс, получавших перорально 15%-ный раствор этанола в сочетании с ЛФ, выявило положительное влияние последнего на восстановление структурно-функциональной организации печеночных клеток и их органелл. Отмечается повышение синтетической активности гепатоцитов – активизируются процессы транскрипции и эухроматизации ядер (рис. 2а). Митохондриальный аппарат гепатоцитов характеризуется полиморфизмом. Часть органелл имеет электронноплотный отечный матрикс со слабо обозначенными кристами (рис. 2b). Выявляются мелкие митохондрии с просветленным матриксом, а также гипертрофированные органеллы удлиненной формы. Данная ультраструктурная организация митохондрий свидетельствует о частичном угнетении их функции и развитии в клетках печени функционального напряжения.
Рис. 2.
Ультраструктурная организация клеток паренхимы печени и синусоидного капилляра крыс, получавших сочетано этанол и лактоферрин. N – ядро, M – митохондрии, SR – гранулярный эндоплазматический ретикулум, PL – перисинусоидальный липоцит, L – липидные капли. (×6000 a, d, e, f; ×8000 b, c).
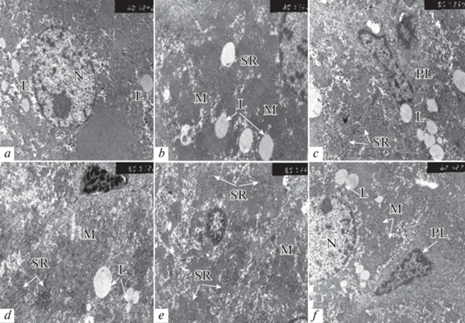
Цистерны гранулярного эндоплазматического ретикулума гиперплазированы и расширены, имеют обильное количество рибосом и полисом (рис. 2d, е). В них накапливается хлопьевидный электронноплотный материал, что связано с повышенной белково-синтетической функцией гепатоцитов и пониженной экскрецией белка. Отмечается гиперплазия мембран комплекса Гольджи. В цитоплазме клеток печени и в перисинусоидальных пространствах выявляются липидные включения.
Синусоидные капилляры полнокровны, отмечается активация клеток, формирующих их стенку – звездчатых макрофагов, перисинусоидальных липоцитов (клеток Ито). Часть клеток Ито имеет фибробластоподобную форму, крупное гетерохромное ядро, вокруг которого концентрируются липидные капли (рис. 2с). Другие клетки относятся к смешанному типу, в них увеличивается количество белоксинтезирующих органелл (рис. 2f). Выявляются активированные звездчатые макрофаги с длинными цитоплазматическими отростками, в цитоплазме которых присутствуют темные лизосомы с электронноплотными включениями.
Таким образом, электронно-микроскопическое исследование паренхимы печени экспериментальных крыс показало положительное влияние ЛФ на восстановление структурно-функциональной организации печеночных клеток и их органелл. Повышение синтетической активности гепатоцитов проявляется активацией процессов транскрипции и эухроматизации ядер, полиморфизмом митохондрий, частичном угнетении их функции и развитии в клетках печени функционального напряжения. Гиперплазия цистерн гранулярного эндоплазматического ретикулума и мембран пластинчатого комплекса Гольджи указывает на повышение белково-синтетической функции печеночных клеток. Возрастает активность клеток синусоидных капилляров. Выявление звездчатых макрофагов с высокой фагоцитарной активностью, содержащих электронноплотные лизосомы, указывает на повышение метаболизма липидов и белковых комплексов, а также на активацию процессов фагоцитоза, направленных на поглощение фрагментов разрушенных органелл клетки. Выявление полиморфных перисинусоидальных липоцитов и клеток смешанного типа свидетельствует об ослаблении процессов фиброза в ткани печени.
ЗАКЛЮЧЕНИЕ
Потребление ЛФ сочетанное с 15%-ным алкоголем приводит к восстановлению ряда биохимических показателей сыворотки крови (уровня общего белка, активности гамма-глютамилтрансферазы и др.). Он способствует восстановлению структурно-функциональной организации печени. Повышение синтетической активности гепатоцитов проявляется активизацией процессов транскрипции и эухроматизации ядер. Гиперплазия цистерн гранулярного плазматического ретикулума и мембран пластинчатого комплекса Гольджи указывает на повышение белково-синтетической функции клеток печени.
Таким образом, настоящим исследованием впервые показана еще одна область возможного использования, полученного в Республике Беларусь рекомбинантного лактоферрина человека, а именно: для коррекции патологических состояний, вызванных хронической алкогольной интоксикацией.
Список литературы
Bishehsari F, Magno E, Swanson G, Desai V, Voigt RM, Forsyth CB, Keshavarzian A (2017) Alcohol and Gut-Derived Inflammation. Alcohol Res 38: 163–171.
Ghosh N, Ghosh R, Mandal V, Mandal SC (2011) Recent advances in herbal medicine for treatment of liver diseases. Pharm Biol 49: 970–988. https://doi.org/10.3109/13880209.2011.558515
Gundermann KJ, Gundermann S, Drozdzik M, Mohan Prasad VG (2016) Essential phospholipids in fatty liver: a scientific update. Clin Exp Gastroenterol 9: 105–117. https://doi.org/10.2147/CEG.S96362
Лукашевич ВС, Будевич АИ, Семак ИВ, Кузнецова ВН, Малюшкова ЕВ, Пыж АЭ, Новаковская СА, Рудниченко ЮА, Попков НА, Ивашкевич ОА, Залуцкий ИВ (2016) Получение рекомбинантного лактоферрина человека из молока коз-продуцентов и его физиологические эффекты. Докл НАН Беларуси 60: 72–81. [Lukashevich VS, Budevich AI, Semak IV, Kuznetsova VN, Malyushkova YEV, Pyzh AE, Novakovskaya SA, Rudnichenko YUA, Popkov NA, Ivashkevich OA, Zalutskiy IV (2016) Obtaining recombinant human lactoferrin from the milk of producing goats and its physiological effects. Dokl NAN Belarusi 60: 72–81. (In Russ)].
Goldman IL, Georgieva SG, Gurskiy YaG, Krasnov AN, Deykin AV, Popov AN, Ermolkevich TG, Budzevich AI, Chernousov AD, Sadchikova ER (2012) Production of human lactoferrin in animal milk. Biochem Cell Biol 90: 513–519. https://doi.org/10.1139/o11-088
Sienkiewicz M, Jaśkiewicz A, Tarasiuk A, Fichna J (2021) Lactoferrin: an overview of its main functions, immunomodulatory and antimicrobial role, and clinical significance. Crit Rev Food Sci Nutr 1–18. https://doi.org/10.1080/10408398.2021.1895063
Боголепов НН (1976) Методы электронно-микроскопического исследования мозга. М. Наука. [Bogolepov NN (1976) Metody elektronno-mikroskopicheskogo issledovaniya mozga. M. Nauka. (In Russ)].
Van de Wiel (2012) A The effect of alcohol on postprandial and fasting triglycerides. Int J Vasc Med 2012:862504. https://doi.org/10.1155/2012/862504
Steiner JL, Lang CH (2017) Alcohol, Adipose Tissue and Lipid Dysregulation. Biomolecules 7: 1–24. https://doi.org/10.3390/biom7010016
Subbaiah GV, Mallikarjuna K, Shanmugam B, Ravi S, Taj PU, Reddy KS (2017) Ginger Treatment Ameliorates Alcohol-induced Myocardial Damage by Suppression of Hyperlipidemia and Cardiac Biomarkers in Rats. Pharmacogn Mag 13: S69–S75. https://doi.org/10.4103/0973-1296.203891
Лелевич ВВ, Леднева ИО, Лелевич СВ (2017) Метаболические эффекты хронической алкогольной интоксикации. Журн Гродненск гос мед универ 15: 310–314 [Lelevich VV, Ledneva IO, Lelevich SV (2017) Metabolic effects of chronic alcohol intoxication. Zhurn Grodnensk Gos Med Univer 15:310–314. (In Russ)].
Chandrasekaran K, Swaminathan K, Mathan Kumar S, Clemens DL, Dey A (2012) In vitro evidence for chronic alcohol and high glucose mediated increased oxidative stress and hepatotoxicity. Alcohol Clin Exp Res 36: 1004–1012. https://doi.org/10.1111/j.1530-0277.2011.01697.x
Tsai WW, Matsumura S, Liu W, Phillips NG, Sonntag T, Hao E, Lee S, Hai T, Montminy M (2015) ATF3 mediates inhibitory effects of ethanol on hepatic gluconeogenesis. Proc Natl Acad Sci U S A 112: 2699–2704. https://doi.org/10.1073/pnas.1424641112
Dixit S, Singh P (2015) Usefulness of Gamma Glutamyl Transferase as Reliable Biological Marker in Objective Corroboration of Relapse in Alcohol Dependent Patients. J Clin Diagn Res 9: VC01–VC04. https://doi.org/10.7860/JCDR/2015/14752.6895
Li YC, Hsieh CC (2014) Lactoferrin dampens high-fructose corn syrup-induced hepatic manifestations of the metabolic syndrome in a murine model. PLoS One 9: e97341. https://doi.org/10.1371/journal.pone.0097341
Marcil V, Mayeur S, Lamarche B, England J, Henderson M, Delvin E, Amre D, Levy E (2017) Cardiometabolic risk factors and lactoferrin: polymorphisms and plasma levels in French-Canadian children. Pediatr Res 82: 741–748. https://doi.org/10.1038/pr.2017.72
Morishita S, Ono T, Fujisaki C, Ishihara Y, Murakoshi M, Kato H, Hosokawa M, Miyashita K, Sugiyama K, Nishino H (2013) Bovine lactoferrin reduces visceral fat and liver triglycerides in ICR mice. J Oleo Sci 62: 97–103. https://doi.org/10.5650/jos.62.97
Maekawa Y, Sugiyama A, Takeuchi T (2017) Lactoferrin potentially facilitates glucose regulation and enhances the incretin effect. Biochem Cell Biol 95: 155–161. https://doi.org/10.1139/bcb-2016-0082
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


