Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 562-578
Морфологические и гистофизиологические особенности эндотелия капилляров головного мозга
А. В. Егорова 2, *, Т. И. Баранич 1, 2, А. В. Брыдун 1, 2, В. В. Глинкина 2, В. С. Сухоруков 1, 2
1 Научный центр неврологии
Москва, Россия
2 Российский национально-исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
* E-mail: AV_Egorova@bk.ru
Поступила в редакцию 02.02.2022
После доработки 03.03.2022
Принята к публикации 25.03.2022
- EDN: ZDKUYN
- DOI: 10.31857/S086981392205003X
Аннотация
В настоящем обзоре рассмотрены современные представления об особенностях морфологии и гистофизиологии эндотелиальных клеток капилляров головного мозга. Особое внимание уделено ультрамикроскопическому строению эндотелиоцитов, входящих в состав нейроваскулярной единицы. Обсуждена взаимосвязь их основных характеристик с реализацией барьерной функции. Проанализирована специфика межклеточных контактов в эндотелиоцитах капилляров в составе гематоэнцефалического барьера, структура их цитоскелета и гликокаликса. Рассмотрены особенности строения капилляров в составе нейрогенных ниш, а также в анатомических образованиях, где гематоэнцефалический барьер отсутствует или слабо выражен. Отдельный раздел обзора посвящен вопросам транспорта веществ в эндотелиоцитах головного мозга. Анализ современных источников информации позволил установить, что несмотря на значительное количество публикаций, посвященных описанию эндотелиальных клеток церебральных микрососудов, ряд вопросов так и остаются неизученными, и исследование особенностей строения и функционирования церебрального эндотелия не утрачивает своей актуальности.
Эндотелий кровеносных сосудов представляет собой активно функционирующую и сложную метаболическую систему. Схожесть строения эндотелиальных клеток в различных участках сосудистого русла сопровождается значительными различиями в их генной и биохимической специфичности, типах рецепторов, наборе ферментов и т.д. [1]. Гетерогенность популяции клеток эндотелия в организме человека определяется особенностями функционирования сосудов в разных тканях, гемодинамическими условиями и клеточным микроокружением.
В эмбриогенезе эндотелиальные клетки формируются из общего предшественника мезенхимного происхождения и приобретают тканеспецифичные свойства на различных этапах развития эндотелиальных прогениторных клеток в ходе их миграции и дифференцировки [2]. Эмбриональные стволовые клетки, коммитированные по эндотелиальному пути развития, заселяют области формирующегося мозга, содержащие радиальную глию, нейробласты и нейроны [3] и рано начинают экспрессировать молекулы межклеточных контактов (молекулы клеточной адгезии, белки плотных и щелевых контактов) [4]. Уже на 8-й неделе эмбриогенеза иммунофенотипирование эндотелиальных прогениторных клеток демонстрирует экспрессию ими некоторых ключевых антигенов (например, CD34, CD31, CD133, CD45, VEGFR2, CD144 и др.) [5], идентификация которых на резидентных клетках сосудистой стенки или прогениторных клетках костномозгового происхождения позволяет судить о механизмах развития и направленной миграции клеток эндотелия в ткани.
Свойства, присущие эндотелиоцитам кровеносных сосудов головного мозга, позволяют эффективно регулировать взаимодействие кровотока и структур центральной нервной системы [6]. Ведущее место в поддержании церебрального гомеостаза принадлежит сосудам микроциркуляторного русла, прежде всего капиллярам, обеспечивающим адекватный обмен веществ.
Эндотелиальная выстилка большинства церебральных капилляров является частью нейроваскулярной единицы – интегрированной структуры, состоящей из эндотелиальных клеток микрососудов, функционально связанных с нейронами, астроцитами и перицитами. Нейроваскулярная единица составляет основу гематоэнцефалического и гематоликворного барьеров, и эндотелий в ее составе характеризуется морфофункциональными признаками, которые позволяют реализовать как барьерную функцию, так и регулируемый транспорт [7].
В представленном обзоре на основании данных современной литературы систематизированы некоторые сведения, касающиеся особенностей морфологического строения и гистофизиологии эндотелия церебральных гемокапилляров.
1. СТРОЕНИЕ ЭНДОТЕЛИЯ КАПИЛЛЯРОВ ГОЛОВНОГО МОЗГА В СОСТАВЕ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА (ГЭБ)
1.1. Ультраструктурное строение эндотелиоцитов
Ультраструктурные особенности строения стенки большинства капилляров головного мозга позволяют отнести их к группе капилляров непрерывного (соматического) типа. Их эндотелий не имеет фенестр и окружен непрерывной базальной мембраной (рис. 1).
Рис. 1.
Ультраструктура стенки капилляра головного мозга человека (препарат Л.Е. Фрумкиной). 1 – ядро эндотелиальной клетки; 2 – цитоплазма эндотелиоцита; 3 – межэндотелиальные соединения; 4 – базальная мембрана; 5 – ядро перицита; 6 – ножки астроцитов; 7 – просвет капилляра. Электронограмма. Ув. 6000.
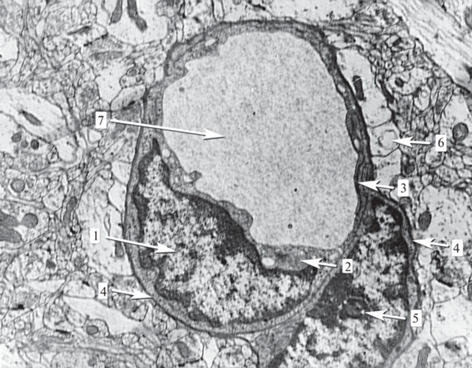
Отсутствие фенестральных диафрагм и малая степень капиллярной проницаемости объясняется низкой экспрессией в плазмолемме эндотелиальных клеток гликопротеина PVLAP (plasmalemma vesicle-associated protein) [8]. Одним из основных регуляторов образования этого белка считается фактор роста эндотелия сосудов (VEGF), продуцируемый самими эндотелиальными клетками и астроцитами [9]. Cостояние гипоксии, индуцирующее синтез VEGF, усиливает экспрессию PVLAP на клетках эндотелия капилляров, что приводит к появлению фенестр и повышению уровня трансцитоза. Так, в экспериментах на мышах с очаговой церебральной ишемией через 48 ч после начала эксперимента в эндотелии выявлялось незначительное количество PLVAP, а через 5 дней было зафиксировано заметное повышение экспрессии данного белка. Кроме того, было показано, что все PLVAP-положительные клетки были локализованы вокруг области ишемического повреждения [10].
Эндотелиоциты капилляров головного мозга, как и другие субпопуляции эндотелиальных клеток, имеют вытянутую полигональную форму, уплощенное ядро и характеризуются немногочисленностью органелл. Исключение составляют митохондрии, которые в церебральных эндотелиоцитах представлены в гораздо большем количестве по сравнению с эндотелиальными клетками других локализаций. Митохондрии в эндотелии капилляров ГЭБ относительно крупные (0.2–0.6 мкм) с умеренно плотным гомогенным матриксом и короткими кристами. Присутствие в клетках большого количества данных органелл объясняется не только высокими энергетическими потребностями транспортных систем, но и значительной интенсивностью процессов ангиогенеза, которые в головном мозге имеют место при восстановлении ткани после повреждения, а также в связи с явлением нейропластичности [11]. Особенностью энергетического метаболизма церебральных эндотелиоцитов является высокий базальный уровень гликолиза, а также интенсификация гликолиза и митохондриального дыхания при индукции васкуло- и ангиогенеза [12]. Ткани головного мозга характеризуются высоким содержанием лактата, основными продуцентами которого являются астроциты [13]. Значительное количество лактата может находиться и в системной циркуляции. В таких условиях клетки церебрального эндотелия реализуют так называемый обратный эффект Варбурга [14]: эндотелий утилизируют лактат, который̆ обеспечивает стимуляцию цикла трикарбоновых кислот и митохондриальной продукции АТФ, что может быть необходимым для формирования локального микроокружения, оптимального для процессов ангиогенеза или высокой активности нейронов и нейропластичности.
Особая роль в осуществлении барьерной функции принадлежит цитоскелету церебральных эндотелиальных клеток, состоящему, как и у клеток других типов, из координированно функционирующих фибриллярных компонентов: актиновых филаментов, микротрубочек и промежуточных филаментов. Изменение структуры цитоскелета вызывает модификацию формы эндотелиоцитов: клетки сокращаются, а между ними возникают промежутки – как следствие, сосудистая проницаемость повышается [15]. Установлено, что деформация эндотелиоцита затрагивает все три системы цитоскелета, но в различное время: сначала изменяется система актиновых филаментов, затем – система микротрубочек и, в заключение, виментиновая сеть [16].
Главными компонентами, обеспечивающими сокращение клетки, являются ее актиновые филаменты, и в целом ряде работ показано, что именно им принадлежит важнейшая роль в обеспечении барьерной функции эндотелия [17]. В эндотелиальных клетках процесс полимеризации актина очень динамичен, время обмена актиновых микрофиламентов составляет несколько секунд, они эффективно регулируют форму клетки. Динамичность обеспечивает быструю перестройку актиновых структур и переход от статического фенотипа, для которого типично наличие массивного кортикального актинового кольца и минимального количества стресс-фибрилл, к так называемому активированному фенотипу, характеризующемуся слабовыраженным слоем кортикальных актиновых филаментов (вплоть до их полного отсутствия) и наличием сжимающих клетку многочисленных стресс-фибрилл [18]. В настоящее время особую актуальность приобретают исследования, касающиеся взаимодействия актиновых филаментов церебральных эндотелиоцитов с адгезионными структурами клетки – фокальными и межклеточными контактами [16, 19]. Кроме того, проводится изучение вклада других фибриллярных структур (микротрубочек, промежуточных филаментов) в процесс регуляции сосудистой проницаемости и осуществление барьерной функции эндотелия, в том числе, в микрососудах головного мозга [20].
Особая роль в выполнении транспортной, барьерной, антитромботической и других функций церебрального эндотелия принадлежит гликокаликсу – многокомпонентной системе, расположенной на люминальной поверхности эндотелиальных клеток [21]. Его толщина в эндотелиоцитах капилляров головного мозга составляет около 0.07 мкм и меняется в зависимости от функционального состояния сосуда [22]. Толщина гликокаликса в эндотелии микрососудов других органов в физиологических условиях колеблется от 0.1 до 0.5 мкм [21].
Среди основных опорных молекул гликокаликса – мембранных протеогликанов (синдиканов и глипиканов) – в эндотелии церебральных капилляров не обнаруживается синдекан-1, экспрессия которого снижена, но все же представлена в гликокаликсе эндотелиальной выстилки других микрососудов [23, 24].
Как и в других клетках, в гликокаликсе эндотелиоцитов капилляров головного мозга выявляются шесть разновидностей глипиканов, среди которых особое место занимает глипикан-1. Он является регулятором активности эндотелиальной NO-синтазы и образования оксида азота (NO), участвующего в изменении сосудистого тонуса [24–27]. Этот глипикан играет защитную роль, и его потеря связана с дисфункцией кровеносных сосудов во время старения [28]. В ответ на повышение напряжения сдвига при изменении скорости кровотока плотность глипикана-1 в области межклеточных контактов увеличивается, что обеспечивается его миграцией в составе липидных рафтов, в то время как в области кавеол остается неизменной. При этом происходит реорганизация внутриклеточного цитоскелета с изменением морфологии эндотелиальных клеток и увеличением их продольного размера [27, 29].
Сульфатированные гликозоаминогликаны гликокаликса (хондроитин- и гепарансульфат), ковалентно неспецифично связанные с трансмембранными доменами протеогликанов, принимают участие во многих физиологических процессах, связывают, активируют или инактивируют биологически активные молекулы, влияют на иммунные реакции, воспаление, гемостаз, клеточный рост [21, 30, 31]. Кроме того, гликозаминогликаны модулируют пути сигналинга факторов роста, в том числе сосудистых эндотелиальных факторов роста VEGFs/VEGFRs, а также влияют на транскрипцию генов в клетках эндотелия за счет стимуляции образования ядерного фактора NFkB [32].
Несульфатированный гликозаминогликан – гиалуроновая кислота – основной компонент гликокаликса, определяющий барьерные свойства эндотелия и регулирующий проницаемость кровеносных сосудов головного мозга – имеет спиралевидную структуру и обладает высокой вязкостью. Она контактирует с молекулами RHAMM (рецептор опосредованной гиалуронаном подвижности) и CD44 на мембране клеток эндотелия. Последние в свою очередь соединяются с актиновыми филаментами и участвуют в кавеол-опосредованном эндоцитозе и трансцитозе [24, 33]. Возрастание активности гиалуронидазы при ряде патологических состояний приводит к фрагментации гиалуроновой кислоты и нарушению целостности эндотелиального гликокаликса с повышением его проницаемости [34]. Известен ряд ферментов, обеспечивающих отщепление протеогликанов и гликозаминогликанов от поверхности эндотелиальных клеток при действии различных стимулов. В частности, расщепление синдеканов и гликозаминогликанов опосредуется матриксными металлопротеазами и гепараназой [32]. В этой связи матриксные металлопротеазы эндотелия рассматриваются в качестве основных эффекторов деградации компонентов гликокаликса.
В состав гликопротеинового комплекса гликокаликса входят белки трех семейств – селектины (Р- и Е-селектины), интегрины (αV, α5, α2) и эндотелиальные иммуноглобулиноподобные белки (ICAM-1, ICAM-2, VCAM-1, PECAM-1) [1]. Они обеспечивают взаимодействие иммунокомпетентных клеток с компонентами сосудистой стенки, регулируют процесс адгезии и последующей миграции лейкоцитов. В физиологических условиях толщина гликокаликса эндотелиоцита капилляра превышает размер адгезионных молекул и длину ворсинок лейкоцита при роллинге. Это ограничивает возможности контакта мембраны лейкоцита с молекулами адгезии на эндотелии, препятствуя их трансэндотелиальной миграции. Уменьшение толщины гликокаликса за счет слущивания его ключевых компонентов под воздействием провоспалительных агентов улучшает проникновение лейкоцитов к стенке сосуда, тем самым облегчая их трансэндотелиальную миграцию [35].
1.2. Межклеточные контакты церебральных эндотелиоцитов
Избирательная проницаемость, характерная в принципе для всех эндотелиальных клеток, регулируется, в первую очередь, плотными межклеточными контактами, представляющими собой комплекс структур, сформированных трансмембранными адгезивными молекулами, сочлененными с сетью внутриклеточных сигнальных молекул и связанных с цитоскелетом белков. В зависимости от фенотипа эндотелия, плотные контакты присутствуют в стенке сосудистого русла в разной степени комплексности. В образующих ГЭБ эндотелиоцитах мозговых капилляров, где особенно необходим контроль проницаемости, плотные контакты развиты значительно лучше, чем в других микрососудах [36]. Кроме того, комплекс межклеточных соединений церебральных эндотелиоцитов отличается динамичностью, что позволяет эффективно регулировать клеточную адгезию, межклеточный транспорт, запускать сигнальные каскады.
Ближе всего к базальной мембране располагаются адгезивные контакты (adherens junctions). В их составе представлены эндотелиальный кадгерин и катенины. Кадгерин эндотелия сосудов (Ve-кадгерин) является основным трансмембранным белком эндотелиальных адгезивных контактов. Внутри эндотелиоцита кадгерин связан с катенином, и через него – с актиновыми филаментами цитоскелета. Семейство катенинов в церебральных эндотелиоцитах представлено катенинами α, β (plakoglobin), γ и катенином p120. Считается, что β- и γ-катенины связывают кадгерин с α-катенином. Роль катенина p120 остается спорной в отличие от вышеупомянутых классических катенинов, но высокое сродство связывания катенина p120 с Ve-кадгерином предполагает, что он может регулировать проницаемость сосудов [37–39] (рис. 2).
Рис. 2.
Структурные особенности комплекса адгезивных и плотных контактов церебральных эндотелиоцитов.
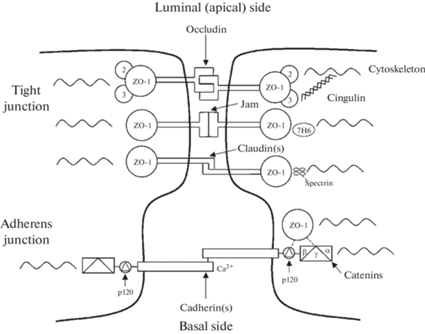
Тромбоцитарная молекула клеточной адгезии (PECAM-1) поддерживает целостность эндотелия кровеносных сосудов и вместе с катенинами участвует во взаимодействии лейкоцитов с эндотелием и обеспечивает их трансэндотелиальную миграцию при воспалении [40].
Выше адгезивных контактов располагаются нексусы, образующие каналы между эндотелиальными клетками посредством белков коннексинов CX30 и CX43, которые осуществляют в эндотелиальном слое в основном коммуникативную функцию.
Непосредственно у апикальной поверхности клеток располагаются плотные контакты, изолирующая способность которых в эндотелии капилляров головного мозга на два порядка выше, чем в капиллярах других органов. В их составе присутствуют трансмембранные и цитоплазматические белки. Трансмебранные белковые молекулы представлены окклюдином и клаудинами, которые ограничивают парацеллюлярный транспорт растворенных веществ и ионов, что создает высокое электрическое сопротивление барьера (более 1000 Ом/см) [41–45]. При исследовании ткани головного мозга методом Вестерн-блоттинга была показана экспрессия клаудинов-1, -3, -5 и -12, обеспечивающих повышение барьерных свойств эндотелия, а также клаудинов-2 и -17, образующих межклеточные поры для транспорта ионов и воды [43, 45–47].
К цитоплазматическим белкам плотных контактов относят ZO-протеины (1-, 2-, 3-), цингулин, Par-3, Par-6, Afidin/AF-6, 7H6, ZONAB, Rab3b, Rab13, PKC, G protein.
ZO-протеины – ассоциированные с мембраной гуанилкиназа-подобные белки (англ.: membrane-associated guanilate kinase-like proteins – MAGUK) состоят из доменов PDZ1, PDZ2 и PDZ3, SH3-домена и гуанилкиназа-подобного домена (GUK). Эти домены участвуют в упорядочении структуры белковых молекул и в поддержании целостности плазматических мембран [48]. ZO-протеины связаны с мембранными клаудинами и окклюдином с одной стороны и актиновыми и винкулиновыми филаментами с другой.
Цингулин обеспечивает связь между белками плотного контакта (ZO-2, ZO-3, AF-6, JAM) и актин-миозиновым цитоскелетом [49]. 7H6 в основном играет роль в поддержании структуры контакта, тогда как ZONAB (ассоциированный с ZO-1 белок, связывающий нуклеиновые кислоты) регулирует транскрипцию ErbB и параклеточную проницаемость. Rab белки (Rab13, Rab3b) играют роль в стыковке и слиянии транспортных пузырьков в комплексе плотных контактов [50]. PKC участвует в регуляции поляризации, а также в сборке плотного контакта, а G-белки (G-i0, G-i2, G12, Gs) ускоряют сборку плотных контактов и поддерживают трансэндотелиальное электрическое сопротивление [51].
В зоне плотных контактов эспрессируются межклеточная молекула адгезии ICAM-1 и молекулы контактной адгезии JAM-A, JAM-B и JAM-C, которые относятся к классу иммуноглобулинов. JAM-B и JAM-C участвуют в миграции сквозь эндотелий лейкоцитов [52]. ICAM-1 (CD54) – одна из главных молекул адгезии, которая обусловливает изменение проницаемости сосудов и трансэндотелиальную миграцию лейкоцитов. ICAM-1 связывается с интегринами CD11/CD18 и LFA-1 лейкоцитов, в основном нейтрофилов, после чего они легко проникают в ткани [53]. Экспрессия ICAM-1 увеличивается после активации эндотелиоцитов активными формами кислорода и провоспалительными стимулами, действие которых опосредуется сигнальными путями с участием Akt/PKB, NF-κB, МАР-киназы p38 и ERK1/2 [54–56]. В норме эндотелиальные клетки церебральных капилляров имеют низкую экспрессию молекул адгезии лейкоцитов, что делает практически невозможным проникновение иммунных клеток в центральную нервную систему. Провоспалительные цитокины (α-ФНО, ИЛ-1β и ИЛ-6), высвобожденные активированной микроглией, индуцируют перегруппировку и изменение экспрессии белков плотных контактов (ZO-1 и окклюдин), что приводит к увеличению проницаемости эндотелия, диффузии малых молекул и миграции лейкоцитов через образующиеся щели [57].
При исследовании особенностей формирования ГЭБ у крыс в физиологических условиях, а также после перинатальной гипоксии и стресса в молодом возрасте, было установлено, что в физиологических условиях количество клеток, экспрессирующих JAM, ZO1 и клаудин 5, несколько увеличивается в период от 7-го до 70-го дня жизни в коре, гиппокампе и миндалине головного мозга. После перенесенной перинатальной гипоксии количество клеток, экспрессирующих белки плотных контактов (JAM, клаудин), значительно увеличивается с 28-го по 70-й дни жизни крысы, в то время как количество ZO1 положительных клеток за тот же период времени снижается. То есть перенесенный в раннем возрасте стресс вызывает дисбаланс между экспрессией ZO1 и других белков плотных контактов, но эти изменения противоположны по направлению [58].
1.3. Базальная мембрана
Немаловажная роль в регуляции проницаемости капилляров головного мозга принадлежит базальной мембране, объединенной с эндотелиоцитами в единую систему при помощи фокальных контактов [59]. Интегрины – основные белки этого контакта представляют собой гликопротеиновые комплексы, состоящие из α- и β-субъединиц. В цитоплазме эндотелиальной клетки интегрины соединяются с актиновыми микрофиламентами цитоскелета. Механические силы, действующие на внеклеточный домен интегрина, способны активировать сигнальные белки, связанные с его цитоплазматическим доменом, и запускать генерализованные реакции с участием цитоскелета. Прочность прикрепления эндотелиальных клеток к матриксу базальной мембраны может изменяться при молекулярных перестройках в области цитоплазматического домена интегрина [59, 60].
Базальная мембрана эндотелиоцитов капилляров ГЭБ является непрерывной, трехслойной и характеризуется повышенным по сравнению с аналогичной структурой других субпопуляций эндотелиоцитов содержанием коллагена IV типа. Протеазы, выделяющиеся при воздействии провоспалительных агентов, увеличивают порозность мембраны, что приводит к повышению проницаемости ГЭБ [61]. Среди белков внеклеточного матрикса базальной мембраны следует отметить ламинин. Он действует как барьер для заряженных частиц с определенными молекулярно-весовыми характеристиками и регулирует проницаемость и клеточный транспорт через ГЭБ. Толщина базальной мембраны в церебральном эндотелии колеблется от 100 до 200 нм. В капиллярах ГЭБ данная структура объединяет между собой эндотелий, перициты и перикапиллярную глию, выполняя связующую функцию. Апикальные микровыросты перицитов и базальные микровыросты эндотелиоцитов связаны между собой при помощи плотных или адгезивных контактов, обеспечивающих тесную функциональную взаимосвязь [62]. Снаружи от базальной мембраны капилляров располагается сплошной футляр из астроцитов, отростки которых образуют плотные или адгезивные соединения.
2. ОСОБЕННОСТИ СТРОЕНИЯ ЭНДОТЕЛИЯ КАПИЛЛЯРОВ В ОТДЕЛЬНЫХ УЧАСТКАХ ГОЛОВНОГО МОЗГА. ИЗМЕНЕНИЯ, СОПРОВОЖДАЮЩИЕ СТАРЕНИЕ
Для капилляров анатомических образований, в которых ГЭБ отсутствует или слабо выражен, характерен несколько иной фенотип. К таким структурам относятся area postrema ромбовидной ямки (дна IV желудочка), эпифиз, нейрогипофиз, прикрепленная пластинка (lamina affixa), субфорникальный орган, субкомиссуральный орган. Большинство из них является нейроэндокринными структурами, участвующими в процессах нейрогуморальной регуляции. Наличие ГЭБ препятствовало бы исполнению данными анатомическими образованиями своих функций.
При электронно-микроскопическом исследовании строения стенки таких капилляров установлено присутствие как типичного, так и фенестрированного эндотелия. Клетки характеризуются менее выраженной экспрессией белков плотных контактов, низким электрическим сопротивлением, наличием в цитоплазме большого количества микровезикул и вакуолей. Это свидетельствует об их участии в процессах трансэндотелиального транспорта веществ и о меняющейся функциональной активности клеток [63].
Рядом структурно-функциональных особенностей обладает и эндотелиальный слой, выстилающий капилляры в области нейрогенных ниш, где благодаря микроокружению, формируемому клетками эндотелия и астроглии, фиксируются явления нейрогенеза в постнатальном периоде. Нейрогенными нишами в головном мозге являются субвентрикулярная зона боковых желудочков и субгранулярная зона зубчатой извилины в гиппокампе [64, 65]. Так, субвентрикулярная зона боковых желудочков характеризуется повышенной проницаемостью ГЭБ вследствие меньшего покрытия эндотелия и перицитов отростками периваскулярной астроглии. Это необходимо для секреции в нишу факторов роста и других регуляторных молекул. В субгранулярной зоне зубчатой извилины проницаемость стенки церебральных микрососудов существенно ниже, и основная часть гуморальных факторов, регулирующих нейрогенез, секретируется локально [66, 67].
При физиологическом старении происходят следующие изменения в структуре церебральных капилляров: увеличивается толщина капиллярной стенки, отмечается утрата перицитов, снижается количество эндотелиоцитов и митохондрий в них, уменьшается экспрессия белков плотных контактов, увеличивается толщина базальной мембраны. В базальной мембране возрастает концентрация коллагена IV и снижается содержание ламинина [68].
3. ТРАНСПОРТ
Барьерный фенотип, присущий эндотелиоцитам капилляров в составе ГЭБ, практически исключает возможность парацеллюлярного транспорта и пиноцитоза. Этим объясняется отсутствие (или минимальное количество) пиноцитозных везикул в клетках [63, 69]. В физиологических условиях вещества, безопасные для нейронов, транспортируются трансцеллюлярно пассивной и облегченной диффузией, а также активным транспортом.
Пассивной диффузией эндотелий преодолевают вещества, обладающие высокой липофильностью, молекулярной массой менее 400 г/моль и имеющие в своей структуре не более 8 водородных связей [70].
Облегченная диффузия также не требует энергетических затрат, но осуществляется при участии энергетически-независимых транспортных белков семейства SLC (the solute-linked carrier). Примером такого способа транспорта является перенос молекул глюкозы, лактата, аминокислот, пептидов малого размера, лекарственных средств и их конъюгатов, стероидов и т.д. [63, 70].
Активный транспорт осуществляется энергетически-зависимыми белками-транспортерами, в подавляющем большинстве суперсемейства АВС (the adenosine triphosphate (ATP) – binding cassette). Они состоят из двух трансмембранных доменов: один осуществляет гидролиз АТФ с высвобождением энергии, второй использует энергию и переносит субстрат через мембрану [71]. Белки суперсемейства АВС осуществляют вынос (эффлюкс) из центральной нервной системы метаболитов, токсинов, избытка нутриентов [63]. Наиболее изученным представителем данного семейства является P-гликопротеин, отвечающий за мультирезистентность центральной нервной системы к лекарственным средствам [72, 73], выводя их из эндотелиоцитов обратно в кровеносное русло. Ингибирование Р-гликопротеина и других белков, ассоциированных с неспецифической лекарственной устойчивостью, является одной из основных проблем фармакотерапии заболеваний центральной нервной системы [74].
Одним из эффлюксных механизмов является конвективно-опосредованное выделение, когда вещество минует прохождение через биологические мембраны. На сегодняшний день многие его аспекты остаются неизученными [63].
Основным видом транспорта, отвечающим за перенос макромолекул, является везикулярный или канальцевый транспорт. Он подразделяется на рецептор-опосредованный и абсорбцио-опосредованный трансцитоз. Рецептор-опосредованный трансцитоз осуществляется за счет связывания макромолекулы с рецепторами на внешней стороне мембраны. Абсорбцио-опосредованный трансцитоз реализуется за счет разности электрических зарядов мембраны клетки и макромолекулы. Таким образом происходит сближение между ними и удержание макромолекулы на поверхности мембраны [75].
Механизмы трансцитоза в церебральных эндотелиоцитах отличаются от таковых в эндотелиальных клетках других тканей [76, 77]. Перенос макромолекул реализуется субстрат-специфическими транспортными системами преимущественно путем рецептор-опосредованного трансцитоза [78].
Эндоцитарные пути в эндотелиальных клетках делятся на две категории: клатрин-опосредованный эндоцитоз и клатрин-независимый эндоцитоз [79]. В эндотелиоцитах головного мозга преобладает достаточно изученный на данный момент клатрин-опосредованный эндоцитоз. Однако механизмы, сопровождающие формирование везикул, до сих пор являются предметом активных исследований. Так, в работах последних лет уточняется роль в эндоцитозе белков Bin/Amphiphysin/Rvs (BAR) и гликокаликса [80]. Белок BАR обнаружен в трех изоформах: N-BAR, F-BAR и I-BAR [58]. N-BAR и F-BAR способствуют образованию инвагинаций плазмолемы, I-BAR участвует в образовании ее выпячиваний. Белок N-BAR существует в двух изоформах, -1 и -2, причем обе содержат домен SH3, который взаимодействует с динамином – белком, обеспечивающим отделение клатринового пузырька от плазмолеммы [81], а также домен CLAP, который обеспечивает связывание клатрина и адаптерного белка AP2 [82].
Наибольший интерес в последние годы вызывает внутриклеточный трафик в эндотелии головного мозга [83, 84]. Трехмерные реконструкции серийных электронно-микроскопических срезов показали, что внутриклеточные структуры, возникающие в ходе трансцитоза, редко были отдельными пузырьками, а являлись частью большой многомерной сети канальцев. Эти исследования предполагают, что транспортировка через канальцы приобретает первостепенную роль в перемещении молекул через ГЭБ [84].
Как утверждают недавние исследования [60], с возрастом экспрессия генов, кодирующих образование рецепторов, включая Tfrc, снижается. Уменьшается синтез белков, участвующих в реализации рецептор-опосредованного трансцитоза, включая клатрин, PICALM, Rin3 и Epsin1. И осуществляется переход от лиганд-специфичного к неспецифическому кавеолярному трансцитозу. Белок F-BAR PACSIN-2 (или синдапин-2) участвует в биогенезе кавеол и опосредованном кавеолами эндоцитозе [85–88]. Интересно, что экспрессия Cav1, который кодирует кавеолин-1, усиливается с возрастом вместе со снижением Mfsd2a, супрессора образования кавеол в церебральных эндотелиоцитах [60]. В реализации механизмов кавеолярного трансцитоза участвует также и гиалуроновая кислота, входящая в состав гликокаликса [24, 33].
Наличие GPI-домена в глипикане-1, с помощью которого он связывается со специфически устроенными участками на мембране эндотелия – липидными рафтами, позволяет предположить участие гликокаликса в процессах рафт-зависимого GPI-связанного эндоцитоза. Однако существование данного типа транспорта и его механизмы в церебральном эндотелии изучены недостаточно.
Особый интерес для исследователей вызывает транспорт воды в центральной нервной системе. Он считается активно регулируемым процессом и осуществляется интегральными мембранными водными белками – аквапоринами. Открытие экспрессии аквапоринов в мозге побудило к изучению возможной связи между данными белками и неврологическими состояниями, связанными с нарушениями движения воды, например, отеком мозга [89]. В церебральном эндотелии экспрессируются аквапорины-1 и -7. Они в основном локализуются на апикальной мембране эндотелиальных клеток сосудистого сплетения, что позволяет предположить их участие в секреции ликвора [90]. Aквапорин-1 играет важную роль в ангиогенезе, миграции и росте клеток. Предполагается, что он может быть вовлечен в опухолевый процесс, так как был обнаружен на эндотелии сосудов различных опухолей: глиобластомы, астроцитомы, метастазирующей карциномы, менингиомы, а также субэпендимальной астроцитомы и опухоли сосудистого сплетения [91].
ЗАКЛЮЧЕНИЕ
Эндотелиальные клетки, выстилающие церебральные капилляры, характеризуются неоднородным фенотипом, что определяется особенностями их локализации и функциональной нагрузкой: эндотелиоциты капилляров сосудистых сплетений играют исключительную роль в регуляции продукции ликвора, эндотелиальные клетки капилляров в структурах, где присутствует ГЭБ, обеспечивают избирательную проницаемость. Уникальные структурно-функциональные характеристики эндотелиальной выстилки капилляров, входящих в состав ГЭБ (отсутствие фенестр, наличие комплекса плотных межклеточных контактов, обилие митохондрий, низкий уровень пиноцитоза, высокое трансэндотелиальное сопротивление), достаточно глубоко исследованы и подробно описаны в современной литературе. Однако ряд вопросов так и остаются не в полной мере изученными. К ним относятся особенности морфологии и функционирования эндотелия в области нейрогенных ниш, роль элементов цитоскелета эндотелиоцитов в формировании и динамической перестройке фокальных и межклеточных контактов, особенности транс- и парацеллюлярного транспорта (в особенности адресной доставки лекарственных препаратов), механизмы поддержания целостности эндотелиального монослоя и многие другие.
Список литературы
Живень МК, Захарова ИС, Шевченко АИ, Покушалов ЕА, Закиян СМ (2015) Гетерогенность клеток эндотелия. Патол кровообращ и кардиохирург 19(4-2): 104–112. [Zhiven’ MK, Zaharova IS, Shevchenko AI, Pokushalov EA, Zakiyan SM (2015) Heterogeneity of endothelial cells. Pathol Blood Circul Card Surg 19(4–2): 104–112. (In Russ)]. https://doi.org/10.21688/1681-3472-2015-4-2-104-112
Atkins G, Jain M, Hamik A (2011) Endothelial differentiation: molecular mechanisms of specification and heterogeneity. Arteriosclerosis, Thrombosis, and Vasc Biol 31(7): 1476–1484. https://doi.org/10.1161/ATVBAHA.111.228999
Lippmann E, Azarin S, Kay J, Nessler R, Wilson H, AlAhmad, A Palecek S, Shusta E (2012) Derivation of blood brain barrier endothelial cells from human pluripotent stem cells. Nat Biotechnol 30(8): 783–791. https://doi.org/10.1038/nbt.2247
Timmermans F, Plum J, Yöder M, Ingram D, Vandekerckhove B, Case J (2009) Endothelial progenitor cells: identity defined? J Cell Mol Med 13(1): 87–102. https://doi.org/10.1111/j.1582-4934.2008.00598.x
Stankovich B, Aguayo E, Barragan F, Sharma A, Pallavicini M (2011) Differential adhesion molecule expression during murine embryonic stem cell commitment to the hematopoietic and endothelial lineages. PLoS One 6(9): e23810. https://doi.org/10.1371/journal.pone.0023810
Shapoval NS, Malinovskaya NA, Morgun AV, Salmina AB, Obolenskaya ON, Medvedeva NA, Medvedev OS (2021) The effect of ubiquinol on cerebral endothelial cells in different regions of rat brain. Cell and Tissue Biol 15: 260–266. https://doi.org/10.1134/S1990519X21030111
Uryu K, Laurer H, McIntosh T, Praticò D, Martinez D, Leight S, Lee VM, Trojanowski JQ (2002) Repetitive mild brain trauma accelerates Aβ deposition, lipid peroxidation, and cognitive impairment in a transgenic mouse model of Alzheimer amyloidosis. J Neurosci 22 (2): 446–454. https://doi.org/10.1523/JNEUROSCI.22-02-00446.2002
Ling Guo, Hongyan Zhang, Yinglong Hou, Tianshu Wei, Ju Liu (2016) Plasmalemma vesicle-associated protein: A crucial component of vascular homeostasis. Exp Therap Med 12:1639–1644. https://doi.org/10.3892/etm.2016.3557
Strickland LA, Jubb AM, Hongo JA, Zhong F, Burwick J, Fu L, Frantz GD, Koeppen H (2005) Plasmalemmal vesicle-associated protein (PLVAP) is expressed by tumour endothelium and is upregulated by vascular endothelial growth factor-A (VEGF). J Pathol 206(4): 466–475. https://doi.org/10.1002/path.1805
Shue EH, Carson-Walter EB, Liu Y, Winans BN, Ali ZS, Chen J, Walter KA (2008) Plasmalemmal vesicle associated protein-1 (PV-1) is a marker of blood-brain barrier disruption in rodent models. BMC Neurosci 9: 29. https://doi.org/10.1186/1471-2202-9-29
Salmina AB, Kuvacheva NV, Morgun AV, Komleva YK, Pozhilenkova EA, Lopatina OL, Gorina YV, Taranushenko TE, Petrova LL (2015) Glycolysis-mediated control of blood-brain barrier development and function. Int J Biochem Cell Biol 64: 174–184. https://doi.org/10.1016/j.biocel.2015.04.005
Rutkai I, Evans WR, Bess N, Salter-Cid T, Cikic S, Chandra PK, Katakam PVG, Mostany R, Busija DW (2020) Chronic imaging of mitochondria in the murine cerebral vasculature using in vivo two-photon microscopy. Am J Physiol Heart Circul Physiol 318(6): 1379–1386. https://doi.org/10.1152/ajpheart.00751.2019
Figley CR (2011) Lactate transport and metabolism in the human brain: implications for the astrocyte-neuron lactate shuttle hypothesis. J Neurosci 31(13): 4768–4770. https://doi.org/10.1523/JNEUROSCI.6612-10.2011
Pavlides S, Whitaker-Menezes D, Castello-Cros R, Flomenberg N, Witkiewicz AK, Frank PG, Casimiro MC, Wang C, Fortina P, Addya S, Pestell RG, Martinez-Outschoorn UE, Sotgia F (2009) The reverse Warburg effect: aerobic glycolysis in cancer associated fibroblasts and the tumor stroma. Cell Cycle 8(23): 3984–4001. https://doi.org/10.4161/cc.8.23.10238
Шахов АС, Дугина ВБ, Алиева ИБ (2019) Актиновый цитоскелет эндотелиоцитов – структурные особенности организации на страже барьерной функции (обзор). Биохимия 84(4): 494–508. [Shakhov AS, Dugina VB, Alieva IB (2019) Actin cytoskeleton of endotheliocytes – structural features of the organization guarding the barrier function (review). Biochemistry 84(4): 494–508. (In Russ)]. https://doi.org/10.1134/S0320972519040031
Zielinski A, Linnartz C, Pleschka C, Dreissen G, Springer R, Merkel R, Hoffmann B (2018) Reorientation dynamics and structural interdependenciesof actin, microtubules and intermediate filaments upon cyclic stretch application. Cytoskeleton. 75(9): 385–394. https://doi.org/10.1002/cm.21470
Zhang C, Chen H, He Q, Luo Y, He A, Tao A, Yan J (2021) Fibrinogen/akt/microfilament axis promotes colitis by enhancing vascular permeability. CMGH Cell Mol Gastroenterol Hepatol 11(3): 683–696. https://doi.org/10.1016/j.jcmgh.2020.10.007
Amann KJ, Pollard TD (2000) Cellular regulation of actin network assembly. Curr Biol 10(20): 728–730. https://doi.org/10.1016/S0960-9822(00)00751-X
Cerutti C, Ridley AJ (2017) Endothelial cell adhesion and signaling. Exper Cell Res 358(1): 31–38. https://doi.org/10.1016/j.yexcr.2017.06.003
Алиева ИБ (2014) Роль микротрубочек цитоскелета в регуляции барьерной функции эндотелия. Биохимия 79(9): 964–975. [Alieva IB (2014) The role of cytoskeletal microtubules in the regulation of endothelial barrier function. Biochemistry 79(9): 964–975. (In Russ)]. https://doi.org/10.1134/S0006297914090119
Власов ТД, Лазовская ОА, Шиманьски ДА, Нестерович ИИ, Шапорова НЛ (2020) Эндотелиальный гликокаликс: методы исследования и перспективы их применения при оценке дисфункции эндотелия. Регионарн кровообращ и микроциркул 19 (1): 5–16. [Vlasov TD, Lazovskaya OA, SHiman’ski DA, Nesterovich II, SHaporova NL (2020) Endothelial glycocalyx: research methods and prospects for their application in assessing endothelial dysfunction. Region Вlood Сircul and Microcircul 19 (1): 5–16. (In Russ)]. https://doi.org/10.24884/1682-6655-2020-19-1
Черток ВМ, Черток АГ (2016) Регуляторный потенциал капилляров мозга. Тихоокеанск мед журн 2: 72–80. [Chertok VM, Chertok AG (2016) Regulatory potential of brain capillaries. Pacific Med J 2: 72–80. (In Russ)].
Song HW, Foreman KL, Gastfriend BD, Kuo JS, Palecek SP, Shusta EV (2020) Transcriptomic comparison of human and mouse brain microvessels. Sci Rep 10: 12358. https://doi.org/10.1038/s41598-020-69096-7
Zeng Y (2016) Endothelial glycocalyx as a critical signalling platform integrating the extracellular hemodynamic forces and chemical signalling. J Cell Mol Med 221(8): 1457–1462. https://doi.org/10.1111/jcmm.13081
Максименко АВ, Турашев АД (2014) Эндотелиальный гликокаликс системы кровообращения. I. Обнаружение, компоненты, структурная организация. Биоорган химия 40 (2): 119–128. [Maksimenko AV, Turashev AD (2014) Endothelial glycocalyx of blood circulation. I. Finding, components, structure organization (Review). Bioorgan Chem 40(2): 119–128. (In Russ)]. https://doi.org/10.1134/s1068162014020113
Ostrowski SR, Gaïni S, Pedersen C, Johansson PI (2015) Sympathoadrenal activation and endothelial damage in patients with varying degrees of acute infectious disease: An observational study. J Crit Care Elsevier Inc 30(1): 90–96. https://doi.org/10.1016/j.jcrc.2014.10.006
Zeng Y, Liu J (2016) Role of glypican-1 in endothelial NOS activation under various steady shear stress magnitudes. Exp Cell Res Elsevier 348(2): 184–189.https://doi.org/10.1016/j.yexcr.2016.09.017
Mahmoud M, Mayer M, Cancel LM, Bartosch, AM, Mathews R, Tarbell JM (2021) The Glycocalyx core protein Glypican 1 protects vessel wall endothelial cells from stiffness-mediated dysfunction and disease. Cardiovasc Res 117(6): 1592–1605. https://doi.org/10.1093/cvr/cvaa201
Yen W, Cai B, Yang J, Zhang L, Zeng M, Tarbell JM, Fu BM (2015) Endothelial surface glycocalyx can regulate flow-induced nitric oxide production in microvessels in vivo. PLoS One 10(1): 1–20. https://doi.org/10.1371/journal.pone.0117133
Zeng Y (2017) Endothelial glycocalyx as a critical signalling platform integrating the extracellular hemodynamic forces and chemical signalling. J Cell Mol Med 21(8): 1457–1462.https://doi.org/10.1111/jcmm.13081
Gao L, Lipowsky HH (2010) Composition of the endothelial glycocalyx and its relation to its Thickness and diffusion of small solutes. Microvasc Res 80(3): 394–401.https://doi.org/10.1016/j.mvr.2010.06.005
Feng S, Cen J, Huang Y, Shen H, Yao L, Wang Y, Chen Z (2011) Matrix metalloproteinase-2 and –9 secreted by leukemic cells increase the permeability of blood- brain barrier by disrupting tight junction proteins. PLoS One 6 (8): e20599.https://doi.org/10.1371/journal.pone.0020599
Cao R-N, Li T, Zhong-Yuan X, Rui X (2019) Endothelial glycocalyx as a potential therapeutic target in organ injuries. Chin Med J (Engl) Ovid Technologies (Wolters Kluwer Health) 132(8): 963–975. https://doi.org/10.1097/CM9.0000000000000177
Lennon FE, Singleton PA (2011) Hyaluronan regulation of vascular integrity. Am J Cardiovasc Dis 1(3): 200–213.
Lipowsky HH (2012) The Endothelial Glycocalyx as a Barrier to Leukocyte Adhesion and its Mediation by Extracellular Proteases. Annu Rev Biomed Eng 40(4): 840–848. https://doi.org/10.1007/s10439-011-0427-x
Wolburg H, Lippoldt A (2002) Tight junctions of the blood- brain barrier: development, composition and regulation. Vasc Pharmacol 38: 323–337. https://doi.org/10.1016/s1537-1891(02)00200-8
Nagafuchi A (2001) Molecular architecture of adherens junctions. Curr Opin Cell Biol 13(5): 600–603. https://doi.org/10.1016/S0955-0674(00)00257-X
Bazzoni G, Martinez-Estrada OM, Mueller F, Nelboeck P, Schmid G, Bartfai T, Dejana E, Brockhaus M (2000) Homophilic interaction of junctional adhesion molecule. J Biol Chem 275(40): 30970–30976. https://doi.org/10.1074/jbc.M003946200
Hatzfeld M (2005) The p120 family of cell adhesion molecules. Eur J Cell Biol 84(2,3): 205–214. https://doi.org/10.1016/J.EJCB.2004.12.016
Wimmer I, Tietz S, Nishihara H, Deutsch U, Sallusto F, Gosselet F, Lyck R, Muller WA, Lassman H, Engelhardt B (2019) PECAM-1 stabilizes blood-brain barrier integrity and favors paracellular t-cell diapedesis across the blood-brain barrier during neuroinflammation. Front Immunol 10. https://doi.org/10.3389/fimmu.2019.00711
Andjelkovic AV, Stamatovic SM, Martinez-Revollar G, Keep RF, Phillips CM (2020) Modeling blood-brain barrier pathology in cerebrovascular disease in vitro: current and future paradigms. Fluids and Barriers of the CNS 17(1): 44. https://doi.org/10.1186/s12987-020-00202-7
Nusrat A, Brown GT, Tom J, Drake A, Bui TT, Quan C, Mrsny RJ (2005) Multiple protein interactions involving proposed extracellular loop domains of the tight junction protein occludin. Mol Biol Cell 16(4): 1725–1734. https://doi.org/10.1091/MBC.E04-06-0465
Van Itallie CM, Anderson JM (2004) The role of claudins in determining paracellular charge selectivity. Proc Am Thorac Soc 1(1): 38–41. https://doi.org/10.1513/pats.2306013
Soma T, Chiba H, Kato-Mori Y, Wada T, Yamashita T, Kojima T, Sawada N (2004) Thr(207) of claudin-5 is involved in size-selective loosening of the endothelial barrier by cyclic AMP. Exp Cell Res 300(1): 202–212. https://doi.org/10.1016/J.YEXCR.2004.07.012
Matter K, Balda MS (2003) Holey barrier: claudins and the regulation of brain endothelial permeability. J Cell Biol 161(3): 459–460. https://doi.org/10.1083/jcb.200304039
Belanger M, Asashima T, Ohtsuki S, Yamaguchi H, Ito S, Terasaki T (2007) Hyperammonemia induces transport of taurine and creatine and suppresses claudin-12 gene expression in brain capillary endothelial cells in vitro. Neurochem Int 50(1): 95–101. https://doi.org/10.1016/j.neuint.2006.07.005
Ohtsuki S, Sato S, Yamaguchi H, Kamoi M, Asashima T, Terasaki T (2007) Exogenous expression of claudin-5 induces barrier properties in cultured rat brain capillary endothelial cells. J Cell Physiol 210(1): 81–86. https://doi.org/10.1007/s00441-005-1101-0
Bernacki J, Dobrowolska A, Nierwińska K, Małecki A (2008) Physiology and pharmacological role of the blood-brain barrier. Pharmacol Rep 60(5): 600–622. PMID: 19066407
Cordenonsi M, D’Atri F, Hammar E, Parry DA, Kendrick- Jones J, Shore D, Citi S (1999) Cingulin contains globular and coiled-coil domains and interacts with ZO-1, ZO-2, ZO-3, and myosin. J Cell Biol 147(7): 1569–1582. https://doi.org/10.1083/jcb.147.7.1569
Tiwari SB, Amiji MM (2006) A review of nanocarrier-based CNS delivery systems. Curr Drug Deliv 3(2): 219–232. https://doi.org/10.2174/156720106776359230
Meyer TN, Hunt J, Schwesinger C, Denker BM (2003) Galpha12 regulates epithelial cell junctions through Src tyrosine kinases. Am J Physiol Cell Physiol 285(5): C1281–C1293. https://doi.org/10.1152/ajpcell.00548.2002
Van Hinsbergh VW, van Nieuw Amerongen GP (2002) Intracellular signalling involved in modulating human endothelial barrier function. J Anat 200(6): 549–560. https://doi.org/10.1046/j.1469-7580.2002.00047_7.x
Yang L, Froio RM, Sciuto TE, Dvorak AM, Alon R, Luscinskas FW (2005) ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow. Blood 106(2): 584–592. https://doi.org/10.1182/blood-2004-12-4942
Гончаров НВ, Попова ПИ, Головкин АС, Залуцкая НМ, Пальчикова ЕИ, Занин КВ, Авдонин ПВ (2020) Дисфункция эндотелия сосудов-патогенетический фактор в развитии нейродегенеративных заболеваний и когнитивных расстройств. Обозрение психиатр и мед психол им ВМ Бехтерева 3: 11–26. [Goncharov NV, Popova PI, Golovkin AS, Zaluckaya NM, Pal’chikova EI, Zanin KV, Avdonin PV (2020) Vascular endothelial dysfunction is a pathogenetic factor in the development of neurodegenerative diseases and cognitive disorders. Rev Psych Med Psychol named after VM Bekhterev 3: 11–26. (In Russ)]. https://doi.org/10.31363/2313-7053-2020-3-11-26
Надеев АД, Кудрявцев ИВ, Серебрякова МК, Авдонин ПВ, Зинченко ВП, Гончаров НВ (2015) Индукция апоптоза и некроза клеток эндотелия пупочной вены человека пероксидом водорода. Цитология 57(12): 909–916. [Nadeev AD, Kudryavtsev IV, Serebriakova MK, Avdonin PV, Zinchenko VP, Goncharov NV (2015) Dual Proapoptotic and pronecrotic effect of hydrogen peroxide on human umbilical vein endothelial cells. Citologia 57(12): 909–916. (In Russ)].
Li Q, Syrovets T, Simmet T, Ding J, Xu J, Chen W, Zhu D, Gao P (2013) Plasmin induces intercellular adhesion molecule 1 expression in human endothelial cells via nuclear factor-κB/mitogen-activated protein kinases-dependent pathways. Exp Biol Med 238(2): 176–186. https://doi.org/10.1177/1535370212473700
Hodo TW, de Aquino MTP, Shimamoto A, Shanker A (2020) Critical neurotransmitters in the neuroimmune network. Front Immunol 11(JUN): 1869. https://doi.org/10.3389/fimmu.2020.01869
Kuvacheva NV, Morgun AV, Malinovskaya NA, Gorina YV, Khilazheva ED, Pozhilenkova EA, Panina YA, Boytsova EB, Ruzaeva VA, Trufanova LV, Salmina AB (2016) Tight Junction Proteins of Cerebral Endothelial Cells in Early Postnatal Development. Cell Tissue Biol 10: 372–377. https://doi.org/10.1134/S1990519X16050084
Erickson MA, Wilson ML, Banks WA (2020) In vitro modeling of blood-brain barrier and interface functions in neuroimmune communication. Fluids Barr CNS 17: 26. https://doi.org/10.1186/s12987-020-00187-3
Yang AC, Stevens MY, Chen MB, Lee DP, Stähli D, Gate D, Contrepois K, Chen W, Iram T, Zhang L, Vest RT, Chaney A, Lehallier B, Olsson N, Bois H, Hsieh R, Cropper HC, Berdnik D, Li L, Wang EY, Traber GM, Bertozzi CR, Luo J, Snyder MP, Elias JE, Quake SR, James ML, Wyss-Coray T (2020) Physiological blood–brain transport is impaired with age by a shift in transcytosis. Nature 583(7816): 425–430. https://doi.org/10.1038/s41586-020-2453-z
Kaplan L, Chow BW, Gu C (2020) Neuronal regulation of the blood-brain barrier and neurovascular coupling. Nat Rev Neurosci 21: 416–432. https://doi.org/10.1038/s41583-020-0322-2
Luis A-M, Muge Y, Turgay D (2021) Pericyte morphology and function. Hystol Histopathol 36(6): 18314. https://doi.org/10.14670/HH-18-314
Блинов ДВ (2014) Современные представления о роли нарушения резистентности гематоэнцефалического барьера в патогенезе заболеваний ЦНС. Часть 2: функции и механизмы гематоэнцефалического барьера. Эпилепсия и пароксизмальн состояния 6(1): 70–84. [Blinov DV (2014) Modern ideas about the role of violation of the resistance of the blood-brain barrier in the pathogenesis of CNS diseases. Part 2: Functions and mechanisms of the blood-brain barrier. Epilepsy and Paroxysmal States 6(1): 70–84. (In Russ)].
Komleva Y, Kuvacheva NV, Malinovskaya NA, Gorina YV, Lopatina OL, Teplyashina EA, Pozhilenkova EA, Zamay AS, Morgun AJ, Salmina AB (2016). Regenerative potential of the brain: Composition and forming of regulatory microenvironment in neurogenic niches. Human Physiol 42: 865–873. https://doi.org/10.1134/s0362119716080077
Mesnil M, Defamie N, Naus C, Sarrouilhe D (2021) Brain disorders and chemical pollutants: a gap junction link? Biomolecules 11(1): 51. https://doi.org/10.3390/biom11010051
Salmina AB, Kapkaeva MR, Vetchinova AS, Illarioshkin SN (2021) Novel approaches used to examine and control neurogenesis in Parkinson’s decease. Int J Mol Sci 22(17). https://doi.org/10.3390/ijms22179608
Pozhilenkova EA, Lopatina OL, Komleva YK, Salmin VV, Salmina AB (2017) Blood-brain barrier-supported neurogenesis in healthy and diseased brain. Rev Neurosci 28(4): 397–415. https://doi.org/10.1515/revneuro-2016-0071
Erdő F, Denes L, de Lange E (2017) Age-associated physiological and pathological changes at the blood-brain barrier: A review. J Cerebral Blood Flow & Metabolism 37(1): 4–24. https://doi.org/10.1177/0271678X16679420
Горбачев ВИ, Маньков АВ, Христенко ИВ, Капустина АВ (2006) О некоторых механизмах гомеостаза центральной нервной системы. Acta Biomed Scient 5(51): 52–54. [Gorbachev VI, Man’kov AV, Hristenko IV, Kapustina AV (2006) About some mechanisms of homeostasis of the central nervous system. Acta Biomed Scient 5(51): 52–54. (In Russ)].
Morris ME, Rodriguez-Cruz V, Felmlee MA (2017) SLC and ABC Transporters: Expression, Localization, and Species Differences at the Blood-Brain and the Blood-Cerebrospinal Fluid Barriers. The AAPS J 19(5): 1317–1331. https://doi.org/10.1208/s12248-017-0110-8
Girardin F (2006) Membrane transporter proteins: a challenge for CNS drug development. Dialogues Clin Neurosci 8(3): 311–321. https://doi.org/10.31887/dcns.2006.8.3/fgirardin
Моргун АВ (2012) Основные функции гематоэнцефалического барьера. Сибирск мед журн 109(2): 5–7. [Morgun AV (2012) The main functions of the blood-brain barrier. Siber Med J 109(2): 5–7. (In Russ)].
Freeman MR (2010) Specification and Morphogenesis of Astrocytes. Science 330(6005): 774–778. https://doi.org/10.1126/science.1190928
Мизиряк ЕВ, Кривошапкин АЛ, Педдер ВВ, Бгатова НП, Котлярова АА (2019) Морфофункциональные особенности гематоэнцефалического барьера и возможные пути его обхода с помощью физических и физико-химических факторов (обзор). Южно-Сибирск научн вестн 4(28) 2: 45–51. [Miziryak EV, Krivoshapkin AL, Pedder VV, Bgatova NP, Kotlyarova AA (2019) Morphofunctional features of the hemato-encephalic barrier and possible ways to bypass it with the help of physical and physico-chemical factors (review). South Siber Scient Bull 4(28) 2: 45–51. (In Russ)].
Аляутдин РН (2012) Транспорт лекарственных веществ через гематоэнцефалический барьер: линия мажино или волшебный сезам? Мол мед 3: 3–12 [Alyautdin RN (2012) Drugs targeting through the blood-brain barrier: Maginot line or magic sesame? Mol Med 3: 3–12. (In Russ)].
Ben-Zvi A, Lacoste B, Kur E, Andreone BJ, Mayshar Y, Yan H, Gu C (2014) Mfsd2a is critical for the formation and function of the blood-brain barrier. Nature 509(7501): 507–511. https://doi.org/10.1038/nature13324
Andreone BJ, Chow BW, Tata A, Lacoste B, Ben-Zvi A, Bullock K, Deik AA, Ginty DD, Clish CB, Gu C (2017) Blood-brain barrier permeability is regulated by lipid transport-dependent suppression of caveolae-mediated transcytosis. Neuron 94(3): 581–594. https://doi.org/10.1016/j.neuron.2017.03.043
Zhao Z, Nelson AR, Betsholtz C, Zlokovic BV (2015) Establishment and dysfunction of the blood-brain barrier. Cell 163(5): 1064–1078. https://doi.org/10.1016/j.cell.2015.10.067
Doherty GJ, McMahon HT (2009) Mechanisms of endocytosis. Annu Rev Biochem 78: 857–902. https://doi.org/10.1146/annurev.biochem.78.081307.110540
Leite DM, Matias D, Battaglia G (2020) The Role of BAR Proteins and the Glycocalyx in Brain Endothelium Transcytosis. Cells 9 (12): E2685. https://doi.org/10.3390/cells9122685
Takei K, Slepnev VI, Haucke V, De Camilli P (1999) Functional partnership between amphiphysin and dynamin in clathrin-mediated endocytosis. Nat Cell Biol 1: 33–39. https://doi.org/10.1038/9004
Slepnev VI, Ochoa G, Butler MH, De Camilli P (2000) Tandem Arrangement of the Clathrin and AP-2 Binding Domains in Amphiphysin 1 and Disruption of Clathrin Coat Function by Amphiphysin Fragments Comprising These Sites. J Biol Chem 275(23): 17583–17589. https://doi.org/10.1074/jbc.M910430199
Villasenor R, Schilling M, Sundaresan J, Lutz Y, Collin L (2017) Sorting Tubules Regulate Blood-Brain Barrier Transcytosis. Cell Rep 21(11): 3256–3270. https://doi.org/10.1016/j.celrep.2017.11.055
Tian X, Leite DM, Scarpa E, Nyberg S, Fullstone G, Forth J, Matias D, Apriceno A, Poma A, Duro-Castano A, Vuyyuru M, Harker-Kirschneck L, Šarić A, Zhang Z, Xiang P, Fang B, Tian Y, Luo L, Rizzello L, Battaglia G (2020) On the shuttling across the blood-brain barrier via tubule formation: Mechanism and cargo avidity bias. Sci Adv 6: eabc4397. https://doi.org/10.1101/2020.04.04.025866
Senju Y, Itoh Y, Takano K, Hamada S, Suetsugu S (2011) Essential role of PACSIN2/syndapin-II in caveolae membrane sculpting. J Cell Sci 124(12): 2032–2040. https://doi.org/10.1242/jcs.086264
Hansen CG, Howard G, Nichols BJ (2011) Pacsin 2 is recruited to caveolae and functions in caveolar biogenesis. J Cell Sci 124 (16): 2777–2785. https://doi.org/10.1242/jcs.084319
Chandrasekaran R, Kenworthy AK, Lacy DB (2016) Clostridium difficile Toxin A Undergoes Clathrin-Independent, PACSIN2-Dependent Endocytosis. PLoS Pathog 12. https://doi.org/10.1371/journal.ppat.1006070
De Kreuk B, Anthony EC, Geerts D, Hordijk PL (2012) The F-BAR Protein PACSIN2 Regulates Epidermal Growth Factor Receptor Internalization. J Biol Chem 287(52): 43438–43453. https://doi.org/10.1074/jbc.M112.391078
Verkman AS (2011) Aquaporins at a glance. J Cell Sci 124(13): 2107–2112. https://doi.org/10.1242/jcs.079467
Щепарева МЕ, Захарова МН (2020) Роль аквапоринов в функционировании нервной системы в норме и при патологии. Нейрохимия 37(1): 5–14 [Shchepareva ME, Zaharova MN (2020) The role of aquaporins in the functioning of the nervous system in normal and pathological conditions. Neurochemistry 37(1): 5–14. (In Russ)].
Saadoun S, Papadopoulos MC, Davies DC, Bell BA, Krishna S (2002) Increased aquaporin I water channel expression in human brain tumors. Brain J Cancer 87(6): 621–623. https://doi.org/10.1038/sj.bjc.6600512
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


