Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 579-593
Влияние гиперкапнии и гипоксии на физиологию и метаболизм церебрального эндотелия в условиях ишемии
1 Научный центр неврологии
Москва, Россия
2 Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского
Москва, Россия
* E-mail: pfiza_asmu@mail.ru
Поступила в редакцию 20.02.2022
После доработки 06.04.2022
Принята к публикации 07.04.2022
- EDN: TDITXD
- DOI: 10.31857/S0869813922050120
Аннотация
В настоящем обзоре приведены данные относительно роли дисфункции гемато-энцефалического барьера (ГЭБ) при неврологической патологии, описание эпигенетических и метаболических регуляторов его функциональной активности и структурной целостности. Также обзор содержит информацию об экспериментальных результатах исследований нейропротекторных эффектов гипоксии и гиперкапнии с оценкой их влияния на функционирование ГЭБ. Кроме того, в обзоре приводятся аргументы в пользу комбинированного использования препаратов, модулирующих метаболизм и проницаемость ГЭБ, в сочетании с гиперкапнической гипоксией для достижения большей нейропротекторной эффективности. Приведенные данные демонстрируют, что существует значительное количество препаратов, обладающих высоким потенциалом для повышения нейропротекторной эффективности при сочетании с гиперкапнической гипоксией. К таким группам препаратов относятся антиоксиданты, эндотелио- и мембранопротекторы, ингибиторы c-Jun N-терминальных киназ (JNK) и энерготропные препараты.
Пермиссивная гиперкапния и ее сочетание с перемежающейся гипоксией формируют эффект увеличения толерантности головного мозга к ишемии [1]. Однако механизмы и сигнальные пути нейропротекторной эффективности гиперкапнии и ее сочетания с дефицитом кислорода на сегодняшний день исследованы мало.
Между тем, одним из таких механизмов может выступать сохранение функциональной активности гематоэнцефалического барьера (ГЭБ), т.к. поддержание целостности ГЭБ является значимым нейропротекторным звеном в структуре формирования ишемической толерантности головного мозга [2]. При этом нарушение целостности ГЭБ является ранним признаком ишемического повреждения мозга и выступает прогностическим фактором неблагоприятного исхода [3].
Функциональная активность ГЭБ, главным образом, зависит от поддержания его стабильного метаболизма, целостности и избирательной проницаемости [4]. Эти элементы, в свою очередь, регулируются целым рядом гуморальных, нейротрофических и эпигенетических сигнальных механизмов [5].
В настоящем обзоре приведены данные относительно роли дисфункции ГЭБ при неврологической патологии, описание эпигенетических и метаболических регуляторов его функциональной активности и структурной целостности. Также обзор содержит информацию об экспериментальных результатах исследований нейропротекторных эффектов гипоксии и гиперкапнии с оценкой их влияния на функционирование ГЭБ. Кроме того, в обзоре приводятся аргументы в пользу комбинированного использования препаратов, модулирующих метаболизм и проницаемость ГЭБ, в сочетании с гиперкапнической гипоксией для достижения большей нейропротекторной эффективности.
РОЛЬ ДИСФУНКЦИИ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА В РАЗВИТИИ НЕВРОЛОГИЧЕСКОЙ ПАТОЛОГИИ
ГЭБ – сложная и неоднородная система головного мозга с многоуровневым избирательным транспортом, необходимая для поддержки регуляции и защиты центральной нервной системы (ЦНС). Структурную основу ГЭБ составляют эндотелиальные клетки, астроциты и перициты. Эндотелиальные клетки церебральных сосудов связаны между собой плотными контактами. Это имеет важное значение для реализации главной функции ГЭБ – поддержания гомеостаза мозга и защиты нервной ткани от циркулирующих в крови токсинов, микроорганизмов, гуморальных и клеточных факторов иммунной системы, воспринимающих ткань мозга как чужеродную [6, 7].
Исследователи подчеркивают роль дисфункции ГЭБ при развитии различных неврологических заболеваний. Например, при посттравматическом исследовании резецированной церебральной ткани и мозга у пациентов с фармакочувствительной и резистентной эпилепсией [8] выявлено, что имеется четко локализованная избыточная экспрессия Р-гликопротеина в эпилептогенном гиппокампе у больных с лекарственно устойчивой эпилепсией. Авторы считают, что на фоне хронического течения эпилепсии развивается воспаление в церебральной сосудистой сети, повышается проницаемость ГЭБ и экспрессия Р-гликопротеина.
В современных исследованиях показано, что эпилептические приступы могут индуцировать повышенную проницаемость ГЭБ для цитокинов, оказывающих влияние на патогенез и ход эпилепсии [9]. У интерлейкина-1β, интерлейкина-6 и фактора некроза опухоли α (TNFα) были зарегистрированы проконвульсивные и противосудорожные эффекты, зависимые от концентрации свободных и доступных рецепторов. Судороги не только индуцировали экспрессию цитокинов в головном мозге, но и увеличивали их периферический уровень на фоне генерализованных тоникоклонических или продолжительных парциальных приступов, возвращаясь к исходному уровню после разных интервалов времени.
Установлена многоуровневая система химической регуляции гомеостаза в ткани головного мозга, повышающая защиту нейронов от стресса и повреждения, а также роль многочисленных ростовых и нейротрофических факторов в репаративных процессах, во многом определяющих исходы и прогноз гипоксического поражения мозга [10, 11].
Отмечается, что повышение проницаемости ГЭБ в условиях хронической гипоксии/ишемии мозга в пери- и неонатальном периоде может выступать одним из факторов прогрессирования нейродегенеративных процессов, возникающих из-за поступления в периферический кровоток забарьерных антигенов с последующим иммунным ответом и дисфункцией протеолитических и нейромедиаторных систем [12, 13].
Нарушение целостности и проницаемости ГЭБ является важным элементом в патогенезе гипоксического/ишемического и инфекционного поражения головного мозга [14]. Однако особенности функционирования ГЭБ при нарушениях развития головного мозга и нейродегенеративных заболеваниях изучены существенно меньше. При этом исследование молекулярных механизмов этих особенностей выступает не только важным шагом в понимании патогенеза заболеваний, но и перспективным направлением для повышения эффективности фармакотерапии. Так, недавно появились убедительные экспериментальные свидетельства о нарушении структуры тесных контактов и дизрегуляции белков-транспортеров ГЭБ при таких нарушениях развития головного мозга, как аутизм, шизофрения, эпилепсия, а также нейродегенеративных состояниях (болезни Альцгеймера и Паркинсона) [15].
ЭПИГЕНЕТИЧЕСКОЕ РЕГУЛИРОВАНИЕ ФУНКЦИИ ЦЕРЕБРАЛЬНОГО ЭНДОТЕЛИЯ В ПАТОГЕНЕЗЕ ГИПОКСИЧЕСКИ-ИШЕМИЧЕСКОГО ПОВРЕЖДЕНИЯ ГОЛОВНОГО МОЗГА
Эпигенетические факторы, обуславливающие метилирование ДНК и ремоделирование гистонов, важны для нормального развития мозга в онтогенезе [16]. Они подвержены регулирующему влиянию гипоксического стимула, который может вызвать как повреждающий эффект, так и эффект прекондиционирования [17]. Если стимул является избыточным и/или длительным, то это вызывает наступление гипоксически-ишемическое поражение мозга и определяет будущие неврологические расстройства.
Показано, что блокирование гистондеацетилазы в культуре микроглии оказывает защитное действие на олигодендроциты после экспериментальной гипоксии-ишемии [18]. При этом фракция М1 подавляет активность олигодендроцитов, а М2 ее усиливает и позволяет снижать экспрессию провоспалительных факторов и снижать экспрессию противовоспалительных цитокинов. Метилирование и деметилирование происходит при участии большого количества ферментов, в т.ч. гистонацетилтрансфераз, деацетилатов, гистоновых метилтрансфераз и деметилаз [19, 20]. Эти процессы способствуют модулированию транскрипции в ответ на эндогенные и экзогенные факторы, такие как гипоксия и воспаление [21]. В моделях in vivo показано, что при экспериментальной гипоксии/ишемии в неонатальном периоде возрастает экспрессия каспазы-3, снижается экспрессия синапсина и ингибируется метилирование гистонов H3K4me2/-me3 и H3K27me2/-me3, что вызывает индукцию нейронального апоптоза в гиппокампе [23].
В настоящее время наиболее существенными факторами эпигенетического влияния являются микроРНК – небольшие некодирующие РНК, обеспечивающие посттранскрипционную модуляцию экспрессии генов [24]. Эти молекулы играют важную роль в онтогенетическом развитии мозга и патогенезе неврологических заболеваний, в том числе ишемического инсульта [25]. При этом ГЭБ рассматривается в качестве мишени для патогенетических факторов [26]. При гипоксии-ишемии нарушение структуры и организации этих белков в наружной мембране эндотелиальных клеток обуславливает нарушение проницаемости церебрального эндотелия [27]. Повышенная адгезия иммунных клеток к поврежденному эндотелию, в том числе, обуславливает их инфильтрацию в окружающую ткань [28].
Доказано, что деградация ГЭБ повышает риск раннего инсульта, а ее блокирование обеспечивает защиту паренхимы головного мозга [29]. Деградация белков плотных контактов, или белков клеточной адгезии, под действием металлопротеиназы (MMP) напрямую регулируется микроРНК. MiR-539 напрямую ингибирует экспрессию MMP-9 и защищает эндотелиальные клетки от экспериментальной ишемии, предотвращая повышение проницаемости ГЭБ [30]. MiR-143 активируется после ишемического инсульта, что было показано в исследованиях на человеке и животных [31, 32].
Некоторые микроРНК могут защищать целостность ГЭБ за счет снижения адгезии иммунных клеток и экспрессии провоспалительных цитокинов. Например, miR-210 активирует экспрессию ФНО-α, ИЛ-1β, ИЛ-6 и хемокиновые лиганды CCL1 и CCL2, связанные с провоспалительным ответом в модели ишемического инсульта у мышей [33], а сверхэкспрессия miR-126-3p и -5p в ишемизированном мозге мышей подавляет провоспалительные цитокины и молекулы адгезии, сохраняя целостность церебрального эндотелия, и снижает негативные последствия после перенесенного инсульта [34, 35]. Напротив, miR-34a активируется в эндотелиальных клетках после эпизода острой гипоксии-ишемии, что отрицательно влияет на функцию митохондрий в эндотелиоцитах, воздействуя на цитохром С. При этом нокаутирование miR-34a снижает проницаемость ГЭБ, выраженность нарушений плотных межклеточных контактов и улучшает исходы инсульта [36, 37].
MiR-26b ингибирует аутофагию и выживание эндотелиоцитов при экспериментальной гипоксии/ишемии in vitro, а длинная некодирующая РНК Malat1, связывая miR-26b, оказывает обратное действие [38]. МикроРНК miR-15a активируется в церебральном эндотелии мышей после острого кислородно-глюкозного голодания, вызывает гибель клеток и ингибируется через активацию δ-рецептора под воздействием пролифератора пероксисом PPAR, который выступает потенциальным нейропротектором при ишемическом инсульте [39]. Главное значение в сохранении проницаемости ГЭБ принадлежит эндотелию и, в меньшей степени, перицитам. Показано, что при гипоксически-ишемическом поражении перициты отделяются и мигрируют от базальной мембраны, способствуя повышению проницаемости. Данный процесс индуцируется под действием miR-149-5p [40].
MiR-210 признана одним из важнейших регуляторов неонатальной гипоксии-ишемии [41]. Эта микроРНК активирована при неонатальной гипотрофии, а острая гипоксия-ишемия приводит к усилению сверхэкспрессии miR-210, что увеличивает проницаемость ГЭБ за счет ингибирования экспрессии окклюдина и β-катенина [42]. Сообщалось, что miR-210 проявляет широкий спектр биологической активности, включающей митохондриальный обмен и дифференцировку клеток [43]. В норме сверхэкспрессия miR-210 способствует ангиогенезу и нейрогенезу [44]. Она обуславливает защитный эффект при ишемическом инсульте и способствует накоплению нервных клеток-предшественников вокруг периинфарктной области [45, 46]. Другие микроРНК (miR-21, miR-374a, miR-424, miR-199a и miR-20b) также могут играть роль в патогенезе гипоксически-ишемического поражения головного мозга [47–50].
ЦЕЛОСТНОСТЬ ГЭБ КАК ФАКТОР ИШЕМИЧЕСКОЙ ТОЛЕРАНТНОСТИ ГОЛОВНОГО МОЗГА
ГЭБ анатомически определяется тесными соединениями между соседними эндотелиальными клетками, выстилающими просвет микрососудов мозга, но в структуру ГЭБ также входят астроциты, перициты, нейроны и внеклеточный матрикс [51]. Последний представляет собой базальную мембрану, лежащую в основе сосудистой сети, и ее нарушения тесно связаны с повышенной проницаемостью ГЭБ в патологическом состоянии. При этом нарушение целостности ГЭБ с последующим вазогенным отеком является ранним признаком ишемического повреждения мозга и выступает ранним прогностическим фактором неблагоприятного исхода [52].
Несколько исследований показали, что ишемическая толерантность способствует сохранности ГЭБ и сокращает образование отека во время контрольной ишемии. Прекондиционирование, вызванное 15-минутной окклюзией средней мозговой артерии и проведенное за три дня до тестовой ишемии у крыс, сокращало и нарушение целостности ГЭБ и отек в периинфарктной зоне, но не в ядре ишемии, что было измерено после 24-часовой окклюзии [53]. Позднее это было подтверждено Zhang и соавт. [54] во время эксперимента, когда молодых крыс подвергали 2-часовой гипоксии/ишемии, транссудация IgG как признак нарушения целостности ГЭБ была связана с ранним повреждением нейронов, и оба этих неблагоприятных эффекта значительно ослаблялись после гипертермического прекондиционирования [55]. И опять же, сложно определить, приводила ли сохранность целостности ГЭБ к уменьшению ишемического повреждения или являлась его последствием. С механистической точки зрения совершенно ясно, что уменьшение воспалительной реактивности головного мозга, вероятно, способствует сохранению целостности ГЭБ [5, 9, 33]. Тем не менее, сохранение целостности ГЭБ может быть главной чертой ишемической толерантности, принимая во внимание взаимодействие между поврежденной/уязвимой тканью и циркуляцией воспалительных клеток во время рециркуляции.
Известно, что матриксные металлопротеиназы (ММП), в особенности ММП-9, разрушают нейроваскулярный матрикс в результате реперфузии, приводя, таким образом, к разрушению ГЭБ [56, 57]. Было показано, что нарушение целостности ГЭБ, наряду с экспрессией ММП-9, уменьшалось после экспериментальной ишемии у крыс, при этом ишемии предшествовало ишемическое прекондиционирование [58]; полученные данные связываются авторами с влиянием белка теплового шока с молекулярной массой 70 килодальтон (HSP70), сверхэкспрессия которого подавляет ММП-9.
Адгезионные молекулы, выделяемые клетками эндотелия (например, ICAM-1), опосредуют прочное прилипание лейкоцитов к выстилке сосудов и также запускают сигнальные каскады, которые способствуют увеличению проницаемости ГЭБ и лейкоцитарной инфильтрации [59]. Повышенная экспрессия ICAM-1 клетками церебрального эндотелия наблюдалась во время ишемии/реперфузии в моделях in vivo и in vitro [60, 61]. Прекондиционирование в культуре эндотелиальных клеток сокращало их ответную воспалительную реакцию и полностью блокировало повышенные уровни ICAM-1, индуцируемые посредством ФНО-α [62]. Данные, подтверждающие эти результаты, были получены с гипоксическим прекондиционированием, которое также ингибировало адгезию нейтрофилов к эндотелиальным клеткам, вызванную гипоксией/реоксигенацией [63].
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ ЦЕРЕБРАЛЬНОГО ЭНДОТЕЛИЯ В УСЛОВИЯХ ГИПОКСИИ/ГИПЕРКАПНИИ
Регуляция метаболизма в клетках, входящих в структуру ГЭБ, подвержена влиянию как гуморальных факторов, присутствующих в периферическом кровотоке, так и молекулярно-клеточных сигнальных систем, влияющих на церебральный эндотелий [64]. Особенно важным это становится в условиях гипоксии и ишемии тканей головного мозга.
Важная роль в метаболическом регулировании церебрального эндотелия отведена продукции и межклеточному транспорту лактата [65], а также его утилизации из окружающей ткани и системного кровотока, что имеет место при развитии ишемического повреждения [66]. При этом продукция лактата тесно связана с редокс-состоянием клеток, в частности соотношением НАД+/НАДН в митохондриях [67]. Кроме того, в условиях высокой потребности в энергопродукции, сформированной кислородно-глюкозной депривацией, активируются процессы митохондриального биогенеза [68]. Этот процесс стимулируется коактиватором 1α-рецептора, активируемого пролифераторами пероксисом (PGC-1) и АМФ-активируемой протеинкиназой (AMPK) [69], а ингибируется индуцируемым гипоксией фактором 1 (HIF-1) [70].
Многие события при межклеточных взаимодействиях на уровне ГЭБ определяются активностью транскрипционного фактора HIF-1, опосредующего ответ клеток на гипоксию [71]. Известно, что HIF-1-индуцируемые реакции энергетического обмена находят свое отражение в изменении процессов гликолиза, аккумуляции лактата и изменении характера нейрон-астроглиального метаболического сопряжения [72]. В числе генов, контролируемых HIF-1, входят гены, кодирующие фактор 1 из стромальных клеток (SDF-1), ферменты гликолиза, переносчики глюкозы и лактата, что необходимо для обеспечения функционирования клеток в условиях острой или хронической гипоксии [51].
В наших работах показана стимулирующая роль в отношении HIF-1 не только со стороны гипоксии, но и пермиссивной гиперкапнии и гиперкапнической гипоксии [73, 74]. Эти обстоятельства также могут свидетельствовать в пользу положительного индуцирующего влияния перемежающей гиперкапнии в сочетании с гипоксией на метаболизм клеток церебрального эндотелия.
ВЛИЯНИЕ ГИПЕРКАПНИИ И ГИПОКСИИ НА СОХРАНЕНИЕ ЦЕЛОСТНОСТИ И ПРОНИЦАЕМОСТИ ГЭБ В УСЛОВИЯХ ИШЕМИИ
Результаты одного из наших исследований свидетельствуют в пользу того, что снижение проницаемости ГЭБ после сочетанного воздействия перемежающей гиперкапнии и гипоксии является вероятным механизмом для формирования ишемической толерантности головного мозга [75]. В пользу нейропротекторной эффективности этого механизма также выступают результаты исследования, демонстрирующие положительное влияние 3-часовой пермиссивной гиперкапнии (80 и 100 мм Hg), предварительное воздействие которой вызывало сохранение целостности ГЭБ при травматическом повреждении головного мозга [76]. Вероятными элементами сигнального пути в механизме снижения проницаемости ГЭБ после перемежающего воздействия гиперкапнии и гиперкапнической гипоксии могут выступать усиление пролиферации эндотелиальных клеток [77], супрессия белка аквапорина-4 и ингибирование апоптоза в клетках церебрального эндотелия [78].
Гипоксическое прекондиционирование вызывает снижение проницаемости ГЭБ, что, как правило, в дальнейшем оказывает защитный эффект на его целостность в условиях последующего ишемического повреждения [2]. Некоторые авторы связывают этот механизм с модуляцией белков плотных соединений сфингозинкиназой-2, окклюдина и ZO-1 [79, 80]. При этом гипоксическое прекондиционирование ингибирует адгезию нейтрофилов к эндотелиальным клеткам [63], а повышение уровня HIF-1α после гипоксии стимулирует пролиферацию эндотелиоцитов ГЭБ [3]. Все эти факторы также должны благоприятно способствовать функционированию ГЭБ в условиях ишемии.
Учитывая, что изолированное воздействие перемежающей пермиссивной гиперкапнии, а также ее сочетание с гипоксией снижают степень проницаемости ГЭБ, можно предположить, что оба эти компонента оказывают влияние на нейропротекторный механизм, активируя разные сигнальные пути [75].
Необходимо также отметить, что существуют данные, которые демонстрируют отрицательное влияние гипоксического прекондиционирования на целостность ГЭБ [81]. Показано, что кратковременное гипоксическое воздействие усиливает проницаемость ГЭБ через сигнальный путь, опосредованный фактором роста эндотелия сосудов (VEGF), что повышает вероятность усугубления отека мозга при церебральной ишемии. Однако стоит принимать во внимание, что в данной работе авторы концентрируются на кратковременных вазогенных эффектах гипоксического прекондиционирования и их влияния на проницаемость ГЭБ, отождествляя их с характеристиками его целостности.
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ ПРЕПАРАТОВ, МОДУЛИРУЮЩИХ МЕТАБОЛИЗМ И ПРОНИЦАЕМОСТЬ ГЭБ В СОЧЕТАНИИ С ГИПЕРКАПНИЧЕСКОЙ ГИПОКСИЕЙ
Использование воздействий перемежающей гиперкапнической гипоксии, несмотря на их высокую нейропротекторную эффективность, имеет существенные ограничения для использования в клинической практике. Это связано с достижением значимого протекторного эффекта от респираторного воздействия не ранее, чем через 7 сеансов 30-минутных тренировок [82]. Перспективным вариантом для потенцирования защитной эффективности респираторных тренировок представляется комбинация гиперкапнически-гипоксических воздействий с фармакологическими активаторами базовых нейропротекторных механизмов [83]. К таким механизмам, в контексте данного обзора, можно отнести поддержание метаболизма и проницаемости ГЭБ.
На основании данных о нейропротекторных механизмах, реализуемых посредством модулирования функционального состояния ГЭБ, можно выделить сигнальные пути, дополнительная стимуляция которых имеет потенциал для усиления защитных эффектов при сочетании с респираторными гиперкапнически-гипоксическими воздействиями. Очевидно, что высоким потенциалом для потенцирования эффективности воздействий гиперкапнической гипоксии могут быть препараты, обладающие антиоксидантной эффективностью и оказывающими эндотелиопроективный эффект [84]. Например, аскорбиновая кислота (витамин С) и α‑токоферол (витамин Е) [85], ретинол (витамин А) [86].
Перспективным направлением с точки зрения положительного влияния на гемореологию крови, провоспалительные факторы и нормализацию показателей NO-продуцирующей системы является использование производных 3‑оксипиридина [87]. У этих соединений обнаружено свойство восстанавливать NO-продуцирующую функцию эндотелия, улучшать эндотелий-зависимую и эндотелий-независимую вазодилатацию в клинических условиях. Так, на фоне гипотензивного и кардиопротекторного свойств этилметилгидроксипиридина сукцинат в сочетании с гиперкапнической гипоксией оказывает выраженное позитивное влияние на гемореологию [88]. Кроме того, эти препараты оказывают мощное мембранопротекторное действие, повышают активность антиоксидантных ферментов, поддерживают процесс окислительного фосфорилирования в условиях гипоксии и активируют энергопродукцию в митохондриях в результате увеличения доставки и потребления клетками сукцината [89, 90].
Высокий потенциал для усиления защитных эффектов гиперкапнической гипоксии имеет игнибирование c-Jun N-терминальных киназ (JNK) при использовании синтетических препаратов (например, IQ-1), которые оказывают выраженный кардио- и нейропротекторный эффект [91, 92]. Принимая во внимание, что гиперкапническая гипоксия активирует сигнальные пути нейропротекции, не связанные напрямую с ингибированием пируватдегидрогеназы, можно ожидать, что комбинация респираторного воздействия с препаратами-ингибиторами JNK будет обладать большим нейропротекторным потенциалом, чем их изолированное применение. Кроме того, на основании данных о том, что JNK репрограммирует метаболизм митохондрий на гликолитическую продукцию лактата посредством фосфорилирования пируватдегидрогеназы (PDH) [93], можно предположить, что нейропротекторные свойства ингибиторов JNK могут быть опосредованы повышением активности PDH и изменением уровня НАД+ в клетках эндотелия ГЭБ c модуляцией его проницаемости.
ЗАКЛЮЧЕНИЕ
Структура ГЭБ в условиях гипоксического/ишемического повреждения находится под регуляторным влиянием целого ряда сигнальных систем: эпигенетический механизм молекулярно-клеточного взаимодействия; трофические и мембранные факторы, поддерживающие структурную целостность и ограниченную проницаемость; нейрон-астроглиальное метаболическое сопряжение. При этом на все эти системы, в той или иной степени, можно оказывать нейропротекторное влияние посредством сочетанного воздействия гиперкапнии и гипоксии (рис. 1).
Рис. 1.
Воздействие пермиссивной гиперкапнии и нормобарической гипоксии на сигнальные пути, регулирующие структурную целостность ГЭБ, его ограниченную проницаемость и метаболическую активность. Красные линии – ингибирование; зеленые линии – активация/индукция. В квадратных скобках указаны ссылки на первоисточники.
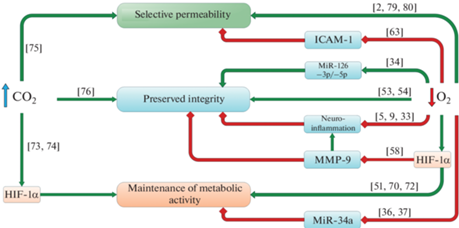
Приведенные данные демонстрируют, что существует значительное количество препаратов, обладающих высоким потенциалом для повышения нейропротекторной эффективности при сочетании с гиперкапнической гипоксией. К таким группам препаратов относятся антиоксиданты, эндотелио- и мембранопротекторы, ингибиторы JNK и энерготропные препараты. Вместе с этим, экспериментальных и клинических данных недостаточно для подтверждения эндотелиопротективного действия отдельных фармакологических модуляторов нейропротекторных механизмов, что требует дальнейшего изучения.
Список литературы
Tregub P, Kulikov V, Motin Y, Bespalov A, Osipov I (2015) Combined exposure to hypercapnia and hypoxia provides its maximum neuroprotective effect during focal ischemic injury in the brain. J Stroke Cerebrovasc Dis 24(2): 381–387. https://doi.org/101016/jjstrokecerebrovasdis201409003
Obrenovitch TP (2008) Molecular Physiology of Preconditioning-Induced Brain Tolerance to Ischemia. Physiol Rev 88: 211–247. https://doi.org/101152/physrev000392006
Кувачева НВ, Моргун АВ, Хилажева ЕД, Бойцова ЕБ, Рузаева ВА, Шуваев АН, Малиновская НА, Пожиленкова ЕА, Салмина АБ (2016) Особенности пролиферации клеток гематоэнцефалического барьера при подавлении активности HIF-1 in vitro. Сиб мед обозр 98(2): 51–56. [Kuvacheva NV, Morgun AV, Khilazheva ED, Boytsova EB, Ruzaeva VA, Shuvaev AN, Malinovskaja NA, Pozhilenkova EA, Salmina AB (2016) Features of proliferation of bloodbrain barrier cells upon suppression of HIF-1 activity in vitro. Sib Med Rev 98(2): 51–56. (In Russ)].
Бережанская СБ, Лукьянова ЕА, Жаворонкова ТЭ, Каушанская ЕЯ, Созаева ДИ (2017) Современная концепция структурно-функциональной организации гематоэнцефалического барьера и основные механизмы нарушения его резистентности. Педиатрия Журн им ГН Сперанского 96(1): 135–141. [Berezhanskaja SB, Luk’janova EA, Zhavoronkova TJe, Kaushanskaja EJa, Sozaeva DI (2017) Sovremennaja koncepcija strukturno-funkcional’noj organizacii gematojencefalicheskogo bar’era i osnovnye mehanizmy narushenija ego rezistentnosti. Pediatrija Zhurn im GN Speranskogo 96(1): 135–141. (In Russ)].
Салмина АБ, Комлева ЮК, Малиновская НА, Моргун АВ, Тепляшина ЕА, Лопатина ОЛ, Горина ЯВ, Харитонова ЕВ, Хилажева ЕД, Шуваев АН (2021) Повреждение гематоэнцефалического барьера при стрессе и нейродегенерации: биохимические механизмы и новые модели для трансляционных исследований. Биохимия 86(6): 917–932. [Salmina AB, Komleva JuK, Malinovskaja NA, Morgun AV, Tepljashina EA, Lopatina OL, Gorina JaV, Haritonova EV, Hilazheva ED, Shuvaev AN (2021) Povrezhdenie gematojencefalicheskogo bar’era pri stresse i nejrodegeneracii: biohimicheskie mehanizmy i novye modeli dlja transljacionnyh issledovanij. Biochemistry 86(6): 917–932. (In Russ)]. https://doi.org/10.31857/S0320972521060130
Ballabh P, Braun A, Nedergaard M (2014) The blood-brain barrier: an overview structure, regulation and clinical implications. Neurobiology of Disease 16: 1–13. https://doi.org/10.1016/j.nbd.2003.12.016
Tran KA, Zhang X, Predescu D, Huang X, Machado RF, Göthert JR, Malik AB, Valyi-Nagy T, Zhao YY (2016) Endothelial β-catenin signaling is required for maintaining adult bloodbrain barrier integrity and central nervous system homeostasis. Circulation 133(2):177–186. https://doi.org/10.1161/CIRCULATIONAHA.115.015982
Liu JY, Thom M, Catarino CB, Martinian L, Figarella-Branger D, Bartolomei F, Koepp M, Sisodiya SM (2012) Neuropathology of the blood-brain barrier and pharmaco-resis tance in human epilepsy. Brain 135(10): 3115–3133. https://doi.org/10.1093/brain/aws147
Gang L, Bauer S, Nowak M, Norwood B, Tackenberg B, Rosenow F, Knake S, Oertel WH, Hammer HM (2011) Cytokines and epilepsy. Seizure-Eur J Epilep 20(3): 249–256. https://doi.org/10.1016/j.seizure.2010.12.005
Моргун АВ, Овчаренко НВ, Таранушенко ТЕ, Устинова СИ, Окунева ОС, Антонова СК, Гилязова ДФ, Успенская ОА, Салмина АБ (2013) Маркеры апоптоза и нейроспецифические белки в диагностике перинатальных поражений центральной нервной системы у новорожденных детей. Сиб мед обозр 3(81): 3–11 [Morgun AV, Ovcharenko NV, Taranushenko TE, Ustinova SI, Okuneva OS, Antonova SK, Gilyazova DF, Uspenskaya OA, Salmina AB (2013) Markers of apoptosis and neurospecific proteins in the diagnosis of perinatal lesions of the central nervous system in newborns. Sib Med Rev 3(81): 3–11. (In Russ)].
Кувачева НВ, Салмина АБ, Комлева ЮК, Малиновская НА, Моргун АВ, Пожиленкова ЕА, Замай ГС, Яузина НА, Петрова ММ (2013) Проницаемость гематоэнцефалического барьера в норме, при нарушении развития головного мозга и нейродегенерации. Журн неврол психиатр им СС Корсакова 113(4): 80–85. [Kuvacheva NV, Salmina AB, Komleva YuK, Malinovskaia NA, Morgun AV, Pozhilenkova EA, Zama$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\imath } $ GS, Iauzina NA, Petrova MM (2013) Permeability of the hematoencephalic barrier in normalcy, brain development pathology and neurodegeneration. Zh Nevrol Psikhiatr im SS Korsakova 113(4): 80–85. (In Russ)].
Чехонин ВП, Лебедев СВ, Блинов ДВ, Гурина ОИ, Семенова АВ, Лазаренко ИП, Петров СВ, Рябухин ИА, Рогаткин СО, Володин НН (2004) Патогенетическая роль нарушения проницаемости гематоэнцефалического барьера для нейроспецифических белков при перинатальных гипоксически-ишемических поражениях центральной нервной системы у новорожденных. Вопр гинекол акушер перинат 3(2): 50–61. [Chekhonin VP, Lebedev SV, BIinov DV, Gurina OI, Semenova AV, Lazarenko IP, Petrov SV, Ryabukhin LA, Rogatkin SO, Volodin NN (2004) Pathogenetic role of impaired permeability of the blood-brain barrier for neurospecific proteins in perinatal hypoxic-ischemic lesions of the central nervous system in newborns. Vopr Ginеcol Akush Perinat 3(2): 50–61. (In Russ)].
Чехонин ВП, Лебедев СВ, Дмитриева ТБ, Блинов ДВ, Гурина ОИ, Семенова АВ, Володин НН (2003) Иммуноферментный анализ NSE и GFAP, как критерий динамической оценки проницаемости гематоэнцефалического барьера крыс при перинатальном гипоксически-ишемическом поражении ЦНС. Бюлл эксп биол мед 136(9): 299–303 [Chehonin VP, Lebedev SV, Dmitrieva TB, Blinov DV, Gurina OI, Semenova AV, Volodin NN (2003) Enzyme immunoassay of NSE and GFAP as a criterion for dynamic assessment of the permeability of the blood-brain barrier of rats with perinatal hypoxic-ischemic CNS lesion. Bull Exp Biol Med 136 (9): 299–303. (In Russ)].
Abbott NJ, Ronnback L, Hansson E (2017) Astrocyte-endothelial interactions at the blood-brain barrier. Nat Rev Neurosci 7: 41–53. https://doi.org/10.1038/nrn1824
Chalbot S, Zetterberg H, Blennow K, Fladby T, Grundke-Iqbal I, Iqbal K (2010) Cerebrospinal Fluid Secretory Ca2+dependent phospholipase A2 activity: a biomarker of blood-cerebrospinal fluid barrier permeability. Neurosci Lett 478(3): 179–183. https://doi.org/10.1016/j.neulet.2010.05.012
Ванюшин БФ (2006) Метилирование ДНК и эпигенетика. Генетика 42(9): 1186–1199. [Vanyushin BF (2006) DNA methylation and epigenetics. Genetics 42(9): 1186–1199. (In Russ)].
Нетребенко ОК, Щеплягина ЛА, Грибакин СГ (2020) Метаболическое программирование и эпигенетика в педиатрии. Лечение и профилактика. 10(1): 29–35. [Netrebenko OK, Scheplyagina LA, Gribakin SG (2020) Metabolic programming and epigenetics in pediatrics. Treatment and Prevention 10(1): 29–35. (In Russ)].
Meng Q, Yang G, Yang Y, Ding F, Hu F (2020) Protective effects of histone deacetylase inhibition by Scriptaid on brain injury in neonatal rat models of cerebral ischemia and hypoxia. Int J Clin Exp Pathol 13(2): 179–191.
Jambhekar A, Dhall A, Shi Y (2019) Roles and regulation of histone methylation in animal development. Nat Rev Mol Cell Biol 20(10): 625–641. https://doi.org/10.1038/s41580-019-0151-1
Yao B, Jin P (2014) Unlocking epigenetic codes in neurogenesis. Genes Dev 28(12): 1253–1271. https://doi.org/10.1101/gad.241547.114
Чурилова АВ, Глущенко ТС, Рыбникова ЕА, Самойлов МО (2018) Влияние ингибитора деацетилаз гистонов на экспрессию глюкокортикоидных рецепторов в структурах переднего мозга крыс при действии гипоксии. Цитология 60(12): 1016–1021. [Churilova AV, Gluschenko TS, Rybnikova EA, Samoilov MO (2018) The effect of histone deacetylase inhibitor on the expression level of glucococrticoid receptor in rat forebrain under hypoxia. Cytology 60(12): 1016–1021. (In Russ)].
Pierre WC, Legault LM, Londono I, McGraw S, Lodygensky GA (2020) Alteration of the brain methylation landscape following postnatal inflammatory injury in rat pups. FASEB J 34(1): 432–445. https://doi.org/10.1096/ fj.201901461R
Deniz BF, Confortim HD, Miguel PM, Bronauth L, Fernandes IR, Muotri AR, Pereira LO (2021) High gestational folic acid supplementation prevents hypoxia-ischemia-induced caspase-3 augmenting without changing synapsin and H3 methylation levels in the rat hippocampus. Int J Dev Neurosci 81(6): 510–519. https://doi.org/10.1002/jdn.10132
Tornabene E, Helms HCC, Pedersen SF, Brodin B (2019) Effects of oxygen-glucose deprivation (OGD) on barrier properties and mRNA transcript levels of selected marker proteins in brain endothelial cells/astrocyte co-cultures. PLoS One 14: e0221103. https://doi.org/10.1371/journal.pone.0221103
Rink C, Khanna S (2017) Micro RNA in ischemic stroke etiology and pathology. Physiol Genomics 43(10): 521–528. https://doi.org/10.1152/ physiolgenomics.00158.2017
Shen G, Ma Q (2020) MicroRNAs in the Blood-Brain Barrier in Hypoxic-Ischemic Brain Injury. Curr Neuropharmacol 18(12): 1180-1186. https://doi.org/10.2174/1570159X18666200429004242
Ek CJ, D’Angelo B, Baburamani AA, Lehner C, Leverin AL, Smith PL, Nilsson H, Svedin P, Hagberg H, Mallard C (2015) Brain barrier properties and cerebral blood flow in neonatal mice exposed to cerebral hypoxia-ischemia. J Cereb Blood Flow Metab 35(5): 818–827. https://doi.org/10.1038/jcbfm.2014.255
Cerutti C, Ridley AJ (2017) Endothelial cell-cell adhesion and signaling. Exp Cell Res 358(1): 31–38. https://doi.org/10.1016/j.yexcr.2017.06.003
Shi Y, Jiang X, Zhang L, Pu H, Hu X, Zhang W, Cai W, Gao Y, Leak RK, Keep RF, Bennett MV, Chen J (2017) Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood-brain barrier disruption after ischemic brain injury. Proc Natl Acad Sci U S A 114(7): 1243–1252. https://doi.org/10.1073/pnas.1621174114
Fan F, Yang J, Xu Y, Guan S (2018) MiR-539 targets MMP-9 to regulate the permeability of blood-brain barrier in ischemia/reperfusion injury of brain. Neurochem Res 43(12): 2260–2267. https://doi.org/10.1007/s11064-018-2646-0
Bai Y, Zhang Y, Han B, Yang L, Chen X, Huang R, Wu F, Chao J, Liu P, Hu G, Zhang JH, Yao H (2018) Circular RNA DLGAP4 ameliorates ischemic stroke outcomes by targeting miR-143 to regulate endothelial-mesenchymal transition associated with blood-brain barrier integrity. J Neurosci 38(1): 32–50. https://doi.org/10.1523/ JNEUROSCI.1348-17.2017
Wang Y, Wang MD, Xia YP, Gao Y, Zhu YY, Chen SC, Mao L, He QW, Yue ZY, Hu B (2018) MicroRNA-130a regulates cerebral ischemia-induced blood-brain barrier permeability by targeting Homeobox A5. FASEB J 32(2): 935–944. https://doi.org/10.1096/ fj.201700139RRR
Huang L, Ma Q, Li Y, Li B, Zhang L (2018) Inhibition of microRNA-210 suppresses pro-inflammatory response and reduces acute brain injury of ischemic stroke in mice. Exp Neurol 300: 41–50. https://doi.org/10.1016/j.expneurol.2017.10.024
Pan J, Qu M, Li Y, Wang L, Zhang L, Wang Y, Tang Y, Tian HL, Zhang Z, Yang GY (2020) MicroRNA-126-3p/-5p overexpression attenuates blood-brain barrier disruption in a mouse model of middle cerebral artery occlusion. Stroke 51(2): 619–627. https://doi.org/10.1161/STROKEAHA.119.027531
Bernstein DL, Zuluaga-Ramirez V, Gajghate S, Reichenbach NL, Polyak B, Persidsky Y, Rom S (2020) miR-98 reduces endothelial dysfunction by protecting blood-brain barrier (BBB) and improves neurological outcomes in mouse ischemia/reperfusion stroke model. J Cereb Blood Flow Metab 40(10): 1953–1965. https://doi.org/10.1177/0271678X19882264
Bukeirat M, Sarkar SN, Hu H, Quintana DD, Simpkins JW, Ren X (2016) MiR-34a regulates bloodbrain barrier permeability and mitochondrial function by targeting cytochrome c. J Cereb Blood Flow Metab 36(2): 387–392. https://doi.org/10.1177/0271678X15606147
Hu H, Hone EA, Provencher EAP, Sprowls SA, Farooqi I, Corbin DR, Sarkar SN, Hollander JM, Lockman PR, Simpkins JW, Ren X (2020) MiR-34a interacts with cytochrome c and shapes stroke outcomes. Sci Rep 10(1): 3233. https://doi.org/10.1038/s41598-020-59997-y
Li Z, Li J, Tang N (2017) Long noncoding RNA Malat1 is a potent autophagy inducer protecting brain microvascular endothelial cells against oxygen-glucose deprivation/reoxygenation-induced injury by sponging miR-26b and upregulating ULK2 expression. Neuroscience 354: 1–10. https://doi.org/10.1016/j.neuroscience.2017.04.017
Yin KJ, Deng Z, Hamblin M, Xiang Y, Huang H, Zhang J, Jiang X, Wang Y, Chen YE (2018) Peroxisome proliferator-activated receptor delta regulation of miR-15a in ischemia-induced cerebral vascular endothelial injury. J Neurosci 30(18): 6398–6408. https://doi.org/10.1523/JNEUROSCI.0780-10.2018
Wan Y, Jin HJ, Zhu YY, Fang Z, Mao L, He Q, Xia YP, Li M, Li Y, Chen X, Hu B (2018) MicroRNA-149-5p regulates bloodbrain barrier permeability after transient middle cerebral artery occlusion in rats by targeting S1PR2 of pericytes. FASEB J 32(6): 3133–3148. https://doi.org/10.1096/fj.201701121R
Chan YC, Banerjee J, Choi SY, Sen CK (2012) miR-210: the master hypoxamir. Microcirculation 19(3): 215–223. https://doi.org/10.1111/j.1549- 8719.2011.00154.x
Ma Q, Dasgupta C, Li Y, Huang L, Zhang L (2017) MicroRNA-210 suppresses junction proteins and disrupts blood-brain barrier integrity in neonatal rat hypoxic-ischemic brain injury. Int J Mol Sci 18(7): E1356. https://doi.org/10.3390/ijms18071356
Zaccagnini G, Greco S, Voellenkle C, Gaetano C, Martelli F (2021) miR-210 hypoxamiR in Angiogenesis and Diabetes. Antioxid Redox Signal. https://doi.org/10.1089/ars.2021.0200
Ma Q, Zhang L, Pearce WJ (2019) MicroRNAs in brain development and cerebrovascular pathophysiology. Am J Physiol Cell Physiol 317(1): 3–19. https://doi.org/10.1152/ajpcell.00022.2019
Jiang Y, Li L, Tan X, Liu B, Zhang Y, Li C (2015) miR-210 mediates vagus nerve stimulationinduced antioxidant stress and anti-apoptosis reactions following cerebral ischemia/reperfusion injury in rats. J Neurochem 134(1): 173–181. https://doi.org/10.1111/jnc.13097
Meng ZY, Kang HL, Duan W, Zheng J, Li QN, Zhou ZJ (2018) MicroRNA-210 promotes accumulation of neural precursor cells around ischemic foci after cerebral ischemia by regulating the SOCS1-STAT3-VEGF-C pathway. J Am Heart Assoc 7(5): e005052. https://doi.org/10.1161/ JAHA.116.005052
Garberg HT, Huun MU, Baumbusch LO, Åsegg-Atneosen M, Solberg R, Saugstad OD (2017) Tempora profile of circulating microRNAs after global hypoxia-ischemi in newborn piglets. Neonatology 111(2): 133–139. https://doi.org/10.1159/000449032
Whitehead CL, Teh WT, Walker SP, Leung C, Larmour L, Tong S (2018) Circulating MicroRNAs in maternal blood as potential biomarkers for fetal hypoxia in-utero. PLoS One 8(11): e78487. https://doi.org/. pone.0078487https://doi.org/10.1371/journal
Ge X, Han Z, Chen F, Wang H, Zhang B, Jiang R, Lei P, Zhang J (2015) MiR-21 alleviates secondary blood-brain barrier damage after traumatic brain injury in rats. Brain Res 1603: 150–157. https://doi.org/10.1016/j.brainres.2015.01.009
Yao X, Wang Y, Zhang D (2018) microRNA-21 confers neuroprotection agains cerebral ischemia-reperfusion injury and alleviates blood-brain barrier disruption in rats via the MAPK signaling pathway. J Mol Neurosci 65(1): 43–53. https://doi.org/10.1007/s12031-018-1067-5
Салмина АБ, Моргун АВ, Кувачева НВ, Пожиленкова ЕА, Солончук ЮР, Лопатина ОЛ, Комлева ЮК, Таранушенко ТЕ (2014) Эндотелиальные прогениторные клетки в развитии и восстановлении церебрального эндотелия (обзор). Соврем технол мед 6(4): 213–222. [Salmina AB, Morgun AV, Kuvacheva NV, Pozhilenkova EA, Solonchuk JuR, Lopatina OL, Komleva JuK, Taranushenko TE (2014) Endothelial Progenitor Cells in the Development and Recovery of the Cerebral Endothelium (Review). Sovrem Technol Med 6(4): 213–222. (In Russ)].
Siegenthaler JA, Sohet F, Daneman R (2013) ‘Sealing off the CNS’: cellular and molecular regulation of blood-brain barriergenesis. Curr Opin Neurobiol 23(6): 1057–1064. https://doi.org/10.1016/j.conb.2013.06.006
Masada T, Hua Y, Xi G, Ennis SR, Keep RF (2013) Attenuation of ischemic brain edema and cerebrovascular injury after ischemic preconditioning in the rat. J Cereb Blood Flow Metab 21: 22–33. https://doi.org/10.1097/00004647-200101000-00004
Zhang FY, Chen XC, Ren HM, Bao WM (2006) Effects of ischemic preconditioning on blood-brain barrier permeability and MMP-9 expression of ischemic brain. Neurol Res 28: 21–24. https://doi.org/10.1179/016164106X91825
Ikeda T, Xia XY, Xia YX, Ikenoue T (1999) Hyperthermic preconditioning prevents blood-brain barrier disruption produced by hypoxia-ischemia in newborn rat. Brain Res 117: 53–58. https://doi.org/10.1016/s0165-3806(99)00097-8
Maruoka N, Murata T, Omata N, Fujibayashi Y, Yonekura Y, Wada Y (2012) Hypoxic tolerance induction in rat brain slices following 3-nitropropionic acid pretreatment as revealed by dynamic changes in glucose metabolism. Neurosci Lett 319: 83–86. https://doi.org/10.1016/s0304-3940(01)02542-3
Yang Y, Estrada EY, Thompson JF, Liu W, Rosenberg GA (2017) Matrix metalloproteinase-mediated disruption of tight junction proteins in cerebral vessels is reversed by synthetic matrix metalloproteinase inhibitor in focal ischemia in rat. J Cereb Blood Flow Metab 27: 697–709. https://doi.org/10.1038/sj.jcbfm.9600375
Zhao BQ, Wang S, Kim HY, Storrie H, Rosen BR, Mooney DJ, Wang X, Lo EH (2006) Role of matrix metalloproteinases in delayed cortical responses after stroke. Nat Med 12: 441–445. https://doi.org/10.1038/nm1387
Tohidpour A, Morgun AV, Boitsova EB, Malinovskaya NA, Martynova GP, Khilazheva ED, Kopylevich NV, Gertsog GE, Salmina AB (2017) Neuroinflammation and infection: molecular mechanisms associated with dysfunction of neurovascular unit. Front Cell Infect Microbiol 7: 276. https://doi.org/10.3389/fcimb.2017.00276
Frijns CJ, Kappelle LJ (2012) Inflammatory cell adhesion molecules in ischemic cerebrovascular disease. Stroke 33: 2115–2122. https://doi.org/10.1161/01.str.0000021902.33129.69
Zhang W, Smith C, Shapiro A, Monette R, Hutchison J, Stanimirovic D (1999) Increased expression of bioactive chemokines in human cerebromicrovascular endothelial cells and astrocytes subjected to simulated ischemia in vitro. J Neuroimmunol 101: 148–160. https://doi.org/10.1016/s0165-5728(99)00137-x
Zahler S, Kupatt C, Becker BF (2000) Endothelial preconditioning by transient oxidative stress reduces inflammatory responses of cultured endothelial cells to TNF-α. FASEB J 14: 555–564. https://doi.org/10.1096/fasebj.14.3.555
Zhou SG, Lei XY, Liao DF (2013) Effects of hypoxic preconditioning on the adhesion of neutrophils to vascular endothelial cells induced by hypoxia/reoxygenation. Zhongguo Wei Zhong Bing Ji Jiu Yi Xu 15: 159–162.
Хилажева ЕД, Писарева НВ, Моргун АВ, Бойцова ЕБ, Таранушенко ТЕ, Фролова ОВ, Салмина АБ (2017) Активация лактатных рецепторов GPR81 стимулирует митохондриальный биогенез в клетках эндотелия церебральных микрососудов. Анн клин эксп неврол 11(1): 34–39. [Hilazheva ED, Pisareva NV, Morgun AV, Bojcova EB, Taranushenko TE, Frolova OV, Salmina AB (2017) Aktivacija laktatnyh receptorov GPR81 stimuliruet mitohondrial’nyj biogenez v kletkah jendotelija cerebral’nyh mikrososudov. Ann Сlin Exp Neurol 11(1): 34–39. (In Russ)].
Verdegem D, Moens S, Stapor P, Carmeliet P (2014) Endothelial cell metabolism: parallels and divergences with cancer cell metabolism. Cancer Metab 2: 19. https://doi.org/10.1186/2049-3002-2-19
Pavlides S, Whitaker-Menezes D, Castello-Cros R (2009) The reverse Warburg effect: aerobic glycolysis in cancer associated fibroblasts and the tumor stroma. Cell Cycle 8: 3984–4001. https://doi.org/10.4161/cc.8.23.10238
Bergersen LH, Gjedde A (2012) Is lactate a volume transmitter of metabolic states of the brain? Front Neuroenergetics 4: 5. https://doi.org/10.3389/fnene.2012.00005
Vásquez-Trincado C, García-Carvajal I, Pennanen C, Parra V, Hill JA, Rothermel BA, Lavandero S (2016) Mitochondrial dynamics, mitophagy and cardiovascular disease. J Physiol 594(3): 509–525. https://doi.org/10.1113/JP271301
Jornayvaz FR, Shulman GI (2010) Regulation of mitochondrial biogenesis. Essays Biochem 47: 69–84. https://doi.org/10.1042/bse0470069
Lin XW, Tang L, Yang J, Xu WH (2016) HIF-1 regulates insect lifespan extension by inhibiting c-Myc-TFAM signaling and mitochondrial biogenesis. Biochim Biophys Acta 1863: 2594–2603. https://doi.org/10.1016/j.bbamcr.2016.07.007
Ruzaeva VA, Morgun AV, Khilazheva ED, Kuvacheva NV, Pozhilenkova EA, Boitsova EB, Martynova GP, Taranushenko TE, Salmina AB (2016) Development of blood-brain barrier under the modulation of HIF activity in astroglialand neuronal cells in vitro. Biomed Khim 62: 664–669. https://doi.org/10.18097/pbmc20166206664
Patten DA, Lafleur VN, Robitaille GA, Chan DA, Giaccia AJ, Richard DE (2010) Hypoxia-inducible factor-1 activation in nonhypoxic conditions: the essential role of mitochondrialderived reactive oxygen species. Mol Biol Cell 21(18): 3247–3257. https://doi.org/10.1091/mbc.E10-01-0025
Куликов ВП, Трегуб ПП, Ковзелев ПД, Дорохов ЕА, Белоусов АА (2015) Гиперкапния – альтернативный гипоксии сигнальный стимул для повышения HIF-1a и эритропоэтина в головном мозге. Патол физиол эксп терапия 59(3): 34–37 [Kulikov VP, Tregub PP, Kovzelev PD, Dorohov EA, Belousov AA (2015) Giperkapnija – al’ternativnyj gipoksii signal’nyj stimul dlja povyshenija HIF-1a i jeritropojetina v golovnom mozge. Patol Fiziol Exp Ter 59(3): 34–37. (In Russ)].
Tregub PP, Malinovskaya NA, Morgun AV, Osipova ED, Kulikov VP, Kuzovkov DA, Kovzelev PD (2020) Hypercapnia potentiates HIF-1α activation in the brain of rats exposed to intermittent hypoxia. Respir Physiol Neurobiol 278: 103442. https://doi.org/10.1016/j.resp.2020.103442
Трегуб ПП, Малиновская НА, Куликов ВП, Кузовков ДА (2021) Гиперкапния и ее сочетание с гипоксией снижают проницаемость гематоэнцефалического барьера у крыс. Патол физиол эксп терапия 65(2): 30–36 [Tregub PP, Malinovskaya NA, Kulikov VP, Kuzovkov DA (2021) Hypercapnia and its combination with hypoxia reduce the permeability of the blood-brain barrier in rats. Patol Fiziol Exp Ter 65(2): 30–36. (In Russ)].
Yang W, Wang Q, Chi, L, Wang Y-Z, Cao H-L, Li W-Z (2019) Therapeutic hypercapnia reduces blood–brain barrier damage possibly via protein kinase Cε in rats with lateral fluid percussion injury. J Neuroinflam 16: 36.
Tregub PP, Morgun AV, Osipova ED, Kulikov VP, Malinovskaya NA, Kuzovkov DA (2020) Hypercapnia and Hypoxia Stimulate Proliferation of Astrocytes and Neurons In Vitro. Bull Exp Biol Med 169(6): 755–758. https://doi.org/10.1007/s10517-020-04972-w
Yang W, Zhang X, Wang N, Tan J, Fang X, Wang Q, Tao T, Li W (2016) Effects of acute systemic hypoxia and hypercapnia on brain damage in a rat model of hypoxia-ischemia. PLoS One 11: e0167359. https://doi.org/10.1371/journal.pone.0167359
Kangwantas K, Pinteaux E, Penny J (2016) The extracellular matrix protein laminin-10 promotes blood-brain barrier repair after hypoxia and inflammation in vitro. J Neuroinflammation 13: 25. https://doi.org/10.1186/s12974-016-0495-9
Wacker BK, Freie AB, Perfater JL, Gidday JM (2017) Junctional protein regulation by sphingosine kinase 2 contributes to blood-brain barrier protection in hypoxic preconditioning-induced cerebral ischemic tolerance. J Cereb Blood Flow Metab 32(6): 1014–1023. https://doi.org/10.1038/jcbfm.2012.3
Chi OZ, Mellender SJ, Barsoum S, Liu X, Weiss HR (2017) Hypoxic Preconditioning Increases Blood-Brain Barrier Disruption in the Early Stages of Cerebral Ischemia. Curr Neurovasc Res 14(1): 26–31. https://doi.org/10.2174/1567202614666161104114821
Tregub P, Kulikov V, Bespalov A (2013) Tolerance to acute hypoxia maximally increases in case of joint effect of normobaric hypoxia and permissive hypercapnia in rats. Pathophysiology 3: 165–170. https://doi.org/10.1016/j.pathophys.2013.09.001
Куликов ВП, Каланова ЛА, Трегуб ПП (2021) Потенцирование защитного эффекта гиперкапнической гипоксии при комбинации с фармакологическими нейропротекторами. Патол физиол эксп терапия 3: 21–25. [Kulikov VP, Kalanova LA, Tregub PP (2021) Potencirovanie zashhitnogo jeffekta giperkapnicheskoj gipoksii pri kombinacii s farmakologicheskimi nejroprotektorami. Patol Fiziol Exp Ter 3: 21–25. (In Russ)].
Шахмарданова СА, Гулевская ОН, Селецкая ВВ, Зеленская АВ, Хананашвили ЯА, Нефедов ДА, Галенко-Ярошевский ПА (2016) Антиоксиданты: классификация, фармакотерапевтические свойства, использование в практической медицине. Журн фунд мед биол 3: 4–15. [Shahmardanova SA, Gulevskaja ON, Seleckaja VV, Zelenskaja AV, Hananashvili JaA, Nefedov DA, Galenko-Jaroshevskij PA (2016) Antioxidants: classification, pharmacotherapeutic properties, use in practical medicine. J Fund Med Biol 3: 4–15. (In Russ)].
Ashor AW, Siervo M, Lara J, Oggioni C, Afshar S, Mathers JC (2015) Effect of vitamin C and vitamin E supplementation on endothelial function: a systematic review and meta-analysis of randomised controlled trials. Br J Nutr 113(8): 1182–1194. https://doi.org/10.1017/S0007114515000227
Brüll V, Burak C, Stoffel-Wagner B, Wolffram S, Nickenig G, Müller C, Langguth P, Alteheld B, Fimmers R, Stehle P, Egert S (2017) Acute intake of quercetin from onion skin extract does not influence postprandial blood pressure and endothelial function in overweight-to-obese adults with hypertension: a randomized, double-blind, placebo-controlled, crossover trial. Eur J Nutr 56(3): 1347–1357. https://doi.org/10.1007/s00394-016-1185-1
Смирнова КВ, Гильдиков ДИ (2021) Сравнительная эффективность антиоксидантных препаратов в эксперименте in vitro. Рос ветерин журн 2: 37–40. [Smirnova KV, Gil’dikov DI (2021) Comparative efficacy of antioxidant drugs in an in vitro experiment. Ros Veterin J 2: 37–40. (In Russ)].
Москаленко СВ, Шахматов ИИ, Бондарчук ЮА, Алексеева ОВ, Улитина ОМ (2018) Реакция системы гемостаза при гиперкапнической гипоксии после курсового применения мексидола с использование метода тромбоэластографии. Каз мед журн 99(6): 936–941. [Moskalenko SV, Shahmatov II, Bondarchuk JuA, Alekseeva OV, Ulitina OM (2018) The reaction of the hemostasis system in hypercapnic hypoxia after a course of mexidol using the method of thromboelastography. Kaz Med J 99(6): 936–941. (In Russ)].
Хлебодаров ФЕ, Михин ВП, Тюриков ПЮ (2009) Дисфункция сосудистого эндотелия и ее коррекция цитопротекторами у больных стабильной стенокардией напряжения и артериальной гипертонией. Рос кардиол журн 6: 34–39. [Khlebodarov FE, Mikhin VP, Tyurikov PYu (2009) Vascular endothelial dysfunction and its correction by cytoprotectors in patients with stable angina pectoris and arterial hypertension. Rus Cardiol J 6: 34–39. (In Russ)].
Семененков ИИ, Пристром МС (2019) Влияние комплексного применения нормобарической гипоксии и омега-3 полиненасыщенных жирных кислот на изменения жирнокислотного состава плазмы крови и показателей системного иммунного воспаления у пациентов с ишемической болезнью сердца, ассоциированной с хронической обструктивной болезнью легких. Кардиоваск тер проф 18(S1): 136–137 [Semenenkov II, Pristrom MS (2019) Influence of the combined use of normobaric hypoxia and omega-3 polyunsaturated fatty acids on changes in the fatty acid composition of blood plasma and indicators of systemic immune inflammation in patients with coronary heart disease associated with chronic obstructive pulmonary disease. Cardiovasc Ter Prof 18(S1): 136–137. (In Russ)].
Шведова МВ, Анфиногенова ЯД, Попов СВ, Щепеткин ИА, Аточин ДН (2016) С-Jun n-терминальные киназы и их модуляторы при ишемически-реперфузионном повреждении миокарда (обзор литературы). Сиб жур клин эксп мед 31(3): 7–15. [Shvedova MV, Anfinogenova JaD, Popov SV, Shhepetkin IA, Atochin DN (2016) C-Jun n-terminal kinases and their modulators in ischemia-reperfusion myocardial injury (literature review). Sib J Clin Exp Med 31(3): 7–15. (In Russ)].
Plotnikov MB, Chernysheva GA, Smolyakova VI, Aliev OI, Trofimova ES, Sherstoboev EY, Osipenko AN, Khlebnikov AI, Anfinogenova YJ, Schepetkin IA, Atochin DN (2020) Neuroprotective Effects of a Novel Inhibitor of c-Jun N-Terminal Kinase in the Rat Model of Transient Focal Cerebral Ischemia. Cells 9(8): 1860. https://doi.org/10.3390/cells9081860
Zhou Q, Lam PY, Han D, Cadenas E (2008) c-Jun N-terminal kinase regulates mitochondrial bioenergetics by modulating pyruvate dehydrogenase activity in primary cortical neurons. J Neurochem 104(2): 325–335. https://doi.org/10.1111/j.1471-4159.2007.04957.x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


