Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 5, стр. 667-676
Прогнозируемые и экспериментально подтвержденные характеристики лактата: новые возможности для управления метаболизмом клеток эндотелия
Ф. Н. Гильмиярова 1, Н. А. Колотьева 1, *, О. А. Гусякова 1
1 Самарский государственный медицинский университет Минздрава России
Самара, Россия
* E-mail: kaf_biohim@samsmu.ru
Поступила в редакцию 02.03.2022
После доработки 03.03.2022
Принята к публикации 25.03.2022
- EDN: NOANZF
- DOI: 10.31857/S0869813922050053
Аннотация
С развитием науки и техники, с учетом накопленных знаний в области геномики, протеомики, метаболомики возникает новый интерес к изучению малых молекул и наступает период, посвященный изучению функциональной активности, роли метаболитов, а также выяснению путей биологических процессов, каскадных реакций в норме и патологии. Мы обратили наше внимание на лактат, который больше не рассматривается как “тупик” анаэробного метаболизма, образующийся в тканях с ускоренным гликолизом. В последние годы доминирует точка зрения о том, что лактат – метаболит, играющий важную роль в регуляции функции многих клеток (адипоциты, клетки эндотелия, нейроны), участвующий в процессах ремоделирования тканей, ангиогенеза, пролиферации и дифференцировки. Изучение влияния лактата на изолированные каталитические белки способно выявить важные и еще не изученные роли малых молекул в межмолекулярных процессах. В качестве белка – потенциальной “мишени” его действия наш выбор остановился на ферменте глицерол-3-фосфатдегидрогеназе, осуществляющем переключение углеводно-липидного и липидно-углеводного обменов. Цель исследования: оценить аффинитет лактата к глицерол-3-фосфатдегидрогеназе с целью выяснения функциональной способности интермедиата. Методами компьютерного моделирования был раскрыт спектр биологической активности для лактата, а также охарактеризованы белки-партнеры по взаимодействию. Методами дифференциальной сканирующей флуориметрии и микрокапиллярного термофореза нами был установлен факт взаимодействия глицерол-3-фосфатдегидрогеназы с лактатом и показаны изменения конформационной стабильности фермента.
Малые молекулы – промежуточные продукты метаболизма, точки пересечения путей обмена углеводов, белков, липидов – выполняют координационную роль в функционировании и модуляции медиаторного, гормонального, рецепторного ответов, иммунологических, воспалительных, защитных реакций. Взаимодействия “белок–малая молекула” могут регулировать и контролировать различные клеточные процессы, играя главную роль в поддержании клеточного гомеостаза [1]. Наши знания о метаболит-белковых взаимодействиях пока недостаточны, однако накапливается все больше данных о влиянии метаболитов на многие клеточные события, причем реализовывать свои эффекты эти метаболиты могут за счет связывания со специфическими рецепторами или в результате трансфера между клетками. Изменение механизмов продукции и утилизации метаболитов клеток влияет на метаболизм в целом, на содержание промежуточных соединений, на окислительно-восстановительные процессы. Было изучено несколько платформ с высокой пропускной способностью, позволяющие выявить многие “неожиданные” взаимодействия белка с метаболитами, которые могут оказать влияние на наше понимание передачи сигналов клетками. В последние годы были построены обширные сети, которые описывают связь ДНК, РНК с белками [2, 3]. Использование компьютерного моделирования и методов in silico может в десятки раз сократить объем необходимого экспериментального тестирования по сравнению со слепым поиском [4].
Мы обратили наше внимание на лактат, который больше не рассматривается как “тупик” анаэробного метаболизма, образующийся в тканях с ускоренным гликолизом, а как на молекулярный инструмент, который оказывает влияние на функциональную активность клеток различных тканей (эндотелий, клетки жировой ткани, нейроны), действуя через лактатные рецепторы HCAR1/GPR81 или будучи транспортируемым монокарбоксилатными транспортерами MCT через мембрану клеток, что имеет своим результатом изменения пролиферации, дифференцировки, метаболизма [5]. В частности, интересны эффекты лактата как проангиогенного фактора, действующего за счет увеличения экспрессии сосудистого эндотелиального фактора роста (VEGF). В некоторых тканях лактат поглощается и окисляется макрофагами, а лактат-опосредованная поляризация макрофагов способствует реваскуляризации и регенерации мышц. Была установлена способность лактата модулировать морфогенез и перфузию сосудов опухоли, тем самым выявлена сигнальная роль в эндотелиальных клетках и определена связь между метаболизмом в опухолевых тканях и ангиогенезом [5]. Обсуждается применение лактата в клинических исследованиях при лечении ишемии и нейродегенеративных заболеваний [6], что имеет в своей основе стимулирующее действие лактата на процессы пластичности мозга. В частности, интересна роль лактата в качестве нейропротекторного фактора при болезни Альцгеймера, что определяется его способностью обеспечивать метаболическое сопряжение между астроцитами и нейронами в активных регионах мозга и участвовать в регуляции церебрального ангиогенеза [7]. Кроме того, лактилирование гистонов является эпигенетической модификацией, которая стимулирует транскрипцию генов и может определять тесную функциональную взаимосвязь метаболического статуса и экспрессионного профиля клеток [8].
Помимо транспортеров и рецепторов лактата, определяющих многие из эффектов этого метаболита, вполне вероятно присутствие в клетках иных белков, выступающих в качестве “мишеней” действия лактата при повышении концентрации этого метаболита в цитозоле или в органеллах. Возможным кандидатом является фермент глицерол-3-фосфатдегидрогеназа (EC 1.1.1.8, ГФД), осуществляющий переключение углеводно-липидного и липидно-углеводного обменов. Было показано, что митохондриальная глицерол-3-фосфатдегидрогеназа ускоряет окисление глюкозы, стимулируя выработку ацетил-кофермента A, ацетилирование гистонов и индукцию генов, кодирующих медиаторы воспаления в макрофагах, способствует онкогенезу в клетках глиомы [9, 10]. С учетом высокого содержания митохондрий в клетках церебрального эндотелия, вклад модуляции активности этого фермента в реализацию эффектов лактата в клетках сосудов головного мозга может быть весьма существенным.
Коль скоро особый интерес при изучении взаимодействий “метаболит–белок” представляют фермент-субстратные взаимоотношения и случаи индуцированного метаболитами ремоделирования белковых комплексов [11, 12], анализ влияния лактата на изолированные каталитические белки способно выявить важные и еще не изученные роли малых молекул в регуляции функциональной активности клеток. Поэтому целью работы стала оценка аффинитета лактата к глицерол-3-фосфатдегидрогеназе с определением возможных физиологически значимых эффектов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Моделирование прогнозируемой биологической активности in silico лактата проводили с использованием программы Prediction of Activity Spectra for Substances (PASS). Определение потенциальных белковых партнеров взаимодействия для малых молекул выполняли в системе Search Tool for Interacting Chemicals (STITCH) версии 5.0. Результат прогноза биологической активности в программе PASS представляется в виде вероятностей Pa “быть активным” (“to be active”) и Pi “быть неактивным” (“to be inactive”) имеющие значения от 0 до 1, мы приняли Pa более 0.5 за оптимальное значение вероятности наличия активности. В STITCH результат отображается в виде построения сети взаимодействия исследуемого соединения с партнерами и рассчитывается параметр р – вероятность взаимодействия малой молекулы и белка. Мы использовали в своей работе настройку по аффинитету связи и средний порог достоверности р > 0.4.
Эксперименты проводили в лаборатории молекулярной и радиационной биофизики ФГБУ НИЦ “Курчатовского института”. В работе использовали реактивы фирмы Sigma-Aldrich, США: глицерол-3-фосфатдегидрогеназа, лактат, буфер Трис-HCl 50 мM, pH 7.5. Контроль значения рН проводили до и после внесения раствора лактата в пробы с помощью рН-метра Mettler Toledo (США). Изменение рН среды имело колебания в пределах 0.01–0.02. Применение микрокапиллярного термофореза позволяет определить наличие комплексов белок–малая молекула и силу взаимодействия между ними благодаря изменению их подвижности в температурном градиенте. Для оценки использовали стехиометрический параметр – константу диссоциации (Kd), численно равный концентрации лиганда, при которой содержание свободной и связанной молекулы-партнера равны. Эксперименты проводились на приборе Monolith NT.115 (NanoTemper Technologies, Германия). Мечение каталитических белков глицерол-3-фосфатдегидрогеназы проводили с использованием коммерческого набора Monolith NT Protein Labeling Kit RED-NHS (NanoTemper Technologies, Германия). С целью определения константы диссоциации методом микротермофореза делали серию постановок с лактатом в конечной концентрации от 0.0012 до 40 мкМ (16 разведений), а конечная концентрация меченого белка глицерол-3-фосфатдегидрогеназы была постоянной, подбиралась эмпирически и составила 0.8 мкМ. Определение изменения конформационной структуры глицерол-3-фосфатдегидрогеназы под влиянием лактата проводили с использованием дифференциальной сканирующей флуориметрии, основанной на оценке собственной флуоресценции триптофана и тирозина белков при длине волны 330 и 350 нм на приборе Prometheus NT.48 (NanoTemper Technologies, Германия). Конформационную стабильность белка описывали его средней температурой денатурации Tm (°C), которая является точкой, где разворачивается половина белка. Готовили шесть разведений, в которых конечная концентрация глицерол-3-фосфатдегидрогеназы была неизмененной – 1 мкМ, а конечная концентрация раствора лактата изменялась в диапазоне от 0.5 до 16 мкМ, сканировали капилляры при интенсивности лазера 30%, диапазон нагрева от 20 до 95°С, шаг 1°С/мин. Математическое моделирование кривых соотношения флуоресценций в зависимости от температуры и концентрации лактата, статистический анализ полученных параметров регрессионных уравнений выполняли в среде пакета SPSS 25.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В более ранних работах в компьютерном обеспечении PASS нами была смоделирована и оценена биологическая активность, молекулярные механизмы и оказываемые фармакологические эффекты лактата [13, 14]. Изучен прогнозируемый спектр биологической активности лактата в отношении ряда каталитических белков (табл. 1).
Таблица 1.
Вероятные молекулярные механизмы действия лактата
| Молекулярный механизм действия | Шифр фермента | Pa лактата | Pi лактата |
|---|---|---|---|
| Ингибирование D-лактатдегидрогеназы | EC 1.1.2.4 | 0.783 | 0.002 |
| Ингибирование глицерол-3-фосфатдегидрогеназы | EC 1.1.1.8 | 0.698 | 0.003 |
| Ингибирование глицерол-3-фосфатоксидазы | EC 1.1.3.21 | 0.616 | 0.004 |
| Ингибирование малатдегидрогеназы | ЕС 1.1.1.37 | 0.705 | 0.004 |
| Ингибирование лактат-малат трансгидрогеназы | EC 1.1.99.7 | 0.808 | 0.001 |
| Ингибирование малатоксидазы | EC 1.1.3.3 | 0.522 | 0.016 |
| Ингибирование оксалоацетат таутомеразы | EC 5.3.2.2 | 0.881 | 0.001 |
| Ингибирование оксалоацетат декарбоксилазы | ЕС 4.1.1.3. | 0.742 | 0.003 |
| Ингибирование пируватдекарбоксилазы | EC 4.1.1.1 | 0.938 | 0.001 |
| Ингибирование пируватдегидрогеназы | ЕС 1.2.4.1. | 0.856 | 0.002 |
| Ингибирование акцептора малатдегидрогеназы | EC 1.1.1.37 | 0.594 | 0.018 |
| Ингибирование фенилпируватдекарбоксилазы | EC 4.1.1.43 | 0.614 | 0.004 |
| Ингибирование глутамин-фенилпируваттрансаминазы | EC 2.6.1.64 | 0.807 | 0.005 |
| Ингибирование аспартат-фенилпируваттрансаминазы | EC 2.6.1.70 | 0.816 | 0.004 |
Далее мы обратились к поисковому инструменту – программе STITCH, в которой можно произвести моделирование потенциальных белковых партнеров для лактата. При использовании среднего порога достоверности р > 0.4 количество взаимодействий для лактата составило 384.
Интересными являются данные о взаимосвязи лактата со многими рецепторами, в числе которых рецепторы гидроксикарбоновой кислоты HCAR1 (р 0.986), HCAR2 (р 0.908), HCAR3 (р 0.900), альфа-2 адренергическими рецепторами ADRA2A (р 0.922), ADRA2B (р 0.914), ADRA2C (р 0.914), опиоидными (р 0.917), дофаминовыми (р 0.907), мускариновыми холинэргическими (р 0.900), брадикининовыми (р 0.900), глутаматными (р 0.900), рецепторами лизофосфатидной кислоты (р 0.900), G-белок-связанным рецептором (р 0.900), что говорит об участии лактата в передаче нервного импульса и выполнении неметаболических функций в центральной нервной системе, связанных с семейством гетеромерных G-белков, роли трансмиттера и медиатора разнообразных клеточных процессов [15].
Было установлено взаимодействие лактата с нейропротективным белком MT-RNR2L2 (р 0.900). Предполагается, что, связываясь с белком, метаболит уменьшает образование бета-амилоидного пептида, тем самым снижая активность нейродегенеративных процессов [7]. Стоит отметить спрогнозированную функцию лактата выступать лигандом для таких нейромедиаторов как глутамат (р 0.985), дофамин (р 0.954), ацетилхолин (р 0.948), гистамин (р 0.946), простагландин Е2 (р 0.944).
Нами была отмечена высокая вероятность взаимодействия лактата с такими гормонами, как адреналин (р 0.985), соматостатин (р 0.936), мелатонин (р 0.929), полипептид поджелудочной железы (р 0.927), промеланин-концентрирующий гормон (р 0.915), который может действовать как нейротрансмиттер в широком спектре нейрональных функций.
Обращает на себя внимание высокая способность лактата воздействовать на иммунологические и воспалительные процессы: связываться с интерлейкином-8 (р 0.924), интерлейкином-6 (р 0.865) – мощным индуктором острой фазы, участвующим в окончательной дифференцировке В-клеток, лимфоцитов и моноцитов; интерлейкином-10 (р 0.851), ингибирующим синтез цитокинов (гамма-интерферон, IL-2, IL-3, TNF и GM-CSF); интерлейкином-1 альфа (р 0.748), участвующим в воспалительном ответе и стимулирующим высвобождение простагландина и коллагеназы из синовиальных клеток.
Отмечена вероятность лактата являться партнером взаимодействия для различных групп хемокинов. Так, хемокин CCL5 (р 0.911) является хемоатрактантом для моноцитов крови, Т-хелперов памяти и эозинофилов, вызывает выброс гистамина из базофилов и активирует эозинофилы. Хемокин CXCL1 (р 0.908) обладает хемотаксической активностью для нейтрофилов и может играть роль в воспалении, оказывая свое влияние на эндотелиальные клетки аутокринным способом.
Полученные в программе STITCH данные согласуются с предсказанными системой PASS различными молекулярными механизмами действия и фармакологическими эффектами лактата. Проведенный анализ большого массива данных компьютерного моделирования с использованием таких платформ как PASS и STITCH позволило сформировать общее представление о разнообразных и разнонаправленных эффектах, межмолекулярных и регуляторных механизмах действия изучаемой малой молекулы.
Установление факта взаимодействия лактата с белком стало более доступно с применением методов флуоресценции (эндогенной, и с использованием флуорофоров), сканирующей флуориметрии, микротермофореза [16 ] . С использованием метода капиллярного термофореза была вычислена константа диссоциации для глицерол-3-фосфатдегидрогеназы с лактатом, которая составила 1.0 мкМ, что свидетельствуют о достаточно сильном сродстве интермедиата к молекуле белка.
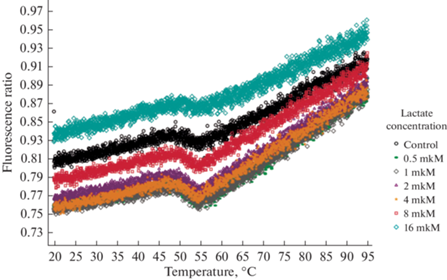
Далее проведен эксперимент по оценке процесса формирования пространственной структуры ГФД под влиянием лактата с использованием метода дифференциальной сканирующей флуориметрии. Предварительный визуальный анализ кривых плавления ГФД без лиганда и в присутствии лактата (рис. 1) позволяет выделить несколько различающихся по структуре участков. Так, в физиологическом диапазоне температур (до 45–50°С) отмечается линейный рост отношения флуоресценций, при температуре порядка 50–55°С – плавление, и при более высоких температурах – последующий рост отношения флуоресценций.
Рис. 1.
Соотношение флуоресценций при разных концентрациях лактата в процессе нагревания ГФД в диапазоне температур 20–95°С.
Нами был выделен температурный диапазон, соответствующий физиологической норме от 20 до 40°С (рис. 2), далее сопоставили средние значения соотношения флуоресценций в присутствии разных концентраций лактата и скорости их роста. Для этого мы использовали парный линейный регрессионный анализ, который определяет углы наклона линейного роста соотношения флуоресценций, и ковариационный анализ (ANCOVA), который позволяет сравнить эти углы наклона у разных лигандов и сравнить средние значения соотношения флуоресценций.
Рис. 2.
Соотношение флуоресценций при разных концентрациях лактата в процессе нагревания ГФД в диапазоне температур 20–40°С.
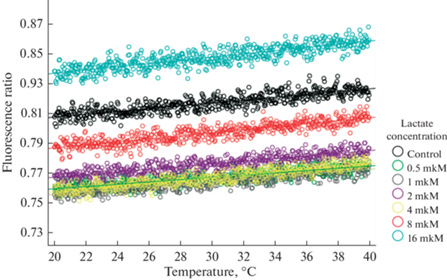
Сводка параметров построенных уравнений парной линейной регрессии, параметры качества моделей: коэффициенты детерминации и стандартные ошибки регрессий приведены в табл. 2. Все построенные модели статистически значимы и имеют приемлемое качество: коэффициенты детерминации в диапазоне от 0.70 до 0.77. Стандартные ошибки регрессий не превышают 4.06 × 10–3.
Таблица 2.
Сводная характеристика линейных моделей зависимости соотношения флуоресценций ГФД от температуры в диапазоне от 20 до 40°С при добавлении лактата в разных концентрациях
| Концентрация лактата | Константа, × 10–3 | Коэффициент регрессии, × 10–3 | Оценка качества моделей | |||
|---|---|---|---|---|---|---|
| b0 | SEb0 | b1 | SEb1 | R2 | SEregr × 0.001 | |
| Контроль | 789.1 | 0.77 | 0.95 | 0.025 | 0.72 | 3.43 |
| 0.5 мкМ | 744.7 | 0.65 | 0.76 | 0.021 | 0.70 | 2.88 |
| 1 мкМ | 739.7 | 0.66 | 0.84 | 0.022 | 0.73 | 2.93 |
| 2 мкМ | 749.9 | 0.69 | 0.89 | 0.022 | 0.74 | 3.04 |
| 4 мкМ | 739.3 | 0.67 | 0.94 | 0.022 | 0.77 | 2.95 |
| 8 мкМ | 767.2 | 0.75 | 1.01 | 0.025 | 0.76 | 3.32 |
| 16 мкМ | 815.8 | 0.92 | 1.08 | 0.030 | 0.70 | 4.06 |
Несмотря на то, что при визуальном анализе скаттерограмм линии регрессии кажутся параллельными, при статистическом анализе выявлены отличия в углах наклона по сравнению с контролем (рис. 3). Так, при концентрациях лактата 0.5 и 1 мкМ скорости нарастания соотношения флуоресценций (параметр регрессии b1) меньше, чем в контроле (0.76 ± 0.021 × 10–3 и 0.84 ± 0.022 × 10–3 по сравнению с 0.95 ± 0.025 × 10–3 (р < = 0.001), а при концентрации лактата 16 мкМ – наоборот, выше (b1 = 1.08 ± 0.030 × 10–3 (р < 0.001).
Рис. 3.
Углы наклона регрессионных уравнений роста соотношений флуоресценций при нагревании ГФД в диапазоне температуры от 20 до 40°С при добавлении лактата в разных концентрациях. Приведены регрессионные коэффициенты b1 и их 95% ДИ.
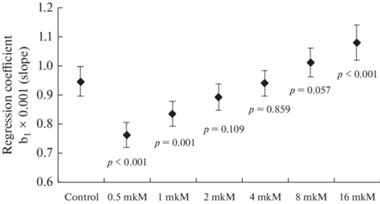
Проведенный эксперимент демонстрирует, что изменялась общая амплитуда сигнала флуоресценции в процессе нагревания фермента. Влияние лактата на соотношение флуоресценций различается в области низких (0.5 и 1 мкМ) и высоких (16 мкМ) концентраций. В физиологическом диапазоне температур при нагревании от 20 до 40°С происходит линейное повышение соотношения флуоресценций в среднем на 0.95 ± 0.024 × 10–3 на каждый градус нагрева (p < 0.001). Концентрации лактата 0.5 и 1 мкМ вызывают уменьшение соотношения флуоресценций и скорости его роста по сравнению с контролем, проявляя протекторное действие и формируя наиболее выгодное каталитически активное – свернутое состояние белка. Лактат (16 мкМ) вызывает увеличение соотношения флуоресценций и скорости его роста, что свидетельствует о развернутой конформации молекулы фермента и снижении термостабильности ГФД.
Методами компьютерного моделирования был раскрыт спектр биологической активности для лактата, а также охарактеризованы белки-партнеры по взаимодействию. Показано, что естественные интермедиаты являются промежуточными соединениями метаболизма, точками пересечения многих метаболических путей обмена углеводов, белков, липидов, выполняют вместе с тем координационную роль в функционировании и модуляции медиаторного, гормонального, рецепторного ответов, иммунологических, воспалительных, антибактериальных, противовирусных реакций. Методами дифференциальной сканирующей флуориметрии и микрокапиллярного термофореза нами был установлен факт взаимодействия ГФД с лактатом и показано наличие изменения конформационной стабильности фермента.
Мы считаем, что документирование и интерпретация взаимодействий между метаболитами и белками в биологическом контексте будут важны для оценки новых механизмов влияния лактата и иных метаболитов, образующихся в нейроваскулярной единице головного мозга, в норме и при патологии.
Список литературы
Li X, Wang X, Snyder M (2013) Systematic investigation of protein-small molecule interactions. IUBMB Life 65(1): 2–8.https://doi.org/10.1002/iub.1111Epub 2012 Dec 7
Gylmiyarova FN, Radomskaya VM, Gusyakova OA, Ryskina EA, Kolotyeva NA, Shahnovich EA, Nefedova NS, Baisheva GM, Pervova YY, Pleten AP (2015) Modeling role of pyruvate in the processes of protein-protein interaction. Biomed Chem 61(1): 132–140. https://doi.org/10.18097/pbmc20156101132
Xu Q, Dunbrack RL Jr (2020) ProtCID: a data resource for structural information on protein interactions. Nat Commun 5;11(1): 711. https://doi.org/10.1038/s41467-020-14301-4
Filimonov DA, Rudik AV, Dmitriev AV, Poroikov VV (2020) Computer-Aided Estimation of Biological Activity Profiles of Drug-Like Compounds Taking into Account Their Metabolism in Human Body. Int J Mol Sci 11; 21(20): 7492. https://doi.org/10.3390/ijms21207492
Zhang L, Gui X, Zhang X, Dai Y, Wang X, Tong X, Li S (2021) Endothelial Cell: Lactate Metabolic Player in Organ Regeneration. Front Cell Dev Biol 9: 701672. https://doi.org/10.3389/fcell.2021.701672
Zhang J, Muri J, Fitzgerald G, Gorski T, Gianni-Barrera R, Masschelein E, D’Hulst G, Gilardoni P, Turiel G, Fan Z, Wang T, Planque M, Carmeliet P, Pellerin L, Wolfrum C, Fendt SM, Banfi A, Stockmann C, Soro-Arnáiz I, Kopf M, De Bock K (2020) Endothelial Lactate Controls Muscle Regeneration from Ischemia by Inducing M2-like Macrophage Polarization. Cell Metab 2 31(6): 1136–1153. https://doi.org/10.1016/j.cmet.2020.05.004
Zhang M, Cheng X, Dang R, Zhang W, Zhang J, Yao Z (2018) Lactate Deficit in an Alzheimer Disease Mouse Model: The Relationship With Neuronal Damage. J Neuropathol Exp Neurol 1 77(12): 1163–1176. https://doi.org/10.1093/jnen/nly102
Zhang D, Tang Z, Huang H, Zhou G, Cui C, Weng Y, Liu W, Kim S, Lee S, Perez-Neut M, Ding J, Czyz D, Hu R, Ye Z, He M, Zheng YG, Shuman HA, Dai L, Ren B, Roeder RG, Becker L, Zhao Y (2019) Metabolic regulation of gene expression by histone lactylation. Nature 574(7779): 575–580. https://doi.org/10.1038/s41586-019-1678-1
Langston PK, Nambu A, Jung J, Shibata M, Aksoylar HI, Lei J, Xu P, Doan MT, Jiang H, MacArthur MR, Gao X, Kong Y, Chouchani ET, Locasale JW, Snyder NW, Horng T (2019) Glycerol phosphate shuttle enzyme GPD2 regulates macrophage inflammatory responses. Nat Immunol 20(9): 1186–1195. https://doi.org/10.1038/s41590-019-0453-7
Lu J, Xu Z, Duan H, Ji H, Zhen Z, Li B, Wang H, Tang H, Zhou J, Guo T, Wu B, Wang D, Liu Y, Niu Y, Zhang R (2020) Tumor-associated macrophage interleukin-β promotes glycerol-3-phosphate dehydrogenase activation, glycolysis and tumorigenesis in glioma cells. Cancer Sci 111(6): 1979–1990. https://doi.org/10.1111/cas.14408
Solier S, Müller S, Rodriguez R (2020) Whole-genome mapping of small-molecule targets for cancer medicine. Curr Opin Chem Biol 56: 42–50. https://doi.org/10.1016/j.cbpa.2019.12.005
Kuusk A, Boyd H, Chen H, Ottmann C (2020) Small-molecule modulation of p53 protein-protein interactions. Biol Chem 28; 401(8): 921–931. https://doi.org/10.1515/hsz-2019-0405
Колотьева НА, Потехина ВИ, Горбачева ИВ, Козлов АВ (2016) Лактат: есть ли тупик метаболизма? Наука молодых – Eruditio Juvenium 1: 28–32. [Kolotyeva NA, Potekhina VI, Gorbacheva IV, Kozlov AV (2016) Lactate: Is There A Stalemate Of Metabolism? Eruditio Juvenium 1: 28–32. (In Russ)].
Gilmiyarova F, Kolotyeva N, Radomskaya V, Gusyakova O, Gorbacheva I, Potekhina V (2016) Role of the Metabolic Minor Components in the Regulation of Intermolecular Interaction. J Biosci Med 4: 28–35. https://doi.org/10.4236/jbm.2016.47004
Tang F, Lane S, Korsak A, Paton JF, Gourine AV, Kasparov S, Teschemacher AG (2014) Lactate-mediated glia-neuronal signalling in the mammalian brain. Nat Commun 5: 3284. https://doi.org/10.1038/ncomms4284
Jin L, Wang W, Fang G (2014) Targeting protein-protein interaction by small molecules. Annu Rev Pharmacol Toxicol 54: 435–456. https://doi.org/10.1146/annurev-pharmtox-011613-140028
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


