Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 6, стр. 736-744
Изменение скоростных показателей мозгового кровотока крыс при старении
О. П. Горшкова *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: o_gorshkova@inbox.ru
Поступила в редакцию 02.04.2022
После доработки 03.05.2022
Принята к публикации 04.05.2022
- EDN: CNQEPF
- DOI: 10.31857/S0869813922060036
Аннотация
Старение сопровождается изменениями в структуре и функциональной активности церебральных сосудов, что может приводить к нарушению мозгового кровотока и повышенному риску развития нейродегенеративных процессов. В работе исследовали возрастные изменения скоростных показателей церебрального кровотока крыс методом ультразвуковой допплерографии. Проводили сравнительный анализ состояния кровотока коры и подкорковых структур полушарий головного мозга по величине линейных скоростей и индексов кровотока у крыс Спрег-Доули в возрасте 4 и 18 мес. Установлено, что к 18 мес. у крыс снижается уровень сопротивления сосудов головного мозга, на что указывает увеличение конечной диастолической скорости кровотока и уменьшение индекса пульсации. Одновременно наблюдается увеличение перфузии лобной и теменной областей полушарий головного мозга за счет повышения пиковых и средней за сердечный цикл скоростей кровотока, и происходит активация коллатеральных путей кровоснабжения, о чем свидетельствует снижение средней систолической скорости кровотока в лобной области полушарий. Эти изменения, вероятно, являются адаптивными проявлениями нарушения мозговой гемодинамики, направленными на поддержание адекватной перфузии ткани стареющего мозга.
Церебральный кровоток обеспечивает поддержание структурно-функциональной целостности мозга, обеспечивая адекватную доставку питательных веществ и кислорода в любое время и в любой участок головного мозга, избегая как гипоперфузии, так и гиперперфузии. Нормальное старение сопровождается значительными изменениями в структуре и функциональной активности церебральных сосудов, что может приводить к нарушению мозгового кровотока и повышенному риску развития нейродегенеративных процессов и цереброваскулярных заболеваний [1–3]. Важными количественными показателями мозговой гемодинамики, которые коррелируют с метаболизмом мозга в состоянии покоя, являются давление крови, сопротивление сосудов и скорость кровотока [4]. Имеющиеся в литературе данные, полученные на людях и различных экспериментальных животных, противоречивы и свидетельствуют как о возрастном уменьшении мозгового кровотока [2, 5–7], так и об отсутствии изменений скоростей и объемов потоков в мозговых артериях при старении [6, 8, 9]. Различия могут быть связаны с методологическими особенностями измерения скорости кровотока, видовыми или регионарными различиями и возрастом [8]. Целью данной работы было исследование возрастных изменений скоростных показателей церебрального кровотока у крыс методом ультразвуковой допплерографии. В задачи исследования входило проведение анализа состояния кровотока коры и подкорковых структур полушарий головного мозга по величине линейных скоростей и индексов кровотока у крыс линии Спрег-Доули в возрасте 4 и 18 мес.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на самцах крыс Спрег-Доули из ЦКП “Биоколлекция ИФ РАН” в возрасте 4 (n = 12, масса 380 ± 50 г) и 18 мес. (n = 11, масса 540 ± 80 г). Все процедуры, выполненные в исследовании с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и требованиям Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. До проведения эксперимента животные содержались в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
При проведении эксперимента крысы наркотизировались золетилом (внутрибрюшинно, 20 мг/кг, Virbac, Франция). Среднее артериальное давление (АД), измеренное с помощью прибора для неинвазивного измерения АД (“Систола”, Netrobotics, Россия) в хвостовой артерии, у наркотизированных крыс в возрасте 4 мес. составляло 129 ± 7 мм рт. ст., в возрасте 18 мес. – 136 ± 5 мм рт. ст.
Скорость мозгового кровотока измерялась через высверленное в теменной области черепа отверстие (S ≈ 1 см2) ультразвуковым компьютеризированным допплерографом ММ-Д-К (Minimax Doppler v.1.7, УЗДП-009-02, Россия) с рабочей частотой датчика 25 МГц. Датчик устанавливался на область измерения через проводящий гель без сдавливания поверхности измерения. Глубина прохождения ультразвукового сигнала для датчика данной частоты составляет порядка 3–4 мм, что обеспечивало исследование кровотока в коре и подкорковых структурах головного мозга крыс. Постановка датчика осуществлялась под углом не более 60 град., что соответствует наилучшему акустическому и визуальному допплеровскому сигналу. В основу метода допплерографии положена регистрация допплеровского сдвига частот, вызванного отражением ультразвукового сигнала от форменных элементов крови. Ультразвуковой допплерограф определяет направление движения и линейную скорость кровотока по срезу исследуемой ткани. Данные представляются на экране монитора в виде цветной допплерограммы. На основании полученной визуальной картины в режиме online можно анализировать все получаемые данные параметров кровотока и выбирать безартефактный фрагмент допплерограммы. По характерному звуковому сигналу и визуальному сигналу на мониторе прибора можно определить тип преобладающего кровотока. В наших исследованиях запись сигнала проводилась преимущественно с артериального участка сосудистой сети обоих полушарий головного мозга. Звуковой сигнал, получаемый с участка сосудистого русла преимущественно артериального наполнения, характеризуется пульсирующим тихим шумом, синхронизированным с фазами сердечного цикла; визуальный сигнал имеет в спектре систолические и диастолические пики.
Оценка состояния кровотока проводилась по данным спектрального анализа допплеровского сигнала. С помощью программного обеспечения допплерографа автоматически рассчитывались величины линейных скоростей кровотока (пиковой (Vps) и средней систолической (Vs), конечной (Vd) и средней диастолической (Vpd) и средней за сердечный цикл (Vm)). Также оценивались индексы кровотока: индекс пульсации (Гослинга), отражающий упруго-эластические свойства артерий (PI), индекс периферического сопротивления (Пурсело), отражающий состояние сопротивления кровотоку дистальнее места измерения (RI) и индекс Арбелли (STI), отражающий степень стеноза артерий [10, 11]:
PI = (Vps – Vd)/Vm, RI = (Vps – Vd)/Vps, STI = 0. 9(1 – Vd/Vs) × 100%.
Межполушарной асимметрии скоростей и индексов кровотока обнаружено не было.
Статистический анализ данных проводился с использованием пакета статистических программ Microsoft Excel 2019 и программы InStat 3.02 (GraphPad Software Inc., США). Проверка экспериментальных данных на нормальное распределение проводилась с использованием критерия Колмогорова–Смирнова. Сравнение средних данных независимых выборок при сравнении более 2 групп при нормальном характере распределения вариант в совокупности данных (выборке) проводилось при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке отличном от нормального при сравнении 2 групп использовался U-критерий Манна–Уитни. Если исследование на нормальность показывало его отсутствие хотя бы для одной выборки, статистический анализ полученных данных производился с использованием непараметрических методов. Данные в табл. 1 и на графиках представлены как медиана [25-й процентиль; 75-й процентиль]. Статистически значимыми считали различия при р < 0.05.
Таблица 1.
Параметры мозгового кровотока у крыс разного возраста
| Линейная скорость кровотока, см/с | Крысы в возрасте 4 мес. (n = 12) | Крысы в возрасте 18 мес. (n = 11) |
|---|---|---|
| Vps | 26.01 [15.03; 43.77] | 31.17 [21.89; 52.16]** |
| Vs | 0.51 [0.35; 0.71] | 0.42 [0.29; 0.51]* |
| Vm | 5.74 [2.13; 16.11] | 11.05 [4.33; 25.63]* |
| Vd | 1.46 [0.68; 2.89] | 2.47 [0.29; 5.63]* |
| Vpd | 0.08 [– 0.03; 0.18] | 0.06 [– 0.02; 0.18] |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У 18-месячных крыс по сравнению с более молодыми животными было отмечено увеличение пиковых скоростей кровотока: систолической (в среднем на 33.81%, p = 0.01, U = 700, критерий Манна–Уитни) и конечной диастолической (в среднем в 2 раза, p = 0.02, U = 532, критерий Манна–Уитни, табл. 1). Средняя за сердечный цикл скорость кровотока также была увеличена (в среднем на 70.72%, p = 0.02, U = 707, критерий Манна–Уитни, табл. 1).
Анализ скоростных параметров кровотока в различных участках полушарий головного мозга показал, что возрастные изменения наблюдаются только в лобной и теменной области полушарий. При старении в лобной области увеличивается пиковая систолическая (до 43.53 [21.89; 54.83] см/с по сравнению с 30.19 [19.34; 39.94] см/с у 4-месячных крыс), средняя за сердечный цикл (в среднем в 2 раза, p = 0.05, U = 612, критерий Манна–Уитни) и конечная диастолическая (до 2.67 [1.18; 5.66] см/с по сравнению с 1.61 [0.69; 2.62] см/с у крыс в возрасте 4 мес.) скорости кровотока (рис. 1). Показатели средней систолической скорости кровотока снижаются (0.53 [0.38; 0.98] см/с у крыс в возрасте 4 мес.; 0.45 [0.33; 0.61] см/с у крыс в возрасте 18 мес.) (рис. 1).
Рис. 1.
Показатели линейных скоростей кровотока в различных участках полушарий головного мозга: лобном (frontal), теменном (parietal) и затылочном (occipital). Темная заливка – крысы в возрасте 4 мес., белая заливка – крысы в возрасте 18 мес. Верхняя и нижняя граница каждого прямоугольника – первый и третий квартили (25-й и 75-й процентили) соответственно, поперечная линия внутри – медиана (50-й процентиль), крестик внутри – среднее арифметическое, концы отрезков 10-й и 90-й процентили, точки – выбросы. Различия значимы по сравнению с соответствующими значениями у крыс в возрасте 4 мес. (*p < 0.05, **p < 0.01, U – критерий Манна–Уитни).
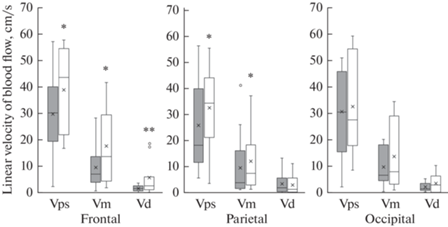
В теменной области полушарий головного мозга у животных в возрасте 18 мес. по сравнению с более молодыми крысами увеличиваются показатели пиковой систолической (в среднем на 25%, p = 0.03, U = 792, критерий Манна–Уитни) и средней за сердечный цикл (в среднем на 21.54%, p = 0.02, U = 1341, критерий Манна–Уитни) скоростей кровотока (рис. 1).
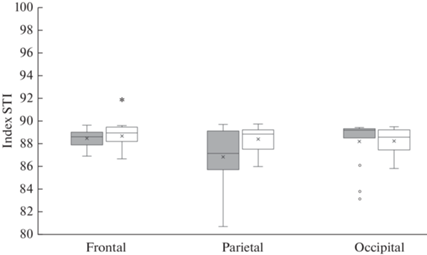
Старение не влияет на показатели индекса резистентности. В то же время в лобной и теменной области полушарий головного мозга у крыс в возрасте 18 мес. отмечается снижение показателя индекса пульсации в среднем на 20% (рис. 2). Индекс STI, отражающий степень стеноза артерий, изменяется только в лобном регионе – увеличивается в среднем на 5.69% (p = 0.02, U = 612, критерий Манна–Уитни) (рис. 3).
Рис. 2.
Показатели пульсационного индекса в различных участках полушарий головного мозга: лобном (frontal), теменном (parietal) и затылочном (occipital). Темная заливка – крысы в возрасте 4 мес., белая заливка – крысы в возрасте 18 мес. Различия значимы по сравнению с соответствующими значениями у крыс в возрасте 4 мес. (*p < 0.05, **p < 0.01 U – критерий Манна–Уитни). Остальные обозначения как на рис. 1.
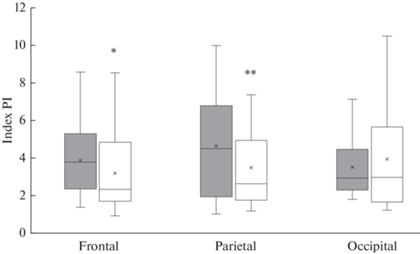
Рис. 3.
Показатели индекса STI в различных участках полушарий головного мозга: лобном (frontal), теменном (parietal) и затылочном (occipital). Темная заливка – крысы в возрасте 4 мес., белая заливка – крысы в возрасте 18 мес. Различия значимы по сравнению с соответствующими значениями у крыс в возрасте 4 мес. (*p < 0.05, U – критерий Манна–Уитни). Остальные обозначения как на рис. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование показало, что старение сопровождается изменением параметров кровотока в коре и подкорковых структурах головного мозга крыс. У 18-месячных крыс по сравнению с более молодыми животными отмечается увеличение пиковых и средней за сердечный цикл скоростей кровотока. Изменения церебрального кровотока при старении во многом связывают с возрастными нарушениями скорости метаболизма и атрофией головного мозга [8]. Установлено, что возрастная атрофия имеет региональную изменчивость и более заметна в лобных, височных и теменных областях [12, 13]. В нашем исследовании у крыс в возрасте 18 мес. изменение скоростных параметров кровотока наблюдалось в лобной и теменной области полушарий головного мозга, в то время как в затылочном регионе достоверных изменений этих показателей по сравнению с аналогичными значениями у 4-месячных животных обнаружено не было. В лобной и теменной области было отмечено увеличение пиковой систолической и средней за сердечный цикл скорости кровотока. Это может указывать на развитие возрастных стенозирующих процессов, связанных со снижением тонуса, сужением и разрежением церебрального микроциркулярного русла [1, 3, 14, 15]. В лобной области полушарий также наблюдалось повышение конечной диастолической скорости кровотока (в среднем в 2 раза) и индекса STI, отражающего степень стеноза артерий, что может свидетельствовать о большей выраженности стеноза артерий в данном регионе по сравнению с другими участками полушарий головного мозга. Сужение просвета сосудов в сочетании с высокими пиковыми скоростями кровотока указывает на гиперперфузию [16]. Однако наши данные не соответствуют результатам других исследователей, полученных на людях и экспериментальных животных и свидетельствующих об отсутствии [6, 8, 9] или уменьшении мозгового кровотока [2, 5–7] при старении. Такие противоречия могут быть связаны с видовыми или регионарными различиями, возрастом и наличием сопутствующей патологии [8]. Нельзя не учитывать и того, что отличия в получаемых результатах могут быть обусловлены методическими особенностями. В наших экспериментах регистрировалась линейная скорость мозгового кровотока, тогда как авторы некоторых из цитируемых работ [2, 7, 8] оценивали объемную скорость кровотока. Исследование объемной скорости кровотока с одной стороны позволяет в большей степени проводить оценку коллатерального кровоснабжения перфузируемой зоны, но в то же время использование такого методического подхода может снизить чувствительность обнаружения изменений мозгового кровотока [7, 17]. Также возможно, что обнаруженная нами гиперперфузия лобных и затылочных областей полушарий головного мозга у 18-месячных крыс предшествует развитию последующих гипоперфузионных нарушений мозгового кровотока. Для сохранения нормальной функции мозга большое значение имеет поддержание адекватной церебральной перфузии через плотную микроваскулярную сеть [18–20]. В настоящее время появляется все больше доказательств того, что старение вызывает многогранные функциональные нарушения в микроциркуляции головного мозга. Согласно гипотезе капиллярной дисфункции, на ранних этапах старения для поддержания адекватной оксигенации мозга необходимо увеличение мозгового кровотока [21]. Но длительная гиперперфузия приводит к повреждению сосудов микроциркулярного русла [22, 23], нарушению нормальной регуляции церебральной перфузии артериолами и развитию гипоперфузии.
Максимальная систолическая скорость кровотока в определенной мере отражает эластичность стенок исследуемых сосудов и зависит от многих переменных (величины артериального давления, вязкости крови и др.). Конечная диастолическая скорость кровотока определяет состояние периферического сосудистого русла, но оба этих параметра отражают кровоток в конкретный период сердечного цикла, не давая информации об истинной скорости кровотока в сосуде за весь период сердечного цикла. Наиболее полное представление о движении частиц крови в сосуде дают величины не максимальных, а средних скоростей потока, которые являются более чувствительным параметром [24], и показатели индексов кровотока, позволяющие судить о величине сосудистого сопротивления [11, 25]. Согласно полученным нами результатам, у животных в возрасте 18 мес. по сравнению с более молодыми крысами в лобной области полушарий головного мозга снижается средняя систолическая скорость кровотока. Такие изменения могут указывать на активацию при старении коллатеральных путей кровотока в этом участке мозга, необходимую для поддержания адекватной перфузии [26]. Старение не влияет на показатели индекса резистентности, в то же время в лобной и теменной областях полушарий головного мозга у крыс в возрасте 18 мес. снижается показатель пульсационного индекса (в среднем на 20%). Наряду с увеличением конечной диастолической скорости кровотока снижение пульсационного индекса может косвенно свидетельствовать о снижении сосудистого сопротивления и тонуса сосудов [16, 26, 27]. В основе данных изменений, вероятно, лежит возрастное нарушение ауторегуляции церебральных сосудов [3].
Таким образом, установлено, что в 18-месячном возрасте у крыс отмечаются проявления нарушения мозговой гемодинамики. На фоне снижения уровня сопротивления мозговых сосудов, на что указывает увеличение конечной диастолической скорости кровотока и уменьшение индекса пульсации, наблюдается активация механизмов, направленных на поддержание адекватной перфузии ткани мозга. Увеличивается перфузия лобной и теменной областей полушарий головного мозга за счет повышения пиковых и средней за сердечный цикл скоростей кровотока, и активируются коллатеральные пути кровоснабжения мозга, о чем свидетельствует снижение средней систолической скорости кровотока в лобной области полушарий.
Список литературы
Diaz-Otero JM, Garver H, Fink GD, Jackson WF, Dorrance AM (2016) Aging is associated with changes to the biomechanical properties of the posterior cerebral artery and parenchymal arterioles. Am J Physiol Heart Circ Physiol 310(3): H365–H375. https://doi.org/10.1152/ajpheart.00562.2015
Staffaroni AM, Cobigo Y, Elahi FM, Casaletto KB, Walters SM, Wolf A, Lindbergh CA, Rosen HJ, Kramer JH (2019) A longitudinal characterization of perfusion in the aging brain and associations with cognition and neural structure. Hum Brain Mapp 40(12): 3522–3533. https://doi.org/10.1002/hbm.24613
Toth P, Tarantini S, Csiszar A, Ungvari Z (2017) Functional vascular contributions to cognitive impairment and dementia: mechanisms and consequences of cerebral autoregulatory dysfunction, endothelial impairment, and neurovascular uncoupling in aging. Am J Physiol Heart Circ Physiol 312(1): H1–H20. https://doi.org/10.1152/ajpheart.00581.2016
Hshieh TT, Dai W, Cavallari M, Guttmann CR, Meier DS, Schmitt EM, Dickerson BC, Press DZ, Marcantonio ER, Jones RN, Gou YR, Travison TG, Fong TG, Ngo L, Inouye SK, Alsop DC; SAGE-S Study Group (2017) Cerebral blood flow MRI in the nondemented elderly is not predictive of post-operative delirium but is correlated with cognitive performance. J Cereb Blood Flow Metab 37(4): 1386–1397. https://doi.org/10.1177/0271678X16656014
Aanerud J, Borghammer P, Chakravarty MM, Vang K, Rodell AB, Jónsdottir KY, Møller A, Ashkanian M, Vafaee MS, Iversen P, Johannsen P, Gjedde A (2012) Brain energy metabolism and blood flow differences in healthy aging. J Cereb Blood Flow Metab 32(7): 1177–1187. https://doi.org/10.1038/jcbfm.2012.18
Nemati M, Bavil AS, Taheri N (2009) Comparison of normal values of Duplex indices of vertebral arteries in young and elderly adults. Cardiovasc Ultrasound 7: 2. https://doi.org/10.1186/1476-7120-7-2
Zhang N, Gordon ML, Goldberg TE (2017). Cerebral blood flow measured by arterial spin labeling MRI at resting state in normal aging and Alzheimer’s disease. Neurosci Biobehav Rev 72: 168–175. https://doi.org/10.1016/j.neubiorev.2016.11.023
Claassen JAHR, Thijssen DHJ, Panerai RB, Faraci FM (2021) Regulation of cerebral blood flow in humans: physiology and clinical implications of autoregulation. Physiol Rev 101(4): 1487–1559. https://doi.org/1010.1152/physrev.00022.2020
Yazici B, Erdogmus B, Tugay A (2005) Cerebral blood flow measurements of the extracranial carotid and vertebral doppler ultrasonography in healthy adults. Diagn Interv Radiol 11: 195–198.
Вознюк ИА, Полушин АЮ, Степанов ЕА (2013) Колличественная оценка ультразвуковых параметров мозгового кровотока (значение и норма). Регионарн кровообращ и микроциркул 12(4): 30–40. [Voznyuk IA, Polushin AYu, Stepanov EA (2013) Quantitative estimation of the parameters of ultrasonic cerebral blood flow (value and norm). Region Blood Circulat and Microcircul 12(4): 30–40. (In Russ)].
Lee MY, Wu CM, Chu CS, Lee KT, Sheu SH, Lai WT (2008) Association of carotid hemodynamics with risk of coronary heart disease in a Taiwanese population with essential hypertension. Am J Hypertens 21(6): 696–700. https://doi.org/10.1038/ajh.2008.160
Mander BA, Rao V, Lu B, Saletin JM, Lindquist JR, Ancoli-Israel S, Jagust W, Walker MP (2014) Prefrontal atrophy, disrupted NREM slow waves and impaired hippocampal-dependent memory in aging. Nat Neurosci 16: 357–364. https://doi.org/10.1038/nn.3324
Oh H, Madison C, Villeneuve S, Markley C, Jagust WJ (2014) Association of gray matter atrophy with age, β-amyloid, and cognition in aging. Cereb Cortex 24: 1609–1618. https://doi.org/10.1093/cercor/bht017
Sokolova IB, Sergeev IV, Fedotova OR, Dvoretskii DP (2014) Age-related changes of microcirculation in pial blood vessels of the sensorimotor cortex of the rat brain. Advanc Gerontol 4(2): 145–149. https://doi.org/10.1134/S207905701402012X
Sonntag WE, Lynch C, Thornton P, Khan A, Bennett S, Ingram R (2000) The effects of growth hormone and IGF-1 deficiency on cerebrovascular and brain ageing. J Anat 197(4): 575–585. https://doi.org/10.1046/j.1469-7580.2000.19740575.x
Heyer EJ, Mergeche JL, Connolly ES Jr (2014) Middle cerebral artery pulsatility index and cognitive improvement after carotid endarterectomy for symptomatic stenosis. J Neurosurg 120(1): 126–131. https://doi.org/10.3171/2013.8.JNS13931
Dahl A, Russell D, Nyberg-Hansen R, Rootwelt K, Bakke SJ (1994) Cerebral vasoreactivity in unilateral carotid artery disease. A comparison of blood flow velocity and regional cerebral blood flow measurements. Stroke 25(3): 621–626. https://doi.org/10.1161/01.str.25.3.621
De Silva TM, Faraci FM (2016) Microvascular dysfunction and cognitive impairment. Cell Mol Neurobiol 36: 241–258. https://doi.org/10.1007/s10571-015-0308-1
Iadecola C (2010) The overlap between neurodegenerative and vascular factors in the pathogenesis of dementia. Acta Neuropathol 120: 287–296. https://doi.org/10.1007/s00401-010-0718-6
Wang N, Allali G, Kesavadas C, Noone ML, Pradeep VG, Blumen HM, Verghese J (2015) Cerebral small vessel disease and motoric cognitive risk syndrome: results from the Kerala–Einstein Study. J Alzheimers Dis 50: 699–707. https://doi.org/10.3233/JAD-150523
Wierenga CE, Hays CC, Zlatar ZZ (2014) Cerebral blood flow measured by arterial spin labeling MRI as a preclinical marker of Alzheimer’s disease. J Alzheimers Dis 42: S411–S419. https://doi.org/10.3233/JAD-141467
Ghaffari M, Alaraj A, Du X, Zhou XJ, Charbel FT, Linninger AA (2018). Quantification of near-wall hemodynamic risk factors in large-scale cerebral arterial trees. Int J Numer Method Biomed Eng 34(7): e2987. https://doi.org/10.1002/cnm.2987
O’Rourke MF, Safar ME (2005) Relationship between aortic stiffening and microvascular disease in brain and kidney: cause and logic of therapy. Hypertension 46: 200–204. https://doi.org/10.1161/01.HYP.0000168052.00426.65
Невзорова ВА, Шуматов ВБ, Настрадин ОВ, Захарчук НВ (2012) Состояние функции сосудистого эндотелия у лиц с факторами риска и больных ишемической болезнью сердца. Тихоокеанск мед журн 2: 37–44. [Nevzorova VA, Shumatov VB, Nastradin OV, Zakharchuk NV (2012) The state of vessel endothelium in patients with risk factors and ischemic heart disease. Pacific Med J 2: 37–44. (In Russ)].
Soinne L, Helenius J, Tatlisumak T, Saimanen E, Salonen O, Lindsberg PJ, Kaste M (2003) Cerebral hemodynamics in asymptomatic and symptomatic patients with high-grade carotid stenosis undergoing carotid endarterectomy. Stroke 34(7): 1655–1661. https://doi.org/10.1161/01.STR.0000075605.36068.D9
Guan J, Zhang S, Zhou Q, Li C, Lu Z (2013) Usefulness of transcranial Doppler ultrasound in evaluating cervical-cranial collateral circulations. Interv Neurol 2(1): 8–18. https://doi.org/10.1159/000354732
Albina G, Fernandez Cisneros L, Laiño R, Nobo UL, Ortega D, Schwarz E, Barja L, Lagos R, Giniger A, Ameriso SF (2004) Trancranial Doppler monitoring during head upring tilt table testing in patient with suspected neurocardiogenie syncope. Europace 6(1): 63–69. https://doi.org/10.1016/j.eupc.2003.09.009
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


