Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 6, стр. 725-735
Расчетный индекс на основе уровней активности изоформ бутирилхолинэстеразы для подтверждения диагноза мягкого когнитивного снижения
Д. И. Козлова 1, *, В. В. Хижа 1, Л. В. Аносова 2, А. А. Королькова 3, Д. С. Васильев 1, А. В. Рыбаков 4, К. В. Пахомов 1, А. Б. Шишкин 5, С. В. Сумина 5, М. Ф. Баллюзек 5
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи МЗ РФ
Санкт-Петербург, Россия
3 Национальный медицинский исследовательский центр им. В.А. Алмазова МЗ РФ России
Санкт-Петербург, Россия
4 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
5 Санкт-Петербургская клиническая больница РАН
Санкт-Петербург, Россия
* E-mail: di.kozlova.official@gmail.com
Поступила в редакцию 12.04.2022
После доработки 29.04.2022
Принята к публикации 04.05.2022
- EDN: LUWWOC
- DOI: 10.31857/S086981392206005X
Аннотация
В существующей клинической практике диагноз мягкого когнитивного снижения ставится на основе опроса пациента по мини-тесту оценки психического состояния (Mini-Mental State Examination – MMSE) и шкале оценки болезни Альцгеймера (The Alzheimer’s Disease Assessment Scale – Cognitive Subscale – ADAS-cog), которые обладают высокой степенью субъективизма и не дают полноценного представления о состоянии здоровья пациента. Нами проведена оценка эффективности использования диагностического индекса на основе активности холинэстераз плазмы крови для подтверждения или опровержения диагноза мягкого когнитивного снижения амнестического типа. В исследовании приняли участие 69 человек: 36 пациентов с диагнозом мягкого когнитивного снижения амнестического типа (а-МКС) и 33 здоровых добровольца. Диагноз а-МКС ставили при наборе менее 28 баллов по MMSE и более 2 баллов по ADAS-cog. В стационаре производили забор крови и выделение плазмы у пациентов обеих групп. На полученном биоматериале определяли активность форм бутирилхолинэстеразы с использованием метода Эллмана в сочетании с ингибиторным анализом. Полученные данные активности атипичной и минорных форм использовали для расчета индекса, отражающего факт наличия или отсутствия у пациента диагноза а-МКС. Были определены диагностические интервалы, характерные для пациентов с а-МКС и здоровых добровольцев. Сравнение распределения показателей расчетного индекса по категориям диагноза осуществляли с помощью критерия χ-квадрат с поправкой Йейтса в пакете статистических программ SPSS 22. Результаты исследования показали, что диагностика на основе индекса соотношения активностей атипичной и минорной изоформ по чувствительности и специфичности не уступает стандартным диагностическим шкалам, одновременно является перспективным, малоинвазивным, быстрым и бюджетным способом лабораторного подтверждения диагноза а-МКС. Предлагаемый в данной статье расчетный диагностический индекс основан на данных лабораторного исследования активности атипичной и минорных изоформ бутирилхолинэстеразы плазмы крови пациентов с предварительным диагнозом а-МКС, что впервые дает возможность подтвердить диагноз лабораторным методом, избегая субъективности.
Характерной чертой современного общества большинства стран мира является старение населения. В связи с этим заболевания, связанные с возрастом, приобретают все большее значение для здравоохранения и общества в целом. Расстройства познавательных функций, в частности, синдром мягкого когнитивного снижения амнестического типа (а-МКС), являются наиболее распространенной причиной старческой деменции. а-МКС представляет собой начальную стадию развития когнитивного дефицита по пути формирования такого нейродегенеративного заболевания, как болезнь Альцгеймера (БА). Постановка диагноза а-МКС пациентам производится на основании оценки их когнитивных функции в соответствии с диагностическими критериями синдрома MKC [1] по шкале общего ухудшения когнитивных функций (Global Deterioration Scale – GDS [2]) и мини-тесту оценки психического состояния (Mini-Mental State Examination – MMSE [1]). Однако на ранних стадиях заболевания данные индексы и шкалы обладают низкой чувствительностью и специфичностью, а также большой долей субъективизма, что не всегда позволяет своевременно поставить диагноз. Результатом является отсроченное применение необходимых лекарственных препаратов, что снижает их эффективность и приводит к необходимости применения более тяжелых и токсичных препаратов.
Таким образом, информативность традиционных критериев оценки наличия а-МКС недостаточна. Это делает актуальным поиск и внедрение в клиническую практику новых методов, в частности, лабораторной диагностики, дополняющих клинические шкалы и позволяющих своевременно диагностировать заболевание и корректировать ход лечения, ориентируясь на лабораторные показатели плазмы крови. В качестве таких перспективных биомаркеров нами в данной статье рассмотрена активность форм бутирилхолинэстеразы (БХЭ) плазмы крови.
Известно, что при постепенном развитии а-МКС происходит постоянно усиливающийся распад памяти и других когнитивных функций, который в терминальной стадии приобретает катастрофические масштабы [3]. Нарушение функционирования холинэргической системы мозга характерно для БА, что также сопровождается изменениями функционирования холинэстераз в периферической крови [4–8]. В процессе развития БА активность ацетилхолинэстеразы (АХЭ) в мозге снижается, тогда как активность БХЭ возрастает. Параллельно показано, что общая удельная активность данного фермента значительно снижена в плазме крови как в контрольной группе пожилых людей, так и при БА [9]. В проведенных нами ранее исследованиях было показано, что общая активность БХЭ плазмы крови пациентов с диагнозом а-МКС ниже активности данного фермента плазмы крови пациентов контрольной группы на 17%, а при БА – на 38% процентов [10].
БХЭ содержится в различных тканях млекопитающих: в печени, сердце, эндотелии сосудов, нервной системе и плазме крови. Характерной особенностью данного фермента является отсутствие субстратного торможения. Генетические варианты этого фермента обладают различной чувствительностью ко многим обратимым и необратимым ингибиторам [11–19]. В популяции преобладает типичная форма БХЭ (т-БХЭ), а активность всех остальных семидесяти генетических вариантов либо ниже, либо отсутствует полностью (S-вариант). Показано, что у пациентов, несущих один из минорных генетических вариантов БХЭ в позднем возрасте в 2 раза увеличен риск заболевания БА [20]. Нами были выбраны следующие формы фермента, как наиболее перспективные с позиции оценки вклада в изменение общей активности: типичная (т-БХЭ), атипичная (а-БХЭ) и минорные (ми-БХЭ). Предпочтение типичной форме БХЭ было отдано потому, что она является преобладающей формой фермента, атипичная форма выбрана, поскольку также часто встречается в популяции и у некоторых людей может выступать в качестве основной формы БХЭ, что приводит к высокой чувствительности таких людей к анестетикам и миорелаксантам. Минорные формы в данной статье – это совокупность остальных вариантов БХЭ, поскольку в настоящее время отсутствует возможность разделить их по критерию активности. Выбранные изоформы БХЭ имеют разную чувствительность к ингибиторам (сукцинилхолин, хлорид суксаметония, тизанидин, этопропазин и т.д.), что позволяет определить отдельно активность т- и а-БХЭ, а также суммарную активность ми-БХЭ.
Целью данного исследования явилась оценка эффективности использования диагностического индекса на основе активности БХЭ плазмы крови для подтверждения или опровержения диагноза мягкого когнитивного снижения амнестического типа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Нами были обследованы 69 человек: 36 пациентов с диагнозом а-МКС (основная группа) и 33 пациента без нарушений внимания и памяти, составивших группу контроля (КГ). Все процедуры, выполненные в исследованиях с участием людей, соответствуют этическим стандартам национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. Протокол исследования получил одобрение независимого этического комитета ФГБУЗ Санкт-Петербургской клинической больницы Российской академии наук (протокол № 240а от 20.01.2020 г.). Всеми пациентами было подписано добровольное информированное согласие на участие в данном исследовании.
Критериями включения пациентов в исследование было соответствие следующим диагностическим критериям синдрома MКC [1]: 1) наличие жалоб на снижение памяти и объективно выявляемые признаки легкого когнитивного снижения по результатам тестов; 2) оценка в диапазоне от 26 до 30 баллов по мини-тесту оценки психического состояния (Mini-MentalStateExamination – MMSE [1]); 3) повышение показателя до 2 баллов по шкале оценки болезни Альцгеймера (ADAS-cog) [21]. В данное исследование включались только пациенты с MКC амнестического типа. Критериями невключения в обеих группах являлись: отказ пациента от участия в исследовании; наличие любой активной инфекции в период включения в исследование; наличие онкологических заболеваний в период включения в исследование; наличие аутоиммунных заболеваний; наличие хронических неинфекционных заболеваний в стадии декомпенсации; наличие мягкого когнитивного снижения сосудистого типа.
Забор крови у пациентов для анализа активности ферментов проводили в вакуумные пробирки с антикоагулянтом (Li-гепарин). Полученные образцы крови центрифугировали при 2000 g в течение15 мин, а затем надосадочную жидкость (плазму) повторно центрифугировали при 9000 g 20 мин.
Определение активности изоформ БХЭ плазмы крови осуществляли по методу Эллмана [22] в комбинации с ингибиторным анализом [23] в 96-луночных планшетах в присутствии синтетического субстрата бутирилтиохолина (БТХ, 100 мМ; “Sigma”, Великобритания) и ингибиторов (хлорида суксаметония, тизанидина и этопропазина). Оптическую плотность измеряли на планшетном спектрофотометре (Immuno Chem-2100, Microplate Reader, США) при длине волны 405 нм. Полученные с прибора данные оптической плотности использовали для расчета удельной активности фермента (нмоль БТХ/мг белка × мин). Количество белка в пробе нормировалось по методу Бредфорда [24]. Метод Эллмана без применения ингибиторов позволяет определять общую удельную активность БХЭ, тогда как применение различных ингибиторов (суксаметония хлорида, тизанидина и этопропазина) дает возможность отделить активности типичной и атипичной форм от суммарной удельной активности минорных форм. На основании соотношения активности атипичной и минорной форм БХЭ рассчитывали индекс и проводили определение диагностических интервалов на основании предварительных анализов показателей контрольной группы (n = 36). Контрольные значения сопоставляли с данными, полученными ранее и использованными для написания патента № 033 501 “Способ дифференциальной диагностики ранней или выраженной стадии ревматоидного артрита с остеоартритом”, в котором была проанализирована активность форм БХЭ у пациентов с диагнозом ревматоидного артрита (РА) и контрольной группы здоровых доноров [23]. Данные пациентов контрольной группы позволили определить границы диагностических интервалов нормы, применяемые в данном исследовании.
Статистическая обработка данных
Расчет оптимального размера выборок проводился на основе заранее проведенного пилотного эксперимента с использованием программы K.M. Sullivan (http://www.openepi.com/SampleSize/SSPropor.htm). Сравнение распределения пациентов по категориям диагноза осуществляли с помощью критерия χ-квадрат с поправкой Йейтса в пакете статистических программ SPSS 22. Для каждого из 3 критериев (соотношение активностей а-БХЭ/ми-БХЭ vs ADAS vs MMSE) определяли специфичность и чувствительность метода. Специфичность определялась как доля истинно отрицательных случаев, выраженная в процентах от общего количества отрицательных диагнозов, а чувствительность – как доля истинно положительных случаев, выраженная в процентах от общего количества положительных диагнозов МКС.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Средний возраст пациентов с диагнозом а-МКС составил 56 ± 21 год, 12 мужчин и 24 женщины; группа контроля включала 18 мужчин и 15 женщин в возрасте 51 ± ± 23 года. Демографические характеристики групп статистически значимо не различались.
В группе пациентов с а-MКC медиана длительности заболевания составила 7 (1; 10) лет. Пациенты из группы а-MКC имели незначительные, но статистически достоверные изменения когнитивных функций по сравнению с контролем, которые выражались в снижении по шкале MMSE до 28.15 ± 0.82 балла и повышении показателя ADAS-cog до 2 баллов (табл. 1).
Таблица 1.
Клиническая характеристика пациентов, включенных в исследование
| Этап заболевания | Средний возраст, годы | MMSE, баллы | ADAS-cog, баллы |
|---|---|---|---|
| Контрольная группа (n = 33) | |||
| – | 51 ± 23 | 31.05 ± 0.01 | 1.00 ± 0.00 |
| Мягкое когнитивное снижение амнестического типа (n = 36) | |||
| Додементный | 56 ± 21 | 28.15 ± 0.82 | 2.00 ± 0.00* |
С помощью диагностических критериев ADAS и MMSE клиницистами было поставлено 33 диагноза “здоров” (КГ) и 36 диагнозов “а-МКС”.
В ходе лабораторного исследования плазмы крови по определению удельной активности разных форм БХЭ показано, что у пациентов обеих обследованных групп наибольшую активность имеет т-БХЭ, тогда как активность а-БХЭ и ми-БХЭ ниже в среднем на 63 и 58% соответственно. При этом у пациентов с диагнозом а-МКС активность всех исследованных изоформ фермента достоверно ниже относительно контрольной группы условно здоровых доноров (рис. 1).
Рис. 1.
Удельная активность изоформ БХЭ (BChE) в плазме крови пациентов с диагнозом а-МКС и пациентов без нарушения внимания и памяти (КГ). * – обозначены статистически значимые различия удельной активности т-БХЭ (t-BChE) между КГ и а-МКС, # – обозначены статистически значимые различия удельной активности а-БХЭ (a-BChE) между КГ и а-МКС; ° – обозначены статистически значимые различия удельной активности ми-БХЭ (mi-BChE) между КГ и а-МКС (р ≤ 0.001).
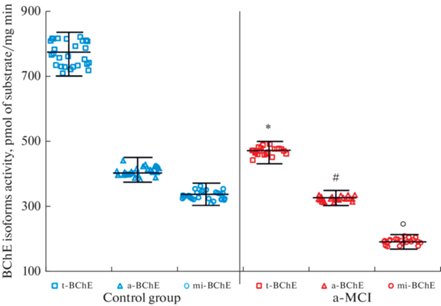
Двухфакторный анализ полученных данных показал, что различия средних значений активности разных форм БХЭ у пациентов с а-МКС и контрольной группы больше, чем можно было бы ожидать случайно, и при статистически значимой разнице (р ≤ 0.001).
Более того, выявлено, что у пациентов с диагнозом а-МКС на фоне снижения активности БХЭ меняется и вклад ее изоформ в общую активность. Так, на фоне снижения показателей удельной активности изоформ БХЭ, вклад активности атипичной формы возрастает (рис. 2).
Рис. 2.
Вклад активности типичной (т-БХЭ, голубой сектор), атипичной (а-БХЭ, желтый сектор) и минорных форм (ми-БХЭ, красный сектор) в общую активность БХЭ плазмы крови. a – пациенты без нарушений внимания и памяти. b – пациенты с диагнозом а-МКС. Данные представлены в % от общей активности. Различия вклада удельной активности каждой формы БХЭ между КГ и а-МКС статистически значимы (р ≤ 0.001).
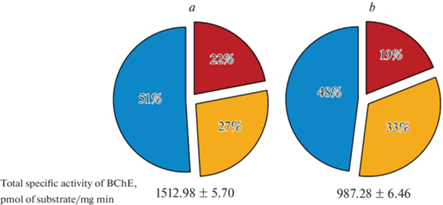
В среднем по обеим группам пациентов удельная активность а- и ми-БХЭ ниже удельной активности т-БХЭ на 39 и 58% соответственно.
Использование показателей удельной активности изоформ БХЭ неудобно для целей клинической и лабораторной диагностики. В связи с этим была предпринята разработка расчетного коэффициента на основе соотношения активности наиболее информативных изоформ БХЭ и определение диагностических интервалов, которые обладают наибольшей предсказательной силой при постановке диагноза а-МКС.
Рис. 3.
Сравнение диаграмм, полученных на основе тестирования исследуемых групп пациентов по шкале MMSE и с использованием разработанного диагностического индекса. а – разброс показателей в исследуемых группах по шкале MMSE; b – разброс показателей по индексу на основе расчета соотношения активности а-БХЭ (a-BChE) и ми-БХЭ (mi-BChE). Данные представлены как Ме ± SEM. * – статистически значимые различия между группой контроля и пациентами с диагнозом а-МКС при р < 0.0001.
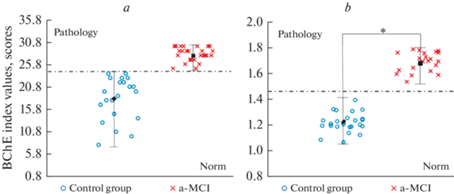
В результате проведенного анализа было показано, что наибольшую предсказательную силу имеет отношение активности атипичной формы БХЭ к ее минорным формам. В соответствии с выбранным подходом диагностический интервал группы условно здоровых доноров находится в пределах от 0 до 1.5, тогда как для а-МКС от 1.6 до 2.5.
По специфичности предложенная нами лабораторная диагностика на основе диагностического индекса на 94.6% соответствует существующим критериям ADAS и MSSE и в настоящий момент не имеет аналогов в мировой практике.
В ходе проведенного исследования абсолютно все случаи позитивного диагноза а-МКС на основе анализа БХЭ плазмы крови подтвердились результатами диагностики по ADAS и/или MSSE, при этом случаи постановки ложно позитивного диагноза отсутствовали. Это позволяет сделать вывод, что предлагаемая методика обладает достаточно высокой специфичностью к обнаружению а-МКС (табл. 2).
Таблица 2.
Распределение пациентов по категориям диагноза
| Диагноз | Истинно- позитивных | Истинно- негативных | Ложно- позитивных | Ложно- негативных | Чувствительность, % | Специфичность, % |
|---|---|---|---|---|---|---|
| ADAS | 36 | 33 | 0 | 0 | – | – |
| MSSE | 36 | 33 | 0 | 0 | – | – |
| Индекс а-БХЭ/ми-БХЭ | 30 | 33 | 0 | 6 | 84.6 | 100 |
На основе полученных данных можно сделать заключение, что предложенная нами диагностика с использованием ингибиторного анализа активности разных форм БХЭ плазмы крови диагностирует только доподлинно больных и пригодна для использования в тех случаях, когда лечение больного связано с серьезными побочными эффектами и гипердиагностика пациентов нежелательна. Более того, этот показатель может быть информативным и для ранней оценки развития а-МКС.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из литературных данных известно, что основная функциональная роль в работе холинэргической системы мозга принадлежит АХЭ, тогда как функцией БХЭ является дублирование роли АХЭ в условиях функциональной недостаточности последней [25]. АХЭ в головном мозге экспрессируется как в холинэргических нейронах, так и в тех, где отсутствуют какие-либо маркеры холинэргической нейротрансмиссии [26, 27]. БХЭ локализуется главным образом в глиальных клетках, а в нейронах и эндотелиальных клетках капилляров ее концентрации минимальны. Многочисленные исследования посвящены изучению роли АХЭ в патогенезе БА в связи с тем, что она занимает главенствующее положение в головном мозге по сравнению с БХЭ. Однако в последнее десятилетие все больше внимания уделяется роли БХЭ в формировании патологических изменений характерных как для БА, так и для предполагаемой промежуточной стадии ее развития – а-МКС [28–32]. В частности, известно, что БХЭ влияет на развитие БА, но не сама по себе, а при наличии аполипопротеина E epsilon 4 (АроЕε4) [33]. Проведенные нами ранее исследования удельной активности данного фермента в плазме крови пациентов с диагнозами а-МКС, БА и контрольной группы доноров показали, что этот параметр позволяет дифференцировать оба состояния друг от друга и от пациентов без нарушения внимания и памяти [10]. Однако полученные предварительные данные не дали ответ на вопрос за счет снижения или изменения соотношения активности каких форм происходит уменьшение общей активности БХЭ. Кроме того, сам по себе показатель активности неудобен для применения в рамках клинической лабораторной диагностики, и его сложно включить в существующие диагностические шкалы. Данные факты послужили предпосылками проведения публикуемого в данной статье исследования, посвященного определению активности изоформ БХЭ и разработке расчетного индекса, основанного на их соотношении, в качестве возможной диагностической стратегии для лабораторного подтверждения диагноза а-МКС. Результаты проведенного исследования позволили продемонстрировать, что у пациентов с а-МКС происходит статистически значимое снижение активности всех проанализированных изоформ БХЭ по сравнению с пациентами без выраженных нарушений внимания и памяти.
Сопоставительный анализ различных комбинаций соотношения т-, а- и ми-БХЭ показал, что наибольшую предсказательную силу для подтверждения диагноза а-МКС имеет отношение активности атипичной БХЭ к ее минорным формам.
Важно отметить, что предпочтение атипичной форме было отдано потому, что на фоне снижения удельной активности БХЭ при а-МКС ее вклад в общую активность возрастает, тогда как вклад типичной и минорной изоформ снижается. Это дало нам возможность предположить компенсаторную функцию а-БХЭ при снижении активности т-БХЭ на фоне развития когнитивного дефицита. Минорные формы БХЭ были выбраны, поскольку при применении лекарственных препаратов для купирования симптомов развивающегося а-МКС угнетается активность как типичной, так и, в меньшей степени, атипичной форм [29], тогда как сведений о подавлении активности минорных форм нет.
Диапазон полученного на основе соотношения активностей двух выбранных изоформ диагностического индекса для контрольной группы пациентов составил от 0 до 1.5, тогда как для группы пациентов с диагнозом а-МКС – от 1.6 до 2.5, что позволило различить пациентов этих двух групп. В 94.6% случаев постановки диагноза а-МКС по расчетному индексу на основе БХЭ совпадали с диагнозами, поставленными по ADAS и MSSE. В отличие от диагностических шкал когнитивной функции, данный индекс основан на лабораторных показателях активности изоформ БХЭ плазмы крови пациентов и позволяет быстро проводить скрининговые обследования широких групп населения с целью выявления а-МКС даже до проведения тестирования с использованием шкал на приеме у профильного специалиста.
Диагностический индекс на основе соотношения активности атипичной и минорных изоформ БХЭ плазмы крови позволяет достаточно точно подтверждать наличие а-МКС. Результаты исследования представляют большой практический интерес для внедрения в клиническую лабораторную диагностику. Разработанная на основе данного исследования диагностическая тест-система обладает небольшой себестоимостью в производстве, при этом позволяет производить одновременное тестирование образцов, полученных от 32 пациентов. Для проведения исследования требуется небольшой объем крови (1 мл), что имеет большое значение при работе с пациентами, находящимися на стационарном обследовании, постоянно проходящими процедуру забора больших объемов крови на различные исследования.
Предлагаемый диагностический индекс является единственным в своем роде лабораторным критерием подтверждения диагноза а-МКС, обладающим высокой чувствительностью и специфичностью. Он не заменяет собой имеющиеся диагностические шкалы, а лишь дополняет их, позволяя с большей уверенностью устанавливать диагноз и наиболее эффективно подбирать лечение.
Список литературы
Folstein M, Folstein S, McHugh P (1975) Mini-Mental State. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 2: 189–198. https://doi.org/10.1016/0022-3956(75)90026-6
Reisberg B, Ferris SH, de Leon MJ, Crook T (1982) The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry 139(9): 1136–1139. https://doi.org/10.1176/ajp.139.9.1136
Cloutier S, Chertkow H, Kergoat MJ, Gauthier S, Belleville S (2015) Patterns of Cognitive Decline Prior to Dementia in Persons with Mild Cognitive Impairment. J Alzheimer’s Dis 47(4): 901–913. https://doi.org/10.3233/JAD-142910
Johansson P, Almqvist EG, Johansson JO, Mattsson N, Andreasson U, Hansson O, Wallin A, Blennow K, Zetterberg H, Svensson J (2013) Cerebrospinal Fluid (CSF) 25-Hydroxyvitamin D Concentration and CSF Acetylcholinesterase Activity Are Reduced in Patients with Alzheimer’s Disease. PloS One 8(11): e81989. https://doi.org/10.1371/journal.pone.0081989
Karami A, Darreh-Shori1 T, Schultzberg M, Eriksdotter M (2021) CSF and Plasma Cholinergic Markers in Patients With Cognitive Impairment. Front Aging Neurosci 13. https://doi.org/10.3389/fnagi.2021.704583
Rinne J, Kaasinen V, Järvenpää T, Någren K, Roivainen A, Yu M, Oikonen V, Kurki T (2003) Brain acetylcholinesterase activity in mild cognitive impairment and early Alzheimer’s disease. J Neurol Neurosurg & Psych 74: 113–115. https://doi.org/10.1136/jnnp.74.1.113
Schliebs R, Arendt T (2011) The cholinergic system in aging and neuronal degeneration. Behav Brain Res 221: 555–563. https://doi.org/10.1016/j.bbr.2010.11.058
Журавин ИА, Васильев ДС, Дубровская НМ, Козлова ДИ, Кочкина ЕГ, Плеснева СА, Туманова НЛ, Алексеева ОС, Ветош АН, Наливаева НН (2014) Изучение механизмов когнитивных дисфункций с использованием модели пренатальной гипоксии. В кн.: Нейродегенеративные заболевания – от генома до целостного организма. Под ред МВУгрюмова. М. Научный мир. 419–437. [Zhuravin IA, Vasilev DS, Dubrovskaya NM, Kozlova DI, Kochkina EG, Plesneva SA, Tumanova NL, Alekseeva OS, Vetosh AN, Nalivaeva NN (2014) Measurement of cognitive dysfunctions using models of prenatal hypoxia. In: Neurodegenerative diseases – from the genome of a rich organism. Ed. MV Ugryumov. M. Scientific World Publishing House 419–437. (In Russ)].
Josviak ND, Batistela MS, Souza RKM, Wegner NR, Bono GF, Sulzbach CD, Simão-Silva DP, Piovezan MR, Souza RLR, Furtado-Alle L (2017) Plasma butyrylcholinesterase activity: a possible biomarker for differential diagnosis between Alzheimer’s disease and dementia with Lewy bodies? Int J Neurosci 127(12): 1082–1086. https://doi.org/10.1080/00207454.2017.1329203
Журавин ИА, Наливаева НН, Козлова ДИ, Кочкина ЕГ, Федорова ЯБ, Гаврилова СИ (2015) Активность холинэстераз и неприлизина плазмы крови как потенциальные биомаркеры синдрома мягкого когнитивного снижения и болезни Альцгеймера. Журн неврол психиатр им СС Корсакова 115(12): 110–117. [Zhuravin IА, Nalivaeva NN, Kozlova DI, Kochkina EG, Fedorova YB, Gavrilova SI (2015) The activity of blood serum cholinesterases and neprilysin as potential biomarkers of mild-cognitive impairment and alzheimer’s disease. Neurosci Behav Phys 115(12): 110–117. (In Russ)]. https://doi.org/10.17116/jnevro2015115112110-117
Бресткин АП, Кузнецова ЛП, Моралев СН, Розенгарт ЕВ, Эпштейн ЛМ (1997) Холинэстеразы наземных животных и гидробионтов. Владивосток. ТИНРО-Центр. [Brestkin AP, Kuznetsova LP, Moralev SN, Rosengart EV, Epshtein LM (1997) Cholinesterases of terrestrial animals and hydrobionts. Vladivostok. TINRO-Center. (In Russ)].
McGuire M, Nogueira C, Bartels C, Lightstone H, Hajra A, Van der Spek A, Lockridge O, La Du B (1989) Identification of the structural mutation responsible for the dibucaine-resistant (atypical) variant form of human serum cholinesterase. Proc Natl Acad Sci USA 86(3): 953–957. https://doi.org/10.1073/pnas.86.3.953
Nogueira C, Bartels C, McGuire M, Adkins S, Lubrano T, Rubinstein H, Lightstone H, Van der Spek A, Lockridge O, La Du B (1992) Identification of two different point mutations associated with the fluoride-resistant phenotype for human butyrylcholinesterase. Am J Hum Genet 51(4): 821–828.
Liddell J, Lehmann H, Silk E (1962) A ‘silent’ pseudo-cholinesterase gene. Nature 193: 561–562. https://doi.org/10.1136/jmg.3.3.190
Jensen F, Bartels C, La Du B (1992) Structural basis of the butyrylcholinesterase H-variant segregating in two Danish families. Pharmacogenetics 2(5): 234–240. https://doi.org/10.1097/00008571-199210000-00006
Garry P, Dietz A, Lubrano T, Ford P, James K, Rubinstein H (1976) New allele at cholinesterase locus 1. J Med Genet 13(1): 38–42. https://doi.org/10.1136/jmg.13.1.38
Rubinstein H, Dietz A, Lubrano T (1978) E1k, another quantitative variant at cholinesterase locus 1. J Med Genet 15(1): 27–29. https://doi.org/10.1136/jmg.15.1.27
Lehmann H, Liddell J (1969) Human cholinesterase (pseudocholinesterase): genetic variants and their recognition. Br J Anaesth 41(3): 235–244. https://doi.org/10.1093/bja/41.3.235
Podoly E, Shalev D, Shenhar-Tsarfaty S, Bennett E, Ben Assayag E, Wilgus H, Livnah O, Soreq H (2009) The Butyrylcholinesterase K Variant Confers Structurally Derived Risks for Alzheimer Pathology. J Biol Chem 284(25): 17170–17179. https://doi.org/10.1074/jbc.M109.004952
Wang Z, Jiang Y, Wang X, Du Y, Xiao D, Deng Y, Wang J (2015) Butyrylcholinesterase K variant and Alzheimer’s disease risk: a meta-analysis. Med Sci Monit 16; 21: 1408–1413. https://doi.org/10.12659/MSM.892982
Mohs RC (1996) The Alzheimers Disease Assessment Scale (ADAS). Int Psychogeriatrics 8(2): 195–203. https://doi.org/10.1017/s1041610296002578
Ellman GL, Courtney KD, Andres VJ, Feather-Stone RM (1961) A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 7(2): 88–90.
Васильев ДС, Козлова ДИ, Попов АВ (2019) Способ дифференциальной диагностики ранней или выраженной стадии ревматоидного артрита с остеоартритом. Патент №1071064, РФ, МПК G01N 33/96 (2006.01) G01N 33/564 (2006.01). Заявл. 2018.04.03; Опубл. 2019.10.31; Бюл. № 10. [Vasilev DS, Kozlova DI, Popov AV (2019) Method for differential diagnosis of early or severe stages of rheumatoid arthritis with osteoarthritis. Patent No. 1071064, Russian Federation, IPC G01N 33/96 (2006.01) G01N 33/564 (2006.01). Appl. 2018.04.03; Published 2019.10.31; Bull. No. 10. (In Russ)].
Bradford MM (1976) A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal Biochem 72(1–2): 248–254. https://doi.org/10.1016/0003-2697(76)90527-3
Darvesh S, Hopkins DA (2003) Differential distribution of butyrylcholinesterase and acetylcholinesterase in the human thalamus. J Comp Neurol 463 (1): 25–43. https://doi.org/10.1002/cne.10751
Greenfield SA (1991) A noncholinergic action of acetylcholinesterase (AChE) in the brain: from neuronal secretion to the generation of movement. Cell Mol Neurobiol 11(1): 55–77. https://doi.org/10.1007/BF00712800
Appleyard M, Jahnsen H (1992) Actions of acetylcholinesterase in the guinea-pig cerebellar cortex in vitro. Neuroscience 47(2): 291–301. https://doi.org/10.1016/0306-4522(92)90245-w
Arendt T, Bruckner MK, Lange M, Bigl V (1992) Changes in acetylcholinesterase and butyrylcholinesterase in Alzheimer’s disease resemble embryonic development – a study of molecular forms. Neurochem Int 21(3): 381–396. https://doi.org/10.1016/0197-0186(92)90189-x
Mesulam M, Geula C (1994) Butyrylcholinesterase reactivity differentiates the amyloid plaques of aging from those of dementia. Ann Neurol 36: 722–727. https://doi.org/10.1002/ana.410360506
Mueller B, Adler G (2015) Prevalence of wild – type butyrylcholinesterase genotype in patients with Alzheimer’s dementia. World J Neurosci 5: 175–179. https://doi.org/10.4236/wjns.2015.53019
Mizukami K, Akatsu H, Abrahamson EE, Mi Z, Ikonomovic MD (2016) Immunohistochemical analysis of hippocampal butyrylcholinesterase: implications for regional vulnerability in Alzheimer’s disease. Neuropathology 36: 135–145. https://doi.org/10.1111/neup.12241
Macdonald R, Maxwell SP, Reid GA, Cash MK, DeBay DR, Darvesh S (2017) Quantification of butyrylcholinesterase activity as a sensitive and specific biomarker of Alzheimer’s disease. J Alzh Dis 58: 491–505. https://doi.org/10.3233/JAD-170164
Gabriel AJ, Almeida MR, Ribeiro MH, Carneiro D, Valério D, Pinheiro AC, Pascoal R, Santana I, Baldeiras I (2018) Influence of butyrylcholinesterase in progression of mild cognitive impairment to Alzheimer’s disease. J Alzh Dis 61(3): 1097–1105. https://doi.org/10.3233/JAD-170695
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


