Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 6, стр. 762-770
Влияние метаболических нарушений и стрептозотоцинового диабета на церебральную циркуляцию у крыс, содержащихся на высокожировой диете
И. Б. Соколова *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: SokolovaIB@infran.ru
Поступила в редакцию 20.04.2022
После доработки 13.05.2022
Принята к публикации 15.05.2022
- EDN: LJUXMZ
- DOI: 10.31857/S0869813922060085
Аннотация
Изучали изменения плотности сосудистой сети пиальной оболочки сенсомоторной коры головного мозга, опосредованной ацетилхолином (AСh) дилатации пиальных артерий, тканевой перфузии и сатурации кислородом у крыс Sprague Dawley после формирования у них метаболических и гормональных нарушений, сходных с метаболическим синдромом (МС) и сахарным диабетом 2-го типа (СД2). Для этого крыс 2 мес. содержали на высокожировой диете, а затем части животных вводили низкую дозу стрептозотоцина (35 мг/кг). Еще 1 мес. все животные получали корм с повышенным содержанием жира. С использованием метода прижизненной микрофотосъемки оценивали количество сосудов на определенной площади поверхности сенсомоторной коры и реакции пиальных артерий на воздействие AСh (10–7М). У тех же животных с помощью многофункционального лазерного диагностического комплекса ЛАКК-М измеряли тканевую перфузию и уровень насыщения кислородом (SO2). Установлено, что потребление высокожирового корма на протяжении 3 мес. привело к формированию у крыс МС: повышению уровня глюкозы в крови, развитию инсулинорезистентности и значительному набору висцерального жира. У этих животных уменьшалась плотность сосудистой сети в пиальной оболочке в 1.3–1.4 раза относительно контрольной группы, число дилатирующих на воздействие AСh пиальных артерий было меньше в 1.2–1.6 раз, уровень тканевой перфузии статистически значимо не изменялся, а SO2 понижалось в среднем на 9%. У крыс с СД2 не произошло дальнейшего урежения сосудистой сети, но AСh-опосредованная дилатация была меньше в 1.6–2.3 раза относительно контрольной группы. Тканевая перфузия была снижена на 22%, а SO2 на 6%. Из-менения церебральной циркуляции начинаются при развитии МС. Развитие СД2 приводит к эндотелиальной дисфункции мозговых артерий: чем меньше диаметр сосуда, тем хуже дилататорная реакция на AСh. Запустевание сосудистого русла, нарушение реактивности церебральных артерий негативно сказывается на снабжении ткани мозга кислородом.
Эксперты ВОЗ охарактеризовали метаболический синдром (МС) как пандемию XXI века. Расстройство пищевого поведения, связанного с повышенным потреблением больших объемов высококалорийной пищи – прямой путь к развитию эндокринных заболеваний, в том числе и сахарного диабета 2-го типа (СД2). У более чем 20% пациентов с СД2 формируются цереброваскулярные патологии [1]. Высокий уровень сахара в крови, нарушение липидного обмена, инсулинорезистентность, окисидативный стресс приводят к ишемическим и геморрагическим инсультам [2], а также к повреждению мелких церебральных сосудов и формированию лакунарных инсультов [3]. У пациентов с СД2 отмечают развитие эндотелиальной дисфункции [4], утолщение стенки и уменьшение просвета мозговых сосудов [5]. Для разработки новых лекарственных препаратов и подходов к лечению СД2 необходимы подробные исследования причин и механизмов цереброваскулярных патологий. Мы предлагаем использовать методику прижизненного изучения функционирования мозговых сосудов и изменений гемодинамики у крыс с МС и СД2.
Цель представленного исследования – дать комплексную оценку нарушениям церебральной циркуляции у крыс с МС и СД2. Для этого поставлены следующие экспериментальные задачи: 1. Определить изменение в плотности сосудистой сети пиальной оболочки сенсомоторной коры при развитии МС и СД2. 2. Выявить у тех же экспериментальных животных развитие эндотелиальной дисфункци. 3. Выяснить, как отражается развитие МС и СД2 на показатель мозговой циркуляции – перфузию – и уровень сатурации кислородом в ткани сенсомоторной коры головного мозга.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на самцах крыс Sprague Dawley (n = 30) из ЦКП “Биоколлекция ИФ РАН”. Работа выполнена в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, принятыми Европейской конвенцией 19.07.2014, и требованиями Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
В начале работы возраст крыс составлял 3 месяца, масса тела 300–350 г. Изначально были сформированы 2 пула животных. Контрольные крысы (группа 1, n = 10) содержались в условиях вивария при естественном освещении и свободном доступе к воде и стандартному пищевому рациону. Крысы, у которых формировался метаболический синдром (МС) (группа 2, n = 10) и сахарный диабет 2-го типа (СД2) (группа 3, n = 10) в течение 2 месяцев содержались на высокожировой диете. Высокожировая диета включала в себя комбикорм (370 г/кг), жир свиной (313 г/кг), казеин (253 г/кг), витаминно-минеральную смесь (61 г/кг) – 58% жира, 25% белка, 17% углеводов от общего количества калорий [6, 7]. Через 2 месяца крысам из группы 3 внутрибрюшинно был введен панкреотоксичный препарат – стрептозотоцин в низкой концентрации (35 мг/кг) (Sigma-Aldrich, США). Еще 1 месяц животные из групп 2 и 3 получали высокожировую диету. Раз в месяц у всех животных проводили забор крови из хвостовой вены для регистрации уровня глюкозы с помощью глюкометра Акку-Чек Актив (“Рош Диабетс Кеа ГМбХ”, Германия). Через 3 месяца крысы из всех 3 групп прошли тесты на инсулинорезистентность и толерантность к глюкозе [8, 9].
Все последующие хирургические и экспериментальные действия были проведены на наркотизированных (золетил (Virbac, Франция) (20 мг/кг) внутрибрюшинно) крысах; эвтаназия проведена путем введения увеличенной дозы наркоза. Перед началом эксперимента у крыс измеряли уровень глюкозы в крови из хвостовой вены, массу тела, рост от кончика носа до анального отверстия, обхват живота.
В теменной области черепа животного высверливали отверстие (S ≈ 1 см2), твердую мозговую оболочку в пределах отверстия удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2PO4 1.2; глюкоза 11.5; pH 7.4), аэрированного карбогеном. Раствор для орошения, как и все другие применяемые растворы, в течение всего эксперимента содержался в медицинском водяном термостате (TW-2, SIA “ELMI”, Латвия) при температуре 37°C. На протяжении всего эксперимента контролировали среднее артериальное давление (АД), показатели которого в течение всего эксперимента оставались примерно на одном уровне. Прямое измерение АД производили через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур, https://www.argonmedical.com), подключенным к АЦП, входящему в состав микроконтроллера фирмы STMicroelectronics (США), выход которого был подключен к компьютеру через порт USB. Для работы устройства с компьютером в нашей лаборатории была разработана оригинальная программа визуализации значений АД. Расчет среднего АД в реальном времени производился программой по классической формуле: Pср = Pд + 1\3(Pс – Pд), где Pср – среднее артериальное давление (мм рт. ст.), Pс – систолическое давление (мм рт. ст.), Pд – диастолическое давление (мм рт. ст.).
Температуру тела животного поддерживали на уровне 38°C. Контроль за ректальной температурой осуществлялся с помощью лабораторного термометра ТТЖ-М, (ОАО “Стеклоприбор”, Украина).
Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (“Микромед”, Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии “Photo M” (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru) определяли количество артерий и общее количество микрососудов на определенной площади. Затем измеряли диаметры пиальных артерий. В ходе эксперимента у каждого животного было исследовано более 40 пиальных артерий. Диаметры артерий измеряли в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса и при орошении мозга раствором ацетилхолина (AСh) (10–7 М) (Sigma-Aldrich, США). Все исследованные пиальные артериальные микрососуды были разбиты на группы в соответствии с исходным диаметром: 60–80 мкм, 40–60 мкм, 20–40 мкм, менее 20 мкм. О результатах воздействия ACh судили по количеству расширившихся артериальных сосудов. Степень дилатации ΔД оценивали как разность между значениями диаметра после (Д2) и до (Д1) воздействия АХ относительно диаметра сосуда Д1 перед воздействием АХ, %: ΔД = (Д2 – тД1)/Д1 × 100. Изменения диаметра в покое не превышали 5.0 ± 0.5%, поэтому при таких значениях считали, что реакция на воздействие отсутствует.
У тех же экспериментальных животных с помощью многофункционального лазерного диагностического комплекса ЛАКК-М (“ЛАЗМА”, Россия) измеряли перфузию (П) и уровень насыщения кислородом (SO2) в ткани сенсомоторной коры головного мозга. Датчик прибора размещали в 3 точках на поверхности мозга с приблизительными координатами АР = 1, 2, 3 мм от брегмы; SD = 1.0 мм латерально от сагиттального шва. Прилагаемое к комплексу ЛАКК-М программное обеспечение автоматически рассчитывало среднюю величину показателя микроциркуляции – П (условные единицы) и методом оптической тканевой оксиметрии определяло SO2 (%).
После эвтаназии у животных тщательно изымали висцеральный жир и определяли его массу. Висцеральная жировая ткань у грызунов включает в себя мезентериальную (располагается по ходу кишечника), забрюшинную (располагается за почками) и эпидидимальную (располагается вдоль семенников) жировую ткань [10].
Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследования показали, что потребление высокожирового корма на протяжении 3 мес. (группа 2) привело к достоверному относительно контрольной группы повышению уровня глюкозы в крови, развитию инсулинорезистентности и значительному набору висцерального жира (табл. 1). Формирование СД2 (группа 3) привело к подъему уровня глюкозы в среднем до 16 ± 0.9 ммоль/л, формированию у животных инсулинорезистентности и толерантности к глюкозе, набору жировой массы. АД у крыс с МС и СД2 находилось в пределах нормы.
Таблица 1.
Параметры экспериментальных животных
| Параметр | Группа 1 Контроль |
Группа 2 МС |
Группа 3 СД2 |
|---|---|---|---|
| Увеличение массы тела относительно исходной, % | 23 ± 0.9 | 33 ± 2.4 *p ≤ 0.05 |
102 ± 13.7 ** p ≤ 0.001 |
| Удельная масса висцерального жира, % | 2.28 ± 0.25 | 4.41 ± 0.42 *p ≤ 0.05 |
5.32 ± 0.24 ***p ≤ 0.0001 |
| Индекс массы тела | 0.77 ± 0.01 | 0.74 ± 0.02 | 0.79 ± 0.02 |
| Уровень глюкозы в крови, ммоль/л | 5.6 ± 0.1 | 10.8 ± 0.8 ** p ≤ 0.001 |
16 ± 0.9 ** p ≤ 0.001 |
| Среднее АД, мм рт. ст. | 120.2 ± 2,2 | 125.7.±.2 *p ≤ 0.05 |
128.5.±.1.9 *p ≤ 0.05 |
| Тест на толерантность к глюкозе* | 100% | 105% | 201% |
| Тест на инсулинорезистентность* | 100% | 114% | 323% |
* Измеряли площадь под кривой “концентрация глюкозы–время (120 мин)”. Результат для группы 1(контроль) принят за 100%. Для групп 2 и 3 показано увеличение площади относительно группы 1, выраженное в %. Уровни отличия указаны относительно группы 1. Показатель индекса массы тела (масса тела/рост2), который используется для диагностики МС у людей, оказался не информативен для крыс: потребление высококалорийной пищи у взрослых людей приводит к набору массы тела, но практически не отражается на их росте; у крыс при нахождении на высокожировой диете увеличивалась и масса и длина тела.
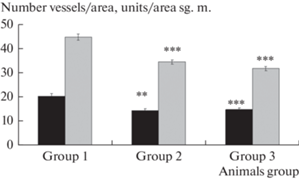
У крыс с МС (группа 2) было выявлено статистически значимое понижение плотности сосудистой сети в пиальной оболочке сенсомоторной коры (в среднем в 1.3 раза) и уменьшение количества артериальных сосудов на единицу площади измерения (в среднем в 1.4 раза). Практически такое же урежение сосудистого русла было выявлено и в группе 3 (СД2) (рис. 1).
Рис. 1.
Показатель плотности микрососудистого русла у крыс интактных (группа 1), с метаболическим синдромом (группа 2) и сахарным диабетом 2-го типа (группа 3). Темная заливка – число пиальных артерий/площадь измерения (мкм2); светлая заливка – число всех сосудов/ площадь измерения (мкм2). По оси абсцисс –группы экспериментальных животных; по оси ординат – показатель плотности микрососудистого русла. Изменения значимы по сравнению с соответствующими значениями у контрольных животных (**р < 0.01, ***р < 0.001, критерий Тьюки).
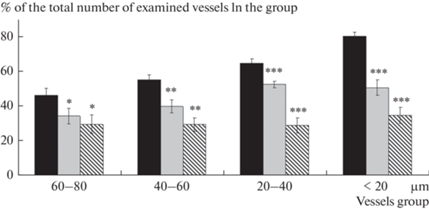
Формирование МС привело к статистически значимому уменьшению числа пиальных артериальных сосудов, ответивших увеличением диаметра на воздействие на поверхность мозга AСh (рис. 2) – в среднем в 1.2–1.6 раза в зависимости от диаметра сосудов. У крыс с СД2 количество дилатирующих на воздействие AСh артерий было значительно меньше, чем у контрольных животных (группа 1) (в среднем в 1.6–2.3 раза) и чем у крыс с МС (группа 2) (в среднем в 1.2–1.9 раза).
Рис. 2.
Дилататорная реакция пиальных артериальных сосудов различных диаметров на воздействие ACh: — число дилатаций (% от общего числа исследованных сосудов). Темная заливка – контрольные животные (группа 1); светлая заливка – животные с МС (группа 2), штриховка – животные с СД2 (группа 3). По оси абсцисс – группы сосудов разного диаметра (мкм); по оси ординат – число расширившихся на воздействие AСh артерий относительно общего числа сосудов в группе (%). Изменения значимы по сравнению с соответствующими значениями у контрольных животных (*р < 0.05, **р < 0.01, ***р < 0.001, критерий Тьюки).
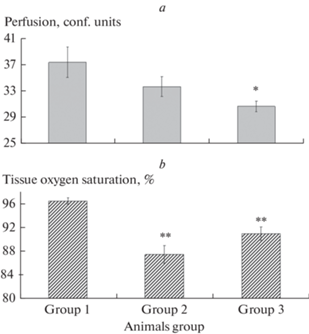
На рис. 3 показано уменьшение показателей тканевой перфузии (a) и тканевого насыщения кислородом SO2 (b) в сенсоматорной коре головного мозга у крыс с СД2 относительно контрольной группы и животных с МС: высокожировая диета не вызывала статистически значимого понижения тканевой перфузии, тогда как развитие СД2 приводило к понижению этого показателя в среднем на 22%. Тканевое SO2 было снижено и у животных с МС и с СД2 на 6–9%.
Рис. 3.
Изменение уровня перфузии (a) и сатурации кислородом (b) в ткани сенсомоторной коры головного мозга у крыс с метаболическим синдромом и сахарным диабетом 2-го типа. По оси абсцисс – группы экспериментальных животных; по оси ординат: a – показатель перфузии (усл. ед.), b – показатель тканевой сатурации кислородом SO2 (%). Изменения значимы по сравнению с соответствующими значениями у контрольных животных (**р < 0.01, критерий Тьюки).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование показало, что потребление пищи с повышенным содержанием жира в течение 3 мес. привело к развитию нарушений в регуляции метаболизма, формированию у животных патологических процессов, сходных по своим проявлениям с МС у человека и значимому ухудшению циркуляции в сенсомоторной коре головного мозга крыс по сравнению с интактными животными. У крыс с МС было выявлено урежение сосудистой сети пиальной оболочки (рис. 1). Применение стрептозотоцина и развитие СД2 на фоне высокожировой диеты не повлияло на архитектонику сосудистого русла пиальной оболочки сенсомоторной коры. В настоящее время считается, что повреждение стенки сосудов, в том числе и церебральных, происходит из-за избытка инсулина в тканях организма на фоне инсулинорезистентности, характерной как для МС, так и для СД2 [11]. Избыточный инсулин активирует митогенактивируемую протеинкиназу, которая, в свою очередь, стимулирует выработку различных ростовых факторов, запускающих пролиферацию и миграцию гладкомышечных клеток в стенке сосудов [12, 13], что значительно утолщает медию и уменьшает внутренний диаметр вплоть до полного стеноза. Однако в наших экспериментах инсулинорезистентность у крыс с МС имела место (табл. 1), но была гораздо менее выражена, чем при СД2. Вероятно, на ранних стадиях МС и СД2 за деградацию церебрального сосудистого русла отвечают и другие механизмы. МС характеризуется сочетанием висцерального ожирения с нарушением липидного обмена. Экспериментально показано, что повышение секреции липопротеинов очень низкой плотности в висцеральной жировой ткани способствует накоплению бета-амилоида в головном мозге [14]. Наличие агрегированного бета-амилоида в мелких церебральных сосудах выводит их из системы циркуляции крови, развивается церебральная амилоидная ангиопатия.
Развитие МС и СД2 привело к угнетению AСh-опосредованной дилатации пиальных артериальных сосудов (рис. 2). Следует отметить, что у крыс с СД2 была нарушена закономерность: чем меньше диаметры сосудов, тем большее их число расширяется при воздействии AСh. Так, в норме разница между артериями 60–80 мкм и артериями менее 20 мкм по данному показателю составляла 1.7 раза, тогда как при СД2 мелкие артерии реагировали примерно так же, как крупные. У крыс с МС эта закономерность сохранялась: число дилатирующих мелких артерий превышало таковое у самых крупных в 1.5 раза. Полученные данные подтверждают, что при СД2 в церебральных артериях происходит повреждение клеток интимы и развивается эндотелиальная дисфункция [3]. При этом в большей мере страдают мелкие артерии, т. е. наиболее вовлеченное в кислородный обмен звено сосудистой сети. Но эндотелиальную дисфункцию наблюдали и у животных с МС. В этом случае одну из ведущих ролей в развитии эндотелиальной дисфункции играет нарушение липидного обмена. Избыточное накопление насыщенных жирных кислот вызывает секрецию провоспалительных факторов IL-1β, TNF-α, IL-6 [15, 16], снижение экспрессии белков плотных контактов и нарушение целостности гематоэнцефалического барьера (ГЭБ) [17]. Повышение проницаемости ГЭБ способствует проникновению в мозг различных токсических метаболитов, провоспалительных факторов, иммунных клеток, активации микроглии, запуская развитие воспалительных процессов в церебральных структурах, в том числе и в стенке сосудов [18]. МС и СД2 оказывают негативное влияние и на перфузию и на сатурацию кислородом в сенсомоторной коре головного мозга экспериментальных животных (рис. 3). Уровень тканевой перфузии был статистически понижен только в группе СД2, тогда как уровень SO2 был достоверно ниже нормы и при МС и при СД2. Понижение скорости мозгового кровотока было отмечено в экспериментальных [19] и клинических [2] исследованиях. Эти изменения у пациентов с СД2 связывают с нарушением ауторегуляции мозгового кровотока [20].
Итак, в представленной работе показано, что моделирование МС у крыс сопровождается урежением сосудистой сети пиальной оболочки головного мозга, развитием эндотелиальной дисфункции пиальных артерий и ухудшением их AСh-опосредованной дилатации, понижением тканевого насыщения кислородом. Эти изменения церебральной циркуляции развиваются при нормальном АД (125.7 ± 2 мм рт. ст.) и умеренной гипергликемии (10.8 ± 0.8 ммоль/л). Вероятно, каскад реакций, приводящих к мозговым патологиям, запускается накоплением висцерального жира. Повышение уровня глюкозы в крови животных с СД2 приводит к прогрессированию эндотелиальной дисфункции, особенно у артерий малого диаметра. Запустевание сосудистого русла, нарушение реактивности церебральных артерий негативно сказывается на снабжении ткани мозга кислородом – уровень сатурации у животных с СД2 был понижен на 6–9% по сравнению с контрольными животными.
Список литературы
Zhou H, Xie P, Dong Y, Chen W, Wu H, Jiang Y, Lei H., Luo G, Liu J (2022) Lacunes and type 2 diabetes mellitus have a joint effect on cognitive impairment: a retrospective study. Peer J 3(10): e13069. https://doi.org/10.7717/peerj.13069
Sloten T, Sedaghat S, Carnethon M, Launer L, Stehouwer C (2020) Cerebral microvascular complications of type 2 diabetes: strort, cognitive dysfunction, and depression. Lancet Diabetes Endocrinol 8(4): 325–336. https://doi.org/10.1016/S2213-8587(19)30405-X
Madonna R, Balistreri C, Geng Y, Caterina R (2017) Diabetic microangiopathy: pathogenetic insights and novel therapeutic approaches. Vascular Pharmac 90: 1-7. https://doi.org/10.1016/j.vph.2017.01.004
Sun D, Wang J, Toan S, Muid D, Li R, Chang X, Zhou H (2022) Molecular mechanisms of coronary microvascular endothelial dysfunction in diabetes mellitus: focus on mitochondrial quality surveillance. Angiogenesis 18. https://doi.org/10.1007/s10456-022-09835-8
Демидов ВИ, Конкина ЕА, Майорова МВ (2008) Патоморфология микроциркуляторного русла периинфарктных зон головного мозга при сахарном диабете. Вестник Ивановск мед акад 13(1–2): 10–16. [Demidov VI, Konkina EA, Mayorova MV (2008) Pathological morphology of microcirculatory channel of brain periinfarction zones in diabetes mellitus. Bull Ivanovo Med Acad 13(1–2): 10–16. (In Russ)].
Кайдаш ОА, Иванов ВВ, Венгеровский АИ, Буйко ЕЕ, Щепеткин ИА (2020) Экспериментальная модель сахарного диабета 2-го типа у крыс, вызванная диетой с высоким содержанием жиров и стрептозотоцином в низкой дозе. Бюл сибирск мед 19(2): 41–47. [Kaydash OA, Ivanov VV, Vengerovsky AI, Buyko EE, Schepetkin IA (2020) The experimental model of type 2 diabetes mellitus caused by a high-fat diet with low-dose streptozotocin in rats. Bull Siber Med 19(2): 41–47. (In Russ)]. https://doi.org/10.20538/1682-0363-2020-2-41-47
Srinivasan K, Viswanad B, Asrat L, Kaul C, Ramarao P (2005) Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: A model for type 2 diabetes and pharmacological screening. Pharmacol Res 52: 313–320. https://doi.org/10.1016/j.phrs.2005.05.004
Gancheva S, Zhelyazkova–Savova M, Galunska B, Chervenkov T (2015) Experimental models of metabolic syndrome in rats. Scripta Scient Med 47(2): 23–30. https://doi.org/10.14748/ssm.v47i2.1145
Dupas J, Feray A, Goanvec C, Guernec A, Samson N, Bougaran P, Guerrero F, Mansourati J (2017) Metabolic syndrome and hypertension resulting from fructose enriched diet in Wistar rats. Biomed Res Int 2017: 2494067. https://doi.org/10.1155/2017/2494067
Якимов ИЮ, Бородин ДА, Подрезов ИК, Иванов ВВ, Васильев ВН, Котловский М Ю, Борисов ЛВ, Мильто ИВ (2015) Морфометрические параметры белой жировой ткани разной локализации у крыс при высокожировой диете. Соврем пробл науки и образов 5. [Yakimovich IY, Borodin DA, Podrezov IK, Ivanov VV, Vasilyev VN, Kotlovsky MY, Borisova LV, Milto IV (2015). White adipose tissue morphometric characteristics in hi-fat diet rats. Modern problems of science and education 5. (In Russ)].
Haratz S, Tanne D (2011) Diabetes, hyperglycemia and the management of cerebrovascular disease. Current Opin Neurol 24(1): 81–88. https://doi.org/10.1097/WCO.obo13e3283418fed
Ding Y, Vaziri N, Coulson R, Kamanna V, Roh D (2000) Effects of stimulated hyperglycemia, insulin, and glucagon on endothelial nitric oxide synthase expression. Am J Physiol Endocrinol Metab 279(1): E11–E17. https://doi.org/10.1152/ajpendo.2000.279.1.E11
Federici M, Menghini R, Mauriello A, Hribal M, Ferrelli F, Lauro D, Sbraccia P, Spagnoli L, Sesti G, Lauro R (2002) Insulin-dependent activation of endothelial nitric oxide synthase is impaired by O-linked glycosylation modification of signaling proteins in human coronary endothelial cells. Circulation 106(4): 466–472. https://doi.org/10.1161/01.cir.0000023043.02648.51
Arshad N, Lin T, Yahaya M (2018) Metabolic syndrome and its effect on the brain: possible mechanism. CNS Neurol Disord Drug Targeta 17(8): 595–603. https://doi.org/10.2174/1871527317666180724143258
Gustafson B, Hammarstedt A, Andersson C, Smith U (2007) Inflamed adipose tissue: a culprit underlying the metabolic syndrome and atherosclerosis. Arterioscler Thromb Vasc Biol 27(11): 2276–2283. https://doi.org/10.1161/ATVBAHA.107.147835
Jais A, Bruning J (2017) Hypothalamic inflammation in obesity and metabolic disease. J Clin Invest 127(1): 24–32. https://doi.org/10.1172/JCI88878
Dyken P, Lacoste B (2018) Impact of metabolic syndrome on neuroinflammation and the blood-brain barrier. Front Neurosci 12: 930. https://doi.org/10.3389/fnins.2018.00930
Schonfeld P, Reiser G (2021) How the brain fights fatty acids, toxicity. Neurochem Int 148: 105050. https://doi.org/10.1016/j.neuint.2021.105050
Li Y, Li Q, Pan C, Yan L, Hu B, Liu Y, Yang L, Huang P, Zhao S, Wang C, Fan J, Wang X, Han J (2018) Bushen huoxue attenuates diabetes-induced cognitive impairment by improvement of cerebral microcirculation: involvement of Rho/ROCK/moesin and Src signaling pathways. Front Physiol 15(9): 527. https://doi.org/10.3389/fphys.2018.00527
Wang S, Jiao F, Border J, Fang X, Crumpler R, Liu Y, Zhang H, Jefferson J, Guo Y, Elliott P, Thomas K, Strong L, Urvina A, Zheng B, Rijal A, Smith S, Yu H, Roman R, Fan F (2022) Luseogliflozin, a sodium-glucose contransporter-2 inhibitor, reverses cerebrovascular dysfunction and cognitive impairments in 18-mo-old diabetic animals. Am J Physiol Heart Circ Physiol. 322(2): H246–H259.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


