Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 7, стр. 890-902
Возрастные изменения микроглии спинного мозга крыс
Е. А. Колос 1, *, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: koloselena1984@yandex.ru
Поступила в редакцию 25.05.2022
После доработки 16.06.2022
Принята к публикации 16.06.2022
- EDN: XJWQZI
- DOI: 10.31857/S0869813922070044
Аннотация
Целью настоящего исследования явилась оценка изменений микроглии в различных областях шейного отдела спинного мозга (СМ) молодых (4 мес.) и стареющих (18 мес.) крыс с использованием иммуногистохимических маркеров. Для идентификации клеток микроглии применяли антитела к кальций-связывающему белку Iba-1. Для оценки изменения количества нейронов СМ при старении использовали антитела к ядерному антигену нервных клеток (NeuN). В работе выявлены региональные различия реакции микроглиоцитов на старение. Установлено, что реактивные изменения микроглиоцитов у стареющих крыс более выражены в белом, а не в сером веществе, что, вероятно, связано с активными процессами де- и ремиелинизации нервных волокон СМ, характерными для поздних стадий онтогенеза. Отмечено, что наибольшие изменения претерпевает микроглия дорсального и вентрального канатика. Известно, что именно эти пути обеспечивают восприятие сенсорной информации от внешних раздражителей, оценку ее интенсивности, типа и последующую двигательную активность. В области дорсального и вентрального канатиков идентифицированы ранее не описанные исследователями скопления (агрегаты) активированных микроглиоцитов, предположительно участвующих в процессах демиелинизации. Полученные результаты свидетельствуют в пользу участия микроглии в сенсорных нарушениях, связанных со старением.
Возрастные изменения биохимических процессов и физиологических функций органов и систем организма могут создать предпосылки для развития тяжелых заболеваний нервной системы в пожилом возрасте. В связи с этим в настоящее время активно изучаются клеточные и молекулярные процессы, происходящие при старении. С возрастом увеличивается частота сенсорных и двигательных нарушений, точные механизмы которых остаются неясными. Хорошо известно, что структурные и функциональные изменения микроглиоцитов при старении играют центральную роль в патогенезе многих нейродегенеративных заболеваний [1–3]. Микроглиоциты представляют собой резидентные иммунные клетки ЦНС. В интактной нервной системе микроглия поддерживает гомеостаз нервной ткани, выполняя широкий спектр функций: фагоцитирует погибшие клетки и их фрагменты, удаляет неправильно агрегированные белки, ремоделирует нейронные сети, модулирует активность астроцитов и нейронов, выполняет нейропротекторные функции, способствует процессам ремиелинизации [4–6]. В ответ на повреждение ЦНС и нарушение гомеостаза, микроглиальные клетки претерпевают процесс активации, который сопровождается морфологическими и молекулярными изменениями. Было высказано предположение, что микроглиоциты ЦНС в раннем и позднем периоде жизни отличаются фенотипически, что связано с изменением функций микроглии во время старения: снижение способности к хемотаксису, фагоцитозу и контролю гомеостаза, поляризации в сторону провоспалительного фенотипа [7–11]. При этом остается неясным, какую роль возрастные изменения микроглиоцитов спинного мозга (СМ) вносят в предрасположенность к нейродегенеративным заболеваниям. Основная масса современных исследований, посвященных старению, акцентирует внимание на изменениях клеток микроглии головного мозга [12–17]. Однако анализ современных данных показывает, что микроглиоциты СМ значительно отличаются от микроглии головного мозга как морфологически, так и функционально [18]. Работы, описывающие особенности глиальных реакций СМ в возрастном аспекте немногочисленны [19–22], несмотря на то, что важность изучения влияния старения на функционирование микроглии СМ очевидна.
Цель настоящего исследования состояла в оценке изменений микроглии в различных зонах шейного отдела СМ молодых (4 мес.) и стареющих (18 мес.) крыс с использованием ряда иммуногистохимических маркеров.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на крысах-самцах Вистар в возрасте 4 (n = 5) и 18 месяцев (n = 5). Все манипуляции проводили в соответствии с “Правилами проведения работ с использованием экспериментальных животных” и с соблюдением Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986 г.). Исследование было одобрено этическим комитетом ФГБНУ “Институт экспериментальной медицины” (протокол № 3/19 от 25 апреля 2019 г.).
У молодых и стареющих животных выделяли фрагменты шейного отдела СМ на уровне CIII–CV сегмента. Материал фиксировали в цинк-этанол-формальдегиде [23] в течение 24 ч, затем обезвоживали в спиртах возрастающей концентрации, заливали в парафин и изготавливали серийные срезы толщиной 5 мкм. На полученных срезах после депарафинирования и регидратации проводили иммуногистохимическую реакцию на белок Iba-1 (ionized calcium-binding adapter molecule 1), используя поликлональные козьи антитела (разведение 1 : 800, AbCam, Великобритания). Белок Iba-1 является маркером микроглиоцитов нервной системы и других фагоцитирующих клеток [6, 24, 25]. Перед постановкой иммуногистохимической реакции проводили тепловое демаскирование антигенов. Для визуализации прореагировавших антител применяли вторичные биотинилированные антитела из набора VECTASTAIN® Universal Quick kit (PK-8800) (Vector Laboratories Inc, США) с блокировкой неспецифической иммунореактивности нормальной сывороткой крысы. Продукт иммуногистохимической реакции выявляли с применением 3,3'-диаминобензидина (DАВ+, K3468, Agilent, США).
Для оценки изменения количества нейронов в сером веществе спинного мозга при старении проводили иммуногистохимическое окрашивание срезов спинного мозга молодых и стареющих животных с применением антител к ядерному белку нервных клеток (NeuN). Для этого использовали мышиные моноклональные (клон A60) антитела (MAB377, Merck, США). В качестве вторичного реагента применяли набор Reveal Polyvalent HRP DAB Detection System (SPD-015, Spring Bioscience, США) с добавлением нормальной сыворотки крысы. Продукт иммуногистохимической реакции выявляли с применением 3,3'-диаминобензидина (DАВ+, K3468, Agilent, США).
Все полученные препараты анализировали с использованием светового микроскопа Leica DM750 (Германия), микрофотографии получали с применением камеры ICC50 (Leica, Германия) и программного обеспечения LAS EZ (Leica, Германия). Оценку морфологических и количественных изменений популяции микроглии проводили в нескольких зонах спинного мозга: дорсальном сером веществе (I–V пластинка Рекседа), вентральном сером веществе (VI–X пластинка Рекседа), дорсальном белом веществе (дорсальные канатики), боковом белом веществе (боковые канатики) и вентральном белом веществе (передние канатики). Для оценки реактивных изменений клеток микроглии при старении производили фотосъемку исследуемых областей, расположенных близко друг к другу, но без перекрывания. Было получено не менее четырех изображений на каждую исследуемую зону. Анализ изображений проводили с применением программы ImageJ (NIH, США). В каждой исследуемой зоне спинного мозга молодых и стареющих животных определяли общее число микроглиоцитов на единицу площади исследуемой области, то есть плотность распределения клеток. При подсчете учитывали Iba-1-иммунопозитивные клетки c ядром в плоскости среза. Фрагменты клеток, не содержащие ядро, а также иммунопозитивные отростки не учитывались при количественном анализе. Также в ходе исследования определяли площадь, занимаемую Iba-1-иммунопозитивными микроглиоцитами в каждой исследуемой зоне СМ крыс разных возрастных групп. Данные гистограмм приведены как среднее значение в группе со стандартной ошибкой. При количественной оценке нейронов СМ проводили подсчет числа NeuN-иммунопозитивных клеток, содержащих ядро в плоскости среза, в дорсальном и вентральном сером веществе СМ молодых и стареющих крыс. Статистический анализ различий между группами проводили с использованием t-критерия Стьюдента при p < 0.05.
Для флуоресцентной микроскопии с целью выявления Iba1-содержащих клеток в качестве вторичных реагентов применяли биотинилированные антитела из набора VECTASTAIN® Universal Quick kit (PK-8800) (Vector Laboratories Inc, США) с добавлением нормальной сыворотки крысы, а также коньюгат стрептавидина с флуорохромом Rhodamine Red-X (AB_2337247, Jackson ImmunoResearch Laboratories Inc, США). Ядра клеток окрашивали ядерным флуоресцентным красителем SYTOX Green (S7020, Invitrogen, США). Препараты анализировали с применением конфокального лазерного микроскопа LSM 800 (Zeiss, Германия). Для возбуждения флуоресценции Rhodamine Red-X (RRX) применяли лазер 561 нм, для SYTOX green – 488 нм. Анализ изображений проводили с использованием программы ZEN 2012 (Zeiss, Германия) и LSM Image Browser (Zeiss, Германия).
Специфичность иммуногистохимической реакции на Iba-1 оценивали при постановке отрицательного и положительного контролей. Для проведения положительного контроля использовались архивные срезы головного мозга взрослых крыс, фиксированные и обработанные таким же образом, как и исследуемый СМ. При постановке отрицательного контроля была исключена инкубация с первичными антителами, на срезы СМ крыс наносили разбавитель для антител (S0809) (Dako, Дания).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При постановке отрицательного контроля для иммуногистохимического выявления Iba-1 на срезах СМ молодых и стареющих животных иммунопозитивных клеток и других структур не обнаружено. При проведении положительного иммуногистохимического контроля для белка Iba-1 позитивная реакция отмечена в клетках головного мозга крыс, обладающих округлым или веретеновидным телом и длинными ветвящимися отростками, то есть в клетках, имеющих типичные морфологические признаки микроглиоцитов. При этом нейроны и другие глиальные клетки (эпендимоциты, астроциты, олигодендроциты) головного мозга взрослых животных не проявляют иммунореактивность, что свидетельствует в пользу высокой специфичности использованного протокола.
В ходе настоящего исследования при анализе микроглиоцитов серого вещества СМ были отмечены некоторые морфологические различия между микроглией молодых и стареющих крыс. В области дорсального серого вещества СМ молодых животных идентифицируются мелкие Iba-1-иммунопозитивные (Iba-1+) клетки, тело которых имеет овальную форму и несколько тонких разветвленных отростков. Также в данной области присутствует большое количество иммунопозитивных тонких отростков микроглиоцитов, тела которых не попали в плоскость среза. Большая часть микроглиоцитов дорсального серого вещества СМ стареющих животных имеет аналогичные морфологические признаки. Однако в ходе исследования отмечено присутствие единичных клеток с короткими толстыми маловетвящимися отростками у животных в возрасте 18 месяцев, то есть единичные микроглиоциты дорсального серого вещества проявляют морфологические признаки активации. При количественной оценке реакции микроглии СМ на старение установлено, что плотность популяции в области дорсального серого вещества СМ не меняется (p > 0.05) (рис. 1а). Также установлено, что площадь дорсального серого вещества, занимаемая Iba-1-иммунопозитивными клетками, при старении также не изменяется (p > 0.05) (рис. 1b).
Рис. 1.
Изменение плотности популяции микроглии (а) и площади спинного мозга, занимаемой Iba-1+ клетками (b) при старении. I – дорсальное серое вещество СМ; II – вентральное серое вещество СМ; III – дорсальный канатик СМ; IV – латеральный канатик СМ; V – вентральный канатик СМ. * – р < 0.05.
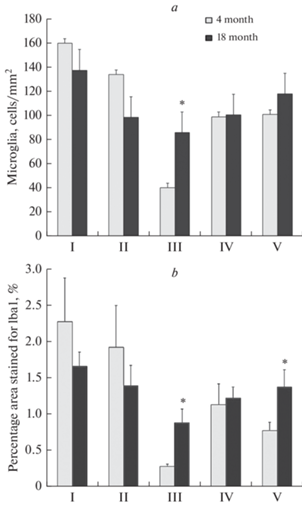
В области переднего серого вещества СМ молодых животных присутствуют округлые иммунопозитивные клетки, обладающие несколькими тонкими длинными разветвленными отростками. Также идентифицируется сеть тонких Iba-1-содержащих отростков клеток, тела которых располагаются вне плоскости среза. У стареющих крыс единичные микроглиоциты вентрального серого вещества СМ отличаются более толстыми и укороченными ветвящимися отростками. Такие морфологические особенности клеток могут свидетельствовать об активации микроглиоцитов. Большая часть микроглиоцитов исследуемой области СМ 18-месячных животных сохраняет признаки рамифицированных клеток, однако проявляют некоторое снижение разветвленности отростков. При количественной оценке реакции микроглии СМ на старение установлено, что плотность распределения Iba-1-иммунопозитивных клеток в области вентрального серого вещества СМ с возрастом не изменяется (p > 0.05) (рис. 1а). Также установлено, что площадь, занимаемая Iba-1-иммунопозитивными клетками в вентральном сером веществе СМ, при старении не меняется (p > 0.05) (рис. 1b).
С применением антител к ядерному белку нервных клеток в ходе настоящего исследования установлено, что количество нейронов задних рогов СМ молодых животных составляет 69.1 ± 2.9 клеток, аналогичный показатель в группе стареющих животных составляет 72.5 ± 5.6 клеток (р > 0.05). В области вентральных рогов количество NeuN-иммунопозитивных клеток составляет 11.6 ± 0.3 клеток. Число нейронов передних рогов СМ при старении также не изменяется и составляет 11.7 ± 0.6 клеток (р > 0.05). Также не было отмечено морфологических признаков гибели нейронов СМ.
При изучении морфологических особенностей микроглиоцитов белого вещества СМ крыс в возрасте 4 мес. отмечено, что в вентральном, дорсальном и боковом канатике СМ мелкие овальные или округлые Iba-1-иммунопозитивные клетки обладают тонкими отростками, идущими параллельно аксональным путям (рис. 2а). Такие клетки распределены равномерно во всех отделах белого вещества СМ. В боковом и вентральном канатике СМ стареющих животных отмечено преобладание микроглиоцитов с аналогичными морфологическими особенностями. Клетки обладают признакам рамифицированных микроглиоцитов. Однако в вентральном белом веществе, в непосредственной близости к передней срединной борозде, отмечается присутствие иммунопозитивных клеток с гипертрофированным клеточным телом и укороченными маловетвистыми отростками. Также в области вентрального канатика СМ стареющих животных обнаруживаются скопления Iba-1-иммунопозитивных клеток (клеточные агрегаты) площадью от 200 до 1100 мкм2, содержащие от 4 до 9 ядер. Клетки, образующие такие структуры, обладают малым количеством коротких, сильно утолщенных отростков, которые окружают волокна белого вещества (рис. 2b, 3).
Рис. 2.
Иммунопозитивные клетки вентрального канатика СМ крыс в возрасте 4 (а) и 18 месяцев (b). Клеточный агрегат, образованный Iba-1-иммунопозитивными клетками в вентральном белом веществе СМ крысы в возрасте 18 месяцев (b). Иммуногистохимическая реакция на белок Iba-1. Масштабный отрезок – 20 мкм.
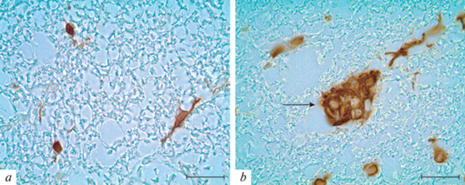
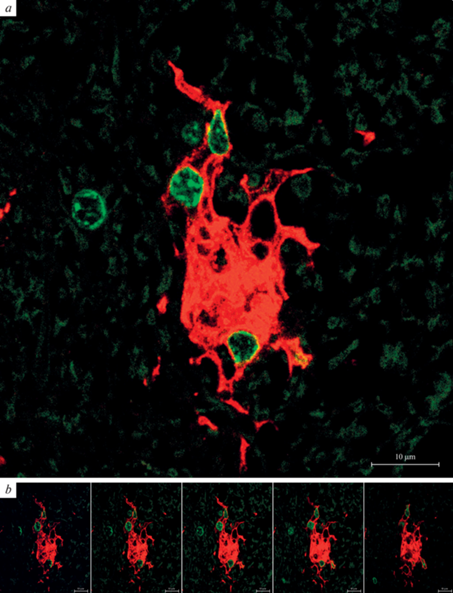
Рис. 3.
Клеточный агрегат, образованный Iba-1-иммунопозитивными клетками в вентральном белом веществе спинного мозга 18-месячной крысы. Иммунофлуоресцентная реакция на белок Iba-1 (RRX – красная флуоресценция) с докраской ядер клеток (SYTOX Green – зеленая флуоресценция). Конфокальная лазерная микроскопия. Объединенная реконструкция (а) по серии из пяти плоскостных изображений, составляющих Z-стек, интервал которого по оси z составляет 0.2 мкм (b). Масштабный отрезок – 10 мкм.
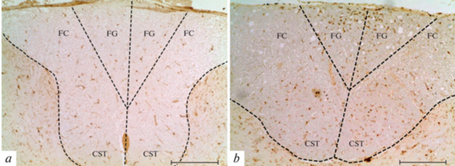
В области дорсального канатика СМ молодых крыс идентифицируются немногочисленные Iba-1-иммунопозитивные округлые и веретеновидные клетки с одним или двумя длинными, тонкими маловетвистыми отростками. Такие клетки равномерно распределены в области тонкого клиновидного пучка и дорсального кортикоспинального тракта (fasciculus gracilis, fasciculus cuneatus, tractus corticospinalis dorsalis) (рис. 4а). При старении крыс микроглиоциты данной области проявляют морфологические признаки реактивных изменений. Иммунопозитивные клетки обладают гипертрофированным клеточным телом и короткими толстыми отростками. Отмечено присутствие лишенных отростков клеток увеличенного размера с тонким ободком цитоплазмы и крупными вакуолями. Такие клетки концентрируются преимущественно в области тонкого пучка СМ (рис. 4b). Единичные гипертрофированные микроглиоциты присутствуют также в области дорсального кортикоспинального тракта. Также в области дорсального канатика СМ идентифицируются агрегаты иммунопозитивных клеток (до 450 мкм2), образованные 3–6 клетками.
Рис. 4.
Распределение Iba-1-иммунопозитивных клеток в дорсальном канатике СМ крыс в возрасте 4 (а) и 18 месяцев (b). FG – тонкий пучок, FC – клиновидный пучок, CST – дорсальный кортикоспинальный тракт. Иммуногистохимическая реакция на Iba-1. Масштабный отрезок – 200 мкм.
В настоящем исследовании установлено, что у стареющих животных количество иммунопозитивных клеток в дорсальном канатике СМ возрастает в 2 раза по сравнению с группой молодых крыс (р < 0.05) (рис. 1а), а площадь, занимаемая Iba-1-иммунопозитивными клетками, возрастает более чем в 3 раза (р < 0.05) (рис. 1b). Также отмечено, что при старении почти в 2 раза возрастает площадь, занимаемая Iba-1-иммунопозитивными клетками в области вентрального канатика СМ крыс (р < 0.05) (рис. 1b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Старение оказывает глубокое влияние на структуру и функции нервной системы. Известно, что возрастные изменения ЦНС затрагивают как нейрональные элементы, так и глиальные. В многочисленных работах, посвященных старению, отмечено, что среди глиальных клеток головного мозга наиболее значительные изменения претерпевает микроглия [13, 15–17]. Исследования микроглии при старении ЦНС показали, что количество клеток и доля гипертрофированной микроглии были пропорциональны возрасту [7, 26, 27]. Установлено, что при старении в головном мозге снижается фагоцитарная функция микроглии [28, 29].
Сравнительные исследования особенностей микроглии головного и СМ в норме, при повреждениях и различных заболеваниях показывают, что клетки микроглии СМ значительно отличаются от микроглиоцитов головного мозга как морфологически, так и функционально [18, 30]. В отличие от головного мозга, реактивные изменения микроглии СМ при старении изучены недостаточно. В настоящей работе исследовали микроглиоциты как серого, так и белого вещества СМ крыс в возрасте 4 и 18 мес. При проведении иммуногистохимического выявления микроглиоцитов молодых и стареющих животных не было отмечено изменения количества Iba-1-содержащих клеток в области серого вещества СМ. Морфологические характеристики клеток микроглии в сером веществе СМ с возрастом также существенно не изменяются, лишь единичные иммунопозитивные клетки СМ 18-месячных крыс проявляют признаки активации. Амебоидные клетки отсутствуют как в дорсальном, так и в вентральном сером веществе СМ стареющих животных. Подобную картину наблюдали при анализе возрастных изменений микроглии спинного мозга у собак [20].
При исследовании СМ молодых и стареющих крыс с применением иммуногистохимического выявления ядерного белка нервных клеток (NeuN) было установлено, что количество нейронов в шейном отделе СМ крыс не меняется при старении, что дополняет результаты исследований, выполненных на животных, относящихся к другим видам [20, 31]. Так как количественный анализ нейронов в СМ крыс не выявил изменения числа клеток при старении, то найденное нами присутствие незначительного числа гипертрофированных (реактивно измененных) микроглиоцитов в сером веществе СМ стареющих крыс не связано с гибелью нейронов и их отростков. Однако стоит учесть, что такая микроглия может способствовать развитию процессов нейродегенерации на более поздних сроках онтогенеза. Известно, что активированная микроглия вносит значительный вклад в патогенез нейродегенеративных заболеваний путем синтеза различных цитотоксических молекул, свободных радикалов, провоспалительных простагландинов и цитокинов [25, 32]. Вероятно, дальнейшее старение животных может привести к росту доли активированных микроглиоцитов и гибели нейронов.
При сравнении распределения и структурных особенностей микроглиоцитов 4- и 18-месячных крыс были отмечены значительные реактивные изменения микроглии белого вещества СМ крыс. Установлено, что плотность распределения клеток микроглии в области дорсального канатика СМ у стареющих животных превышает аналогичный показатель 4-месячных крыс более чем в 2 раза, а площадь, занимаемая Iba-1-иммунопозитивными клетками в этой области, возрастает при старении более чем в 3 раза. Дорсальный канатик СМ является важным восходящим путем передачи сенсорной информации. Центральные отростки чувствительных нейронов в составе задних корешков входят в СМ и, образуя дорсальный канатик, обеспечивают дальнейшее распространение сенсорных сигналов по восходящим трактам к различным отделам головного мозга. Кроме того, в области дорсального белого вещества СМ крыс располагается корково-спинномозговой путь, являющийся ключевым элементом контроля двигательных функций и контроля сенсорной обратной связи на уровне СМ [33, 34]. Данный нисходящий тракт СМ является дополнительным уровнем сенсомоторной интеграции [35, 36]. Увеличение количества реактивной микроглии в области проводящих путей СМ может свидетельствовать о начале патологических изменений со стороны сенсорной и двигательной систем.
В работах, посвященных старению головного мозга, авторы связывают реактивные изменения микроглии с нарушениями процессов миелинизации. Обнаруженное в настоящем исследовании увеличение количества реактивной микроглии в области дорсального канатика (клиновидного, тонкого пучка и дорсального кортикоспинального тракта) в СМ 18-месячных крыс также может свидетельствовать о начале демиелинизации аксонов сенсорной системы. Можно предположить, что при старении фрагменты миелиновых оболочек проводящих трактов накапливаются в дорсальном белом веществе и фагоцитируется клетками микроглии. Известно, что в сенсомоторной системе (дорсальный канатик) стареющих крыс уже к 12 мес. постнатального развития наблюдаются выраженные изменения в миелиновой оболочке аксонов, проявляющиеся волнообразным разделением миелиновых слоев, разрушением миелина, вздутием аксонов и участками локальной демиелинизации [37].
Мы полагаем, что активация микроглиоцитов дорсального белого вещества может быть обусловлена не только процессами демиелинизации чувствительных афферентов, но также гибелью сенсорных нейронов спинномозгового ганглия, обусловленной старением. Сокращение числа нейронов спинномозгового ганглия с возрастом ранее было отмечено у крыс и кроликов [38, 39]. В исследованиях, выполненных на мышах, установлено, что проприоцептивные сенсорные нейроны, афференты которых образуют тонкий и клиновидный пучки СМ, дегенерируют при старении [40]. В нашей предыдущей работе было отмечено, что в спинномозговом ганглии крыс в возрасте 18 месяцев происходит активация клеток-сателлитов [41], что свидетельствует о метаболических изменениях, происходящих в чувствительных нейронах при старении, и начале дегенеративных изменений их центральных афферентов.
Отмеченное в настоящей работе преобладание реактивной микроглии и клеток с крупными вакуолями, предположительно содержащими липиды, в тонком пучке СМ по сравнению с клиновидным пучком свидетельствует о более активном процессе демиелинизации в нижележащих (грудном и поясничном) сегментах СМ стареющих крыс по сравнению с шейным отделом.
В настоящем исследовании в вентральном белом веществе СМ стареющих животных отмечено значительное увеличение площади, занимаемой микроглиоцитами, по сравнению с группой молодых крыс. При этом не наблюдается увеличения количества клеток микроглии. Такой факт объясняется присутствием в области вентрального белого вещества СМ крупных скоплений (агрегатов) микроглиоцитов, впервые идентифицированных в настоящем исследовании. Их образование, вероятно, связано с демиелинизацией аксонов, образующих передний кортикоспинальный тракт. Нами не было отмечено микроглиальной реакции в латеральных областях белого вещества, где также проходят нисходящие двигательные тракты. Исследование, выполненное на более старых крысах (30 месяцев), показало значительное увеличение числа микроглиоцитов как в тонком пучке дорсального белого вещества СМ, так и в латеральном и вентральном белом веществе [19]. По-видимому, по мере старения патологические изменения сенсомоторных путей прогрессируют и захватывают дорсальные, латеральные и вентральные тракты СМ.
В последние годы особое внимание уделяется участию микроглиоцитов головного мозга в фагоцитозе миелина и участию микроглиоцитов в процессах де- и ремиелинизации при нейродегенеративных заболеваниях и повреждениях головного мозга. Такие исследования выполняются с целью формирования терапевтических подходов для модуляции фагоцитоза и ремиелинезации [42–44]. Исследования, касающиеся участия микроглиоцитов СМ в фагоцитозе миелина и ремиелинизации при старении, малочисленны [45]. Известно, что утилизация миелиновых фрагментов имеет решающее значение для процесса ремиелинизации [46]. Избыточное накопление неразрушенных фрагментов миелина во внеклеточном пространстве после длительной демиелинизации ингибирует дифференцировку предшественников олигодендроцитов и препятствует ремиелинизации [43, 46–48]. Можно предположить, что выявленное нами накопление микроглиоцитов в области белого вещества СМ при старении в некоторой степени связано с протекающими процессами ремиелинизации. Кроме того, известно, что микроглиоциты способны принимать участие в процессах ремиелинизации аксонов путем синтеза факторов роста для созревания предшественников олигодендроцитов в дополнение к удалению ингибирующих фрагментов миелина.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе выявлены возрастные изменения клеток микроглии СМ крыс и определены региональные особенности обнаруженных изменений. Сравнительное исследование белого и серого вещества СМ показало, что реактивные изменения микроглиоцитов более характерны для белого вещества. Предположительно, это связано с активными процессами де- и ремиелинизации нервных волокон СМ. Впервые показано, что у стареющих животных наибольшие изменения претерпевает микроглия дорсального и вентрального канатика. В этих областях выявлены также скопления (агрегаты) реактивных микроглиоцитов. Проводящие пути вентрального и дорсального канатика СМ обеспечивают восприятие сенсорной информации от внешних раздражителей, осуществляют ее оценку и определяют последующую двигательную активность Полученные результаты свидетельствуют о возможном вкладе микроглии в патогенез сенсорных нарушений, связанных со старением.
Список литературы
Hickman S, Izzy S, Sen P, Morsett L, El Khoury J (2018) Microglia in neurodegeneration. Nat Neurosci 21: 1359–1369. https://doi.org/10.1038/s41593-018-0242-x
Xu Y, Jin MZ, Yang ZY, Jin WL (2021) Microglia in neurodegenerative diseases. Neural Regen Res 16: 270–280. https://doi.org/10.4103/1673-5374.290881
Yoo H-J, Kwon M-S (2021) Aged microglia in neurodegenerative diseases: microglia lifespan and culture methods. Front Aging Neurosci 13: 766267. https://doi.org/10.3389/fnagi.2021.766267
Tremblay MÈ (2011) The role of microglia at synapses in the healthy CNS: novel insights from recent imaging studies. Neuron Glia Biol 7(1): 67–76. https://doi.org/10.1017/S1740925X12000038
Colonna M, Butovsky O (2017) Microglia function in the central nervous system during health and neurodegeneration. Annu Rev Immunol 35: 441–468. https://doi.org/10.1146/annurev-immunol-051116-052358
Kolos EA, Korzhevskii DE (2020) Spinal cord microglia in health and disease. Acta Naturae 12(1): 4–17. https://doi.org/10.32607/actanaturae.10934
Damani MR, Zhao L, Fontainhas AM, Amaral J, Fariss RN, Wong WT (2011). Age-related alterations in the dynamic behavior of microglia. Aging Cell 10: 263–276. https://doi.org/10.1111/j.1474-9726.2010.00660.x
Njie EG, Boelen E, Stassen FR, Steinbusch HW, Borchelt DR, Streit WJ (2012). Ex vivo cultures of microglia from young and aged rodent brain reveal age-related changes in microglial function. Neurobiol Aging 33: 195 e1–e12. https://doi.org/10.1016/j.neurobiolaging.2010.05.008
Hart AD, Wyttenbach A, Perry VH, Teeling JL (2012) Age related changes in microglial phenotype vary between CNS regions: grey versus white matter differences. Brain Behav Immun 26: 754–765. https://doi.org/10.1016/j.bbi.2011.11.006
Nikodemova M, Small AL, Kimyon RS, Watters JJ (2016) Age-dependent differences in microglial responses to systemic inflammation are evident as early as middle age. Physiol Genomics 48(5): 336–344. https://doi.org/10.1152/physiolgenomics.00129.2015
Stojiljkovic MR, Ain Q, Bondeva T, Heller R, Schmeer C, Witte OW (2019) Phenotypic and functional differences between senescent and aged murine microglia. Neurobiol Aging 74: 56–69. https://doi.org/10.1016/j.neurobiolaging.2018.10.007
Seidler RD, Bernard JA, Burutolu TB, Fling BW, Gordon MT, Gwin JT, Kwak Y, Lipps DB (2010) Motor control and aging: links to age-related brain structural, functional, and biochemical effects. Neurosci Biobehav Rev 34: 721–733. https://doi.org/10.1016/j.neubiorev.2009.10.005
Streit WJ, Xue Q-S (2010) The brain’s aging immune system. Aging Dis 1(3): 254–261.
Tomasi D, Volkow ND (2012) Aging and functional brain networks. Mol Psychiatry 17: 549–558. https://doi.org/10.1038/mp.2011.81
von Bernhardi R, Eugenin-von Bernhardi L, Eugenin J (2015) Microglial cell dysregulation in brain aging and neurodegeneration. Front Aging Neurosci 7: 124. https://doi.org/10.3389/fnagi.2015.00124
Salas IH, Burgado J, Allen NJ (2020) Glia: victims or villains of the aging brain? Neurobiol Disease 143: 105008. https://doi.org/10.1016/j.nbd.2020.105008
Costa J, Martins S, Ferreira PA, Cardoso AMS, Guedes JR, Peça J, Cardoso AL (2021). The old guard: Age-related changes in microglia and their consequences. Mech Ageing Dev 197: 111512. https://doi.org/10.1016/j.mad.2021.111512
Xuan FL, Chithanathan K, Lilleväli K, Yuan X, Tian L (2019) Differences of microglia in the brain and the spinal cord. Front Cell Neurosci 14(13): 504. https://doi.org/10.3389/fncel.2019.00504
Kullberg S, Aldskogius H, Ulfhake B (2001) Microglial activation, emergence of ED1-expressing cells and clusterin upregulation in the aging rat CNS, with special reference to the spinal cord. Brain Res 899: 169–186. https://doi.org/10.1016/S0006-8993(01)02222-3
Chung JY, Choi JH, Lee CH, Yoo KY, Won MH, Yoo DY, Kim DW, Choi SY, Youn HY, Moon SM, Hwang IK (2010) Comparison of ionized calcium-binding adapter molecule 1-immunoreactive microglia in the spinal cord between young adult and aged dogs. Neurochem Res 35: 620–627. https://doi.org/10.1007/s11064-009-0108-4
Lee S, Wu Y, Shi XQ, Zhang J (2015) Characteristics of spinal microglia in aged and obese mice: potential contributions to impaired sensory behavior. Immunity & Ageing 12: 22. https://doi.org/10.1186/s12979-015-0049-5
Ritzel RM, Patel AR, Pan S, Crapser J, Hammond M, Jellison E, McCullough LD (2015) Age- and location-related changes in microglial function. Neurobiol Aging 36: 2153–2163. https://doi.org/10.1016/j.neurobiolaging.2015.02.016
Korzhevskii DE, Sukhorukova EG, Kirik OV, Grigorev IP (2015) Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde Eur J Histochem 59(3): 233–237. https://doi.org/10.4081/ejh.2015.2530
Kongsui R, Beynon SB, Johnson SJ, Walker FR (2014) Quantitative assessment of microglial morphology and density reveals remarkable consistency in the distribution and morphology of cells within the healthy prefrontal cortex of the rat. J Neuroinflam 11: 182. https://doi.org/10.1186/s12974-014-0182-7
Streit WJ, Xue QS, Tischer J, Bechmann I (2014) Microglial pathology. Acta Neuropathol Commun 2: 142. https://doi.org/10.1186/s40478-014-0142-6
Tremblay ME, Zettel ML, Ison, JR, Allen PD, Majewska AK (2012) Effects of aging and sensory loss on glial cells in mouse visual and auditory cortices. Glia 60: 541–558. https://doi.org/10.1002/glia.22287
Shahidehpour RK, Higdon RE, Crawford NG, Neltner JH, Ighodaro ET, Patel E, Price D, Nelson PT, Bachstetter AD (2021) Dystrophic microglia are associated with neurodegenerative disease and not healthy aging in the human brain. Neurobiol Aging 99: 19–27. https://doi.org/10.1016/j.neurobiolaging.2020.12.003
Bliederhaeuser C, Grozdanov V, Speidel A, Zondler L, Ruf W P, Bayer H, Kiechle M, Feiler MS, Freischmidt A, Brenner D, Witting A, Hengerer B, Fändrich M, Ludolph AC, Weishaupt JH, Gillardon F, Danzer KM (2016) Age-dependent defects of alpha-synuclein oligomer uptake in microglia and monocytes. Acta Neuropathol 131: 379–391. https://doi.org/10.1007/s00401-015-1504-2
Yanguas-Casás N, Crespo-Castrillo A, Arevalo MA, Garcia-Segura LM (2020) Aging and sex: Impact on microglia phagocytosis. Aging Cell 19(8): e13182. https://doi.org/10.1111/acel.13182
Zhang B, Gensel JC (2014) Is neuroinflammation in the injured spinal cord different than in the brain? Examining intrinsic differences between the brain and spinal cord. Exp Neurol 258:112–120. https://doi.org/10.1016/j.expneurol.2014.04.007
Maxwell N, Castro RW, Sutherland NM, Vaughan KL, Szarowicz MD, de Cabo R, Mattison A, Valdez G (2018) α-Motor neurons are spared from aging while their synaptic inputs degenerate in monkeys and mice. Aging Cell 17: e12726. https://doi.org/10.1111/acel.12726
Azam S, Haque M, Kim IS, Choi DK (2021) Microglial turnover in ageing-related neurodegeneration: therapeutic avenue to intervene in disease progression. Cells 10(1): 150. https://doi.org/10.3390/cells10010150
Carvalho WA, Bahia CP, Teixeira JC, Gomes-Leal W, Pereira A (2017) Interlimb Dynamic after Unilateral Focal Lesion of the Cervical Dorsal Corticospinal Tract with Endothelin-1. Front Neuroanat 11: 89. https://doi.org/10.3389/fnana.2017.00089
Bieler L, Grassner L, Zaunmair P, Kreutzer C, Lampe L, Trinka E, Marschallinger J, Aigner L, Couillard-Despres S (2018) Motor deficits following dorsal corticospinal tract transection in rats: voluntary versus skilled locomotion readouts. Heliyon 4: e00540. https://doi.org/10.1016/j.heliyon.2018.e00540
Moreno-López Y, Olivares-Moreno R, Cordero-Erausquin M, Rojas-Piloni G (2016) Sensorimotor Integration by Corticospinal System. Front Neuroanat 10: 24. https://doi.org/10.3389/fnana.2016.00024
Alam M, Garcia-Alias G, Jin B, Keyes J, Zhong H, Roy RR, Gerasimenko Y, Lu DC, Edgerton VR (2017) Electrical neuromodulation of the cervical spinal cord facilitates forelimb skilled function recovery in spinal cord injured rats. Exp Neurol 291: 141–150. https://doi.org/10.1016/j.expneurol.2017.02.006
Xie F, Zhang JC, Fu H, Chen J (2013) Age-related decline of myelin proteins is highly correlated with activation of astrocytes and microglia in the rat CNS. Int J Mol Med 32: 1021–1028. https://doi.org/10.3892/ijmm.2013.1486
Bergman E, Ulfhake B (1998) Loss of primary sensory neurons in the very old rat: neuron number estimates using the disector method and confocal optical sectioning. J Comp Neurol 396: 211–222.
Pannese E, Sartori P, Martinelli C, Ledda M (1998) Age-related decrease in the overall extent of perikaryal projections in rabbit spinal ganglion neurons. Neurosci Lett 254: 177–179.
Vaughan SK, Stanley OL, Valdez G (2017) Impact of aging on proprioceptive sensory neurons and intrafusal muscle fibers in mice. J Gerontol A Biol Sci Med Sci 72(6): 771–779. https://doi.org/10.1093/gerona/glw175
Kolos EA, Korzhevskii DE (2020) Immunohistological detection of active satellite cellsin rat dorsal root ganglia after parenteral administration of lipopolysaccharide and during aging. Bull Exp Biol Med 169(5): 665–668. https://doi.org/10.1007/s10517-020-04950-2
Thériault P, Rivest S (2016) Microglia: senescence impairs clearance of myelin debris. Current Biol 26(16): R772–R775. https://doi.org/10.1016/j.cub.2016.06.066
Pinto MV, Fernandes A (2020) Microglial phagocytosis-rational but challenging therapeutic target in multiple sclerosis. Int J Mol Sci 21(17): 5960. https://doi.org/10.3390/ijms21175960
Sen MK, Mahns DA, Coorssen JR, Shortland PJ (2022) The roles of microglia and astrocytes in phagocytosis and myelination: Insights from the cuprizone model of multiple sclerosis. Glia 70(7): 1215–1250. https://doi.org/10.1002/glia.24148
Rawji KS, Kappen J, Tang W, Teo W, J PlemelR, Stys PK, Yong VW (2018) Deficient surveillance and phagocytic activity of myeloid cells within demyelinated lesions in aging mice visualized by ex vivo live multiphoton imaging. J Neurosci 38 (8): 1973–1988. https://doi.org/10.1523/JNEUROSCI.2341-17.2018
Lampron A, Larochelle A, Laflamme N, Prefontaine P, Plante MM, Sanchez MG, Yong VW, Stys PK, Tremblay MÈ, Rivest S (2015) Inefficient clearance of myelin debris by microglia impairs remyelinating processes. J Exp Med 212 (4): 481–495. https://doi.org/10.1084/jem.20141656
Lloyd AF, Miron VE (2019) The pro-remyelination properties of microglia in the central nervous system. Nat Rev Neurol 15(8): 447–458. https://doi.org/10.1038/s41582-019-0184-2
Shen K, Reichelt M, Kyauk R, Ngu H, Shen Y, Foreman O, Modrusan Z, Friedman BA, Sheng M, Yuen TJ (2021) Multiple sclerosis risk gene Mertk is required for microglial activation and subsequent remyelination. Cell Rep 34(10): 108835. https://doi.org/10.1016/j.celrep.2021.108835
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


