Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 8, стр. 1028-1041
Эффективность различных доз метформина для восстановления метаболических показателей и гормонального статуса у самцов крыс с ограничением грудного вскармливания
К. В. Деркач 1, *, В. М. Бондарева 1, Т. С. Шарова 1, А. О. Шпаков 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: derkatch_k@list.ru
Поступила в редакцию 02.06.2022
После доработки 30.06.2022
Принята к публикации 04.07.2022
- EDN: FYSKNB
- DOI: 10.31857/S0869813922080015
Аннотация
Ограничение грудного вскармливания в раннем онтогенезе (Early Weaned, EW) приводит к метаболическим нарушениям в зрелом возрасте, являясь одной из причин метаболического синдрома (МС). Однако спектр гормональных нарушений при EW изучен в недостаточной степени, а подходы для его коррекции не разработаны. Целью работы было изучить метаболические и гормональные изменения, включая гормональный статус гонадной и тиреоидной осей, у 10-месячных самцов крыс, которые в раннем постнатальном периоде были лишены грудного вскармливания, а также исследовать восстанавливающий эффект на эти изменения четырехнедельного лечения с помощью различных доз метформина (МФ) – средней (120 мг/кг/сутки) и сравнительно высокой (250 мг/кг/сутки). Лактацию у кормящих самок крыс прерывали с помощью бромокриптина (10 мг/кг/сутки) на 19–21-й дни лактации. Крысят после вынужденного голодания в этот период переводили на стандартный корм. В возрасте 10 месяцев самцы крыс группы EW имели характерные признаки МС, такие как ожирение, нарушенная толерантность к глюкозе, инсулинорезистентность, гиперлептинемия, дислипидемия. У них были снижены уровни тестостерона, лютеинизирующего гормона (ЛГ) и тиреоидных гормонов и повышен уровень тиреотропного гормона (ТТГ). Четырехнедельное лечение МФ взрослых крыс в средней дозе снижало массу тела и жира, частично восстанавливало метаболические показатели, в полной мере нормализовало уровни тестостерона, ЛГ, тироксина, трийодтиронина и ТТГ. Лечение МФ в относительно высокой дозе более эффективно восстанавливало метаболические показатели, нормализовало уровни лептина и инсулина, но слабо влияло на уровни гормонов гонадной и тиреоидной осей. Таким образом, длительное лечение самцов крыс группы EW с помощью средних доз МФ улучшает метаболические показатели и полностью восстанавливает гормональный статус гонадной и тиреоидной осей, что указывает на перспективность использования таких доз для коррекции МС и эндокринных дисфункций, вызванных нарушением грудного вскармливания.
Бигуанид метформин (МФ), препарат первой линии выбора при лечении сахарного диабета 2-го типа [1–4], широко применяется для нормализации метаболических и гормональных показателей и при ряде других заболеваний, среди которых метаболический синдром (МС), атеросклероз, поликистоз яичников, старческая деменция, онкологические заболевания [5–7]. Значительные перспективы имеет применение МФ для восстановления функций эндокринной системы, в том числе не связанных с развитием диабета [8–11]. Известно, что нарушение грудного вскармливания и голодание в раннем постнатальном периоде приводят к метаболическим и гормональным нарушениям в зрелом возрасте [12]. Моделирование таких состояний у крыс показывает, что в результате острого дефицита грудного вскармливания в дальнейшем, в возрасте трех и более месяцев, у них начинают выявляться такие признаки МС, как нарушение толерантности к глюкозе, изменения липидного и углеводного метаболизма [13–17]. Поскольку основным механизмом терапевтического воздействия МФ является восстановление чувствительности тканей к инсулину, снижение всасывания глюкозы в желудочно-кишечном тракте и нормализация метаболизма, то имеются основания полагать, что МФ-терапия способна улучшить метаболические и гормональные показатели при МС-подобном состоянии, которое запрограммировано дефицитом пищевых ресурсов, в первую очередь, ограничением потребления грудного молока в раннем онтогенезе. В соответствии с этим одной из задач данного исследования было проверить это предположение.
Имеются данные, что следствием ограничения грудного вскармливания являются нарушения со стороны эндокринной системы, но эти данные немногочисленны и противоречивы [16, 18–20]. Так, показано, что снижение потребляемого крысятами грудного молока вследствие избыточного их числа в помете (20 крысят) в зрелом возрасте приводит к андрогенной недостаточности [18]. Вызываемое различными способами ограничение грудного вскармливания приводит к развитию у взрослых животных дефицита тиреоидных гормонов, в первую очередь тироксина, что указывает на ослабление функций щитовидной железы [19, 20]. При этом данные о влиянии фармакологических препаратов на функции эндокринной системы у крыс с дефицитом грудного вскармливания отсутствуют. Обнаружение гормональных изменений в гонадной и тиреоидной осях и оценка влияния на них МФ были другими задачами нашего исследования.
В соответствии с вышесказанным, целью работы было исследовать метаболические и гормональные изменения, в том числе гормональный статус гонадной и тиреоидной осей, у 10-месячных самцов крыс с ограничением грудного вскармливания, вызванным обработкой кормящих самок бромокриптином, а также оценить восстанавливающее влияние на эти показатели четырехнедельного лечения МФ. Поскольку при различных метаболических и эндокринных заболеваниях используют различные дозы МФ, то нами были изучены средняя доза (120 мг/кг/сутки), обычно используемая для коррекции ожирения и МС у крыс, и более высокая доза препарата (250 мг/кг/сутки), применяемая, как правило, при более тяжелых расстройствах, в первую очередь при сахарном диабете 2-го типа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для экспериментов были использованы крысы линии Вистар, которых содержали в стандартных условиях вивария, при свободном доступе к корму и воде. Все процедуры по уходу за животными и их использованию для создания, характеристики и изучения модели МС осуществляли в строгом соответствии с требованиями Этического комитета Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН, European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Для опытов использовались самцы крыс Вистар, которые в раннем онтогенезе испытали дефицит грудного вскармливания и возраст которых в начале эксперимента составил 9 мес. В неонатальный период число крысят в помете составило от 8 до 10 животных, чтобы в контрольной группе результаты не зависели от возможного дефицита грудного вскармливания, характерного для больших пометов. Взрослых самцов крыс содержали по 6 животных в пластиковом контейнере с неограниченным доступом к питьевой воде и стандартному сухому корму.
Модель ограничения грудного вскармливания, называемую также моделью “раннего отлучения от груди” (Early Weaned, EW), индуцировали вследствие прекращения лактации у кормящих самок на 19–21-й дни постнатального развития (P19–P21), согласно методу [13] с некоторыми модификациями. Для этого кормящим самкам дважды в день перорально (через зонд) вводили суспензию бромокриптин-мезилата в суточной дозе 10 мг/крысу (“Gedeon Richter, Plc.”, Венгрия). В течение трех дней (P19–P21) крысята не имели доступа к пище, начиная с дня P22 их переводили на стандартный сухой корм. Самцы-крысята, которые были в пометах того же размера, но получали полноценное грудное вскармливание, в дальнейшем служили контролем. Кормящие их самки в те же сроки и в том же объеме вместо суспензии бромокриптина получали физиологический раствор. После отъема от самок, самцов-крысят одного и того же возраста случайным образом распределяли в разные контейнеры.
В возрасте 6 месяцев у самцов-крыс группы EW были отмечены значимое повышение массы тела и повышенный уровень постпрандиальной глюкозы (через 2 ч после потребления пищи), что указывало на развитие МС. В возрасте 9 мес., перед началом МФ-терапии, у животных оценивали массу тела и уровень глюкозы через 120 мин после глюкозной нагрузки (2 г/кг массы тела), и на основании полученных данных отбирали крыс с явными признаками ожирения (масса тела более 400 г) и нарушенной толерантностью к глюкозе (уровень глюкозы через 120 мин после глюкозной нагрузки выше 6.5 мМ). Отобранных животных (36 крыс) с EW рандомизировали на 3 группы (в каждой n = 12): интактные самцы крыс с ограничением грудного вскармливания в раннем онтогенезе, которые вместо МФ в течение 4 недель через зонд получали физиологический раствор (группа EW), EW-крысы, которые на протяжении 4 нед. получали лечение МФ (перорально, через зонд) в двух дозах – 120 мг/кг/сутки (группа EW-МФ120) и 250 мг/кг/сутки (группа EW-МФ250). В качестве контроля использовали самцов крыс того же возраста, которые полноценно питались в раннем онтогенезе (группа К, n = 12).
За неделю до окончания лечения МФ у половины крыс в каждой группе (n = 6) проводили глюкозотолерантный тест (ГТТ), у другой половины – инсулиноглюкозотолерантный тест (ИГТТ). При проведении ГТТ крысам вводили глюкозу (2 г/кг, в/б), в то время как в случае ИГТТ животные одновременно получали глюкозу (2 г/кг, в/б) и инсулин “Humalog” (Eli Lilly, Швейцария) в дозе 0.8 МЕ/крысу (п/к). Перед введением и через 15, 30, 60, 90 и 120 мин после него измеряли уровни глюкозы в крови, для чего использовали тест-полоски “One Touch Select” (США) и глюкометр (Life Scan Johnson & Johnson, Дания). До и через 120 мин после введения глюкозы в ГТТ и ИГТТ из хвостовой вены забирали образцы крови для определения концентрации инсулина, используя местный наркоз (2–4 мг лидокаина/крысу). Концентрацию инсулина измеряли с помощью ИФА-набора “Rat Insulin ELISA” (Mercodia, Швеция). До введения глюкозы оценивали уровень свободных жирных кислот, для чего использовали набор “NEFA FS kit” (DiaSys, Германия). Через 2 и 4 нед. после начала лечения МФ у животных забирали кровь для определения концентраций свободного тироксина (fT4), общего тироксина (tT4), свободного трийодтиронина (fT3) и общего трийодтиронина (tT3), тестостерона. Уровни тиреоидных гормонов оценивали с помощью наборов фирмы “Иммунотех” (Россия), тестостерона – с помощью набора фирмы “АлкорБио” (Россия).
В конце эксперимента крыс наркотизировали хлоральгидратом (400 мг/кг, в/б), декапитировали, оценивали у них содержание абдоминального и эпидидимального жира и определяли уровни гормонов и метаболитов в крови. Для измерения уровней лептина, лютеинизирующего (ЛГ) и тиреотропного гормонов (ТТГ) и гликированного гемоглобина (HbA1c) использовали наборы “ELISA for Leptin, Rat”, “ELISA for LH, Rat” (Cloud-Clone Corp., США), “Rat Thyroid Stimulating Hormone ELISA” (Cusabio Biotech Co., Китай) и “Multi Test HbA1c System kit” (Polymer Technology Systems, Inc., США). Для измерения уровней триглицеридов и общего холестерина использовали тест-полоски “Triglycerides multiCare-in” и “Cholesterol multiCare-in” (Biochemical Systems Int., Италия). Индекс инсулиновой резистентности (ИР) рассчитывали как произведение концентраций глюкозы и инсулина в крови и представляли в виде условных единиц.
Для статистического анализа данных применяли пакет программ Microsoft Office Excel 2007, результаты представляли как среднее ± стандартная ошибка среднего (M ± SEM). Нормальность распределения оценивали с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения 3 или 4 групп – дисперсионный анализ с поправкой Бонферрони. Достоверными считали различия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
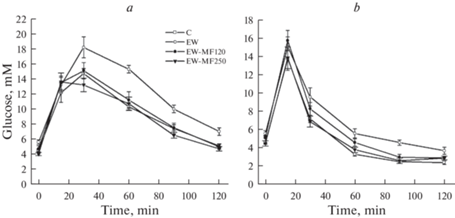
Взрослые, 10-месячные крысы с лишением грудного вскармливания в период P19–P21 имели повышение массы тела, абдоминального и эпидидимального жира и доли жировой ткани, что указывает на явные признаки ожирения, а также повышенные уровни триглицеридов и общего холестерина, это свидетельствует о нарушении липидного обмена (табл. 1). Отмечали тенденцию к повышению уровня свободных жирных кислот, но различия с контролем не были статистически значимыми (p > 0.05). Несмотря на отсутствие между группами К и EW значимых различий в уровне глюкозы натощак и содержания HbA1c в крови (табл. 1), при проведении ГТТ и ИГТТ уровни глюкозы в группе EW в различные временные точки, в том числе через 120 мин после глюкозной нагрузки, были выше, чем в контроле (рис. 1). Это иллюстрируют и более высокие значения AUC0–120 для ГТТ и ИГТТ в группе EW в сравнении с контролем (табл. 1).
Таблица 1.
Масса тела и жировой ткани, липидный статус и глюкозный гомеостаз у самцов крыс Вистар с ранним отлучением от груди (EW, Early Weaned) и влияние на них четырехнедельной терапии метформином в суточных дозах 120 и 250 мг/кг
| Показатель | К | EW | EW-МФ120 | EW-МФ250 |
|---|---|---|---|---|
| Масса тела, г | 394 ± 9 | 453 ± 11a | 419 ± 11 | 401 ± 14b |
| Масса АЖ, г | 6.6 ± 0.3 | 10.0 ± 0.7a | 7.8 ± 0.7 | 6.8 ± 0.5b |
| Масса ЭЖ, г | 3.9 ± 0.2 | 5.6 ± 0.4a | 4.9 ± 0.3 a | 4.4 ± 0.3b |
| Доля жира, % | 2.7 ± 0.1 | 3.4 ± 0.2a | 3.0 ± 0.2 | 2.8 ± 0.1b |
| ТГ, мМ | 2.07 ± 0.15 | 3.31 ± 0.24a | 2.79 ± 0.17 a | 2.12 ± 0.14b, c |
| ОХ, мМ | 4.40 ± 0.14 | 5.32 ± 0.28a | 4.78 ± 0.17 | 4.29 ± 0.18b |
| СЖК, мМ | 3.79 ± 0.15 | 4.60 ± 0.39 | 4.16 ± 0.22 | 4.03 ± 0.19 |
| Глюкоза, мМ | 4.27 ± 0.13 | 5.09 ± 0.31 | 4.49 ± 0.15 | 4.01 ± 0.17b |
| HbA1c, % | 4.38 ± 0.16 | 5.57 ± 0.34 | 4.47 ± 0.19 b | 4.26 ± 0.15b |
| AUC0–120, ГТТ* | 1151 ± 35 | 1513 ± 39a | 1212 ± 62 b | 1116 ± 62b |
| AUC0–120, ИГТТ* | 611 ± 31 | 844 ± 59a | 732 ± 46 | 630 ± 52b |
АЖ и ЭЖ – абдоминальный и эпидидимальный жир, ТГ – триглицериды, ОХ – общий холестерин, СЖК – свободные жирные кислоты, AUC0–120 (ГТТ) и AUC0–120 (ИГТТ) – площади под кривыми “концентрация глюкозы, мМ – время, мин” (в условных единицах) в глюкозотолерантном и инсулиноглюкозотолерантном тестах. Различия с группой К (a), между группой EW и группами, обработанными метформином (b) и между группами EW-МФ120 и EW-МФ250 (c) статистически значимы при p < 0.05. M ± SEM, n = 12. * – при проведении ГГТ и ИГТТ число животных n = 6.
Рис. 1.
Концентрация глюкозы в крови крыс с ограничением грудного вскармливания при проведении глюкозотолерантного (a) и инсулиноглюкозотолерантного (b) тестов и влияние на утилизацию глюкозы четырехнедельной терапии метформином в дозах 120 и 250 мг/кг/сутки. Обозначения групп – К (C), EW, EW-МФ120 (EW-MF120), EW-МФ250 (EW-MF250). M ± SEM, n = 6.
Уровни инсулина через 120 мин после введения глюкозы и значения индекса ИР, как базовые, так и после глюкозной нагрузки, значимо превышали таковые в контроле (рис. 2).
Рис. 2.
Уровни инсулина в крови (a) и рассчитанные значения индекса инсулиновой резистентности (b) у взрослых крыс с ограничением грудного вскармливания до (0 мин) и через 120 мин после нагрузки глюкозой в глюкозотолерантном тесте и влияние на них четырехнедельной терапии различными дозами метформина. Различия с группой К (a) и между группой EW и группами, обработанными метформином (b), статистически значимы при p < 0.05. M ± SEM, n = 6. Обозначения групп: К (C), EW, EW-МФ120 (EW-MF120), EW-МФ250 (EW-MF250).

Четырехнедельное лечение МФ в обеих исследованных дозах улучшало метаболические показатели, но в более высокой дозе препарат был эффективнее. Так, в группе EW-МФ250 отмечали достоверное снижение в сравнении с группой EW массы тела и жира, триглицеридов, холестерина, HbA1c, глюкозы, значений AUC0–120 для ГТТ и ИГТТ, индекса ИР, а также уровня инсулина после глюкозной нагрузки (табл. 1, рис. 1, 2). В группе EW-МФ120 значимо, в сравнении с группой EW, снижались только индекс ИР, концентрации глюкозы и инсулина через 120 мин после глюкозной нагрузки, значение AUC0–120 для глюкозной кривой в ГТТ и содержание HbA1c (табл. 1, рис. 1, 2). Следует отметить, что в группе EW-МФ120 масса тела и абдоминального жира, концентрация холестерина в крови и значение AUC0–120 для глюкозной кривой в ИГТТ, хотя и не отличались от группы EW, но не отличались и от контроля, что указывает на их частичное восстановление средними дозами МФ (табл. 1).
В отличие от инсулина, базовый уровень которого в группе EW не отличался от контрольных значений, уровни других изученных полипептидных гормонов у EW-крыс значимо менялись. В группе EW концентрации лептина и ТТГ повышались, а концентрация ЛГ снижалась (табл. 2). Средние дозы МФ полностью восстанавливали уровни ЛГ и ТТГ, но слабо влияли на уровень лептина, который оставался повышенным, в то время как высокие дозы МФ нормализовали уровень лептина, но при этом в незначительной степени влияли на уровни обоих гипофизарных гормонов. Так в группе EW-МФ250 концентрация ТТГ была выше по сравнению с контролем и группой EW-МФ120, но не отличалась от группы EW (табл. 2).
Таблица 2.
Уровни гормонов у 10-месячных самцов крыс с ограничением грудного вскармливания и влияние на них четырехнедельной терапии различными дозами метформина
| Показатель | К | EW | EW-МФ120 | EW-МФ250 |
|---|---|---|---|---|
| Лептин, нг/мл | 0.93 ± 0.10 | 1.81 ± 0.16a | 1.37 ± 0.13a | 1.03 ± 0.11b |
| ЛГ, нг/мл | 1.98 ± 0.16 | 1.39 ± 0.12a | 2.03 ± 0.16b | 1.47 ± 0.14c |
| ТТГ, мкЕД/мл | 0.52 ± 0.06 | 1.43 ± 0.15a | 0.54 ± 0.09b | 0.98 ± 0.12a, c |
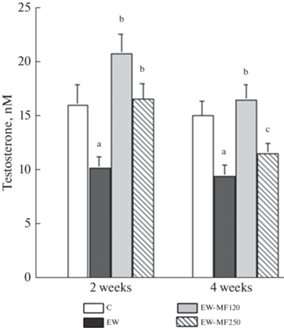
Уровни тиреоидных гормонов и тестостерона у самцов крыс группы EW были снижены, что свидетельствует о нарушении функций тиреоидной и гонадной осей (рис. 3, 4). Двухнедельная обработка крыс группы EW обеими дозами МФ полностью восстанавливала тиреоидный и андрогенный статус, причем во всех случаях различия с группой EW были значимыми (рис. 3, 4). Однако более продолжительное лечение МФ вызывало дифференцированный ответ эндокринной системы EW-крыс на различные дозы препарата. При использовании средних доз восстанавливающий эффект МФ сохранялся, в то время как при использовании дозы 250 мг/кг он ослабевал или, как это показано для tT3 и тестостерона, полностью исчезал (рис. 3, 4). Необходимо отметить, что в группе EW-МФ250 через 4 недели лечения МФ уровни тиреоидных гормонов и тестостерона были ниже, чем в группе EW-МФ120 (рис. 3, 4).
Рис. 3.
Уровни тиреоидных гормонов в крови 10-месячных самцов крыс с ограничением грудного вскармливания и влияние на них двух- и четырехнедельной терапии различными дозами метформина. (a) – свободный тироксин; (b) – общий тироксин; (c) – свободный трийодтиронин; (d) – общий трийодтиронин. Различия с группой К (a), между группой EW и группами, обработанными метформином (b), и между группами EW-МФ120 и EW-МФ250 (c) статистически значимы при p < 0.05. M ± SEM, n = 12. Обозначения групп: К (C), EW, EW-МФ120 (EW-MF120), EW-МФ250 (EW-MF250).
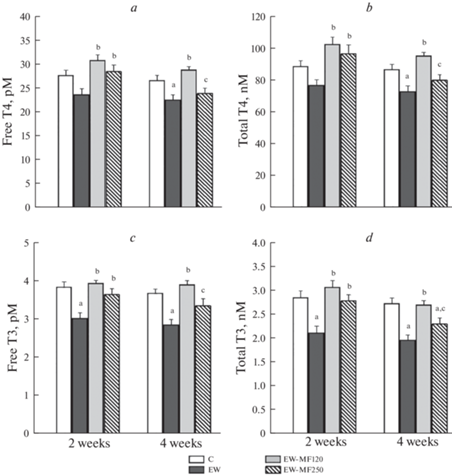
Рис. 4.
Уровень тестостерона в крови 10-месячных самцов крыс с ограничением грудного вскармливания и влияние на него двух- и четырехнедельной терапии различными дозами метформина. Различия с группой К (a), между группой EW и группами, обработанными метформином (b) и между группами EW-МФ120 и EW-МФ250 (c) статистически значимы при p < 0.05. M ± SEM, n = 12. Обозначения групп: К (C), EW, EW-МФ120 (EW-MF120), EW-МФ250 (EW-MF250).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
У человека как голодание в раннем возрасте, так и раннее прекращение грудного вскармливания приводят к отставленным во времени метаболическим и гормональным изменениям, которые в ряде случаев могут быть классифицированы, как МС [4, 21–23]. Причинами этого являются недостаток белка и других нутриентов, необходимых для нормального развития новорожденного, а также ослабление или полное отсутствие регуляторного воздействия на организм множества гормонов и ростовых факторов, поступающих в организм новорожденного в составе грудного молока [4, 12, 21, 24, 25]. Результаты клинических исследований получают подтверждение в экспериментах на крысах с различными моделями нарушения грудного вскармливания, вызванного как обработкой кормящих самок фармакологическими препаратами, подавляющими лактацию (бромокриптин, метилглиоксаль), так и снижением количества и доступности грудного молока вследствие повышения числа крысят в помете или в результате использования бандажа, препятствующего доступу крысят к молочным железам [13–17].
Нами показано, что ингибирование лактации D2-агонистом бромокриптином у кормящих самок приводит к преждевременному прекращению грудного вскармливания потомства, что в дальнейшем, в 10-месячном возрасте, выражается в развитии у них комплекса метаболических и гормональных нарушений, характерных для МС, таких как ожирение, дислипидемия, нарушенная толерантность к глюкозе, гиперлептинемия, постпрандиальная гиперинсулинемия. Эти данные в целом согласуются с результатами других авторов, которые, однако, исследовали животных с ограничением грудного вскармливания в возрасте от трех до шести месяцев. При этом характер изменений имел черты сходства при различных способах индукции прерывания или острой недостаточности грудного вскармливания в раннем постнатальном периоде [13–15, 17, 26]. Так, у трехмесячных крыс с подавлением грудного вскармливания с помощью прооксиданта метилглиоксаля, наряду с ожирением, имелись явные признаки дислипидемии и нарушенной чувствительности к глюкозе [15]. В пятимесячном возрасте у крыс с ограничением грудного вскармливания с помощью бандажа отмечали ожирение, триглицеридемию, повышение доли атерогенных форм холестерина, сильно выраженную гиперлептинемию [14]. Похожие изменения были у шестимесячных крыс, которые, как и в нашем случае, лишались грудного вскармливания на протяжении трех дней при обработке кормящих самок бромокриптином [13]. Следует отметить, что и в нашем исследовании у крыс группы EW в возрасте шести месяцев были повышены масса тела и уровень постпрандиальной глюкозы в крови, что свидетельствует о развитии признаков МС. Тем самым, метаболические нарушения развиваются уже через 3–6 мес, а затем сохраняются в более зрелом возрасте.
Наряду с метаболическими изменениями и снижением чувствительности к инсулину и лептину, в группе EW были выявлены нарушения функций гонадной и тиреоидной осей. Это иллюстрируется андрогенным дефицитом и сниженным уровнем ЛГ, что может указывать на ослабление различных звеньев гипоталамо-гипофизарно-тестикулярной оси, а также дефицитом тиреоидных гормонов на фоне значимого повышения уровня ТТГ в крови крыс группы EW, что свидетельствует о развитии у них гипотиреоидного состояния, вызванного снижением ответа тироцитов на ТТГ. Следует отметить, что несмотря на пристальное внимание к вопросу о влиянии недостаточности грудного вскармливания в раннем онтогенезе на эндокринный статус в зрелом возрасте, данные по этому вопросу малочисленны и противоречивы [18–20]. Показано, что недостаток грудного молока, обусловленный большим размером помета, приводит к андрогенному дефициту у взрослых самцов, причем это в большей степени связано с нарушением синтеза тестостерона в семенниках, чем с ослаблением вышележащих звеньев гонадной оси [18]. Ограничение грудного вскармливания как с помощью обработки самок бромокриптином, так и путем ограничения их в пище приводит к снижению у взрослого потомства концентрации в крови некоторых тиреоидных гормонов [19, 20]. У взрослых крыс, родившихся от голодающих в период лактации самок, отмечали повышение уровня ТТГ и соотношения ТТГ/fT4, что, как и в нашем случае, указывает на снижение чувствительности тироцитов к стимулирующему воздействию ТТГ [20]. Так, нами показано, что соотношение концентраций в крови ТТГ и тироксина в группе EW в 3 раза выше, чем в контроле.
Представленные данные свидетельствуют о том, что полноценное грудное вскармливание в ранний постнатальный период имеет критическое значение как для нормального функционирования систем, контролирующих углеводный и липидный обмен, энергетический баланс и гормональный статус организма, так и для формирования в раннем онтогенезе гипоталамо-гипофизарно-гонадной и -тиреоидной осей, ответственных за регуляцию репродуктивных функций, термогенез и другие, зависимые от тиреоидных и половых стероидных гормонов, физиологические процессы. При этом возникающие в результате “неонатального” голодания нарушения в системах, контролирующих метаболизм и эндокринные функции, сохраняются в зрелом возрасте. Соответственно необходимы подходы для их коррекции, среди которых наибольший интерес представляет терапия препаратами, используемыми для лечения МС и сахарного диабета 2-го типа.
Среди фармакологических подходов для коррекции МС наибольший интерес представляет МФ, который широко применяется для лечения метаболических расстройств, характеризующихся ожирением, ИР, нарушением глюкозного гомеостаза, дислипидемией, повышением индекса атерогенности [3–5]. МФ-терапия значимо восстанавливает метаболические и гормональные показатели у грызунов с экспериментальными моделями МС и сахарного диабета 2-го типа, что ранее продемонстрировано нами [27, 28], и другими авторами [29–31]. Важное значение имеет выбор дозы МФ, поскольку высокие дозы как в клинике, так и в экспериментах на животных способны привести к нежелательным эффектам, среди которых лактоацидоз и нарушения функций желудочно-кишечного тракта, в то время как низкие дозы не всегда эффективны, особенно при лечении сильно выраженных метаболических расстройств [32–34]. Нами показано, что относительно высокая доза МФ (250 мг/кг/сутки) в большей степени восстанавливает метаболические показатели у EW-крыс в сравнении со средней дозой препарата (120 мг/кг/сутки), хотя различия между группами EW-МФ120 и EW-МФ250 не были статистически значимыми, за исключением различий в уровне триглицеридов, который в группе EW-МФ120 оставался более высоким в сравнении с группой EW-МФ250 (табл. 1, рис. 1, 2). Тем самым, нами впервые показана эффективность МФ при коррекции метаболических расстройств, индуцированных EW, а также выявлена зависимость восстанавливающего эффекта МФ от его дозы.
Четырехнедельная обработка крыс с помощью средней дозы МФ в значительной степени восстанавливала уровни тиреоидных гормоном и тестостерона, а также нормализовала повышенный у EW-крыс уровень ТТГ и сниженный у них уровень ЛГ. Это свидетельствует об отчетливо выраженном восстановительном потенциале МФ в отношении нарушенных вследствие EW эндокринных функций. Однако несмотря на более выраженный эффект на метаболические показатели, четырехнедельная обработка МФ в более высокой дозе была менее эффективна в отношении восстановления гормонального статуса тиреоидной и гонадной осей, слабо или вовсе не влияя на оцениваемые гормональные показатели (табл. 2, рис. 2, 3). Важно отметить, что через 2 недели восстанавливающий эффект высокой дозы МФ на уровни тиреоидных гормонов и тестостерона был еще сопоставим с таковым, вызываемым средней дозой, но в дальнейшем, через 4 недели, затухал (рис. 3, 4). Такая динамика эффекта высоких доз МФ может быть обусловлена как побочными эффектами МФ-терапии, так и избыточной активацией АМФ-активируемой протеинкиназы, основной мишени действия этого препарата, в том числе в гипофизе, семенниках и щитовидной железе, основных компонентах гонадной и тиреоидной осей [9, 29, 35].
До наших исследований информация о влиянии МФ на эндокринные функции у потомства с метаболическими и гормональными расстройствами, вызванными ограничением или лишением грудного вскармливания, отсутствовала. В то же время имелись данные о том, что МФ-терапия при диабете и МС способна улучшать функции тиреоидной [36–38] и гонадной осей [9, 39, 40]. Это обусловлено способностью препарата восстанавливать активность гипоталамических нейронов, секретирующих рилизинг-факторы, а также нормализовать метаболические процессы в гипофизе, щитовидной железе и гонадах. У пациентов с ИР лечение МФ вызывало снижение повышенного уровня ТТГ [36–38] и повышало уровень трийодтиронина, основного эффекторного гормона тиреоидной оси [37], что может указывать на повышение чувствительности тироцитов к ТТГ. Сходные результаты были получены и в экспериментах с диабетическими животными [41]. Установлено, что лечение МФ улучшает сперматогенез и тестикулярный стероидогенез у пациентов с МС и диабетической патологией [40, 42, 43]. Лечение МФ самцов крыс и мышей с различными моделями МС и диабета усиливало ответ семенников на гонадотропины, подавляло апоптотические и воспалительные процессы в тестикулярных клетках, улучшало сперматогенез, результатом чего были нормализация андрогенного статуса и восстановление фертильности [44–47].
ЗАКЛЮЧЕНИЕ
Нами установлено, что дефицит грудного вскармливания в раннем онтогенезе у самцов крыс в зрелом возрасте приводит к ожирению, нарушенной толерантности к глюкозе, снижению чувствительности к инсулину, гиперлептинемии, дислипидемии, к андрогенной недостаточности и гипотиреоидному состоянию с характерными для него снижением уровней тиреоидных гормонов и повышением уровня ТТГ. Четырехнедельное лечение крыс МФ в средней дозе (120 мг/кг/сутки) снижало массу тела и жировой ткани, частично восстанавливало метаболические показатели, в полной мере нормализовало гормональный статус гонадной и тиреоидной систем. Лечение МФ в более высокой дозе (250 мг/кг/сутки) оказалось эффективнее в отношении восстановления метаболических показателей, уровней лептина и инсулина, но сравнительно слабо влияло на уровни тестостерона, тиреоидных гормонов, ЛГ и ТТГ. Необходимо, однако, отметить, что через две недели лечения эффективность обеих использованных доз МФ была сопоставимой. Таким образом, впервые показано, что длительное лечение самцов крыс группы EW средними дозами МФ улучшает метаболические показатели и полностью восстанавливает гормональный статус тиреоидной и гонадной систем, что указывает на перспективность применения таких доз для коррекции МС, вызванного нарушением грудного вскармливания.
Список литературы
Smith CJ, Ryckman KK (2015) Epigenetic and developmental influences on the risk of obesity, diabetes, and metabolic syndrome. Diabetes Metab Syndr Obes 8: 295–302. https://doi.org/10.2147/DMSO.S61296
Cwynar-Zając Ł (2021) Metformin - a new approach. Pediatr Endocrinol Diabetes Metab 27: 134–140. https://doi.org/10.5114/pedm.2021.107166
Guo Z, Priefer R (2021) Current progress in pharmacogenomics of Type 2 diabetes: A systemic overview. Diabetes Metab Syndr 15: 102239. https://doi.org/10.1016/j.dsx.2021.102239
Picó C, Reis F, Egas C, Mathias P, Matafome P (2021) Lactation as a programming window for metabolic syndrome. Eur J Clin Invest 51: e13482. https://doi.org/10.1111/eci.13482
Tulipano G (2021) Integrated or Independent Actions of Metformin in Target Tissues Underlying Its Current Use and New Possible Applications in the Endocrine and Metabolic Disorder Area. Int J Mol Sci 22: 13068. https://doi.org/10.3390/ijms222313068
Kononova YA, Likhonosov NP, Babenko AY (2022) Metformin: Expanding the Scope of Application-Starting Earlier than Yesterday, Canceling Later. Int J Mol Sci 23: 2363. https://doi.org/10.3390/ijms23042363
Top WMC, Kooy A, Stehouwer CDA (2022) Metformin: A Narrative Review of Its Potential Benefits for Cardiovascular Disease, Cancer and Dementia. Pharmaceuticals (Basel) 15: 312. https://doi.org/10.3390/ph15030312
Kalra S, Aggarwal S, Khandelwal D (2019) Thyroid Dysfunction and Type 2 Diabetes Mellitus: Screening Strategies and Implications for Management. Diabetes Ther 10: 2035–2044. https://doi.org/10.1007/s13300-019-00700-4
Shpakov AO (2021) Improvement Effect of Metformin on Female and Male Reproduction in Endocrine Pathologies and Its Mechanisms. Pharmaceuticals (Basel) 14: 42. https://doi.org/10.3390/ph14010042
Kimber-Trojnar Ż, Dłuski DF, Wierzchowska-Opoka M, Ruszała M, Leszczyńska-Gorzelak B (2022) Metformin as a Potential Treatment Option for Endometriosis. Cancers (Basel) 14: 577. https://doi.org/10.3390/cancers14030577
Magzoub R, Kheirelseid EAH, Perks C, Lewis S (2022) Does metformin improve reproduction outcomes for non-obese, infertile women with polycystic ovary syndrome? Meta-analysis and systematic review. Eur J Obstet Gynecol Reprod Biol 271: 38–62. https://doi.org/10.1016/j.ejogrb.2022.01.025
Badillo-Suárez PA, Rodríguez-Cruz M, Nieves-Morales X (2017) Impact of Metabolic Hormones Secreted in Human Breast Milk on Nutritional Programming in Childhood Obesity. J Mammary Gland Biol Neoplasia 22: 171–191. https://doi.org/10.1007/s10911-017-9382-y
Lima Nda S, de Moura EG, Passos MC, Nogueira Neto FJ, Reis AM, de Oliveira E, Lisboa PC (2011) Early weaning causes undernutrition for a short period and programmes some metabolic syndrome components and leptin resistance in adult rat offspring. Br J Nutr 105: 1405–1413. https://doi.org/10.1017/S0007114510005064
Lima Nda S, Franco JG, Peixoto-Silva N, Maia LA, Kaezer A, Felzenszwalb I, de Oliveira E, de Moura EG, Lisboa PC (2014) Ilex paraguariensis (yerba mate) improves endocrine and metabolic disorders in obese rats primed by early weaning. Eur J Nutr 53: 73–82. https://doi.org/10.1007/s00394-013-0500-3
Francisco FA, Barella LF, Silveira SDS, Saavedra LPJ, Prates KV, Alves VS, Franco CCDS, Miranda RA, Ribeiro TA, Tófolo LP, Malta A, Vieira E, Palma-Rigo K, Pavanello A, Martins IP, Moreira VM, de Oliveira JC, Mathias PCF, Gomes RM (2018) Methylglyoxal treatment in lactating mothers leads to type 2 diabetes phenotype in male rat offspring at adulthood. Eur J Nutr 57: 477–486. https://doi.org/10.1007/s00394-016-1330-x
Souza LL, de Moura EG, Lisboa PC (2020) Does early weaning shape future endocrine and metabolic disorders? Lessons from animal models. J Dev Orig Health Dis 11: 441–451. https://doi.org/10.1017/S2040174420000410
Lisboa PC, Miranda RA, Souza LL, Moura EG (2021) Can breastfeeding affect the rest of our life? Neuropharmacology 200: 108821. https://doi.org/10.1016/j.neuropharm.2021.108821
Smith JT, Spencer SJ (2012) Preweaning over- and underfeeding alters onset of puberty in the rat without affecting kisspeptin. Biol Reprod 86: 145. https://doi.org/10.1095/biolreprod.111.097758
Ayala-Moreno R, Racotta R, Anguiano B, Aceves C, Quevedo L (2013) Perinatal undernutrition programmes thyroid function in the adult rat offspring. Br J Nutr 110:2207–2215. https://doi.org/10.1017/S0007114513001736
Pietrobon CB, Bertasso IM, Silva BS, Peixoto-Silva N, Oliveira E, Moura EG, Lisboa PC (2020) Body Adiposity and Endocrine Profile of Female Wistar Rats of Distinct Ages that were Early Weaned. Horm Metab Res 52: 58–66. https://doi.org/10.1055/a-0966-8784
Liu L, Wang W, Sun J, Pang Z (2018) Association of famine exposure during early life with the risk of type 2 diabetes in adulthood: a meta-analysis. Eur J Nutr 57: 741–749. https://doi.org/10.1007/s00394-016-1363-1
Zhou J, Zhang L, Xuan P, Fan Y, Yang L, Hu C, Bo Q, Wang G, Sheng J, Wang S (2018) The relationship between famine exposure during early life and body mass index in adulthood: A systematic review and meta-analysis. PLoS One 13: e0192212. https://doi.org/10.1371/journal.pone.0192212
Xin X, Wang W, Xu H, Li Z, Zhang D (2019) Exposure to Chinese famine in early life and the risk of dyslipidemia in adulthood. Eur J Nutr 58: 391–398. https://doi.org/10.1007/s00394-017-1603-z
Jiang X, Ma H, Wang Y, Liu Y (2013) Early life factors and type 2 diabetes mellitus. J Diabetes Res 2013: 485082. https://doi.org/10.1155/2013/485082
Qin LL, Luo BA, Gao F, Feng XL, Liu JH (2020) Effect of Exposure to Famine during Early Life on Risk of Metabolic Syndrome in Adulthood: A Meta-Analysis. J Diabetes Res 2020: 3251275. https://doi.org/10.1155/2020/3251275
Pietrobon CB, Miranda RA, Bertasso IM, Mathias PCF, Bonfleur ML, Balbo SL, Reis MAB, Latorraca MQ, Arantes VC, de Oliveira E, Lisboa PC, de Moura EG (2020) Early weaning induces short- and long-term effects on pancreatic islets in Wistar rats of both sexes. J Physiol 598: 489–502. https://doi.org/10.1113/JP278833
Derkach KV, Bondareva VM, Kornyushin OV, Galagudza MM, Shpakov AO (2020) Restoration of β-Adrenergic Signaling and Activity of Akt-Kinase and AMP-Activated Protein Kinase with Metformin in the Myocardium of Diabetic Rats. Bull Exp Biol Med 169: 24–28. https://doi.org/10.1007/s10517-020-04816-7
Bakhtyukov AA, Derkach KV, Sorokoumov VN, Stepochkina AM, Romanova IV, Morina IY, Zakharova IO, Bayunova LV, Shpakov AO (2021) The Effects of Separate and Combined Treatment of Male Rats with Type 2 Diabetes with Metformin and Orthosteric and Allosteric Agonists of Luteinizing Hormone Receptor on Steroidogenesis and Spermatogenesis. Int J Mol Sci 23: 198. https://doi.org/10.3390/ijms23010198
Meng XM, Ma XX, Tian YL, Jiang Q, Wang LL, Shi R, Ding L, Pang SG (2017) Metformin improves the glucose and lipid metabolism via influencing the level of serum total bile acids in rats with streptozotocin-induced type 2 diabetes mellitus. Eur Rev Med Pharmacol Sci 21: 2232–2237.
Kim HW (2021) Metabolomic Approaches to Investigate the Effect of Metformin: An Overview. Int J Mol Sci 22: 10275. https://doi.org/10.3390/ijms221910275
Lee YF, Sim XY, Teh YH, Ismail MN, Greimel P, Murugaiyah V, Ibrahim B, Gam LH (2021) The effects of high-fat diet and metformin on urinary metabolites in diabetes and prediabetes rat models. Biotechnol Appl Biochem 68: 1014–1026. https://doi.org/10.1002/bab.2021
Kanto K, Ito H, Noso S, Babaya N, Hiromine Y, Taketomo Y, Toma J, Niwano F, Yasutake S, Kawabata Y, Ikegami H (2017) Effects of dosage and dosing frequency on the efficacy and safety of high-dose metformin in Japanese patients with type 2 diabetes mellitus. J Diabetes Investig 9: 587–593. https://doi.org/10.1111/jdi.12755
DeFronzo R, Fleming GA, Chen K, Bicsak TA (2016) Metformin-associated lactic acidosis: Current perspectives on causes and risk. Metabolism 65: 20–29. https://doi.org/10.1016/j.metabol.2015.10.014
Derkach K, Zakharova I, Zorina I, Bakhtyukov A, Romanova I, Bayunova L, Shpakov A (2019) The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One 14: e0213779. https://doi.org/10.1371/journal.pone.0213779
Rena G, Hardie DG, Pearson ER (2017) The mechanisms of action of metformin. Diabetologia 60: 1577–1585. https://doi.org/10.1007/s00125-017-4342-z
Dimic D, Golubovic MV, Radenkovic S, Radojkovic D, Pesic M (2016) The effect of metformin on TSH levels in euthyroid and hypothyroid newly diagnosed diabetes mellitus type 2 patients. Bratisl Lek Listy 117: 433–435. https://doi.org/10.4149/bll_2016_084
Sui M, Yu Y, Zhang H, Di H, Liu C, Fan Y (2018) Efficacy of Metformin for Benign Thyroid Nodules in Subjects With Insulin Resistance: A Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne) 9: 494. https://doi.org/10.3389/fendo.2018.00494
Haroon SM, Khan K, Maqsood M, Iqbal S, Aleem M, Khan TU (2021) Exploring the Effect of Metformin to Lower Thyroid-Stimulating Hormone in Euthyroid and Hypothyroid Type-2 Diabetic Patients. Cureus 13: e13283. https://doi.org/10.7759/cureus.13283
Alves MG, Martins AD, Vaz CV, Correia S, Moreira PI, Oliveira PF, Socorro S (2014) Metformin and male reproduction: effects on Sertoli cell metabolism. Br J Pharmacol 171: 1033–1042. https://doi.org/10.1111/bph.12522
Faure M, Bertoldo MJ, Khoueiry R, Bongrani A, Brion F, Giulivi C, Dupont J, Froment P (2018) Metformin in Reproductive Biology. Front Endocrinol (Lausanne) 9: 675. https://doi.org/10.3389/fendo.2018.00675
Hu X, Liu Y, Wang C, Hou L, Zheng X, Xu Y, Ding L, Pang S (2017) Metformin affects thyroid function in male rats. Oncotarget 8: 107589–107595. https://doi.org/10.18632/oncotarget.22536
Casulari LA, Caldas AD, Domingues Casulari Motta L, Lofrano-Porto A (2010) Effects of metformin and short-term lifestyle modification on the improvement of male hypogonadism associated with metabolic syndrome. Minerva Endocrinol 35: 145–151.
Morgante G, Tosti C, Orvieto R, Musacchio MC, Piomboni P, De Leo V (2011) Metformin improves semen characteristics of oligo-terato-asthenozoospermic men with metabolic syndrome. Fertil Steril 95: 2150–2152. https://doi.org/10.1016/j.fertnstert.2010.12.009
Yan WJ, Mu Y, Yu N, Yi TL, Zhang Y, Pang XL, Cheng D, Yang J (2015) Protective effects of metformin on reproductive function in obese male rats induced by high-fat diet. J Assist Reprod Genet 32: 1097–1104. https://doi.org/10.1007/s10815-015-0506-2
Annie L, Jeremy M, Gurusubramanian G, Derkach KV, Shpakov AO, Roy VK (2020) Effect of metformin on testicular expression and localization of leptin receptor and levels of leptin in the diabetic mice. Mol Reprod Dev 87: 620–629. https://doi.org/10.1002/mrd.23342
Derkach KV, Bakhtyukov AA, Romanova IV, Zorina II, Bayunova LV, Bondareva VM, Yu Morina I, Kumar Roy V, Shpakov AO (2020) The effect of metformin treatment on the basal and gonadotropin-stimulated steroidogenesis in male rats with type 2 diabetes mellitus. Andrologia 52: e13816. https://doi.org/10.1111/and.13816
Koroglu Aydın P, Karabulut-Bulan O, Bugan I, Turkyilmaz IB, Altun S, Yanardag R (2022) The protective effect of metformin against testicular damage in diabetes and prostate cancer model. Cell Biochem Funct 40: 60–70. https://doi.org/10.1002/cbf.3674
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


