Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 8, стр. 1015-1027
Меланокортиновые рецепторы 1-го типа в гипоталамусе мышей в норме и при диета-индуцированном ожирении
Е. В. Михайлова 1, К. В. Деркач 1, А. О. Шпаков 1, И. В. Романова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: irinaromanova@mail.ru
Поступила в редакцию 26.05.2022
После доработки 17.06.2022
Принята к публикации 20.06.2022
- EDN: VZXMHG
- DOI: 10.31857/S0869813922080052
Аннотация
Меланокортиновая система в гипоталамусе играет ключевую роль в регуляции пищевого поведения и периферического метаболизма, и в условиях метаболических расстройств ее активность существенно меняется. Однако возможная роль в этом меланокортиновых рецепторов 1-го типа (MC1R) остается не выясненной, тем более что данные об экспрессии и локализации этого рецептора в гипоталамусе позвоночных животных фрагментарны. Цель исследования состояла в изучении экспрессии и распределения MC1R в гипоталамусе контрольных мышей и животных с диета-индуцированным ожирением (ДИО) и в их сопоставлении с экспрессией других компонентов меланокортиновой системы и гипоталамической локализацией маркера микроглиоза IBA1. ДИО вызывали 16-недельной диетой, обогащенной легкими углеводами и насыщенными жирами, у самок мышей С57Bl/6J, что также приводило к нарушенной толерантности к глюкозе, гиперлептинемии и гиперинсулинемии. С помощью двойного флуоресцентного иммуномечения было показано, что в аркуатном ядре гипоталамуса мышей MC1R локализованы на проопиомеланокортин (POMC)-иммунопозитивных нейронах. В условиях ДИО количество MC1R и POMC в гипоталамических нейронах значительно возрастало. Наряду с этим в гипоталамусе ДИО-мышей повышались уровни мРНК для MC1R, MC3R и POMC, что указывает на повышение экспрессии основных компонентов меланокортиновой системы при ДИО. В аркуатных ядрах гипоталамуса ДИО мышей повышалось оцениваемое иммуногистохимическими методами содержание маркера микроглиального воспаления IBA1, что может свидетельствовать о взаимосвязи между MC1R-сигнальными каскадами и активностью воспалительных процессов в гипоталамусе в условиях ДИО. Таким образом, нами впервые показана экспрессия MC1R и его локализация на POMC-иммунопозитивных нейронах в аркуатных ядрах гипоталамуса, их увеличение при ДИО и возможную взаимосвязь с гипоталамической экспрессией POMC и маркера воспаления IBA1, что может свидетельствовать о роли MC1R, как потенциального регулятора периферического метаболизма и нейровоспаления в норме и при метаболических расстройствах.
Гипоталамическая меланокортиновая система играет исключительно важную роль в контроле пищевого поведения, периферического метаболизма, функций нервной и нейроэндокринной систем, в основе чего лежит обеспечение интеграции в единую функциональную сеть множества сигнальных систем мозга [1–4]. Компонентами меланокортиновой системы являются сопряженные с гетеротримерными G-белками меланокортиновые рецепторы (MCR) и их эндогенные лиганды – наделенные агонистической активностью меланокортиновые пептиды и выполняющий функцию антагониста агутиподобный пептид (AgRP). Прекурсором меланокортиновых пептидов является про-опиомеланокортин (POMC), который широко экспрессируется на периферии и в различных отделах мозга, в том числе в гипоталамических нейронах [1, 5, 6]. В ходе сайт-специфичного протеолиза из POMC генерируются α-, β- и γ-меланоцитстимулирующие гормоны (MSH) и адренокортикотропный гормон. В мозге наиболее значительные популяции синтезирующих POMC нейронов локализованы в аркуатных ядрах гипоталамуса (arcuate nucleus – ARC) [1].
Мишенями MSH являются пять типов MCR – MC1R–MC5R, которые в активированном гормонами состоянии стимулируют Gs-белки и через них фермент аденилатциклазу, катализирующую синтез универсального вторичного посредника цАМФ [6, 7]. Повышение уровня цАМФ приводит к активации протеинкиназы А и других цАМФ-зависимых эффекторных белков, обеспечивая реализацию основных физиологических эффектов меланокортиновых пептидов в ЦНС и на периферии [7, 8]. В настоящее время принято считать, что в мозге в основном экспрессируются MC3R и MC4R, которые стимулируются α-MSH и, в меньшей степени, другими пептидами меланокортинового семейства [3, 7, 9]. Эти же рецепторы ингибируются нейропептидом AgRP, который продуцируется AgRP/нейропептид Y-экспрессирующими нейронами, причем AgRP не только снижает индуцированную α-MSH стимуляцию MC3R и MC4R, но и ослабляет конститутивную активность этих рецепторов [4, 10]. В последние годы появились данные о том, что в регуляции функций ЦНС может быть вовлечен и MC1R, который до этого рассматривали как преимущественно “периферический” MCR [11]. С помощью иммуногистохимии у мышей МС1R выявлены в нейронах черной субстанции [12], а методом ПЦР экспрессия гена Mc1r выявлена в разных областях мозга крысы [13] и в гипоталамусе костистой рыбы (Epinephelus coioides) [14]. При этом локализация MC1R в структурах мозга и его функции не были изучены.
Ожирение и сахарный диабет 2-го типа приводят к значительным изменениям функционирования гипоталамической меланокортиновой системы мозга, что показано у пациентов с метаболическими расстройствами [3, 4, 15, 16] и у грызунов с экспериментальными моделями этих заболеваний [3, 4, 17–19]. При этом в гипоталамусе отмечается как нарушение баланса факторов пищевого поведения, регулирующих меланокортиновую систему (POMC, AgRP), так и изменение экспрессии MC3R и MC4R. В то же время данные об экспрессии гена Mc1r, кодирующего MC1R, и распределения этого белка в гипоталамических нейронах в условиях метаболических расстройств отсутствуют. Не выяснена возможная взаимосвязь между изменением экспрессии MC1R и других MCR, а также с интенсивностью нейровоспалительных процессов, которые играют важную роль в развитии нейродегенеративных изменений в гипоталамусе и являются индукторами нарушений функционирования гипоталамических сигнальных систем и зависимых от них физиологических процессов. В этом отношении наибольший интерес представляет исследование взаимосвязи между уровнями MC1R и связывающей ионизированный кальций адаптерной молекулы-1 (IBA-1), специфичного маркера микроглии, экспрессия которой в ЦНС условиях нейровоспаления, в том числе индуцированного несбалансированной диетой, возрастает [20–22].
Таким образом, целью работы было изучить экспрессию и распределение MC1R в гипоталамусе контрольных мышей и животных с диета-индуцированным ожирением (ДИО) и сопоставить их с экспрессией других компонентов меланокортиновой системы и локализацией маркера микроглиоза IBA1.
МЕТОДЫ ИССЛЕДОВАНИЯ
Статья не содержит результатов исследований с участием людей в качестве объектов исследований. Все эксперименты были проведены в полном соответствии с правилами, разработанными Комитетом по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (редакция 15.02.2018 г.), правилами и требованиями, изложенными в документах “European Communities Council Directive” (2010/63/EEC) и “Guide for the Care and Use of Laboratory Animals”. На проведение экспериментов было получено разрешение Комитета по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (протокол 01/09 от 8 сентября 2020 г.).
Для исследований были взяты четырехмесячные самки мышей С57Bl/6J (a/a), которых получали из питомника Рапполово (Россия). После двухнедельного периода адаптации животные были разделены на 2 группы – контрольные мыши, которых содержали на стандартном сухом корме (“Контроль”, n = 14), и мыши с ДИО, которое вызывали с помощью длительной (три месяца) высококалорийной диеты, состоящей из животного жира (свиное сало) и 30%-ного раствора сахарозы, заменявшего животным питьевую воду (“ДИО”, n = 14). Для мониторинга развития ожирения животных взвешивали с периодичностью 1 раз в неделю, а также оценивали количество потребляемого ими корма. Уже через два месяца высококалорийной диеты у мышей наблюдалось достоверное повышенные массы тела (соответственно 23.3 ± 0.8 г в группе “ДИО” и 19.5 ± 0.6 г в контроле, n = 14) и уровня глюкозы натощак (5.64 ± 0.23 мМ группе “ДИО” и 4.83 ± 0.15 мМ в контроле, n = 14). Из группы “ДИО” были исключены 3 животных с плохо развившимся ожирением (2) или с аномально высокой массой тела (1), и соответственно три животных были исключены из группы “Контроль”, в результате чего в дальнейших экспериментах изучали две группы “Контроль” и “ДИО” по 11 мышей в каждой.
Концентрацию глюкозы в крови мышей измеряли с помощью глюкометра “Life Scan Johnson & Johnson” (Дания) и тест-полосок “One Touch Ultra” (США), для чего забирали кровь из хвостовой вены. Оценивали уровни глюкозы натощак и через 120 мин после нагрузки глюкозой (2 г/кг, в/б). Для определения базовых уровней инсулина, лептина и гликированного гемоглобина образцы крови забирали в конце эксперимента из сердца после анестезии животных хлоральгидратом (400 мг/кг, в/б). Концентрацию инсулина и лептина определяли с помощью ИФА-наборов “Mouse Insulin ELISA” (Mercodia AB, Швеция) и “ELISA Kit for Leptin” (Cloud-Clone Corp., США) соответственно. Для определения содержания гликированного гемоглобина (HbA1c) в крови мышей использовали наборы “Multi Test HbA1c System kit” (Polymer Technology Systems, Inc., США). Также определяли массу висцерального жира (г) и определяли его долю относительно массы тела (%).
Уровень мРНК в гипоталамусе мышей оценивали с помощью ПЦР в реальном времени, для чего из образцов ткани гипоталамуса выделяли тотальную РНК с помощью реагента ExtractRNA (Евроген, Россия). Обратную транскрипцию осуществляли с помощью набора MMLV RT Kit (Евроген, Россия), количественную оценку экспрессии проводили с помощью амплификатора 7500 Real-Time PCR System (Thermo Fisher Scientific Inc., США). Последовательности используемых праймеров представлены в табл. 1. Для исследования использовали референсные гены – ген гипоксантингуанинфосфорибозилтрансферазы (Hprt) и 18S-субъединицу рибосомальной РНК (18S-rRNA). Результаты анализировали с помощью метода ΔΔСt и программ 7500 Software v2.0.6 и Expression Suite Software v1.0.3. Значения RQ в группе “ДИО” нормировали по их значениям в группе “Контроль”, данные представлены в условных единицах (у. ед.). Для оценки экспрессии из каждой группы мышей случайным образом было отобрано по шесть животных.
Таблица 1.
Структуры прямых (For) и обратных (Rev) праймеров, используемых для амплификации транскриптов целевых генов
| Ген | Локализация | Праймер | Размер, bp | NCBI Reference Sequence |
|---|---|---|---|---|
| Mc1r | For 5'–3' | CTCCACAGACCGCTTCCTAC | 141 | NM_008559.2 |
| Rev 5'–3' | ACATACAGGCACCAAGGCTC | |||
| Mc3r | For 5'–3' | CAAGGAGATTCTCTGCGGCT | 101 | NM_008561.3 |
| Rev 5'–3' | TCCCGTCTGAGCGTTGTTTT | |||
| Mc4r | For 5'–3' | GGGTCGGAAACCATCGTCAT | 124 | NM_016977.4 |
| Rev 5'–3' | TGCAAATGGATGCGAGCAAG | |||
| Pomc | For 5'–3' | CAGTGCCAGGACCTCACC | 72 | NM_008895.4 |
| Rev 5'–3' | CAGCGAGAGGTCGAGTTTG | |||
| Agrp | For 5'–3' | ACAACTGCAGACCGAGCAGAA | 98 | NM_001271806.1 |
| Rev 5'–3' | CGACGCGGAGAACGAGACT | |||
| Hprt* | For 5'–3' | AGCCGACCGGTTCTGTCAT | 72 | NM_013556.2 |
| Rev 5'–3' | GGTCATAACCTGGTTCATCATCAC | |||
| 18S-rRNA* | For 5'–3' | GGGAGCCTGAGAAACGGC | 68 | NR_003278.3 |
| Rev 5'–3' | GGGTCGGGAGTGGGTAATTT |
Для подготовки образцов мозга с целью проведения иммуногистохимического анализа животных (n = 5 в каждой группе) анестезировали хлоральгидратом (400 мг/кг, в/б), транскардиально перфузировали с помощью 0.1 М натрий-фосфатного буфера (ФБ, рН 7.4) и 4%-ного раствора пара-формальдегида в 0.2 М ФБ. Затем мозг извлекали, дофиксировали в течение ночи в 4%-ном растворе пара-формальдегида в 0.2 М ФБ (4°С), промывали 0.02 М ФБ с 0.9% NaCl (ФБ-NaCl) и после криопротекции в 30%-ном растворе сахарозы в 0.02 М ФБ-NaCl замораживали в изопентане (при –42°С). Для подготовки срезов мозга из каждой группы мышей случайным образом было отобрано по пять животных.
Для иммуногистохимического анализа были использованы фронтальные срезы мозга (толщиной 16 мкм), которые монтировали на стеклах, как описано нами ранее [23]. От каждого животного из области гипоталамуса получали 10–12 срезов, которые монтировали на стекле Superfrost/plus, высушивали при комнатной температуре и хранили при –20°С. Для исследования отбирали стекла со срезами, содержащими аркуатное ядро гипоталамуса согласно атласу мозга мыши [24]. Флуоресцентное иммуномечение проводили в соответствии с ранее описанным протоколом [17, 23]. После демаскировки антигена кипячением в натрий-цитратном буфере (рН 6.0), срезы промывали в 0.02 М ФБ-NaCl и блокировали в смеси сывороток цыпленка (3%), козы (3%) и быка (1%), растворенных в ФБ-NaCl, содержащем 0.01% Triton X-100. Затем срезы инкубировали в течение 48 ч (4°C) с первичными антителами. Для двойного иммуномечения использовали смесь первичных антител кролика против MC1R (Elabscience, США) в разведении 1 : 200 с антителами мыши против POMC (Abcam, Великобритания) в разведении 1 : 1000. Для одиночного иммуномечения использовали первичные антитела кролика против IBA1 (NovusBio, США) в разведении 1 : 500. После тщательной промывки срезы инкубировали в течение 1 ч в смеси вторичных антител, конъюгированных с различными флуоресцентными метками: Ig цыпленка против кролика с Alexa-488 и Ig осла против мыши с Alexa-568 (Invitrogen, США) в разведении 1 : 1000. Для выявления IBA1 инкубацию проводили в растворе, содержащем Ig цыпленка против кролика с A-lexa-488. После промывки в ФБ срезы заключали под покровное стекло с помощью среды Мовиол (Sigma-Aldrich, США) и хранили при 4°C до полимеризации. Для верификации локализации IBA1 перед заключением под покровное стекло на срезы наносили раствор ядерного красителя DAPI (Sigma, США), разведенного в ФБ-NaCl 1 : 2000 и промывали в ФБ-NaCl. Специфичность иммуногистохимических реакций проверяли негативным контролем (реакции без первичных или вторичных антител). Изображения получали на конфокальном микроскопе DMI6000 с лазерной сканирующей конфокальной установкой “Leica TСS SР5” (Leiсa Microsystems, Германия), или с мультифотонной установкой. Использовали иммерсионный объектив ×63, лазеры с длиной волны возбуждения 355, 488 и 568 нм. Полученные изображения анализировали посредством пакета программ Leiсa LAS AF. Значения интенсивности свечения нормировали по их значениям в контроле (у. ед.), в аркуатных ядрах гипоталамуса подсчитывали количество IBA1-иммунопозитивных клеток, результаты представлены в процентах относительно уровня контрольных мышей, принятого за 100%.
Статистический анализ проводили в программе “GraphPad Prism 7” (GraphPad Software, США). Нормальность распределения данных оценивали тестом D’Agostino–Pearson, различия между группами оценивали непарным t-тестом и рассматривали как статистически значимые при p < 0.05. Данные представлены как M ± SEM.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мыши, которые в течение трех месяцев находились на высококалорийной диете, имели повышенные массу тела и жировой ткани, увеличенную удельную долю жира, повышенные уровни глюкозы, как натощак, так и через 120 мин после глюкозной нагрузки, а также повышенные уровни инсулина и лептина в крови (табл. 2), что свидетельствует о развитии у них ожирения, нарушенной толерантности к глюкозе, гиперинсулинемии и гиперлептинемии. В группе “ДИО” индекс инсулино-резистентности (ИР), рассчитанный, как произведение концентраций инсулина и глюкозы натощак, был значимо выше, чем в группе “Контроль” (табл. 2), что указывает на снижение чувствительности тканей к инсулину и развитие ИР у ДИО-мышей.
Таблица 2.
Масса тела и жировой ткани, уровни глюкозы, инсулина и лептина в крови и индекс инсулиновой резистентности у контрольных и с диета индуцированным ожирением мышей
| Контроль, n = 11 | ДИО, n = 11 | |
|---|---|---|
| Масса тела, г | 20.9 ± 0.6 | 25.6 ± 0.5* |
| Масса жировой ткани, г | 0.29 ± 0.02 | 0.64 ± 0.04* |
| Доля жира, % | 1.39 ± 0.05 | 2.48 ± 0.11* |
| Глюкоза (тощ.), мМ | 5.07 ± 0.11 | 6.68 ± 0.31* |
| Глюкоза (стим.), мМ | 5.20 ± 0.17 | 7.82 ± 0.39* |
| Инсулин, нг/мл | 0.39 ± 0.04 | 0.66 ± 0.06* |
| Лептин, нг/мл | 0.90 ± 0.10 | 2.01 ± 0.15* |
| ИР, у. ед. | 2.02 ± 0.24 | 4.59 ± 0.58* |
| HbA1c, % | 4.01 ± 0.19 | 4.76 ± 0.32 |
Все выявленные метаболические и гормональные изменения указывают на развитие у мышей отчетливо выраженных признаков метаболического синдрома. Ранее нами и другими авторами было показано, что у мышей, получавших различные по длительности диеты, обогащенные насыщенными жирами и легкоусвояемыми углеводами, также имеются ожирение, изменения углеводного и липидного обмена, нарушенная толерантность к глюкозе, ИР и гиперлептинемия [17, 25–27].
Изучение экспрессии генов в гипоталамусе ДИО-мышей показало повышение по сравнению с контролем уровня Mc1r (до 2.15 ± 0.18 у. ед., р < 0.05) и Mc3r (до 1.86 у. ед., р < 0.05), при этом экспрессия гена Mc4r у ДИО-мышей возрастала в 1.5 раза, но статистически не отличалась от контроля (рис. 1).
Рис. 1.
Экспрессия генов, кодирующих меланокортиновые рецепторы и нейропептиды, контролирующие пищевое поведение, в гипоталамусе мышей контрольных и с диета-индуцированным ожирением. * – различия между группами контроль (“Control”) и ДИО (“DIO”) статистически значимы при p < 0.05, значения представлены в условных единицах.

Экспрессия гена Pomc, кодирующего POMC, прекурсор анорексигенных меланокортиновых пептидов, возрастала (в 1.4 раза, р < 0.05), в то время как экспрессия гена Agrp, кодирующего орексигенный нейропептид AgRP, менялась слабо (рис. 1). При этом соотношение экспрессии генов Pomc и Agrp в группе “ДИО” было в 1.7 раза выше, чем в контроле. В различной степени выраженное повышение экспрессии генов MCR, а также увеличение соотношения Pomc/Agrp может указывать на более выраженную стимуляцию анорексигенных каскадов в гипоталамусе мышей с ДИО. Эти изменения можно рассматривать как компенсаторную реакцию, направленную на снижение потребления животными высококалорийной пищи и, как следствие, на предотвращение развития у них тяжелой формы метаболического синдрома. Необходимо отметить, что данные литературы в отношении экспрессии генов Mc3r, Mc4r, Pomc и Agrp в гипоталамусе мышей с ДИО весьма противоречивы. Они демонстрируют, что изменение экспрессии этих генов во многом определяется составом и длительностью высококалорийной диеты, выраженностью и длительностью метаболических нарушений у животных, а также областью гипоталамуса, выбранной для изучения генной экспрессии [28–31]. Так, в гипоталамусе мышей через 8 недель ДИО, индуцированной потреблением насыщенных жиров, экспрессия генов, кодирующих POMC и AgRP, была снижена, в то время как экспрессия гена Mc4R не менялась, а через 16 недель ДИО экспрессия гена Mc4r повышалась, а экспрессия генов Pomc и Agrp нормализовалась [28]. Согласно другим авторам, длительная, 21-недельная, высокожировая диета приводила к существенному повышению в гипоталамусе мышей с повышенной экспрессией лептинового рецептора как экспрессии гена Pomc, так и к повышению на 60% соотношения генов Pomc и Agrp [31].
При этом данные в отношении влияния ДИО на экспрессию MC1R в гипоталамусе и других отделах мозга отсутствуют. Это обусловлено как тем, что информация об экспрессии и локализации этого типа MCR в ЦНС фрагментарна [13, 14], так и отсутствием информации о возможной роли MC1R в гипоталамусе и других отделах мозга [14]. Так, у крыс экспрессия гена Mc1r в различных отделах мозга была показана только в 2021 г., причем в гипоталамусе уровень этой экспрессии был сравнительно низким и существенно уступал таковому в среднем мозге, мозжечке и гиппокампе и был сопоставимым с таковым во фронтальной коре [13]. Кроме того, мРНК для гена Mc1r была обнаружена в гипоталамусе морского окуня (Epinephelus coioides) [14]. При этом роль MC1R в ЦНС до сих пор не установлена, в отличие от хорошо изученной роли этого рецептора на периферии. Так, MC1R широко представлены во многих периферических органах и тканях, в коже и клетках крови [11, 32, 33], контролируют многие физиологические процессы, включая меланогенез [11] и липидный обмен [33, 34].
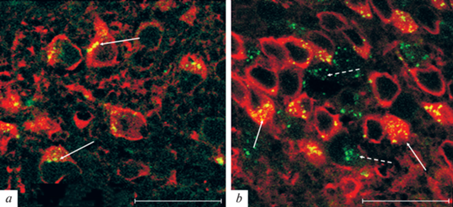
Нами с помощью молекулярно-биологических и иммуногистохимических методов MC1R не только идентифицированы в гипоталамусе, но и показано изменение уровня экспрессии кодирующего их гена, а также плотности этих рецепторов в нейронах аркуатного ядра гипоталамуса (рис. 2a). С помощью двойного флуоресцентного иммуномечения локализация MC1R выявлена в POMC-нейронах, а также показано увеличение уровня MC1R в них у ДИО-мышей (рис. 2b), что может указывать на тесную взаимосвязь между MC1R-опосредуемыми каскадами и продукцией POMC нейронами в аркуатных ядрах гипоталамуса. Это может быть обусловлено тем, что в гипоталамусе мышей с ДИО экспрессия генов Mc1r и Pomc повышается примерно в одинаковой степени. Взаимоотношения между MC1R и другими компонентами меланокортинового сигналинга в норме и при различных формах метаболических расстройств требуют дальнейших исследований.
Рис. 2.
Двойное флуоресцентное иммуномечение меланокортинового рецептора 1-го типа (MC1R) и про-опиомеланокортина (POMC) в аркуатном ядре гипоталамуса мышей контрольных (a) и с диета-индуцированным ожирением (b). Микрофотографии демонстрируют иммуногистохимические реакции к MC1R (зеленый), POMC (красный) и их совмещение (желтый). Сплошные стрелки указывают на MC1R, локализованных в телах POMC-иммунопозитивных нейронов, прерывистые стрелки – вне POMC-нейронов. Масштаб 25 мкм.
Как на периферии, так и в ЦНС меланокортиновые пептиды и их рецепторы, включая MC1R, вовлечены в регуляцию воспалительных процессов [35–38]. Так, имеются сведения о том, что MC1R могут контролировать воспалительные процессы в клетках эндотелия сосудов мозга, глиальных клетках и нейронах и их выживаемость, что может свидетельствовать о тесной взаимосвязи между MC1R-опосредуемыми сигнальными каскадами и активностью провоспалительных и апоптотических путей в этих клетках [37, 39–41]. Показано, что противовоспалительные эффекты α-MSH, реализуемые в микроглии и нейронах через MC1R, направлены на ингибирование активности АМФ-активируемой киназы и зависимого от нее провоспалительного ядерного фактора-κB [39], на ослабление вовлеченного в регуляцию митохондриальной динамики и апоптоза сигнального пути, включающего АМФ-активируемую протеинкиназу, сиртуин-1 и коактиватор-1α, активируемого пероксисомными активаторами рецептора-γ (PGC-1α) [40], а также на стимуляцию активности MC1R-зависимого цАМФ-зависимого каскада и зависимой от него экспрессии подавляющего воспаление ядерного рецептора Nurr1 [41].
С целью проверки возможных взаимосвязей между уровнем MC1R и интенсивностью воспалительных процессов в гипоталамусе мышей при ДИО, мы исследовали уровень экспрессии белка IBA1 – маркера микроглиального воспаления (рис. 3). Этот белок обладает специфическим кальций-связывающим и актин-связывающим действием, участвует в изменении формы плазматической мембраны, в процессах фагоцитоза и активации микроглии и периферических макрофагов [42].
Рис. 3.
Флуоресцентное иммуномечение IBA1, маркера микроглии, в аркуатном ядре гипоталамуса мышей контрольных (a, b) и с диета-индуцированным ожирением (c, d). Микрофотографии демонстрируют иммуногистохимические реакции к IBA1 (зеленый) и ядерному красителю DAPI (синий). Стрелки указывают на тела IBA1-иммунопозитивных клеток, 3v – полость 3-го желудочка мозга. Масштаб 50 мкм (a, c) или 20 мкм (b, d).
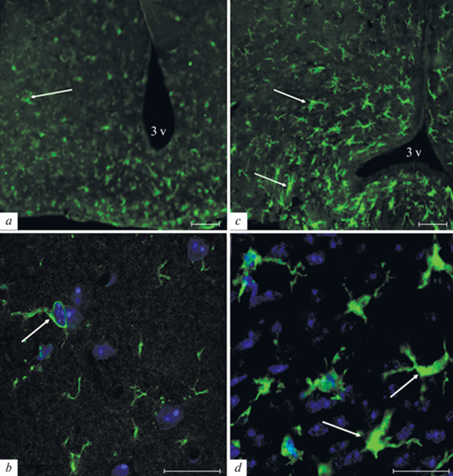
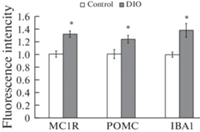
Полученные нами данные демонстрируют в гипоталамусе ДИО-мышей, в частности в области аркуатных ядер, увеличение количества IBA1-иммунопозитивных клеток на 60% (р < 0.05 по сравнению с контрольной группой; рис. 3a, c), увеличение размера их тела и утолщение отростков (рис. 3b, d), а также увеличение уровня IBA1 (на 38%, р < 0.05), о чем свидетельствует увеличение интенсивности свечения иммунопозитивного материала в них (рис. 4). При этом анализ POMC-иммунопозитивных нейронов аркуатных ядер демонстрирует у ДИО-мышей увеличение как уровня POMC (на 24%, р < 0.05), так и уровня MC1R (на 32%, р < 0.05) в них по сравнению с контрольными животными (рис. 4).
Рис. 4.
Анализ интенсивности свечения меланокортиновых рецепторов 1-го типа (MC1R), про-опиомеланокортина (POMC) и связывающей ионизированный кальций адаптерной молекулы-1 (IBA1) в телах клеток, локализованных в аркуатных ядрах гипоталамуса у мышей контрольных (Сontrol) и с диета-индуцированным ожирением (DIO); * – различия между группами “Control” и “DIO” статистически значимы при p < 0.05.
Повышение уровня IBA1 служит маркером активации микроглиальных клеток при патологических процессах в мозге, в том числе при активации процессов воспаления и апоптоза при ДИО [43], причем уровень IBA1 повышается даже при однодневной высокожировой диете [44]. Нами показано, что повышение экспрессии белка IBA1 в гипоталамусе ДИО мышей ассоциировано с повышением экспрессии MC1R. Это может свидетельствовать о том, что активация MC1R-сигнальных путей при метаболических расстройствах является одним из механизмов ослабления процессов воспаления, маркером которого является повышение экспрессии белка IBA1.
ЗАКЛЮЧЕНИЕ
Нами с помощью двойного флуоресцентного иммуномечения было показано, что в аркуатном ядре гипоталамуса мышей MC1R локализованы на POMC-иммунопозитивных нейронах, причем в условиях ДИО количество MC1R и POMC значительно возрастало. В гипоталамусе ДИО-мышей также повышались уровни мРНК для MC1R, MC3R и POMC, что указывает на активацию меланокортиновой системы, вовлеченной в снижение аппетита при ДИО. В аркуатных ядрах гипоталамуса у ДИО мышей повышалось содержание маркера микроглиального воспаления – белка IBA1, что может свидетельствовать о взаимосвязи между MC1R-сигнальными каскадами и активностью воспалительных процессов в гипоталамусе в условиях ДИО. Таким образом, мы впервые показали, что MC1R экспрессируются в гипоталамусе и локализованы в POMC-иммунопозитивных нейронах в аркуатных ядрах гипоталамуса, их количество в гипоталамусе ДИО мышей увеличивается, и это может свидетельствовать об участии MC1R, подобно MC3R и MC4R, в регуляции периферического метаболизма. Кроме того, наши данные указывают на возможную взаимосвязь повышения экспрессии MC1R с усилением нейровоспаления при ДИО, о чем свидетельствует выявленное нами синхронное повышение содержания в гипоталамусе MC1R и маркера воспаления IBA1.
Список литературы
Cone RD (2006) Studies on the physiological functions of the melanocortin system. Endocr Rev 7: 736–749. https://doi.org/10.1210/er.2006-0034
Shpakov AO, Derkach KV, Berstein LM (2015) Brain signaling systems in the Type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Sci OA 1(3): FSO25. https://doi.org/10.4155/fso.15.23
Baldini G, Phelan KD (2019) The melanocortin pathway and control of appetite-progress and therapeutic implications. J Endocrinol 241(1): R1–R33. https://doi.org/10.1530/JOE-18-0596
Micioni Di Bonaventura E, Botticelli L, Tomassoni D, Tayebati SK, Micioni Di, Bonaventura MV, Cifani C (2020) The Melanocortin System behind the Dysfunctional Eating Behaviors. Nutrients 12(11): 3502. https://doi.org/10.3390/nu12113502
Zhou Y, Cai M (2017) Novel approaches to the design of bioavailable melanotropins. Expert Opin Drug Discov 12(10): 1023–1030. https://doi.org/10.1080/17460441.2017.1351940
Lindberg I, Fricker LD (2021) Obesity, POMC, and POMC-processing Enzymes: Surprising Results From Animal Models. Endocrinology 162(12): bqab155. https://doi.org/10.1210/endocr/bqab155
Rodrigues AR, Almeida H, Gouveia AM (2015) Intracellular signaling mechanisms of the melanocortin receptors: current state of the art. Cell Mol Life Sci 72(7): 1331–1345. https://doi.org/10.1007/s00018-014-1800-3
Li YQ, Shrestha Y, Pandey M, Chen M, Kablan A, Gavrilova O, Offermanns S, Weinstein LS (2016) G(q/11)α and G(s)α mediate distinct physiological responses to central melanocortins. J Clin Invest 126(1): 40–49. https://doi.org/10.1172/JCI76348
Mountjoy KG (2010) Distribution and function of melanocortin receptors within the brain. Adv Exp Med Biol 681: 29–48. https://doi.org/10.1007/978-1-4419-6354-3_3
Zhang J, Li X, Zhou Y, Cui L, Li J, Wu C, Wan Y, Li J, Wang Y (2017) The interaction of MC3R and MC4R with MRAP2, ACTH, α-MSH and AgRP in chickens. J Endocrinol 234(2): 155–174. https://doi.org/10.1530/JOE-17-0131
Rosenkranz AA, Slastnikova TA, Durymanov MO, Sobolev AS (2013) Malignant melanoma and melanocortin 1 receptor. Biochemistry (Mosc) 78(11): 1228–1237. https://doi.org/10.1134/S0006297913110035
Chen X, Chen H, Cai W, Maguire M, Ya B, Zuo F, Logan R, Li H, Robinson K, Vanderburg CR, Yu Y, Wang Y, Fisher DE, Schwarzschild MA (2017) The melanoma-linked “redhead” MC1R influences dopaminergic neuron survival. Ann Neurol 81(3): 395–406. https://doi.org/10.1002/ana.24852
Zhou Y, Chawla MK, Rios-Monterrosa JL, Wang L, Zempare MA, Hruby VJ, Barnes CA, Cai M (2021) Aged Brains Express Less Melanocortin Receptors, Which Correlates with Age-Related Decline of Cognitive Functions. Molecules 26(20): 6266. https://doi.org/10.3390/molecules26206266
Ji LQ, Rao YZ, Zhang Y, Chen R, Tao YX (2020) Regulation of melanocortin-1 receptor pharmacology by melanocortin receptor accessory protein 2 in orange-spotted grouper (Epinephelus coioides). Gen Comp Endocrinol 285: 113291. https://doi.org/10.1016/j.ygcen.2019.113291
Ayers KL, Glicksberg BS, Garfield AS, Longerich S, White JA, Yang P, Du L, Chittenden TW, Gulcher JR, Roy S, Fiedorek F, Gottesdiener K, Cohen S, North KE, Schadt EE, Li SD, Chen R, Van der Ploeg LHT (2018) Melanocortin 4 Receptor Pathway Dysfunction in Obesity: Patient Stratification Aimed at MC4R Agonist Treatment. J Clin Endocrinol Metab 103(7): 2601–2612. https://doi.org/10.1210/jc.2018-00258
Yeo GSH, Chao DHM, Siegert AM, Koerperich ZM, Ericson MD, Simonds SE, Larson CM, Luquet S, Clarke I, Sharma S, Clément K, Cowley MA, Haskell-Luevano C, Van Der Ploeg L, Adan RAH (2021) The melanocortin pathway and energy homeostasis: From discovery to obesity therapy. Mol Metab 48: 101206. https://doi.org/10.1016/j.molmet.2021.101206
Romanova IV, Derkach KV, Mikhrina AL, Sukhov IB, Mikhailova EV, Shpakov AO (2018) The Leptin, Dopamine and Serotonin Receptors in Hypothalamic POMC-Neurons of Normal and Obese Rodents. Neurochem Res 43(4): 821–837. https://doi.org/10.1007/s11064-018-2485-z
Derkach KV, Bondareva VM, Chistyakova OV, Berstein LM, Shpakov AO (2015) The Effect of Long-Term Intranasal Serotonin Treatment on Metabolic Parameters and Hormonal Signaling in Rats with High-Fat Diet/Low-Dose Streptozotocin-Induced Type 2 Diabetes. Int J Endocrinol 2015: 245459. https://doi.org/10.1155/2015/245459
Derkach K, Zakharova I, Zorina I, Bakhtyukov A, Romanova I, Bayunova L, Shpakov A (2019) The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One 14(3): e0213779. https://doi.org/10.1371/journal.pone.0213779
Ohsawa K, Imai Y, Kanazawa H, Sasaki Y, Kohsaka S (2000) Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. J Cell Sci 113 (Pt 17): 3073–3084. https://doi.org/10.1242/jcs.113.17.3073
Gao Y, Ottaway N, Schriever SC, Legutko B, García-Cáceres C, de la Fuente E, Mergen C, Bour S, Thaler JP, Seeley RJ, Filosa J, Stern JE, Perez-Tilve D, Schwartz MW, Tschöp MH, Yi CX (2014) Hormones and diet, but not body weight, control hypothalamic microglial activity. Glia 62(1): 17–25. https://doi.org/10.1002/glia.22580
Calcia MA, Bonsall DR, Bloomfield PS, Selvaraj S, Barichello T, Howes OD (2016) Stress and neuroinflammation: a systematic review of the effects of stress on microglia and the implications for mental illness. Psychopharmacology (Berl) 233(9): 1637–1650. https://doi.org/10.1007/s00213-016-4218-9
Romanova IV, Mikhailova EV, Shpakov AO (2019) Immunochemical Identification of Melanocortin and Leptin Receptors on Serotoninergic Neurons in the Rat Midbrain. Neurosci Behav Physiol 49 (7): 832–837. https://doi.org/10.1007/s11055-019-00809-w
Paxinos G, Franklin KBJ (2019) The Mouse Brain in Stereotaxic Coordinates. 5th ed. Hardcover.
Maioli TU, Gonçalves JL, Miranda MC, Martins VD, Horta LS, Moreira TG, Godard AL, Santiago AF, Faria AM (2016) High sugar and butter (HSB) diet induces obesity and metabolic syndrome with decrease in regulatory T cells in adipose tissue of mice. Inflamm Res 65(2): 169–178. https://doi.org/10.1007/s00011-015-0902-1
Murtaza M, Khan G, Aftab MF, Afridi SK, Ghaffar S, Ahmed A, Hafizur RM, Waraich RS (2017) Cucurbitacin E reduces obesity and related metabolic dysfunction in mice by targeting JAK-STAT5 signaling pathway. PLoS One 12(6): e0178910. https://doi.org/10.1371/journal.pone.0178910
Pretz D, Le Foll C, Rizwan MZ, Lutz TA, Tups A (2021) Hyperleptinemia as a contributing factor for the impairment of glucose intolerance in obesity. FASEB J 35(2): e21216. https://doi.org/10.1096/fj.202001147R
Huang XF, Han M, South T, Storlien L (2003) Altered levels of POMC, AgRP and MC4R mRNA expression in the hypothalamus and other parts of the limbic system of mice prone or resistant to chronic high-energy diet-induced obesity. Brain Res 992(1): 9–19. https://doi.org/10.1016/j.brainres.2003.08.019
Enriori PJ, Evans AE, Sinnayah P, Jobst EE, Tonelli-Lemos L, Billes SK, Glavas MM, Grayson BE, Perello M, Nillni EA, Grove KL, Cowley MA (2007) Diet-induced obesity causes severe but reversible leptin resistance in arcuate melanocortin neurons. Cell Metab 5(3): 181–194. https://doi.org/10.1016/j.cmet.2007.02.004
Gout J, Sarafian D, Tirard J, Blondet A, Vigier M, Rajas F, Mithieux G, Begeot M, Naville D (2008) Leptin infusion and obesity in mouse cause alterations in the hypothalamic melanocortin system. Obesity (Silver Spring) 16(8): 1763–1769. https://doi.org/10.1038/oby.2008.303
Gamber KM, Huo L, Ha S, Hairston JE, Greeley S, Bjørbæk C (2012) Over-expression of leptin receptors in hypothalamic POMC neurons increases susceptibility to diet-induced obesity. PLoS One 2012;7(1): e30485. https://doi.org/10.1371/journal.pone.0030485
Salazar-Onfray F, López M, Lundqvist A, Aguirre A, Escobar A, Serrano A, Korenblit C, Petersson M, Chhajla-ni V, Larsson O, Kiessling R (2002) Tissue distribution and differential expression of melanocortin 1 receptor, a malignant melanoma marker. Br J Cancer 87(4): 414–422. https://doi.org/10.1038/sj.bjc.6600441
Rinne P, Rami M, Nuutinen S, Santovito D, van der Vorst EPC, Guillamat-Prats R, Lyytikäinen LP, Raitoharju E, Oksala N, Ring L, Cai M, Hruby VJ, Lehtimäki T, Weber C, Steffens S (2017) Melanocortin 1 Receptor Signaling Regulates Cholesterol Transport in Macrophages. Circulation 136(1): 83–97. https://doi.org/10.1161/CIRCULATIONAHA.116.025889
Kadiri JJ, Tadayon S, Thapa K, Suominen A, Hollmén M, Rinne P (2021) Melanocortin 1 Receptor Deficiency in Hematopoietic Cells Promotes the Expansion of Inflammatory Leukocytes in Atherosclerotic Mice. Front Immunol 12: 774013. https://doi.org/10.3389/fimmu.2021.774013
Mioni C, Giuliani D, Cainazzo MM, Leone S, Bazzani C, Grieco P, Novellino E, Tomasi A, Bertolini A, Guarini S (2003) Further evidence that melanocortins prevent myocardial reperfusion injury by activating melanocortin MC3 receptors. Eur J Pharmacol 477(3): 227–234. https://doi.org/10.1016/s0014-2999(03)02184-8
Catania A, Lonati C, Sordi A, Carlin A, Leonardi P, Gatti S (2010) The melanocortin system in control of inflammation. Scient World J 14 (10): 1840–1853. PMCID: PMC5763663https://doi.org/10.1100/tsw.2010.17320852827
Wang W, Guo DY, Lin YJ, Tao YX (2019) Melanocortin Regulation of Inflammation. Front Endocrinol (Lausanne) 10: 683. https://doi.org/10.3389/fendo.2019.00683
Fu C, Chen J, Lu J, Yi L, Tong X, Kang L, Pei S, Ouyang Y, Jiang L, Ding Y, Zhao X, Li S, Yang Y, Huang J, Zeng Q (2020) Roles of inflammation factors in melanogenesis (Review). Mol Med Rep 21(3): 1421–1430. https://doi.org/10.3892/mmr.2020.10950
Xu W, Mo J, Ocak U, Travis ZD, Enkhjargal B, Zhang T, Wu P, Peng J, Li T, Zuo Y, Shao A, Tang J, Zhang J, Zhang JH (2020) Activation of Melanocortin 1 Receptor Attenuates Early Brain Injury in a Rat Model of Subarachnoid Hemorrhage viathe Suppression of Neuroinflammation through AMPK/TBK1/NF-κB Pathway in Rats. Neurotherapeutics 17(1): 294–308. https://doi.org/10.1007/s13311-019-00772-x
Xu W, Yan J, Ocak U, Lenahan C, Shao A, Tang J, Zhang J, Zhang JH (2021) Melanocortin 1 receptor attenuates early brain injury following subarachnoid hemorrhage by controlling mitochondrial metabolism via AMPK/SIRT1/PGC-1α pathway in rats. Theranostics 11(2): 522–539. https://doi.org/10.7150/thno.49426
Yu S, Doycheva DM, Gamdzyk M, Gao Y, Guo Y, Travis ZD, Tang J, Chen WX, Zhang JH (2022) BMS-470539 Attenuates Oxidative Stress and Neuronal Apoptosis via MC1R/cAMP/PKA/Nurr1 Signaling Pathway in a Neonatal Hypoxic-Ischemic Rat Model. Oxid Med Cell Longev 2022: 4054938. https://doi.org/10.1155/2022/4054938
Ohsawa K, Imai Y, Sasaki Y, Kohsaka S (2004) Microglia/macrophage-specific protein Iba1 binds to fimbrin and enhances its actin-bundling activity. J Neurochem 88(4): 844–856. https://doi.org/10.1046/j.1471-4159.2003.02213.x
Leyh J, Winter K, Reinicke M, Ceglarek U, Bechmann I, Landmann J (2021) Long-term diet-induced obesity does not lead to learning and memory impairment in adult mice. PLoS One 16(9): e0257921. https://doi.org/10.1371/journal.pone.0257921
Waise TMZ, Toshinai K, Naznin F, NamKoong C, Md Moin AS, Sakoda H, Nakazato M (2015) One-day high-fat diet induces inflammation in the nodose ganglion and hypothalamus of mice. Biochem Biophys Res Commun 464(4): 1157–1162. https://doi.org/10.1016/j.bbrc.2015.07.097
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


