Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1175-1187
Разработка подходов для снижения эффективной дозы гонадотропина при лечении андрогенной недостаточности у самцов крыс с сахарным диабетом 1-го типа
А. А. Бахтюков 1, *, И. Ю. Морина 1, К. В. Деркач 1, И. В. Романова 1, В. Н. Сорокоумов 1, 2, А. О. Шпаков 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Институт химии Санкт-Петербургского государственного университета
Санкт-Петербург, Россия
* E-mail: bahtyukov@gmail.com
Поступила в редакцию 08.07.2022
После доработки 04.08.2022
Принята к публикации 10.08.2022
- EDN: RJDCXS
- DOI: 10.31857/S0869813922090023
Аннотация
При сахарном диабете 1-го типа (СД1) синтез тестостерона в семенниках нарушается, что ведет к андрогенной недостаточности и нарушению сперматогенеза. Длительное использование высоких доз гонадотропинов для их коррекции приводит к снижению чувствительности рецептора лютеинизирующего гормона/хорионического гонадотропина человека (ЛГ/ХГЧ) в клетках Лейдига. Целью работы было изучить влияние трехдневной обработки самцов крыс Вистар с СД1, вызванным стрептозотоцином (45 мг/кг), с помощью аллостерического агониста рецептора ЛГ/ХГЧ 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d] пиримидин-6-карбоксамида (ТП03, 15 мг/кг в сутки) на эффекты относительно низкой дозы ХГЧ (10 МЕ/крысу, однократно, п/к) на уровень тестостерона в крови, экспрессию генов стероидогенеза и морфометрические показатели семенных канальцев. Предобработка СД1-крыс ТП03 усиливала стимулирующий эффект ХГЧ на уровень тестостерона в крови. Причиной подобного эффекта с одной стороны является усиление стероидогенеза за счет повышения экспрессии гена Cyp11a1, кодирующего фермент цитохром P450scc, ответственный за первый этап синтеза тестостерона, а с другой стороны – улучшение тестикулярной чувствительности к гонадотропинам за счет повышения содержания рецептора ЛГ/ХГЧ в семенниках СД1-крыс. Кроме того, предобработка ТП03 с последующей стимуляцией ХГЧ демонстрировала более выраженное улучшение морфометрических показателей семенных канальцев по сравнению с группами, получавшими только ТП03 или ХГЧ. Тем самым, ТП03 позволяет повысить эффективность стероидогенного эффекта ХГЧ и снизить дозу гонадотропина, компенсирующую андрогенную недостаточность при диабете.
Сахарный диабет 1-го типа (СД1) приводит к нарушению метаболизма и множества физиологических функций, затрагивая почти все системы организма. Одним из ключевых направлений в клинической эндокринологии является изучение нарушений у мужчин-пациентов с СД1, возникающих в гипоталамо-гипофизарно-тестикулярной оси и приводящих к андрогенной недостаточности. Мощным триггером к появлению таких нарушений являются гипергликемия, инсулиновая резистентность и воспалительные процессы [1]. В условиях СД1 снижается синтез тестостерона тестикулярными клетками Лейдига и нарушается процесс созревания сперматозоидов, что ведет к снижению фертильности [2, 3]. У крыс с СД1 снижается экспрессия и количество белка StAR (Steroidogenic acute regulatory protein, ген Star), ответственного за транспорт холестерина в митохондрии, где осуществляется первые стадии тестикулярного стероидогенеза. При СД1 в семенниках снижаются экспрессия и активность ферментов – цитохрома Р450scc, катализирующего превращение холестерина в прегненолон (ген Cyp11a1), и цитохрома P450c17, превращающего прогестерон в 17-ОН-прогестерон и далее в андростендион (ген Cyp17a1), что приводит к дефициту тестостерона [4, 5]. Не менее фатальными для функционирования репродуктивной системы при СД1 являются изменения морфологии семенных канальцев семенников, которые выражаются в уменьшении толщины герминативного эпителия семенных канальцев, а также значительное снижение количества сперматогенных клеток, что ведет к тяжелым нарушениям сперматогенеза [6, 7].
Длительное применение высоких доз препаратов гонадотропинов, хорионического гонадотропина человека (ХГЧ) и лютеинизирующего гормона (ЛГ) снижает чувствительность клеток Лейдига к эндогенному ЛГ, следствием чего является значимое снижение продукции тестостерона после окончания лечения [8]. Альтернативой гонадотропинам являются низкомолекулярные аллостерические агонисты рецептора ЛГ/ХГЧ, созданные на основе тиено[2,3-d]-пиримидина, которые взаимодействуют с аллостерическим сайтом, локализованным в трансмембранном домене рецептора. Показана способность ряда соединений, в том числе одного из наиболее активных и селективных, Org 43553, активировать рецептор ЛГ/ХГЧ и стимулировать синтез тестостерона у самцов крыс [9]. Нами ранее разработана серия производных тиено[2,3-d]-пиримидина, в том числе наиболее активные из них – соединения ТП03 и ТП04, которые с высокой эффективностью стимулировали тестикулярный стероидогенез при парентеральном и пероральном способах введения [10]. В отличие от гонадотропинов, они не снижали ответ клеток Лейдига на эндогенный ЛГ [11, 12]. Наряду с этим, соединения ТП03 и ТП04 стимулировали тестикулярный стероидогенез у самцов крыс со стрептозотоциновым диабетом [11–13]. Имеются данные о способности тиено[2,3-d]-пиримидиновых производных функционировать как низкомолекулярные шапероны, которые активируют рецепторы ЛГ/ХГЧ внутри клетки и(или) облегчают транслокацию мутантных и неправильно свернутых рецепторов к плазматической мембране [14]. На основании этого можно предположить, что предобработка животных тиено[2,3-d]-пиримидиновыми производными будет усиливать действие гонадотропинов, снижая их эффективную дозу, причем в наибольшей степени этот эффект будет выявляться в условиях патологических изменений в семенниках, в том числе при СД1.
Целью работы было изучить эффект трехдневной предобработки самцов крыс с СД1 с помощью 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d] пиримидин-6-карбоксамида (ТП03), низкомолекулярного агониста рецептора ЛГ/ХГЧ и однократно вводимого животным ХГЧ на (1) стероидогенные эффекты, которые оценивали по уровню тестостерона в крови и по экспрессии тестикулярных генов, кодирующих ферменты, участвующие в синтезе тестостерона, (2) на уровень рецептора ЛГ/ХГЧ и его генную экспрессии, а также (3) на морфометрические показатели семенных канальцев. В качестве модели среднего по тяжести СД1 был выбран стрептозотоциновый диабет, индуцированный введением половозрелым самцам крыс средней дозы стрептозотоцина (45 мг/кг).
МЕТОДЫ ИССЛЕДОВАНИЯ
Моделирование сахарного диабета 1-го типа и схема эксперимента. Для экспериментов использовали половозрелых (3 мес.) самцов крыс Вистар, которые содержались в стандартных условиях вивария со свободным доступом к воде и корму. Все процедуры осуществляли в строгом соответствии с требованиями Комитета по биоэтике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (протокол № 7-3/2020), “Guide for the Care and Use of Laboratory Animals” и European Communities Council Directive 1986 (86/609/EEC).
СД1 вызывали инъекцией стрептозотоцина (СТЗ) в дозе 45 мг/кг (в/б, в 0.1 M цитратном буфере, pH 4.5) самцам крыс. Контрольные животные того же возраста получали только буфер. Эффективность развития СД1 оценивали через 10 дней по уровню глюкозы в крови через 2 ч после потребления стандартной кормовой смеси, отбирая животных с уровнем глюкозы выше 15 мМ. Для определения уровня глюкозы использовали глюкометр и тест-полоски “One-Touch Select Ultra” (“LifeScan”, США). Через 30 дней после индукции СД1 крыс распределяли на группы (в каждой n = 5). Животные из групп “СД1+ТП03-1Д” и “СД1+ТП03-3Д” были обработаны с помощью ТП03, который синтезировали, как описано ранее [13]. ТП03 растворяли в диметилсульфоксиде (ДМСО) и вводили крысам в дозе 15 мг/кг/сутки (в/б) в течение одного или трех дней соответственно. Другие группы обрабатывали следующим образом: “Контроль” и “СД1” – ДМСО (300 мкл, в/б), “СД1 + ХГЧ-1Д” – ХГЧ (“Московский эндокринный завод”, Россия) однократно, в дозе 10 МЕ/крысу (п/к), “СД1 + ТП03-3Д + ХГЧ” – ТП03 (15 мг/кг/сутки, в/б, в течение трех дней) и ХГЧ (10 МЕ/крысу, п/к, однократно, на третий день эксперимента, через 30 мин после инъекции ТП03). Дозы препаратов ТП03 и ХГЧ были выбраны на основе результатов предварительных экспериментов. Доза ХГЧ была в два раза ниже той дозы (20 МЕ/крысу), при которой достигался 70%-ный стероидогенный эффект гонадотропина. Образцы плазмы получали из цельной крови, взятой из хвостовой вены крыс в первый (до и через 1, 3 и 5 ч после введения ТП03 или ДМСО) и в третий дни эксперимента (до введения препаратов, через 2 и 3.5 ч после введения ТП03 или ДМСО, или соответственно через 1.5 и 3 ч после введения ХГЧ). Образцы тканей семенников забирали после декапитации животных, которая осуществлялась под наркозом (хлоральгидрат, 400 мг/кг, в/б).
Морфологические показатели семенников крыс. Образцы тканей семенников фиксировали в течение 48 ч (4°С) в 4%-ном растворе параформальдегида, затем промывали 0.9%-ным натрий-фосфатным буфером (PBS) и погружали в PBS, содержащий 30% сахарозы. Далее ткани семенников замораживали на сухом льду с использованием среды Tissue-Tek (“Sacura Finetek Europe”, Нидерланды). Серии поперечных срезов (толщина 6 мкм) готовили с помощью криостата Leica CM-1520 (“Leica Biosystems”, Германия) и монтировали на стеклах SuperFrost/plus (“Menzel”, Германия). Срезы из разных экспериментальных групп помещали на одно и то же стекло, сушили на воздухе в течение ночи, а затем использовали для гистологического и иммуногистохимического анализа.
Для изучения морфологии семенных канальцев срезы семенников обрабатывали 50%-ным этанолом в течение 15 мин, промывали дистиллированной водой и окрашивали гематоксилином Малера по стандартной методике. Затем срезы снова промывали дистиллированной водой и помещали под покровное стекло с глицерином. На каждом срезе было проанализировано 10 семенных канальцев.
Иммуноферментный и иммуногистохимический анализ. Уровень тестостерона в образцах плазмы крови крыс определяли с помощью иммуноферментного анализа (“ИФА-Тестостерон”, “Алкор-Био”, Россия). Свежеприготовленные срезы семенников промывали PBS, обрабатывали 0.6%-ной перекисью водорода в PBS в течение 30 мин для блокирования активности эндогенной пероксидазы, далее промывали PBS в течение 10 мин, а затем PBS, содержащим 0.1% Triton X-100 (PBST) в течение 20 мин. Затем срезы инкубировали в течение 1 ч в блокирующем растворе (5%-ная козья сыворотка в PBST). Инкубацию с первичными поликлональными кроличьими антителами к ЛГР (“LSBio”, США) проводили в 1%-ном блокирующем растворе в разведении 1 : 1000 в течение ночи (22°С). После промывки PBST (40 мин) срезы инкубировали в течение 1 ч в PBST с биотин-конъюгированными вторичными антикроличьими IgG-антителами козы (“VectorLabs”, Великобритания) в разведении 1 : 600, затем промывали PBS в течение 30 мин и инкубировали в растворе стрептавидин-пероксидазы (“Sigma-Aldrich”, США) в PBS в разведении 1 : 1000 в течение 1 ч. После промывки в PBS срезы обрабатывали 0.05%-ным диаминобензидином (“Sigma-Aldrich”, США) и 0.03%-ной перекисью водорода в PBS. Реакцию останавливали промывкой дистиллированной водой, после чего срезы помещали под покровное стекло с глицерином. Специфичность иммуногистохимической реакции проверяли с использованием отрицательного контроля (образцы без первичных или вторичных антител). Микрофотографии (по 20 для каждого животного) с разных уровней семенников получали с помощью микроскопа Carl Zeiss Imager A1, объектив ×20 (“Carl Zeiss”, Германия) с использованием одинаковых оптических характеристик для разных групп животных. Оптическую плотность количественно определяли с помощью программного обеспечения Image J NIH Analysis (“National Institutes of Health”, США). На каждой микрофотографии анализировали 5 участков с клетками и оценивали оптическую плотность ЛГР-иммунопозитивного материала, выраженную в арбитражных единицах.
Анализ генной экспрессии. Для анализа экспрессии генов из семенников выделяли тотальную РНК с помощью реагента “ExtractRNA” (“Евроген”, Россия), затем получали кДНК с помощью реакции обратной транскрипции (“MMLV RT Kit”, “Евроген”, Россия). ПЦР в реальном времени осуществляли с помощью амплификатора “Applied Biosystems® 7500 Real-Time PCR System” (“Life Technologies, Thermo Fisher Scientific Inc.”, США) в смеси, содержащей кДНК, 0.4 мкМ прямого и обратного специфичных праймеров, реагент “qPCR-HS SYBR + Low ROX” (“Евроген”, Россия). В работе использовали ранее описанные последовательности комплементарных прямого и обратного праймеров для генов крысы Lhr, Star, Cyp11a1 и Cyp17a1, а также Actb, используемого в качестве референсного гена [12, 13].
Статистическая обработка результатов. Статистическую обработку данных осуществляли с помощью критерия Крускала–Уоллиса с дальнейшим использованием апостериорного критерия Дана для попарного сравнения групп, используя пакет программ GraphPad Prism 8 (версия 8.0.1).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристика диабетической модели и развитие андрогенной недостаточности. Крысы с СД1 демонстрировали сильно выраженную гипергликемию через 2 ч после потребления пищи (“СД1” – 21.2 ± 3.9 мМ, “Контроль” – 6.3 ± 0.4 мМ, p < 0.05) и снижение массы тела (“СД1” – 241 ± 20 г, ‘Контроль” – 327 ± 18 г, p < 0.05). У самцов крыс с СД1 был снижен базовый уровень тестостерона в крови – до 38.7–45.0% от такового в контроле, что свидетельствует о развитии андрогенной недостаточности (табл. 1, А). В семенниках диабетических крыс экспрессия генов Star, Cyp11a1 и Cyp17a1, кодирующих белок StAR и цитохромы P450scc и P450c17, была снижена соответственно до 30.0, 30.0 и 34.4% от ее уровня в контроле (рис. 1). При изучении относительного уровня мРНК гена Lhr, кодирующего рецептор ЛГ/ХГЧ в семенниках крыс с СД1, отличий выявлено не было. Однако при иммуногистохимическом анализе рецептора ЛГ/ХГЧ было показано снижение уровня белка для этого рецептора на 18% относительно контроля (рис. 2). Гистологический анализ тканей семенников СД1-крыс показал уменьшение высоты герминативного эпителия семенных канальцев на 15.5%, а количества сперматогониев и пахитеновых сперматоцитов на 10.1 и 11.1% соответственно (табл. 2). Таким образом, у самцов с экспериментальным СД1 наряду с метаболическими нарушениями наблюдались значительное ослабление стероидогенеза и сперматогенеза.
Таблица 1.
Уровни тестостерона в крови крыс с СД1 при однократном введении им ТП03, аллостерического агониста рецептора ЛГ/ХГЧ (А), а также в условиях трехдневной обработки животных ТП03, в том числе в сочетании с однократно вводимым ХГЧ (Б)
| A. Однократное введение ТП03 самцам крыс с СД1 | ||||
| Группа/время (ч) | 0 | 1 | 3 | 5 |
| “Контроль” | 12.70 (10.94 –17.98) | 17.11 (10.99–25.27) | 13.43 (6.55–16.91) | 13.25 (6.88–17.29) |
| “СД1" | 5.72 (3.55–9.29)a | 7.02 (1.89–12.43) a | 4.52 (3.14–9.88)a | 5.13 (4.23–11.67)a |
| “СД1 + ТП03” | 6.12 (4.45–7.69)a | 12.37 (10.06–27.88) | 20.20 (13.08 ̶–30.01)b | 11.88 (8.72–22.22) |
| Б. Уровни тестостерона в крови крыс на третий день их обработки ТП03 или ДМСО и однократной стимуляции ХГЧ | ||||
| Группа/время (ч) | 0 | 2 | 3.5 | |
| “Контроль” | 13.54 (8.51–15.73) | 15.24 (10.69–16.55) | 9.93 (8.67–17.09) | |
| “СД1” | 5.70 (2.79–9.07)a | 3.44 (2.96–5.38)a | 3.72 (2.55–7.45)a | |
| “СД1 + ТП03-3Д” | 9.79 (7.00–12.76) | 16.13 (12.64–31.37) | 18.06 (13.58–39.09) | |
| “СД1 + ХГЧ-1Д” | 6.54 (2.81–12.49)a | 18.30 (4.08–29.26) | 36.81 (24.39–71.37)b | |
| “СД1 + ТП03-3Д + ХГЧ” | 5.47 (4.76–11.39)a | 43.00 (27.37–58.71)ab | 47.01 (41.79–77.82)ab | |
A. ТП03 или его растворитель ДМСО вводили в 11.00, образцы крови забирали в 10.00 (до введения, точка “0”) и через 1, 3 и 5 ч после введения. Уровень тестостерона измеряли в плазме крови крыс (нмоль/л). Б. ТП03 или его растворитель ДМСО вводили в 11.00, ХГЧ – через 30 мин после инъекции ТП03 или ДМСО. Образцы крови забирали в 10.00 (до введения, точка “0”) и через 2 и 3.5 ч после введения ТП03. a – отличия от группы "Контроль”, b – от группы “СД1" статистически значимы при p < 0.05, данные представлены как медиана, максимальное и минимальное значение, n = 5.
Рис. 1.
Экспрессия генов Lhr (a), Star (b), Cyp11a1 (c) и Cyp17a1 (d) в семенниках самцов крыс с СД1 при однократном введении им ТП03 или ХГЧ, а также в условиях трехдневной обработки ТП03, в том числе в сочетании с однократно вводимым ХГЧ. Ткани семенников были взяты через 3.5 ч после введения ТП03 (соответственно через 3 ч после введения ХГЧ) в последний день эксперимента. 1 – “Контроль” (ДМСО, в/б), 2 – “СД1” (ДМСО, в/б), 3 – “СД1 + ТП03-1Д”, однократное введение ТП03 (15 мг/кг/сутки, в/б), 4 – “СД1 + ХГЧ-1Д”, однократное введение ХГЧ (10 МЕ/крысу, п/к), 5 – “СД1 + ТП03-3Д”, введение ТП03 (15 мг/кг/сутки, в/б) в течение трех дней, 6 – “СД1 + ТП03-3Д + ХГЧ” введение ТП03 (15 мг/кг/сутки, в/б) в течение трех дней и однократное введение ХГЧ (10 МЕ/крысу, п/к) на третий день эксперимента. Экспрессия генов нормирована относительно референсного гена (Actb). a – отличия от группы “Контроль”, b – от группы “СД1”, c – от группы “СД1+ТП03-3Д”, d – от группы “СД1 + ХГЧ-1Д” статистически значимы при p < 0.05, данные представлены как медиана, 25 и 75 процентиль (“бокс”), минимальное и максимальное значение (“усы”), n = 5.
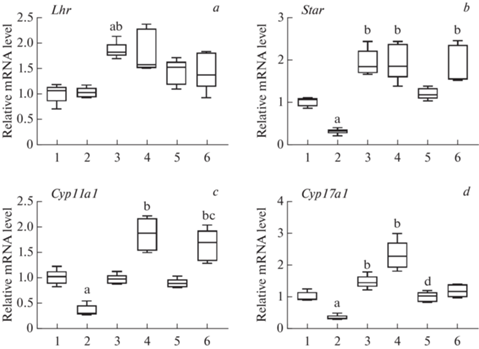
Таблица 2.
Эффекты однократного введения ТП03 и ХГЧ, а также трехдневной обработки ТП03 с последующей однократной стимуляцией ХГЧ на высоту эпителия семенных канальцев, количество сперматогониев и пахитеновых сперматоцитов в семенниках СД1-крыс
| Высота эпителия, мкм | Количество сперматогониев | Количество пахитеновых сперматоцитов | |
|---|---|---|---|
| “Контроль” | 71.0 (57.5 –83.0) | 64.5 (55.0–77.0) | 58.50 (44.0–69.0) |
| “СД1” | 60.7 (50.0–74.5)a | 58.5 (45.0–71.0)a | 52.0 (42.0–60.0)a |
| “СД1 + ТП03-1Д” | 68.0 (52.0 –82.0)ab | 63.0 (42.0–71.0)ab | 53.5 (43.0–67.0)a |
| “СД1 + ХГЧ-1Д” | 67.5 (52.5–78.0)ab | 61.5 (48.0–82.0)ab | 53.0 (34.0–65.0)a |
| “СД1 + ТП03-3Д” | 67.0 (52.0–80.0)ab | 60.5 (51.0–69.0)a | 54.5 (39.0–64.0)a |
| “СД1 + ТП03-3Д + ХГЧ” | 68.0 (56.5–81.0)ab | 66.0 (44.0–85.0)bcd | 56.5 (37.0 –72.0)b |
Эффекты агонистов рецептора ЛГ/ХГЧ на стероидогенез и сперматогенез СД1-крыс. Аллостерический агонист рецептора ЛГ/ХГЧ ТП03 через 3 ч после однократного введения стимулировал повышение уровня тестостерона у СД1-крыс на 347% (табл. 1, А). Однократная обработка ХГЧ приводила к повышению уровня тестостерона на 890% через 3 ч после введения. Трехдневная обработка крыс с помощью ТП03 восстанавливала уровень тестостерона до контрольных значений (табл. 1, Б). Введение ХГЧ крысам, которые получали ТП03 в течение трех дней, приводило к повышению уровня тестостерона на 1125% уже через 1.5 ч после инъекции гонадотропина. Через 3 ч после введения ХГЧ (3.5 ч после последней инъекции ТП03) уровень тестостерона в этой группе был на 1163% выше, чем в группе “СД1” (табл. 1, Б). При этом у животных в группах “СД1 + ХГЧ-1Д” и “СД1 + ТП03-3Д” уровень тестостерона хоть и имел тенденцию к повышению, но не достигал достоверных различий через 1.5 ч после введения ХГЧ и 2 ч после введения ТП03.
Изучение экспрессии генов, вовлеченных в регуляцию тестикулярного стероидогенеза у диабетических крыс показало, что однократные инъекции ТП03 и ХГЧ повышали экспрессию генов Star на 42.4 и 42.7% и Cyp17a1 на 35.9 и 59.2% соответственно. Кроме того, в ответ на однократное введение ХГЧ экспрессия Cyp11a1 повышалась на 45.2% (рис. 1). Трехдневное введение ТП03 оказывало менее выраженный эффект на экспрессию генов Star, Cyp11a1 и Cyp17a1 по сравнению с однократной стимуляцией ТП03 или ХГЧ. Введение ХГЧ крысам с СД1, обработанных ТП03, усиливало эффект на экспрессию Cyp11a1 по сравнению с группой “СД1 + ТП03-3Д”, но при этом значение генной экспрессии были сопоставимы с таковым одного ХГЧ. Эффекты стимуляции ХГЧ на фоне предобработки ТП03 оказывали сопоставимое влияние на экспрессию гена Cyp17a1 в сравнении с группой, обработанной ТП03, но без ХГЧ (рис. 1).
Однократное введение ТП03 и ХГЧ СД1-крысам приводило к восстановлению некоторых морфологических характеристик семенных канальцев, сниженных при СД1, практически до их показателей в контроле. Высота герминативного эпителия увеличилась на 11 и 10% соответственно, а количество сперматогониев повышалось на 7.2 и 5% под действием агонистов рецептора ЛГ/ХГЧ (табл. 2). Трехдневное введение ТП03 СД1-крысам повлияло лишь на высоту эпителия семенников, которая увеличилась на 10%. Предобработка крыс ТП03 и дальнейшая однократная стимуляция с помощью ХГЧ привели к значительному улучшению морфологических характеристик семенных канальцев у диабетических крыс, что выражалось в повышении количества пахитеновых сперматоцитов на 8% по сравнению с группой “СД1”. Количество сперматогониев в группе “СД1 + ТП03-3Д + ХГЧ” увеличилось на 11% и было достоверно выше соответствующих значений в группах с трехдневным введением ТП03 и однократным введением ХГЧ. Наравне с этим, высота герминативного эпителия в семенных канальцах в группе с предобработкой ТП03 увеличилась на 11%, что было сопоставимо с подобными значениями в группах “СД1 + ХГЧ-1Д” и “СД1 + ТП03-3Д” (табл. 2).
Эффекты ТП03 и ХГЧ на экспрессию и клеточное содержание рецептора ЛГ/ХГЧ. При изучении эффектов ТП03 и ХГЧ на стероидогенез в клетках Лейдига, было также исследовано их влияние на экспрессию Lhr, гена, кодирующего рецептор ЛГ/ХГЧ. Было показано, что однократное введение ТП03 приводит к повышению генной экспрессии рецептора ЛГ/ХГЧ на 41.5%. При этом трехдневная обработка СД1-крыс ТП03 и их дальнейшая стимуляция с помощью ХГЧ не вызывали такого выраженного повышения экспрессии гена Lhr (рис. 1). При иммуногистохимическом исследовании тканей семенников было показано повышение уровня рецептора ЛГ/ХГЧ в группе “СД1 + ТП03-1Д” на 17% по сравнению с группой “СД1”. Содержание рецептора ЛГ/ХГЧ в группах “СД1 + ТП03-3Д” и “СД1 + ТП03-3Д + ХГЧ” увеличивалось на 15 и 13% соответственно по сравнению с группой “СД1” (рис. 2).
Рис. 2.
Изменение оптической плотности иммунофлуоресценции рецептора ЛГ/ХГЧ в семенниках СД1-крыс в ходе предобработки ТП03 и однократной стимуляцией ХГЧ. 1 – “Контроль” (ДМСО, в/б), 2 – “СД1” (ДМСО, в/б), 3 – “СД1 + ТП03-1Д”, однократное введение ТП03 (15 мг/кг/сутки, в/б), 4 – “СД1 + ХГЧ-1Д”, однократное введение ХГЧ (10 МЕ/крысу, п/к), 5 – “СД1 + ТП03-3Д”, введение ТП03 (15 мг/кг/сутки, в/б) в течение трех дней, 6 – “СД1 + ТП03-3Д + ХГЧ” введение ТП03 (15 мг/кг/сутки, в/б) в течение трех дней и однократное введение ХГЧ (10 МЕ/крысу, п/к) на третий день эксперимента. a – отличия от группы “Контроль”, b – от группы “СД1”, c – от группы “СД1 + ТП03-3Д”, d – от группы “СД1 + ХГЧ-1Д” статистически значимы при p < 0.05, данные представлены как медиана, 25 и 75 процентиль (“бокс”), минимальное и максимальное значение (“усы”), n = 50.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нарушение тестикулярного стероидогенеза и сперматогенеза являются частыми спутниками диабетической патологии, что подтверждено многочисленными исследованиями как на моделях животных, так и клиническими данными, полученными на человеке [1–3, 15–18]. Гипергликемия, инсулиновая резистентность, воспалительные процессы, нарушения процессинга и посттрансляционных модификаций белков при СД1 являются главными причинами дисфункций мужской репродуктивной системы [1]. Одним из основных показателей, характеризующих ослабление работы гипоталамо-гипофизарно-гонадной оси при диабетической патологии является снижение уровня тестостерона в крови. В использованной нами модели стрептозотоцинового СД1 при оценке динамики суточного изменения уровня гормона снижение уровня тестостерона в крови крыс находилось в пределах 38.7–45.0%, что определяет релевантность использования данной модели для изучения андрогенного дефицита, вызванного СД (табл. 1, А). Снижение уровня тестостерона в крови является следствием нарушений процессов стероидогенеза, которые протекают преимущественно в клетках Лейдига семенников. Основными причинами андрогенного дефицита при экспериментальном СД являются гипергликемия, окислительный стресс и воспалительные процессы. Также одной из причин снижения уровня тестостерона в крови самцов крыс может быть токсический эффект стрептозотоцина, который он оказывает на клетки печени, вызывая снижение синтеза холестерина гепатоцитами. Одними из ключевых звеньев в системе стероидогенеза, чьи функции нарушаются при СД, являются транспорт холестерина в митохондрии и некоторые этапы синтеза гормона. Белок StAR, транспортирующий холестерин в митохондрии, представляет собой основную мишень при гормональной регуляции синтеза тестостерона, а цитохромы P450scc и P450c17 являются ключевыми ферментами, катализирующими реакции превращения холестерина в прегненолон и прогестерона в 17-гидроксипрогестерон и далее в андростендион соответственно [5]. Нами показано значительное снижение экспрессии генов Star, Cyp11a1 и Cyp17a1, кодирующих StAR и цитохромы P450scc и P450c17 в семенниках крыс с СД1 (рис. 1), что хорошо соотносится как с ранее полученными нашими данными [11, 12], так и с данными литературы о подобных нарушениях стероидогенеза в экспериментальных диабетических моделях [4, 5].
Ослабление стероидогенеза в семенниках при диабетической патологии может быть также связано с нарушением рецепции гонадотропных гормонов тканями семенников, вызванными нарушениями синтеза и процессинга рецептора ЛГ/ХГЧ. С помощью иммуногистохимического анализа нами показано уменьшение содержания рецептора ЛГ/ХГЧ в тканях семенников СД1-крыс (рис. 2), однако уровень мРНК Lhr у диабетических животных не отличался от контроля (рис. 1a), хотя в литературе есть данные, показывающие ослабление экспрессии Lhr при экспериментальных моделях СД [19]. Подобные различия в экспрессии генов и количестве “зрелого” белка в клетке могут быть связаны с нарушением процессинга и посттрансляционных модификаций белка вследствие усиления стресса эндоплазматического ретикулума при диабетической патологии, что может стимулировать компенсаторное повышение экспрессии мРНК рецептора [20].
Нарушение сперматогенеза при диабетической патологии связано с одной стороны с инсулиновой резистентностью, воспалительными процессами и окислительным стрессом, а с другой – с ослаблением тестикулярного стероидогенеза. Многочисленные работы показывают изменения целого ряда морфологических параметров семенников. Прежде всего это нарушение структуры семенных канальцев, уменьшение их диаметра и толщины эпителиального слоя [15–17]. Следствием этого становится уменьшение и структурная дезорганизация клеток, обеспечивающих начальные этапы сперматогенеза: сперматогониев и первичных сперматоцитов [17]. Нами были показаны значительные нарушения морфологии семенных канальцев у СД1-крыс, которые выражались в уменьшении таких морфометрических параметров как толщина герминативного эпителия, число сператогониев и пахитеновых сперматоцитов, что отражает ослабление сперматогенной системы у крыс при СД1 (табл. 2).
Использование препаратов гонадотропинов для коррекции андрогенной недостаточности наравне с тестостерон-заместительной терапией является одним из немногих способов поддержания нормального уровня тестостерона у мужчин с нарушениями фертильности [21, 22]. Однако наличие широкого списка противопоказаний у пациентов с диабетической патологией значительно ограничивает возможности их применения. Нами были разработаны и системно исследованы соединения на основе тиенопиримидиновых производных, которые обладали активностью агонистов рецептора ЛГ/ХГЧ [10–13]. Связываясь с аллостерическим сайтом, локализованным в трансмембранном домене рецептора, они вызывают его активацию, при этом не конкурируя с гонадотропными гормонами, взаимодействующими с эктодоменом рецептора. Важной в практическом отношении особенностью наиболее активных соединений ТП03 и ТП04 была способность оказывать стабильный стероидогенный эффект не только при однократном введении, но и при обработке в течение 5–7 дней без существенного снижения чувствительности тканей семенников к действию эндогенного ЛГ. Это выражалось в сохранении высокого уровня экспрессии мРНК Lhr и количества рецепторов ЛГ/ХГЧ в клетках семенников при введении ТП03 и ТП04, в то время как хроническое введение препарата ХГЧ в дозировке 20 МЕ/крысу, оказывающей 70–80% от максимального эффекта препарата, приводило к значительному снижению как генной экспрессии, так и содержания рецептора в клетке, следствием чего было ослабление стимулирующего эффекта препарата на тестикулярный стероидогенез [11–13].
Мы предположили, что предобработка в течение трех дней одним из наиболее активных из разработанных нами аллостерических агонистов рецептора ЛГ/ХГЧ – ТП03 может привести к усилению эффекта хорионического гонадотропина, взятого в более низкой дозе 10 МЕ/крысу на тестикулярный стероидогенез у крыс, нарушенный вследствие диабетической патологии, но при этом не приведет к снижению чувствительности рецепторного аппарата клеток Лейдига к действию эндогенного ЛГ. Нами было показано, что предобработка СД1-крыс с помощью ТП03 в течение трех дней вызывает усиление эффекта на уровень тестостерона в крови однократной инъекции ХГЧ, взятого в сравнительно низкой дозе 10 МЕ/крысу (табл. 1, B). При этом, выраженный стимулирующий эффект наблюдается уже через 1.5 ч после введения ХГЧ и 2 ч после последней инъекции ТП03. Однако через 3 ч после введения ХГЧ различия в значениях уровня тестостерона в группах “СД1 + ХГЧ” и “СД1 + ТП03-3Д + ХГЧ” становятся менее выраженными. Изучив генную экспрессию в семенниках СД1-крыс нами было показано, что влияние однократной и трехдневной обработки животных с помощью ТП03 имеет существенные отличия. Однократное введение ТП03 оказывает сопоставимое влияние на экспрессию генов Star и Cyp17a1 в сравнении с животными, обработанными однократной дозой ХГЧ (рис. 1). При трехдневной обработке с помощью ТП03 мы наблюдали менее выраженный эффект на экспрессию генов Star, кодирующий одноименный транспортный белок и Cyp17a1, катализирующего превращение предшественников в синтезе тестостерона прогестерона в 17-гидроксипрогестерон и далее в андростендион. Аналогичные значения уровня мРНК гена Cyp17a1 были получены в группе “СД1 + ТП03-3Д + ХГЧ”. Таким образом, в группах с трехдневной обработкой ТП03 не наблюдается повышения экспрессии гена Cyp17a1 в отличие от групп с однократным введением ТП03 или ХГЧ, что может быть следствием влияния петли отрицательной обратной связи, сдерживающей избыточное повышение уровня тестостерона, либо обусловлено разнонаправленной модуляцией ТП03 и ХГЧ транскрипционных факторов, регулирующих экспрессию генов стероидогенеза. Также в группе “СД1 + ТП03-3Д + ХГЧ” мы наблюдали усиление экспрессии гена Cyp11a1, кодирующего фермент, катализирующий первую реакцию в цепи превращений холестерина в тестостерон в сравнении с группой “СД1 + ТП03-3Д”, но не с группой “СД1 + ХГЧ-1Д” (рис. 1). Усиление экспрессии Cyp11a1 в группе “СД1 + ТП03-3Д + ХГЧ” может отчасти объяснить усиление эффекта ХГЧ на фоне предобработки ТП03 на уровень тестостерона в крови СД1-крыс.
Ранее нами было показано, что один из наиболее многообещающих эффектов аллостерического агониста рецептора ЛГ/ХГЧ ТП03 – это отсутствие снижения генной экспрессии Lhr при однократной и многодневной обработке, следствием чего было сохранение чувствительности тканей семенников к эффектам эндогенного ЛГ. В данной работе нами показано увеличение как генной экспрессии Lhr (рис. 1a), так и уровня белка ЛГ/ХГЧ при однократном введении ТП03 (рис. 2). При трехдневной обработке ТП03 в группах “СД1 + ТП03-3Д” и “СД1 + ТП03-3Д + ХГЧ” мы наблюдали увеличения только уровня белка рецептора ЛГ/ХГЧ, без изменения генной экспрессии. Повышение уровня рецептора ЛГ/ХГЧ, сниженном у крыс с СД1, может быть одной из основных причин усиления эффекта ХГЧ на фоне предобработки ТП03.
Далее мы исследовали влияние препаратов ТП03 и ХГЧ на морфологические параметры семенников, нарушенные вследствие диабетической патологии. Даже однократные инъекции ТП03 или ХГЧ вызывали улучшение морфологических характеристик: высоты герминативного эпителия, количества сперматогониев, но не влияли на число пахитеновых сперматоцитов. Трехдневная обработка ТП03 приводила к повышению высоты герменативного эпителия, тогда как другие характеристики хоть и имели тенденции к повышению, но не были статистически значимыми. При этом только в группе “СД1 + ТП03-3Д + ХГЧ” мы наблюдали полное восстановление количества пахитеновых сперматоцитов и сперматогониев до их уровня у контрольных животных, в то время как толщина герминативного эпителия семенных канальцев не превышала соответствующих значений у групп с однократным введением ХГЧ или трехдневным введением ТП03 (табл. 2).
Таким образом, нами впервые показано, что трехдневная предобработка крыс с андрогенным дефицитом, вызванным СД1, с помощью ТП03 приводит к усилению стимулирующего эффекта однократно введенного ХГЧ, взятого в относительно низкой дозе (10 МЕ/крысу), на уровень тестостерона в крови, и это сопровождается повышением экспрессии гена Cyp11a1 в семенниках. Это может быть обусловлено показанными нами повышением уровня белка рецептора ЛГ/ХГЧ в семенниках. Кроме того, предобработка СД1-крыс с помощью ТП03 усиливала восстанавливающие эффекты ХГЧ на морфологические параметры семенных канальцев в семенниках диабетических животных, повышая некоторые из них до контрольных значений. Использование аллостерических агонистов рецептора ЛГ/ХГЧ на основе тиенопиримидиновых производных может способствовать снижению дозировок препаратов гонадотропных гормонов, что имеет большое значение в клинической эндокринологии и во вспомогательных репродуктивных технологиях.
Список литературы
Maresch CC, Stute DC, Alves MG, Oliveira PF, de Kretser DM, Linn T (2018) Diabetes-induced hyperglycemia impairs male reproductive function: a systematic review. Hum Reprod Update 24(1): 86–105. https://doi.org/10.1093/humupd/dmx033
Rato L, Alves MG, Duarte AI, Santos MS, Moreira PI, Cavaco JE, Oliveira PF (2015) Testosterone deficiency induced by progressive stages of diabetes mellitus impairs glucose metabolism and favors glycogenesis in mature rat Sertoli cells. Int J Biochem Cell Biol 66: 1–10. https://doi.org/10.1016/j.biocel.2015.07.001
Skurikhin EG, Pakhomova AV, Pershina OV, Krupin VA, Ermakova NN, Pan ES, Kudryashova AI, Ermolaeva LA, Khmelevskaya ES, Goldberg VE, Zhdanov VV, Dygai AM (2017) Role of Sertoli and Leydig cells in the regulation of spermatogonial stem cell and development of reproductive disorders in male C57Bl/6 mice with type 1 diabetes mellitus. Bull Exp Biol Med 64(2): 127–131. https://doi.org/10.1007/s10517-017-3940-6
Khamis T, Abdelalim AF, Abdallah SH, Saeed AA, Edress NM, Arisha AH (2020) Early intervention with breast milk mesenchymal stem cells attenuates the development of diabetic-induced testicular dysfunction via hypothalamic Kisspeptin/Kiss1r-GnRH/GnIH system in male rats. Biochim Biophys Acta Mol Basis Dis 866(1): 165577. https://doi.org/10.1016/j.bbadis.2019.165577
Wagner IV, Klöting N, Savchuk I, Eifler L, Kulle A, Kralisch-Jäcklein S, Dötsch J, Hiort O, Svechnikov K, Söder O (2021) Diabetes type 1 negatively influences Leydig cell function in rats, which is partially reversible by insulin treatment. Endocrinology 162(4): bqab017. https://doi.org/10.1210/endocr/bqab017
Barsiah S, Behnam-Rassouli M, Shahabipour F, Rostami S, Sabbaghi MA, Momeni Z, Tavassoli A, Sahebkar A (2019) Evaluation of testis hormonal and histopathological alterations in type I and type II diabetic rats. J Cell Biochem 120(10): 16775–16785. https://doi.org/10.1002/jcb.28936
Keyhanmanesh R, Hamidian G, Alipour MR, Oghbaei H (2019) Beneficial treatment effects of dietary nitrate supplementation on testicular injury in streptozotocin-induced diabetic male rats. Reprod Biomed Online 39(3): 357–371. https://doi.org/10.1016/j.rbmo.2018.11.027
Veldhuis JD, Liu PY, Takahashi PY, Keenan DM (2012) Dynamic testosterone responses to near-physiological LH pulses are determined by the time pattern of prior intravenous LH infusion. Am J Physiol Endocrinol Metab 303: 720–728. https://doi.org/10.1152/ajpendo.00200.2012
van Koppen CJ, Zaman GJ, Timmers CM, Kelder J, Mosselman S, van de Lagemaat R, Smit MJ, Hanssen RG (2008) A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch Pharmacol 378(5): 503–514. https://doi.org/10.1007/s00210-008-0318-3
Derkach KV, Dar’in DV, Bakhtyukov AA, Lobanov PS, Shpakov AO (2016) In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Mosc) Suppl Ser A: Membr Cell Biol 10(4): 294–300. https://doi.org/10.1134/S1990747816030132
Bakhtyukov AA, Derkach KV, Stepochkina AM, Shpakov AO, Dar’in DV (2019) A low molecular weight agonist of the luteinizing hormone receptor stimulates adenylyl cyclase in the testicular membranes and steroidogenesis in the testes of rats with type 1 diabetes. Biochemistry (Mosc) Suppl Ser A: Membr Cell Biol 13(4): 301–309. https://doi.org/10.1134/S1990747819040032
Bakhtyukov AA, Derkach KV, Gureev MA, Dar’in DV, Sorokoumov VN, Romanova IV, Morina IY, Stepochkina AM, Shpakov AO (2020) Comparative study of the steroidogenic effects of human chorionic gonadotropin and thieno[2,3-D]pyrimidine-based allosteric agonist of luteinizing hormone receptor in young adult, aging and diabetic male rats. Int J Mol Sci 21(20): 7493. https://doi.org/10.3390/ijms21207493
Bakhtyukov AA, Derkach KV, Sorokoumov VN, Stepochkina AM, Romanova IV, Morina IY, Zakharova IO, Bayunova LV, Shpakov AO (2022) The effects of separate and combined treatment of male rats with type 2 diabetes with metformin and orthosteric and allosteric agonists of luteinizing hormone receptor on steroidogenesis and spermatogenesis. Int J Mol Sci 23(1): 198. https://doi.org/10.3390/ijms23010198
Newton CL, Whay AM, McArdle CA, Zhang M, van Koppen CJ, van de Lagemaat R, Segaloff DL, Millar RP (2011) Rescue of expression and signaling of human luteinizing hormone G protein-coupled receptor mutants with an allosterically binding small-molecule agonist. Proc Natl Acad Sci U S A 108(17): 7172–7176. https://doi.org/10.1073/pnas.1015723108
Mardanshahi T, Rezaei N, Zare Z, Malekzadeh Shafaroudi M, Mohammadi H (2018) Effects of L-Carnitine on the sperm parameters disorders, apoptosis of spermatogenic cells and testis histopathology in diabetic Rats. Int J Reprod Biomed 17(5): 325–336. https://doi.org/10.18502/ijrm.v17i5.4600
Pourheydar B, Azarm F, Farjah G, Karimipour M, Pourheydar M (2022) Effect of silymarin and metformin on the sperm parameters and histopathological changes of testes in diabetic rats: An experimental study. Int J Reprod Biomed 19(12): 1091–1104.https://doi.org/10.18502/ijrm.v19i12.10060
Omolaoye TS, Skosana BT, du Plessis SS (2018) Diabetes mellitus- induction: Effect of different streptozotocin doses on male reproductive parameters. Acta Histochem 120(2): 103–109.https://doi.org/10.1016/j.acthis.2017.12.005
He Z, Yin G, Li QQ, Zeng Q, Duan J (2021) Diabetes mellitus causes male reproductive dysfunction: a review of the evidence and mechanisms. In Vivo 35(5): 2503–2511. https://doi.org/10.21873/invivo.12531
Shoorei H, Khaki A, Shokoohi M, Khaki AA, Alihemmati A, Moghimian M, Abtahi-Eivary SH (2020) Evaluation of carvacrol on pituitary and sexual hormones and their receptors in the testicle of male diabetic rats. Hum Exp Toxicol 39(8): 1019–1030. https://doi.org/10.1177/0960327120909525
Dombroski BA, Nayak RR, Ewens KG, Ankener W, Cheung VG, Spielman RS (2010) Gene expression and genetic variation in response to endoplasmic reticulum stress in human cells. Am J Hum Genet 86(5): 719–729. https://doi.org/10.1016/j.ajhg.2010.03.017
Shiraishi K, Matsuyama H (2017) Gonadotoropin actions on spermatogenesis and hormonal therapies for spermatogenic disorders [Review]. Endocr J 64(2): 123–131. https://doi.org/10.1507/endocrj.EJ17-0001
Fink J, Schoenfeld BJ, Hackney AC, Maekawa T, Horie S (2021) Human chorionic gonadotropin treatment: a viable option for management of secondary hypogonadism and male infertility. Expert Rev Endocrinol Metab 16(1): 1–8. https://doi.org/10.1080/17446651.2021.1863783
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


