Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1188-1199
Механизм влияния тестостерона на белок-транспортер Р-гликопротеин
А. А. Слепнев 1, А. В. Щулькин 1, Ю. В. Абаленихина 1, *, Н. М. Попова 1, И. В. Черных 1, Е. Н. Якушева 1
1 Рязанский государственный медицинский университет им. акад. И.П. Павлова Минздрава России
Рязань, Россия
* E-mail: abalenihina88@mail.ru
Поступила в редакцию 01.07.2022
После доработки 12.08.2022
Принята к публикации 15.08.2022
- EDN: ACNELM
- DOI: 10.31857/S0869813922090059
Аннотация
Р-гликопротеин (Pgp) – эффлюксный мембранный белок-транспортер, играющий важную роль в фармакокинетике лекарственных веществ. Известно, что тестостерон может снижать активность и количество Pgp, однако механизмы его действия остаются неизученными. Цель исследования – изучить механизмы влияния тестостерона на функционирование Рgp, в частности оценить роль андрогенного (AR), прегнан Х (PXR) и конститутивного андростанового рецепторов (CAR) в данном процессе in vitro и in vivo. In vitro на клетках линии Caco-2 воздействие тестостерона (1 и 10 мкМ) в течение 24 ч снижало количество Pgp (метод вестерн-блот) по сравнению с контролем. Ингибитор PXR – кетоконазол (1 и 10 мкМ, экспозиция 24 ч) не влиял на количество Pgp, а ингибитор CAR – CINPA в концентрации 10 мкМ уменьшал содержание Pgp. Комбинация CINPA 10 мкМ и тестостерона 10 мкМ также снижала содержание Pgp, однако количество транспортера достоверно не отличалось от показателей групп изолированного применения тестостерона и CINPA. In vivo на кроликах-самцах породы Шиншилла показано, что однократное внутримышечное введение тестостерона ундеканоата в дозе 24 мг/кг массы повышало уровень тестостерона в сыворотке крови на 21-е сутки исследования по сравнению с контролем, а после выполнения орхиэктомии его содержание на 21-е сутки снижалось. Относительное количество Pgp и CAR в тощей кишке кроликов при введении тестостерона уменьшалось, а после выполнения орхиэктомии – увеличивалось. Количество PXR и AR в тощей кишке кроликов в указанных группах статистически значимо не изменялось. Таким образом, в опытах in vitro и in vivo показано, что тестостерон снижает количество белка-транспортера Pgp, ингибируя CAR.
Р-гликопротеин (Pgp, АВСВ1), белок суперсемейства АВС-транспортеров, который экспрессируется в цитоплазматических мембранах и препятствует проникновению своих субстратов внутрь клеток, выводя их в межклеточное пространство и биологические жидкости [1]. Доказана локализация Pgp в энтероцитах кишечника, гепатоцитах, эпителии почечных канальцев, эндотелии гистогематических барьеров, эндокринных и опухолевых клетках. При этом максимальная экспрессия гена MDR1, кодирующего данный белок, обнаружена в надпочечниках и тонком кишечнике [2]. Исходя из данной локализации, принято считать, что основными функциями Pgp являются транспорт эндогенных веществ (стероидные, тиреоидные гормоны), развитие резистентности опухолей к химиотерапевтическим агентам (за счет их эффлюкса из опухолевых клеток) и участие в фармакокинетике (всасывании, распределении и выведении) лекарственных веществ [3].
Показано, что активность Pgp может изменяться под действием ряда веществ и факторов внешней и внутренней среды. Так, гипокcия [4], окислительный стресс [5], рифампицин [6] повышают активность транспортера, а прогестерон [7], кетоконазол и амиодарон [6] ее снижают. Регуляция активности Pgp имеет важное практическое значение. Ингибиторы синтеза и активности транспортера могут использоваться в комплексной терапии онкологических заболеваний (подавление функционирования Pgp повышает проникновение цитостатиков внутрь клеток) [8], а изучение влияния лекарственных веществ на активность Pgp важно для прогнозирования межлекарственных взаимодействий. Ингибирование транспортера в клетках кишечника, печени и почек может привести к повышению в крови концентрации его субстратов и развитию побочных эффектов фармакотерапии (посредством повышения всасывания и замедления выведения), а повышение активности Pgp в данных органах – наоборот, к уменьшению уровня субстратов и снижению эффективности лечения (путем снижения всасывания и ускорения выведения) [3]. Наибольшее клиническое значение имеют субстраты Pgp антикоагулянты – дабигатрана этексилат, ривароксабан, изменение концентрации которых в плазме крови может привести к кровотечению или к развитию тромбозов соответственно [6]. Поэтому актуальным является тестирование принадлежности лекарственных и биологически активных веществ к субстратам, индукторам и ингибиторам Pgp.
В ряде исследований было показано, что тестостерон может влиять на активность и количество Pgp. В эксперименте на роговицах новозеландских кроликов было установлено, что тестостерон в концентрациях 100 и 150 мкМ не влиял на опосредованный Рgp транспорт эритромицина через роговицу, однако в концентрациях 250 и 500 мкМ ингибировал активность белка-транспортера, при этом IC50 (концентрация, ингибирующая активность Pgp на 50%) составила 241 ± 27.6 мкМ [9]. В эксперименте на культуре клеток 2780AD (карцинома яичника человека, вариант, резистентный к лекарственной терапии) показано, что тестостерон в концентрациях 50–150 мкМ ингибировал активность Pgp, оцениваемую по эффлюксу субстрата белка-транспортера – даунорубицина [10]. В исследовании на линии клеток VBL-resistant cell lines, J7.Vl-1 выявлено, что тестостерон в концентрации 50 мкМ уменьшал содержание белка-транспортера в мембранах микросом на 45% [11]. В опытах на изолированных участках двенадцатиперстной, тощей и подвздошной кишок крыс установлено, что тестостерон в концентрации 20 мкМ повышал всасывание субстрата Pgp – винбластина в двенадцатиперстной и тощей кишках, что свидетельствует о его способности ингибировать белок-транспортер [12]. В эксперименте на самках крыс линии Sprague-Dawley было показано, что введение им тестостерона в дозе 10 мг/день в течение 7 дней приводило к снижению экспрессии (вестерн-блот) и активности Pgp, оцениваемой по билиарному клиренсу доксорубицина до показателей самцов [13]. На кроликах породы Шиншилла нами было показано, что введение тестостерона вызывало уменьшение количества и активности Pgp в тонком кишечнике, а орхиэктомия, наоборот, повышала количество и активность транспортера [14, 15].
Таким образом, в большинстве исследований доказано, что тестостерон снижает активность и количество Pgp. Однако механизмы выявленных изменений на данный момент не известны. Цель исследования – изучить механизмы влияния тестостерона на функционирование белка-транспортера Рgp, в частности оценить роль андрогенного, прегнан Х и конститутивного андростанового рецепторов в данном процессе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры выполнены с участием животных и соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации. Протокол исследования был рассмотрен и утвержден на заседании биоэтической комиссии Рязанского государственного медицинского университета Минздрава России № 12 от 08.04.16 г.
Исследование выполнено in vitro и in vivo. Для экспериментов in vitro использовалась линия клеток аденокарциномы ободочной кишки человека (Caco-2) (ЦКП “Коллекция культур клеток позвоночных”, Санкт-Петербург, Россия). Клетки культивировали при 37°С и 5%-ном содержании СО2 в инкубаторе WS-189C (“World Science”, Корея) в среде Игла, модифицированной Дульбекко (DMEM), с высоким содержанием глюкозы (4.5 г/л) (“Sigma-Aldrich”, Германия), с добавлением L-глутамина (4 мМ) (“Sigma-Aldrich”, Германия), 15% эмбриональной бычьей сыворотки (“Sigma-Aldrich”, Германия), 100 ЕД/мл и 100 мкг/мл пенициллина и стрептомицина (“Sigma-Aldrich”, Германия) соответственно. Для определения количества Pgp клетки культивировали в 6-луночных планшетах в течение 21 сут, поскольку при данном сроке происходит их спонтанная дифференцировка в энтероцитоподобные клетки, гиперэкспрессирующие Pgp [16].
В ходе исследования in vitro было сформировано пять экспериментальных групп. При выполнении каждого эксперимента было выполнено по 3 повторения (n = 3). Первая группа – контроль, представлена клетками линии Сасо-2, которые инкубировали в питательной среде без добавления тестируемых веществ (n = 3). Вторая группа – оценка влияния тестостерона на количество Pgp, включала клетки линии Сасо-2, которые инкубировали с тестостероном в концентрациях 1 и 10 мкМ в течение 24 ч (n = 3). Третья группа – изучение влияния ингибирования прегнан Х рецептора (PXR) на количество Pgp, представляла собой клетки линии Caco-2, которые инкубировали с кетоконазолом (ингибитор PXR, “Sigma Aldrich”, Германия) в концентрациях 1 и 10 мкМ в течение 24 ч (n = 3) [17]. Четвертая группа – исследование влияния ингибирования конститутивного андростанового рецептора (CAR) на количество Pgp – клетки линии Caco-2 инкубировали с 5-[(Диэтиламино)ацетил]-10,11-дигидро-5Н-дибензо[b,f]азепин-3-[ил]этиловым эфиром карбаминовой кислоты (CINPA 1, ингибитор CAR, “Tocris”, Великобритания) в концентрациях 1 и 10 мкМ в течение 24 ч (n = 3) [18]. Выбор данного ингибитора обусловлен его селективностью по отношению к CAR и отсутствием влияния на PXR, например, в отличие от другого ингибитора 1-(2-хлорофенил)-N-метил-N-(1-метилпропил)-3-изохинолинкарбоксамида (PK11195). Пятая группа – оценка влияния комбинации 10 мкМ CINPA и 10 мкМ тестостерона при длительности инкубации 24 ч на количество Pgp (n = 3).
После окончания экспозиции клетки снимали с лунок раствором трипсин-ЭДТА (“Sigma-Aldrich”, Германия), трижды промывали раствором фосфатного буфера (“BioRad”, США) и лизировали в NP40 Cell Lysis Buffer Thermo (“Thermo Fisher Scientific”, США) c добавлением смеси ингибиторов протеиназ (“Sigma-Aldrich”, Германия) в течение 30 мин при 4°С и постоянном перемешивании из расчета 107 клеток на 100 мкл буфера. Полученный лизат центрифугировали при 22 440 g в течение 10 мин (“AvantiJXN-3”, “BeckmanCoulter”, США). Супернатант использовали для анализа.
Исследование in vivo выполнено на кроликах-самцах породы Шиншилла, массой 3000–3500 г, в возрасте 7–10 мес. Выбор вида животных обусловлен наибольшей схожестью механизмов регуляции Pgp у человека и кроликов [19, 20]. Все животные были разделены на 4 экспериментальные группы. Первая группа (контроль 1) – интактные кролики, которым внутримышечно вводили физиологический раствор в объеме, эквивалентном объему раствора тестостерона, и через 21 сутки выводили из эксперимента (n = 5). Вторая группа – кролики, которым однократно внутримышечно вводили тестостерона ундеканоат (раствор для внутримышечного введения “Небидо” 250 мг/мл (“Bayer Pharma AG”, Германия) в дозе 24 мг/кг массы [21] и выводили из эксперимента на 21-е сутки (n = 5). Третья группа (контроль 2) – интактные кролики, которым выполняли “ложную” операцию и через 21 сутки выводили из эксперимента (n = 5). Четвертая группа – кролики, которым выполняли орхиэктомию и выводили из эксперимента на 21-е сутки после операции (n = 5). Длительность наблюдения и доза тестостерона ундеканоата выбраны на основе ранее полученных результатов об изменении активности и количества Pgp при повышении и снижении уровня тестостерона [14, 15].
Оперативные вмешательства проводили в условиях операционной вивария Рязанского государственного медицинского университета с соблюдением методов асептики и антисептики под наркозом, который осуществляли в/м введением ксилазина гидрохлорида (“Рометар”, “СПОФА”, Чехия) в дозе 4.0–6.0 мг/кг массы и золетила-50 (“Virbac”, Франция) в дозе 5–10 мг/кг массы [22]. У всех животных перед выведением из эксперимента из ушной вены забиралась кровь и в сыворотке определяли концентрацию тестостерона радиоиммунным методом с использованием тест-систем “IMMUNOTECH” (Чехия). Концентрацию тестостерона выражали в нмоль/л.
При завершении эксперимента животных каждой серии выводили из него передозировкой золетила (“Золетил 100”, “Virbac C.A.”, Франция) в дозе 30 мг/кг массы. Для исследования забирали образец тощей кишки. Полученные образцы измельчали и гомогенизировали в NP40 Cell Lysis Buffer Thermo (“Thermo Fisher Scientific”, США) c добавлением смеси ингибиторов протеиназ (“Sigma-Aldrich”, Германия) с помощью гомогенизатора Поттера (16–20 ударов) в соотношении масса ткани (мг) : объем буфера (мл) 1 : 1, а затем инкубировали в течение 3 ч при 4°С и постоянном перемешивании. Полученный гомогенат центрифугировали при 22 440 g в течение 10 мин (“AvantiJXN-3”, “BeckmanCoulter”, США). Супернатант использовали для анализа.
В полученных лизатах и гомогенатах методом вестерн-блот оценивали относительное количество Pgp, CAR, PXR и андрогенного рецептора (АR). Для этого белки (30 мкг, количество белка анализировали методом Брэдфорда) подвергали электрофорезу с использованием TGX Stain-Free FastCast Acrylamide Kit (“Bio-Rad”) в буферной системе Laemmli (“BioRad”). Перед загрузкой образцы обрабатывали в соответствии с протоколом Bio-Rad. Их смешивали с буфером для образцов Laemmli (“Bio-Rad”), содержащем 2.5% 2-меркаптоэтанола (“Bio-Rad”) в соотношении 1 : 3, инкубировали 5 мин при температуре 70°C. Гели прогоняли при 100 В в течение 90 мин. Для определения относительного количества Pgp, CAR, PXR и AR методом вестерн-блот использовали первичные мышиные моноклональные антитела P-Glycoprotein Antibody MA5-13854 (“Invitrogen”, США), MB67 CAR Monoclonal Antibody (“Invitrogen”, США), MA5-31808 PXR Monoclonal Antibody (1D12G1) (“Invitrogen”), США, Anti-Androgen Receptor antibody [DHTR/882] (“Abcam”, США) в разведении 1 : 200. Визуализацию первичных антител осуществляли с использованием вторичных кроличьих антител (Rabbit anti-Mouse IgG (H + L) Secondary Antibody, HRP, “Invitrogen”, США) в разведении 1 : 4000. Белки визуализировали хемилюминесценцией с помощью Chemi Doc XRS+ (“Bio-Rad”, США). Молекулярная масса белков была подтверждена путем сравнения с маркерами молекулярной массы (Precision plus protein standards Dual Color, “Bio-Rad”, США). Интенсивность полученных полос (бэндов) анализировали денситометрически с помощью программного обеспечения ImageLab (“Bio-Rad”, США). Количество Pgp, CAR, PXR, АR оценивали относительно содержания белка домашнего хозяйства GAPDH (первичные GAPDH Loading Control Monoclonal Antibody (GA1R), DyLight 68, “Invitrogen”, США, разведение 1 : 1000, вторичные антитела – вторичные кроличьи антитела к первичным антителам GAPDH – Rabbitanti-Mouse IgG (H + L) Secondary Antibody, HRP, “Invitrogen”, США, разведение 1 : 4000).
Полученные результаты анализировали с помощью программы GgraphPadPrism 8. Характер распределения данных оценивали с помощью критерия Шапиро–Уилка. Учитывая, что данные имели нормальное распределение, для оценки статистической значимости различий использовали дисперсионный анализ (ANOVA) для несвязанных выборок, попарные сравнения выполняли с помощью критерия Фишера. Статистически значимыми считали различия при p < 0.05. Результаты представлены в виде M ± SD.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Воздействие тестостерона на клетки линии Caco-2 в течение 24 ч приводило к снижению количества Pgp в концентрации 1 мкМ на 32.4% (р < 0.0001), 10 мкМ на 42.9% (р < 0.0001) по сравнению с контролем (рис. 1). В то же время уровень CAR и PXR достоверно не изменялся, а АR практически не детектировался (рис. 1).
Рис. 1.
Относительное количество гликопротеина-Р (Pgp, 1), конститутивного андростанового рецептора (CAR, 2), прегнан-Х-рецептора (PXR, 3), андрогенного рецептора (АR) в клетках линии Сасо-2 при воздействии тестостерона в концентрациях 1 и 10 мкМ в течение 24 ч (M ± SD, n = 3). ****p < 0.0001 по сравнению с контролем (C) (критерий Фишера).

Специфические ингибиторы CAR и PXR оказывали следующее влияние на уровень Pgp. Ингибитор PXR – кетоконазол в концентрациях 1 и 10 мкМ и экспозиции 24 ч не влиял на количество Pgp, а ингибитор CAR – CINPA в концентрации 10 мкМ снижал содержание Pgp на 37.6% (р < 0.0001) по сравнению с контролем (рис. 2).
Рис. 2.
Относительное количество гликопротеина-Р (Pgp) в клетках линии Сасо-2 в контроле (1), при воздействии CINPA 1 мкМ (2) и 10 мкМ (3), сочетанном применении тестостерона 10 мкМ и CINPA 10 мкМ (4), при инкубации с кетоконазолом 1 мкМ (5) и 10 мкМ (6) в течение 24 ч (M ± SD, n = 3). ****p < < 0.0001 по сравнению с контролем (критерий Фишера).
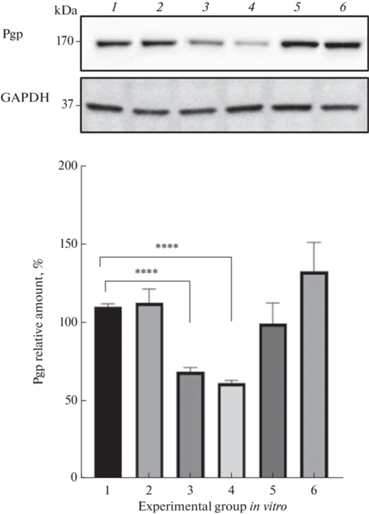
Комбинация 10 мкМ CINPA и 10 мкМ тестостерона также снижала содержание Pgp в клетках линии Caco-2 по сравнению с показателями контроля на 44.3% (р < 0.0001), однако количество транспортера достоверно не отличалось от показателей групп изолированного применения тестостерона и CINPA (рис. 2).
Рис. 3.
Концентрация тестостерона в сыворотке крови кроликов-самцов при внутримышечном введении физиологического раствора (1), при внутримышечном введении тестостерона ундеканоата в дозе 24 мг/кг массы (2), при проведении “ложной” операции (3), при орхиэктомии (4) на 21-е сутки (M ± SD, n = 5). *p ≤ 0.01; **p ≤ 0.001 по сравнению с соответствующим контролем (критерий Фишера).

В эксперименте in vivo установлено, что внутримышечное введение тестостерона ундеканоата кроликам в дозе 24 мг/кг массы приводило к повышению уровня тестостерона в сыворотке крови на 21-е сутки исследования на 166.7% (p = 0.001) по сравнению с контролем 1. После выполнения орхиэктомии содержание тестостерона в сыворотке крови на 21-е сутки снижалось на 92.9% (р = 0.012) относительно контроля 2 (рис. 3).
Относительное количество Pgp в тощей кишке кроликов при введении тестостерона ундеканоата снижалось на 35.5% (р < 0.001), а при выполнении орхиэктомии – увеличивалось на 50.9% (р < 0.01) (рис. 4а). Содержание CAR в тощей кишке при использовании тестостерона ундеканоата снижалось на 30.4% (р < 0.001), а при выполнении орхиэктомии увеличивалось на 100% (р < 0.0001) (рис. 4b).
Рис. 4.
Относительное количество гликопротеина-Р (Pgp) (а), конститутивного андростанового рецептора (CAR) (b) в тощей кишке кроликов-самцов при внутримышечном введении физиологического раствора (1), при внутримышечном введении тестостерона ундеканоата в дозе 24 мг/кг массы (2), при проведении “ложной” операции (3), при орхиэктомии (4) на 21-е сутки (M ± SD, n = 5). ** p < 0.01; ***p < 0.001; **** р < 0.0001 по сравнению с соответствующим контролем (критерий Фишера).

Количество PXR в тощей кишке кроликов оставалось на уровне контроля при изменении сывороточной концентрации тестостерона. АR детектировался в следовых количествах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Pgp (ABCB1) – самый изученный белок-транспортер из суперсемейства АВС-транспортеров. Он играет важную роль в феномене резистентности опухолей к цитостатикам, удаляя их из клеток в межклеточное пространство, а также обеспечивает транспорт экзогенных и эндогенных веществ [3, 8]. Механизмы регуляции Pgp активно изучаются с целью разработки подходов к преодолению множественной лекарственной устойчивости опухолей, а также для улучшения доставки фармакологических активных веществ и прогнозирования развития фармакокинетических межлекарственных взаимодействий.
На данный момент выделяют следующие механизмы регуляции Pgp [23]: изменение экспрессии гена MDR1 посредством влияния на его промотор; полиморфизм гена MDR1; увеличение дозы гена – амплификация участка генома, содержащего ген MDR1; стабилизация мРНК гена MDR1; влияние микроРНК на экспрессию Pgp; передача Pgp между клетками; изменение активности синтезированного белка-транспортера; влияние на гидролиз АТФ; изменение свойств цитоплазматических мембран. В ряде работ было показано, что тестостерон обладает способностью ингибировать активность Pgp без влияния на его количество. Согласно другим данным, тестостерон снижает и количество изучаемого белка-транспортера [9, 10, 14, 15].
В настоящем исследовании на клетках линии Caco-2 при воздействии тестостерона в концентрациях 1 и 10 мкМ и инкубации 24 ч, а также на кроликах-самцах породы Шиншилла при внутримышечном введении тестостерона ундеканоата в дозе 24 мг/кг массы в тощей кишке было подтверждено снижение количества Pgp. Для изучения механизмов влияния тестостерона на уровень Pgp было оценено количество АR, PXR и CAR. PXR и CAR являются членами суперсемейства ядерных рецепторов. Показано, что они стимулируют экспрессию генов, которые кодируют белки, участвующие в метаболизме и элиминации ксенобиотиков, таких как цитохромы P450, глюкуронозилтрансферазы, сульфотрансферазы и белки множественной лекарственной устойчивости [24, 25]. В опытах in vitro уровень CAR и PXR при воздействии тестостерона достоверно не изменялся, а АR практически не детектировался. Известно, что индукторы/ингибиторы CAR и PXR могут влиять на данные транскрипционные факторы без изменения их количества [26, 27]. То есть тестостерон теоретически может влиять на Pgp через ингибирование CAR и PXR. Для проверки данной гипотезы на клетках линии Caco-2 были выполнены эксперименты с использованием прямых ингибиторов CAR и PXR. В ходе исследования было выявлено, что ингибитор CAR – CINPA в концентрации 10 мкМ снижал количество Pgp, при этом комбинация CINPA и тестостерона также вызывала снижение уровня белка-транспортера, причем на том же уровне, что и изолированное применение ингибитора CAR. Ингибирование PXR не оказывало достоверного влияния на уровень Pgp, это свидетельствует о том, что указанный рецептор не играет существенной роли в реализации влияния тестостерона на количество белка-транспортера.
В экспериментах in vivo снижение уровня тестостерона в сыворотке крови, вызванное орхиэктомией, сопровождалось повышением количества Pgp и CAR в тощей кишке. И наоборот, повышение концентрации тестостерона в сыворотке крови, вызванное внутримышечным введением тестостерона ундеканоата в дозе 24 мг/кг вызывало снижение количества белка-транспортера и CAR.
Как и в культуре клеток Caco-2, в тощей кишке кроликов АR практически не детектировался, а концентрация PXR достоверно не изменялась в ходе эксперимента. Полученные данные in vitro и in vivo в совокупности свидетельствуют о том, что тестостерон оказывает влияние на уровень Pgp в энтероцитах, скорее всего, через CAR. Полученные результаты косвенно подтверждаются данными литературы. Так, на культурах клеток g2car-3 и HepG2 показано, что андростанол, андростенол, тестостерон и андростендион (1–10 мкМ) подавляли активность CAR [28, 29]. В исследованиях на мышах выявлено, что орхиэктомия приводила к повышению синтеза CAR [29]. В то же время в исследовании на клетках линии hCMEC/D3 установлено, что ингибирование не только CAR, но и PXR уменьшало экспрессию Pgp [30].
Отсутствие значения PXR в регуляции Pgp, выявленное в нашем исследовании, может быть связано с разными линиями клеток, использованными в экспериментах. Механизм влияния андрогенов на CAR окончательно не установлен. Предполагается, что андростанол и андростенол ингибируют CAR, способствуя высвобождению коактиватора из лиганд-связывающего домена рецептора [28]. Ограничением исследования является то, что роль CAR в регуляции Pgp in vivo была доказана лишь косвенно, по анализу уровня орфанного рецептора при изменении уровня тестостерона. Для подтверждения полученных данных требуются дальнейшие исследования, в частности эксперименты на животных с нокаутом CAR.
Таким образом, in vitro на клетках линии Caco-2 и in vivo на кроликах показано, что тестостерон снижает количество белка-транспортера Pgp, ингибируя конститутивный андростановый рецептор. Полученные результаты можно рассматривать как способ преодоления множественной лекарственной устойчивости опухолевых клеток, обусловленной гиперэкспрессией данного белка-транспортера, а конститутивный андростановый рецептор – как возможную фармакологическую мишень для реализации этой цели.
Список литературы
Mollazadeh S, Sahebkar A, Hadizadeh F, Behravan J, Arabzadeh S (2018) Structural and functional aspects of P-glycoprotein and its inhibitors. Life Sci 214: 118–123. https://doi.org/10.1016/j.lfs.2018.10.048
Chin KV, Liu B (1994) Regulation of the multidrug resistance (MDR1) gene expression (Review). In Vivo 8(5): 835–841.
Gessner A, König J, Fromm MF (2019) Clinical Aspects of Transporter-Mediated Drug-Drug Interactions. Clin Pharmacol Ther 105(6): 1386–1394. https://doi.org/10.1002/cpt.1360
Zhang J, Zhang M, Zhang J, Wang R (2020) Enhanced P-glycoprotein expression under high-altitude hypoxia contributes to increased phenytoin levels and reduced clearance in rats. Eur J Pharm Sci 1(153): 105490. https://doi.org/10.1016/j.ejps.2020.105490
Shchulkin AV, Abalenikhina YV, Erokhina PD, Chernykh IV, Yakusheva EN (2021) The Role of P-Glycoprotein in Decreasing Cell Membranes Permeability during Oxidative Stress. Biochemistry (Mosc) 86(2): 197–206. https://doi.org/10.1134/S0006297921020085
Щулькин АВ, Якушева ЕН, Попова НМ (2013) Роль гликопротеина-Р в рациональной фармакотерапии в кардиологии. Рацион фармакотер в кардиол 9(6): 701–707. [Shchulkin AV, Yakusheva EN, Popova NM (2013) The role of glycoprotein-P in rational pharmacotherapy in cardiology. Rational Pharmacother Cardiol 9(6): 701–707. (In Russ)]. https://doi.org/10.20996/1819-6446-2013-9-6-701-707
Ерохина ПД, Абаленихина ЮВ, Щулькин АВ, Черных ИВ, Попова НМ, Слепнев АА, Якушева ЕН (2020) Изучение влияния прогестерона на активность гликопротеина-Р in vitro. Рос мед-биол вестн им акад ИП Павлова 28 (2): 135–142 [Erokhina PD, Abalenikhina YuV, Shchulkin AV, Chernykh IV, Popova NM, Slepnev AA, Yakusheva EN (2020) A study of influence of progesterone on activity of glycoprotein-P in vitro. IPPavlov Rus Med Biol Herald 28(2): 135–142. (In Russ)]. https://doi.org/10.23888/PAVLOVJ2020282135-142
Zhang H, Xu H, Ashby ChR, Assaraf YG, Chen Zh, Liu H (2021) Chemical molecular-based approach to overcome multidrug resistance in cancer by targeting P-glycoprotein (P-gp). Med Res Rev 41 (1): 525–555. https://doi.org/10.1002/med.21739
Dey S, Gunda S, Mitra AK (2004) Pharmacokinetics of erythromycin in rabbit corneas after single-dose infusion: role of P-glycoprotein as a barrier to in vivo ocular drug absorption. J Pharmacol Exp Therap311 (1): 246–255. https://doi.org/10.1124/jpet.104.069583
Van Kalken CK, Broxterman HJ, Pinedo HM, Feller N, Dekker H, Lankelma J, Giaccone G (1993) Cortisol is transported by the multidrug resistance gene product P-glycoprotein. Br J Cancer 67(2): 284–289. https://doi.org/10.1038/bjc.1993.54
Yang CP, DePinho SG, Greenberger LM, Arceci RJ, Horwitz SB (1989) Progesterone interacts with P-glycoprotein in multidrug-resistant cells and in the endometrium of gravid uterus J Biol Chem 264: 782–788.
Nakayama A, Eguchi O, Hatakeyama M, Saitoh H, Takada M (1999) Different absorption behaviors among steroid hormones due to possible interaction with P-glycoprotein in the rat small intestine. Biol Pharm Bull 22: 535–538. https://doi.org/10.1248/bpb.22.535
Suzuki T, Zhao YL, Nadai M, Naruhashi K, Shimizu A, Takagi K, Takagi K, Hasegawa T (2006) Gender-related differences in expression and function of hepatic P-glycoprotein and multidrug resistance-associated protein (Mrp2) in rats. Life Sci 79(5): 455–461. https://doi.org/10.1016/j.lfs.2006.01.024
Shchulkin AV, Yakusheva EN, Chernykh IV, Nikiforov AA (2017) The role of testosterone in the regulation of P-glycoprotein functioning. Biol Bull 44: 524–530. https://doi.org/10.1134/S1062359017050168
Shchul’kin AV, Yakusheva EN, Chernykh IV, Nikiforov AA, Popova NM (2017) Effects of testosterone on the functional activity of P-glycoprotein. Pharm Chem J 51(9): 743–747. https://doi.org/10.1007/s11094-017-1685-1
Hilgers AR, Conradi RA, Burton PS (1990) Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa. Pharmac Res 7 (9): 902–910. https://doi.org/10.1023/a:1015937605100
Fuchs I, Hafner-Blumenstiel V, Markert C, Burhenne J, Weiss J, Haefeli W E, Mikus G (2013) Effect of the CYP3A inhibitor ketoconazole on the PXR-mediated induction of CYP3A activity. Eur J Clin Pharmacol 69 (3): 507–513. https://doi.org/10.1007/s00228-012-1388-1
Cherian MT, Lin W, Wu J, Chen T (2015) CINPA1 is an inhibitor of constitutive androstane receptor that does not activate pregnane X receptor. Mol Pharmacol 87 (5): 878–889. https://doi.org/10.1124/mol.115.097782
Moore LB, Maglich JM, McKee DD, Wisely B, Willson TM, Kliewer SA, Lambert MH, Moore JT (2002) Pregnane X receptor (PXR), constitutive androstane receptor (CAR), and benzoate X receptor (BXR) define three pharmacologically distinct classes of nuclear receptors. Mol Endocrin 16 (5): 977–986.https://doi.org/10.1210/mend.16.5.0828
Гацанога МВ, Черных ИВ, Щулькин АВ, Якушева ЕН, Попова НМ (2016). Можно ли оценивать принадлежность лекарственных веществ к субстратам гликопротеина-Р на самках кроликов породы шиншилла. Наука молодых (Eruditio Juvenium) 3: 5–10. [Gaczanoga MV, Cherny`x IV, Shhul`kin AV, Yakusheva EN, Popova NM (2016). Is it possible to assess the affiliation of medicinal substances to glycoprotein-P substrates on female chinchilla rabbits? Nauka molody`x (Eruditio Juvenium) 3: 5–10. (In Russ)].
Zhao C, Moon DG, Park JK (2013) Effect of testosterone undecanoate on hematological profiles, blood lipid and viscosity and plasma testosterone level in castrated rabbits. Can Urol Assoc J 7(3–4): 221–225. https://doi.org/10.5489/cuaj.507
Разина АВ, Фролова АИ, Сергеев МА (2010) Оптимизация общей анестезии на кроликах. Актуальн вопр ветерин и биол 1: 32–35. [Razina AV, Frolova AI, Sergeev MA (2010) Optimizaciya obshhej anestezii na krolikax. Akt Vopr Veterinarii i Biol 1: 32–35. (In Russ)].
Якушева ЕН, Черных ИВ, Щулькин АВ, Попова НМ (2014) Гликопротеин-Р: структура, физиологическая роль и молекулярные механизмы модуляции функциональной активности. Успехи физиол наук 45(4): 89–98. [Yakusheva EN, Cherny`x IV, Shhul`kin AV, Popova NM (2014) Glikoprotein-Р: struktura, fiziologicheskaya rol` i molekulyarny`e mexanizmy` modulyacii funkcional`noj aktivnosti. Uspexi fiziol nauk 45(4): 89–98. (In Russ)]
Buchman CD, Chai SC, Chen TA (2018) Current structural perspective on PXR and CAR in drug metabolism. Exp Opin Drug Metab Toxicol 14(6): 635–647. https://doi.org/10.1080/17425255.2018.1476488
Burk O, Kuzikov M, Kronenberger T, Jeske J, Keminer O, Thasler WE, Schwab M, Wrenger C, Windshugel B (2018) Identification of approved drugs as potent inhibitors of pregnane X receptor activation with differential receptor interaction profiles. Arch Toxicol 92(4): 1435–1451. https://doi.org/10.1007/s00204-018-2165-4
Rigalli JP, Ruiz ML, Perdomo VG, Villanueva SS, Mottino AD, Catania VA (2011) Pregnane X receptor mediates the induction of P-glycoprotein by spironolactone in HepG2 cells. Toxicology 285(1-2): 18–24. https://doi.org/10.1016/j.tox.2011.03.015
Slosky LM, Thompson BJ, Sanchez-Covarrubias L, Zhang Y, Laracuente ML, Vanderah TW, Ronaldson PT, Davis TP (2013) Acetaminophen modulates P-glycoprotein functional expression at the blood-brain barrier by a constitutive androstane receptor-dependent mechanism. Mol Pharmacol 84(5): 774–786. https://doi.org/10.1124/mol.113.086298
Forman BM, Tzameli I, Choi HS, Chen J, Simha D, Seol W, Evans RM, Moore DD (1998) Androstane metabolites bind to and deactivate the nuclear receptor CAR-beta. Nature 395: 612–615. https://doi.org/10.1038/26996
Kawamoto T, Kakizaki S, Yoshinari K, Negishi M (2000) Estrogen activation of the nuclear orphan receptor CAR (constitutive active receptor) in induction of the mouse Cyp2b10 gene. Mol Endocrinol 14(11): 1897–1905. https://doi.org/10.1210/mend.14.11.0547
Chan GNY, Hoque T, Cummins CL, Bendayan R (2011) Regulation of P-glycoprotein by orphan nuclear receptors in human brain microvessel endothelial cells. J Neurochem 118 (2): 163–175. https://doi.org/10.1111/j.1471-4159.2011.07288.x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


