Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1159-1174
Дисбаланс гормонов, вовлеченных в регуляцию энергетического баланса у больных ожирением – изучение вклада в нарушение пищевого поведения и метаболических параметров
А. Ю. Бабенко 1, *, Г. А. Матвеев 1
1 Национальный медицинский исследовательский центр им. В.А. Алмазова
Санкт-Петербург, Россия
* E-mail: alina_babenko@mail.ru
Поступила в редакцию 14.07.2022
После доработки 15.08.2022
Принята к публикации 22.08.2022
- EDN: WTHQYS
- DOI: 10.31857/S0869813922090047
Аннотация
У здоровых людей в постпищевом статусе происходит закономерная динамика уровня гормонов, вовлеченных в регуляцию пищевого поведения и энергетического баланса. Данные у пациентов с ожирением носят гетерогенный характер. Целью нашего исследования было изучение характера динамики изменений уровней ряда гормонов (лептина, грелина, глюкагоноподобного пептида 1 (ГПП-1), глюкозозависимого инсулинотропного пептида (ГИП)) и установление их взаимосвязи с факторами, характеризующими метаболический статус и пищевое поведение. В исследование были включены 66 пациентов (12 мужчин и 54 женщины) с ожирением, средний возраст 37.8 ± 10.8 лет, средняя масса тела (МТ) 105.2 ± 16.7 кг, индекс МТ 37.3 ± 4.8 кг/м2. У всех пациентов было проведено антропометрическое обследование, измерение уровня артериального давления, исследованы показатели углеводного и липидного обмена. Уровень изучаемых гормонов (лептин, ГИП, ГПП-1, грелин) определяли натощак и через 60 мин после стандартного завтрака, содержащего 60 г углеводов. Было отмечено, что у разных пациентов с ожирением имеются разнонаправленные изменения уровня изученных гормонов. У части пациентов сохраняется динамика типичная для здоровых людей, у большинства – либо ослабление постпищевых пиков (у 48.2% обследованных ослабление пика ГПП-1, у 50% – ослабление пика ГИП), либо аномальная динамика (отсутствие снижение уровня грелина у 60.8%, отсутствие повышение лептина у 83.3%). Патологическая динамика уровня гормонов в постпищевом статусе была ассоциирована с более выраженными изменениями параметров, отражающих метаболически нездоровый тип (повышенные уровни глюкозы и триглицеридов, повышенный индекс НОМА-IR) и нарушения пищевого поведения. Полученные данные демонстрируют наличие различных подтипов ожирения по постпищевой динамике уровня гормонов, вовлеченных в регуляцию аппетита и энергетический баланс. Те подтипы, которые, вероятно, отражают развивающуюся при ожирении резистентность к этим гормонам и/или их дефицит, характеризуются худшими характеристиками метаболического здоровья.
Ожирение – пандемия 21 века, среди ключевых характеристик которой – нарушение регуляции аппетита и пищевого поведения. Пищевое поведение находится под контролем сложной системы, которая включает центральные и гуморальные звенья регуляции [1]. В обеспечении центральных механизмов ключевую роль играет кора и зоны вознаграждения в лимбической системе (“гедонистическая” регуляция) [2], а также гипоталамус, стимуляция вентромедиальных ядер которого сопровождается снижением аппетита, а стимуляция латеральных ядер – его усилением. Ведущую роль в обеспечении гуморальной (гомеостатической, периферической) регуляции играют гормоны желудочно-кишечного тракта (ЖКТ) и жировой ткани. Известно более 20 гормонов, в различной степени вовлеченных в регуляцию пищевого поведения и обладающих орексигенными или анорексигенными эффектами. Среди гормонов, обладающих орексигенным действием, ведущую роль играет грелин, а наиболее значимыми анорексигенными гормонами являются гормон ЖКТ глюкагоноподобный пептид-1 (ГПП-1) и гормон жировой ткани лептин [3]. Инсулин также является аппетит-регулирующим гормоном, проявляя свою активность в гипоталамусе в вентральной тегментальной зоне, где уменьшает опосредуемое через дофаминергические нейроны потребление пищи и удовольствие от еды. Не вызывает сомнений важная роль нарушения эффектов этих гормонов в дисрегуляции системы пищевого поведения и развитии гиперфагии, характерной для пациентов с ожирением и в значительной степени препятствующей снижению веса [4].
В условиях нормальной физиологии лептин подавляет активность нейронов в вентральной тегментальной зоне, снижая мотивацию к приему вкусной пищи, снижает вкусовое, зрительное и обонятельное восприятие пищи. Таким образом, лептин вовлечен не только в периферический, но и в гедонистический контроль пищевого поведения, способен подавлять активность системы еда/награда. Прогрессия ожирения (увеличение объема жировой ткани) и его переход в метаболически нездоровый фенотип (перераспределение депонирования жира из подкожного депо в висцеральное) ассоциированы с увеличением дисбаланса адипокинов – гормонов жировой ткани. При этом, несмотря на повышение уровня лептина, его эффекты снижены, что указывает на нарушение чувствительности к этому гормону. По данным одних исследований, его уровень у людей с нормальной массой тела либо не изменяется [5], либо постепенно повышается в течение 180 мин после пищевой нагрузки, причем в большей степени после углеводной [6]. По данным других авторов, уровень лептина снижается через 2 ч после приема жирной пищи, но не изменяется после перорального глюкозотолерантного теста (ОГТ) [7]. При ожирении происходит снижение уровня лептина через 30–60 мин после ОГТ, но его уровень не изменяется после приема пищи богатой жирами [7]. Эти результаты в целом совпадают с результатами Adamska-Patruno и соавт. [6], согласно которым при ожирении уже через 30 мин происходит значимое снижение уровня лептина, которое сохраняется на этом уровне длительно после углеводной нагрузки и возвращается к исходному уровню через 60 мин после эугликемической пищевой нагрузки.
Грелин, гормон, большая часть которого секретируется в фундальных отделах желудка [8], напротив, повышает активность нейронов в вентральной тегментальной зоне, стимулируя мотивацию к приему вкусной пищи, алкоголя и наркотиков, повышает активность опиоидной и эндоканнабиноидной систем (усиливает удовольствие от приема пищи и других вышеперечисленных стимулов), индуцирует нерациональное импульсивное поведение. У пациентов с ожирением его концентрация ниже и составляет около 68% от уровня, типичного для людей с нормальным весом [9], что, вероятно, обусловлено адаптивной реакцией в ответ на положительный энергетический баланс. Степень снижения уровня грелина натощак обратно пропорциональна ИМТ [10]. У людей с нормальной массой тела происходит снижение уровня грелина после приема пищи, что указывает на ингибирование его продукции в состоянии избытка энергии (повышение уровня глюкозы и других нутриентов) [11], а величина подавления связана с количеством полученной энергии (нутриентов) [12] и характером пищи [6]. В стандартизированных условиях (стандартный углеводный завтрак) у здоровых людей его уровень снижается через 30 мин после еды примерно на 30–50% и остается на этом уровне как минимум до 120 мин теста, а у пациентов с ожирением его содержание не меняется [10].
Из гормонов ЖКТ наибольший интерес исследователей вызывают инкретины – интестинальные гормоны, роль которых в регуляции энергетического баланса не вполне определена. Роль ГПП-1 – гормона, секретируемого Л-клетками кишечника в ответ на прием пищи, более очевидна. Его основными функциями являются стимуляция секреции инсулина, увеличение пролиферации и выживаемости β-клеток, ингибирование высвобождения глюкагона α-клетками и подавление аппетита. Так как три четверти ГПП-1, секретируемого в кишечнике, разрушается дипептидилпептидазой 4-го типа в течение 1–2 мин, еще около 50% деградирует в печени и в циркуляцию попадает лишь 10–12% ГПП-1 [13], эндокринный механизм не является основным в реализации эффектов этого гормона на головной мозг. В большей степени эффекты ГПП-1, секретируемого в кишечнике, на потребление пищи могут быть обусловлены его влиянием на мозг через ГПП-1-чувствительные нейроны блуждающего нерва [14]. Кроме того, ГПП-1 секретируется в головном мозге и может непосредственно влиять на специфические центры, регулирующие аппетит в гипоталамусе [13]. ГПП-1 ингибирует аппетит не только непосредственно, но и путем регуляции продукции грелина [15, 16] и количества растворимых рецепторов лептина (LepRs) [17]. Показано, что у пациентов с ожирением увеличение количества LepRs является одним из механизмов развития лептин-резистентности. Агонисты ГПП-1 (аГПП-1) ингибируют увеличение числа LepRs, сохраняя уровень свободного лептина и предотвращая набор массы тела [18]. В норме уровень ГПП-1 низкий натощак и повышается в постпищевом статусе [19]. В ряде исследований показано, что при ожирении секреция ГПП-1 снижается, что опосредует снижение чувства сытости [20]. В других исследованиях было показано, что уровни ГПП-1 положительно связаны с ИМТ, уровнями инсулина и лептина и отрицательно связаны с содержанием адипонектина. Отмечается,что более высокий уровень ГПП-1 при ожирении ассоциирован с развитием метаболических нарушений. На основании этих данных, японские исследователи [21] предложили гипотезу, согласно которой высокий уровень ГПП-1 у больных с ожирением является следствием центральной резистентности к нему, по аналогии с выше описанной резистентностью к лептину и грелину. Таким образом, нарушение чувствительности к ГПП-1 может лежать в основе нарушения регуляции аппетита и инсулинорезистентности (ИР). Учитывая, что ГПП-1 вовлечен в обеспечение гедонистического контроля не только в отношении пищевого (сигналы насыщения), но и кокаин-амфетамин регулирующего транскрипта (снижает удовольствие от потребления алкоголя и наркотиков), у пациентов с ожирением может увеличиваться приверженность к этим зависимостям.
Глюкозозависимый инсулинотропный пептид (ГИП) оказывает аналогичные ГПП-1 эффекты на функцию бета-клеток, но в большей степени вовлечен в регуляцию жирового метаболизма, чем углеводного. В эксперименте показано, что жирная еда приводит к гиперплазии К-клеток и увеличению секреции ГИП, который, в свою очередь, усиливает адипогенез [22]. ГИП действует на адипоциты непосредственно через его рецепторы (GIPR), регулируя метаболизм липидов. В зависимости от уровня инсулина ГИП может усиливать либо липолиз, либо адипогенез. Эффекты ГИП на жировую ткань частично отрегулированы через активацию липопротеиновой липазы (LPL). Секреция ГИП в ЖКТ увеличивает уровень инсулина, и в условиях высокого уровня инсулина и нормальной к нему чувствительности ГИП ингибирует липолиз в адипоцитах и стимулирует адипогенез через рецептор инсулина. Таким образом, в условиях нормальной чувствительности к инсулину, ГИП способствует здоровому балансу липидов, стимулируя их депонирование в подкожной жировой ткани. Между тем, экспрессия гена GIPRs в подкожной жировой ткани отрицательно коррелирует с ИМТ, объемом талии и уровнем триглицеридов [23]. В норме уровень ГИП низкий натощак и повышается после углеводной нагрузки в 2–3 раза, достигая пика к 60-й минуте [24]. При ожирении были отмечены разнонаправленные изменения его уровня: в одних исследованиях не было значимых отличий в его динамике у людей с нормальной массой тела [24], в других отмечено значимое снижение постпищевого пика при ожирении [25]. В работе Шестаковой и соавт., наоборот, было отмечено нарастание постпищевого пика ГИП вместе с увеличением ИМТ [19]. Это может быть связано с разными типами пищевой нагрузки и разными характеристиками пациентов. Высокожировое питание может непосредственно влиять на продукцию ГИП, увеличивая ее, но при этом может снижать чувствительность к нему, формируя, как минимум, парциальную резистентность. Имеются единичные данные, указывающие на связь тощакового уровня ГИП с параметрами, отражающими метаболическое здоровье. Так, в исследовании Шестаковой с соавт. отмечен значимо более высокий уровень ГИП у пациентов с ИР [19], в исследовании Goralska [26] была установлена взаимосвязь между высоким уровнем ГИП при ожирении и неалкогольной жировой болезнью печени. В исследовании Yamaoka-Tojo [27] наблюдалось значительное взаимодействие между циркулирующим ГПП-1 и ГИП натощак, сывороточным холестерином липопротеинов высокой плотности (ХС-ЛПВП), триглицеридами и мочевой кислотой в сыворотке крови. В то же время исследований, изучивших особенности постпищевой динамики уровня этих гормонов и ее взаимосвязь с метаболическими параметрами, в литературе практически не представлено. Таким образом, все большее количество данных указывает на то, что для ожирения характерно развитие резистентности к многим гормонам, вовлеченным в регуляцию энергетического баланса. Не вызывает сомнений развитие резистентности к лептину и грелину. Между тем, является ли развитие этих изменений неизменным атрибутом любого фенотипа ожирения, или их выраженность может варьировать в зависимости от фенотипа ожирения (гиноидное, андроидное, висцеральное, подкожное, метаболически здоровое/нездоровое) и, возможно, определять особенности нарушений пищевого поведения у отдельных пациентов, не установлено. В настоящее время вклад резистентности к гормонам в нарушения пищевого поведения при ожирении мало изучен. Также мало данных имеется о чувствительности к инкретинам при ожирении и факторах, которые влияют на ее состояние.
Как отмечено выше, одним из методов оценки чувствительности к гормонам, вовлеченным в регуляцию нутритивного баланса, является их оценка в постпищевом статусе. Уровни инкретинов, основным стимулом секреции которых является прием пищи, значимо и наиболее рано повышаются в постпищевом статусе. Пик их секреции приходится на точку 30 мин после приема углеводов, хотя для ГИП – инкретина, в большей степени вовлеченного в регуляцию жирового обмена, прием жирной пищи может вызвать больший и более поздний пик секреции ГИП. Пиковый уровень инкретинов сохраняется и в точке 60 мин. Уровень грелина – орексигенного гормона, также продуцируемого в основном в ЖКТ (фундальные отделы желудка), натощак высок и снижается на 35–50% через 60–120 мин после приема углеводов. В отношении постпищевой динамики уровня лептина, как отмечено выше, в настоящее время единого мнения нет. В норме лептин – анорексигенный гормон, а значит, его уровень должен повышаться в постпищевом статусе. Но если при ожирении имеется выраженная резистентность к лептину, то его уровень резко повышен натощак и может существенно не изменяться в постпищевом статусе. Как уже отмечено, у разных гормонов имеются разные сроки реагирования, но для инкретинов, грелина и инсулина есть точка, в которой их уровни будут пиковыми – это точка 60 мин после приема углеводов. Хотя в отличие от гормонов ЖКТ, стимулированная секреция лептина может происходить в значительно более поздний период времени, ряд исследований свидетельствует о ее повышении через 60 мин после углеводной нагрузки. Это явилось причиной выбора данной точки для оценки постпищевой динамики изучаемых гормонов. Не исключено, что выраженность резистентности к лептину может существенно варьировать в группах с различным статусом метаболического здоровья, и это явилось причиной дисбаланса в результатах различных исследований.
В связи с этим целью нашего исследования стало изучение динамики ряда гормонов, регулирующих пищевое поведение, натощак и через 1 ч после стандартного углеводного завтрака, сравнение изменений данных гормональных показателей с группой здорового контроля и оценка его связи с факторами, отражающими метаболическое здоровье и пищевое поведение.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в исследованиях с участием людей, соответствуют этическим стандартам Национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участников было получено информированное добровольное согласие. Протокол исследования одобрен локальным этическим комитетом НМИЦ им. В.А. Алмазова (выписка из протокола № 022018-14д от 12 февраля 2018 г.).
В настоящее исследование включались пациенты с ожирением, соответствующие следующим критериям. Критерии включения: мужчины и женщины старше 18 лет с ИМТ ≥ 30 кг/м2; документально оформленное согласие пациента на участие в исследовании. Критерии невключения: существенная патология сердечно-сосудистой системы (артериальная гипертензия с нецелевыми уровнями артериального давления, наличие в анамнезе инфаркта миокарда, острого нарушения мозгового кровообращения, стенокардии, хронической сердечной недостаточности выше 2-го функционального класса по NYHA, аритмий высокого риска); наличие сахарного диабета; наличие заболеваний, сопровождающихся изменением функции щитовидной железы; хроническая патология почек со сниженной скоростью клубочковой фильтрации.
В соответствии с данными критериями в исследование были включены 66 пациентов (12 мужчин (18.2%) и 54 женщины (81.8%)) с ожирением, средний возраст 37.8 ± 10.8 лет, средняя масса тела (сМТ) 105.2 ± 16.7 кг, ИМТ 37.3 ± 4.8 кг/м2. Исходная характеристика пациентов представлена в табл. 1.
Таблица 1.
Исходная характеристика пациентов с ожирением
| Исследуемые параметры | Пациенты с ожирением n = 66 |
Референсные или целевые интервалы, где применимо | |
|---|---|---|---|
| Возраст, лет | 37.8 ± 10.8 | NA | |
| Масса тела, кг | 105.2 ± 16.7 | NA | |
| ИМТ, кг/м2 | 37.3 ± 4.8 | <25 | |
| М и Ж | 108.2 ± 11.6 | ||
| ОТ, см | Мужчины | 116.4 ± 8.2 | <90 |
| Женщины | 106.3 ± 11.5 | <84 | |
| М и Ж | 119.6 ± 9.5 | ||
| ОБ, см | Мужчины | 114.7 ± 6.05 | NA |
| Женщины | 120.7 ± 9.9 | NA | |
| Глюкоза натощак, ммоль/л | 5.3 ± 0.6 | 3.3–6.1 | |
| Инсулин натощак, пмоль/л | 162.2 ± 95.7 | 17.8–173.0 | |
| НОМА-IR | 6.0 ± 5.0 | <2.77 | |
| HOMA-B | 285.2 ± 214.6 | >100 | |
| ОХС, ммоль/л | 5.05 ± 1.03 | <4.5 | |
| ХС ЛПВП, ммоль/л | М и Ж | 1.32 ± 0.35 | |
| Мужчины | 1.1 ± 0.28 | >1.0 | |
| Женщины | 1.37 ± 0.35 | >1.2 | |
| ХС ЛПНП, ммоль/л | 3.02 ± 0.81 | <1.8 | |
| ТГ, ммоль/л | 1.52 ± 0.74 | <1.7 | |
| САД, мм рт. ст. | 119.4 ± 13.4 | <140 | |
| ДАД, мм рт. ст. | 71.8 ± 9.1 | <85 | |
ИМТ – индекс массы тела; ОТ – окружность талии; ОБ – окружность бедер; НОМА-IR – индекс резистентности к инсулину; HOMA-B – индекс секреции инсулина; ОХС – общий холестерин; ХС ЛПВП – холестерин липопротеинов высокой плотности; ХС ЛПНП – холестерин липопротеинов низкой плотности; ТГ – триглицериды; САД – систолическое артериальное давление; ДАД – диастолическое артериальное давление.
Методы обследования: при включении в исследование всем пациентам выполнялся физикальный осмотр: измерение роста в см, веса в кг, расчет ИМТ в кг/м2, измерение окружности талии (ОТ) и окружности бедер (ОБ) в см, измерения уровня артериального давления в мм рт.ст.
Оценку биохимических параметров проводили с использованием автоматического анализатора (Cobas c311, Roche, автоматизированный биохимический анализатор, Швейцария) и коммерческих наборов (наборы реагентов Roshe, Швейцария). Референсные значения для различных биохимических параметров: глюкоза в плазме натощак 3.30–6.10 ммоль/л с диапазоном измерения 0.11–41.1 ммоль/л; общий холестерин (ОХС) с диапазоном измерения 0.1–20.7 ммоль/л и нормальным значением 3.50–5.00 ммоль/л; триглицериды сыворотки с диапазоном измерения 0.1–10.0 ммоль/л и нормальным значением <1.77 ммоль/л; ЛПВП с диапазоном измерения 0.08–3.12 ммоль/л и нормальным значением для женщин >1.2 ммоль/л, для мужчин >1.0 ммоль/л. Уровень инсулина в сыворотке крови измеряли с использованием автоматического анализатора (Cobas e411, Roche, полностью автоматизированный иммунохимический электрохемилюминесцентный анализатор, Швейцария) и с использованием коммерческих наборов Insulin Elecsys, Cobas e (Roche, Швейцария), с диапазоном измерения 1.39–6945 МкМЕ/мл и нормальным значением 17.8–173.0 пмоль/л. Коэффициент пересчета пмоль/л × 0.144 = мкЕ/мл.
Уровень грелина, ГПП-1 и ГИП в плазме крови, а лептина – в сыворотке крови измеряли с помощью иммуноферментного анализа с использованием автоматического анализатора (BioRad 680-монометр, автоматизированный анализатор, США). Для грелина (коммерческий набор BCM Diagnostics, США) диапазон измерения 0.0–1000 пг/мл, для ГПП-1 (коммерческий набор BCM Diagnostics, США) диапазон измерения 0.0–25.0 пг/мл, чувствительность 0.04 пг/мл, для ГИП (коммерческий набор ELISA Kit for Gastric Inhibitory Polypeptide (Cloud-Clone Corp., США) диапазон измерения 61.7–5000 пг/мл, коэффициент чувствительности <23.9 пг/мл, для лептина (коммерческий набор для проведения иммуноферментного анализа (DBC, США) диапазон измерения от 2.0 до 11.0 нг/мл, чувствительность 0.5 нг/мл.
В связи с отсутствием общепринятой нормы для ГПП-1, ГИП и грелина, в исследование была включена группа здоровых людей, состоящая из 19 человек (сотрудников НМИЦ им. В.А. Алмазова, подписавших информированное согласие и не имевших каких-либо хронических заболеваний, включая дислипидемию, нарушение углеводного обмена, артериальную гипертензию и ожирение по результатам диспансеризации. Эта группа включала 5 мужчин (26.3%) и 14 женщин (73.7%) и была сопоставима по возрасту и соотношению полов с группой пациентов с ожирением. Средний уровень глюкозы крови у данной выборки составил 4.9 ± 0.7 ммоль/л, ОХС 4.4 ± 0.5 ммоль/л, ХС-ЛПВП 1.4 ± 0.2 ммоль/л, ХС-ЛПНП 1.7 ± 0.4 ммоль/л, ТГ 1.4 ± 0.3 ммоль/л, систолическое артериальное давление 117.4 ± 9.9 мм рт. ст., диастолическое артериальное давление 79 ± 6.6 мм рт. ст. В этой группе были оценены уровни ГПП-1, ГИП и грелина.
У обследованных пациентов с ожирением выявлен более высокий уровень ГПП-1 (3.8 ± 1.1 vs 2.0 ± 1.4 нг/мл, р ≤ 0.001), существенно меньший уровень ГИП (219.8 ± 148.7 vs 607.9 ± 215.5 нг/мл, р ≤ 0.001) и грелина (3.4 ± 2.4 vs 4.7 ± 6.0 нг/мл, р ≤ 0.05) по сравнению с группой здорового контроля (ГЗК).
Уровень ГПП-1, ГИП и грелина был оценен у 56 пациентов, а лептина – у всех 66 человек с ожирением, натощак и через 60 мин после стандартного завтрака. Стандартный углеводный завтрак включал: 2 куска хлеба (50 г черного хлеба), 1 небольшой фрукт (яблоко 200 г или апельсин 200 г) и стакан сладкого сока (250 мл). Всеми пациентами были заполнены опросники в соответствии с дизайном исследования: голландский опросник пищевого поведения (Dutch Eating Behavior Questionnaire (DEBQ)), визуально-аналоговая шкала, состоящая из 4 вопросов (Насколько голодным вы себя чувствуете? Насколько сытым вы себя чувствуете? Насколько сильно вы хотите есть? Сколько пищи вы могли бы сейчас съесть?).
При анализе DEBQ в большинстве случаев были выявлены смешанные нарушения пищевого поведения, среди которых превалировали нарушения эмоциогенного и ограничительного характера. Пациентов без нарушений пищевого поведения в нашем исследовании выявлено не было. Для упрощения анализа у пациентов со смешанными вариантами определялся доминантный тип нарушения пищевого поведения. Для определения доминантного типа был рассчитан процент отклонений от нормальных значений для каждого типа пищевого поведения, и тот тип пищевого поведения, по которому определялся наибольший процент отклонений, фиксировался как доминантный.
Статистический анализ. Статистический анализ был проведен с использованием STATISTICA 10 (StatSoftInc, США) для Windows. Данные были представлены как среднее ± стандартное отклонение или число (%). Распределение всех изучаемых переменных имело отклонение от нормального (р < 0.05 в тесте Колмогорова–Смирнова), поэтому для сравнения выборок использовались непараметрические тесты. Для сравнения двух независимых выборок с интервальной шкалой использовался критерий Манна–Уитни. Критический уровень значимости (p) для проверки статистических гипотез при сравнении статистических показателей принимался менее 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При рассмотрении исследуемой группы, состоящей из 66 пациентов с ожирением, установлено, что медиана ИМТ соответствовала 2-ой степени ожирения, медиана возраста соответствовала молодому возрасту. Медианы уровней липидов (за исключением ЛПНП – 3.0 ± 0.8 ммоль/л), артериального давления, глюкозы были в пределах адекватного контроля, но индекс НОМА-IR (6.0 ± 5.0) указывал на наличие ИР. Детальная характеристика данной группы представлена в табл. 1.
При анализе характеристик пищевого поведения было установлено, что средний % пациентов с доминантным эмоциогенным типом нарушения пищевого поведения (ЭмПП) составил 72.2%, с экстернальным типом (ЭксПП) – 11.1%, с ограничительным типом (ОПП) – 16.7%, то есть с наибольшей частотой встречался ЭмПП.
Уровень лептина был повышен в группе пациентов с ожирением. Имелась прямая корреляционная зависимость между уровнем лептина и ИМТ, отмечались гендерные отличия в его уровне – у женщин было выявлено значимо большее повышение уровня лептина при той же степени ожирения и ИМТ (1-я степень ожирения, р ≤ 0.001; 2-я степень ожирения, р ≤ 0.001; 3-я степень ожирения, р ≤ 0.01). Уровень лептина натощак и через 1 ч после стандартного углеводного завтрака у мужчин составил 24.9 ± 19.6 и 21.9 ± 17.2 нг/мл, а у женщин был значительно выше – 82.3 ± 29.5 и 76.5 ± 28.5 пг/мл соответственно. Снижение уровня лептина через час после углеводной нагрузки было статистически значимым как у мужчин (р ≤ 0.01), так и у женщин (р ≤ 0.001). Между тем, у разных пациентов динамика лептина после еды имела разнонаправленный характер. В зависимости от динамики уровня лептина после стандартного углеводного завтрака мы выделили три группы:
Группа 1 – уровень лептина повышается после еды на ≥10% от исходного (11 пациентов, 16.7%).
Группа 2 – уровень лептина после еды изменяется не более, чем на 10% от исходного (26 пациентов, 39.4%).
Группа 3 – уровень лептина снижается после еды на ≥10% от исходного (11 пациентов, 43.9%).
Мы сравнили основные метаболические параметры (ИМТ, иНОМА-IR, иНОМА-В, уровень глюкозы, липидов), артериальное давление, содержание других изученных гормонов в этих группах. Также были сравнены характеристики пищевого поведения.
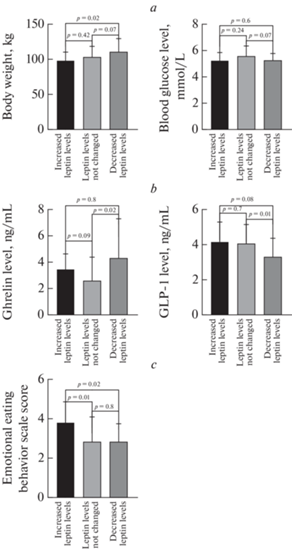
При сравнении антропометрических показателей в группе со снижением уровня лептина после углеводной нагрузки было отмечено, что у этих пациентов масса тела и окружность бедер были больше, чем в других группах (р ≤ 0.05 в обоих случаях) (рис. 1а). Других статистически значимых отличий антропометрических показателей, а также показателей углеводного и липидного обменов выявлено не было. В группе пациентов с понижением лептина после стандартного углеводного завтрака выявлен более высокий уровень грелина натощак (р ≤ 0.05), а уровень ГПП-1 был ниже, чем в других группах (р ≤ 0.01) (рис. 1b). Различия между группами по данным опросников пищевого поведения наблюдались только по параметру “балл по шкале эмоциогенного пищевого поведения”, который был ниже в группе с понижением уровня лептина после стандартного углеводного завтрака (рис. 1c).
Рис. 1.
Различия массы тела и глюкозы крови (а), уровней грелина и ГПП-1 натощак (b), пищевого поведения (c) у пациентов с разнонаправленной динамикой уровня лептина после стандартного углеводного завтрака.
Был оценен уровень грелина натощак и через 1 ч после стандартного завтрака. Уровень грелина натощак был значимо ниже, чем в контрольной группе (р ≤ 0.05). После стандартного углеводного завтрака достоверного изменения уровня грелина в общей группе выявлено не было. В связи с тем, что уровень грелина после углеводного завтрака не снижался адекватно в общей группе, а изменение его содержания носило разнонаправленный характер, были сформированы 2 группы: первая – пациенты с понижением грелина после пищевой нагрузки и вторая – с аномальным повышением уровня грелина. Повышение уровня грелина после углеводной нагрузки было выявлено у 60.8% пациентов, а снижение на 35% и более у 39.2% пациентов. В группе со снижением грелина после стандартного углеводного завтрака содержание грелина натощак был значимо выше (р ≤ 0.01). Уровень грелина имел отрицательную взаимосвязь с уровнем ГПП-1 (r = –0.33, р ≤ 0.01), уровень грелина через 60 мин после завтрака имел аналогичную отрицательную взаимосвязь с уровнем ГПП-1 в этой же точке (r = –0.3, р ≤ 0,05) и положительную – с индексом НОМА-IR (r = 0.4, р ≤ 0.01). Группы с адекватным снижением содержания грелина после еды и без адекватного снижения были сравнены между собой по метаболическим параметрам. В группе со снижением грелина уровень триглицеридов был ниже (р ≤ 0.05), а уровень НОМА-В выше (р ≤ 0.05) (рис. 2). Других достоверных отличий в исследуемых параметрах выявлено не было.
Рис. 2.
Различия в уровнях триглицеридов и индекса НОМА-В у пациентов с разнонаправленной динамикой уровня грелина после стандартного углеводного завтрака.

Балл по шкалам различных типов пищевого поведения и визуально-аналоговой шкале значимо не различался в группах с различной постпищевой динамикой уровня грелина.
Уровень ГПП-1 был повышен при ожирении по сравнению с группой здоровых людей (3.7 ± 1.1 и 2.0 ± 1.4, р ≤ 0.001). В соответствии с данными литературы, у здоровых людей уровень ГПП-1 после углеводной нагрузки повышается более чем в 2 раза. У обследованных пациентов с ожирением уровень ГПП-1 после завтрака не менялся (3.7 ± 1.1 vs 3.8 ± 1.3 нг/мл), что можно расценивать как резистентность к ГПП-1. В связи с тем, что изменения постпрандиального уровня ГПП-1 различались у отдельных пациентов, мы разделили пациентов на группы с адекватным (>50%) повышением уровня ГПП-1 после углеводной нагрузки и без него. После углеводной нагрузки у 48.2% (n = 27) было выявлено снижение уровня ГПП-1, у 41.1% – повышение уровня ГПП-1 менее чем на 50% (n = 23) и лишь у 10.8% (n = 6) найдено адекватное повышение содержания ГПП-1 более чем на 50%.
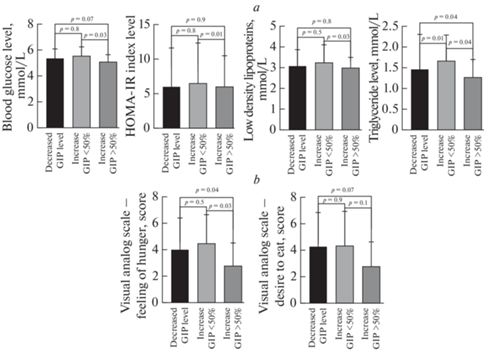
В группе с повышением уровня ГПП-1 более 50% был выявлен более низкий уровень триглицеридов (1.1 ± 0.5 vs 1.7 ± 0.7 vs 1.3 ± 0.6, р ≤ 0.05) и ГПП-1 натощак (2.6 ± 0.6 vs 4.0 ± 1.2 vs 3.7 ± 0.9, р ≤ 0.05), более высокий уровень грелина натощак (6.0 ± 3.6 vs 2.8 ± 1.8 vs 3.4 ± 2.1, р ≤ 0.05) (рис. 3) и диастолического артериального давления (78.3 ± 9.8 vs 69.9 ± 8.0 vs 69.3 ± 8.3, р ≤ 0.05). Значимых отличий в сумме баллов по шкалам нарушений пищевого поведения и визуально-аналоговой шкале в группах с различной постпищевой динамикой ГПП-1 выявлено не было.
Рис. 3.
Различия уровня триглицеридов и грелина у пациентов с различной динамикой ГПП-1 после стандартного углеводного завтрака.

Уровень ГИП натощак у пациентов с ожирением был достоверно ниже, чем у здоровых людей (219.8 ± 148.7 vs 607.9 ± 215.5, р ≤ 0.001), что указывает на его дефицит. При этом медиана уровня ГИП после углеводного завтрака значимо не менялась (219.8 ± 148.7 vs 199.1 ± 109.5 пг/мл), однако изменения постпрандиального уровня ГИП имели разнонаправленный характер: у части больных – адекватное (более 50%) повышение, у части – несущественное повышение или снижение. В связи с этим все пациенты были разделены на группы с повышением и понижением уровня ГИП после нагрузки: у 50% (n = 28) было выявлено снижение уровня ГИП, у 28.6% найдено повышение менее 50% (n =16) и у 21.4% (n = 12) адекватное повышение уровня ГИП более чем на 50%. В группе с повышением уровня ГИП более 50% был выявлен более низкий уровень триглицеридов (1.2 ± 0.4 vs 1.4 ± 0.8 vs 1.7 ± 0.6, р ≤ 0.05) (рис. 4а) и ГИП натощак (114.8 ± 61.3 vs 289.0 ± 159.3, р ≤ 0.05), чем в группе с понижением уровня ГИП после завтрака. Кроме того, у пациентов данной группы по визуально-аналоговой шкале выявлено меньшее чувство голода и желания есть (2.8 ± 1.7 vs 4.0 ± 2.4 vs 4.5 ± 2.2, р ≤ 0.05) (рис. 4b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные в нашем исследовании данные по распределению различных типов пищевого поведения при ожирении совпадает с данными литературы [28]. Наиболее частым типом нарушения пищевого поведения был эмоциогенный. Следует отметить, что этот тип ассоциирован с наихудшим ответом на различные варианты вмешательств, направленных на снижение веса [29]. Различные авторы отмечали в два раза меньшую потерю веса в программах изменения образа жизни [30, 31], отсутствие целевой потери веса на ГПП-1 [32], меньшую потерю веса после бариатрических вмешательств [33].
Наши данные совпадают с данными других исследований в отношении тощакового уровня лептина. Для этого гормона характерно повышение уровня по мере увеличения ИМТ [34]. Кроме того, имеются гендерные различия в его уровне – у женщин уровень лептина значимо выше, чем у мужчин. В постпищевом статусе как у мужчин, так и у женщин с ожирением, мы отметили значимое снижение уровня лептина после нагрузки углеводами в целом по группе, что совпадает с результатами ряда недавних исследований [6, 7]. В отличие от этих исследовательских групп мы проанализировали внутригрупповые различия и отметили, что лишь у меньшей части пациентов с ожирением уровень лептина после стандартного углеводного завтрака снижался (16.7%). У большинства обследованных уровень лептина не изменялся по сравнению с исходным после нагрузки (39.4%) или повышался (43.9%). Нарастание патологической динамики (снижение лептина после углеводного завтрака) было ассоциировано с большей массой тела и, что интересно – с большей окружностей бедер. Из метаболических параметров были выявлены отличия в уровне глюкозы натощак, который имел тенденцию к повышению в группе со снижением лептина после завтрака. Кроме того, постпищевая динамика лептина проявила ассоциацию с характеристиками пищевого поведения. При этом балл по шкале ЭмПП был самым высоким в группе с повышением лептина после углеводной нагрузки. Чувство голода, напротив, было наименее выражено в этой группе. Интересно, что в сравнении с другими группами группа со снижением лептина в постпищевом статусе характеризовалась значениями уровней грелина и ГПП-1 в крови натощак, наиболее близкими к показателям у здоровых людей.
При оценке постпищевой динамики уровня грелина мы отметили сохранение адекватного изменения его уровня менее чем у половины пациентов (39.2%). Уровень грелина имел отрицательную взаимосвязь с уровнем ГПП-1 как натощак, так и после пищевой нагрузки. Эти результаты хорошо соотносятся с полученными ранее другими исследователями данными о подавлении продукции грелина ГПП-1 [35]. Наши данные дополнили эти результаты, показав, что в постпищевом статусе это влияние сохраняется и постпищевое повышение ГПП-1 вносит свой вклад в адекватное снижение уровня грелина после еды. В группе со снижением грелина уровень триглицеридов был достоверно ниже (р ≤ 0.05), а уровень НОМА-В выше (р ≤ 0.05). Так же как и для ГПП-1, для грелина отмечены признаки лучшего метаболического здоровья в группе с адекватной постпищевой динамикой его уровня. В недавнем исследовании, сравнившем уровень грелина натощак в группах с метаболически здоровым ожирением и с метаболическим синдромом, не было выявлено значимых межгрупповых различий. Так же, как и в нашем исследовании, авторы этой работы не выявили связи между уровнем грелина натощак и аппетитом [36].
Лишь небольшая часть обследованных пациентов имела сохраненный ответ инкретинов на пищевую нагрузку: уровень ГПП-1 адекватно (более чем на 50%) повышался у 10.8% обследованных, а уровень ГИП – у 21.4%. При этом группы с адекватным повышением как уровня ГПП-1, так и уровня ГИП, характеризовались более низким уровнем триглицеридов. Кроме того, у пациентов с адекватным повышением уровня ГИП имелись менее выраженное чувство голода и желание есть. Базальные уровни инкретинов в этих группах были значимо ниже, а уровень грелина был выше, то есть они были ближе к базальным уровням контрольной группы.
Таким образом, наши данные демонстрируют наличие различных подтипов по постпищевой динамике уровня гормонов, вовлеченных в регуляцию аппетита и энергетический баланс. Те подтипы, которые согласно данным литературы, наиболее типичны для пациентов с ожирением и отражают развивающуюся при ожирении резистентность к этим гормонам и/или их дефицит, имеют худшие характеристики метаболического здоровья. В нашей выборке эти различия в основном касались уровня триглицеридов, который был значительно ниже практически во всех подгруппах с нормальной, в соответствии с данными литературы, динамикой после углеводной нагрузки. Между тем, включенные в наше исследование пациенты исходно не имели выраженных изменений метаболических параметров, что затрудняло выявление значительных различий в этой довольно небольшой группе. Дальнейшие исследования на выборках большего объема и с большей выраженностью метаболических отклонений необходимы для уточнения роли этих различий в постпищевой динамике гормонов в формировании метаболически здоровых и метаболически нездоровых типов ожирения и нарушений пищевого поведения.
Список литературы
Kemps E, Herman CP, Hollitt S, Polivy J, Prichard I, Tiggemann M (2016) The role of expectations in the effect of food cue exposure on intake. Appetite 103: 259–264. https://doi.org/10.1016/j.appet.2016.04.026
Travagli RA, Anselmi L (2016) Vagal neurocircuitry and its influence on gastric motility. Nat Rev Gastroenterol Hepatol 13(7): 389–401. https://doi.org/10.1038/nrgastro.2016.76
Тихоненко ЕВ, Цой ЮА, Васильева ЕЮ, Бабенко АЮ (2018) Особенности пищевого поведения и уровень гормонов, регулирующих аппетит у пациентов с сахарным диабетом 2-го типа и индексом массы тела более 35 кг/м2. Ожирение и обмен веществ 15(1): 30–38. [Tichonenko EV, Tsoi UA, Vasilieva EY, Babenko AYu (2018) Characteristics of eating behavior and the level of hormones regulating the appetite in patients with type 2 diabetes mellitus and body mass index more than 35 kg /m2. Obesity and metabolism 15(1): 30–38. (In Russ)]. https://doi.org/10.14341/omet2018130-38
Klok MD, Jakobsdottir S, Drent ML (2007) The role of leptin and ghrelin in the regulation of food intake and body weight in humans: a review. Obes Rev 8(1):21–34. https://doi.org/10.1111/j.1467-789X.2006.00270.x
Monteleone P, Martiadis V, Fabrazzo M, Serritella C, Maj M (2003) Ghrelin and leptin responses to food ingestion in bulimia nervosa: implications for binge-eating and compensatory behaviours. Psychol Med 33(8): 1387–1394. https://doi.org/10.1017/s0033291703008316
Adamska-Patruno E, Ostrowska L, Goscik J, Fiedorczuk J, Moroz M, Kretowski A, Gorska M (2019) The Differences in Postprandial Serum Concentrations of Peptides That Regulate Satiety/Hunger and Metabolism after Various Meal Intake, in Men with Normal vs. Excessive BMI. Nutrients 11(3): 493. https://doi.org/10.3390/nu11030493
Larsen MA, Isaksen VT, Paulssen EJ, Goll R, Florholmen JR (2019) Postprandial leptin and adiponectin in response to sugar and fat in obese and normal weight individuals. Endocrine 66(3): 517–525. https://doi.org/10.1007/s12020-019-02102-9
Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K (1999) Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 402(6762): 656–660. https://doi.org/10.1038/45230
Williams DL, Cummings DE (2005) Regulation of ghrelin in physiologic and pathophysiologic states. J Nutr 135(5): 1320–1325. https://doi.org/10.1093/jn/135.5.1320
Zwirska-Korczala K, Konturek SJ, Sodowski M, Wylezol M, Kuka D, Sowa P, Adamczyk-Sowa M, Kukla M, Berdowska A, Rehfeld JF, Bielanski W, Brzozowski T (2007) Basal and postprandial plasma levels of PYY, ghrelin, cholecystokinin, gastrin and insulin in women with moderate and morbid obesity and metabolic syndrome. J Physiol Pharmacol 58 Suppl 1: 13–35.
McLaughlin T, Abbasi F, Lamendola C, Frayo RS, Cummings DE (2004) Plasma ghrelin concentrations are decreased in insulin-resistant obese adults relative to equally obese insulin-sensitive controls. J Clin Endocrinol Metab 89(4): 1630–1635. https://doi.org/10.1210/jc.2003-031572
Callahan HS, Cummings DE, Pepe MS, Breen PA, Matthys CC, Weigle DS (2004) Postprandial suppression of plasma ghrelin level is proportional to ingested caloric load but does not predict intermeal interval in humans. J Clin Endocrinol Metab 89(3): 1319–1324. https://doi.org/10.1210/jc.2003-031267
Holst JJ, Deacon CF (2005) Glucagon-like peptide-1 mediates the therapeutic actions of DPP-IV inhibitors. Diabetologia 48(4): 612–615. https://doi.org/10.1007/s00125-005-1705-7
Spreckley E, Murphy KG (2015) The L-Cell in Nutritional Sensing and the Regulation of Appetite. Front Nutr 2: 23. https://doi.org/10.3389/fnut.2015.00023
Hagemann D, Holst JJ, Gethmann A, Banasch M, Schmidt WE, Meier JJ (2007) Glucagon-like peptide 1 (GLP-1) suppresses ghrelin levels in humans via increased insulin secretion. Regul Pept 143(1–3): 64–68. https://doi.org/10.1016/j.regpep.2007.03.002
Hong X, Zhang H, Liang H, Li D, Huang J, Li Z, Jiang S, Zhang W, Xu G (2016) Exendin-4 decreases ghrelin levels through mTOR signaling. Mol Cell Endocrinol 437: 201–212. https://doi.org/10.1016/j.mce.2016.08.039
Clemmensen C, Chabenne J, Finan B, Sullivan L, Fischer K, Küchler D, Sehrer L, Ograjsek T, Hofmann SM, Schriever SC, Pfluger PT, Pinkstaff J, Tschöp MH, Dimarchi R, Müller TD (2014) GLP-1/glucagon coagonism restores leptin responsiveness in obese mice chronically maintained on an obesogenic diet. Diabetes 63(4): 1422–1427. https://doi.org/10.2337/db13-1609
Iepsen EW, Lundgren J, Dirksen C, Jensen JE, Pedersen O, Hansen T, Madsbad S, Holst JJ, Torekov SS (2014) Treatment with a GLP-1 receptor agonist diminishes the decrease in free plasma leptin during maintenance of weight loss. Int J Obes (Lond) 39(5): 834–841. https://doi.org/10.1038/ijo.2014.177
Шестакова ЕА, Ильин АВ, Шестакова МВ, Дедов ИИ (2015) Глюкозозависимый инсулинотропный полипептид – новое звено в развитии ожирения. Ожирение и обмен веществ 12(1):16–19. [Shestakova EA, Il’in AV, Shestakova MV, Dedov II (2015) Glucose-dependent insulinotropic polypeptide – a new link in the development of obesity. Obesity and metabolism 12(1): 16–19. (In Russ)]. https://doi.org/10.14341/omet2015116-19
Simpson KA, Martin NM, Bloom SR (2008) Hypothalamic regulation of appetite. Expert Rev Endocrinol Metab 577–592. https://doi.org/10.1586/17446651.3.5.577
Yamaoka-Tojo M, Tojo T, Takahira N, Matsunaga A, Aoyama N, Masuda T, Izumi T (2010) Elevated circulating levels of an incretin hormone, glucagon-like peptide-1, are associated with metabolic components in high-risk patients with cardiovascular disease. Cardiovasc Diabetol 9: 17. https://doi.org/10.1186/1475-2840-9-17
Finan B, Müller TD, Clemmensen C, Perez-Tilve D, DiMarchi RD, Tschöp MH (2016) Reappraisal of GIP Pharmacology for Metabolic Diseases. Trends Mol Med 22(5): 359–376. https://doi.org/10.1016/j.molmed.2016.03.005
Møller CL, Vistisen D, Færch K, Johansen NB, Witte DR, Jonsson A, Pedersen O, Hansen T, Lauritzen T, Jørgensen ME, Torekov SS, Holst JJ (2016) Glucose-Dependent Insulinotropic Polypeptide Is Associated With Lower Low-Density Lipoprotein But Unhealthy Fat Distribution, Independent of Insulin: The ADDITION-PRO Study. J Clin Endocrinol Metab 101(2): 485–493. https://doi.org/10.1210/jc.2015-3133
Verdich C, Toubro S, Buemann B, Lysgård Madsen J, Juul Holst J, Astrup A (2001) The role of postprandial releases of insulin and incretin hormones in meal-induced satiety-effect of obesity and weight reduction. Int J Obes Relat Metab Disord 25(8): 1206–1214. https://doi.org/10.1038/sj.ijo.0801655
Carr RD, Larsen MO, Jelic K, Lindgren O, Vikman J, Holst JJ, Deacon CF, Ahrén B (2009) Secretion and dipeptidyl peptidase-4-mediated metabolism of incretin hormones after a mixed meal or glucose ingestion in obese compared to lean, nondiabetic men. J Clin Endocrinol Metab 95(2): 872–878. https://doi.org/10.1210/jc.2009-2054
Góralska J, Raźny U, Polus A, Dziewońska A, Gruca A, Zdzienicka A, Dembińska-Kieć A, Solnica B, Micek A, Kapusta M, Słowińska-Solnica K, Malczewska-Malec M (2020) Enhanced GIP Secretion in Obesity Is Associated with Biochemical Alteration and miRNA Contribution to the Development of Liver Steatosis. Nutrients 12(2): 476. https://doi.org/10.3390/nu12020476
Yamaoka-Tojo M, Tojo T, Takahira N, Matsunaga A, Aoyama N, Masuda T, Izumi T (2010) Elevated circulating levels of an incretin hormone, glucagon-like peptide-1, are associated with metabolic components in high-risk patients with cardiovascular disease. Cardiovasc Diabetol 9: 17. https://doi.org/10.1186/1475-2840-9-17
Ganley RM (1989) Emotion and eating in obesity: A review of the literature. Int J Eat Disord 343–361. https://doi.org/10.1002/1098-108X(198905)8:3<343::AID-EAT2260080310>3.0.CO;2-C
Frayn M, Knäupe B (2018) Emotional Eating and Weight in Adults: a Review. Curr Psychol 37: 924–933.https://doi.org/10.1007/s12144-017-9577-9
López-Guimerà G, Dashti HS, Smith CE, Sánchez-Carracedo D, Ordovas JM (2014) CLOCK 3111 T/C SNP Interacts with Emotional Eating Behavior for Weight-Loss in a Mediterranean Population. PLos One 9(6): e99152. https://doi.org/10.1371/journal.pone.0099152
Delahanty LM, Peyrot M, Shrader PJ, Williamson DA, Meigs JB, Nathan DM (2013) DPP Research Group. Pretreatment, psychological, and behavioral predictors of weight outcomes among lifestyle intervention participants in the Diabetes Prevention Program (DPP). Diabetes Care 36(1): 34–40. https://doi.org/10.2337/dc12-0733
van Ruiten CC, Ten Kulve JS, van Bloemendaal L, Nieuwdorp M, Veltman DJ, IJzerman RG (2022) Eating behavior modulates the sensitivity to the central effects of GLP-1 receptor agonist treatment: a secondary analysis of a randomized trial. Psychoneuroendocrinology137: 105667. https://doi.org/10.1016/j.psyneuen.2022.105667
Canetti L, Berry EM, Elizur Y (2009) Psychosocial predictors of weight loss and psychological adjustment following bariatric surgery and a weight-loss program: the mediating role of emotional eating. Int J Eat Disord 42(2): 109–117. https://doi.org/10.1002/eat.20592
Shufen Li, Xi Li (2016) Leptin in normal physiology and leptin resistance. Sci Bull 61(19): 1480–1488. https://doi.org/10.1007/s11434-015-0951-4
Hagemann D, Holst JJ, Gethmann A, Banasch M, Schmidt WE, Meier JJ (2007) Glucagon-like peptide 1 (GLP-1) suppresses ghrelin levels in humans via increased insulin secretion. Regul Pept 143(1–3): 64–68. https://doi.org/10.1016/j.regpep.2007.03.002
Mesgari-Abbasi M, AbbasalizadFarhangi M (2020) Serum concentrations of cholecystokinin, peptide YY, ghrelin and high sensitive C-reactive protein in association with metabolic syndrome ingredients in obese individuals. Acta Endocrinol (Buchar) 16(1): 37–42. https://doi.org/10.4183/aeb.2020.37
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова