Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1148-1158
Участие iNOS в формировании тонуса пиальных артерий при метаболических нарушениях и стрептозотоциновом диабете у крыс, содержащихся на высокожировой диете
И. Б. Соколова *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: SokolovaIB@infran.ru
Поступила в редакцию 14.06.2022
После доработки 19.07.2022
Принята к публикации 30.07.2022
- EDN: WMDOZO
- DOI: 10.31857/S0869813922090096
Аннотация
Изучали изменения опосредованной ацетилхолином (AСh) дилатации пиальных артерий сенсомоторной коры головного мозга у крыс Sprague Dawley после формирования у них метаболических и гормональных нарушений, сходных с сахарным диабетом 2-го типа. Для этого крыс 2 мес. содержали на высокожировой диете (ВЖД), а затем части животных вводили низкую дозу стрептозотоцина (35 мг/кг). Еще 1 мес. все животные получали корм с повышенным содержанием жира. С использованием метода прижизненной микрофотосъемки оценивали реакции пиальных артерий на воздействие одного AСh (10–7 М) и AСh на фоне действия неселективного блокатора NO-синтаз L-NAME и на воздействие селективного блокатора индуцибельной NO-синтазы (iNOS) аминогуанидина (АГ). Установлено, что потребление высокожирового корма на протяжении 3 мес. (группа ВЖД) привело к развитию эндотелиальной дисфункции в пиальных артериях сенсомоторной коры головного мозга: число расширившихся на воздействие AСh сосудов было меньше в 1.2–1.6 раз, чем в контрольной группе. AСh-зависимая дилатация определялась реакциями с участием еNOS только в артериях диаметром менее 40 мкм. У крыс, находящихся на ВЖД, в церебральных артериях не выявили наличие iNOS. У животных, которым моделировали сахарный диабет 2-го типа (СД2) также имела место эндотелиальная дисфункция в церебральных артериях: число расширившихся на воздействие AСh сосудов было меньше в 1.6–2.3, чем в контроле. При этом сигнальный каскад с участием еNOS не контролировал реактивность артерий. Поддержание сосудистого тонуса в основном происходило за счет реакций с участием iNOS. Основные нарушения в дилататорной реакции у крыс с СД2 – наименьшее число расширившихся на воздействие AСh сосудов со значительным уменьшением степени дилатации (в 1.5–1.6 раза относительно контроля), отсутствие блокировки AСh-опосредованной дилатации на фоне L-NAME, наибольшее число констрикций при воздействии АГ (60–70% от всех исследованных сосудов) – были выявлены в пиальных артериях диаметром менее 40 мкм, т.е. именно в том звене сосудистой сети, которое принимает максимальное участие в газообмене между кровью и тканью.
Механизмы ремоделирования сосудистого русла при метаболическом синдроме и сахарном диабете 2-го типа (СД2) к настоящему времени остаются малоизученными. Для метаболического синдорма и СД2 характерна инсулинорезистентность, а для СД2 – хроническая гипергликемия. Инсулинорезистентность развивается при нарушении обмена веществ и значительном накоплении в организме висцерального жира [1] и рассматривается как основной патогенетический механизм развития СД2 [2]. Инсулин в высокой концентрации оказывает прямое атерогенное действие на стенки сосудов, вызывая пролиферацию и миграцию гладкомышечных клеток, пролиферацию фибробластов, активацию системы свертывания крови, снижение активности фибринолиза [3]. В последние годы инсулинорезистентность связывают с накоплением в ткани и сосудах головного мозга β-амилоидного белка. Отложение β-амилоида было зафиксировано в стенках лептоменингеальных и кортикальных артерий, что приводило к развитию воспалительной реакции как в сосудистой стенке, так и в окружающей сосуды ткани [4]. При хронической гипергликемии глюкоза вступает во взаимодействие с белками и липидами крови с образованием продуктов гликозилирования [5]. Эти соединения токсичны для клеток эндотелия сосудов. Повреждение эндотелиоцитов ведет к развитию эндотелиальной дисфункции: нарушению баланса выработки вазодилататоров/вазоконстрикторов, повышенному тромбообразованию, активации процессов воспаления [6]. При развитии тканевого воспаления экспрессируется значительное количество индуцибельной NO-синтазы (iNOS). iNOS продуцирует огромные (в 100–1000 раз больше, чем эндотелиальная и нейрональная NOS) количества NO. Поскольку высокие дозы NO токсичны для клеток, эта изоформа фермента считается патологической в отличие от конститутивной [7]. iNOS следует рассматривать как важную терапевтическую мишень, воздействуя на которую можно уменьшить ремоделирование и деградацию церебрального сосудистого русла у больных с метаболическим синдромом и СД2.
Цель представленного исследования выяснить на какой стадии нарушения метаболизма и в каких церебральных артериях (крупных, мелких) iNOS принимает участие в формировании сосудистого тонуса.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на самцах крыс Sprague Dawley (n = 30) из ЦКП “Биоколлекция ИФ РАН”. Работа выполнена в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, принятыми Европейской конвенцией 19.07.2014 г. и требованиями Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения (цикл: 12 ч свет/12 ч темнота).
В начале работы возраст крыс составлял 3 месяца, масса тела 300–350 г. Контрольные крысы (Группа 1, n = 10) содержались в условиях вивария при естественном освещении и свободном доступе к воде и стандартному пищевому рациону. Крысы, содержащиеся на высокожировой диете (ВЖД) (Группа 2, n = 10) и крысы, у которых моделировали сахарный диабет 2-го типа (СД2) (Группа 3, n = 10) в течение 2 мес. получали корм с повышенным содержанием жира. ВЖД включала в себя комбикорм (370 г/кг), жир свиной (313 г/кг), казеин (253 г/кг), витаминно-минеральную смесь (61г/кг) – 58% жира, 25% белка, 17% углеводов от общего количества калорий [8, 9]. Через 2 мес. крысам из группы 3 внутрибрюшинно был введен панкреотоксичный препарат стрептозотоцина в низкой концентрации (35 мг/кг) (Sigma-Aldrich, США). Еще 1 месяц животные из групп 2 и 3 получали ВЖД. Раз в месяц у всех животных проводили забот крови из хвостовой вены для регистрации уровня глюкозы с помощью глюкометра Акку-Чек Актив (“Рош Диабетс Кеа ГМбХ”, Германия). Через 3 мес. крысы из всех 3 групп прошли тесты на инсулинорезистентность и толерантность к глюкозе.
Все последующие хирургические и экспериментальные действия были проведены на наркотизированных (золетил, Virbac, Франция, 20 мг/кг, внутрибрюшинно) крысах; эвтаназия проведена путем введения увеличенной дозы наркоза. Перед началом эксперимента у крыс измеряли уровень глюкозы в крови из хвостовой вены, массу тела, длину от кончика носа до анального отверстия, обхват живота. После эвтаназии у животных тщательно изымали висцеральный жир и определяли его вес. Висцеральная жировая ткань у грызунов включает в себя мезентериальную (располагается по ходу кишечника), забрюшинную (располагается за почками) и эпидимальную (располагается вдоль семенников) жировую ткань [10].
В теменной области черепа животного высверливали отверстие (S ≈ 1 см2), твердую мозговую оболочку в пределах отверстия удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2P-O4 1.2; глюкоза 11.5; pH 7.4), аэрированного карбогеном. Раствор для орошения, как и все другие применяемые растворы, в течение всего эксперимента содержался в медицинском водяном термостате (TW-2, SIA “ELMI”, Латвия) при температуре 37°C. На протяжении всего эксперимента контролировали среднее артериальное давление, показатели которого в течение всего эксперимента оставались примерно на одном уровне. Прямое измерение артериального давления производили через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур, https://www.argonmedical.com), подключенным к АЦП, входящему в состав микроконтроллера фирмы STMicroelectronics (США), выход которого был подключен к компьютеру через порт USB. Для работы устройства с компьютером в нашей лаборатории была разработана оригинальная программа визуализации значений артериального давления. Расчет среднего артериального давления в реальном времени производился программой по классической формуле:
Температуру тела животного поддерживали на уровне 38°C. Контроль за ректальной температурой осуществлялся с помощью лабораторного термометра ТТЖ-М, (ОАО “Стеклоприбор”, Украина).
Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (“Микромед”, Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии “Photo M” (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru) определяли количество артерий и общее количество микрососудов на определенной площади. Затем измеряли диаметры пиальных артерий. В ходе эксперимента у каждого животного было исследовано более 40 пиальных артерий. Диаметры артерий измеряли в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса и при орошении мозга раствором ацетилхолина (AСh) (10–7 М) (Sigma-Aldrich, США). Все исследованные пиальные артерии были разбиты на группы в соответствии с исходным диаметром: 60–80, 40–60, 20–40, менее 20 мкм. О результатах воздействия ACh судили по количеству расширившихся сосудов и по степени их расширения. Степень дилатации ΔД оценивали как разность между значениями диаметра после (Д2) и до (Д1) воздействия ACh относительно диаметра сосуда Д1 перед воздействием ACh, %: ΔД = (Д2 – Д1)/Д1 × 100. Изменения диаметра пиальной артерии в течение 20 мин при орошении поверхности мозга раствором Кребса составляют ±5%, поэтому считали, что реакция на воздействие отсутствует, если ΔД не превышает 5% [11].
Последующий ход эксперимента: поверхность головного мозга в течение 20 мин отмывали от AСh раствором Кребса. Затем на 5 мин на пиальную оболочку наносили раствор неселективного блокатора NO-синтаз L-NAME (N(ω)-nitro-l-arginine methyl ester, Sigma-Aldrich, 100 мкМ), а затем на фоне действия L-NAME наносили AСh. В другой серии экспериментов вместо L-NAME наносили раствор аминогуанидина (Aminoguanidine hydrochloride, Sigma-Aldrich, 10–3 М), являющегося селективным ингибитором iNOS. Далее проводили описанные выше измерения.
Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследования показали, что потребление высокожирового корма на протяжении 3 мес. (Группа 2, ВЖД) привело к значительному повышению удельного веса висцерального жира (4.41 ± 0.42% против 2.28 ± 0.25% в контроле, p ≤ 0.05), достоверному относительно контрольной группы повышению уровня глюкозы в крови (10.8 ± 0.8 ммоль/л относительно 5.6 ± 0.1 ммоль/л, p ≤ 0.001), развитию инсулинорезистентности (площадь под кривой “концентрация глюкозы в крови–время (120 мин)” была на 14% больше, чем у контрольных крыс). При этом тест на толерантность к глюкозе не выявил статистически значимой разницы между площадью под кривой “концентрация глюкозы в крови–время (120 мин)” у контрольных и ВЖД крыс, содержащихся на ВЖД. Применение панкреотоксичного препарата стрептозотоцина на фоне ВЖД (Группа 3, СД2) привело к подъему уровня глюкозы в среднем до 16 ± 0.9 ммоль/л (p ≤ 0.001), формированию у животных инсулинорезистентности и толерантности к глюкозе (площадь под кривой “концентрация глюкозы в крови–время (120 мин)” была соответственно на 223 и 101% больше, чем у контрольных крыс, повышению удельного веса висцерального жира до 5.32 ± 0.24% (p ≤ 0.001). Среднее артериальное давление у крыс ВЖД и СД2 составляло 125.7 ± 2 и 128.5 ± 1.9 мм рт. ст. соответственно.
ВЖД (Группа 2) привела к статистически значимому уменьшению числа пиальных артериальных сосудов, ответивших увеличением диаметра на воздействие AСh (табл. 1) – в среднем в 1.2–1.6 раза в зависимости от диаметра сосудов. У крыс с СД2 количество дилатирующих на AСh артерий было значительно меньше, чем у контрольных животных (Группа 1) (в среднем в 1.6–2.3 раза) и чем у крыс ВЖД (Группа 2) (в среднем в 1.2–1.9 раза).
Таблица 1.
Число расширившихся пиальных артерий под воздействием AСh, AСh на фоне действия L-NAME и AСh на фоне действия аминогуанидина в разных группах экспериментальных животных
| Группа животных |
Воздействие | Число расширившихся артерий, % | |||
|---|---|---|---|---|---|
| 60–80 мкм | 40–60 мкм | 20–40 мкм | ≤ 20 мкм | ||
| Группа 1 контроль |
ACh | 46.4 ± 3.9 | 55.2 ± 2.8 | 64.7 ± 2.5 | 80.2 ± 2.3 |
| AСh/L-NAME | 26 ± 6.7 | 18.7 ± 2.4••• | 22.3 ± 2••• | 20 ± 3.2••• | |
| Группа 2 ВЖД |
ACh | 34.1 ± 4.4* | 39.7 ± 3.9** | 52.5 ± 1.9*** | 50.7 ± 4.4*** |
| AСh/L-NAME | 22 ± 6.3 | 28.4 ± 5.9 | 29.4 ± 1.7• | 21 ± 11.3• | |
| Группа 3 СД2 |
ACh | 29.4 ± 5.3* | 29.2 ± 3.9** | 28.7 ± 4.3*** | 34.5 ± 4.7*** |
| AСh/L-NAME | 10.6 ± 2.9• | 24 ± 7.2 | 29. 2 ± 6.2 | 33.6 ± 5.6 | |
* – Изменения значимы по сравнению с соответствующими значениями у контрольных животных (*р < 0.05, ** < 0.01, ***р < 0.001 , критерий Тьюки). • – Изменения значимы по сравнению с числом расширений на воздействие ACh в этой же группе животных у артерий такого же диаметра (•р < 0.05, •••р < 0.001, критерий Тьюки).
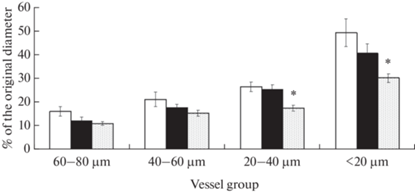
У крыс ВЖД степень расширения пиальных артерий под воздействием AСh была примерно такой же, как и у животных из контрольной группы (рис. 1). В группе СД2 наблюдали статистически значимое уменьшение степени расширения артерий по сравнению с контролем у мелких сосудов (исходный диаметр менее 40 мкм).
Рис. 1.
Дилататорная реакция пиальных артерий различных диаметров на воздействие ACh: – степень расширения сосудов (% от исходного диаметра). Светлая заливка– контрольные животные (Группа 1); темная заливка – животные ВЖД (Группа 2), штриховка – животные с СД2 (Группа 3). По оси абсцисс – группы сосудов разного диаметра; по оси ординат – степень расширения артерий на воздействие AСh (%) относительно исходного диаметра, который был принят за 100%. Изменения значимы по сравнению с соответствующими значениями у контрольных животных (*р < 0.05, критерий Тьюки).
Число расширившихся пиальных артерий на AСh на фоне действия неселективного блокатора NO-синтаз L-NAME в контрольной группе было снижено в 3–4 раза по сравнению с воздействием одного AСh, исключая самые крупные сосуды (табл. 1). У животных ВЖД статистически значимая разница между этими показателями была выявлена у сосудов диаметром менее 40 мкм. У животных с СД2 не наблюдали статистически значимой разницы между числом расширившихся артерий под воздействием только AСh и AСh на фоне L-NAME (за исключением артерий с исходным диаметром 60–80 мкм). В контрольной группе степень расширения пиальных артерий на воздействие AСh на фоне L-NAME по сравнению с действием одного AСh статистически значимо уменьшалась у сосудов с исходным диаметром менее 40 мкм (рис. 2). У животных ВЖД и СД2 все исследованные артерии расширялись примерно одинаково и на один AСh и на AСh на фоне действия L-NAME.
Рис. 2.
Дилататорная реакция пиальных артерий различных диаметров на воздействие AСh на фоне действия неселективного блокатора NO-синтаз L-NAME: – степень расширения сосудов (% от исходного диаметра). Светлая заливка – артерии диаметром 60–80 мкм, темная заливка – артерии диаметром 40–60 мкм, темная штриховка на светлом фоне – артерии диаметром 20–40 мкм, светлая штриховка на темном фоне – артерии диаметром менее 20 мкм. По оси абсцисс – группы сосудов разного диаметра: группа 1 – контрольные животные; группа 2 – животные ВЖД; группа 3 – животные с СД2. По оси ординат – степень расширения артерий на воздействие AСh и AСh на фоне L-NAME (%). Изменения значимы для артерий одинакового диаметра из одной и той же группы животных (**р < 0.01, ***р < 0.001, критерий Тьюки).
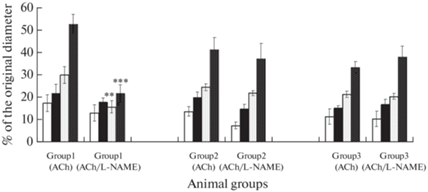
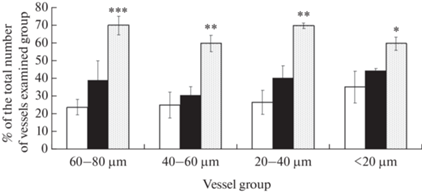
Рис. 3 иллюстрирует влияние селективного блокатора индуцибельной NO-синтазы аминогуанидина на пиальные артерии у животных из экспериментальных групп. Под воздействием аминогуанидина у контрольных животных уменьшается диаметр примерно 1/3 всех исследованных пиальных артерий. Примерно такое же число сузившихся сосудов и в группе ВЖД. У крыс с развившемся СД2 число констрикций на аминогуанидин резко возрастает и достигает 60–70%.
Рис. 3.
Констрикторная реакция пиальных артериальных сосудов различных диаметров на воздействие аминогуанидина: – число констрикций (% от общего числа исследованных сосудов). Светлая заливка – контрольные животные (Группа 1); темная заливка – животные ВЖД (Группа 2), штриховка – животные с СД2 (Группа 3). По оси абсцисс – группы сосудов разного диаметра; по оси ординат – число сузившихся на воздействие аминогуанидина артерий относительно общего числа сосудов в группе (%). Изменения значимы по сравнению с соответствующими значениями у контрольных животных (*р < 0.05, **р < 0.01, ***р < 0.001, критерий Тьюки).
Аминогуанидин не влияет на AСh-зависимую дилататорную реакцию пиальных артерий у животных из всех экспериментальных групп.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К настоящему времени патогенез сосудистых осложнений СД2 в головном мозге остается до конца не решенной проблемой. Основная роль в развитии диабетических ангиопатий отводится эндотелиальной дисфункции, которая приводит к нарушению регуляции сосудистого тонуса и ауторегуляции мозгового кровотока [12]. К эндотелиальной дисфункции ведет инсулинорезистентность, характерная и для МС и для СД2. В норме инсулин активирует фосфатил-инозитол-3-киназу в эндотелиальных клетках мелких сосудов, что приводит к экспрессии гена эндотелиальной NO-синтазы (еNOS) и высвобождению NO – инсулин-обусловленная вазодилатация [13]. Избыточный инсулин активирует митогенактивируемую протеинкиназу, которая, в свою очередь, стимулирует выработку различных ростовых факторов, запускающих пролиферацию и миграцию гладкомышечных клеток в стенке артерий [14]. Это приводит к повышению сосудистого тонуса и ремоделированию церебральной сосудистой системы.
В представленном исследовании нахождение на ВЖД и развитие СД2 у крыс привело к угнетению AСh-опосредованной дилатации пиальных артериальных сосудов (табл. 1): по сравнению с контролем у животных из Группы 2 (ВЖД) в среднем в 1.2–1.6 раза, в зависимости от диаметра сосудов, уменьшилось число дилатаций при аппликации на поверхность головного мозга AСh; в Группе 3 (СД2) – в среднем в 1.6–2.3 раза. Полученные данные подтверждают, что повреждение клеток интимы в церебральных артериях и развитие эндотелиальной дисфункции происходит и при метаболических нарушениях (ВЖД) [15] и при более серьезных гормональных патологиях (СД2) [16]. При этом в большей мере страдают мелкие артерии диаметром менее 40 мкм, у которых уменьшается и число дилатаций и степень расширения сосудов (рис. 1).
В нормальных условиях AСh, связываясь с мускариновыми рецепторами эндотелиальных клеток, запускает реакцию окисления аминокислоты L-аргинина с образованием NO и L-цитруллина. Катализатором данного процесса выступает еNOS. Применение блокатора NOS L-NAME у контрольных животных привело к уменьшению числа дилатирующих на воздействие AСh артерий в 2–4 раза (табл. 1) и уменьшению степени расширения сосудов с исходным диаметром 20–40 мкм и менее 20 мкм на 11 и 20% соответственно (рис. 2). В группе животных ВЖД статистически значимое уменьшение числа дилатаций на AСh на фоне действия L-NAME было отмечено у сосудов диаметром менее 40 мкм (табл. 1). У более крупных артерий число дилатаций статистически значимо не изменялось, как не изменялась и степень расширения всех исследованных сосудов у крыс ВЖД. Это свидетельствует о незначительной роли каскада L-аргинина/еNOS/NO в сосудистой регуляции пиальных артерий. У крыс с СД2 применение L-NAME не вызвало статистически значимых изменений в AСh-опосредованной дилатаций ни по числу расширившихся артерий (табл. 1), ни по степени их расширения (рис. 2). Отсутствие реакции на воздействие L-NAME объяснить достаточно сложно, хотя такие экспериментальные наблюдения у животных с СД отмечены в литературе [17, 18]. При гипергликемии активируется протеинкиназа С, окислительный стресс и метаболизм гексозаминов, что приводит к понижению экспрессии/активности еNOS [19]. П-оказано, что инсулинорезистентность понижала уровень еNOS на эндотелиальных клетках на 60% по сравнению с контролем [20]. Также уменьшение количества еNOS происходит из-за увеличения продукции активных форм кислорода [21]. Следовательно, при СД2 уровнь еNOS понижен и реакция ингибирования этого фермента с помощью L-NAME мало выражена. Можно предположить, что при наличии ярко выраженной эндотелиальной дисфункции у крыс с СД2, особенно в мелких артериях, каскад L-аргинина/еNOS/NO в эндотелиальных клетках принимает незначительное участие в формировании дилататорного ответа на AСh.
При СД2 отмечено повышение экспрессии iNOS в головном мозге (в макрофагах, ГМК, нейронах, глии) [7]. Отсутствие ингибирования iNOS неселективным блокатором L-NAME отмечено и в литературе [18, 22] именно при СД или при аллергических реакциях [23]. Авторы предполагают, что при развитии тканевого воспаления с выделением большого количества iNOS обычных концентраций раствора L-NAME (100 мкМ), который применяется для работы с контрольными животными, не хватает для того, чтобы заблокировать всю iNOS. Вероятно, из-за совокупности этих факторов в представленной работе и не было выявлено реакции L-NAME на эндотелий-зависимую дилатацию церебральных артерий у животных с СД2.
Роль iNOS в формировании сосудистого тонуса мозговых артерий у крыс ВЖД и СД2 изучена недостаточно. В немногочисленных работах показано, что iNOS может влиять на тонус и проницаемость церебральных сосудов [24, 25]. Ингибирование активности iNOS селективным блокатором аминогуанидином у крыс из контрольной группы вызвало минимальную констрикторную реакцию (рис. 3). Следовательно, реакции с iNOS у контрольных животных не принимают участие в формировании и поддержании сосудистого тонуса в головном мозге. Отсутствие влияния аминогуанидина на степени расширения артерий при воздействии AСh (рис. 4) демонстрировало только то, что селективный блокатор iNOS не вызывает отрицательной реакции по ингибированию еNOS у контрольных животных. У крыс из Группы 2 (ВЖД) также не выявлено значимого констрикторного ответа на воздействие аминогуанидина (рис. 3) и уменьшение степени AСh-опосредованной дилатации (рис. 4). Потенциально селективные ингибиторы iNOS могут быть использованы в качестве терапевтического средства, предотвращающего чрезмерную выработку NO при метаболическом синдроме и СД [18, 22].
Рис. 4.
Дилататорная реакция пиальных артерий различных диаметров на воздействие AСh на фоне действия селективного блокатора индуцибельной NO-синтазы аминогуанидина: — степень расширения сосудов (% от исходного диаметра). Светлая заливка – артерии диаметром 60–80 мкм, темная заливка – артерии диаметром 40–60 мкм, темная штриховка на светлом фоне – артерии диаметром 20–40 мкм, светлая штриховка на темном фоне – артерии диаметром менее 20 мкм. По оси абсцисс – группы сосудов разного диаметра: группа 1 – контрольные животные; группа 2 – животные ВЖД; группа 3 – животные с СД2. По оси ординат – степень расширения артерий на воздействие AСh и AСh на фоне L-NAME (%). Значимых изменений для артерий одинакового диаметра из одной и той же группы животных не выявлено.

У крыс с СД2 на воздействие аминогуанидина сужением ответило 60–70% всех исследованных пиальных артерий (рис. 3). Эти данные свидетельствуют о том, что именно реакции с участием iNOS контролируют сосудистый тонус церебральных артерий у животных с СД2 и не затрагивают сигнальный путь L-аргинина/еNOS/NO в эндотелиальных клетках (рис. 4), что также указывает на возможность использования селективных блокаторов iNOS в терапевтических целях при СД2.
Итак, потребление в течение 3 месяцев корма с высоким содержанием жира привело к развитию эндотелиальной дисфункции в пиальных артериях сенсомоторной коры головного мозга. AСh-опосредованная дилатация определялась реакциями с участием еNOS в артериях диаметром менее 40 мкм. У крыс, находящихся только на высокожировой диете, в церебральных артериях не выявили наличия iNOS.
Повышение уровня глюкозы в крови животных с СД2 приводило к прогрессированию эндотелиальной дисфункции: число расширившихся на воздействие AСh сосудов было меньше в 1.2–1.9 раза, чем у животных на ВЖД. При этом сигнальный каскад с участием еNOS не контролировал реактивность артерий. Поддержание сосудистого тонуса в основном происходило за счет реакций с участием iNOS. Основные нарушения в дилататорной реакции у крыс с СД2 – наименьшее число расширившихся на воздействие чистого AСh сосудов со значительным уменьшением степени дилатации (в 1.5–1.6 раза относительно контроля), отсутствие блокировки AСh-опосредованной дилатации на фоне L-NAME, наибольшее число констрикций при воздействии аминогуанидина (60–70% от всех исследованных сосудов) – были выявлены в пиальных артериях диаметром менее 40 мкм, т.е. именно в том звене сосудистой сети, которое принимает максимальное участие в газообмене между кровью и тканью.
Список литературы
Gustafson B, Hammarstedt A, Andersson CX, Smith U (2007) Inflamed adipose tissue: a culprit underlying the metabolic syndrome and atherosclerosis. Arterioscler Thromb Vasc Biol 27(11): 2276–2283. https://doi.org/10.1161/ATVBAHA.107.147835
Yang Q, Vijayakumar A, Kahn B (2018) Metabolites as regulators of insulin sensitivity and metabolism. Nat Rev Mol Cell Biol 19(10): 654–672. https://doi.org/10.1038/s41580-018-0044-8
Begum N (2003) Insulin signaling in the vasculature. Front Biosci 8: s796–804. https://doi.org/10.2741/1146
Weber S, Patel R, Lutsep H (2018) Cerebral amyloid angiopathy: diagnosis and potential therapies. Expert Rev Neurother 18(6): 503–513. https://doi.org/10.1080/14737175.2018.1480938
Madonna R, Balistreri C, Geng Y, Caterina R (2017) Diabetic microangiopathy: pathogenetic insights and novel therapeutic approaches. Vascular Pharmac 90: 1–7. https://doi.org/10.1016/j.vph.2017.01.004
Shi Y, Vanhoutte P (2017) Macro- and microvascular endothelial dysfunction in diabetes. J Diabetes 9: 434–449. https://doi.org/10.1111/1753-0407.12521
Elhessy H, Eltahry H, Erfan O, Mahdi M, Hazem N, El-Shahat M (2020) Evaluation of the modulation of nitric oxide synthase expression in cerebellum of diabetic albino rats and the possible protective effect of ferulic acid. Acta Histochem 122(8): 151633. https://doi.org/10.1016/j.acthis.2020.151633
Кайдаш ОА, Иванов ВВ, Венгеровский АИ, Буйко ЕЕ, Щепеткин ИА (2020) Экспериментальная модель сахарного диабета 2-го типа у крыс, вызванная диетой с высоким содержанием жиров и стрептозотоцином в низкой дозе. Бюл сибирск мед 19(2): 41–47. [Kaydash OA, Ivanov VV, Vengerovsky AI, Buyko EE, Schepetkin IA (2020) The experimental model of type 2 diabetes mellitus caused by a high-fat diet with low-dose streptozotocin in rats. Bull Siber Med 19(2): 41–47. (In Russ)].https://doi.org/10.20538/1682-0363-2020-2-41-47
Srinivasan K, Viswanad B, Asrat L, Kaul C, Ramarao P (2005) Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: A model for type 2 diabetes and pharmacological screening. Pharmacol Res 52: 313–320. https://doi.org/10.1016/j.phrs.2005.05.004
Якимов ИЮ, Бородин ДА, Подрезов ИК, Иванов ВВ, Васильев ВН, Котловский МЮ, Борисов ЛВ, Мильто ИВ (2015) Морфометрические параметры белой жировой ткани разной локализации у крыс при высокожировой диете. Совр пробл науки и образов 5. [Yakimovich IY, Borodin DA, Podrezov IK, Ivanov VV, Vasilyev VN, Kotlovsky MY, Borisova LV, Milto IV (2015) White adipose tissue morphometric characteristics in hi-fat diet rats. Modern Probl Sci Educat 5. (In Russ)].
Шуваева ВН, Горшкова ОП (2021) Возрастные изменения вклада NO и калиевых каналов в дилатацию пиальных артериальных сосудов у крыс. Рос физиол журн им И М Сеченова 107(11): 1440–1452. [Shuvaeva VN, Gorshkova OP (2021) Age Changes in the Contribution of NO and Potassium Channels to the Dilation of the Pial Arterial Vessels in Rats. Russ J Physiol 107(11): 1440–1452. (In Russ)]. https://doi.org/10.31857/S0869813921110091
Domingueti C, Dusse L, Carvalho M, Sousa L, Gomes K, Fernandes A (2016). Diabetes mellitus: the linkage between oxidative stress, inflammation, hypercoagulability and vascular complications. J Diabetes Complicat 30: 738–745. https://doi.org/10.1016/j.jdiacomp.2015.12.018
Haratz S, Tanne D (2011) Diabetes, hyperglycemia and the management of cerebrovascular disease. Current Opinion Neurol 24(1): 81–88. https://doi.org/10.1097/WCO.obo13e3283418fed
Ding Y, Vaziri N, Coulson R, Kamanna V, Roh D (2000) Effects of stimulated hyperglycemia, insulin, and glucagon on endothelial nitric oxide synthase expression. Am J Physiol Endocrinol Metab 279(1): E11–E17. https://doi.org/10.1152/ajpendo.2000.279.1.E11
Arshad N, Lin T, Yahaya M (2018) Metabolic syndrome and its effect on the brain: possible mechanism. CNS Neurol Disord Drug Targeta 17(8): 595–603. https://doi.org/10.2174/1871527317666180724143258
Zhou H, Zhang X, Lu J (2014) Progress on diabetic cerebrovascular diseases. Bosn J Basic Med Sci 14(4): 185–190. https://doi.org/10.17305/bjbms.2014.4.203
Hein T, Omae T, Xu W, Yoshida A, Kuo L (2020) Role of arginase in selective impairment of endothelium-dependent nitric oxide synthase-mediated dilation of retinal arterioles during early diabetes. Invest Ophthalmol Visual Sci 61(5): 36. https://doi.org/10.1167/iovs.61.5.36
Kadoi Y, Goto F (2007) Effect of selective iNOS inhibition on systemic hemodynamics and mortality rate on endotoxic shock in streptozotocin-induced diabetic rats. Shock 28(5): 602–609. https://doi.org/10.1097/SHK.0b013e31804d452d
Toda N, Imamura T, Okamura T (2010) Alteration of nitric oxide-mediated blood flow regulation in diabetes mellitus. Pharmacol Ther 127(3): 189–209. https://doi.org/10.1016/j.pharmthera.2010.04.009
Vicent D, Ilany J, Kondo T, Naruse K, Fisher S, Kisanuki Y, Bursell S, Yanagisawa M, King G, Kahn C (2003) The role of endothelial insulin signaling in the regulation of vascular tone and insulin resistance. J Clin Invest 111: 1373–1380. https://doi.org/10.1172/JCI15211
Фатеева ВВ, Воробьева ОВ (2017) Оксид азота: от механизма действия к фармакологическим эффектам при цереброваскулярных заболеваниях. Журн неврол психиатрии им СС Корсакова 117(10): 131–135. [Fateeva VV, Vorob’eva OV (2017) Nitric oxide: from the mechanism of action to pharmacological effects in cerebrovascular diseases. Zhurn Nevrol Psikhiatr im SS Korsakova 117(10): 131–135. (In Russ)]. https://doi.org/10.17116/jnevro2017117101131-135
Strunk V, Hahnenkamp K, Schneuing M, Schneuing M, Fischer L, Rich G (2001) Selective iNOS inhibition prevents hypotension in septic rats while preserving endothelium-dependent vasodilation. Anesth Anal 92: 681–687. https://doi.org/10.1213/00000539-200103000-00025
Antosova M, Strapkova A, Mikolka P, Mokry J, Medvedova I, Mokra D (2015) The influence of L-NAME on iNOSexpression and markers of oxidative stressin allergen-induced airway hyperreactivitym. Advs Exp Med Biol–Neurosci Respirat 7: 1–10. https://doi.org/10.1007/5584_2014_62
Nassi A, Malorgio F, Tedesco S, Cignarella A, Gaion R (2016) Upregulation of inducible NO synthase by exogenous adenosine in vascular smooth muscle cells activated by inflammatory stimuli in experimental diabetes. Cardiovasc Diabetol 15: 32.https://doi.org/10.1186/s12933-016-0349-x
Barrett E, Liu Z, Khamaisi M, King G, Klein R, Klein B, Hughes T, Craft S, Freedman B, Bowden D, Vinik A, Casellini C (2017) Diabetic microvascular disease: an endocrine society scientific statement. J Clin Endocrinol Metab 102(12): 4343–4410.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


