Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1094-1113
Рецептор тиреотропного гормона: роль в развитии тиреоидной патологии и перспективная мишень для ее коррекции
Е. А. Фокина a, *, А. О. Шпаков a
a Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: fokina-katrina@yandex.ru
Поступила в редакцию 10.08.2022
После доработки 12.08.2022
Принята к публикации 12.08.2022
- EDN: RKOYEM
- DOI: 10.31857/S0869813922090060
Аннотация
Одним из ключевых компонентов, ответственных за ответ щитовидной железы на стимуляцию тиреотропным гормоном (ТТГ), является рецептор ТТГ, относящийся к суперсемейству G-белок-сопряженных рецепторов. Связывание ТТГ или стимулирующих аутоантител с внеклеточным доменом рецептора ТТГ приводит к запуску множества сигнальных путей в клетках-мишенях, которые реализуются через различные типы G-белков и β-аррестины. Ингибирующие аутоантитела, напротив, подавляют активность рецептора ТТГ, индуцируя гипотиреоидные состояния. Активирующие мутации приводят к конститутивно активным формам рецептора ТТГ и могут стать триггером онкологических заболеваний. В соответствии с этим, рецептор ТТГ является одной из ключевых мишеней для регуляции функций щитовидной железы и тиреоидного статуса, а также для коррекции заболеваний, обусловленных изменением активности рецептора ТТГ (аутоиммунные гипертиреоз и гипотиреоз, офтальмопатия Грейвса, тиреоидный рак). Препараты ТТГ исключительно редко применяются в медицине, что обусловлено их иммуногенностью и серьезными побочными эффектами. Наибольшие перспективы связывают с разработкой низкомолекулярных аллостерических регуляторов рецептора ТТГ с активностью полных и инверсионных агонистов и нейтральных антагонистов. Они способны проникать в аллостерический сайт, расположенный в трансмембранном домене рецептора ТТГ, и специфично связываться с ним, контролируя, тем самым, способность рецептора взаимодействовать с G-белками и β-аррестинами. Аллостерические регуляторы не влияют на связывание ТТГ и аутоантител с рецептором, что создает возможности для мягкой и селективной регуляции функций щитовидной железы без критических изменений уровня ТТГ и тиреоидных гормонов. Современному состоянию проблемы регуляции активности рецептора ТТГ, в том числе с помощью лигандов его аллостерических сайтов, посвящен настоящий обзор.
ВВЕДЕНИЕ
Широкая распространенность тиреоидной патологии в человеческой популяции делает проблему поиска эффективных подходов для ее коррекции чрезвычайно актуальной. Встречаемость дисфункций щитовидной железы (ЩЖ) в мире варьирует от 10 до 30%, в зависимости от особенностей рациона на данной территории, ее удаленности от моря, а также наличия вредных экологических воздействий [1] . Заболевания ЩЖ представляют гетерогенную группу эндокринной патологии, однако патогенез большинства из них связан с повышенной или, напротив, сниженной активностью рецептора тиреотропного гормона (ТТГ), основной мишени ТТГ в фолликулярных клетках ЩЖ, ответственных за синтез тиреоидных гормонов. Все это делает рецептор ТТГ привлекательной мишенью для разработки новых фармакологических подходов, направленных на восстановление функций ЩЖ и нормализацию тиреоидного статуса. Перед тем, как приступить к анализу структурно-функциональной организации рецептора ТТГ и механизмов регуляции его активности, кратко остановимся на заболеваниях ЩЖ и имеющихся в настоящее время путях их коррекции.
Наиболее распространенные заболевания тиреоидной системы Гипертиреоз (болезнь Грейвса)
Аутоиммунный гипертиреоз, или болезнь Грейвса, считается одной из наиболее распространенных патологий ЩЖ. Не существует единого мнения относительно факторов, безусловно приводящих к ее развитию, однако наибольшее значение среди них имеют генетическая предрасположенность и женский пол [2]. Патогенез болезни Грейвса заключается в образовании стимулирующих аутоантител к внеклеточному домену рецептора ТТГ, что нередко сопровождается снижением иммунной толерантности к другим компонентам системы синтеза тиреоидных гормонов, таким как тиреопероксидаза и тиреоглобулин. Гиперактивация рецептора ТТГ стимулирующими аутоантителами приводит к неконтролируемому повышению уровня тиреоидных гормонов в крови пациента с последующей реализацией их системных метаболических эффектов на ткани-мишени, что приводит к клинической картине гипертиреоза.
Лечение болезни Грейвса связано в основном с эрадикацией избытка гормонов, либо путем блокирования их синтеза, либо путем уменьшения объема ткани ЩЖ. Все используемые подходы сопряжены с рядом осложнений. Несмотря на то, что производные тионамида, представляющие собой наиболее широко применяемую группу антитиреоидных препаратов, обладают благоприятным профилем безопасности, их применение приводит к ряду нежелательных побочных эффектов, таким как агранулоцитоз, васкулиты, поражение печени, кожные реакции [3]. Помимо этого, лечение антитиреоидными препаратами не позволяет избежать высокого риска рецидива основного заболевания в течение двух лет после отмены терапии [4]. Радиойодтерапия, которая является следующей ступенью в стратегии лечения болезни Грейвса, характеризуется отсроченным эффектом, что вызывает потребность одновременно с ней назначать антитиреоидные препараты [5]. Хирургическое лечение сопряжено с рисками осложнения оперативного вмешательства, такими как кровотечение, инфекционные осложнения, эстетические дефекты, паралич гортанного нерва, гипопаратиреоз [6]. Кроме того, пациенты, перенесшие тотальную тироидэктомию, вынуждены пожизненно принимать препараты L-тироксина в связи со значительно выраженным послеоперационным гипотиреозом.
Такое разнообразие побочных эффектов и не всегда простые пути их коррекции создают острую необходимость в поиске качественно новых фармакологических подходов для лечения гипертиреоидных состояний. Наиболее интересной представляется так называемая таргетная терапия, которая позволяет воздействовать на конкретное звено патогенеза, в частности – на рецептор ТТГ, мишень стимулирующих рецептор ТТГ аутоантител. Среди таких подходов рассматриваются применение аутоантител, способных блокировать рецептор ТТГ, а также низкомолекулярные аллостерические антагонисты этого рецептора. Препараты аутоантител к рецептору ТТГ находятся на разных фазах клинических испытаний и позиционируются как весьма перспективная группа антитиреоидных препаратов [7]. Аллостерические регуляторы, модифицирующие активность рецептора ТТГ, будут рассмотрены далее и более подробно.
Гипотиреоз
Предрасполагающими факторами к развитию гипотиреоза, в том числе аутоиммунного, являются отягощенный семейный анамнез, женский пол, но наибольший вклад в развитие этой патологии ЩЖ вносит дефицит алиментарного йода. Сочетание факторов приводит к выработке аутоантител к различным звеньям синтеза тиреоидных гормонов, в том числе – к рецептору ТТГ [8] . Классическим подходом для лечения гипотиреоза любой этиологии является заместительная терапия препаратами тиреоидных гормонов, в первую очередь L-тироксином. Заместительная терапия является относительно безопасной, и побочные эффекты, как правило, обусловлены передозировкой и ятрогенным избытком тироксина [9]. Следует, однако, отметить, что часть пациентов с гипотиреозом имеют индивидуальную непереносимость к препаратам тироксина, что затрудняет их лечение в связи с отсутствием альтернативных подходов.
Перспективными подходами, способными стать альтернативой существующему стандарту терапии, является создание селективных агонистов рецепторов тиреоидных гормонов [10] и аллостерических агонистов рецептора ТТГ [11]. Механизм действия агонистов рецепторов тиреоидных гормонов состоит в специфичном связывании с β-изоформой этих рецепторов, следствием чего является потенцирование физиологических эффектов тиреоидных гормонов – тироксина и трийодтиронина. Однако для некоторых тиромиметиков уже на ранних этапах клинических исследований были показаны отчетливо выраженные токсические эффекты, обусловленные разрушением хрящевой и костной ткани [12]. Помимо этого, применение агонистов рецепторов тиреоидных гормонов связано со значительным риском развития осложнений со стороны сердечно-сосудистой системы. Селективные аллостерические агонисты рецептора ТТГ являются малоизученной, но при этом очень интересной группой препаратов, спектр клинического применения не ограничивается гипотиреозом и может быть расширен на различные метаболические заболевания, сопровождающиеся ослаблением функций ЩЖ, такие как ожирение и сахарный диабет различной этиологии. Они будут рассмотрены в соответствующем разделе.
РЕЦЕПТОР ТИРЕОТРОПНОГО ГОРМОНА КАК ПРЕДСТАВИТЕЛЬ СУПЕРСЕМЕЙСТВА GPCR
Рецептор ТТГ относится к большому суперсемейству рецепторов, сопряженных с гетеротримерными G-белками (GPCR). Общей их особенностью является наличие трансмембранного домена, состоящего из семи гидрофобных спиральных сегментов (transmembrane helices, TMH). Несмотря на сходную топологию в мембране, аминокислотные последовательности этих ТМH и их взаимное расположение могут значительно отличаться у разных семейств GPCR, что приводит к различной конфигурации расположенных внутри трансмембранного домена сайтов [13]. Наибольшая вариабельность первичной структуры GPCR характерна для внеклеточного домена, который в случае рецептора ТТГ непосредственно связывает лиганд, а в большинстве GPCR отвечает за первичное опознавание лиганда. Расположенные в цитоплазме внутриклеточные петли GPCR ответственны за активацию гетеротримерных G-белков, функциональное взаимодействие с β-аррестинами и другими регуляторами GPCR-сигналинга, а также являются мишенями GPCR-специфичных протеинкиназ. В настоящее время у человека выявлено до 800 GPCR, функции которых простираются от контроля зрительной функции и вкуса до регуляции репродуктивных и метаболических процессов и нейротрансмиссии. Именно поэтому GPCR являются наиболее популярной терапевтической мишенью при лечении множества патологий, и более 30% всех фармакологических препаратов прямо или опосредованно действуют на эти рецепторы [14].
Суперсемейство GPCR можно разделить на подсемейства на основе филогенетического анализа их первичных структур, а также топологии рецепторов в мембране [15]. Подсемейство рецепторов гликопротеиновых гормонов включает рецепторы ТТГ и гонадотропинов – фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов, и относится к более крупному семейству A, называемому также семейством родопсина. Особенностью рецепторов ТТГ, ФСГ и ЛГ является наличие исключительно больших внеклеточных доменов (эктодоменов), содержащих до 340–420 аминокислотных остатков и включающих обогащенные остатками лейцина повторы. Эти рецепторы возникли в результате слияния двух белковых молекул – “классического” GPCR с гептагеликальным трансмембранным доменом и гидрофильного β-складчатого белка с регулярной структурой, содержащего около десяти обогащенных остатками лейцина повторов [16]. Показано, что аминокислотная последовательность рецептора ТТГ, как и рецепторов гонадотропинов, у различных представителей позвоночных животных характеризуется сравнительно высокой степенью консервативности. Значимые различия между рецепторами ТТГ, в том числе среди высших приматов, обусловлены различиями в посттрансляционных модификациях рецепторной молекулы, в первую очередь на уровне ее N-гликозилирования. При сравнении различных классов позвоночных, рыб и млекопитающих различия в первичной структуре рецептора ТТГ ожидаемо выше. При этом степень гомологии первичной структуры рецепторов ТТГ у лососевых с таковыми у млекопитающих (человек, грызуны) достаточно высокая, несмотря на 100 миллионов лет, прошедших со времени дивергенции представителей этих таксонов. В то же время различие первичной структуры этих рецепторов с таковыми у костистых рыб, напротив, очень значимое, что может быть обусловлено более высокой скоростью накопления мутаций в рецепторах ТТГ последних [17]. Большая часть различий в первичной структуре рецепторов ТТГ различных представителей позвоночных сконцентрирована в N-концевом пептиде и во внутриклеточном хвосте, в то время как внеклеточный лиганд-связывающий домен и трансмембранный домен характеризуются высокой степенью консервативности.
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ РЕЦЕПТОРА ТТГ
Внеклеточный домен (эктодомен)
Внеклеточный домен рецепторов гликопротеиновых гормонов, в том числе рецептора ТТГ, включает две отдельные области: N-концевую, содержащую обогащенные остатками лейцина повторы, и шарнирную, которая соединяет эктодомен с трансмембранным доменом. В обогащенной лейцинами N-концевой области рецептора ТТГ локализованы 11 последовательно расположенных повторяющихся сегментов длиной 20–30 аминокислотных остатков, каждый из которых состоит из β-тяжа и α-спирали. Они формируют внутреннюю полость, в которой локализован высокоаффинный (ортостерический) сайт, ответственный за связывание с гормоном [18]. Внутреннюю поверхность этой полости формируют боковые алкильные группы гидрофобных аминокислот, в то время как снаружи оказываются боковые радикалы ароматических аминокислот. Расположенный на C-конце повторяющийся сегмент содержит два остатка цистеина, которые образуют дисульфидные мостики с остатками цистеина, локализованными в шарнирной области, что приводит к стабилизации неактивной конформации рецептора ТТГ. При этом замена цистеинов на остатки серина, неспособных к образованию дисульфидных мостиков, вызывает перманентную активацию рецептора [19].
В настоящее время роль шарнирной области эктодомена рецепторов гликопротеиновых гормонов в процессе связывании гормона и трансдукции сигнала в клетку интенсивно исследуется. Эта область содержит сайты, которые способны подвергаться модификации N-гликанами и сульфатированию, что указывает на ее определяющую роль в регуляции функциональной активности рецептора [20]. В 2012 г. Jiang и соавт., изучая рецептор ФСГ, продемонстрировали критическое значение сульфатированного остатка Tyr335 в его шарнирной области как дополнительного, второго сайта для взаимодействия с ФСГ [21]. Сходную функцию эта область играет и в рецепторе ТТГ, поскольку сульфатирование Tyr385 необходимо для активации рецептора лигандом [22], причем для рецептора ТТГ шарнирная область играет ключевую роль в узнавании лиганда и обеспечивает специфичность взаимодействия ТТГ с его рецептором [23, 24]. Имеются основания считать, что шарнирная область в рецепторах ТТГ и гонадотропинов может взаимодействовать в большей степени не с β-субъединицами гормонов, которые определяют их индивидуальность, а с общими для ТТГ и гонадотропинов α-субъединицами, функции которых состоят в физическом воздействии αβ-гетеродимерного гипофизарного гормона на внеклеточные петли и трансмембранный домен рецептора. Так, после связывания рецептора с молекулой гормона шарнирная область “втягивается” в карман, расположенный между N-концевым областью, включающей лейцин-обогащенные повторы, и внешним входом в трансмембранный домен. Поскольку N-концевая часть эктодомена оказывает ингибирующее влияние на способность переходить в активированную конформацию, необходимую для передачи сигнала к гетеротримерным G-белкам и внутриклеточным эффекторам [25, 26], то разобщение эктодомена и трансмембранного домена вследствие такого втягивания шарнирной области в интерфейс между ними приводит к “снятию” ингибирующего влияния эктодомена и активации рецептора. В пользу этого механизма свидетельствует то, что удаление эктодомена рецептора ТТГ приводит к переходу рецептора в перманентно активируемую форму, нечувствительную к ТТГ и стимулирующим антителам [27]. Важную роль в реализации механизма активации рецептора ТТГ может играть меняющееся в ходе активации рецептора ТТГ местоположение небольшого декапептидного фрагмента, расположенного на C-конце шарнирной области, непосредственно перед первым трансмембранным участком (TMH1), называемым “внутренним инверсионным агонистом” [28]. Этот фрагмент встраивается между внешними концами TMH рецептора и препятствует передаче сигнала в отсутствие лиганда. При связывании рецептора с гормоном, вследствие изменения конформации шарнирной области, пептидный фрагмент извлекается из входа в трансмембранный канал рецептора, что приводит к активации сигнальной трансдукции [29]. Наряду с влиянием на активированную конформацию рецептора ТТГ в ходе его связывания с гормоном, шарнирная область может быть мишенью для стимулирующих аутоантител, образующихся при аутоиммунном гипертиреозе [30]. Аутоантитела к шарнирной области, выявляемые у некоторых пациентов с болезнью Грейвса, хотя напрямую и не активируют рецептор, но способны влиять на посттрансляционные модификации этого участка, в первую очередь на сульфатирование тирозиновых остатков и, тем самым, осуществляют модуляцию ответа рецептора ТТГ на взаимодействие со стимулирующими его аутоантителами [31].
Исключительно важную роль в функционировании рецептора ТТГ играет модификации его внеклеточной части N-гликанами по остаткам аспарагина, мишеням для N-гликозилирования [32]. N-гликаны, как правило, имеют отрицательный заряд и опосредуют эффективное связывание с молекулой ТТГ, которая также гликозилирована как по ее α-, так и по β-субъединице [33]. В N-концевом домене рецептора ТТГ, содержащем лейцин-обогащенные повторы, локализовано пять сайтов для N-гликозилирования, в то время как в шарнирной области имеется еще один такой сайт. Показано, что в функционально активном состоянии рецептор должен быть гликозилирован, по крайней мере, по четырем сайтам для N-гликозилирования [34]. Рецептор ТТГ может быть гликозилирован по аспарагину в положениях 77, 99, 113, 177, 198 и 302, среди которых Asp113 является специфичным для рецептора ТТГ человека, в то время как Asp177 – для рецепторов ТТГ других млекопитающих, в то время как остальные остатки аспарагина представляют собой эволюционно консервативные сайты для N-гликозилирования [33, 35]. Из всех сайтов наибольшее влияние на функциональную активность рецептора оказывает гликозилирование по Asp77, поскольку замена этого остатка на близкий по физико-химическим свойствам глутамин приводит к полной потере мутантным рецептором биологической активности, в то время как, например, замена остатка Asp113 на глутамин лишь снижает аффинность рецептора к гормону [36]. Судя по всему, гликозилирование по остальным сайтам заметно не влияет на сродство рецептора к лиганду и на его способность в ТТГ-связанном состоянии опосредовать повышение внутриклеточного уровня цАМФ.
Трансмембранный домен
Поскольку до настоящего времени не получено экспериментальных данных кристаллографии по рецептору ТТГ и другим рецепторам гликопротеиновых гормонов, то информация о пространственной структуре их трансмембранных доменов и о конформационных изменениях в них при связывании с гормонами базируется исключительно на гомологических моделях. Эти модели строятся на основе GPCR того же класса А, для которых имеются данные рентгеноструктурного анализа, cреди них β-адренергические и аденозиновые рецепторы, а также светочувствительный рецепторный белок родопсин [29]. На основании анализа гомологии аминокислотных последовательностей трансмембранных доменов полагают, что наиболее близким рецептору ТТГ по пространственной организации является трансмембранный домен β2-адренергического рецептора [37]. Однако это предположение имеет ряд значимых ограничений. Так, в отличие от большинства GPCR класса А высококонсервативный остаток пролина, локализованный в TMH5 (в положении 5 × 50), в рецепторе ТТГ заменен на остаток аланина [29]. Как известно, остаток пролина относится к спиралеразрушающим остаткам, и его локализация в середине TMH5 генерирует в нем жесткий излом, что способствует формированию объемистого кармана внутри трансмембранного канала, который может выступать в качестве лиганд-связывающего сайта, как это показано, например, для β-адренергических рецепторов. Отсутствие пролина в рецепторе ТТГ приводит к тому, что TMH5 в нем формирует правильную альфа-спираль без нарушающих ее целостность изгибов. Другим важным отличием рецептора ТТГ является замена характерного для GPCR класса А объемного остатка триптофана в TMH6 (в положении 6 × 48) на сравнительно небольшой метионин, что также способствует формированию более компактного кармана внутри трансмембранного канала рецептора. В пользу функциональной важности этой замены свидетельствует то, что обратная замена метионина на триптофан приводит к конститутивно активному мутантному рецептору ТТГ [29].
Трансмембранный домен играет ключевую роль в активации рецептора и передаче гормонального сигнала на трансдукторные звенья ТТГ-сигнальных путей. При этом важную роль играет изменение взаимной ориентации TMH, в первую очередь TMH6 [29, 38]. Так, для перехода в активированную конформацию наиболее важны гидрофобные взаимодействия между TMH3, TMH5 и TMH6, что обеспечивает сдвиг TMH6 кнаружи и более эффективное вовлечение интерфейсов между этой спиралью и третьей цитоплазматической петлей рецептора во взаимодействие с G-белками [39]. Определенный вклад в стабилизацию активированной конформации рецептора ТТГ вносят и гидрофильные контакты между внутренними поверхностями TMH2, TMH3, TMH6 и TMH7. Связывание рецептора с ТТГ приводит к изменению эффективности взаимодействий между гидрофильными группами аминокислотных остатков внутри трансмембранного канала, что, в свою очередь, меняет его конфигурацию и повышает способность функционально взаимодействовать с C-концевыми участками α-субъединиц G-белков, проникающих в этот канал с цитоплазматической его стороны [40].
СИГНАЛЬНЫЕ ПУТИ РЕЦЕПТОРА ТИРЕОТРОПНОГО ГОРМОНА
Рецептор ТТГ может быть активирован не только ТТГ, но также тиреостимулином [41], стимулирующими аутоантителами к рецептору ТТГ, а также трипсином, который расщепляет рецепторную молекулу, удаляя эктодомен, ингибирующий его базальную активность [42]. Наряду с этим к перманентной активации рецептора ТТГ приводят мутации в различных его локусах и делеции в области внеклеточного домена [43]. Активация рецептора ТТГ способствует его функциональному взаимодействию с различными типами гетеротримерных G-белков, относящихся к Gs-, Gi/o- и Gq/11-семействам, а также с регуляторными белками β-аррестинами [44] (рис. 1).
Рис. 1.
Сигнальные пути тиреотропного гормона в тироцитах (по [48] с изменениями). Условные обозначения: ТТГ – тиреотропный гормон; ФЛС – фосфоинозитид-специфичная фосфолипаза Сβ; ФИ3К – фосфатидилинозитол-3-киназа; ПКС – кальций-чувствительная изоформа протеинкиназы С; цАМФ – циклический АМФ; ПКА – цАМФ-активируемая серин/треониновая протеинкиназа А; CREB – транскрипционный фактор, взаимодействующий с цАМФ-респонсивным элементом; PDK1 – фосфоинозитид-зависимая киназа-1; Akt – серин/треониновая протеинкиназа В; mTOR – чувствительная к рапамицину киназа, кодируемая геном MTOR (mammalian target of rapamycin), относящаяся к семейству ФИ3К-подобных киназ; NFkB – ядерный фактор kВ; Raf – протоонкогенная серин/треониновая протеинкиназа, относящаяся к семейству митоген-активируемых протеинкиназ, продукт гена Raf1, которая фосфорилирует киназу MEK1/2; MEK1/2 – киназа митогенактивируемых протеинкиназ, которая фосфорилирует киназу ERK1/2; ERK1/2 – терминальная киназа в каскаде митогенактивируемых протеинкиназ, регулируемая внеклеточными сигналами; Elk1 – кодируемый геном Elk1 фактор тройного комплекса, функционирующий как активатор транскрипции.
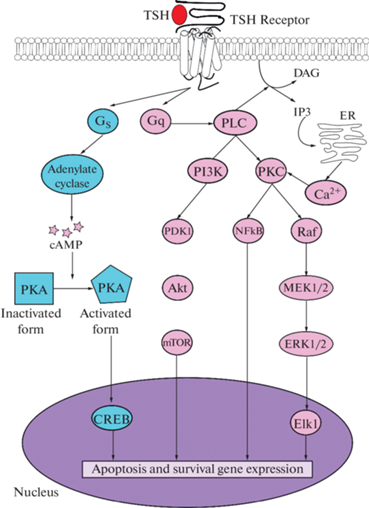
“Классическим” сигнальным путем, который запускается в результате гормональной активации рецептора ТТГ, является цАМФ-зависимый путь, который включает Gs-белок и фермент аденилатциклазу, катализирующий образование вторичного посредника – цАМФ [43] (рис. 1). Повышение внутриклеточной концентрации цАМФ приводит к активации протеинкиназы А и фосфорилированию мишеней этой киназы, в первую очередь транскрипционного фактора, который специфично связывается с цАМФ-респонсивными элементами в промоторных участках генов (cAMP response element-binding protein, CREB). Именно через активацию фактора CREB реализуются эффекты ТТГ на синтез тиреоидных гормонов, а также эффекты на рост и дифференцировку клеток-мишеней [45]. При длительном повышении уровня цАМФ активируются сигнальные каскады, опосредующие ослабление цАМФ-зависимых сигнальных путей, и один из них опосредован активацией Gi/o-белков и ингибированием ТТГ-индуцированной активности аденилатциклазы [29].
Активация рецептора ТТГ через посредство Gq/11-белков может приводить к активации фосфоинозитид-специфичной фосфолипазы Cβ (ФЛСβ) и, как следствие, к запуску кальций-зависимых и 3-фосфоинозитидных каскадов, опосредующих широкий спектр метаболических и ростовых процессов [29, 46] (рис. 1). Активация ФЛСβ приводит к усилению продукции инозитол-1,4,5-трифосфата, опосредующего выход ионов кальция из внутриклеточных депо и активацию кальций-зависимых белков и транскрипционных факторов, а также диацилглицерина, активатора форбол-чувствительных изоформ протеинкиназы С и каскада митоген-активируемых протеинкиназ. В результате реализуется широкий спектр регуляторных влияний на рост и дифференцировку клеток, а также контролируются ключевые этапы синтеза тиреоидных гормонов [47]. Следствием активации ФЛСβ также является активация фосфатидилинозитол-3-киназы (ФИ3К) – фермента, катализирующего синтез фосфатидилинозитол-3,4,5-трифосфата. Это, в свою очередь, вызывает стимуляцию активности другого нижележащего фермента – серин/треониновой протеинкиназы B (Akt-киназу), мишенями которой является большое число ферментов и транскрипционных факторов, регулирующих транскрипцию множества генов, контролирующих апоптоз и выживаемость клеток [46].
Как отмечалось выше, рецептор ТТГ может быть переведен в конститутивно активированное состояние путем замены ряда аминокислот с помощью сайт-направленного мутагенеза, причем в большинстве своем эти аминокислоты локализованы в трансмембранном домене [49]. В настоящее время обнаружены или генерированы следующие активирующие мутации, затрагивающие аминокислотные остатки, локализованные в TMH1, TMH2, TMH3, TMH6 и TMH7: V421I (TMH1), Y466A (TMH2), T501A (TMH3), L587V (TMH6), M637C (TMH6), M637W (TMH6), S641A (TMH6), Y643F (TMH6), L645V (TMH6) и Y667A (TMH7). Среди них наибольшее активирующее влияние оказывает мутация M637W (TMH6), поскольку она в наибольшей степени меняет пространственную конфигурацию трансмембранного канала, повышая эффективность взаимодействия мутантного рецептора с G-белками.
Все эти остатки в той или иной степени участвуют в формировании аллостерического сайта рецептора ТТГ, расположенного внутри его трансмембранного домена [49]. В этой связи следует отметить, что в большинстве GPCR высокоаффинный ортостерический сайт локализован либо внутри трансмембранного домена, либо в области внеклеточного входа в трансмембранный канал, в то время как низкоаффинные аллостерические сайты расположены во внеклеточных петлях рецептора. Однако в рецепторах ТТГ и гонадотропинов, которые связываются со значительными по размеру гипофизарными гликопротеиновыми гормонами, ситуация обратная, и место ортостерического сайта в трансмембранном домене занимает аллостерический сайт, в то время как ортостерический сайт вынесен во внеклеточный домен. Тем самым, в рецепторе ТТГ имеется еще один очень важный регуляторный сайт, который расположен внутри трансмембранного домена, остается свободным в случае активации рецептора гормоном (точнее, содержит связанную воду и простые ионы и может стать одной из мишеней для регуляции активности ТТГ-зависимых путей, причем как позитивной (аллостерические агонисты), так и негативной (инверсионные агонисты, нейтральные антагонисты) [50].
АЛЛОСТЕРИЧЕСКИЕ РЕГУЛЯТОРЫ РЕЦЕПТОРА ТТГ С АКТИВНОСТЬЮ АГОНИСТОВ И АНТАГОНИСТОВ
Функциональная важность рецептора ТТГ в гормональной регуляции функций ЩЖ указывает на то, что этот рецептор может стать одной из перспективных мишеней для фармакологических препаратов, предназначенных для лечения тиреоидной патологии. Среди критериев, которым должен удовлетворять такой препарат, особенно при лечении аутоиммунного гипертиреоза, могут быть выделены минимально выраженные побочные эффекты, сохранение нормальной функции ЩЖ, безопасность в отношении беременности и лактации, действие на уровне патогенеза, а также экономическая целесообразность. Препараты ТТГ в настоящее время в медицине практически не используются, поскольку не удовлетворяют большинству из приведенных выше критериев. В то же время большие перспективы связывают с регуляторами аллостерического сайта рецептора ТТГ. Здесь необходимо отметить, что сходная стратегия применяется и для поиска новых регуляторов и модуляторов рецепторов гонадотропинов, хотя в этом случае имеются препараты гонадотропинов, которые на протяжении многих лет используются в клинике при лечении репродуктивных дисфункций и во вспомогательных репродуктивных технологиях [51].
Неоспоримым преимуществом аллостерических регуляторов рецептора ТТГ является то, что они не взаимодействуют с внеклеточным ортостерическим сайтом, что не препятствует связыванию с рецептором эндогенного ТТГ. Наряду с этим, в зависимости от их структуры и особенностей взаимодействия с аллостерическим сайтом рецептора ТТГ, лиганды аллостерического сайта могут проявлять активность не только полных агонистов, как ТТГ, но и инверсионных агонистов и антагонистов, чему нет аналогов среди биогенных регуляторов. В случае лечения тиреоидной патологии востребованы лиганды аллостерического сайта рецептора ТТГ с различной активностью. Полные агонисты могут быть использованы для коррекции гипотиреоза и стимуляции закачки радиоактивного йода в тироциты при лечении рака ЩЖ. В настоящее время для повышения поглощения радиоактивного йода используют ТТГ, но это сопряжено с рядом нежелательных эффектов. В свою очередь, аллостерические инверсионные агонисты полезны для компенсации аутоиммунного гипертиреоза и офтальмопатии Грейвса, основной причиной которых являются циркулирующие в крови стимулирующие аутоантитела к рецептору ТТГ, а аллостерические нейтральные антагонисты полезны при лечении ТТГ-зависимых опухолей, в том числе нетиреоидной локализации. Важно, что обладающие активностью инверсионных агонистов и антагонистов аллостерические регуляторы рецептора ТТГ действуют мягко и лишь частично подавляют синтез тиреоидных гормонов, что предотвращает развитие острых гипотиреоидных состояний [52–54].
Однако имеется и ряд проблем при разработке аллостерических регуляторов рецептора ТТГ, среди которых наиболее существенной является их потенциальная способность взаимодействовать с трансмембранными аллостерическими сайтами рецепторов гонадотропинов, в первую очередь рецептора ЛГ, очень близкого рецептору ТТГ по структуре своего аллостерического сайта [55]. Высокая консервативность первичной структуры и пространственной организации трансмембранных аллостерических сайтов рецепторов ТТГ и гонадотропинов обусловлена тем, что мутационная изменчивость была характерна почти исключительно для эктодомена рецептора, определяющего его специфическое взаимодействие с различными изоформами гипофизарных гормонов, а также для цитоплазматических участков, вовлеченных в сопряжение с различными трансдукторными и регуляторными белками. В то же время механизм передачи сигнала к G-белкам, за который в основном отвечает трансмембранный домен, сохранялся неизменным, что и привело к эволюционной стабильности локализованного в нем аллостерического сайта [56]. Однако несмотря на структурное сходство, между аллостерическими сайтами рецепторов ТТГ и гонадотропинов имеются некоторые различия, которые могут быть использованы для создания селективных регуляторов этих сайтов. Так, трансмембранный аллостерический сайт рецептора ТТГ в отличие от наиболее близкого ему аллостерического сайта рецептора ЛГ меньше по объему и характеризуется большим числом гидрофобных аминокислотных остатков, в том числе на внешнем входе в сайт [55]. В связи с этим более гидрофильные низкомолекулярные аллостерические регуляторы рецептора ЛГ с низкой эффективностью проникают в аллостерический сайт рецептора ТТГ и имеют низкие константы связывания с ним. Так, разработанное в 2019 г. относительно гидрофобное соединение S37 с активностью аллостерического инверсионного агониста рецептора ТТГ, имеющее жесткую каркасную структуру, подавляет стимуляцию рецептора ТТГ как гормоном, так и стимулирующими антителами, но не влияет на функциональную активность рецепторов ЛГ и ФСГ [57]. Созданные нами тиенопиримидиновые производные с активностью агонистов и инверсионных антагонистов рецептора ТТГ также не влияли на активность рецептора ЛГ, как в условиях in vitro, так и in vivo [11, 52, 58, 59]. При этом по гидрофобности они существенно превосходили соответствующие производные с активностью агонистов рецептора ЛГ и имели меньший объем боковых радикалов, что полностью удовлетворяло структурным характеристикам аллостерического сайта рецептора ТТГ [11, 59].
Результаты докинга низкомолекулярных соединений, наделенных активностью in vitro и in vivo в отношении рецептора ТТГ, в аллостерический сайт рецептора указывают на то, что эти соединения взаимодействуют преимущественно с теми аминокислотными остатками, локализованными в трансмембранном аллостерическом сайте рецептора, замены которых в наибольшей степени влияют на его специфическую активность. При этом важной является эффекторная специфичность аллостерических регуляторов, поскольку они активируют или, напротив, ингибируют какие-то определенные сигнальные каскады, осуществляемые через конкретный тип G-белка или β-аррестина. Это позволяет создавать эффектор-специфичные регуляторы рецептора ТТГ, которые в отличие от самого гормона направленно запускают определенный внутриклеточный сигнальный каскад и потому реализует вполне определенный биологический эффект.
В настоящее время разработаны как полные агонисты рецептора ТТГ, так и инверсионные агонисты и нейтральные антагонисты (табл. 1).
Таблица1.
Аллостерические регуляторы рецептора ТТГ с активностью полных и инверсионных агонистов и нейтральных антагонистов
| № | Название, формула | Биологическая активность | Источник |
|---|---|---|---|
| Полные агонисты | |||
| 1 | Org41841 N-трет-бутил-5-амино-4-(3-метоксифенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамид |
Активация рецептора ТТГ и его сигнальных путей, повышение уровня цАМФ в клетках-мишенях | [55] |
| 2 | NCGC00168126–01 N-(4-(5-(3-(фуран-2-илметил)-4-оксо-1,2,3,4-тетрагидрохиназолин-2-ил)-2-метоксибензилокси)фенил)ацетамид |
[60] | |
| 3 | NCGC00161870–01 N-(4-(5-(3-бензил-5-гидрокси-4-оксо-1,2,3,4-тетрагидрохиназолин-2-ил)-2-метоксибензилокси)фенил)ацетамид |
[60] | |
| Инверсионные агонисты | |||
| 4 | NCGC00229600 2-{3-[(2,6-диметилфенокси)метил]-4-метоксифенил}-3-(пиридин-3-илметил)-2,3-дигидрохиназолин-4(1Н)-1 |
Ингибирование как конститутивной, так и стимулированной гормоном или аутоантителами активности рецептора ТТГ | [53] |
| 5 | NCGC00161856 2-{3-[(2,6-диметилфенокси)метил]-4-метоксифенил}-3-(фуран-2-илметил)-1,2-дигидрохиназолин-4(1Н)-1 |
[61] | |
| Нейтральные антагонисты | |||
| 6 | NIDDK/CEB-52 5-амино-4-(4-бромфенил)-N-трет-бутил-2(метилтио)тиено[2,3-d]пиримидин-6-карбоксамид |
Подавление активации рецептора ТТГ как ТТГ, так и стимулирующими аутоантителами при отсутствии влияния на базальную активность рецептора | [62] |
| 7 | NCGC00242595 2-{3-[(2,6-диметилфенилтио)метил]-4-метоксифенил}-3(фуран-2-илметил)-2,3-дигидрохиназолин-4(1Н)-1 |
[61] | |
Первыми разработанными и продемонстрировавшими эффективность соединениями с активностью аллостерических агонистов рецептора ТТГ стали тиенопиримидиновые производные Org41841 и Org43553, известные также как полные агонисты рецептора ЛГ [63]. Было показано, что они обладают биологическим эффектом и в отношении рецептора ТТГ, хотя и в существенно меньшей степени. На основании данных о ключевых взаимодействиях этих аллостерических регуляторов и рецептора ТТГ с помощью методов молекулярного моделирования была сконструирована первая модель трансмембранного домена рецептора ТТГ [55], которая позволила в дальнейшем разрабатывать новые низкомолекулярные лиганды этого рецептора. Так, было разработано соединение NCGC00168126–01 и его более активный аналог NCGC00161870–01, оба характеризовались высокой селективностью по отношению к рецептору ТТГ и обладали способностью стимулировать активность рецептора в отсутствие ТТГ и стимулирующих антител [50, 60].
Дальнейшие исследования были направлены на поиск соединений, обладающих активностью нейтральных антагонистов и инверсионных агонистов. Так, в 2008 г. было разработано соединение NIDDK/CEB-52, ингибирующее стимулированную гормоном и аутоантителами активность рецептора ТТГ, что позволило его классифицировать как нейтральный антагонист [62]. Впоследствии были синтезированы соединения NCGC00242595 и NCGC00242364, обладающие выраженной антагонистической активностью в отношении рецептора ТТГ [53, 64], а также соединение s37a, которое подавляло стимуляцию рецептора не только ТТГ, но и олигоклональными антителами, характерными для болезни Грейвса [57].
На основании структуры NCGC00165237–01 были разработаны инверсионные агонисты NCGC00161856 [65] и NCGC00229600 [50], которые подавляли как стимулированную, так и базальную активность рецептора ТТГ. Это было важно для подавления роста опухолей, причиной которых являются активирующие мутации в молекуле рецептора ТТГ, приводящие к его высокой конститутивной активности и неспособности стимулироваться эндогенным ТТГ.
Нами на протяжении последних нескольких лет были разработаны соединения с активностью различных аллостерических регуляторов рецептора ТТГ. Соединение 5-амино-N-(трет-бутил)-4-(4-йодофенил)-2-(метилтио)тиено[2,3-d]-пиримидин-6-карбоксамид (TP48) характеризовалось активностью инверсионного агониста [58]. Оно снижало стимулированную ТТГ продукцию тиреоидных гормонов в культуре фолликулярных клеток ЩЖ крыс линии Fisher (FRTL-5) и базальные уровни тиреоидных гормонов при внутрибрюшинном введении препарата самцам крыс в дозе 15 мг/кг. При введении соединения TP48 крысам за полчаса до обработки интраназально вводимым тиролиберином, рилизинг-фактором ТТГ, оно ингибировало стимулированное тиролиберином повышение уровней тироксина и трийодтиронина и подавляло стимулированную тиролиберином экспрессию генов Tg, TPO и Dio2, кодирующих основные белки синтеза тиреоидных гормонов в тироцитах – тиреоглобулин, основной источник тирозина для синтеза тиреоидных гормонов, тиреопероксидазу, осуществляющую йодирование тирозина и его конденсацию молекул йодтирозина в тироксин, и D2-дейодиназу, осуществляющую конверсию тироксина в трийодтиронин, эффекторный гормон тиреоидной системы.
Соединение 5-амино-N-(трет-бутил)-4-(4-(3-метоксипроп-1-ин-1-ил)фенил)-2-(метио)тиено[2,3-d]-пиримидин-6-карбоксамид (TPY1) было сходно с TP48 по способности подавлять стимулированные ТТГ синтез тиреоидных гормонов и экспрессию тиреоидогенных белков в клетках FRTL-5, а также ингибировать стимулирующие эффекты тиролиберина на продукцию тироксина и трийодтиронина при введении самцам крыс [59, 66]. Однако соединение TPY1 не влияло на базальные уровни тиреоидных гормонов и на экспрессию тиреоидогенных генов в ЩЖ крыс без обработки тиролиберином. Все вышесказанное свидетельствует о том, что TPY1 наделено активностью нейтрального антагониста, препятствующего стимуляции рецептора ТТГ гормоном, но не влияющего на собственную активность этого рецептора.
Соединение этил-2-(4-(4-(5-амино-6-(трет-бутилкарбамоил)-2-(метилтио)тиено[2,3-d]-пиримидин-4-ил)фенил)-1H-1,2,3-триазол-1-ил)ацетат (TPY3m) продемонстрировало активность полного агониста рецептора ТТГ, наделенного тиреоидогенной активностью [11]. При введении самцам крыс (15 мг/кг, внутрибрюшинно) соединение TPY3m мягко стимулировало базальные уровни гормонов ЩЖ и повышало экспрессию генов Tg, TPO и Dio2. Предварительное введение TPY3m крысам усиливало стимулирующее воздействие тиролиберина на уровень тиреоидных гормонов и экспрессию генов TPO и Dio2, а также усиливало стимулирующий эффект тиролиберина на экспрессию гена NIS, кодирующего натрий-йодидный симпортер, ответственный за поглощение йодида фолликулярными клетками ЩЖ. Существенный вклад в стимулирующий эффект TPY3m может вносить и вызываемое им повышение экспрессии гена Tshr, кодирующего рецептор ТТГ, в ЩЖ контрольных и обработанных тиролиберином крыс [11].
Наряду с аллостерическими регуляторами, взаимодействующими с трансмембранным аллостерическим сайтом, многообещающей является разработка лигандов аллостерических сайтов, локализованных в цитоплазматических петлях рецептора ТТГ, в первую очередь в его второй и третьей цитоплазматических петлях, содержащих ключевые молекулярные детерминанты, ответственные за взаимодействие с G-белками. В этом отношении перспективными являются пальмитоилированные пептидные фрагменты третьей цитоплазматической петли рецептора ТТГ, которые способны в отсутствие ТТГ стимулировать активность рецептора, меняя конформацию его цитоплазматических аллостерических сайтов и модулировать тем самым взаимодействие рецептора с G-белками [67–69].
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ АЛЛОСТЕРИЧЕСКИХ РЕГУЛЯТОРОВ РЕЦЕПТОРА ТТГ
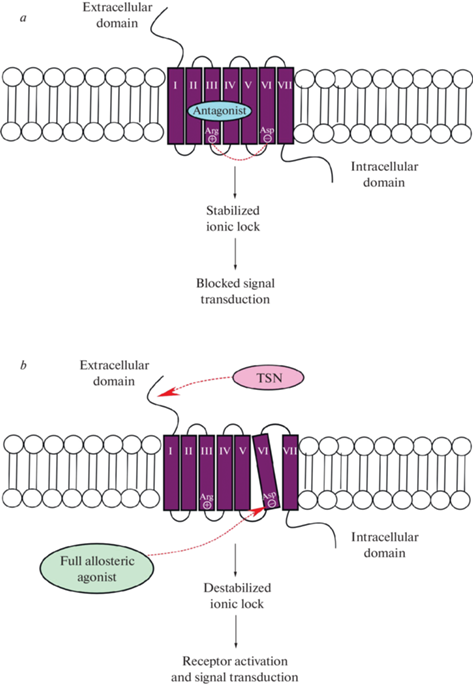
Среди возможных механизмов ингибирующего влияния аллостерических антагонистов/инверсионных агонистов рецептора ТТГ предлагается два возможных молекулярных механизма (рис. 2). Первый состоит в вызываемой аллостерическим лигандом стабилизации “ионного замка”, который представляет собой полярное взаимодействие между положительно заряженным остатком аргинина, расположенного на границе TMH3 и второй цитоплазматической петли, и отрицательно заряженными остатками глутаминовой или аспарагиновой кислот, локализованными на границе TMH6 и третьей цитоплазматической петли [64]. Основная функция “ионного замка” состоит в стабилизации неактивной конформации рецептора. Антагонист, стабилизируя “ионный замок”, препятствует конформационным изменениям, ведущим к активации рецептора ТТГ, что блокирует связывание ТТГ-связанного рецептора с G-белками [70]. При этом аллостерические полные агонисты рецептора ТТГ способны дестабилизировать “ионный замок”, индуцировать конформационные изменения, в первую очередь обусловленные изменением пространственной локализации TMH6 в трансмембранном домене, и, тем самым, стимулировать передачу сигнала к внутриклеточным каскадам [71] (рис. 2).
Другим механизмом действия аллостерических антагонистов может быть механическое воспрепятствование нормальному движению шарнирной области внеклеточного домена рецептора ТТГ [57]. В этом случае антагонист, внедряясь между внеклеточными петлями рецептора, “замораживает” шарнирную область, не позволяя ей подвергаться конформационным перестройкам при связывании ТТГ или стимулирующих аутоантител с внеклеточным доменом. Однако учитывая, что аллостерические регуляторы проникают внутрь трансмембранного домена рецептора ТТГ, не до конца понятно, как они могут непосредственно влиять на подвижность шарнирной области.
Нельзя исключить влияния аллостерических регуляторов на способность рецепторов ТТГ образовывать димерные и олигомерные комплексы, что самым непосредственным образом влияет на их активность и селективность передачи сигнала к внутриклеточным мишеням [70]. Такая возможность показана для рецептора ФСГ. Взаимодействие аллостерического регулятора с одним из мономеров олигомерного комплекса рецептора ФСГ приводит к ослаблению взаимодействия между мономерами и модифицирует способность рецепторных молекул взаимодействовать с гормоном [72].
ЗАКЛЮЧЕНИЕ
Полученные к настоящему времени экспериментальные и клинические данные свидетельствуют о том, что рецептор ТТГ может рассматриваться как одна из важнейших мишеней для регуляции функций ЩЖ, контроля тиреоидного статуса и коррекции заболеваний, обусловленных гиперактивацией рецептора ТТГ (болезнь Грейвса, формы рака, обусловленные активирующими мутациями в рецепторе ТТГ) или снижением его активности (гипотиреоидные состояния). Парадоксально, но ТТГ и различные конструкты на его основе не могут широко применяться для коррекции функций тиреоидной системы, что обусловлено их высокой иммуногенностью и серьезными побочными эффектами, в то время как разработка подходов для применения стимулирующих или ингибирующих аутоантител к рецептору ТТГ находится на начальном этапе, а ее возможное применение влечет за собой ряд нежелательных последствий, характерных для аутоиммунных заболеваний ЩЖ. В этой связи значительный интерес представляют низкомолекулярные аллостерические регуляторы рецептора ТТГ, которые могут быть наделены активностью как полных агонистов, так и инверсионных агонистов и антагонистов. Они взаимодействуют с аллостерическим сайтом, расположенным в трансмембранном домене, и не влияют на его связывание с гормоном или аутоантителами, которое осуществляется с помощью внеклеточных участков рецептора ТТГ. Создание аллостерических регуляторов позволяет более тонко и мягко регулировать активность рецептора ТТГ, не вызывая критических изменений уровня ТТГ и тиреоидных гормонов.
Список литературы
Vanderpump MPJ (2019) Epidemiology of Thyroid Disorders. In: The Thyroid and Its Diseases. Springer Int Publ Cham, 75–85.
Wémeau J, Klein M, Sadoul J-L, Briet C, Vélayoudom-Céphise F-L (2018) Graves’ disease: Introduction, epidemiology, endogenous and environmental pathogenic factors. Ann Endocrinol 79: 599–607. https://doi.org/10.1016/j.ando.2018.09.002
Burch HB, Cooper DS (2018) Antithyroid drug therapy: 70 years later. Eur J Endocrinol 179: R261–R274. https://doi.org/10.1530/EJE-18-0678
Vos XG, Endert E, Zwinderman AH, Tijssen JGP, Wiersinga WM (2016) Predicting the Risk of Recurrence Before the Start of Antithyroid Drug Therapy in Patients With Graves’ Hyperthyroidism. J Clin Endocrinol Metabolism 101: 1381–1389. https://doi.org/10.1210/jc.2015-3644
Walter MA, Briel M, Christ-Crain M, Bonnema SJ, Connell J, Cooper DS, Bucher HC, Müller-Brand J, Müller B (2007) Effects of antithyroid drugs on radioiodine treatment: systematic review and meta-analysis of randomised controlled trials. BMJ 334: 514. https://doi.org/10.1136/bmj.39114.670150.BE
Bartalena L, Piantanida E, Gallo D, Ippolito S, Tanda ML (2022) Management of Graves’ hyperthyroidism: present and future. Exp Rev Endocrinol Metabol 17: 153–166. https://doi.org/10.1080/17446651.2022.2052044
Furmaniak J, Sanders J, Sanders P, Li Y, Rees Smith B (2022) TSH receptor specific monoclonal autoantibody K1-70 TM targeting of the TSH receptor in subjects with Graves’ disease and Graves’ orbitopathy–Results from a phase I clinical trial. Clin Endocrinol 96: 878–887. https://doi.org/10.1111/cen.14681
Garber JR, Cobin RH, Gharib H, Hennessey J V., Klein I, Mechanick JI, Pessah-Pollack R, Singer PA, Woeber KA (2012) Clinical Practice Guidelines for Hypothyroidism in Adults: Cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract 18: 988–1028. https://doi.org/10.4158/EP12280.GL
Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS, Cooper DS, Kim BW, Peeters RP, Rosenthal MS, Sawka AM (2014) Guidelines for the Treatment of Hypothyroidism: Prepared by the American Thyroid Association Task Force on Thyroid Hormone Replacement. Thyroid 24: 1670–1751. https://doi.org/10.1089/thy.2014.0028
Grover G, Mellstrom K, Malm J (2007) Therapeutic Potential for Thyroid Hormone Receptor-β Selective Agonists for Treating Obesity, Hyperlipidemia and Diabetes. Current Vasc Pharmacol 5: 141–154. https://doi.org/10.2174/157016107780368271
Bakhtyukov AA, Derkach KV, Fokina EA, Sorokoumov VN, Zakharova IO, Bayunova LV, Shpakov AO (2022) Development of Low-Molecular-Weight Allosteric Agonist of Thyroid-Stimulating Hormone Receptor with Thyroidogenic Activity. Dokl Biochem Biophys 503: 67–70. https://doi.org/10.1134/S1607672922020016
Meruvu S, Ayers SD, Winnier G, Webb P (2013) Thyroid Hormone Analogues: Where Do We Stand in 2013? Thyroid 23: 1333–1344. https://doi.org/10.1089/thy.2012.0458
Núñez Miguel R, Sanders J, Furmaniak J, Smith BR (2017) Structure and activation of the TSH receptor transmembrane domain. Autoimmun Highlights 8: 2. https://doi.org/10.1007/s13317-016-0090-1
Hauser AS, Attwood MM, Rask-Andersen M, Schiöth HB, Gloriam DE (2017) Trends in GPCR drug discovery: new agents, targets and indications. Nature Rev Drug Discov 16: 829–842. https://doi.org/10.1038/nrd.2017.178
Katritch V, Cherezov V, Stevens RC (2013) Structure-Function of the G Protein–Coupled Receptor Superfamily. Ann Rev Pharmacol Toxicol 53: 531–556. https://doi.org/10.1146/annurev-pharmtox-032112-135923
Hsu SY, Hsueh AJW (2000) Discovering New Hormones, Receptors, and Signaling Mediators in the Genomic Era. Mol Endocrinol 14:594–604. https://doi.org/10.1210/mend.14.5.0472
Kaczur V, Puskás LG, Takács M, Rácz IA, Szendrői A, Tóth S, Nagy Z, Szalai C, Balázs C, Falus A, Knudsen B, Farid NR (2003) Evolution of the thyrotropin receptor: a G protein coupled receptor with an intrinsic capacity to dimerize. Mol Genet Metabol 78: 275–290. https://doi.org/10.1016/S1096-7192(03)00036-2
Ulloa-Aguirre A, Zariñán T, Jardón-Valadez E, Gutiérrez-Sagal R, Dias JA (2018) Structure-Function Relationships of the Follicle-Stimulating Hormone Receptor. Front Endocrinol 9. https://doi.org/10.3389/fendo.2018.00707
Ho SC, van Sande J, Lefort A, Vassart G, Costagliola S (2001) Effects of Mutations Involving the Highly Conserved S281HCC Motif in the Extracellular Domain of the Thyrotropin (TSH) Receptor on TSH Binding and Constitutive Activity*. Endocrinology 142: 2760–2767. https://doi.org/10.1210/endo.142.7.8246
Mueller S, Jaeschke H, Günther R, Paschke R (2010) The hinge region: an important receptor component for GPHR function. Trends Endocrinol Metabol 21: 111–122. https://doi.org/10.1016/j.tem.2009.09.001
Jiang X, Liu H, Chen X, Chen P-H, Fischer D, Sriraman V, Yu HN, Arkinstall S, He X (2012) Structure of follicle-stimulating hormone in complex with the entire ectodomain of its receptor. Proc Natl Acad Sci U S A 109: 12491–12496. https://doi.org/10.1073/pnas.1206643109
Costagliola S (2002) Tyrosine sulfation is required for agonist recognition by glycoprotein hormone receptors. The EMBO J 21: 504–513. https://doi.org/10.1093/emboj/21.4.504
Schaarschmidt J, Huth S, Meier R, Paschke R, Jaeschke H (2014) Influence of the Hinge Region and Its Adjacent Domains on Binding and Signaling Patterns of the Thyrotropin and Follitropin Receptor. PLoS One 9:e111570. https://doi.org/10.1371/journal.pone.0111570
Mueller S, Kleinau G, Jaeschke H, Paschke R, Krause G (2008) Extended Hormone Binding Site of the Human Thyroid Stimulating Hormone Receptor. J Biol Chem 283: 18048–18055. https://doi.org/10.1074/jbc.M800449200
Vlaeminck-Guillem V, Ho S-C, Rodien P, Vassart G, Costagliola S (2002) Activation of the cAMP pathway by the TSH receptor involves switching of the ectodomain from a tethered inverse agonist to an agonist. Mol Endocrinol 16: 736–746. https://doi.org/10.1210/mend.16.4.0816
Zhang M, Tong KP, Fremont V, Chen J, Narayan P, Puett D, Weintraub BD, Szkudlinski MW (2000) The extracellular domain suppresses constitutive activity of the transmembrane domain of the human TSH receptor: implications for hormone-receptor interaction and antagonist design. Endocrinology 141: 3514–3517. https://doi.org/10.1210/endo.141.9.7790
Mizutori Y, Chen C-R, McLachlan SM, Rapoport B (2008) The Thyrotropin Receptor Hinge Region Is Not Simply a Scaffold for the Leucine-Rich Domain but Contributes to Ligand Binding and Signal Transduction. Mol Endocrinol 22: 1171–1182. https://doi.org/10.1210/me.2007-0407
Brüser A, Schulz A, Rothemund S, Ricken A, Calebiro D, Kleinau G, Schöneberg T (2016) The Activation Mechanism of Glycoprotein Hormone Receptors with Implications in the Cause and Therapy of Endocrine Diseases. J Biol Chem 291: 508–520. https://doi.org/10.1074/jbc.M115.701102
Kleinau G, Worth CL, Kreuchwig A, Biebermann H, Marcinkowski P, Scheerer P, Krause G (2017) Structural–Functional Features of the Thyrotropin Receptor: A Class A G-Protein-Coupled Receptor at Work. Front Endocrinol 8: https://doi.org/10.3389/fendo.2017.00086
Chen C-R, McLachlan SM, Rapoport B (2009) A Monoclonal Antibody with Thyrotropin (TSH) Receptor Inverse Agonist and TSH Antagonist Activities Binds to the Receptor Hinge Region as Well as to the Leucine-Rich Domain. Endocrinology 150: 3401–3408. https://doi.org/10.1210/en.2008-1800
Sun S, Summachiwakij S, Schneck O, Morshed SA, Ma R, Latif R, Davies TF (2019) Antigenic “Hot- Spots” on the TSH Receptor Hinge Region. Front Endocrinol 9: https://doi.org/10.3389/fendo.2018.00765
Kursawe R, Paschke R (2007) Modulation of TSHR signaling by posttranslational modifications. Trends Endocrinol Metabol 18 199–207. https://doi.org/10.1016/j.tem.2007.05.002
Korta P, Pocheć E (2019) Glycosylation of thyroid-stimulating hormone receptor. Endokrynol Pol 70: 86–100. https://doi.org/10.5603/EP.a2018.0077
Nagayama Y, Nishihara E, Namba H, Yamashita S, Niwa M (2000) Identification of the sites of asparagine-linked glycosylation on the human thyrotropin receptor and studies on their role in receptor function and expression. J Pharmacol Exp Ther 295: 404–409.
Ząbczyńska M, Kozłowska K, Pocheć E (2018) Glycosylation in the Thyroid Gland: Vital Aspects of Glycoprotein Function in Thyrocyte Physiology and Thyroid Disorders. Int J Mol Sci 19: 2792. https://doi.org/10.3390/ijms19092792
Russo D, Chazenbalk GD, Nagayama Y, Wadsworth HL, Rapoport B (1991) Site-Directed Mutagenesis of the Human Thyrotropin Receptor: Role of Asparagine-Linked Oligosaccharides in the Expression of a Functional Receptor. Mol Endocrinol 5: 29–33. https://doi.org/10.1210/mend-5-1-29
Costanzi S, Wang K (2014) The GPCR Crystallography Boom: Providing an Invaluable Source of Structural Information and Expanding the Scope of Homology Modeling. 3–13.
Rasmussen SGF, DeVree BT, Zou Y, Kruse AC, Chung KY, Kobilka TS, Thian FS, Chae PS, Pardon E, Calinski D, Mathiesen JM, Shah STA, Lyons JA, Caffrey M, Gellman SH, Steyaert J, Skiniotis G, Weis WI, Sunahara RK, Kobilka BK (2011) Crystal structure of the β2 adrenergic receptor–Gs protein complex. Nature 477: 549–555. https://doi.org/10.1038/nature10361
Karges B, Krause G, Homoki J, Debatin K-M, de Roux N, Karges W (2005) TSH receptor mutation V509A causes familial hyperthyroidism by release of interhelical constraints between transmembrane helices TMH3 and TMH5. J Endocrinol 186: 377–385. https://doi.org/10.1677/joe.1.06208
Brüser A, Schulz A, Rothemund S, Ricken A, Calebiro D, Kleinau G, Schöneberg T (2016) The Activation Mechanism of Glycoprotein Hormone Receptors with Implications in the Cause and Therapy of Endocrine Diseases. J Biol Chem 291: 508–520. https://doi.org/10.1074/jbc.M115.701102
Nakabayashi K, Matsumi H, Bhalla A, Bae J, Mosselman S, Hsu SY, Hsueh AJW (2002) Thyrostimulin, a heterodimer of two new human glycoprotein hormone subunits, activates the thyroid-stimulating hormone receptor. J Clin Invest 109: 1445–1452. https://doi.org/10.1172/JCI14340
van Sande J, Massart C, Costagliola S, Allgeier A, Cetani F, Vassart G, Dumont JE (1996) Specific activation of the thyrotropin receptor by trypsin. Mol Cell Endocrinol 119: 161–168. https://doi.org/10.1016/0303-7207(96)03804-X
Kleinau G, Krause G (2009) Thyrotropin and Homologous Glycoprotein Hormone Receptors: Structural and Functional Aspects of Extracellular Signaling Mechanisms. Endocr Rev 30: 133–151. https://doi.org/10.1210/er.2008-0044
Eichel K, von Zastrow M (2018) Subcellular Organization of GPCR Signaling. Trends Pharmacol Sci 39: 200–208. https://doi.org/10.1016/j.tips.2017.11.009
Morshed SA, Latif R, Davies TF (2009) Characterization of Thyrotropin Receptor Antibody-Induced Signaling Cascades. Endocrinology 150: 519–529. https://doi.org/10.1210/en.2008-0878
Hamm HE (1998) The Many Faces of G Protein Signaling. J Biol Chem 273: 669–672. https://doi.org/10.1074/jbc.273.2.669
Jang D, Marcus-Samuels B, Morgan SJ, Klubo-Gwiezdzinska J, Neumann S, Gershengorn MC (2020) Thyrotropin regulation of differentiated gene transcription in adult human thyrocytes in primary culture. Mol Cell Endocrinol 518: 111032. https://doi.org/10.1016/j.mce.2020.111032
Chu Y-D, Yeh C-T (2020) The Molecular Function and Clinical Role of Thyroid Stimulating Hormone Receptor in Cancer Cells. Cells 9:1730. https://doi.org/10.3390/cells9071730
Hoyer I, Haas A-K, Kreuchwig A, Schülein R, Krause G (2013) Molecular sampling of the allosteric binding pocket of the TSH receptor provides discriminative pharmacophores for antagonist and agonists. Biochem Soc Transact 41: 213–217. https://doi.org/10.1042/BST20120319
Neumann S, Gershengorn MC (2011) Small molecule TSHR agonists and antagonists. Ann d’Endocrinol 72: 74–76. https://doi.org/10.1016/j.ando.2011.03.002
Jungheim E, Meyer M, Broughton D (2015) Best Practices for Controlled Ovarian Stimulation in In Vitro Fertilization. Seminars Reproduct Med 33: 077–082. https://doi.org/10.1055/s-0035-1546424
Shpakov AO (2021) Endogenous and Synthetic Regulators of the Peripheral Components of the Hypothalamo-Hypophyseal-Gonadal and -Thyroid Axes. Neurosci Behav Physiol 51: 332–345. https://doi.org/10.1007/s11055-021-01076-4
Turcu AF, Kumar S, Neumann S, Coenen M, Iyer S, Chiriboga P, Gershengorn MC, Bahn RS (2013) A Small Molecule Antagonist Inhibits Thyrotropin Receptor Antibody-Induced Orbital Fibroblast Functions Involved in the Pathogenesis of Graves Ophthalmopathy. The J Clin Endocrinol Metabol 98: 2153–2159. https://doi.org/10.1210/jc.2013-1149
Krause G, Marcinkowski P (2018) Intervention Strategies into Glycoprotein Hormone Receptors for Modulating (Mal–)function, with Special Emphasis on the TSH Receptor. Hormone and Metabol Res 50: 894–907. https://doi.org/10.1055/a-0749-6528
Jäschke H, Neumann S, Moore S, Thomas CJ, Colson A-O, Costanzi S, Kleinau G, Jiang J-K, Paschke R, Raaka BM, Krause G, Gershengorn MC (2006) A Low Molecular Weight Agonist Signals by Binding to the Transmembrane Domain of Thyroid-stimulating Hormone Receptor (TSHR) and Luteinizing Hormone/Chorionic Gonadotropin Receptor (LHCGR). J Biol Chem 281: 9841–9844. https://doi.org/10.1074/jbc.C600014200
Knudsen B, Farid NR (2004) Evolutionary divergence of thyrotropin receptor structure. Mol Genetics and Metabol 81: 322–334. https://doi.org/10.1016/j.ymgme.2004.01.010
Marcinkowski P, Hoyer I, Specker E, Furkert J, Rutz C, Neuenschwander M, Sobottka S, Sun H, Nazare M, Berchner-Pfannschmidt U, von Kries JP, Eckstein A, Schülein R, Krause G (2019) A New Highly Thyrotropin Receptor-Selective Small-Molecule Antagonist with Potential for the Treatment of Graves’ Orbitopathy. Thyroid 29: 111–123. https://doi.org/10.1089/thy.2018.0349
Derkach KV, Bakhtyukov AA, Sorokoumov VN, Shpakov AO (2020) New Thieno-[2,3-d]pyrimidine-Based Functional Antagonist for the Receptor of Thyroid Stimulating Hormone. Dokl Biochem Biophys 491: 77–80. https://doi.org/10.1134/S1607672920020064
Derkach KV, Fokina EA, Bakhtyukov AA, Sorokoumov VN, Stepochkina AM, Zakharova IO, Shpakov AO (2022) The Study of Biological Activity of a New Thieno[2,3-D]-Pyrimidine-Based Neutral Antagonist of Thyrotropin Receptor. Bull Exp Biol Med 172: 713–717. https://doi.org/10.1007/s10517-022-05462-x
Neumann S, Huang W, Titus S, Krause G, Kleinau G, Alberobello AT, Zheng W, Southall NT, Inglese J, Austin CP, Celi FS, Gavrilova O, Thomas CJ, Raaka BM, Gershengorn MC (2009) Small-molecule agonists for the thyrotropin receptor stimulate thyroid function in human thyrocytes and mice. Proc Natl Acad Sci U S A 106: 12471–12476. https://doi.org/10.1073/pnas.0904506106
Boutin A, Allen MD, Geras-Raaka E, Huang W, Neumann S, Gershengorn MC (2011) Thyrotropin Receptor Stimulates Internalization-Independent Persistent Phosphoinositide Signaling. Mol Pharmacol 80: 240–246. https://doi.org/10.1124/mol.111.072157
Neumann S, Kleinau G, Costanzi S, Moore S, Jiang J, Raaka BM, Thomas CJ, Krause G, Gershengorn MC (2008) A Low-Molecular-Weight Antagonist for the Human Thyrotropin Receptor with Therapeutic Potential for Hyperthyroidism. Endocrinology 149: 5945–5950. https://doi.org/10.1210/en.2008-0836
Moore S, Jaeschke H, Kleinau G, Neumann S, Costanzi S, Jiang J, Childress J, Raaka BM, Colson A, Paschke R, Krause G, Thomas CJ, Gershengorn MC (2006) Evaluation of Small-Molecule Modulators of the Luteinizing Hormone/Choriogonadotropin and Thyroid Stimulating Hormone Receptors: Structure−Activity Relationships and Selective Binding Patterns. J Med Chem 49: 3888–3896. https://doi.org/10.1021/jm060247s
Neumann S, Nir EA, Eliseeva E, Huang W, Marugan J, Xiao J, Dulcey AE, Gershengorn MC (2014) A selective TSH receptor antagonist inhibits stimulation of thyroid function in female mice. Endocrinology 155: 310–314. https://doi.org/10.1210/en.2013-1835
Neumann S, Huang W, Eliseeva E, Titus S, Thomas CJ, Gershengorn MC (2010) A Small Molecule Inverse Agonist for the Human Thyroid-Stimulating Hormone Receptor. Endocrinology 151: 3454–3459. https://doi.org/10.1210/en.2010-0199
Bakhtuykov A, Derkach K, Sorokoumov V, Fokina E, Shpakov A (2021) The development of new low-molecular-weight allosteric antagonists of thyroid-stimulating hormone receptor and their effect on the basal and thyroliberin-stimulated production of thyroid hormones. FEBS Open Bio 11: 103–507. https://doi.org/10.1002/2211-5463.13205
Shpakova EA, Shpakov AO, Chistyakova OV, Moyseyuk IV, Derkach KV (2012) Biological activity in vitro and in vivo of peptides corresponding to the third intracellular loop of thyrotropin receptor. Dokl Biochem Biophys 443: 64–67. https://doi.org/10.1134/S1607672912020020
Shpakov AO, Shpakova EA, Tarasenko II, Derkach KV (2014) Peptide 612–627 of thyrotropin receptor and its modified analogs as regulators of adenylyl cyclase in rat thyroid gland. Cell and Tissue Biol 8: 488–498. https://doi.org/10.1134/S1990519X1406008X
Derkach KV, Shpakova EA, Titov AK, Shpakov AO (2015) Intranasal and Intramuscular Administration of Lysine-Palmitoylated Peptide 612–627 of Thyroid-Stimulating Hormone Receptor Increases the Level of Thyroid Hormones in Rats. Int J Peptide Res Therap 21: 249–260. https://doi.org/10.1007/s10989-014-9452-6
Davies TF, Ali MR, Latif R (2014) Allosteric Modulators Hit the TSH Receptor. Endocrinology 155: 1–5. https://doi.org/10.1210/en.2013-2079
Audet M, Bouvier M (2012) Restructuring G-Protein- Coupled Receptor Activation. Cell 151: 14–23. https://doi.org/10.1016/j.cell.2012.09.003
Nataraja S, Sriraman V, Palmer S (2018) Allosteric Regulation of the Follicle-Stimulating Hormone Receptor. Endocrinology 159: 2704–2716. https://doi.org/10.1210/en.2018-00317
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова