Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1114-1124
Дифференциальное влияние ПТСР-подобного или депрессивно-подобного состояния самцов крыс перед спариванием на активность гипоталамо-гипофизарно-адренокортикальной системы половозрелых потомков
Н. Э. Ордян 1, *, С. Г. Пивина 1, Г. И. Холова 1, В. К. Акулова 1, В. В. Ракицкая 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: neo@infran.ru
Поступила в редакцию 26.05.2022
После доработки 29.07.2022
Принята к публикации 30.07.2022
- EDN: KWUQVH
- DOI: 10.31857/S0869813922090114
Аннотация
В настоящее время растет число наблюдений о трансгенерационном влиянии стресса отца на различные функции потомков без вовлечения прямого взаимодействия между потомками и отцом. Установлено, что у потомков родителей, страдавших посттравматическим стрессовым расстройством (ПТСР), наблюдается усиление ПТСР-подобных симптомов. В экспериментах, где у самцов мышей создавали хронически повышенный уровень кортикостерона в течение всего периода сперматогенеза, показано снижение стрессорной реактивности гипоталамо-гипофизарно-адренокортикальной системы (ГГАС) у потомков обоего пола. Однако ПТСР у больных создает сниженный уровень глюкокортикоидов в крови, а экспериментальные данные о влиянии моделирования ПТСР у отцов на активность ГГАС потомков отсутствуют. В связи с этим цель исследования состояла в сравнении эффектов ПТСР-подобного состояния (парадигма “стресс–рестресс”) и депрессивно-подобного состояния (парадигма “выученная беспомощность”) самцов крыс перед спариванием на активность ГГАС их половозрелых потомков обоего пола. Помимо активности ГГАС у потомков анализировали экспрессию глюкокортикоидных рецепторов методом количественной иммуноцитохимии в гиппокампе и медиальной префронтальной коре (мПФК). Установлено, что у самок – потомков отцов с ПТСР-подобным или депрессивно-подобным состоянием – наблюдается снижение, базальной и стрессорной реактивности ГГАС в ответ на 30-минутную иммобилизацию, что сопровождалось увеличением экспрессии глюкокортикоидных рецепторов в гиппокампе и 2-ом слое мПФК. Схожий профиль активности ГАС был выявлен и у самцов – потомков отцов с моделированием ПТСР. Однако у самцов – потомков отцов с депрессивно-подобным состоянием – чувствительность ГГАС к сигналам обратной связи снижалась и сопровождалась уменьшением экспрессии глюкокортикоидных рецепторов в гиппокампе и 2-ом слое мПФК. Сделано заключение, что ПТСР- или депрессивно-подобное состояние отцов в период сперматогенеза оказывает дифференциальное влияние на активность ГГАС и экспрессию глюкокортикоидных рецепторов в мозге их потомков самцов.
В настоящее время растет число доклинических и эпидемиологических наблюдений о трансгенерационном влиянии стресса отца на различные функции потомков без вовлечения прямого взаимодействия между потомками и отцом. Эпидемиологические исследования родителей, страдавших посттравматическим стрессовым расстройством (ПТСР), продемонстрировали усиление ПТСР-подобных симптомов у их потомков, которые сами по себе никакие травматические события не испытывали [1]. Такие симптомы у потомков проявлялись прежде всего в снижении базального уровня кортикостерона и усилении чувствительности их гипоталамо-гипофизарно-адренокортикальной системы (ГГАС) к сигналам отрицательной обратной связи. Однако такой профиль активности ГГАС был характерен только для потомков обоих родителей, болевших ПТСР, но не отцов, потомки которых, напротив, демонстрировали признаки ослабления регуляции ГГАС по механизму отрицательной обратной связи [2].
В эксперименте на лабораторных животных также было установлено влияние стресса отца на активность ГГАС потомков. В исследованиях Rodgers с соавт. [3] было показано, что хроническое умеренное стрессирование самцов мышей, создающее повышенный уровень кортикостерона в течение всего периода сперматогенеза, проявляется у их половозрелых потомков обоего пола в снижении стрессорной реактивности ГГАС. Эти данные позволили авторам рассматривать стресс отца как фактор риска развития ПТСР у их потомков [4].
В наших исследованиях был установлен факт влияния ПТСР-подобного состояния самцов крыс в период сперматогенеза на активность ГГАС их половозрелых потомков [5]. Профиль активности этой системы со сниженным базальным уровнем кортикостерона и пониженной стрессореактивностью, а также ускоренным торможением после стрессорной активации в целом соответствует симптомам ПТСР у людей [6]. Тем не менее, использованная нами модель ПТСР “стресс–рестресс” создает сниженный уровень кортикостерона в крови, а не повышенный, как в упомянутом исследовании Rodgers и соавт. [3]. Возникает вопрос: сама ли по себе стрессорная процедура, предъявленная самцам-отцам, влияет на активность ГГАС потомков, или значение имеет тот уровень кортикостерона, который в крови самцов-отцов создается в период созревания сперматозоидов? Последнее представляет определенный интерес в связи с тем, что как повышенный, так и сниженный уровень глюкокортикоидов в крови может оказывает влияние на процесс сперматогенеза [7].
В связи с этим в настоящем исследовании мы сравнили эффекты ПТСР-подобного состояния (сниженный уровень кортикостерона) и депрессивно-подобного состояния (повышенный уровень кортикостерона) самцов-отцов перед спариванием на активность ГГАС их половозрелых потомков обоего пола.
Для моделирования ПТСР у самцов крыс мы использовали парадигму “стресс–рестресс”, в которой основным воздействием служит травматический комбинированный стресс с последующим дополнительным стрессированием (рестрессс)через 6 сут, но более слабым и менее продолжительным. Рестресс служит триггером для развития стойкого ПТСР-подобного состояния, сопровождающееся снижением уровня кортикостерона и усилением чувствительности ГГАС к сигналам отрицательной обратной связи не менее 10 дней [8]. В качестве модели депрессии использовали парадигму “выученная беспомощность”, где самцов подвергали часовой электро-кожной стимуляции в режиме неизбегаемости и неконтролируемости [9]. Такое воздействие создает не только повышенный уровень кортикостерона в крови, но и нарушает регуляцию ГГАС по механизму отрицательной обратной связи на протяжении не менее 10 дней [10]. В обеих парадигмах по сути используется однократное сильное стрессорное воздействие, что позволяет дифференциально учитывать влияние уровня кортикостерона в крови самцов в процессе сперматогенеза на активность ГГАС их половозрелых потомков. Помимо активности ГГАС у потомков мы также анализировали экспрессию глюкокортикоидных рецепторов методом количественной иммуноцитохимии в гиппокампе и медиальной префронтальной коре (мПФК) – структурах, имеющих непосредственное отношение к регуляции активности этой гормональной оси [11].
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из ЦКП “Биоколлекция Института физиологии им. И.П. Павлова РАН для исследования интегративных механизмов деятельности нервной и висцеральных систем”. В исследовании использовали 15 самцов крыс линии Вистар в возрасте 3 мес. и массой тела 250–280 г, 30 самок крыс той же линии в возрасте 3 мес. и массой 220–240 г. Были соблюдены все рекомендации по этике работы с животными, утвержденными правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Животных содержали в пластиковых клетках, по 6 особей, на стандартной диете (гранулированный комбикорм) при свободном доступе к воде и пище и 12-часовом режиме смены дня и ночи.
Самцов случайным образом делили на 3 группы по 5 крыс в каждой. У первой группы вырабатывали ПТСР-подобное состояние, для чего их подвергали комбинированному стрессорному воздействию, состоящему из двухчасовой иммобилизации в узких пластиковых пеналах, двадцатиминутного плавания в стеклянных цилиндрах диаметром 40 см и глубиной 60 см, заполненных водой с температурой 24 ± 2°С, и после небольшой паузы эфирный стресс в течение 1 мин. Все типы стрессорных воздействий применяли последовательно. На 7-е сутки после комбинированного стресса производили тридцатиминутную иммобилизацию – рестресс.
Самцов второй группы подвергали неизбегаемому и неконтролируемому электрокожному раздражению в клетке с токопроводящим полом размером 30 × 18 × 20 см. Удары электрического тока (1 мА, 50 Гц) длительностью 15 с подавались 60 раз в течение 1 ч с длительностью интервала между ударами током от 15 до 54 с. Такой тип стрессорного воздействия формирует у животных состояние “выученная беспомощность”, являющееся моделью депрессии [9]. Самцы третьей группы оставались интактными и служили контролем для первой и второй групп.
В исследованиях, проведенных нами ранее, было установлено, что в парадигме “стресс–рестресс” не все самцы формируют ПТСР-подобное состояние со сниженным уровнем кортикостерона на 10-е сутки после рестресса [5]. В связи с этим у самцов на 10-е сутки после “рестресса” или электрокожного раздражения, а также у контрольных самцов в покое осуществляли забор проб крови из хвостовой вены, которую использовали для определения уровня кортикостерона в крови. Полученные пробы крови центрифугировали (1000 g, 20 мин, 4°С) и далее плазму хранили при температуре –20°С.
Самцов через 46–48 сут после процедуры стрессирования, а также контрольных самцов по одиночке подсаживали к двум рецептивным самкам, находящимся в стадии проэструс–эструс. На следующий день у самок забирали вагинальные мазки с целью обнаружения в них сперматозоидов. Если сперматозоиды обнаружены не были, то самец оставался с самкой еще на один эстральный цикл.
Беременных самок отсаживали от самцов и содержали по 5 особей в клетке до 17-го дня беременности, а с 18-го дня – в индивидуальных клетках. На 2-е сутки после родов пометы выравнивали (не более 8 крысят с равным соотношением полов). Пометы содержали с матерью до 30-дневного возраста, а далее по 6–7 особей в соответствии с полом. От каждого самца было получено по два помета.
Дальнейшие эксперименты выполняли на половозрелых потомках (возраст 2.5 мес., масса 220–250 г – самцы и 200–230 г – самки) трех групп самцов. Экспериментальные группы формировали таким образом, чтобы в каждой группе присутствовало не более двух животных соответствующего пола из одного помета.
Активность ГГАС половозрелых потомков исследовали по изменению содержания кортикостерона в плазме крови в динамике до и после иммобилизационного стрессорного воздействия. Каждую крысу помещали в узкий пластиковый пенал, ограничивающий подвижность, и в течение не более 3 мин из хвостовой вены отбирали пробу крови (0 мин, базальная активность). Далее через 30 мин повторяли отбор крови (30 мин, стрессорная активность ГГАС). Затем крысу из пенала извлекали, помещали в домашнюю клетку, а через 180 мин кровь из хвостовой вены отбирали вновь (торможение ГГАС после стрессорной активации). Полученные пробы крови центрифугировали (1000 g, 20 мин, 4°С) и далее плазму хранили при температуре –20°С до момента определения содержания в ней кортикостерона.
Оценку активности ГГАС проводили с 11-00 до 14-00 ч. Каждая группа контрольных и подопытных крыс состояла из 10 животных соответствующего пола.
Уровень кортикостерона в плазме крови определяли методом ИФА, используя стандартные наборы производства “ХЕМА” (Россия) и анализатор Multickan FS (Thermo Fisher Scientific, Финляндия). Анализ выполнялся согласно протоколу производителя.
Отдельную группу животных – потомков двух групп стрессированных самцов и контрольных животных – использовали для анализа экспрессии глюкокортикоидных рецепторов в головном мозге. Животных декапитировали, мозг быстро извлекали из черепной коробки и помещали в 4%-ный раствор параформальдегида в 0.1 М фосфатном буфере (pH 7.3) на 1 ч, а затем на 48 ч при 4°C. Далее определение экспрессии глюкокортикоидных рецепторов проводили по методике, описанной ранее [12]. Вкратце, материал после стандартной гистологической обработки заливали в парафин и изготавливали серии срезов мозга во фронтальной плоскости толщиной 6 мкм. Выявление иммунореактивного вещества проводили с помощью метода немеченых антител (авидин-биотинового) и иммунопероксидазной реакции. Использовали первичные кроличьи поликлональные антитела к глюкокортикоидным рецепторам (Abcam, ab3578, разведение 1 : 200) и стандартный набор ABC кит (Abcam, ab64261). Для визуализации реакции связывания антитела с антигеном использовали диаминобензидиновый компекс, входящий в состав кита АВС. Количественную оценку иммунореактивности производили с использованием системы анализа изображения, включающей световой микроскоп Olympus CX31 (Япония), цветную цифровую камеру VideoZavr Standard VZ-C31Sr и программное обеспечение Видеозавр Мультиметр 2.3 (“АТМ-практика”, Санкт-Петербург). Проводили оценку средней оптической плотности окраски в иммунопозитивных нейронах гиппокампа и мПФК (1 мм от брегмы).
Подсчет производился на 4–5 срезах от каждого животного, было проанализировано количество клеток на одинаковой площади среза для каждой исследуемой области гиппокампа (поле СА1, зубчатая извилина) и мПФК (2-й и 5-й клеточные слои). На основании оценки оптической плотности иммунопозитивные клетки разделяли на 3 класса: слабо- (0.05–0.1 ед. оптической плотности), средне- (0.1–0.25 ед. оптической плотности) и сильноиммунореактивные (0.25–0.5 ед. оптической плотности) клетки. Проанализировали общее число иммунореактивных клеток и число клеток каждого класса.
Для оценки индекса общей иммунореактивности (ОИр) использовали формулу:
Каждая группа самцов и самок в данном эксперименте состояла из 6 животных.
Статистический анализ данных проводили с использованием пакета программ STATISTICA 12.0. Оценку нормальности распределения данных проводили с использованием теста Шапиро–Уилка. Для анализа динамики стрессорной реактивности ГГАС применяли двухфакторный ANOVA для повторных измерений (группа (отец) х уровень кортикостерона в зависимости от времени начала стрессирования) с последующими парными post-hoc сравнениями (тест Тьюки) значений уровня кортикостерона в каждой временной точке у отдельных групп животных. Уровень кортикостерона в крови самцов отцов и результаты иммуноцитохимического исследования анализировали с применением однофакторного ANOVA с последующими парными post-hoc сравнениями (тест Тьюки) значений для каждой группы животных. Статистически значимыми считали различия при p < 0.05. Данные представлены в виде M ± m.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные исследования показали, что в выполненной серии экспериментов все самцы сформировали ПТСР-подобное состояние (сниженный базальный уровень кортикостерона, 82.3 ± 9.2 нмоль/л) и депрессивно-подобное состояние (повышенный базальный уровень кортикостерона, 188.7 ± 15.4 нмоль/л) по сравнению с группой контрольных самцов (134.1 ± 12.2, p < 0.05).
Двухфакторный дисперсионный анализ показал достоверное влияние пола животных на динамику стрессорного выброса кортикостерона как в группе потомков контрольных самцов отцов (F(2,59) = 7.3, p < 0.001), так и в группах потомков отцов с ПТСР-подобным (F(2,59) = 7.9, p < 0.01) или депрессивно-подобным состоянием (F(2,59) = 13.8, p < 0.001). Таким образом стресс отца не повлиял на характер активности ГГАС потомков в зависимости от пола.
Выявлено достоверное взаимодействие факторов отец и уровень кортикостерона в зависимости от времени начала стрессирования у потомков самцов (F(4,89) = 6.8, p < 0.01) и потомков самок (F(4,89) = 4.3, p < 0.05). Post-hoc анализ различий между группами в каждой временной точке показал, что у самок – потомков отцов с ПТСР-подобным или депрессивно-подобным состоянием – наблюдается снижение базальной и стрессорной реактивности ГГАС по сравнению с потомками контрольных самцов отцов (рис. 1а). Сходный характер активности ГГАС был выявлен и у самцов – потомков отцов с ПТСР-подобным состоянием (рис. 1b). Однако у самцов – потомков отцов с депрессивно-подобным состоянием – изменений в базальной и стрессорной активности ГГАС не выявлено, тогда как чувствительность этой гормональной оси к сигналам обратной связи снижалась, о чем свидетельствовал более высокий уровень кортикостерона через 180 мин после начала 30-минутной иммобилизации по сравнению с потомками контрольных самцов отцов.
Рис. 1.
Характер базальной и стрессорной активности ГГАС потомков самцов отцов с ПТСР-подобным или депрессивно-подобным состоянием. a – потомки самки; b – потомки самцы. По вертикали – уровень кортикостерона в плазме крови (нмоль/л), по горизонтали – время от начала 30-минутной иммобилизации. Белые столбики – потомки контрольных самцов отцов, темные столбики – потомки отцов с ПТСР-подобным состоянием, столбики со штриховкой – потомки отцов с депрессивно-подобным состоянием. * – статистически значимые различия между потомками подопытных и контрольных самцов отцов (p < 0.05).

Результаты иммуногистохимического анализа экспрессии глюкокортикоидных рецепторов в гиппокампе и мПФК потомков представлены в табл. 1 и 2.
Таблица 1.
Показатель индекса иммунореактивности к глюкокортикоидным рецепторам областей мозга потомков самок
| Область мозга | Потомки контрольных самцов | Потомки самцов с ПТСР-подобным состоянием | Потомки самцов с депрессивно-подобным состоянием | Однофакторный ANOVA |
|---|---|---|---|---|
| СА1 поле гиппокампа | 60.2 ± 3.2 | 80 ± 5.8* | 74.6 ± 4.3** | F(2,17 ) = 7.8, p < 0.01 |
| Зубчатая извилина | 220.7 ± 16.2 | 341.5 ± 18.9 ** | 283.5 ± 15.8* | F(2,17) = 15.5, p < 0.0001 |
| 2-й слой мПФК | 194.3 ± 4.4 | 246.5 ± 9.6* | 244 ± 10.9* | F(2,17) = 9.4, p < 0.001 |
| 5-й слой мПФК | 104.5 ± 6.7 | 127.3 ± 12.4 | 123.8 ± 11.2 | F(2,17) = 3.56, p > 0.05 |
Таблица 2.
Показатель индекса иммунореактивности к глюкокортикоидным рецепторам областей мозга потомков самцов
| Область мозга | Потомки контрольных самцов | Потомки самцов с ПТСР-подобным состоянием | Потомки самцов с депрессивно-подобным состоянием | Однофакторный ANOVA |
|---|---|---|---|---|
| СА1 поле гиппокампа | 64.2 ± 4.6 | 78 ± 6.8* | 34.3 ± 4.4** | F(2,17) = 17.6, p < 0.0001 |
| Зубчатая извилина | 253.7 ± 10.5 | 380 ± 21.3* | 211.5 ± 22.2 | F(2,17) = 13.2, p < 0.0001 |
| 2-й слой мПФК | 253.3 ± 12.2 | 352.2 ± 25.4* | 206.7 ±1 3.9* | F(2,17) = 21.4, p < 0.0001 |
| 5-й мПФК | 123.8 ± 4.2 | 148.5 ± 15.3 | 115 ± 6.3 | F(2,17) = 3.4, p > 0.05 |
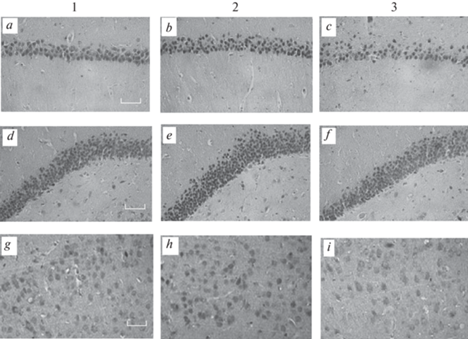
Самцы и самки – потомки отцов с моделированием ПТСР – характеризовались повышенной экспрессией глюкокортикоидных рецепторов в поле СА1 гиппокампа и зубчатой извилине, а также во 2-ом слое мПФК по сравнению с потомками контрольных самцов. Такие же изменения экспрессии глюкокортикоидных рецепторов в гиппокампе и мПФК были выявлены и у самок – “потомков отцов с выученной беспомощностью”. Напротив, у самцов – потомков отцов с депрессивно-подобным состоянием (парадигма “выученная беспомощность”) обнаружено снижение экспрессии глюкокортикоидных рецепторов в поле СА1 гиппокамп и тенденция к снижению в зубчатой извилине (p = 0.07), а также статистически значимое снижение этого показателя во 2-ом слое мПФК. Изменений в экспрессии глюкокортикоидных рецепторов в 5-ом слое мПФК не выявлено ни у одной из групп крыс. Микрофотографии областей мозга с выявленными клетками, экспрессирующими глюкокортикоидные рецепторы, у самцов – потомков отцов разных экспериментальных групп – представлены на рис. 2.
Рис. 2.
Экспрессия белка глюкокортикоидных рецепторов в гиппокампе и медиальной префронтальной коре самцов – потомков отцов экспериментальных групп. 1 – потомки контрольных самцов; 2 – потомки самцов c ПТСР-подобным состоянием; 3 – потомки самцов с депрессивно-подобным состоянием. a, b, c – СА1 поле гиппокампа; d, e, f – зубчатая извилина; g, h, i – медиальная префронтальная кора. Масштаб 50 мкм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Внимание к роли ПТСР родителей как фактора риска развития ПТСР у их потомков было привлечено исследованием, проведенным Solomon и соавт. [14], показавшими, что ветераны войны в Ливане, которые являлись потомками переживших Холокост, были более склонны к развитию ПТСР, чем другие израильские солдаты, после своего военного опыта. Это исследование предоставило первое эмпирическое доказательство большей чувствительности потомков родителей, переживших Холокост, к их собственным стрессовым событиям.
Более подробно данная проблема была разработана Yahuda с соавт., которые убедительно продемонстрировали, что у потомков, переживших травматические события, вероятность развития ПТСР была выше, если их родители болели этой психопатологией [15, 16]. Авторы пришли к выводу, что ПТСР у родителей может быть фактором риска развития соответствующего заболевания у потомков.
Дальнейшие исследования, проведенные коллективом этих авторов, выявили, что родительское ПТСР, а не воздействие Холокоста, связано с изменениями в функции оси гипоталамус–гипофиз–надпочечники, включая повышенное подавление уровня кортизола после введения дексаметазона и более низкие исходные уровни кортизола в крови потомков [1, 2]. Следует отметить, что наибольшие изменения в активности ГГАС этими авторами были обнаружены у тех потомков, у которых оба родителя страдали ПТСР, тогда как если болели только отцы, то у их взрослых потомков, напротив, чувствительность ГГАС к сигналам отрицательной обратной связи снижалась [17], и это, по мнению авторов, связано с риском развития у таких потомков депрессии.
В экспериментах на крысах было установлено, что более низкая исходная активность ГГАС играет решающую роль в формировании долгосрочных нейрональных и гормональных дисбалансов, лежащих в основе поведенческих симптомов, характерных для ПТСР [18, 19]. Эти данные также подтверждают мысль о том, что более низкий уровень активности ГГАС может являться фактором риска ПТСР.
Тем не менее, в экспериментальных исследованиях, выполненных на лабораторных грызунах, показано общее снижение активности ГГАС у потомков самцов, которые подвергались стрессированию в течение всего периода сперматогенеза [3], т.е. имели повышенный уровень глюкокортикоидов в крови, а не сниженный, как при моделировании ПТСР. Причем этот эффект не зависел от пола потомков и от того, в какой период онтогенеза (неполовозрелые и взрослые животные) применялись стрессорные процедуры к самцам.
Наши исследования показали, что моделирование ПТСР у самцов в парадигме “стресс–рестресс” приводит к сходным изменениям активности ГГАС у их взрослых потомков обоего пола. Мы выявили не только сниженный базальный уровень кортикостерона в крови таких потомков, но и снижение стрессорной реактивности ГГАС. Активированная стрессом ГГАС потомков отцов с моделированием ПТСР возвращалась к исходному более низкому состоянию в те же сроки, что и у потомков контрольных самцов отцов. Более того, у этих же потомков мы обнаружили повышение экспрессии белка глюкокортикоидных рецепторов в гиппокампе и мПФК. Сходный профиль активности ГГАС и уровень глюкокортикоидных рецепторов в исследованных областях мозга были выявлены и у потомков самок отцов, у которых моделировали депрессию. При этом у потомков самцов тех отцов, у которых моделировали депрессию, базальная и стрессорная активность ГГАС не изменялась по сравнению с потомками контрольных отцов, но торможение их ГГАС после стрессорной активации была отсрочена, о чем свидетельствовал более высокий уровень кортикостерона в их крови через 3 ч после начала стрессирования. Характерно, что у этих самцов мы обнаружили более низкий уровень глюкокортикоидных рецепторов в гиппокампе и мПФК – структурах, ответственных в том числе за торможение стрессорной активности ГГАС [11]. Другими словами, эффекты моделирования разных психопатологий у самцов отцов на активность ГГАС их взрослых потомков различались только в отношении потомков самцов и были схожи у потомков самок. Складывается впечатление, что у потомков самок изменение активности ГГАС происходит вследствие самого стресса отца, а у потоков самцов зависит от того, какую парадигму использовали для стрессирования самцов отцов и, вероятно, от уровня кортикостерона, который создавался в этих парадигмах.
Обращает на себя внимание выявленный нами факт более выраженного изменения экспрессии глюкокортикоидных рецепторов во 2-м слое мПФК по сравнению с 5-м слоем. Цепь, посредством которой эфферентные проекционные нейроны из мПФК ингибируют ГГАС, включает вторичную активацию тормозных ГАМКергических нейронов в подобластях ядра ложа конечной полоски (BNST) [20]. Слой 5 является основным местом для проекционных нейронов, которые распространяются на подкорковые лимбические структуры, такие как BNST [21]. Вместе с тем, 2-й слой мПФК также участвует в регуляции активности ГГАС по механизму отрицательной обратной связи, а его пирамидные нейроны проявляет повышенную чувствительность к глюкокортикоидам [22]. Нейроны обоих слоев обильно экспрессируют глюкокортикоидные рецепторы. Учитывая эти данные, мы полагали, что снижение активности ГГАС, выявленное у потомков обоего пола самцов отцов с моделированием ПТСР, и самок – потомков отцов с моделированием депрессии в большей мере отразится на количестве глюкокортикоидных рецепторов в 5-м слое мПФК, а не во 2-м. Тем не менее, данный факт представляет определенный интерес для дальнейшего анализа.
В настоящий момент сложно предполагать, с чем может быть связан такой дифференциальный эффект на потомков самцов ПТСР-подобного или депрессивно-подобного состояния их отцов. Отметим, что в упомянутых выше работах Yehuda и соавт. не было выявлено значимого гендерного влияния ПТСР родителей на потомков. Более того, было продемонстрировано, что у потомства отцов с посттравматическим стрессовым расстройством наблюдается более высокое метилирование экзона 1F промотора гена глюкокортикоидного рецептора (NR3C1), тогда как у потомства обоих родителей с ПТСР, напротив, более низкое метилирование. Метилирование промотора глюкокортикоидного рецептора 1F было в значительной степени связано с большим подавлением секреции кортизола после введения дексаметазона и не зависело от пола потомков [23]. Авторы пришли к заключению, что отцовский посттравматический стресс и материнское ПТСР, вероятнее всего, имеет различные механизмы трансгенерационной передачи признаков, связанных с травматическими событиями. Может ли сходный механизм, связанный с метилированием ДНК промотора гена глюкокортикоидных рецепторов, быть вовлечен в обнаруженное нами дифференциальное влияние отцовского ПТСР-подобного или депрессивно-подобного состояния на экспрессию белка глюкокортикоидных рецепторов в мозге и соответственное изменение активности ГГАС потомков самцов, нуждается в дальнейшем исследовании.
Список литературы
Yehuda R, Teicher MH, Seckl JR, Grossman RA, Morris A, Bierer LM (2007) Parental posttraumatic stress disorder as a vulnerability factor for low cortisol trait in offspring of Holocaust survivors. Archiv Gen Psychiatry 64: 1040–1048. https://doi.org/10.1001/archpsyc.64.9.1040
Yehuda R, Blair W, Labinsky E, Bierer LM (2007) Effects of parental PTSD on the cortisol response to dexamethasone administration in their adult offspring. Am J Psychiatry164: 163–166. https://doi.org/10.1176/ajp.2007.164.1.163
Rodgers AB, Morgan CP, Bronson SL, Revello S, Bale TL (2013) Paternal stress exposure alters sperm microRNA content and reprograms offspring HPA stress axis regulation. J Neurosci 33: 9003–9012. https://doi.org/10.1523/JNEUROSCI.0914-13.2013
Rodgers AB, Bale TL (2015) Germ cell origins of Posttraumatic stress disorder risk: the transgenerational impact of parental stress experience. Biol Psychiatry 78: 307–314. https://doi.org/10.1016/j.biopsych.2015.03.018
Ordyan NE, Pivina SG, Akulova VK, Kholova GI (2021) Changes in the nature of behavior and the activity of the hypophyseal-adrenocortical system in the offspring of paternal rats subjected to stress in the stress–restress paradigm before mating. Neurosci Behav Physiol 51: 528–534. https://doi.org/10.1007/s11055-021-01100-7
Andreasen NC (2011) What is post-traumatic stress disorder? Dialog Clin Neurosci 13: 240–243. https://doi.org/10.31887/DCNS.2011.13.2/nandreasen
Whirledge S, Cidlowski JA (2017) Glucocorticoids and reproduction: traffic control on the road to reproduction. Trends Endocrinol Metab 28: 399–415. https://doi.org/10.1016/j.tem.2017.02.005
Pivina SG, Rakitskaya VV, Akulova VK, Ordyan NE (2016) Activity of the hypothalamic–pituitary–adrenal system in prenatally stressed male rats on the experimental model of post-traumatic stress disorder. Bull Exp Biol Med 160: 601–604. https://www.doi.org/10.1007/s10517-016-3227-3
Czén B, Fuchs E, Wiborg O, Simon M (2016) Animal models of major depression and their clinical implications. Progress Neuropsyhopharmacol Biol Psychiatry 64: 293–310. https://doi.org/10.1016/j.pnpbp.2015.04.004
Mironova V, Pivina SG, Rybnikova E (2013) Effect of inescapable stress in rodent models of depression and posttraumatic stress disorder on CRH and vasopressin immunoreactivity in the hypothalamic paraventricular nucleus. Acta Physiol Hungar 100: 395–410. https://doi.org/10.1556/APhysiol.100.2013.4.4
McEwen BS, Nasca C, Gray JD (2016) Stress effects on neuronal structure: hippocampus, amygdala, and prefrontal cortex. Neuropsychopharmacology 41: 3–23. https://doi.org/10.1038/npp.2015.171
Ordyan NE, Pivina SG, Baranova KA, Rakitskaya VV, Akulova VK, Kholova GI (2021) Sex-dependent actions of prenatal stress on the activity of the hypothalamo-hypophyseal-adrenocortical system in rats: the role of corticosteroid receptors in the brain. Neurosci Behav Physiol 51: 357–366. https://doi.org/10.1007/s11055-021-01079-1
Boos A, Kohtes J, Janssen V, Mülling C, Stelljes A, Zerbe H, Hässig M, Thole HH (2006) Pregnancy effects on distribution of progesterone receptors, oestrogen receptor alpha, glucocorticoid receptors, Ki-67 antigen and apoptosis in the bovine interplacentomal uterine wall and foetal membranes. Anim Reprod Sci 91: 55–76. https://doi.org/10.1016/j.anireprosci.2005.03.012
Solomon Z, Kotler M, Mikulincer M (1988) Combat-related posttrau-matic stress disorder among second generation Holocaust survivors: preliminary findings. Am J Psychiatry 145: 865–886. https://doi.org/10.1176/ajp.145.7.865
Yehuda R, Schmeidler J, Giller EL, Siever LJ, Binder-Brynes K (1998) Relationship between Posttraumatic stress disorder characteristics of Holocaust survivors and their adult offspring. Am J Psychiatry 155: 841–843. https://doi.org/10.1176/ajp.155.6.841
Yehuda R, Schmeidler J, Wainberg M, Binder-Brynes K, Duvdevani T (1998) Vulnerability to posttraumatic stress disorder in adult offspring of Holocaust survivors. Am J Psychiatry 155: 1163–1171. https://doi.org/10.1176/ajp.155.9.1163
Yehuda R, Bell A, Bierer LM, Schmeidler J (2008) Maternal, not paternal, PTSD is related to increased risk for PTSD in offspring of Holocaust survivors. J Psychiatr Res 42: 1104–1111. https://doi.org/10.1016/j.jpsychires.2008.01.002
Cohen H, Zohar J, Gidron Y, Matar MA, Belkind D, Loewenthal U, Kozlovsky N, Kaplan Z (2006) Blunted HPA axis response to stress influences susceptibility to posttraumatic stress response in rats. Biol Psychiatry 59: 1208–1218. https://doi.org/10.1016/j.biopsych.2005.12.003
Danan D, Todder D, Zohar J, Cohen H (2021) Is PTSD-phenotype associated with HPA-axis sensitivity? Feedback inhibition and other modulating factors of glucocorticoid signaling dynamics. Int J Mol Sci 22: 6050. https://doi.org/0.3390/ijms22116050
Radley JJ, Gosselink KL, Sawchenko PE (2009) A discrete GABAergic relay mediates medial prefrontal cortical inhibition of the neuroendocrine stress response. J Neurosci 29: 7330–7340. https://doi.org/10.1523/JNEUROSCI.5924-08.2009
Gabbott PL, Warner TA, Jays PR, Salway P, Busby SJ (2005) Prefrontal cortex in the rat: projections to subcortical autonomic, motor, and limbic centers. J Comp Neurol 492: 145–177. https://doi.org/10.1002/cne.20738
Radley JJ, Rocher AB, Rodriguez A, Ehlenberger DB, Dammann M, McEwen BS, Morrison JH, Wearne SL, Hof PR (2008) Repeated stress alters dendritic spine morphology in the rat medial prefrontal cortex. J Compar Neurol 507(1): 1141–1150. https://doi.org/10.1002/cne.21588
Yehuda R, Daskalakis NP, Lehrner A, Desarnaud F, Bader HN, Makotkine I, Flory JD, Bierer LM, Meaney MJ (2014) Influences of maternal and paternal PTSD on epigenetic regulation of the glucocorticoid receptor gene in Holocaust survivor offspring. Am J Psychiatry 171: 872–880. https://doi.org/10.1176/appi.ajp.2014.13121571
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


