Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1134-1147
Ранние изменения функционального состояния артерий и сосудов микроциркуляторного русла при моделировании метаболического синдрома
И. А. Царева 1, *, Г. Т. Иванова 1, Г. И. Лобов 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: innatsareva@yandex.ru
Поступила в редакцию 12.06.2022
После доработки 06.08.2022
Принята к публикации 08.08.2022
- EDN: TIXVYX
- DOI: 10.31857/S0869813922090084
Аннотация
Изучены ранние изменения в сердечно-сосудистой системе молодых крыс Вистар при моделировании метаболического синдрома применением фруктозной нагрузки. Установлено, что несмотря на некоторое снижение массы тела у крыс, находившихся на фруктозной диете, по сравнению с крысами контрольной группы, у этих животных были выявлены признаки метаболического синдрома: гипергликемия, инсулинорезистентность, дислипидемия, повышение активности симпатической нервной системы и артериальная гипертензия. Изменения со стороны брыжеечных артерий заключались в повышении реактивности на фенилэфрин и ослаблении ацетилхолин-индуцированной дилатации, что объясняется снижением продукции эндотелием NO, которое в определенной степени компенсируется повышением производства эндотелиального гиперполяризующего фактора, реализующего свой эффект через активацию Са2+-чувствительных К+-каналов промежуточной проводимости. Изменения в гладкомышечных клетках артерий крыс, вызванные фруктозной нагрузкой, заключались в ингибировании растворимой гуанилатциклазы. В микроциркуляторном русле кожи крыс, получавших фруктозную нагрузку, перфузия сохранялась на уровне, характерном для крыс контрольной группы, при этом установлено повышение нейрогенного тонуса и ослабление эндотелийзависимого тонуса микрососудов кожи. Показано также уменьшение продукции NO в сосудах микроциркуляторного русла, которое компенсируется эндотелиальным производством других вазодилатирующих факторов.
Метаболический синдром (МС) в XXI веке представляет собой тихую пандемию, которая является серьезной проблемой для общественного здравоохранения во всем мире. Около 20% взрослого населения Земли (более миллиарда человек) страдают от этого симптомокомплекса [1]. В России распространенность МС высокая и составляет в различных городах среди населения в возрасте от 25 до 74 лет от 35.3 до 53.1% (при использовании трех вариантов критериев МС) [2]. В настоящее время нет единого мнения относительно определения МС и критериев диагностики, но общепризнанно, что он характеризуется сосуществованием ряда метаболических нарушений, включающих несколько факторов риска, таких как резистентность к инсулину, артериальная гипертензия, атерогенная дислипидемия, протромботическое и провоспалительное состояние, которые обычно связаны с накоплением висцерального жира и составляют прогностический набор факторов риска развития сердечно-сосудистых заболеваний. МС сопровождается 5-кратным увеличением риска развития сахарного диабета 2-го типа (СД2) и 3-кратным увеличением риска развития сердечно-сосудистых заболеваний (риск инсульта увеличивается в 2–4 раза, риск инфаркта миокарда в 3–4 раза) по сравнению с теми, у кого МС нет [3]. Ядром синдрома являются четыре фактора риска: резистентность к инсулину, артериальная гипертензия, висцеральное ожирение и дислипидемия [4].
Хотя способы определения МС у детей и подростков остаются спорными, обширные исследования в этой области показывают, что МС затронул и эту когорту населения. Потребление детьми и подростками высококалорийной пищи с фруктозой приводит к развитию у них МС. Распространенность МС у детей в США составляет до 9.8%, у подростков – до 6.3% [5, 6]. У детей часто не все компоненты МС встречаются одновременно. Наиболее ранними проявлениями МС являются дислипидемия и артериальная гипертензия [5].
Высокая распространенность, общественная значимость и высокие риски осложнений приводят к интенсивному изучению этиологии и патогенеза МС. По данным PubMed, за последнее десятилетие было опубликовано около 50 000 статей, посвященных исследованию различных механизмов развития МС, однако многие аспекты патогенеза МС сложны и до конца не изучены [7].
Использование животных в эксперименте имело и имеет большое значение в медицинских исследованиях, в том числе и для изучения обмена веществ. Преимуществом использования животных моделей для изучения МС является возможность наблюдения за гистологическими, функциональными, биохимическими и морфологическими изменениями при МС, что для человека затруднительно, а порой и невозможно. Основными моделями грызунов, используемыми для изучения ожирения и МС, являются генетически модифицированные модели и модели ожирения, вызванного диетой (diet-induced obesity (DIO)). Животные модели DIO наиболее близки к метаболическому синдрому у людей [8]. Однако результаты исследований часто противоречивы, в основном в отношении состава рационов и типа используемой модели [9]. Поиск моделей, которые представляют ожирение и МС так же, как и у людей, может помочь понять не только патофизиологию этих состояний, но и позволить разработать более эффективные методы лечения. Полигенная линия крыс Вистар достаточно широко использовалась для изучения ожирения, вызванного диетой, и продемонстрировала существенное увеличение массы тела, но результаты изменения инсулинемии были противоречивы. У некоторых животных развивалась гиперинсулинемия, а у других нет [10]. Большинство диет были разработаны с комбинацией продуктов с высоким содержанием углеводов и жиров [11]. Особой разновидностью диет с высокой долей углеводов является диета с высоким содержанием фруктозы. В целом, диеты с высоким содержанием фруктозы имитируют диету человека и, когда они связаны с высоким содержанием жира, способствуют увеличению веса, развитию абдоминальномого жира, гипергликемии и гиперинсулинемии у животных [12]. Фруктоза играет важную роль в развитии метаболического синдрома, а также самого ожирения, поскольку этот сахар приводит не только к резистентности к инсулину, но и к резистентности к лептину, что сопровождается увеличением веса [13]. Биологической потребности в пищевой фруктозе нет, это всего лишь промежуточная молекула в процессе метаболизма глюкозы. Концентрация циркулирующей фруктозы в периферической крови в 500 раз ниже по сравнению с глюкозой. Однако потребление фруктозы людьми в настоящее время, особенно в развитых странах, чрезмерно из-за потребления искусственно подслащенных напитков и разнообразных продуктов питания. Большой приток фруктозы в печень вызывает накопление триглицеридов и холестерина из-за ее липогенных свойств, что впоследствии приводит к снижению чувствительности к инсулину, резистентности к инсулину и непереносимости глюкозы [4, 14].
Исследование метаболизма фруктозы выявило преимущество фруктозной диеты в индукции МС на животных моделях по сравнению с глюкозой или крахмалом. Существует высокая корреляция между хроническим высоким потреблением фруктозы с повышенным потреблением энергии, массой тела, ожирением, гипертриглицеридемией, гиперлипидемией, артериальной гипертензией и снижением чувствительности к инсулину у лабораторных животных, приводящих к МС [15]. Что касается количества потребляемой фруктозы, необходимого для развития МС, то исследование, проведенное Sanchez-Lozada и соавт. [16] показало, что даже 10% фруктозы в питьевой воде достаточно для развития артериальной гипертензии и гиперлипидемии у крыс Sprague-Dawley и Вистар.
С момента формулирования определения МС клинические исследования и исследования на животных проводились с целью изучения различных патофизиологических процессов, которые вовлечены в его развитие, в т.ч. и артериальной гипертензии, сопровождающейся тяжелыми осложнениями (инфаркт миокарда, инсульт, повреждение почек, ретинопатия). При МС развитие артериальной гипертензии представляет собой сложный процесс, включающий множество различных сигнальных путей. На сегодняшний день предложено несколько патофизиологических механизмов развития артериальной гипертензии. Принято считать, что основными являются инсулинорезистентность, наличие ожирения, активация симпатической нервной системы и задержка натрия [17]. При этом важнейшим патогенетическим механизмом развития артериальной гипертензии при МС является развивающаяся эндотелиальная дисфункция, сопровождающаяся снижением биодоступности NO (в результате снижения его продукции или инактивации активными формами кислорода), снижением доступности других вазодилататоров (простациклин, эндотелиальный гиперполяризующий фактор) и/или увеличением продукции или активности сосудосуживающих веществ (включая эндотелин-1, простагландины и ангиотензин II) [18, 19].
Целью настоящей работы было исследование ранних функциональных изменений в артериях и сосудах микроциркуляторного русла молодых крыс при моделировании МС с использованием фруктозной нагрузки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Крысы для исследования были получены из Центра коллективного пользования “Биоколлекция” Института физиологии им. И.П. Павлова РАН. Все манипуляции с животными соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации. Протокол исследований одобрен этической комиссией Института физиологии им. И.П. Павлова РАН.
26 самцов крыс стока Вистар в возрасте 4 недель были разделены случайным образом на две группы: 15 особей получали 20%-ную фруктозную нагрузку в питьевой воде на протяжении 16 недель (крысы high-fructose diet (HFrD)); 11 особей – контрольная группа, получали обычную питьевую воду. Обе группы крыс имели свободный доступ к пище и воде (раствору фруктозы). Животные содержались в одинаковых условиях: по 5 крыс в стандартной клетке при температуре в помещении 20–22°C и световом режиме 12 ч свет/12 ч темнота. На протяжении 16 недель четырежды (один раз в месяц) измеряли уровень глюкозы в плазме натощак следующим образом: после 12-часового голодания, под местной анестезией (крем EMLA; 2.5% лидокаин, 2.5% прилокаин, Швеция) у животного надрезали скальпелем кончик хвоста и каплю крови помещали на тестовую полоску глюкометра Accu Chek Active (Германия) и считывали результат.
На 16-й неделе проводили тесты на толерантность к глюкозе и инсулинорезистентность. Глюкозотолерантный тест проводили по следующей схеме: после 12-часового голодания измеряли концентрацию глюкозы в крови вышеуказанным способом. Затем животным внутрибрюшинно вводили 40%-ный раствор глюкозы из расчета 2 г глюкозы/кг массы и через 30, 45, 60, 90, 120 и 240 мин забирали кровь для исследований концентрации глюкозы. По окончании теста животные получали доступ к пище. Тест на инсулинорезистентность проводили по следующей схеме: после 3-часового голодания измеряли базальную концентрацию глюкозы. Затем внутрибрюшинно вводили инсулин (Инсуман Рапид ГТ, Sanofi Aventis, Германия) в дозе 0.75 Ед/кг массы. Через 15, 30, 45, 60, 90, 120 и 180 мин с момента введения инсулина проводили измерение концентрации глюкозы в крови. По окончании теста животные получали доступ к пище.
Измерение артериального давления у бодрствующих крыс выполняли манжеточным методом на хвосте, используя систему неинвазивного измерения кровяного давления у грызунов “Систола” (“Нейроботикс”, Москва). Для каждой крысы выполняли 3 замера и рассчитывали среднее значение измерений.
В конце 16-й недели производили оценку кровотока в микроциркуляторном русле кожи методом лазерной доплеровской флоуметрии (ЛДФ) с помощью анализатора лазерной микроциркуляции крови “ЛАЗМА ПФ” (НПП “Лазма”, Россия). Анализатор помещали на предварительно побритую кожу спины наркотизированного животного (крыс анестезировали внутрибрюшинным введением 50 мкг/кг золетила (Золетил 100, Virbac Sante Animale, Франция) и 50 мкг/кг ксилавета (Pharmamagist Ltd., Венгрия). Метод ЛДФ предусматривает зондирование ткани лазерным излучением в объеме зондируемой ткани около 1 мм3, т.е., в зондируемой области оказываются артериолы, терминальные артериолы, капилляры, постакпиллярные венулы, венулы и артериоло-венулярные анастомозы. Амплитуда отраженного сигнала при ЛДФ формируется в результате отражения излучения от эритроцитов, двигающихся с разной линейной скоростью по всем сосудам микроциркуляторного русла. На выходе прибора формируется итог флоуметрии – сигнал, амплитуда которого пропорциональна количеству и скорости движения эритроцитов в зондируемой области [20].
В данном исследовании ЛДФ регистрировали в три этапа, каждый продолжительностью по 8 мин: в исходном состоянии, после 2-минутного ионофореза ацетилхолина (АХ, 1%, (Sigma-Aldrich, США) с помощью прибора для гальванизации и лекарственного ионофореза “ЭЛФОР-ПРОФ” (Россия) и после 2-минутного введения нитропруссида натрия (НП, 1%, ICN Biomedicals, США). Области введения АХ и НП были разделены и не перекрывались. В результате исследования были зарегистрированы: показатель микроциркуляции, максимальные значения колебаний перфузии в эндотелиальном (Аэ), нейрогенном (Ан) и миогенном (Ам) диапазонах и среднее квадратическое отклонение. В последующем рассчитывали эндотелиальный, нейрогенный и миогенный компоненты сосудистого тонуса, которые характеризуют активные механизмы контроля микрогемодинамики.
Расчет компонентов микрососудистого тонуса проводили по формуле:
Нейрогенный и миогенный компоненты сосудистого тонуса рассчитывали по такой же формуле, заменяя Аэ на Ан и Ам.
На следующем этапе исследования in vivo оценивали реактивность артерий брыжейки у 14 животных (7 крыс, получавших фруктозную нагрузку, 7 крыс – контроль). Исследование проводили на установке, включающей подогреваемый столик, специальную подогреваемую камеру, микроскоп (МСП-2, ЛОМО, Россия) и видеокамеру (Basler, Германия). Обработку результатов проводили в программе MultiMedia Catаlog (MMC, Россия). Крыс наркотизировали раствором Золетил 100 (Vibrac, Франция) из расчета тилетамин/золазепам –10 мг/кг массы тела крысы, с предварительной премедикацией раствором Pометара (Bioveta, Чешская Республика) из расчета ксилазин – 5 мг/кг массы крысы. У наркотизированной крысы через разрез брюшной стенки выводили петлю тонкого кишечника, расправляли и помещали ее в специальный желоб в термостатируемой камере с протекающим физиологическим солевым раствором (PSS) следующего состава (ммоль/л): NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5. PSS сатурировали газовой смесью, состоящей из 95% О2 и 5% СО2. Температуру в камере поддерживали на уровне 37 ± 0.1°С. Исходный диаметр артерий, выбранных для исследования, составлял 160–330 мкм (второй/третий порядок ветвления от верхней брыжеечной артерии).
В процессе исследования оценивали исходный диаметр артерий, затем осуществляли предконтрактирование посредством введения в омывающий раствор фенилэфрина (ФЭ, 1 × 10–6 М, Sigma-Aldrich, США). К концу второй минуты воздействия ФЭ приводил к максимальной вазоконстрикции, вновь оценивали диаметр артерий и затем в камеру добавляли АХ (1 × 10–6 М) или НП (1 × 10–6 М) и вновь проводили измерение диаметра сосудов. В последующем в разных опытах в PSS вводили L-NAME – неселективный ингибитор NO-синтаз (1 × 10–5 М, Sigma-Aldrich, США) или TRAM-34 – специфический блокатор IK(Ca) (1 × 10–5 М, Merck, США) или ODQ – селективный ингибитор NO-чувствительной гуанилатциклазы (1 × 10–5 М, Sigma-Aldrich, США), через 15 мин добавляли ФЭ и на фоне максимальной вазоконстрикции вводили АХ. Амплитуду дилатации на АХ и НП выражали в % от амплитуды констрикции сосуда на ФЭ.
По завершении исследования крыс декапитировали, осуществляли забор крови для определения липидного профиля плазмы (триглицериды (ТГ), холестерин общий (ХС), холестерин-ЛПНП и холестерин-ЛПВП). Биохимический анализ был выполнен на анализаторе ARCHITECT c8000 (США).
При статистической обработке результатов использовали программу Statistica v.12. Полученные данные представлены в виде среднего значения ± стандартная ошибка среднего. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента. В случае распределения вариант в выборке, отличном от нормального, при исследовании реактивности сосудов брыжейки, при сравнении двух независимых групп, применяли U-критерий Манна–Уитни. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
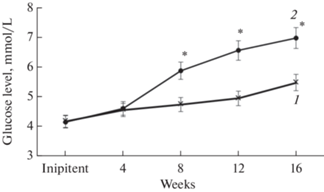
На рис. 1 представлены графики, иллюстрирующие динамику изменения концентрации глюкозы в крови крыс HFrD и крыс контрольной групп. Значимое увеличение уровня глюкозы произошло к 8-й неделе фруктозной диеты и далее уровень глюкозы непрерывно повышался.
Рис. 1.
Концентрация глюкозы в крови крыс, получавших фруктозу (2) и крыс контрольной группы (1) на протяжении 16 недель. * – различия достоверны, p < 0.05.
В табл. 1 представлены полученные в ходе исследования основные показатели, характеризующие МС. Практически по всем показателям в группах были выявлены достоверные различия. Уровень глюкозы натощак у крыс HFrD был достоверно выше по сравнению с аналогичным показателем у контрольных животных. У крыс HFrD было достоверно повышено артериальное давление, как систолическое, так и диастолическое. Наиболее выраженные изменения наблюдались в липидном спектре: уровень ТГ у крыс HFrD был в 2 раза выше по сравнению с контрольными животными, ХС-ЛПНП – выше в 2.5 раза. Неожиданными оказались результаты сравнения массы тела крыс HFrD и крыс контрольной группы: крысы HFrD имели меньшую массу по сравнению с контрольными.
Таблица 1.
Основные показатели, характеризующие метаболический синдром у крыс, получавших фруктозу и крыс контрольной группы
| Показатель | Группа, получавшая фруктозную нагрузку (n = 15) | Контрольная группа (n = 11) |
|---|---|---|
| Масса, г | 382 ± 13* | 418 ± 14 |
| Уровень глюкозы в крови натощак, ммоль/л | 6.98 ± 0.37* | 5.48 ± 0.24 |
| Финальный уровень глюкозы в крови при ГТТ, ммоль/л | 7.0 ± 0.4* | 5.6 ± 0.1 |
| Финальный уровень глюкозы в крови при тесте на ИР, ммоль/л | 7.6 ± 0.3* | 5.5 ± 0.5 |
| АД систолическое, мм рт.ст | 137 ± 7** | 113 ± 6 |
| АД диастолическое, мм рт.ст | 93 ± 6* | 75 ± 5 |
| ТГ, ммоль/л | 1.2 ± 0.2*** | 0.6 ± 0.2 |
| ХС-ЛПВП, ммоль/л | 0.6 ± 0.1 | 0.6 ± 0.1 |
| ХС-ЛПНП, ммоль/л | 0.4 ± 0.1*** | 1.03 ± 0.1 |
| ХС, ммоль/л | 1.5 ± 0.1* | 1.9 ± 0.2 |
Данные представлены в виде среднее ± стандартная ошибка. ГТТ – глюкозотолерантый тест, ИР – инсулинорезистентность, АД – артериальное давление, ТГ – триглицериды, ХС-ЛПВП – холестерин липопротеинов высокой плотности, ХС-ЛПНП – холестерин липопротеинов низкой плотности. Различия по сравнению с контролем достоверны: * – p < 0.05, ** – p< 0.01, *** – p < 0.001.
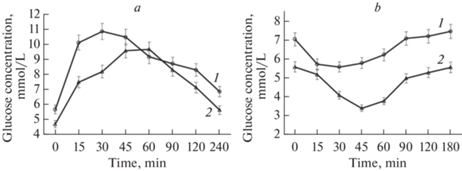
На рис. 2 представлены графики, иллюстрирующие данные, полученные в ходе проведения глюкозотолерантного теста и теста на инсулинорезистентность. Анализ графиков показывает, что толерантность к глюкозе у крыс HFrD снижена по сравнению с крысами контрольной группы (рис. 2а). Максимальная разница в концентрации глюкозы в крови наблюдалась в первые 15–30 мин после введения глюкозы. Тест на инсулинорезистентность продемонстрировал повышение резистентности к инсулину у крыс HFrD (рис. 2b).
Рис. 2.
Тесты на гликемию: a – глюкозотолерантный тест, b – тест на резистентность к инсулину. 1 – график, отражающий динамику концентрации глюкозы в крови крыс, получавших фруктозу, 2 – график, отражающий динамику концентрации глюкозы в крови крыс контрольной группы.
На следующем этапе исследования мы изучили реакции брыжеечных артерий крыс на АХ и НП. Первое, что необходимо отметить, это различия в реакциях артерий на ФЭ: средняя амплитуда ФЭ-индуцированного уменьшения диаметра артерий у крыс HFrD составляла 136.4 ± 8.7% (уменьшение диаметра артерий крыс контрольной группы было принято за 100%). Амплитуда дилатации предконтрактированных артерий на АХ в двух группах крыс была разной: у крыс HFrD она составила 57.3 ± 4.2% от ФЭ-индуцированного сокращения, а в контрольной группе – 71.6 ± 5.5%. Также отличались и реакции артерий на НП: амплитуда дилатации предконтрактированных артерий крыс HFrD составила 47.4 ± 2.9%, а артерий крыс контрольной группы – 63.2 ± 3.4%.
С целью оценки роли NO в дилатации брыжеечных артерий была проведена серия экспериментов с ингибированием эндотелиальной NO-синтазы. Мы использовали ингибитор NO-синтаз L-NAME. На фоне действия L-NAME амплитуда АХ-индуцированной дилатации брыжеечных артерий значительно уменьшилась: в артериях крыс HFrD дилатация уменьшилась на 36%, а в артериях крыс контрольной группы – на 56%.
С целью изучения роли растворимой гуанилатциклазы гладкомышечных клеток в АХ-индуцированной дилатации артерий мы ингибировали этот фермент посредством добавления в раствор ODQ. На фоне ингибирования растворимой гуанилатциклазы эффект АХ значительно уменьшился (дилатация брыжеечных артерий крыс HFrD составила 21.6 ± 1.7%, а артерий крыс контрольной группы – 11.3 ± 1.1%). Применение блокатора Са2+-чувствительных К+-каналов TRAM-34 также привело к уменьшению амплитуды АХ-индуцированной дилатации брыжеечных артерий, при этом в артериях крыс HFrD ингибиторный эффект TRAM-34 был более выражен (табл. 2).
Таблица 2.
Амплитуда АХ- и НП-индуцированной дилатации предконтрактированных артерий брыжейки крыс
| Крысы контрольной группы (n = 7) |
Крысы, получавшие
фруктозную нагрузку (n = 7) |
|
|---|---|---|
| АХ-индуцированная дилатация, % | 71.2 ± 5.5 | 57.3 ± 4.2* |
| АХ-индуцированная дилатация на фоне L-NAME, % | 15.6 ± 2.1 | 21.7 ± 2.6* |
| НП-индуцированная дилатация, % | 63.6 ± 4.2 | 47.4 ± 2.4* |
| АХ-индуцированная дилатация на фоне ODQ, % | 11.3 ± 1.1 | 21.6 ± 1.7** |
| АХ-индуцированная дилатация на фоне TRAM-34, % | 57.8 ± 3.3 | 34.2 ± 1.9** |
В табл. 3 представлены данные, полученные в процессе исследования состояния микроциркуляторного русла кожи у крыс HFrD и крыс контрольной группы на 16-й неделе эксперимента. Исходный показатель микроциркуляции кожи животных обеих групп был практически одинаковым. В то же время σ, представляющая собой среднее колебание перфузии в исследуемой ткани, у крыс HFrD была достоверно больше (0.73 ± 0.04 п.е.) по сравнению с крысами контрольной группы (0.64 ± ± 0.03 п.е.). Коэффициент вариации в микроциркуляторном русле кожи крыс HFrD составил 11.2 ± 0.6%, что было достоверно больше коэффициента вариации в микроциркуляторном русле кожи крыс контрольной группы (9.3 ± 0.4%). Ионофорез АХ привел к практически одинаковому увеличению показателя микроциркуляции в обеих группах. В то же время результаты пробы с НП значительно отличались, у крыс HFrD прирост показателя микроциркуляции был достоверно меньше.
Таблица 3.
Показатель микроциркуляции в коже крыс после ионофореза ацетилхолина и нитропруссида натрия
| Исходный показатель микроциркуляции (п. е.) |
Показатель микроциркуляции после ионофореза АХ (п. е.) | Показатель микроциркуляции после ионофореза НП (п. е.) | |
|---|---|---|---|
| Крысы, получавшие фруктозную нагрузку (n = 15) | 7.03 ± 0.31 | 12.3 ± 0.42 | 9.73 ± 0.36* |
| Крысы контрольной группы (n = 11) | 7.26 ± 0.29 | 12.6 ± 0.45 | 11.0 ± 0.43 |
На основании данных об амплитуде колебаний микрокровотока в разных частотных диапазонах были рассчитаны величины эндотелиального (ЭТ), нейрогенного (НТ) и миогенного тонусов сосудов микроциркуляторного русла кожи крыс (табл. 4). ЭТ в сосудах микроциркуляторного русла кожи крыс HFrD был понижен на 16.1%, НТ повышен на 25.6% по сравнению с аналогичными показателями крыс контрольной группы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как указывалось во введении, МС представляет собой сложный комплекс метаболических нарушений, как правило, сопровождающихся артериальной гипертензией, приводящей к тяжелым сердечно-сосудистым заболеваниям [1, 2]. МС широко распространен среди взрослого населения [2], а в последние десятилетия все чаще выявляется у детей и подростков [5, 6]. Однако развитие МС у детей и подростков остается спорным вопросом, несмотря на обширные исследования в этой области [21]. Именно по этой причине в нашем исследовании моделирование МС было начато на крысах в 4-недельном возрасте. Необходимо отметить, что “идеальной модели” для индуцирования МС не существует. Требования к моделям предусматривают, что они должны быть воспроизводимыми, надежными и доступными [22, 23]. Крысы стока Вистар в достаточной степени соответствуют этим требованиям [10]. Мы остановились на диете с достаточно высоким содержанием фруктозы в питьевой воде. Фруктоза оказывает выраженное влияние на метаболизм и важна при моделировании МС, поскольку приводит не только к гипергликемии, но и индуцирует инсулинорезистентность и резистентность к лептину [24].
В нашем наблюдении уже через четыре недели фруктозной нагрузки концентрация глюкозы в крови крыс достоверно повысилась и держалась повышенной на протяжении всего эксперимента. И хотя превышение концентрации глюкозы в крови крыс HFrD было невысоким, были выявлены другие признаки нарушения углеводного обмена: повышенный уровень глюкозы в крови при проведении глюкозотолерантного теста и теста на инсулинорезистентность. Наряду с этими изменениями метаболизма была зарегистрирована выраженная дислипидемия. Со стороны сердечно-сосудистой системы изменения заключались в достоверном повышении систолического и диастолического артериального давления.
Таким образом, несмотря на то, что масса тела крыс HFrD была меньше по сравнению с крысами контрольной группы, гипергликемия, дислипидемия и артериальная гипертензия являются проявлениями МС. Отсутствие ожирения при моделировании МС у крыс встречается довольно часто, диетические вмешательства вызывают только отдельные симптомы МС [25], например, у крыс Sprague Dawley при фруктозной диете развивается инсулинорезистентность, гиперинсулинемия и гипертензия, а масса тела изменяется незначительно [26]. Так же у детей и подростков не всегда гиперинсулинемия и инсулинорезистентность связаны с количеством жировой ткани [27].
В нашей работе основное внимание было уделено изменениям в сердечно-сосудистой системе, развивающимся при моделировании МС. Как уже отмечалось, у крыс HFrD достоверно повышалось систолическое и диастолическое артериальное давление.
Известно, что инсулинорезистентность, характерная для МС, приводит к активации симпатической нервной системы, это важнейший механизм повышения артериального давления [28]. Гипертриглицеридемия, выявленная в нашем исследовании у крыс HFrD, также является важным фактором сердечно-сосудистого риска и еще одним механизмом развития артериальной гипертензии [29]. Одновременно с этими изменениями при МС выявляется эндотелиальная дисфункция [30], выражающаяся, в частности, в снижении продукции эндотелиоцитами вазодилататоров. Неповрежденный эндотелий продуцирует вазодилатирующие факторы: NO, простациклин и эндотелиальный гиперполяризующий фактор, тем самым обеспечивая баланс между вазодилатацией и вазоконстрикцией, которые определяют диаметр артерий и, следовательно, артериальное давление [31].
Исследование брыжеечных артерий крыс обеих групп позволило выявить определенные функциональные изменения в артериях крыс HFrD. В частности, констрикция артерий крыс HFrD на фенилэфрин была значительно большей по сравнению с артериями крыс контрольной группы, что, по-видимому, является проявлением повышенной симпатической активации и повышения экспрессии α1-адренорецепторов на мембране гладкомышечных клеток артерий, характерной для артериальной гипертензии [32].
Также было установлено снижение амплитуды АХ- и НП-индуцированной дилатации брыжеечных артерий крыс HFrD (на 14 и 16% соответственно). Известно, что неповрежденный эндотелий продуцирует вазодилатирующие факторы, тем самым обеспечивая баланс между вазодилатацией и вазоконстрикцией, которые определяют диаметр артерий и, следовательно, артериальное давление [33]. Уменьшение АХ-индуцированной дилатации свидетельствует о нарушении вазодилатирующей функции эндотелия в артериях крыс HFrD и уменьшении продукции вазодилататоров. Для ответа на вопрос: производство какого вазодилататора было нарушено в наибольшей степени, мы использовали L-NAME, являющийся ингибитором NO-синтаз. На фоне L-NAME амплитуда дилатации в артериях крыс HFrD снизилась на 36%, в то время как в артериях крыс контрольной группы – на 56%. Эти данные свидетельствуют, что NO является важнейшим вазодилататором в брыжеечных артериях крыс и его производство значительно снижено в артериях крыс HFrD.
Изучение вазодилатирующего влияния НП на брыжеечные артерии крыс показало различия в величине НП-опосредованной дилатации в двух группах, амплитуда дилатации артерий крыс HFrD была достоверно меньше. Поскольку НП является экзогенным донором NO и его концентрация в растворе не зависела от состояния эндотелия, следует полагать, что у крыс HFrD нарушены механизмы внутриклеточной сигнализации в гладкомышечных клетках артерий. Для выяснения этого вопроса были проведены эксперименты с ингибированием NO-зависимой растворимой гуанилатциклазы ODQ. Действие ODQ приводило к уменьшению АХ-индуцируемой дилатации в обеих группах крыс, при этом снижение амплитуды дилатации в артериях крыс контрольной группы составило 60%, а в артериях крыс HFrD – 36%. Полученные данные позволяют заключить что в гладкомышечных клетках брыжеечных артерий крыс HFrD наблюдается ингибирование растворимой гуанилатциклазы, что приводит к ослаблению NO-опосредованной дилатации.
Мы также провели эксперименты по выяснению возможной роли эндотелиальной гиперполяризации в АХ-индуцируемой дилатации брыжеечных артерий крыс. С этой целью в раствор вводили TRAM-34 – специфический блокатор Са2+-чувствительных К+-каналов промежуточной проводимости [34]. На фоне TRAM-34 амплитуда АХ-индуцируемой дилатации артерий уменьшалась: у крыс контрольной группы – на 14%, а у крыс HFrD – на 23%. Результаты этих экспериментов позволяют сделать два заключения: 1 – в брыжеечных артериях крыс Вистар функционирует механизм дилатации, заключающийся в эндотелиальной гиперполяризации, обусловленной активацией Са2+-чувствительных К+-каналов промежуточной проводимости; 2 – в эндотелиальных клетках артерий крыс HFrD в процессе развития МС и снижения продукции/биодоступности NO компенсаторно возрастает роль эндотелиальной гиперполяризации, что часто наблюдается и при других видах патологии, сопровождающихся повреждением эндотелия [35].
Исследование состояния сосудов микроциркуляторного русла кожи крыс HFrD, проведенное методом ЛДФ, показало незначительное уменьшение перфузии кожи по сравнению с крысами контрольной группы. В микрососудах кожи крыс HFrD было зарегистрировано увеличение нейрогенного тонуса, что является подтверждением повышения у них симпатической активности (табл. 3). При этом повышение симпатической активности не привело к ограничению кровотока в микрососудах кожи. Это может быть связано с нивелированием эндотелием избыточной вазоконстрикции микрососудов кожи, вызванной повышенной активностью симпатической нервной системы у крыс HFrD посредством усиления продукции вазодилататоров (эндотелиального гиперполяризующего фактора), что подтверждается зарегистрированным ослаблением эндотелиального тонуса сосудов микроциркуляторного русла у крыс HFrD (табл. 3) [20].
Одинаковое увеличение показателя микроциркуляции в коже крыс обеих групп после ионофореза АХ свидетельствует о способности эндотелия микрососудов кожи крыс обеих групп продуцировать достаточное количество вазодилататоров (АХ-индуцированный прирост показателя микроциркуляции составил в обеих группах 65–67%). В то же время данные о величинах показателя микроциркуляции кожи после ионофореза НП (в контрольной группе прирост этого показателя составил 52%, а у крыс HFrD – лишь 30%) показывают, что механизмы увеличения микрокровотока в коже в разных группах крыс существенно отличаются. Если у контрольных крыс увеличение показателя микроциркуляции было опосредовано усилением продукции NO, то у крыс HFrD NO обеспечивал меньшую дилатацию. По-видимому, выраженная дилатация микрососудов в коже крыс HFrD при ионофорезе АХ так же, как и в брыжеечных артериях, обусловлена возрастанием продукции эндотелиального гиперполяризующего фактора (основанием для подобного предположения являются данные о повышении роли эндотелий-зависимой гиперполяризации в брыжеечных артериях крыс HFrD).
ЗАКЛЮЧЕНИЕ
Нами изучены ранние изменения в сердечно-сосудистой системе молодых крыс при моделировании МС с применением фруктозной нагрузки. Установлено, что несмотря на некоторое снижение массы тела у крыс, находившихся на фруктозной диете, по сравнению с крысами контрольной группы, у этих животных были выявлены признаки МС: гипергликемия, инсулинорезистентность, дислипидемия, повышение активности симпатической нервной системы и артериальная гипертензия. Изменения со стороны брыжеечных артерий заключались в повышении реактивности на ФЭ и ослаблении АХ-индуцированной дилатации, что объясняется снижением продукции эндотелием NO. При этом было установлено, что в этих артериях повышается продукция эндотелиального гиперполяризующего фактора, компенсирующего в определенной степени дефицит NO. Изменения в гладкомышечных клетках артерий заключались в ослаблении эффективности NO-опосредованной сигнализации: было выявлено ингибирование растворимой гуанилатциклазы. В микроциркуляторном русле кожи крыс, получавших фруктозную нагрузку, перфузия сохранялось на уровне, характерном для крыс контрольной группы, при этом было обнаружено повышение нейрогенного тонуса и ослабление эндотелий-зависимого тонуса микрососудов кожи. Показано также уменьшение продукции NO в сосудах микроциркуляторного русла, которое компенсируется производством эндотелием других вазодилатирующих факторов.
Список литературы
Saklayen MG (2018) The Global Epidemic of the Metabolic Syndrome. Curr Hypertens Rep 20 (2): 12. https://doi.org/ doi:10.1007/s11906-018-0812-z
Ротарь ОП, Либис РА, Исаева ЕН, Ерина АМ, Шавшин ДА, Могучая ЕВ, Колесова ЕП, Бояринова МА, Морошкина НВ, Яковлева ОИ, Солнцев ВН, Конради АО, Шляхто ЕВ (2012) Распространенность метаболического синдрома в разных городах РФ. Рос кардиол журн (2): 55–62. [Rotar OP, Libis RA, Isaeva EN, Erina AM, Shavshin DA, Moguchaya EV, Kolesova EP, Boyarinova MA, Moroshkina NV, Yakovleva OI, Solntsev VN, Konradi AO, Shlyakhto EV (2012) Metabolic syndrome prevalence in russian cities. Russ J Cardiol (2): 55–62. (In Russ)].
Lopez-Candales A, Hernández Burgos PM, Hernandez-Suarez DF, Harris D (2017) Linking Chronic Inflammation with Cardiovascular Disease: From Normal Aging to the Metabolic Syndrome. J Nat Sci 3(4): e341.
Bovolini A, Garcia J, Andrade MA, Duarte JA (2021) Metabolic Syndrome Pathophysiology and Predisposing Factors. Int J Sports Med 42(3): 199–214.https://doi.org/10.1055/a-1263-0898
Lee AM, Gurka MJ, DeBoer MD (2016) Trends in Metabolic Syndrome Severity and Lifestyle Factors Among Adolescents. Pediatrics 137(3): e20153177.https://doi.org/10.1542/peds.2015-3177
DeBoer MD (2019) Assessing and Managing the Metabolic Syndrome in Children and Adolescents. Nutrients 11(8): 1788. https://doi.org/10.3390/nu11081788
Samson SL, Garber AJ (2018) Metabolic syndrome. Endocrinol Metab Clin North Am 43(1): 1–23. https://doi.org/10.1016/j.ecl.2013.09.009
Fuchs T, Loureiro MP, Macedo LE, Nocca D, Nedelcu M, Costa-Casagrande TA (2018) Animal models in metabolic syndrome. Rev Col Bras Circ 45(5): e1975.https://doi.org/10.1590/0100-6991e-20181975
Nilsson C, Raun K, Yan FF, Larsen MO Tang-Christensen M (2012) Laboratory animals as surrogate models of human obesity. Acta Pharmacol Sin 33(2): 173–181.https://doi.org/10.1038/aps.2011.203
Estadella D, Oyama LM, Dâmaso AR, Ribeiro EB, Oller Do Nascimento CM (2004) Effect of palatable hyperlipidic diet on lipid metabolism of sedentary and exercised rats. Nutrition 20(2): 218–224.https://doi.org/10.1016/j.nut.2003.10.008
Wong SK, Chin KY, Suhaimi FH, Fairus A, Ima-Nirwana S (2016) Animal models of metabolic syndrome: a review. Nutr Metab (Lond)13: 65. https://doi.org/10.1186/s12986-016-0123-9
Sato Mito N, Suzui M, Yoshino H, Kaburagi T, Sato K (2009) Long term effects of high fat and sucrose diets on obesity and lymphocyte proliferation in mice. J Nutr Health Aging 13(7): 602–606. https://doi.org/10.1007/s12603-009-0170-2
Aydin S, Aksoy A, Aydin S, Kalayci M, Yilmaz M, Kuloglu T, Citil C, Catak Z (2014) Today’s and yesterday’s of pathophysiology: biochemistry of metabolic syndrome and animal models. Nutrition 30(1): 1–9. https://doi.org/10.1016/j.nut.2013.05.013
Basciano H, Federico L, Adeli K (2005) Fructose, insulin resistance, and metabolic dyslipidemia. Nutr Metab (Lond) 2(1): 5. https://doi.org/10.1186/1743-7075-2-5
Johnson RJ, Segal MS, Sautin Y, Nakagawa T, Feig DI, Kang DH, Gersch MS, Benner S, Sánchez-Lozada LG (2007) Potential role of sugar (fructose) in the epidemic of hypertension, obesity and the metabolic syndrome, diabetes, kidney disease, and cardiovascular disease. Am J Clin Nutr 86(4): 899–906. https://doi.org/10.1093/ajcn/86.4.899
Sánchez-Lozada LG, Tapia E, Jiménez A, Bautista P, Cristóbal M, Nepomuceno T, Soto V, Avila-Casado C, Nakagawa T, Johnson RJ, Herrera-Acosta J, Franco M (2007) Fructose-induced metabolic syndrome is associated with glomerular hypertension and renal microvascular damage in rats. Am J Physiol Renal Physiol 292(1): F423–F429. https://doi.org/10.1152/ajprenal.00124.2006
Kotsis V, Jordan J, Micic D, Finer N, Leitner DR, Toplak H, Tokgozoglu L, Athyros V, Elisaf M, Filippatos TD, Redon J, Redon P, Antza C, Tsioufis K, Grassi G, Seravalle G, Coca A, Sierra C, Lurbe E, Stabouli S, Jelakovic B, Nilsson PM (2018) Obesity and cardiovascular risk: a call for action from the European Society of Hypertension Working Group of Obesity, Diabetes and the High-risk Patient and European Association for the Study of Obesity: part A: mechanisms of obesity induced hypertension, diabetes and dyslipidemia and practice guidelines for treatment. J Hypertens 36(7): 1427–1440.https://doi.org/10.1097/HJH.0000000000001730
Tziomalos K, Athyros VG, Karagiannis A, Mikhailidis DP (2010) Endothelial dysfunction in metabolic syndrome: prevalence, pathogenesis and management. Nutr Metab Cardiovasc Dis 20(2): 140–146.https://doi.org/10.1016/j.numecd.2009.08.006
Deanfield JE, Halcox JP, Rabelink TJ (2007) Endothelial function and dysfunction: testing and clinical relevance. Circulation 115(10): 1285–1295. https://doi.org/10.1161/CIRCULATIONAHA.106.652859
Крупаткин АИ, Сидоров ВВ (2005) Лазерная доплеровская флоуметрия микроциркуляции крови. М. Медицина. [Krupatkin AI, Sidorov VV (2005) Laser Doppler flowmetry of blood microcirculation. М. Medicine. (In Russ)].
Serbis A, Giapros V, Galli-Tsinopoulou A, Siomou E (2020) Metabolic Syndrome in Children and Adolescents: Is There a Universally Accepted Definition? Does it Matter? Metab Syndr Relat Disord 18(10): 462–470.https://doi.org/10.1089/met.2020.0076
Rohman M, Lukitasari M, Nugroho D, Nashi W, Nugraheini N, Sardjono T (2017) Development of an Experimental Model of Metabolic Syndrome in Sprague Dawley Rat. Res J Life Sci 4(1): 76–86.https://doi.org/10.21776/ub.rjls.2017.004.01.10
Moreno-Fernández S, Garcés-Rimón M, Vera G, Astier J, Landrier JF, Miguel M (2018) High Fat/High Glucose Diet Induces Metabolic Syndrome in an Experimental Rat Model. Nutrients 10(10): 1502. https://doi.org/10.3390/nu10101502
Sheludiakova A, Rooney K, Boakes RA (2012) Metabolic and behavioural effects of sucrose and fructose/glucose drinks in the rat. Eur J Nutr 51(4): 445–454. https://doi.org/10.1007/s00394-011-0228-x
Bertram CE, Hanson MA (2001) Animal models and programming of the metabolic syndrome. Br Med Bull 60: 103–121. https://doi.org/10.1093/bmb/60.1.103
Oron-Herman M, Kamari Y, Grossman E, Yeger G, Peleg E, Shabtay Z, Shamiss A, Sharabi Y (2008) Metabolic syndrome: comparison of the two commonly used animal models. Am J Hypertens 21(9): 1018–1022. https://doi.org/10.1038/ajh.2008.218
Litwin M, Kułaga Z (2021) Obesity, metabolic syndrome, and primary hypertension. Pediatr Nephrol 36(4): 825–837.https://doi.org/10.1007/s00467-020-04579-3
da Silva AA, do Carmo JM, Li X, Wang Z, Mouton AJ, Hall JE (2020) Role of Hyperinsulinemia and Insulin Resistance in Hypertension: Metabolic Syndrome Revisited. Can J Cardiol 36(5): 671–682.https://doi.org/10.1016/j.cjca.2020.02.066
Hert KA, Fisk PS 2nd, Rhee YS, Brunt AR (2014) Decreased consumption of sugar-sweetened beverages improved selected biomarkers of chronic disease risk among US adults: 1999 to 2010. Nutr Res 34(1): 58–65.https://doi.org/10.1016/j.nutres.2013.10.005
Tziomalos K, Athyros VG, Karagiannis A, Mikhailidis DP (2010) Endothelial dysfunction in metabolic syndrome: prevalence, pathogenesis and management. Nutr Metab Cardiovasc Dis 20(2): 140–146. https://doi.org/10.1016/j.numecd.2009.08.006
Spieker LE, Noll G, Ruschitzka FT, Maier W, Lüscher TF (2000) Working under pressure: the vascular endothelium in arterial hypertension. J Hum Hypertens 14(10–11): 617–630. https://doi.org/ doi:10.1038/sj.jhh.1001012
Clements ML, Banes AJ, Faber JE (1997) Effect of mechanical loading on vascular alpha 1D- and alpha 1B-adrenergic receptor expression. Hypertension 29(5): 1156–1164.https://doi.org/10.1161/01.hyp.29.5.1156
Félétou M, Köhler R, Vanhoutte PM (2012) Nitric oxide: orchestrator of endothelium-dependent responses. Ann Med 44(7): 694–716. https://doi.org/10.3109/07853890.2011.585658
Li JC, Velagic A, Qin CX, Li M, Leo CH, Kemp-Harper BK, Ritchie RH, Woodman OL (2021) Diabetes Attenuates the Contribution of Endogenous Nitric Oxide but Not Nitroxyl to Endothelium Dependent Relaxation of Rat Carotid Arteries. Front Pharmacol 21(11): 585740. https://doi.org/10.3389/fphar.2020.585740
Yada T, Shimokawa H, Tachibana H (2018) Endothelium-dependent hyperpolarization-mediated vasodilatation compensates nitric oxide-mediated endothelial dysfunction during ischemia in diabetes-induced canine coronary collateral microcirculation in vivo. Microcirculation 25(5): e12456. https://doi.org/10.1111/micc.12456
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


