Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 9, стр. 1125-1133
Экспрессия mTOR в нейронах туберальной области гипоталамуса крыс при старении
П. А. Анфимова 1, К. Ю. Моисеев 1, В. В. Порсева 1, Л. Г. Панкрашева 1, П. М. Маслюков 1, *
1 Ярославский государственный медицинский университет
Ярославль, Россия
* E-mail: mpm@ysmu.ru
Поступила в редакцию 31.05.2022
После доработки 15.07.2022
Принята к публикации 16.07.2022
- EDN: WJIQCD
- DOI: 10.31857/S0869813922090126
Аннотация
Экспрессия мишени рапамицина млекопитающих (mammalian target of rapamycin, mTOR) и белка RICTOR определялась в нейронах туберальной области гипоталамуса крысы при помощи иммуногистохимического метода у самцов крыс в возрасте 3, 6, 12 и 24 мес. Мы впервые показали наличие mTOR-иммунопозитивных (ИП) нейронов в дугообразном (ARN), дорсомедиальном (DMN) и вентромедиальном (VMN) ядрах гипоталамуса, а также RICTOR-ИП нейронов в ARN и VMN у крыс разного возраста. При старении увеличивается процент mTOR-ИП нейронов и уменьшается доля mTOR-ИП нейронов, колокализующих RICTOR в ARN. В VMN и DMN наибольший процент mTOR-ИП нейронов отмечен у крыс в возрасте 6 мес. Наибольший процент RICTOR-ИП нейронов отмечен в VMN 6-месячных крыс. Таким образом, при старении наблюдаются изменения экспрессии mTOR в нейронах туберальных ядер гипоталамуса.
Мишенью рапамицина у млекопитающих (mammalian target of rapamycin, mTOR) служит серин/треониновая киназа, принадлежащая к семейству киназ, родственных фосфоинозитид-3-киназе (PI3K). Установлено, что mTOR может регулировать различные клеточные процессы, включая клеточный рост, выживание клеток и аутофагию. Наличие питательных веществ и кислорода вызывает активацию пути mTOR, что усиливает анаболические процессы, включая биосинтез белков и липидов [1]. mTOR может быть представлена двумя различными белковыми комплексами: mTOR комплекс 1 (mTORC1) и mTOR комплекс 2 (mTORC2), каждый из которых содержит различные белковые компоненты и фосфорилирует разные субстраты. mTORC1 образован взаимодействием протеинкиназы mTOR с белком Raptor, а также субстратом Akt PRAS40. mTORC2 образован взаимодействием mTOR с каркасным белком RICTOR, а также с другими mTORC2-специфическими белковыми субъединицами, включая mSin1 и Protor-1/2. Как mTORC1, так и mTORC2 включают mLST8/GβL, необходимый для сборки и стабильности комплекса, а также регуляторный белок DEPTOR [2].
mTORC1 ингибируется рапамицином и интегрирует гормональные и сигналы внешней среды, стимулирует биосинтез белка и аутофагию. mTORC2 является ключевым эффектором сигнального пути инсулина, регулирующим несколько субстратов в каскаде от рецептора инсулина/инсулиноподобного фактора роста 1 (insulin-like growth factor 1, IGF1) [2]. Он значительно менее чувствителен к рапамицину, играет роль в организации цитоскелета и является важным эффектором передачи сигналов инсулина/PI3K [3]. По данным литературы, гипоталамическая активность mTORC2 увеличивается с возрастом у мышей, и генный нокаут этого комплекса в нейронах гипоталамуса приводил к увеличению жировой массы, нарушению гомеостаза глюкозы и снижению продолжительности жизни [4].
Одной из возможных причин старения является дисфункция гипоталамуса, в частности возрастное повышение порога чувствительности гипоталамуса к гомеостатическим сигналам [5, 6]. При этом в туберальной группе ядер, в частности в ARN, VMN и DMN, у старых крыс наблюдаются морфологические, нейрохимические и функциональные изменения нейронов [7–9]. Тем не менее, данных об изменении экспрессии mTOR, а также mTORC2 при старении в литературе нет.
Целью исследования явилось определение локализации mTOR-, mTORC2/RICTOR-экспрессирующих нейронов в туберальной группе ядер гипоталамуса и колокализации mTOR с RICTOR.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на самцах крыс (n = 20) линии Вистар в возрасте 3 (n = 5), 6 (n = 5), 12 (n = 5) и 24 мес. (n = 5) с соблюдением “Правил проведения работ с использованием экспериментальных животных” (приказ № 775 от 12.08.1977 г. МЗ СССР), в соответствии с принципами Базельской декларации и рекомендациями этического комитета ФГБОУ ВО ЯГМУ Минздрава РФ.
После введения летальной дозы уретана (3 г/кг, внутрибрюшинно), животных перфузировали транскардиально раствором стандартного фоcфатно-cолевого буфеpа (PBS; 0.01 М, pH 7.4) (БиолоТ, Россия). С целью проведения иммуногистохимических исследований, животных (n = 20) затем перфузировали 4%-ным pаcтвоpом паpафоpмальдегида (Sigma, США) на PBS. После перфузии головной мозг извлекали и иссекали участок гипоталамуса в области срединного возвышения согласно координатам атласа мозга крыс [16]. Серии коронарных срезов гипоталамуса толщиной 14 мкм изготовляли с помощью криотома Shandon E (Thermo Scientific, Великобритания), монтировали на стекла Superfrost/Plus (Thermo Scientific, США), высушивали при комнатной температуре и хранили при температуре –20°С.
С целью выявления нейронов, содержащих mTOR и mTORC2 применялось двойное иммуномечение антителами. Срезы преинкубировали в течение 30 мин при комнатной температуре в PBS с добавлением 10% ослиной сыворотки (“Jackson Immunoresearch”, США), 1% тритона X-100, 0.1% бычьего сывороточного альбумина, 0.05% тимерозола. Затем срезы инкубировали с первичными антителами (кроличьи против mTOR, 1 : 200, Invitrogen, PA5-34663; мышиные против mTOR, 1 : 100, Santa Cruz, sc-517464; мышиные против RICTOR (компонент комплекса mTORC2), 1 : 100, Santa Cruz, sc-271081) в течение 24 ч при комнатной температуре. После кратковременной промывки в PBS срезы инкубировали с вторичными антителами в течение 2 ч. Вторичные антитела были конъюгированы с флуорохромами – флуоресцеин-изотиоцианатом (FITC) и индокарбоцианином (Cy3) (разведение 1 : 150, “Jackson Immunoresearch”, США) с эмиссией в зеленой и красной области спектра соответственно. Окраску клеток всей популяции нейронов проводили красителем, флуоресцирующим в зеленой области спектра, NeuroTrace Green Fluorescent Nissl Stains (Molecular Probes, США) – разведение 1 : 200. После этого срезы отмывали в PBS и заключали в среду для флуоресцентной микроскопии VectaShield (Vector Laboratories, США). Для исключения неспецифической реакции часть срезов инкубировали без первичных и/или вторичных антител.
Анализ препаратов проводили на флуоресцентном микроскопе “Olympus BX43” (Токио, Япония) с соответствующим набором светофильтров и охлаждаемой цифровой CCD камерой Tucsen FL-20 c программным обеспечением Mosaic V2.1 (Китай). Для выявления меченых нейронов использовали каждый третий из серийных срезов. Число иммунопозитивных (ИП) нейронов определяли на изображениях срезов, полученных под объективом 20×/0.50. Площадь изображений составляла 0.14 мм2. Долю ИП нейронов определяли как их отношение к общему количеству нейронов, выявленных NeuroTrace Fluorescent Nissl Stains, или суммарному количеству mTOR-ИП и RICTOR-ИП нейронов, которое принимали за 100%. Анализу подлежали нейроны, в которых срез прошел через ядро с видимым ядрышком и с флуоресценцией, превышающей фоновое свечение. Процент ИР нейронов определяли с помощью программы Image J (NIH, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
MTOR-ИП нейроны обнаруживались во всех исследованных возрастных группах в ARN, DMN и VMN (рис. 1). В ходе возрастного развития процент mTOR-содержащих нейронов достоверно увеличивался в ARN в течение первого года жизни (p < 0.05) и далее не изменялся у старых животных (р > 0.05) (рис. 2). В DMN доля mTOR-ИП нейронов достигала максимального значения к первому полугодию жизни, снижалась к первому году и далее достоверно не отличалась от старых животных (p > 0.05). В VMN у 3-месячных крыс более половины нейронов ядра была mTOR-ИП, процент ИП нейронов достоверно увеличивался и достигал максимального значения к первому полугодию жизни (p < 0.05), далее снижался у 12-месячных крыс и был минимальным у старых 24-месячных животных (p < 0.05).
Рис. 1.
Микрофотографии с двойным мечением: окраска NeuroTrace Green (NTG, зеленый, левый ряд), mTOR (красный, средний ряд), комбинированное фото mTOR + NeuroTrace Green (правый ряд) нейронов ARN (a, b), VMN (c, d), DMN (e, f) 6-месячных (a, c, e) и 24-месячных (b, d, f) крыс. Флуоресценция Сy3 (красный), NeuroTrace Green (зеленый). Масштаб – 50 мкм.

Рис. 2.
Процент mTOR-ИР (a), RICTOR-ИР (b), mTOR-ИР, колокализующих RICTOR (с) нейронов в ARN, VMТ, DMN 3-, 6-, 12-, 24-месячных крыс. *p < 0.05, различия достоверны по сравнению с 24-месячными животными.
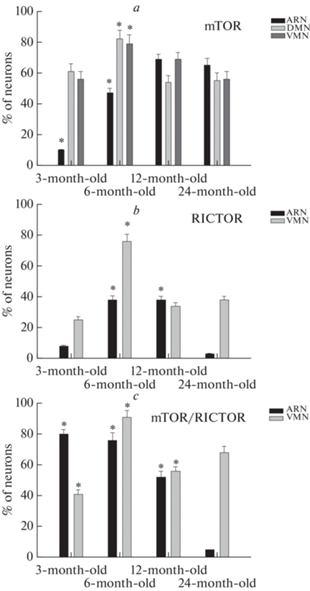
RICTOR-ИП нейроны выявлялись в ARN и VMN (рис. 3), но отсутствовали в DMN. В ARN у 3-месячных и старых животных содержание этого белка было очень низким, но у 6- и 12-месячных животных значительно повышалось (p < 0.001). В VMN 3-месячных животных четверть нейронов была RICTOR-ИП, процент ИП нейронов возрастал (рис. 2) и был максимален у 6-месячных крыс (p < 0.05), далее снижался у 12-месячных животных и был минимальным у старых крыс (p < 0.05).
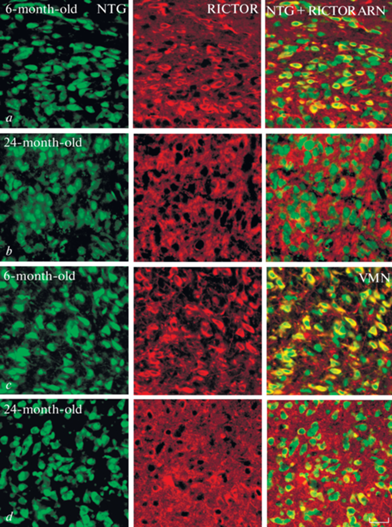
Рис. 3.
Микрофотографии с двойным мечением: окраска NeuroTrace Green (NTG, зеленый, левый ряд), RICTOR (красный, средний ряд), комбинированное фото RICTOR + NTG (правый ряд) нейронов ARN (a, b), VMN (c, d) 6-месячных (a, c) и 24-месячных (b, d) крыс. Флуоресценция Сy3 (красный), NeuroTrace Green (зеленый). Масштаб – 50 мкм.
При исследовании колокализации mTOR и RICTOR были выявлены нейроны, содержащие только mTOR, а также ИП нейроны к mTOR и RICTOR. Нейроны, ИП только к RICTOR, отсутствовали. В ARN процент нейронов, колокализующих mTOR и RICTOR, был максимален у 3-месячных крыс (рис. 2), далее достоверно снижался в онтогенезе и был минимален у старых 24-месячных животных (p < 0.05). В VMN процент mTOR/RICTOR-ИП нейронов возрастал с 3 мес., достигая максимума у 6-месячных крыс (p < 0.05), а далее снижался у 12-месячных животных без достоверных отличий от старых крыс (p > 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты нашего исследования свидетельствуют, что при старении происходят изменения экспрессии mTOR сигнального пути, в т.ч. компонентов mTORC1 и mTORC2.
Мы впервые показали наличие mTOR-ИР нейронов в ARN, DMN и VMN, а также RICTOR-ИП нейронов в ARN и VMN у крыс разного возраста. Нами впервые обнаружено, что при старении увеличивается процент mTOR-ИП нейронов клеток в ARN. В VMN и DMN наибольший процент mTOR-ИП нейронов отмечен у крыс в возрасте 6 мес. Литературные данные свидетельствуют, что усиление сигнального пути mTORС1 в нейронах гипоталамуса, содержащих проопиомеланокортин (POMC) способствует возрастному ожирению, вызывая сайленсинг этих нейронов и, как следствие, увеличение потребления пищи [10].
Нами выявлено уменьшение доли mTOR-ИП нейронов, колокализующих RICTOR в ARN. Наибольший процент RICTOR-ИП нейронов отмечен в VMN 6-месячных крыс. У 12-месячных и старых 24-месячных животных процент RICTOR-ИП нейронов снижается. RICTOR является компонентом mTORC2. Выключение RICTOR в ЦНС приводило к повышению потребления пищи и ожирению, гипергликемии натощак. Подобный фенотип также наблюдался после нокаута RICTOR, особенно в нейронах, ИП к POMC, тогда как нокаут в нейронах, ИП к агути-подобному пептиду (AgRP) имел минимальные эффекты. Хотя механизм, с помощью которого mTORC2 регулирует толерантность к глюкозе в POMC-ИР не ясен, мыши с выключением рецептора инсулина в нейронах демонстрировали частично сходные фенотипы с мышами, лишенными RICTOR в POMC-ИП нейронах, что указывает на критическую роль mTORC2 в регуляции метаболизма [11]. Учитывая, что старение сопровождается метаболическим синдромом, можно предположить участие нейронов гипоталамуса, прежде всего ARN, в этом процессе, что сопровождается повышением экспрессии mTOR и снижением экспрессии mTORC2 и RICTOR.
Генетическое ингибирование передачи сигналов mTOR, а также применение рапамицина может увеличивать продолжительность жизни дрожжей, червей и мух [12–14]. Нокаут по гену Rictor сильно сокращает продолжительность жизни самцов, но не самок мышей [15]. Передача сигналов mTORC2 также значительно повышена у долгоживущих карликовых мышей Snell и мышей с нокаутом рецептора гормона роста [16]. Ингибирование сигнального пути инсулина/IGF1/mTOR может быть важным механизмом, посредством которого вмешательства (например, рапамицин, ограничение калорий), увеличивают продолжительность жизни [17, 18].
Старение сопровождается повышением порога чувствительности нейронов гипоталамуса к регуляторным сигналам. В предыдущих исследованиях нами установлено, что при старении снижается экспрессия микроРНК Let-7a в ядрах медиобазальной группы ядер гипоталамуса, преимущественно у самцов [19]. Члены семейства миРНК Let-7 участвуют в регуляции метаболизма глюкозы, действуют как супрессоры многих генов, участвующих в сигнальном пути инсулина, включая RICTOR [20]. В некоторых тканях, например, в скелетной мышечной и белой жировой, let-7 подавляет активацию mTORC1, вызывая аутофагию при недостатке питательных веществ [21].
Таким образом, результаты исследования свидетельствуют, что при старении у самцов происходят изменения экспрессии mTOR, в том числе компонента mTORC2 главным образом в ARN гипоталамуса. Избирательное влияние на эти сигнальные пути может быть использовано для разработки средств, увеличивающих продолжительность жизни.
Список литературы
Simcox J, Lamming DW (2022) The central moTOR of metabolism. Dev Cell 57(6): 691–706. https://doi.org/10.1016/j.devcel.2022.02.024
Kennedy BK, Lamming DW (2016) The Mechanistic Target of Rapamycin: The Grand ConducTOR of Metabolism and Aging. Cell Metab 23(6): 990–1003. https://doi.org/10.1016/j.cmet.2016.05.009
Liu GY, Sabatini DM (2020) mTOR at the nexus of nutrition, growth, ageing and disease. Nat Rev Mol Cell Biol 21(4): 183–203. https://doi.org/10.1038/s41580-019-0199-y
Chellappa K, Brinkman JA, Mukherjee S, Morrison M, Alotaibi MI, Carbajal KA, Alhadeff AL, Perron IJ, Yao R, Purdy CS, DeFelice DM, Wakai MH, Tomasiewicz J, Lin A, Meyer E, Peng Y, Arriola Apelo SI, Puglielli L, Betley JN, Paschos GK, Baur JA, Lamming DW (2019) Hypothalamic mTORC2 is essential for metabolic health and longevity. Aging Cell 18(5): e13014. https://doi.org/10.1111/acel.13014
Дильман ВМ (1981) Большие биологические часы (Введение в интегральную медицину) Знание. [Dilman VM (1981) Large biological clock: (An introduction to integral medicine) Znanie. (In Russ)].
Masliukov PM, Nozdrachev AD (2021) Hypothalamic Regulatory Mechanisms of Aging. J Evol Biochem Phys 57: 473–491. https://doi.org/10.1134/S0022093021030030
Moiseev KY, Vishnyakova PA, Porseva VV, Masliukov AP, Spirichev AA, Emanuilov AI, Masliukov PM (2020) Changes of nNOS expression in the tuberal hypothalamic nuclei during ageing. Nitric Oxide 100–101: 1–6. https://doi.org/10.1016/j.niox.2020.04.002
Moiseev KY, Spirichev AA, Vishnyakova PA, Pankrasheva LG, Masliukov PM (2021) Changes of discharge properties of neurons from dorsomedial hypothalamic nuclei during aging in rats. Neurosci Lett 762: 136168. https://doi.org/10.1016/j.neulet.2021.136168
Vishnyakova PA, Moiseev KY, Spirichev AA, Emanuilov AI, Nozdrachev AD, Masliukov PM (2021) Expression of calbindin and calretinin in the dorsomedial and ventromedial hypothalamic nuclei during aging. Anat Rec (Hoboken) 304: 1094–1104. https://doi.org/10.1002/ar.24536
Martínez de Morentin PB, Martinez-Sanchez N, Roa J, Ferno J, Nogueiras R, Tena-Sempere M, Dieguez C, Lopez M (2014) Hypothalamic mTOR: the rookie energy sensor. Curr Mol Med 14(1): 3–21. https://doi.org/10.2174/1566524013666131118103706
Reifsnyder PC, Flurkey K, Te A, Harrison DE (2016) Rapamycin treatment benefits glucose metabolism in mouse models of type 2 diabetes. Aging (Albany NY) 8(11): 3120–3130. https://doi.org/10.18632/aging.101117
Vellai T, Takacs-Vellai K, Zhang Y, Kovacs AL, Orosz L, Müller F (2003) Genetics: influence of TOR kinase on lifespan in C. elegans. Nature 426(6967): 620. https://doi.org/10.1038/426620a
Harrison DE, Strong R, Sharp ZD, Nelson JF, Astle CM, Flurkey K, Nadon NL, Wilkinson JE, Frenkel K, Carter CS, Pahor M, Javors MA, Fernandez E, Miller RA (2009) Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature 460(7253): 392–395. https://doi.org/10.1038/nature08221
Robida-Stubbs S, Glover-Cutter K, Lamming DW, Mizunuma M, Narasimhan SD, Neumann-Haefelin E, Sabatini DM, Blackwell TK (2012) TOR signaling and rapamycin influence longevity by regulating SKN-1/Nrf and DAF-16/FoxO. Cell Metab 15(5): 713–724. https://doi.org/10.1016/j.cmet.2012.04.007
Lamming DW, Mihaylova MM, Katajisto P, Baar EL, Yilmaz OH, Hutchins A, Gultekin Y, Gaither R, Sabatini DM (2014) Depletion of Rictor, an essential protein component of mTORC2, decreases male lifespan. Aging Cell 13(5): 911–917. https://doi.org/10.1111/acel.12256
Dominick G, Berryman DE, List EO, Kopchick JJ, Li X, Miller RA, Garcia GG (2015) Regulation of mTOR activity in Snell dwarf and GH receptor gene-disrupted mice. Endocrinology 156(2): 565–575. https://doi.org/10.1210/en.2014-1690
Green CL, Lamming DW, Fontana L (2022) Molecular mechanisms of dietary restriction promoting health and longevity. Nat Rev Mol Cell Biol 23(1): 56–73. https://doi.org/10.1038/s41580-021-00411-4
Duran-Ortiz S, List EO, Basu R, Kopchick JJ (2021) Extending lifespan by modulating the growth hormone/insulin-like growth factor-1 axis: coming of age. Pituitary 24(3): 438–456. https://doi.org/10.1007/s11102-020-01117-0
Porseva VV, Levshin NYu, Moiseev KYu, Pankrasheva LG, Baranov AA, Pavlov AV, Nozdrachev AD, Masliukov PM (2021) Let-7a, mir-9, mir-132 and mir-218 microRNA Expression in the Dorsomedial and Ventromedial Hypothalamic Nuclei during Aging in Rats. Adv Gerontol 11(4): 346–350. https://doi.org/10.1134/S207905702104010X
Iang S (2019) A Regulator of Metabolic Reprogramming: MicroRNA Let-7. Transl Oncol 12(7): 1005–1013. https://doi.org/10.1016/j.tranon.2019.04.013
Liu WM, Cheng RR, Niu ZR, Chen AC, Ma MY, Li T, Chiu PC, Pang RT, Lee YL, Ou JP, Yao YQ, Yeung WSB (2020) Let-7 derived from endometrial extracellular vesicles is an important inducer of embryonic diapause in mice. Sci Adv 6(37):eaaz7070. https://doi.org/10.1126/sciadv.aaz7070
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


