Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 75-93
Метилобогащенная диета матери нормализует характеристики цикла сон–бодрствование и сонных веретен у взрослого потомства крыс линии WAG/Rij с генетической абсансной эпилепсией
А. В. Габова 1, *, К. Ю. Саркисова 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: agabova@yandex.ru
Поступила в редакцию 06.10.2022
После доработки 24.11.2022
Принята к публикации 24.11.2022
- EDN: IYQRQF
- DOI: 10.31857/S086981392301003X
Аннотация
Ранее было показано, что перинатальная метилобогащенная диета (МОД) матери уменьшает число пик-волновых разрядов (ПВР) и поведенческие симптомы депрессии у взрослого потомства крыс линии WAG/Rij. Эпилепсия и депрессия обычно сопровождаются нарушениями цикла сон–бодрствование. ПВР и сонные веретена являются различными проявлениями таламокортикальной активности. Предполагается, что патологические изменения в таламокортикальной системе, которые приводят к ПВР, изменяют и сонные веретена. Возможно, что МОД матери оказывает положительное влияние не только на ПВР, но и на сонные веретена. Цель данной работы – выяснить, влияет ли МОД матери на цикл сон–бодрствование и изменяет ли характеристики сонных веретен у взрослого потомства крыс линии WAG/Rij. Показано, что у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими в перинатальном периоде МОД, по сравнению с потомством, матери которого потребляли контрольную диету (КД), значимо увеличивается относительная длительность быстрого сна. У потомства крыс линии WAG/Rij, матери которых потребляли МОД, относительная длительность быстрого сна и число его эпизодов становятся неотличимыми от аналогичных показателей у неэпилептических крыс Wistar. МОД матери увеличивает также число переходов от медленноволнового сна к быстрому сну. Имеется значимая отрицательная корреляция между числом ПВР и длительностью быстрого сна. МОД матери по сравнению с КД уменьшала амплитуду и спектральную плотность мощности сонных веретен. Они становились значительно ближе к амплитуде и спектральной плотности мощности сонных веретен у крыс Wistar. Таким образом, МОД матери нормализует цикл сон–бодрствование и характеристики сонных веретен у взрослого потомства крыс линии WAG/Rij. Мы предполагаем, что этот позитивный эффект связан с уменьшением симптомов абсанc-эпилепсии и коморбидной депрессии, а также с коррекцией активности таламокортикальной системы.
Крысы линии WAG/Rij являются валидной моделью генетической абсансной эпилепсии с коморбидной депрессией [1]. Абсансная эпилепсия характеризуется спонтанными генерализованными пик-волновыми разрядами (ПВР) на ЭЭГ, сопровождающимися потерей сознания (уменьшение реагирования на внешние стимулы). Метилобогащенная диета (МОД) матери в перинатальном периоде является эпигенетическим фактором, влияющим на метилирование ДНК и экспрессию генов в мозге у потомства в особо чувствительном для их развития периоде. Эпигенетические модификации влияют на развитие психических и неврологических заболеваний, среди которых эпилепсия [2] и депрессия [3]. Ранее мы показали, что МОД матери во время перинатального периода уменьшает число ПВР и подавляет проявление коморбидной депрессии у взрослого потомства крыс линии WAG/Rij [4]. Обнаружена связь между гипометилированием отдельных участков ДНК и нарушениями сна в виде его фрагментированности и инверсии цикла сон–бодрствование [5]. Качество сна имеет большое значение для когнитивных и физиологических функций организма [6, 7]. Для формирования долговременной памяти необходим процесс консолидации, который зависит от качества сна. Недавно приобретенные знания и навыки консолидируются во время быстрого (REM) сна, а его дефицит может приводить к когнитивным нарушениям. Увеличение числа и длительности сонных веретен (14–16 Гц) после обучения коррелирует с улучшением выполнения выработанного навыка. Предполагают, что сонные веретена “вовлечены в диалог гиппокампа и неокортекса, необходимый для консолидации памяти” [8].
Известно, что эпилепсия и депрессия влияют на сон, изменяя характеристики цикла сон–бодрствование. Нарушения сна обнаружены как у пациентов с абсансной эпилепсией [9, 10], так и у генетической модели абсансной эпилепсии – у крыс линии WAG/Rij [11–13]. Ранее было установлено, что относительная длительность быстрого сна у крыс линии WAG/Rij меньше, чем у неэпилептических крыс линии ACI, а длительность медленноволнового сна больше [12]. Хроническое введение антиабсансного препарата этосуксимида, подавляющего появление ПВР, влияло на длительность быстрого сна. Хотя в течение суток относительная длительность быстрого сна изменялась, в конце светового периода суток и в начале темнового периода суток (период, в котором обычно проводят записи ЭЭГ) общая и относительная длительность быстрого сна у крыс линии WAG/Rij, потреблявших этосуксимид с питьевой водой в течение четырех месяцев, была меньше, чем у контрольных крыс, которые этосуксимид не потребляли или потребляли в течение двух месяцев, а параметры медленноволнового сна не изменялись [14]. Авторы полагают, что уменьшение симптомов коморбидной депрессии, вызываемое длительным и хроническим потреблением этосуксимида, может быть связано с уменьшением быстрого сна. Имеются данные, свидетельствующие о том, что неонатальное введение трициклического антидепрессанта кломипрамина вызывает у крыс линии WAG/Rij в возрасте восьми месяцев увеличение длительности быстрого сна, при этом длительность медленноволнового сна и бодрствования значимо не изменялись. Интересно, что кломипрамин уменьшал также число ПВР у взрослого потомства крыс линии WAG/Rij [15]. На пилокарпиновой модели эпилепсии у крыс показано, что депривация быстрого сна приводит к усилению перекисного окисления липидов, а также к увеличению концентрации провоспалительных цитокинов в коре мозга, что, согласно предположению авторов, приводит к гипервозбудимости и становится причиной понижения порога возникновения эпилептических разрядов [16].
Переход от медленноволнового сна к быстрому сну или состоянию бодрствования у животных и человека в большинстве случаев сопровождается промежуточным сном. Промежуточный сон длительностью от нескольких секунд до нескольких минут – это переходная фаза от медленноволнового к быстрому сну или состоянию бодрствования. В этой фазе присутствуют веретена в фронтопариетальной коре и тета-активность в гиппокампе, проявляющаяся также в окципитальной коре. У человека длительность промежуточной фазы сна увеличивается при психических расстройствах [17]. Показано, что длительность промежуточного сна у крыс линии WAG/Rij больше, чем у крыс Wistar [11].
Известно, что ПВР является результатом таламокортикальных взаимодействий и запускается глубокими слоями соматосенсорной коры, в которых повышена возбудимость при эпилепсии как у крыс линии WAG/Rij [18–20], так и у пациентов с абсансной эпилепсией [21, 22]. Сонные веретена, так же, как и ПВР, являются проявлениями таламокортикальной активности, но запускаются ретикулярным ядром таламуса [23–25]. Ранее предполагали, что ПВР при абсансной эпилепсии являются патологической трансформацией сонных веретен [26]. Однако в настоящее время экспериментальные данные не подтверждают это мнение [21]. Наиболее убедительным доказательством являются данные о том, что этосуксимид в определенных условиях может подавлять ПВР и стимулировать появление сонных веретен [28]. Изменения в таламокортикальной системе при абсансной эпилепсии у крыс линии WAG/Rij не только приводят к спонтанной генерации ПВР, но и влияют на характеристики сонных веретен. В частности показано, что у крыс линии WAG/Rij и Wistar число веретен, разделенных на типы по их средней частоте, различается. Число “медленных” и “средних” веретен (с частотой 8–12.4 Гц) было больше у крыс линии WAG/Rij, в то время как у крыс Wistar, напротив, преобладали “быстрые” и “экстрабыстрые” веретена (с частотой 12.5–16 Гц) [29]. По нашим данным, средняя частота веретен у крыс Wistar составляет 13.0 ± 0.4 Гц [30]. Это значение подтверждает, что у крыс Wistar большинство веретен находится в области “быстрых” частот. Однако имеются ли изменения в амплитуде веретен у крыс линии WAG/Rij по сравнению с крысами Wistar, неизвестно.
Таким образом, ранее полученные данные указывают на то, что у крыс линии WAG/Rij с абсансной эпилепсией по сравнению с неэпилептическими крысами имеются нарушения цикла сон–бодрствование, такие как пониженная длительность быстрого сна и увеличенная длительность промежуточной стадии сна. Тот факт, что изменение числа ПВР сопровождается изменением длительности быстрого сна, может свидетельствовать о том, что между числом ПВР и длительностью быстрого сна могут существовать причинно-следственные связи. Однако прямые доказательства того, что число ПВР коррелирует с длительностью быстрого сна, отсутствуют. Кроме того, сравнительный анализ амплитуды и спектральной плотности мощности сонных веретен у эпилептических крыс линии WAG/Rij и неэпилептических крыс Wistar никем ранее не проводился.
Цель данной работы – выяснить: 1) влияет ли МОД матери на цикл сон–бодрствование и изменяет ли характеристики сонных веретен у взрослого потомства крыс линии WAG/Rij; 2) существует ли корреляция между числом ПВР и длительностью быстрого сна. Для достижения этой цели у крыс-самцов линии WAG/Rij, рожденных матерями, потреблявших МОД или контрольную диету (КД) в перинатальном периоде, и у неэпилептических крыс Wistar исследовали абсолютную (мин), относительную (%) длительность стадий и число их эпизодов в цикле сон–бодрствование, а также амплитуду и спектральную плотность мощности сонных веретен.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 7-месячных крысах-самцах линии WAG/Rij с генетической абсансной эпилепсией и неэпилептических крысах Wistar. Использованы крысы линии WAG/Rij, разводимые в Институте высшей нервной деятельности и нейрофизиологии РАН и представляющие примерно 73-е поколение от родителей, исходно полученных из Нидерландов (Университет Radboud, Nijmegen) в 1995 г. В нашей популяции крыс линии WAG/Rij ПВР имеют все животные, и они полностью воспроизводят исходный эпилептический фенотип от одного поколения к другому. Это их отличает от другой популяции крыс линии WAG/Rij, также разводимых в Институте высшей нервной деятельности и нейрофизиологии РАН. Однако 25% животных в этой популяции не имеют ПВР [31]. Крысы Wistar, которые были использованы в настоящей работе, не имели ПВР. Все животные не были чувствительны к аудиогенным воздействиям [32].
Было исследовано потомство крыс линии WAG/Rij, рожденных матерями, потреблявшими КД (n = 8), МОД (n = 8), и крыс Wistar (n = 7). Использовали МОД, содержащую на 1 кг корма следующие доноры метильных групп и кофакторы одноуглеродного цикла: холин 15 г; бетаин 15 г; L-метионин 7.5 г; фолиевая кислота 15 мг; витамин В12 1.5 мг; ZnSO4 150 мг. Эти ингредиенты давали самкам крыс с пищей в течение 7 дней до спаривания, во время спаривания, в течение беременности и в течение 7 дней после рождения крысят [33]. Крысы содержались в стандартных условиях вивария. Регистрацию ЭЭГ проводили у свободно передвигающихся животных в течение 3 ч в день (с 16.00 до 19.00) эпидурально с фронтальных (AP +2 мм, L 2.5 мм) и окципитальных (AP –6 мм, L 4 мм) отделов коры. Запись ЭЭГ осуществляли с использованием восьмиканального беспроводного усилителя биопотенциалов BR8V1 (Texas Instruments, США) в соответствии с ранее описанной методикой [34, 35] монополярно, референтный электрод устанавливали над мозжечком. Частота дискредитации записи ЭЭГ составляла 250 Гц, ЭЭГ записывали без фильтрации. Для анализа ЭЭГ использовали полосу пропускания от 1 до 40 Гц. Вживление электродов (маленькие винтики из нержавеющей стали) в кости черепа выполняли под хлоралгидратной анестезией (400 мг/кг, в/б). Регистрацию ЭЭГ проводили приблизительно через 7 дней после вживления электродов. Анализировали записи ЭЭГ, зарегистрированные во фронтальной коре мозга, в которой ПВР имеют наибольшую амплитуду и более отчетливые морфологические характеристики, а фронтальные сонные веретена (frontal anterior spindles) характеризуются хорошо выраженными изменениями. Записи ЭЭГ проводили во второй половине дня, когда у крыс линии WAG/Rij наблюдают наибольшее число ПВР, а характеристики цикла бодрствование–сон и сонных веретен в большей степени изменены [12]. Стадии сна и бодрствования определяли при визуальном инспектировании записей ЭЭГ в соответствии с критериями, приведенными для крыс линии WAG/Rij в работе [12, 15].
Состояние бодрствования сопровождалось ЭЭГ-активностью с доминированием тета- (6–8 Гц) и бета- (20–40 Гц) частот. ЭЭГ-активность, содержащая сонные веретена с частотой (10–16 Гц), тета-волны и медленные волны (2–4 Гц) определяли как легкий медленноволновый сон. Глубокий медленноволновый сон характеризовался постепенно исчезающими сонными веретенами и увеличивающимся числом медленных дельта-волн (1.5–4 Гц). Непрерывная тета-активность (6–8 Гц), наступающая после медленноволнового сна, отличающаяся от ритма бодрствования отсутствием бета-частот и двигательных реакций, нерегулярным дыханием и появлением подергиваний животного, идентифицировалась как быстрый сон. Промежуточная фаза сна характеризовалась веретенами с острыми пиками во фронтальной коре и тета-ритмом в окципитальной коре. Пребывание в одной стадии цикла сон–бодрствование с перерывом менее, чем на 15 с, определяли как один эпизод этой стадии. Число и длительность эпизодов стадий цикла сон–бодрствование измерялись полуавтоматически. Вычисляли среднее число эпизодов (n) стадий цикла сон–бодрствование, их абсолютную (мин) и относительную (в %) длительность, длительность эпизодов промежуточного сна на протяжении всей записи. Кроме того, определяли число переходов из медленноволнового сна в парадоксальный и в бодрствование. В медленноволновом сне выделяли сонные веретена для последующего анализа. На фоне дельта-волн они отличались увеличенной амплитудой (до 800 мкВ) и основной частотой (от 12 до 16 Гц). Усредненный спектр мощности сонных веретен вычислялся из Фурье-спектров, построенных методом Уэлча (окно Хэннинга, ширина окна 2 с, перекрытие окна 7/8). Для сравнения групп спектров сонных веретен использовался групповой статистический тест Манна–Уитни (альфа-уровень 0.05) с поправкой Бонферрони на число значений в спектре и число парных сравнений. Применялась программа Procedure (автор А.А. Морозов, Институт радиотехники и электроники им. В.А. Котельникова РАН). Для построения спектров брали выборку из 45–50 сонных веретен в каждой группе крыс. Также вычисляли средние значения амплитуды сонных веретен. Для вычисления средних значений брали 28–30 сонных веретен в каждой группе. Амплитуда сонных веретен определялась полуавтоматическим способом с помощью программы HILB4 (автор А.А. Морозов, Институт радиотехники и электроники им. В.А. Котельникова РАН). Исходные данные поступали в формате edf. С помощью программы на графике сонного веретена вручную отмечались локальные минимумы и максимумы. Значения минимумов и максимумов автоматически передавались в программу Матлаб в виде двух векторов отрицательных и положительных чисел, обозначающих смещение локального минимума или максимума относительно нулевой линии в мкВ. Амплитудой веретена определялась как сумма абсолютных значений локального максимума и локального минимума сонного веретена. Для каждой группы рассчитывали среднюю амплитуду сонных веретен.
Статистическую обработку полученных данных проводили с помощью пакета статистических программ “STATISTICA Release 7”. Использован однофакторный дисперсионный анализ (ANOVA), непараметрический аналог ANOVA – Kruskal–Wallis H test и критерий U Манна–Уиттни с поправкой Бонферрони. Определение различий между средними значениями показателей проводили по post-hoc критерию Ньюмена–Кейлса (Newman–Keuls test). Вычисляли линейный коэффициент корреляции Пирсона для показателей числа ПВР и длительности быстрого сна. Для вычисления коэффициента корреляции использовали записи ЭЭГ у 26 крыс линии WAG/Rij, рожденных матерями, потреблявшими КД в перинатальном периоде.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
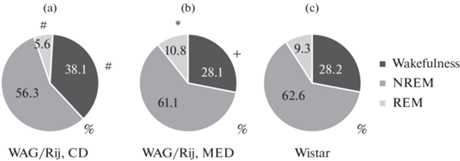
На круговых диаграммах (рис. 1) показана относительная длительность стадий цикла сон–бодрствование у взрослого потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими КД и МОД, и у потомства крыс Wistar аналогичного возраста. Статистический анализ (ANOVA) показал, что МОД матери оказывает влияние на относительную длительность бодрствования и быстрого сна в цикле сон–бодрствование у взрослого потомства крыс линии WAG/Rij: МОД матери по сравнению с КД вызывает тенденцию к уменьшению бодрствования [H(2,23) = 4.1, p = 0.1; U = 16, p = 0.09] и значимое увеличение быстрого сна [F(1,14) = 5.1, p < 0.05]. Вследствие этого структура цикла сон–бодрствование у потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими МОД, становится неотличимой от цикла сон–бодрствование у крыс Wistar. Влияние МОД матери на относительную длительность медленноволнового сна было незначимым [H(2,23) = 2.4, p = 0.3]. У крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, по сравнению с крысами Wistar наблюдали тенденцию [F(1,13) = 3.36, p = 0.09] к большей относительной длительности бодрствования и тенденцию [F(1,13) = 2.5, p = 0.1] к меньшей относительной длительности быстрого сна.
Рис. 1.
Относительная длительность (%) стадий цикла сон–бодрствование у потомства крыс линии WAG/Rij, рожденных матерями перинатально потреблявшими МОД и КД, и у крыс Wistar. (a) – крысы линии WAG/Rij, КД; (b) – крысы линии WAG/Rij, МОД; (c) – крысы Wistar. *p < 0.05, +0.05 < p < 0.1 (тенденция) по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД. #0.05 < p < 0.1 (тенденция) по сравнению с крысами Wistar. CD – КД, MED – МОД. Wakefulness – бодрствование, NREM – медленноволновый сон, REM – быстрый сон.
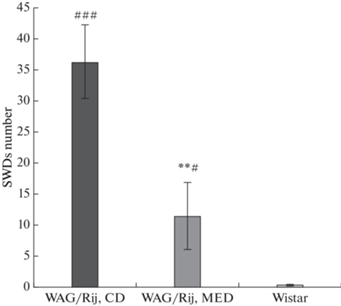
Дисперсионный анализ (ANOVA) показал, что МОД матери оказывает значимое влияние на число ПВР [F(1,14) = 9.5, p < 0.01] и незначимое на среднюю длительность ПВР [F(1,14) = 0.02, p = 0.9] у взрослого потомства крыс линии WAG/Rij. У потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими МОД, число ПВР было меньше, чем у потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими КД, но больше, чем у потомства крыс Wistar аналогичного возраста (рис. 2).
Рис. 2.
Число ПВР у потомства крыс линии WAG/Rij, рожденных матерями потреблявших МОД и КД, и у крыс Wistar. **p < 0.01 по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД. #p < 0.05, ###p < 0.001 по сравнению с крысами Wistar. SWDs number – число ПВР. CD – КД, MED – МОД.
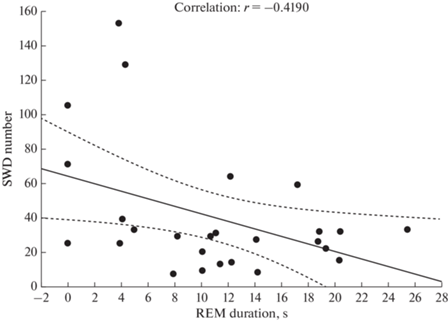
Установлено, что число ПВР отрицательно коррелирует с длительностью быстрого сна (R = – 0.42, p < 0.05) (рис. 3).
Рис. 3.
Связь между числом ПВР и длительностью быстрого сна. SWD number – число ПВР; REM duration – длительность быстрого сна, с.
Статистический анализ (ANOVA) показал, что МОД матери оказывает значимое влияние на число эпизодов бодрствования [F(2,20) = 6.4, p < 0.01], медленноволнового сна [F(2,20) = 3.7, p = 0.04] и быстрого сна [F(2,20) = 6.9, p < 0.01] (рис. 4).
Рис. 4.
Число эпизодов стадий цикла сон–бодрствование у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД и КД, и крыс Wistar. *p < 0.05, **p < 0.01 по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, ##p < 0.01 по сравнению с крысами Wistar.
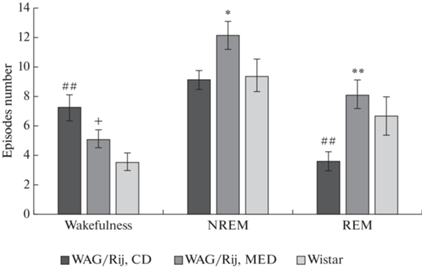
Число эпизодов бодрствования у потомства крыс линии WAG/Rij, рожденного матерями, потреблявших МОД и крыс Wistar значимо не отличалось. МОД матери по сравнению с КД вызывал тенденцию к уменьшению числа эпизодов бодрствования. У потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими КД, число эпизодов бодрствования было значимо больше, чем у крыс Wistar. Число эпизодов медленноволнового сна у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД, было значимо больше по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, и по сравнению с крысами Wistar. Различие числа эпизодов быстрого сна у потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими МОД, и крыс Wistar было незначимым. У потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими МОД и крыс Wistar, число эпизодов быстрого сна было значимо больше, чем у потомства крыс линии WAG/Rij, матери которых потребляли КД (рис. 4).
МОД матери не оказывала значимого влияния на общую длительность (мин) эпизодов стадий цикла сон–бодрствования [F(2,20) ≤ 1.7, p ≥ 0.2].
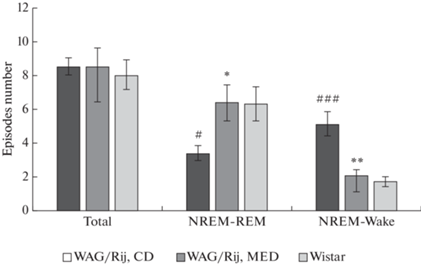
Статистический анализ (ANOVA) показал, что у потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими КД, по сравнению с потомством крыс Wistar число переходов от медленноволнового сна к бодрствованию больше [F(1,13) = 18.63, p < 0.001], а число переходов от медленноволного сна к парадоксальному – меньше [F(1,13) = 8.34, p = 0.01]. МОД матери вызывала у потомства крыс линии WAG/Rij уменьшение числа переходов от медленноволнового сна к бодрствованию [F(1,13) = 18.63, p < 0.001], а также увеличение числа переходов от медленноволнового сна к парадоксальному [F(1,13) = 7.44, p = 0.02]. При этом различия между крысами линии WAG/Rij, рожденными матерями, потреблявшими МОД, по сравнению с потомством крыс Wistar по этим показателям становились незначимыми (рис. 5).
Рис. 5.
Число переходов от медленноволнового сна к быстрому сну и бодрствованию у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД и КД, и крыс Wistar. *p < 0.05, **p < 0.01 по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, #p < 0.05, ###p < 0.001 по сравнению с крысами Wistar. Transitions number – число переходов. Total – общее число переходов. NREM-REM – переходы от медленноволнового сна к быстрому сну. NREM-Wake –переходы от медленноволнового сна к бодрствованию.
За медленноволновым сном в большинстве случаев следует промежуточный сон, который переходит в быстрый сон или бодрствование.
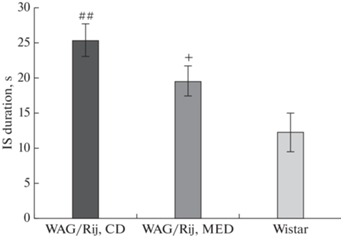
Длительность промежуточной стадии сна у потомства крыс линии WAG/Rij, матери которых потребляли КД, значимо больше, чем у неэпилептических крыс Wistar. У потомства крыс, матери которых потребляли МОД, по сравнению с КД, имеется тенденция к уменьшению длительности промежуточной стадии сна (рис. 6).
Рис. 6.
Длительность промежуточной стадии сна у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД и КД, и крыс Wistar. +0.05 < p < 0.1 (тенденция) по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, ##p < 0.01 по сравнению с крысами Wistar. IS duration, s – длительность промежуточной стадии, с. WAG/Rij, CD – потомство крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, WAG/Rij, MED – потомство крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД.
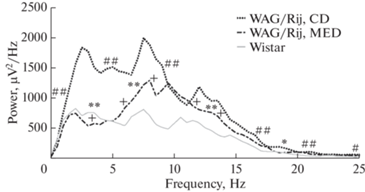
Анализ усредненной спектральной плотности мощности сонных веретен показал, что МОД матери по сравнению с КД уменьшает спектральную плотность мощности сонных веретен в стадии медленноволнового сна у взрослого потомства крыс линии WAG/Rij. Она становится значительно ближе к спектральной плотности мощности частот сонных веретен у неэпелиптичеких крыс Wistar, особенно на дельта- и тета-частотах (рис. 7).
Рис. 7.
Усредненные спектры мощности сонных веретен у потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими МОД и КД, и крыс Wistar, вычисленные методом Уэлча с применением быстрого преобразования Фурье. **p < 0.01, *р < 0.05 по сравнению с потомством матерей, потреблявших КД, на частотах 1.5–6, 7, 14, 19 Гц. +p < 0.05 по сравнению с крысами Wistar на частотах 3, 6, 7.5–11, 13 Гц; ##p < 0.01 по сравнению с крысами Wistar на частотах 2–10, 17, 21 Гц, Power, µV2/Hz – спектральная плотность мощности, мкВ2/Гц; Frequency, Hz – частота, Гц.
Сонные веретена у потомства крыс линии WAG/Rij, матери которых потребляли КД и МОД, и у крыс Wistar также различаются по амплитуде. Амплитуда сонных веретен у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД, значимо меньше, чем у потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими КД, и незначимо отличается от амплитуды сонных веретен у крыс Wistar. Значимого влияния МОД матери на коэффициент асимметрии сонных веретен не выявлено (табл. 1).
Таблица 1.
Амплитуда и коэффициент асимметрии сонных веретен у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД, КД и у крыс Wistar
| Группа крыс | Амплитуда, мкВ | Коэффициент асимметрии, % |
|---|---|---|
| WAG/Rij, КД | 517.13 ± 57.9## | 56.25 ± 1.49 |
| WAG/Rij, МОД | 314.75 ± 24.75** | 55.88 ± 1.91 |
| Wistar | 267.14 ± 21.53 | 54.71 ± 2.07 |
На примере двух крыс линии WAG/Rij, мать одной из них потребляла КД, а другой МОД в перинатальном периоде, продемонстрированы различия, зависящие от диеты матери, между разрядами в стадии спокойного бодрствования и между сонными веретенами во время медленноволнового сна во фронтальной коре мозга (рис. 8).
Рис. 8.
Разряды в спокойном бодрствовании и фрагменты медленноволнового сна с веретенами во фронтальной коре у двух крыс линии WAG/Rij, рожденных матерями, одна из которых потребляла КД (рис. 8a, b), а другая – МОД (рис. 8c, d). (a) – зрелый ПВР; (c) – незрелый разряд; (b), (d) – медленноволновый сон (веретена отмечены красными эллипсами). 1 – разряд/медленноволновый сон; 2 – фрагмент разряда/сонного веретена, представленный на увеличенной по времени шкале (отмечен черной горизонтальной линией над ЭЭГ) с целью иллюстрации их морфологии; над фрагментом незрелого разряда синей чертой отмечена часть, имеющая два компонента, красной – четыре компонента: I – ранний позитивный переходный процесс (ранний ППП), II – пик 2, III – поздний ППП, IV – волна; 3 – вейвлет-спектрограмма разряда/медленноволнового сна. Увеличенная шкала: время 500 мс (абсцисса), а-мплитуда 500 мкВ (ордината). Amplitude, µV – амплитуда, мкВ; Frequency, Hz – частота, Гц; Time, s – время, с.
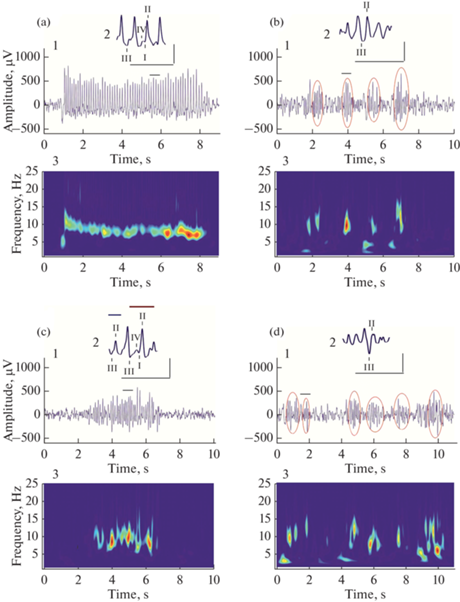
У потомства крыс WAG/Rij, матери которых потребляли КД, на ЭЭГ, в основном, присутствуют зрелые ПВР (рис. 8a, 1), являющиеся спонтанно возникающей генерализованной ритмической активностью, состоящей из чередующихся пиков и волн, в которых выделяют четыре компонента (рис. 8a, 2). Вейвлет-спектрограмма отражает частотно-временные характеристика ПВР: начало ПВР на частоте 12 Гц, которая быстро, в течение приблизительно 0.5 с, уменьшается. Далее на протяжении нескольких секунд ПВР имеет стабильную частоту 7–8 Гц. У взрослого потомства крыс линии WAG/Rij МОД матери значимо уменьшает число зрелых ПВР (см. рис. 2), которые замещаются незрелыми разрядами. В незрелом разряде (рис. 8c, 1) перемежаются пик-волновые комплексы, состоящие из четырех компонентов, и осцилляции, напоминающие сонные веретена, состоящие из двух компонентов (рис. 8c, 2). Средняя амплитуда и коэффициент асимметрии незрелого разряда значимо меньше, чем у зрелого ПВР. Вейвлет-спектрограмма разряда демонстрирует неустойчивую частоту незрелого разряда (рис. 8c, 3).
Медленноволновый сон у крысы линии WAG/Rij, мать которой потребляла КД (рис. 8b, 1), отличается от медленноволнового сна крысы, мать которой потребляла МОД (рис. 8d, 1). У обеих крыс веретена представляют осцилляции, имеющие только два компонента: пик, менее острый, чем у ПВР (рис. 8b, 2; d, 2) и поздний ППП. У крысы линии WAG/Rij, мать которой потребляла МОД, сонные веретена имеют меньшую амплитуду (сравни рис. 8b, 1, 2 и d, 1, 2), что иллюстрирует усредненные данные, представленные в табл. 1.
У крыс линии WAG/Rij, матери которых потребляли КД, промежуточная стадия сна значительно чаще переходит в стадию бодрствования, чем в стадию быстрого сна (рис. 9), что свидетельствует о частом прерывании сна. Кроме того, у крыс линии WAG/Rij, матери которых потребляли КД, промежуточная стадия сна значительно длительнее, чем у крыс линии WAG/Rij, матери которых потребляли МОД (сравни рис. 9, a, IS и b, IS, а также рис. 6).
Рис. 9.
Примеры перехода от медленноволнового к промежуточному сну и затем к бодрствованию (a) или быстрому сну (b) у крыс линии WAG/Rij, матери которых потребляли КД и МОД в перинатальном периоде. Стадии сна разделены красными вертикальными линиями. (a) – крыса, мать которой потребляла КД. (b) – крыса, мать которой потребляла МОД. 1 – фронтальная кора, 2 – окципитальная кора. NREM – медленноволновой сон, IS – промежуточный сон, Wakefulness – бодрствование, REM – быстрый сон.
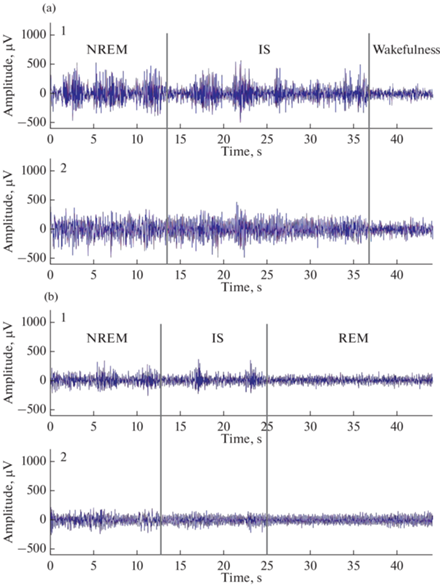
У крысы линии WAG/Rij, мать которой потребляла КД, медленноволновый сон сменяется промежуточной стадией, а затем переходит в стадию бодрствования (рис. 9a). У крысы линии WAG/Rij, мать которой потребляла МОД, медленноволновый сон переходит в промежуточную стадию, более короткую, чем у крысы, мать которой потребляла КД, а затем наступает стадия быстрого сна (рис. 9b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ длительности стадий цикла сон–бодрствование у потомства крыс линии WAG/Rij, матери которых потребляли КД и МОД, и у крыс Wistar показал, что МОД матери по сравнению с КД увеличивает относительную длительность быстрого сна, она становилась равной длительности этой стадии у крыс Wistar. Длительность медленноволнового сна не изменялась. Наблюдали тенденцию к уменьшению длительности бодрствования. В данном исследовании показано, что МОД матери уменьшает число ПВР, но не влияет на их среднюю длительность. Эти результаты согласуются с ранее полученными данными [4]. Данные об уменьшении числа ПВР и увеличении длительности быстрого сна под действием МОД указывают на существование связи между этими показателями, что подтверждается наличием отрицательной корреляции между числом ПВР и длительностью быстрого сна. Полученные нами результаты также согласуются с исследованиями, в которых относительная длительность быстрого сна у крыс линии WAG/Rij была меньше, чем у неэпилептических крыс ACI [12], а при введении кломипрамина [15] увеличение относительной длительности быстрого сна сопровождалось уменьшением числа ПВР. Связь между количеством быстрого сна и числом разрядов была установлена также в экспериментах с пилокарпином. Уменьшение быстрого сна наблюдалось у модели эпилепсии у крыс Wistar, вызванной пилокарпином, провоцирующим возникновение разрядов. Пилокарпин вызывает усиление перекисного окисления липидов и выброс провоспалительных цитокинов в коре головного мозга у крыс, что, как полагают авторы, приводит к повышению возбудимости коры и к понижению порога возникновения эпилептических разрядов [16]. Таким образом, нормализация относительного количества быстрого сна у потомства у крыс линии WAG/Rij, матери которых потребляли МОД, по-видимому, связана с уменьшением числа ПВР, вызываемых МОД.
Число эпизодов быстрого сна у потомства крыс линии WAG/Rij, рожденных матерями, потреблявших МОД, и крыс Wistar близко по величине и значимо больше, чем у потомства крыс, матери которых потребляли КД. Длительность эпизодов значимо не изменялась независимо от того, потребляли ли матери в перинатальном периоде КД или МОД, а также по сравнению с крысами Wistar. Это приводит к предположению о том, что увеличение длительности быстрого сна у потомства крыс линии WAG/Rij, рожденных матерями, потреблявших МОД, по сравнению с КД, происходит за счет увеличения числа их эпизодов. Нами показано, что число переходов медленноволнового сна в быстрый сон по сравнению с числом переходов в бодрствование у потомства крыс линии WAG/Rij, матери которых потребляли МОД, значительно больше по сравнению с потомством, матери которых потребляли КД. При этом длительность промежуточной стадии сна имеет тенденцию к уменьшению у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД в перинатальном периоде, по сравнению с потомством крыс линии WAG/Rij, рожденных матерями, потреблявшими КД, и у крыс Wistar. Эти результаты согласуются с ранее полученными данными о том, что у крыс линии WAG/Rij переход от медленноволнового сна к быстрому сну происходит значительно реже, чем у крыс Wistar, а длительность промежуточной стадии сна увеличена [11]. Увеличение числа эпизодов медленноволнового сна, за которым следует быстрый сон и тенденция к уменьшению длительности промежуточного сна у потомства крыс линии WAG/Rij, матери которых потребляли МОД, свидетельствует о нормализации перехода от медленноволнового к быстрому сну, что приводит к увеличению относительной длительности быстрого сна.
Известно, что ПВР и сонные веретена являются результатом таламокортикальных взаимодействий. Однако они запускаются разными структурами: ПВР – глубокими слоями соматосенсорной коры [18–22]; сонные веретена – ретикулярным ядром таламуса [23, 27, 36]. Поэтому изменение работы таламокортикальной системы под воздействием МОД матери может приводить как к снижению числа ПВР, так и изменять характеристики сонных веретен в медленноволновом сне, что было продемонстрировано в настоящей работе.
В усредненных спектрах мощности частот сонных веретен у потомства крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД, и у крыс Wistar спектры в дельта- и тета-диапазонах (от 1.5 до 7 Гц) более близки по величине, чем на частоте альфа-диапазона (8–13 Гц). Хотя принято считать, что у сонных веретен преобладают частоты 8–16 Гц [29], на вейвлет-спектрограммах (рис. 8) мы видим увеличенную мощность в дельта- и тета-диапазоне частот одновременно с альфа- и бета-частотами. Аналогичная увеличенная мощность в дельта- и тета-диапазоне показана в работе других авторов [29]. Мы не рассматриваем дельта-волны медленноволнового сна в данной работе отдельно. Однако данные о дельта-составляющих веретен, полученные нами, дают основание предполагать, что дельта-волны медленноволнового сна у взрослого потомства крыс линии WAG/Rij, матери которых потребляли МОД, также приближаются по своей амплитуде к дельта-волнам у неэпилептических крыс Wistar. Несмотря на то, что относительная длительность медленноволнового сна под влиянием МОД матери у потомства крыс линии WAG/Rij значимо не изменяется, структура ЭЭГ медленноволнового сна существенно изменяется. В работе [29] показано, что у неэпилептических крыс Wistar сонные веретена имеют частоту, отличающуюся от частоты веретен у крыс линии WAG/Rij. Мы показали, что в медленноволновом сне у крыс линии WAG/Rij значимо изменяются спектр мощности и амплитуда веретен. Они становятся близкими к спектру мощности и амплитуде веретен неэпилептических крыс Wistar, что свидетельствует об улучшении качества медленноволнового сна. Как известно, улучшение качества медленноволнового сна способствует улучшению памяти [37]. Мы можем предположить, что МОД матери во время перинатального периода вызывает не только нормализацию цикла сон–бодрствование, но может также вызвать улучшение когнитивных функций у взрослого потомства крыс линии WAG/Rij, нарушения которых были обнаружены ранее [38, 39]. Необходимы дальнейшие исследования, чтобы проверить это предположение.
В предыдущих исследованиях нами было показано, что МОД матери вызывает у потомства крыс линии WAG/Rij стойкое подавление симптомов абсансной эпилепсии и коморбидной депрессии, что сопровождается повышением экспрессии гена ионного канала HCN1 в соматосенсорной коре мозга – зоне генерации ПВР [40]. Каналопатия, в частности уменьшение экспрессии HCN1, считается ключевым механизмом патогенеза абсансной эпилепсии у крыс линии WAG/Rij [41]. Интересно, что МОД матери вызывает такое же повышение экспрессии HCN1 у крыс линии WAG/Rij, как и длительное хроническое введение этосуксимида – антиабсансного препарата первого выбора [42, 43]. Это позволяет предположить, что МОД матери на ранних стадиях онтогенеза препятствует снижению экспрессии HCN1 в соматосенсорной коре у потомства крыс линии WAG/Rij, предотвращая повышение возбудимости в этой области мозга и, тем самым, генерацию ПВР. Другими словами, предполагается, что МОД матери в перинатальном периоде нормализует функционирование кортико-таламо-кортикальной системы, что приводит не только к уменьшению числа ПВР, но и нормализации характеристик цикла сон–бодрствование и сонных веретен у потомства крыс линии WAG/Rij.
Тот факт, что МОД матери подавляет коморбидную депрессию и увеличивает длительность быстрого сна у крыс линии WAG/Rij, на первый взгляд, не согласуется с общепринятой точкой зрения, свидетельствующей о том, что депрессия у людей и животных сопровождается увеличением длительности парадоксального сна, а антидепрессанты, приводящие к уменьшению депрессивных расстройств, уменьшают длительность парадоксального сна [44]. Однако сопоставление эффектов антидепрессантов различных механизмов действия показало, что для проявления антидепрессантного действия подавление парадоксального сна не является обязательным [45]. Возможно, что кажущаяся парадоксальность эффекта МОД матери (антидепрессантное действие, сопровождающееся увеличением парадоксального сна) обусловлена эпигенетическим механизмом действия (воздействие на метилирование ДНК, приводящее к изменению экспрессии генов). Необходимы дальнейшие более глубокие исследования для выяснения эпигенетических механизмов антидепрессантного эффекта МОД.
Таким образом, нами впервые показано, что у потомства крыс WAG/Rij, матери которых потребляли МОД, происходит нормализация относительной длительности стадий цикла сон–бодрствование, длительности промежуточного сна, спектров мощности сонных веретен и их амплитуды. Предполагается, что этот благоприятный эффект МОД матери на цикл сон–бодрствование у потомства крыс линии WAG/Rij является, прежде всего, результатом изменения функционирования таламокортикальной системы, снижения возбудимости соматосенсорной коры мозга и уменьшения признаков абсансной эпилепсии предположительно за счет повышения экспрессии гена ионного канала HCN1, критически влияющего на возбудимость соматосенсорной коры.
Список литературы
Sarkisova K, van Luijtelaar G (2011) The WAG/Rij strain: A genetic animal model of absence epilepsy with comorbidity of depressiony. Prog Neuro-Psychopharmacol Biol Psychiatry 35: 854–876. https://doi.org/10.1016/j.pnpbp.2010.11.010
Kobow K, Blümcke I (2012) The emerging role of DNA methylation in epileptogenesis. Epilepsia 53: 11–20. https://doi.org/10.1111/epi.12031
Vialou V, Feng J, Robison AJ, Nestler EJ (2013) Epigenetic mechanisms of depression and antidepressant action. Annu Rev Pharmacol Toxicol 53: 59–87. https://doi.org/10.1146/annurev-pharmtox-010611-134540
Sarkisova KY, Gabova AV, Fedosova EA, Shatskova AB (2020) Gender-dependent effect of maternal methyl-enriched diet on the expression of genetic absence epilepsy and comorbid depression in adult offspring of WAG/Rij Rats. Dokl Biol Sci 494: 244–247. https://doi.org/10.1134/S0012496620050075
Lahtinen A, Puttonen S, Vanttola P, Viitasalo K, Sulkava S, Pervjakova N, Joensuu A, Salo P, Toivola A, Härmä M, Milani L, Perola M, Paunio T (2019) A distinctive DNA methylation pattern in insufficient sleep. Sci Rep 9: 1–9. https://doi.org/10.1038/s41598-018-38009-0
Colavito V, Fabene PF, Grassi–Zucconi G, Pifferi F, Lamberty Y, Bentivoglio M, Bertini G (2013) Experimental sleep deprivation as a tool to test memory deficits in rodents. Front Syst Neurosci 7: 1–17. https://doi.org/10.3389/fnsys.2013.00106
Kansagra S (2020) Sleep disorders in adolescents. Pediatrics 145(Suppl 2): S204–S209. https://doi.org/10.1542/PEDS.2019-2056I
Fogel SM, Smith CT (2011) The function of the sleep spindle: A physiological index of intelligence and a mechanism for sleep-dependent memory consolidation. Neurosci Biobehav Rev 35: 1154–1165. https://doi.org/10.1016/j.neubiorev.2010.12.003
Al-Biltagi MA (2014) Childhood epilepsy and sleep. World J Clin Pediatr 3: 45. https://doi.org/10.5409/wjcp.v3.i3.45
Dinopoulos A, Tsirouda MA, Bonakis A, Pons R, Pavlopoulou ID, Tsoumakas K (2018) Sleep architecture and epileptic characteristics of drug naïve patients in childhood absence epilepsy spectrum. A prospective study. Seizure 59: 99–107. https://doi.org/10.1016/j.seizure.2018.04.021
Gandolfo G, Romettino S, Gottesmann C, Van Luijtelaar G, Coenen A (1990) Genetically epileptic rats show a pronounced intermediate stage of sleep. Physiol Behav 47: 213–215. https://doi.org/10.1016/0031-9384(90)90063-A
van Luijtelaar G, Bikbaev A (2007) Midfrequency cortico-thalamic oscillations and the sleep cycle: Genetic, time of day and age effects. Epilepsy Res 73: 259–265. https://doi.org/10.1016/j.eplepsyres.2006.11.002
Sitnikova E (2021) Sleep disturbances in rats with genetic predisposition to spike-wave epilepsy (WAG/Rij). Front Neurol 12: 1–6. https://doi.org/10.3389/fneur.2021.766566
van Luijtelaar G, Wilde M, Citraro R, Scicchitano F, van Rijn C (2012) Does antiepileptogenesis affects sleep in genetic epileptic rats? Int J Psychophysiol 85: 49–54. https://doi.org/10.1016/j.ijpsycho.2011.09.010
Kovács Z, Czurkó A, Kékesi KA, Juhász G (2012) Neonatal tricyclic antidepressant clomipramine treatment reduces the spike-wave discharge activity of the adult WAG/Rij rat. Brain Res Bull 89: 102–107. https://doi.org/10.1016/j.brainresbull.2012.07.010
Mohammed HS, Khadrawy YA (2021) Electrophysiological and neurochemical evaluation of the adverse effects of REM sleep deprivation and epileptic seizures on rat’s brain. Life Sci 273: 119303. https://doi.org/10.1016/j.lfs.2021.119303
Grubar JC (1983) Sleep and mental deficiency. Rev Electroencephal Neurophysiol Clin 13: 107–113. https://doi.org/10.1016/S0370-4475(83)80068-9
Meeren HKM, Pijn JPM, Van Luijtelaar ELJM, Coenen AML, Da Silva FHL (2002) Cortical focus drives widespread corticothalamic networks during spontaneous absence seizures in rats. J Neurosci 22: 1480–1495. https://doi.org/10.1523/jneurosci.22-04-01480.2002
Polack P-O, Guillemain I, Hu E, Deransart C, Depaulis A, Charpier S (2007) Deep layer somatosensory cortical neurons initiate spike-and-wave discharges in a genetic model of absence seizures. J Neurosci 27: 6590–6599. https://doi.org/10.1523/JNEUROSCI.0753-07.2007
Lüttjohann A, Van Luijtelaar G (2012) The dynamics of cortico-thalamo-cortical interactions at the transition from pre-ictal to ictal LFPs in absence epilepsy. Neurobiol Dis 47: 49–60. https://doi.org/10.1016/j.nbd.2012.03.023
Westmijse I, Ossenblok P, Gunning B, van Luijtelaar G (2009) Onset and propagation of spike and slow wave discharges in human absence epilepsy: A MEG study. Epilepsia 50: 2538–2548. https://doi.org/10.1111/j.1528-1167.2009.02162.x
Sarrigiannis PG, Zhao Y, He F, Billings SA, Baster K, Rittey C, Yianni J, Zis P, Wei H, Hadjivassiliou M, Grünewald R (2018) The cortical focus in childhood absence epilepsy; evidence from nonlinear analysis of scalp EEG recordings. Clin Neurophysiol 129(3): 602–617. https://doi.org/10.1016/j.clinph.2017.11.029
Fernandez LMJ, Lüthi A (2020) Sleep spindles: Mechanisms and functions. Physiol Rev 100: 805–868. https://doi.org/10.1152/physrev.00042.2018
Steriade M, Deschenes M (1984) The thalamus as a neuronal oscillator. Brain Res Rev 8: 1–63. https://doi.org/10.1016/0165-0173(84)90017-1
Steriade M, McCormick DA, Sejnowski TJ (1993) Thalamocortical oscillations in the sleeping and aroused brain. Science 262(5134): 679–685. https://doi.org/10.1126/science.8235588
Kostopoulos G, Gloor P, Pellegrini A, Gotman J (1981) A study of the transition from spindles to spike and wave discharge in feline generalized penicillin epilepsy: Microphysiological features. Exp Neurol 73: 55–77. https://doi.org/10.1016/0014-4886(81)90045-5
Leresche N, Lambert RC, Errington AC, Crunelli V (2012) From sleep spindles of natural sleep to spike and wave discharges of typical absence seizures: Is the hypothesis still valid? Pflugers Arch 463: 201–212. https://doi.org/10.1007/s00424-011-1009-3
Kozák G, Földi T, Berényi A (2020) Spike-and-wave discharges are not pathological sleep spindles, network-level aspects of age-dependent absence seizure development in rats. 7(1): eNeuro 0253-19.2019. https://doi.org/10.1523/ENEURO.0253-19.2019
Sitnikova E, Hramov AE, Grubov V, Koronovsky AA (2014) Time-frequency characteristics and dynamics of sleep spindles in WAG/Rij rats with absence epilepsy. Brain Res 1543: 290–299. https://doi.org/10.1016/j.brainres.2013.11.001
Gabova AV, Sarkisova KY, Fedosova EA, Shatskova AB, Morozov AA (2020) Developmental changes in peak-wave discharges in WAG/Rij rats with genetic absence epilepsy. Neurosci Behav Physiol 50: 245–252. https://doi.org/10.1007/s11055-019-00893-y
Sitnikova EY, Smirnov KS, Grubov VV, Hramov AE (2019) Diagnostic principles of immature epileptic (proepileptic) EEG activity in rats with genetic predisposition to absence epilepsy. Informatsionno-Upravliaiushchie Sist 2019: 89–97. https://doi.org/10.31799/1684-8853-2019-1-89-97
Sarkisova KY, Kulikov MA (2006) Behavioral characteristics of WAG/Rij rats susceptible and non-susceptible to audiogenic seizures. Behav Brain Res 166: 9–18. https://doi.org/10.1016/j.bbr.2005.07.024
Surina NM, Ashapkin VV, Merzalov IB, Perepelkina OV, Fedotova IB, Pavlova GV, Poletaeva II (2014) Audiogenic seizure proneness after methyl-enriched diet in ontogeny. Dokl Biol Sci 454: 62–64. https://doi.org/10.1134/S0012496614010219
Sarkisova KY, Gabova AV (2018) Maternal care exerts disease-modifying effects on genetic absence epilepsy and comorbid depression. Genes Brain Behav 17(7): e12477. https://doi.org/10.1111/gbb.12477
Sarkisova KY, Gabova AV, Kulikov MA, Fedosova EA, Shatskova AB, Morosov AA (2017) Rearing by foster Wistar mother with high level of maternal care counteracts the development of genetic absence epilepsy and comorbid depression in WAG/Rij rats. Dokl Biol Sci 473: 39–42. https://doi.org/10.1134/S0012496617020077
Gobbo D, Scheller A, Kirchhoff F (2021) From physiology to pathology of cortico-thalamo-cortical oscillations: astroglia as a target for further research. Front Neurol 12: 1–26. https://doi.org/10.3389/fneur.2021.661408
Zhang Y, Gruber R (2019) Can slow-wave sleep enhancement improve memory? A review of current approaches and cognitive outcomes. Yale J Biol Med 92: 63–80.
Fedosova EA, Shatskova AB, Sarkisova KYu (2022) Ethosuximide improves cognitive flexibility during reversal learning in WAG/Rij rats with absence epilepsy and comorbid depression. J Evol Biochem Physiol 58: 98–116. https://doi.org/10.1134/S0022093022010100
Fedosova EA, Shatskova AB, Sarkisova KYu (2021) Ethosuximide increases exploratory motivation and improves episodic memory in the novel object recognition test in WAG/Rij rats with genetic absence epilepsy. Neurosci Behav Physiol 51: 501–512. https://doi.org/10.1007/s11055-021-01097-z
Sarkisova K, Fedosova E, Shatskova A, Gabova A, Rudenok M, Stanishevskaya V, Slominsky P (2021) Maternal methyl-enriched diet alters absence seizures, depression-like comorbidity and DNMT1, HCN1 and TH gene expression in adult offspring. 34th Int Epilepsy Congress Virtual, 2021. Epilepsia. Special Issue. S3. 62: 135–136. https://doi.org/10.1111/epi.17079
Strauss U, Kole MHP, Bräuer AU, Pahnke J, Bajorat R, Rolfs A, Nitsch R, Deisz RA (2004) An impaired neocortical Ih is associated with enhanced excitability and absence epilepsy. Eur J Neurosci 19: 3048–3058. https://doi.org/10.1111/j.0953-816X.2004.03392.x
Sarkisova K, van Luijtelaar G (2022) The impact of early-life environment on absence epilepsy and neuropsychiatric comorbiidities. IBRO Neurosci Rep 13: 436–438. https://doi.org/10.1016/j.ibneur.2022.10.012
Blumenfeld H, Klein JP, Schridde U, Vestal M, Rice T, Khera DS, Bashyal C, Giblin K, Paul-Laughinghouse C, Wang F, Phadke A, Mission J, Agarwal RK, Englot DJ, Motelow J, Nersesyan H, Waxman SG, Levin AR (2008) Early treatment suppresses the development of spike-wave epilepsy in a rat model. Epilepsia 49: 400–409. https://doi.org/10.1111/j.1528-1167.2007.01458.x
Palagini L, Baglioni C, Ciaparelli A, Gemignani A, Riemann D (2013) REM sleep dysregulation in depression: state of the art. Sleep Med Rev 17: 377–390. https://doi.org/10.1016/j.smrv.2012.11.001
Steiger A, Pawlowski M, Kimura M (2015) Sleep electroencephalography as a biomarker in depression. Chrono Physiol Ther 5: 15–25. https://doi.org/10.3390/ijms20030607
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


