Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 61-74
Реактивность брыжеечных артерий при развитии метаболического синдрома у крыс, получавших диету с высоким содержанием жиров
Г. Т. Иванова *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: ivanovagt@infran.ru
Поступила в редакцию 20.10.2022
После доработки 28.11.2022
Принята к публикации 29.11.2022
- EDN: IYTKZR
- DOI: 10.31857/S0869813923010089
Аннотация
Потребление избыточного количества жиров может приводить к развитию метаболического синдрома (МС). Однако вопрос о механизмах патофизиологических процессов МС изучен недостаточно. Целью работы было изучить влияние высокожировой диеты (HFD) на реактивность брыжеечных артерий крыс Wistar в условиях in vivo, а также оценить изменение механизмов эндотелийзависимой дилатации артерий при HFD. HFD-группа крыс (n = 25) получала в течение 10 недель HFD, содержащий 50% животного жира, контрольная (n = 25) – стандартный пищевой рацион. Оценивали влияние HFD на эндотелийзависимые и не связанные с эндотелием реакции брыжеечных артерий при действии агонистов в отсутствие и при применении блокаторов NO-синтазы (L-NAME), циклооксигеназы (индометацин) и К+-каналов (тетраэтиламмоний), используя микрофото- и видеорегистрацию диаметра брыжеечных артерий in vivo. Показано, что HFD у крыс приводила к развитию МС, в том числе к дислипидемии, гипергликемии и инсулинорезистентности, росту артериального давления. МС сопровождался нарушением функционального состояния брыжеечных артерий. У крыс HFD-группы, по сравнению с контрольной группой, наблюдалось усиление констрикторной реакции на фенилэфрин на 29%, а также снижение реактивности предварительно сокращенных фенилэфрином сосудов при действии ацетилхолина на 36%. Предварительная инкубация сосудов с блокаторами снижала амплитуду релаксации при действии ацетилхолина, по сравнению с исходной ацетилхолин-индуцированной вазорелаксацией, у крыс HFD-группы: с L-NAME – на 47%, L-NAME и индометацином – на 50%, L-NAME, индометацином и тетраэтиламмонием – на 65%; у контрольной группы – на 69, 72 и 83% соответственно. HFD не оказывала существенного влияния на амплитуду вазодилатации при действии нитропруссида натрия. Таким образом, эндотелиальная дисфункция у крыс, получавших HFD, была опосредована как нарушением NO-зависимых механизмов вазодилатации, в частности уменьшением продукции NO эндотелием, так и снижением эффективности ВКСа. Уменьшение биодоступности NO при HFD частично компенсировалось активацией механизмов эндотелиальной гиперполяризации (опосредованной активностью IКСа и SКСа) в ацетилхолин-индуцированной вазодилатации.
В настоящее время ожирение, приводящее к развитию метаболического синдрома (МС), приобрело характер эпидемии [1]. Во многом это связано с изменением профиля питания, в частности с увеличением доли продуктов, содержащих избыточное количество жиров [2]. Несмотря на активные исследования в последнее десятилетие, вопрос о механизмах патофизиологических процессов при развитии МС остается неясным, а поиск путей предупреждения или уменьшения патологических нарушений функций органов и тканей при МС является актуальной задачей современной физиологии и медицины.
Решить эту проблему помогает экспериментальное моделирование МС на лабораторных животных, для этого применяют диеты различного состава [3]. Для создания МС выбирают, как правило, сочетание высокожировой (HFD) и высокоуглеводной диеты [4], а HFD при стандартном содержании углеводов в диете у животных с исходно нормальным состоянием обмена веществ используется значительно реже.
Понятие МС включает в себя сложный комплекс процессов, основными из которых считаются развитие дислипидемии, инсулинорезистентности, артериальной гипертензии, эндотелиальной дисфункции, однако о конкретных механизмах таких нарушений пока нет единого мнения [1, 5].
Развитие эндотелиальной дисфункции является одним из факторов риска при высоком потреблении жиров в диете [6–8]. Клинические исследования у людей методом внутривенной плетизмографии на плече показали, что потребление избыточного количества жиров сопровождается уменьшением дилататорной реакции кровотока на введение ацетилхолина (АХ), причем роль NO-опосредованных механизмов вазодилатации при этом также снижается [9]. В экспериментах на животных было показано, что HFD вызывает угнетение эндотелийзависимой релаксации сосудов, оцененных в условиях in vitro, что может способствовать развитию артериальной гипертензии [10, 11]. Однако по вопросу конкретных механизмов эндотелиальной дисфункции при избыточном поступлении жиров с диетой нет полной ясности. Результаты экспериментов значительно варьируют вследствие применения диет с различным содержанием жиров и/или углеводов, отличающихся по возрасту животных и длительности диетического воздействия. Целью данной работы было оценить функциональное состояние сосудов у взрослых крыс Wistar, получающих HFD (содержание животных жиров 50%) в течение 10 нед., а также определить участие различных механизмов в АХ-индуцированной дилатации брыжеечных артерий у крыс при HFD, регистрируя динамику диаметра сосудов in vivo.
МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовались взрослые крысы стока Wistar (Центр коллективного пользования “Биоколлекция” Института физиологии им. И.П. Павлова РАН), самцы, исходной массой 260–280 г. Для проведения исследования 50 животных были случайным образом распределены на 2 равные группы, различающиеся по составу диеты. В первую, высокожировую группу (HFD) вошли 25 животных, получавших в течение 10 недель диету с высоким содержанием животных жиров (50%). В качестве источника жиров использовали говяжий жир. Контролем к ним служила группа крыс, получавших стандартный пищевой рацион, содержащий 4% жиров. Все животные имели свободный доступ к корму и воде.
Перед окончанием эксперимента у крыс собирали мочу и измеряли артериальное давление (АД) манжеточным методом на хвосте, используя электроманометр (ELEMA, Швеция).
В конце срока наблюдения проводили глюкозотолерантный тест, для этого крысам вводили внутрибрюшинно раствор глюкозы из расчета 2 г/кг массы тела и оценивали динамику уровня глюкозы в крови в течение 120 мин, по графику изменения уровня глюкозы рассчитывали площадь под кривыми “концентрация глюкозы–время”. Для инсулинорезистентного теста крысам вводили инсулин из расчета 0.75 ЕД/кг (Инсуман Рапид ГТ, Sanofi Aventis, Германия) и оценивали динамику уровня глюкозы в крови в течение 120 мин, по графику изменения уровня глюкозы рассчитывали площадь под кривыми “концентрация глюкозы–время”, а также константу скорости утилизации глюкозы (KITT): KITT = 0.693/t1/2 × 100, где t1/2 – время снижения уровня глюкозы до 50% от максимального снижения.
По окончании срока наблюдения 10 крыс из каждой группы декапитировали, собирали пробы крови, а также взвешивали миокард, забрюшинный и эпидидимальный жир и рассчитывали индексы массы органов и тканей, равные массе органа/массу крысы (мг/г). В сыворотке крови концентрацию креатинина, мочевины, глюкозы определяли на биохимическом анализаторе FURUNO-90 (Япония), содержание триглицеридов – на анализаторе ARCHITECT c8000 (США). В моче уровень креатинина и общего белка определяли на биохимическом анализаторе FURUNO-90 (Япония).
У 15 крыс из каждой группы проводили исследование эндотелийзависимой вазодилатации брыжеечных артерий in vivo. Крыс наркотизировали тилетамин/золазепамом (10 мг/кг массы тела, Zoletil 100, Vibrac, Франция). Для оценки АХ-индуцированной релаксации сосудов in vivo у крысы через разрез стенки брюшной полости выводили петлю тонкого кишечника, расправляли и помещали в специальный желоб, который фиксировали в термостабилизированной при температуре 37°С камере с протекающим физиологическим раствором следующего состава (ммоль/л): NaCl – 120.4; KCl – 5.9; CaCl2 – 2.5; MgCl2 – 1.2; NaH2PO4 – 1.2; NaHCO3 – 15.5; глюкоза – 11.5. Физиологический раствор сатурировали газовой смесью, состоящей из 95% О2 и 5% СО2, рН раствора поддерживали на уровне 7.4. Перед тестированием сосуд оставляли на 30 мин для стабилизации, затем проводили исследования согласно выбранному протоколу.
Для оценки эндотелийзависимой и эндотелийнезависимой вазодилатации использовали введение в омывающий сосуд раствор АХ (Sigma-Aldrich, США) 1 × 10–5 моль/л и нитропруссида натрия (ICN Biomedicals, США) 1 × 10–6 моль/л на фоне предварительного сокращения сосуда фенилэфрином (ФЭ, Sigma-Aldrich, США) 1 × 10–5 моль/л. Амплитуду дилатации выражали в процентах от амплитуды констрикции, вызванной ФЭ. С целью оценки участия отдельных механизмов в сосудистых реакциях на АХ использовали соответствующие блокаторы: блокатор NO-синтазы L-NAME (Nω-Nitro-L-arginine methyl ester hydrochloride, ICN Biomedicals) 1 × 10–4 моль/л; блокатор циклооксигеназы индометацин (Indomethacin, Sigma-Aldrich), 1 × 10–5 моль/л; неспецифический блокатор К+-каналов – тетраэтиламмоний (ТЭА), (Tetraethylammonium chloride, Sigma-Aldrich) 1 × 10–3 моль/л. Инкубирование сосуда в растворе с блокаторами проводили в течение 30 мин, после чего в раствор вводили ФЭ с последующим добавлением АХ. Индометацин использовали при одновременном ингибировании NO-зависимых механизмов, ТЭА – при одновременном ингибировании NO-синтазы и циклооксигеназы. Маточные растворы АХ, нитропруссида натрия, L-NAME и ТЭА готовились на основе дистиллированной воды. Индометацин растворяли в диметилсульфоксиде (Вектон, Россия). Полученный раствор добавляли в физиологический раствор до достижения необходимой концентрации индометацина. Диметилсульфоксид, при разведении его физиологическим раствором в соотношении 1 : 1000, не вызывал значимых изменений реактивности брыжеечных артерий.
Для уточнения влияния различных концентраций АХ на величину дилатации брыжеечных артерий у 10 крыс каждой группы проводили оценку кумулятивного эффекта постепенного повышения концентрации АХ (1 × 10–10–1 × 10–5 моль/л) на амплитуду вазодилатации.
Для оценки реактивности сосудов проводили фото- и видеорегистрацию диаметра брыжеечных артерий крыс in vivo с использованием с микроскопа Биомед МС-1Т-ZOOM (Россия) и камеры Basler BASLER acA4600-10uc (Германия), результаты обрабатывались программой MultiMedia Catаlog (MMC).
При статистической обработке результатов использовали программу Statistica v.12. Полученные данные представляли в виде среднего с его стандартной ошибкой. Для анализа полученных данных использовали однофакторный дисперсионный анализ (ANOVA). Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные исследования показали, что исходная масса тела крыс, а также ее динамика при потреблении HFD значимо не отличалась от показателей контрольных животных, получавших стандартный рацион. Через 10 нед. прирост массы тела животных, получавших HFD диету, составлял в среднем 42 ± 5%, в контрольной группе – 43 ± 6%, p > 0.05.
Однако несмотря на отсутствие различий в массе тела, потребление рациона с высоким содержанием жиров приводило к значительному изменению показателей гомеостаза, в частности у животных HFD-группы повышался уровень креатинина, мочевины, триглицеридов, и глюкозы в крови по сравнению с показателями контрольной группы (табл. 1). Кроме того, потребление HFD приводило к значительной протеинурии (содержание общего белка в моче животных HFD-группы 2.04 ± 0.34 г/л по сравнению с контрольной группой 1.11 ± 0.15 г/л, p < 0.001) и увеличению выведения креатинина почками (концентрация креатинина в моче у HFD-крыс 13.84 ± 2.74 ммоль/л по сравнению с контрольными – 7.83 ± 1.18 ммоль/л, p < 0.001).
Таблица 1.
Биохимические показатели крови крыс, получавших различную по содержанию жиров диету
| Показатель | Высокожировая группа n = 10 |
Контрольная группа n = 10 |
p |
|---|---|---|---|
| Мочевина, ммоль/л | 6.65 ± 0.63 | 5.57 ± 0.22 | <0.001 |
| Креатинин, ммоль/л | 86 ± 7 | 72 ± 3 | <0.001 |
| Триглицериды, ммоль/л | 1.11 ± 0.11 | 0.61 ± 0.25 | <0.001 |
| Глюкоза, ммоль/л | 6.6 ± 0.2 | 5.3 ± 0.3 | <0.001 |
| Максимальный уровень глюкозы при глюкозотолерантном тесте, ммоль/л | 22.2 ± 0.9 | 13.0 ± 0.9 | <0.001 |
| Минимальный уровень глюкозы при инсулинрезистентном тесте, ммоль/л | 4.9 ± 0.6 | 3.4 ± 0.5 | <0.01 |
Для оценки влияния HFD на состояние углеводного обмена крысам были проведены глюкозотолерантный и инсулинорезистентный тесты. Результаты глюкозотолерантного теста показали, что у крыс, получавших 50% жиров в диете, наблюдается повышение чувствительности к глюкозе, так как максимальный подъем уровня глюкозы у крыс HFD-группы превышал данный показатель контрольных животных в 1.7 раза (табл. 1), при этом площадь под кривой “глюкоза–время” у HFD крыс была больше (25.2 ± 1.6 усл. ед.), чем у животных, получавших стандартный рацион (16.0 ± ± 0.5 усл. ед., p < 0.001). Инсулинорезистентный тест показал, что крысы HFD-группы при введении инсулина имели менее выраженное снижение уровня глюкозы в крови по сравнению с контрольной группой (табл. 1), при этом площадь под кривой “глюкоза–время” у HFD-группы была больше (11.4 ± 0.9 усл. ед.), чем у контрольных животных (8.5 ± 0.3 усл. ед.). Константа скорости утилизации глюкозы (KITT) у HFD-крыс была значимо меньше (2.1 ± 0.8%/мин) чем у животных контрольной группы (5.8 ± 1.5%/мин, p < 0.01).
Результаты исследования также показали, что потребление HFD рациона имеет выраженный гипертензивный эффект, уровень АД крыс HFD-группы был значимо выше, чем контрольной (143 ± 5 и 120 ± 4 мм рт. ст. соответственно, p < 0.001).
Показано, что потребление диеты, содержащей 50% жиров, вызывает активизацию процессов ремоделирования миокарда, поскольку значимо увеличивается индекс массы миокарда и левого желудочка (табл. 2). Высокое содержание жиров в диете приводит к висцеральному ожирению: индекс массы эпидидимального и забрюшинного жира были значительно больше у HFD-крыс, чем у крыс, получавших стандартный пищевой рацион (табл. 2).
Таблица 2.
Индекс массы органов и тканей крыс, получавших различную по содержанию жиров диету
| Показатель | Высокожировая
группа n = 25 |
Контрольная
группа n = 25 |
p |
|---|---|---|---|
| Индекс массы миокарда, мг/г | 2.87 ± 0.12 | 2.59 ± 0.16 | <0.001 |
| Индекс массы левого желудочка, мг/г | 2.11 ± 0.13 | 1.84 ± 0.12 | <0.001 |
| Индекс массы эпидидимального жира, мг/г | 15.68 ± 2.06 | 11.67 ± 1.58 | <0.01 |
| Индекс массы забрюшинного жира, мг/г | 17.77 ± 2.17 | 9.98 ± 2.40 | <0.001 |
При исследовании влияния HFD на реактивность брыжеечных сосудов использовались агонисты, действие которых было опосредовано как эндотелийзависимыми (АХ), так и эндотелийнезависимыми (нитропруссид натрия, фенилэфрин) механизмами. Для определения роли различных механизмов эндотелийзависимой вазодилатации использовали блокаторы, поэтому прежде всего была проведена оценка влияния ингибиторов на тонус сосудов перед тестирующим воздействием. У всех крыс, независимо от группы, инкубация сосудов в физиологическом растворе, содержащем комплекс блокаторов, значимо не изменяла диаметр сосудов. Так, при принятии исходного диаметра сосуда за 100%, диаметр артерий у крыс HFD-группы составлял после инкубации с: L-NAME – 102 ± 6%, комплексом L-NAME и индометацина – 96 ± 6%, комплексом L-NAME, индометацина и ТЭА – 94 ± 5%; у крыс контрольной группы при инкубации с: L-NAME – 97 ± 7%, комплексом L-NAME и индометацина – 95 ± 5%, комплексом L-NAME, индометацина и ТЭА 96 ± 3%.
Оценка действия ФЭ на брыжеечные артерии показала, что у крыс HFD-группы амплитуда констрикции сосудов была в среднем на 29% больше, чем в контрольной группе (рис. 1а).
Рис. 1.
Влияние высокожировой диеты на эндотелийнезависимую реактивность брыжеечных артерий. (а) – амплитуда сокращения брыжеечных артерий при введении в омывающий сосуд раствора фенилэфрина (РЕ, 1 × 10–6 моль/л). По оси ординат – амплитуда констрикции, выраженная в процентах от исходного диаметра сосуда. (b) – амплитуда дилатации предварительно сокращенных фенилэфрином (1 × 10–6 моль/л) брыжеечных артерий при введении в омывающий сосуд раствора нитропруссида натрия (NP, 1 × 10–6 моль/л). По оси ординат – амплитуда дилатации, выраженная в процентах от амплитуды констрикции сосуда при действии фенилэфрина. Экспериментальные группы: HFD – крысы, получавшие диету с высоким содержанием животных жиров (50%), n = 15; сontrol – крысы, получавшие стандартную диету, n = 15. Данные представлены в виде среднего значения ± стандартная ошибка. p – значимость различий между группами.
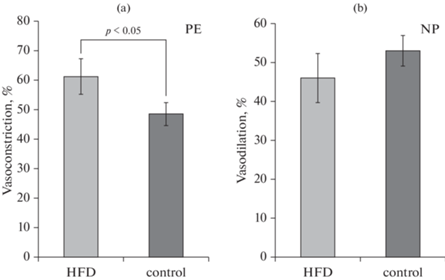
Для изучения влияния HFD на эндотелийнезависимую реактивность брыжеечных артерий крыс использовали оценку величины релаксации предварительно сокращенных ФЭ артерий на введение в перфузионный раствор нитропруссида натрия, источника экзогенного NO (рис. 1b). Эксперименты показали, что HFD в течение 10 нед. не оказывает значимого влияния на вазодилататорный эффект нитропруссида натрия, можно отметить лишь некоторую тенденцию к уменьшению амплитуды релаксации сосудов у HFD-крыс по сравнению с группой, получавшей стандартный рацион.
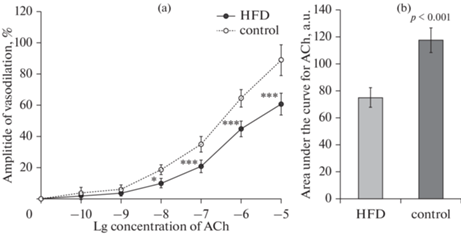
Для изучения влияния HFD на эндотелийзависимую вазодилатацию провели оценку кумулятивного эффекта введения в омывающий сосуд раствора АХ в ступенчато повышающейся концентрации от 1 × 10–10 до 1 × 10–5 моль/л на амплитуду дилатации предварительно сокращенных ФЭ брыжеечных артерий. Результаты показали, что у крыс, получавших HFD, по сравнению со стандартной диетой, наблюдается ослабление вазодилатации: амплитуда релаксации значимо уменьшалась уже при концентрации АХ 1 × 10–8 моль/л, а при повышении концентрации АХ различия между группами усилились (рис. 2а). Кроме того, расчет площади под кривой дозозависимого эффекта АХ показал, что общая реактивность брыжеечных артерий крыс, получавших HFD, снижалась в среднем на 28% по сравнению с показателем контрольной группы (рис. 2b).
Рис. 2.
Влияние высокожировой диеты на ацетилхолин-индуцированную дилатацию предварительно сокращенных фенилэфрином брыжеечных артерий крыс, кумулятивный эффект. (а) – амплитуда дилатации брыжеечных артерий при введении в омывающий сосуд раствора ацетилхолина (ACh): по оси абсцисс – логарифм концентрации ацетилхолина, по оси ординат – амплитуда вазорелаксации, выраженная в процентах от амплитуды вазоконстрикции при действии фенилэфрина (1 × 10–6 моль/л). (b) – площадь под кривой доза–эффект для ацетилхолина: по оси ординат – площадь под кривой зависимой от концентрации ацетилхолина амплитуды дилатации, усл. ед. Экспериментальные группы: HFD – крысы, получавшие диету с высоким содержанием животных жиров (50%), n = 10; сontrol – крысы, получавшие стандартную диету, n = 10. Данные представлены в виде среднего значения ± стандартная ошибка среднего. * – различия между группами значимы (p < 0.05), *** – различия между группами значимы (p < 0.001).
Оценка дилататорного эффекта АХ при концентрации 1 × 10–5 моль/л была использована в исследовании для уточнения роли основных механизмов АХ-индуцированной вазодилатации у крыс, получавших различное количество жиров в диете. Эксперименты показали, что HFD вызывает угнетение вызванной АХ релаксации брыжеечных сосудов: амплитуда вазодилатации была на 19.6% меньше, чем в контрольной группе (рис. 3а).
Рис. 3.
Влияние высокожировой диеты на ацетилхолин-индуцированную дилатацию предварительно сокращенных фенилэфрином брыжеечных артерий крыс. Амплитуда дилатации предварительно сокращенных фенилэфрином (1 × 10–6 моль/л) брыжеечных артерий при введении в омывающий сосуд раствора ацетилхолина (1 × 10–5 моль/л): (а) – в отсутствие блокаторов и после инкубации сосудов с L-NAME (1 × 10–4 моль/л); (b) – после инкубации сосудов с комплексом L-NAME, индометацина (Indo, 1 × 10–5 моль/л) и ТЭА (1 × 10–3 моль/л). По оси ординат: амплитуда вазодилатации при действии ацетилхолина, выраженная в процентах от амплитуды сокращения на фенилэфрин. Экспериментальные группы: HFD – крысы, получавшие диету с высоким содержанием животных жиров (50%), n = 15; сontrol – крысы, получавшие стандартную диету, n = 15. Данные представлены в виде среднего значения ± стандартная ошибка. p – значимость различий между группами.
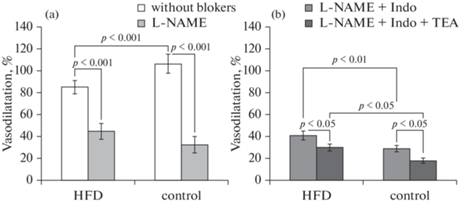
Для того чтобы определить возможные механизмы снижения АХ-индуцированной вазодилатации крыс, получавших HFD, оценивали изменение диаметра брыжеечных артерий при действии АХ в условиях ингибирования NO-синтазы введением в омывающий сосуд раствор L-NAME, а также L-NAME в сочетании с ингибитором циклооксигеназы индометацином и неспецифическим блокатором К+-каналов ТЭА. Эксперименты показали, что при блокаде NO-синтазы, по сравнению с условиями без блокаторов, амплитуда дилатации значительно снижалась у крыс HFD-группы на 46.6 ± 6.8%, однако в контрольной группе понижение амплитуды вазорелаксации оказалось более выраженным – на 66.7 ± 5.2% (p < 0.001). Добавление в инкубационную среду комплекса L-NAME с индометацином значимо не изменило реакцию сосудов на АХ по сравнению с применением только блокатора NO-синтазы (рис. 3b). В то же время добавление ТЭА в инкубационный раствор, содержащий L-NAME и индометацин, привело к значимому уменьшению амплитуды дилатации сосудов у крыс HFD-группы на 26.8 ± 3.8%, у контрольных животных – на 37.9 ± 4.3% (рис. 3b). После применения комплекса трех блокаторов реактивность сосудов к действию АХ у HFD-крыс оказалась в среднем на 40% выше, чем у контрольных животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные исследования показали, что HFD оказывает значительное влияние на липидный и глюкозный обмен, а также на функциональное состояние сосудов. Используемая в течение 10 нед. HFD приводила к появлению у крыс основных признаков МС. Отсутствие общего ожирения у крыс при потреблении HFD в наших экспериментах согласуется с некоторыми исследованиями [12, 13], однако другие авторы сообщают о повышенной массе тела крыс, получавших HFD [4, 14, 15]. В нашем исследовании HFD вызывала развитие у крыс висцерального ожирения, что считается более значимым патологическим фактором, чем общее ожирение. Показано, что при висцеральном ожирении наблюдается снижение синтеза сосудорасширяющих адипокинов, лептина и усиление производства обладающих патологической активностью цитокинов и свободных радикалов [11, 16], а также развитие хронического воспаления [17], что может усиливать дисфункцию сосудов.
В нашем исследовании потребление HFD приводило к росту уровня АД, что могло быть следствием как показанной нами эндотелиальной дисфункции, выражающейся в снижении вазодилатирующей способности сосудов, приводящей к росту сосудистого тонуса, так и развития симпатикотонии, отмечающейся при HFD [14]. Возможным следствием подъема уровня АД можно считать активизацию процессов ремоделирования миокарда, о которой судили по отмеченному нами повышению индекса массы миокарда и левого желудочка. При ожирении усиление гипертрофии миокарда отмечается как у людей [18], так и у экспериментальных животных [19].
Наши исследования показали возможность изменения метаболизма глюкозы при модификации только жировой составляющей диеты уже на ранних сроках, при этом отмечалась как инсулинорезистентность, так и повышение чувствительности к глюкозе, что согласуется с другими исследованиями, показавшими изменение углеводного обмена уже через 2–8 нед. HFD [20, 21]. Таким образом, потребление HFD приводило к появлению всех основных факторов МС у крыс.
Проведенные исследования показали, что развитие МС сопровождается повышением констрикторной реакции сосудов на действие ФЭ. Увеличение вызванной ФЭ реактивности сосудов при МС отмечалось и другими авторами как при применении HFD [22], так и при использовании высокоуглеводной нагрузки [23]. Поскольку величина сосудистого тонуса определяется балансом между констрикторными и дилататорными факторами, действующими на ГМК [24], то усиление реакций сосудов на констрикторные агенты, в частности на ФЭ, которое наблюдается при HFD, может приводить к дисбалансу между сосудорасширяющими и сосудосуживающими влияниями даже при сохранении нормальной продукции эндотелием вазорелаксирующих факторов.
С целью изучения влияния HFD на эндотелийзависимую вазорелаксацию оценивали АХ-индуцированную дилатацию брыжеечных артерий крыс. Эксперименты показали, что HFD снижает амплитуду вызванного АХ расслабления сосудов у крыс почти на 20% по сравнению с животными, получавшими стандартную диету, то есть развивалась эндотелиальная дисфункция. Ослабление релаксации сосудов различного типа у животных с МС отмечали и другие исследователи в экспериментах in vitro [10, 11, 25]. Важно, что уменьшение реакции на АХ при повышенном потреблении жиров отмечается не только у экспериментальных животных [26], но и у людей, показавших значительное снижение реакции кровотока в предплечье на инфузию АХ при потреблении диеты, содержащей более 35% жиров [9].
Принято считать, что эндотелийзависимая релаксация сосудов зависит от активности трех основных механизмов: NO-зависимых, простагландин-опосредованных, а также эндотелиальной гиперполяризации [27, 28]. Роль каждого их этих путей АХ-индуцированной вазодилатации мы попытались оценить в данном исследовании.
Основным вазодилатирующим фактором, продуцируемым эндотелием, считают NO [28]. Для определения степени участия связанных с NO механизмов дилатации перед проведением тестового воздействия сосуд инкубировали в растворе, содержащем ингибитор NO-синтазы L-NAME, и оценивали разницу в амплитуде дилатации без блокатора и после его применения. Прекращение продукции NO сопровождалось уменьшением вызванной АХ вазорелаксации как у контрольных крыс, так и у животных, получавших HFD. Однако анализ результатов показал, что HFD приводит к снижению роли NO-опосредованного механизма в дилатации брыжеечных артерий, поскольку инкубация сосудов с L-NAME снижала амплитуду вазодилатации у HFD-крыс в меньшей степени, чем у контрольных животных. Участие NO в реакции сосудов на АХ зависит не только от количества синтезированного эндотелием NO, но и от чувствительности ГМК к нему. Наши исследования показали, что снижение роли NO-зависимого пути расслабления сосудов HFD-крыс не связано с изменением чувствительности ГМК к NO, поскольку отсутствовали различия с контрольной группой в амплитуде вызванной нитропруссидом натрия дилатации сосудов у крыс. Таким образом, МС приводит к нарушению NO-зависимого механизма регуляции сосудистого тонуса вследствие ослабления синтеза NO эндотелием при сохранении нормальной реактивности ГМК на действие NO. Наши результаты, полученные на сосудах в условиях in vivo, согласуются с экспериментальными исследованиями in vitro, показавшими ослабление NO-зависимых механизмов вазодилатации при развитии МС у животных [10, 22], а также с клиническими исследованиями при МС у людей [29, 30].
Так как NO обладает способностью модулировать продукцию эндотелием других вазодилататоров [31, 32], то роль отличных от NO механизмов релаксации сосудов исследовалась на фоне ингибирования NO-синтазы. Учитывая, что одним из основных факторов, регулирующих тонус кровеносных сосудов, являются простагландины, мы оценили влияние HFD на опосредованные простагландинами механизмы вазодилатации. Поскольку простациклин считается основным простагландином, участвующим в эндотелийзависимой вазодилатации [33], был использован блокатор циклооксигеназы индометацин. Сравнение амплитуды вазодилатации после инкубации сосудов с L-NAME и при использовании комплекса L-NAME и индометацина показало, что блокада циклооксигеназы не оказывала существенного влияния на амплитуду дилатации сосудов как у HFD-крыс, так и у контрольных животных. Таким образом, снижение реактивности сосудов на АХ у крыс, получавших HFD, не связана с изменением активности простагландин-зависимых механизмов. Наши данные согласуются с результатами исследований in vitro на сосудистых кольцах, которые также показали отсутствие влияния MC на опосредованную простагландинами дилатацию сосудов [10, 34].
Одним из важнейших механизмов эндотелийзависимой дилатации сосудов является эндотелиальная гиперполяризация [27, 28]. Несмотря на то, что природа гиперполяризующего фактора точно не установлена, развитие эндотелиальной гиперполяризации реализуется через активацию локализованных в эндотелии К+-каналов [35–37]. Для исследования роли К+-каналов в реакции брыжеечных артерий на АХ использовали предварительную инкубацию сосудов в физиологическом растворе, содержащем неспецифический блокатор К+-каналов ТЭА, который применяли в комплексе с L-NAME и индометацином. Хотя ТЭА является неспецифическим блокатором как Са2+-активируемых К+-каналов большой проводимости (ВКСа), так и различных потенциал-зависимых К+-каналов (Кv), считается, что при концентрации 10–3 моль/л он достаточно эффективен в отношении ВКСа [38]. Результаты показали, что HFD приводит к снижению роли ВКСа, а, возможно, и Кv, в АХ-индуцированной вазодилатации, поскольку у крыс HFD-группы снижение амплитуды релаксации брыжеечных артерий, измеренной до и после применения ТЭА, было меньше, чем у контрольных животных.
Применение комплекса трех блокаторов (L-NAME, индометацина и ТЭА) не привело к полному ингибированию релаксации при действии АХ. Остаточная реактивность на действие АХ может осуществляться через механизм эндотелиальной гиперполяризации, опосредованной активностью Са2+-активируемых К+-каналов промежуточной (IКСа) и малой (SКСа) проводимости [39, 40]. В наших экспериментах после инкубации сосудов с комплексом трех блокаторов амплитуда дилатации сосудов крыс HFD-группы оказалась значительно больше, чем у контрольных животных, что может свидетельствовать о повышении роли механизма эндотелиальной гиперполяризации в эндотелийзависимой релаксации брыжеечных артерий крыс, получавших HFD. В отличие от наших данных, в некоторых исследованиях отмечено снижение экспрессии IКСа и SКСа при HFD и сочетании HFD и высокоуглеводной диеты [14, 41], однако длительность диетического воздействия в данных исследованиях была значительно большей. Возможно, что в наших экспериментах на ранних сроках МС сопровождался первоначальной компенсаторной активацией механизма эндотелиальной гиперполяризации, которая развивалась в ответ на снижение эффективности NO-зависимых механизмов вазодилатации.
Таким образом, наши исследования показали, что HFD у крыс длительностью 10 нед. приводит к развитию МС, который характеризуется гиперглицеридемией, подъемом уровня АД, инсулинорезистентностью, эндотелиальной дисфункцией. Нарушение функционального состояния брыжеечных артерий HFD-крыс выражается в усилении констрикторных реакций на ФЭ, а также в снижении реактивности сосудов к действию АХ. Эндотелиальная дисфункция у крыс, получавших HFD, опосредована как нарушением NO-зависимых механизмов вазодилатации, в частности уменьшением продукции NO эндотелием, так и снижением эффективности ВКСа. Уменьшение биодоступности NO при HFD частично компенсируется активацией механизмов эндотелиальной гиперполяризации (опосредованной активностью IКСа и SКСа) в ацетилхолин-индуцированной вазодилатации.
Список литературы
Bovolini A, Garcia J, Andrade MA, Duarte JA (2021) Metabolic Syndrome Pathophysiology and Predisposing Factors. Int J Sports Med 42(3): 199–214. https://doi.org/10.1055/a-1263-0898
Rochlani Y, Pothineni NV, Kovelamudi S, Mehta JL (2017) Metabolic syndrome: pathophysiology, management, and modulation by natural compounds. Ther Adv Cardiovasc Dis 11(8): 215–225. https://doi.org/10.1177/1753944717711379
Wong SK, Chin KY, Suhaimi FH, Fairus A, Ima-Nirwana S (2016) Animal models of metabolic syndrome: a review. Nutr Metab 13: 65. https://doi.org/10.1186/s12986-016-0123-9
Abdulrahman AO, Kuerban A, Alshehri ZA, Abdulaal WH, Khan JA, Khan MI (2020) Urolithins Attenuate Multiple Symptoms of Obesity in Rats Fed on a High-Fat Diet. Diabetes Metab Syndr Obes 13: 3337–3348. https://doi.org/10.2147/DMSO.S268146
Alberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, Fruhart JC, James WPT, Loria CM, Smith SC Jr (2009) Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 120: 1640–1645. https://doi.org/10.1161/CIRCULATIONAHA.109.192644
Koliaki C, Liatis S, Kokkinos A (2019) Obesity and Cardiovascular Disease: Revisiting an Old Relationship. Metabolism 92: 98–107. https://doi.org/10.1016/j.metabol.2018.10.011
Stanek A, Fazeli B, Bartuś S, Sutkowska E (2018) The Role of Endothelium in Physiological and Pathological States: New Data. Biomed Res Int 2018: e1098039. https://doi.org/10.1155/2018/1098039
Suzuki T, Hirata K, Elkind MS, Jin Z, Rundek T, Miyake Y, Boden-Albala B, Di Tullio MR, Sacco R, Homma S (2008) Metabolic syndrome, endothelial dysfunction, and risk of cardiovascular events: the Northern Manhattan Study (NOMAS). Am Heart J 156(2): 405–410. https://doi.org/10.1016/j.ahj.2008.02.022
Dow CA, Stauffer BL, Greiner JJ, DeSouza CA (2015) Influence of habitual high dietary fat intake on endothelium-dependent vasodilation. Appl Physiol Nutr Metab 40(7): 711–715. https://doi.org/10.1139/apnm-2015-0006
Lozano-Cuenca J, Valencia-Hernández I, López-Canales OA, Flores-Herrera H, López-Mayorga RM, Castillo-Henkel EF, López-Canales JS (2020) Possible mechanisms involved in the effect of the subchronic administration of rosuvastatin on endothelial function in rats with metabolic syndrome. Braz J Med Biol Res 53(2): e9304. https://doi.org/10.1590/1414-431X20199304
Oishi JC, Castro CA, Silva KA, Fabricio V, Cárnio EC, Phillips SA, Duarte ACGO, Rodrigues GJ (2018) Endothelial Dysfunction and Inflammation Precedes Elevations in Blood Pressure Induced by a High-Fat Diet. Arq Bras Cardiol 110(6): 558–567. https://doi.org/10.5935/abc.20180086
Oliva L, Aranda T, Caviola G, Fernández-Bernal A, Alemany M, Fernández-López JA, Remesar X (2017) In rats fed high-energy diets, taste, rather than fat content, is the key factor increasing food intake: a comparison of a cafeteria and a lipid-supplemented standard diet. Peer J 5: e3697. https://doi.org/10.7717/peerj.3697
Ramalho L, da Jornada MN, Antunes LC, Hidalgo MP (2017) Metabolic disturbances due to a high-fat diet in a non-insulin-resistant animal model. Nutr Diabetes 7(3): e245. https://doi.org/10.1038/nutd.2016.47
Garcia ML, Milanez MIO, Nishi EE, Sato AYS, Carvalho PM, Nogueira FN, Campos RR, Oyama LM, Bergamaschi CT (2021) Retroperitoneal adipose tissue denervation improves cardiometabolic and autonomic dysfunction in a high fat diet model. Life Sci 283: 119841. https://doi.org/10.1016/j.lfs.2021.119841
Gradel AKJ, Salomonsson M, Sørensen CM, Holstein-Rathlou NH, Jensen LJ (2018) Long-term diet-induced hypertension in rats is associated with reduced expression and function of small artery SKCa, IKCa, and Kir2.1 channels. Clin Sci (Lond) 132(4): 461–474. https://doi.org/10.1042/CS20171408
Skurk T, Alberti-Huber C, Herder C, Hauner H (2007) Relationship between Adipocyte Size and Adipokine Expression and Secretion. J Clin Endocrinol Metab 92: 1023–1033. https://doi.org/10.1210/jc.2006-1055
Sudhakar M, Silambanan S, Chandran AS, Prabhakaran AA, Ramakrishnan R (2018) C-Reactive Protein (CRP) and Leptin Receptor in Obesity: Binding of Monomeric CRP to Leptin Receptor. Front Immunol 9: 1167. https://doi.org/10.3389/fimmu.2018.01167
Mahajan R, Lau DH, Sanders P (2015) Impact of obesity on cardiac metabolism, fibrosis, and function. Trends Cardiovasc Med 25: 119–126. https://doi.org/10.1016/j.tcm.2014.09.005
Gutiérrez-Cuevas J, Sandoval-Rodríguez A, Monroy-Ramírez HC, Mercado MV-D, Santos-García A, Armendáriz-Borunda J (2020) Prolonged-release pirfenidone prevents obesity-induced cardiac steatosis and fibrosis in a mouse NASH model. Cardiovasc Drugs Ther 35(5): 927–938. https://doi.org/10.1007/s10557-020-07014-9
Kwiatkowski G, Bar A, Jasztal A, Chłopicki S (2021) MRI-based in vivo detection of coronary microvascular dysfunction before alterations in cardiac function induced by short-term high-fat diet in mice. Sci Rep 11(1): 18915. https://doi.org/10.1038/s41598-021-98401-1
Zhang XY, Guo CC, Yu YX, Xie L, Chang CQ (2020) Establishment of high-fat diet-induced obesity and insulin resistance model in rats. Beijing Da Xue Xue Bao Yi Xue Ban (Chinese) 52(3): 557–563. https://doi.org/10.19723/j.issn.1671-167X.2020.03.024
Azemi AK, Siti-Sarah AR, Mokhtar SS, Rasool AHG (2022) Time-Restricted Feeding Improved Vascular Endothelial Function in a High-Fat Diet-Induced Obesity Rat Model. Vet Sci 9(5): 217. https://doi.org/10.3390/vetsci9050217
Царева ИА, Иванова ГТ, Лобов ГИ (2022) Ранние изменения функционального состояния артерий и сосудов микроциркуляторного русла при моделировании метаболического синдрома. Рос физиол журн им ИМ Сеченова 108(9): 1134–1147. [Tsareva IA, Ivanova GT, Lobov GI (2022) Early Changes in the Functional State of the Arteries and Vessels of the Microcirculatory Bed in Modeling the Metabolic Syndrome. Russ J Physiol 108(9): 1134–1147. (In Russ)]. https://doi.org/10.31857/S0869813922090084
Ledoux J, Werner EM, Brayden EJ, Nelson TM (2006) Calcium-activated potassium channels and the regulation of vascular tone. Physiology 21: 69–78. https://doi.org/10.1152/physiol.00040.2005
Gamez-Mendez AM, Vargas-Robles H, Ríos A, Escalante B (2015) Oxidative stress-dependent coronary endothelial dysfunction in obese mice. PLoS One 10(9): 1–17. https://doi.org/10.1371/journal.pone.0138609
Madkhali HA (2020) Morin attenuates high-fat diet induced-obesity related vascular endothelial dysfunction in Wistar albino rats. Saudi Pharm J 28(3): 300–307. https://doi.org/10.1016/j.jsps.2020.01.009
Rubanyi GM (1991) Endothelium-derived relaxing and contracting factors. J Cell Biochem 46(1): 27–36. https://doi.org/10.1002/jcb.240460106
Freed JK, Gutterman DD (2017) Communication Is Key: Mechanisms of Intercellular Signaling in Vasodilation. J Cardiovasc Pharmacol 69(5): 264–272. https://doi.org/10.1097/FJC.0000000000000463
Dimassi S, Chahed K, Boumiza S, Canault M, Tabka Z, Laurant P, Riva C (2016) Role of eNOS- and NOX-containing microparticles in endothelial dysfunction in patients with obesity. Obesity 24: 1305–1312. https://doi.org/10.1002/oby.21508
Schinzari F, Iantorno M, Campia U, Mores N, Rovella V, Tesauro M, Di Daniele N, Cardillo C (2015) Vasodilator responses and endothelin-dependent vasoconstriction in metabolically healthy obesity and the metabolic syndrome. Am J Physiol Endocrinol Metab 309(9): E787–E792. https://doi.org/10.1152/ajpendo.00278.2015
Looft-Wilson RC, Ashley BS, Billig JE, Wolfert MR, Ambrecht LA, Bearden SE (2008) Chronic diet-induced hyperhomocysteinemia impairs eNOS regulation in mouse mesenteric arteries. Am J Physiol Regul Integr Comp Physiol 295(1): R59–R66. https://doi.org/10.1152/ajpregu.00833.2007
Giles TD, Sander GE, Nossaman BD, Kadowitz PJ (2012) Impaired vasodilation in the pathogenesis of hypertension: focus on nitric oxide, endothelial-derived hyperpolarizing factors, and prostaglandins. J Clin Hypertens (Greenwich) 14(4): 198–205. https://doi.org/10.1111/j.1751-7176.2012.00606.x
Parkington HC, Coleman HA, Tare M (2004) Prostacyclin and endothelium-dependent hyperpolarization. Pharmacol Res 49(6): 509–514. https://doi.org/10.1016/j.phrs.2003.11.012
Rubio-Ruiz ME, Pérez-Torres I, Diaz-Diaz E, Pavón N, Guarner-Lans V (2014) Non-steroidal anti-inflammatory drugs attenuate the vascular responses in aging metabolic syndrome rats. Acta Pharmacol Sin 35(11): 1364–1374. https://doi.org/10.1038/aps.2014.67
Jin X, Satoh-Otonashi Y, Zamami Y, Takatori S, Hashikawa-Hobara N, Kitamura Y, Kawasaki H (2011) New molecular mechanisms for cardiovascular disease: contribution of endothelium-derived hyperpolarizing factor in the regulation of vasoconstriction in peripheral resistance arteries. J Pharmacol Sci 116(4): 332–336. https://doi.org/10.1254/jphs.10r30fm
Mandalà M, Gokina N, Barron C, Osol G (2012) Endothelial-derived hyperpolarization factor (EDHF) contributes to PLGF-induced dilation of mesenteric resistance arteries from pregnant rats. J Vasc Res 49: 43–49. https://doi.org/10.1159/000329821
Busse R, Edwards G, Félétou M, Fleming I, Vanhoutte PM, Weston AH (2002) EDHF: bringing the concepts together. Trends Pharmacol Sci 23(8): 374–380. https://doi.org/10.1016/s0165-6147(02)02050-3
Tykocki NR, Boerman EM, Jackson WF (2017) Smooth Muscle Ion Channels and Regulation of Vascular Tone in Resistance Arteries and Arterioles. Compr Physiol 16; 7(2): 485–581. https://doi.org/10.1002/cphy.c160011
Köhler R, Olivan-Viguera A, Wulff H (2016) Endothelial Small- and Intermediate-Conductance K Channels and Endothelium-Dependent Hyperpolarization as Drug Targets in Cardiovascular Disease. Adv Pharmacol 77: 65–104. https://doi.org/10.1016/bs.apha.2016.04.002
Félétou M (2016) Endothelium-Dependent Hyperpolarization and Endothelial Dysfunction. J Cardiovasc Pharm 67: 373–387. https://doi.org/10.1097/FJC.0000000000000346
Haddock RE, Grayson TH, Morris MJ, Howitt L, Chadha PS, Sandow SL (2011) Diet-induced obesity impairs endothelium-derived hyperpolarization via altered potassium channel signaling mechanisms. PLoS One 6(1): e16423. https://doi.org/10.1371/journal.pone.0016423
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


