Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 94-108
Динамика экспрессии генов костного гомеостаза при развитии асептического некроза головки бедренной кости в эксперименте
Н. А. Шабалдин 1, *, А. В. Синицкая 2, А. В. Шабалдин 1, 2, Р. А. Мухамадияров 2
1 Кемеровский государственный медицинский университет МЗ РФ
Кемерово, Россия
2 НИИ комплексных проблем сердечно-сосудистых заболеваний
Кемерово, Россия
* E-mail: shabaldin.nk@yandex.ru
Поступила в редакцию 28.09.2022
После доработки 29.11.2022
Принята к публикации 08.12.2022
- EDN: IYJYVU
- DOI: 10.31857/S0869813923010107
Аннотация
Патогенез ряда заболеваний характеризуется нарушением регуляции костного гомеостаза с прогрессирующим развитием остеодеструкции. Вместе с тем ведется активное изучение механизмов, приводящих к смещению баланса остеорепаративного и остеорезорбционного направления остеогенеза. Определение молекулярно-клеточных паттернов, влияющих на динамику изменений костного метаболизма, является значимой задачей в среде широкого круга специалистов. Такие исследовательские работы позволяют предложить алгоритмы таргетного терапевтического воздействия на различные ключевые звенья патогенеза остеодеструкции. В проведенном исследовании выполнен анализ экспрессии генов, участвующих в поддержании костного гомеостаза, а также изучено изменение гистологической картины в экспериментальных условиях в зависимости от времени, прошедшего с момента индукции асептического некроза. Результаты работы отобразили гетерогенность развития остеодеструкции в экспериментах на крысах линии Вистар при хирургически созданном очаге гипоперфузии головки бедренной кости на фоне повышения внутрисуставного давления. В первые две недели развития асептического некроза наиболее активно экспрессировался ген hif1a, который может рассматриваться с позиции триггера дальнейшего нарушения костного метаболизма. При этом экспрессия мРНК генов остеогенеза и остеорезорбции была снижена. Наиболее активные остеолитические процессы по данным электронной микроскопии, а также увеличение экспрессии генов индукции остеокластогенеза наблюдались на 6-й неделе эксперимента. Остеорепаративная направленность метаболизма костной ткани постепенно увеличивалась от начала исследования, и через 2 мес. после индукции аваскулярного некроза головки бедренной кости в образцах определялись активные остеобласты, усиление экспрессии генов костного матрикса и остеобластогенеза. Таким образом, развитие остеодеструкции является крайне гетерогенным процессом с динамически меняющимися в зависимости от времени молекулярными паттернами, определяющими активность сигнальных путей костного метаболизма.
Гомеостаз костной ткани является динамическим процессом, сохраняющим баланс посредством функционирования большого количества разнообразных внутриклеточных и межклеточных сигнальных путей, направленных на регуляцию остеобластогенеза и остеокластогенеза [1]. При этом сигналинг костного метаболизма характеризуется значительной гетерогенностью: так, в нем участвуют системы рецептора активатора ядерного фактора каппа β, его лиганда и остеопротегерина (RANK–RANKL–OPG), канонический wnt (wingless)/b катенин, JAK (Janus Kinase)/STAT (Signal Transducer and Activator of Transcription), MAPK (протеинкиназа, активируемая митогенами), фосфорилирование, а также большое количество разнообразных медиаторов [2–4].
В патогенезе ряда заболеваний, таких как ревматоидный, ювенильный идиопатический артриты, асептический некроз и остеохондропатия наблюдается смещение баланса регуляции процессов ремоделирования в сторону преобладания костной резорбции. Характер остеодеструкции во многом определяется природой той или иной нозологической формы, однако в большинстве случаев можно выделить стадийность течения патологии с активацией определенных молекулярно-клеточных регуляторных звеньев.
Ключевая роль в генезе асептического некроза и остеохондропатии головки бедренной кости принадлежит нарушению перфузии проксимального отдела бедра, при этом ишемический стресс, последующий за этим, может являться триггерным фактором нарушения метаболизма костной ткани [5]. Тканевая кислородная недостаточность приводит к повышению транскрипции гена гипоксией индуцированного фактора 1 (hif1a), который может транскрибироваться в большинстве клеток. Кислород-зависимая субъединица HIF-1a является маркером острой тканевой гипоксии. Высокий уровень экспрессии hif1a реализует стресс-реакцию организма с преобладанием провоспалительных реакций, что может привести к дисбалансу биологического действия цитокинов [6].
Так, ряд исследований выявил повышенную экспрессию провоспалительных цитокинов хондроцитами при развитии остеодеструкции, увеличение концентрации которых рассматривается как один из основных компонентов индукции дифференцировки остеокластов посредством сигнальной системы RANK–RANKL–OPG. Известно, что биологическое действие таких цитокинов как интерлейкин 1b (IL-1b), интерлейкин 6 (IL-6) и фактор некроза опухоли α (TNF-α) направлено на усиление экспрессии лиганда рецептора активатора ядерного фактора каппа b (RANKL) на поверхности остеобластов и активированных T-лимфоцитах [7]. В результате связывания лиганда (RANKL) и рецептора активатора ядерного фактора каппа b (RANK), находящегося на плазматической мембране преостеокластов, происходит транспорт ядерного фактора каппа b (NF-kB) из цитоплазмы в ядро клетки с последующей транскрипцией генов дифференцировки зрелых остеокластов. Остеопротегерин (OPG) связывает свободный и мембранно-ассоциированный RANKL, тем самым препятствует его взаимодействию с RANK, ингибирует процессы созревания остеокластов из прогениторных клеток. Высокий уровень провоспалительных цитокинов приводит к преобладанию продуцирования RANKL, индукции остекластогенеза, и, как следствие, усилению процессов остеолизиса [8].
Тем не менее, активация тех или иных сигнальных путей и повышение концентрации регуляторных молекул во многом зависят от стадии течения асептического некроза, а также времени, прошедшего с момента начала заболевания.
Цель исследования: оценить динамику экспрессии генов, участвующих в поддержании костного гомеостаза, изменении гистологической картины в экспериментальных условиях при хирургической индукции асептического некроза.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальная работа проведена на 20 самцах крыс линии Вистар, массой тела 250 ± 25 г, в возрасте 3 мес. Экспериментальная часть работы с лабораторными животными проводилась на базе вивария, располагающегося в Научно-исследовательском институте комплексных проблем сердечно-сосудистых заболеваний, г. Кемерово. Выведение крыс из эксперимента осуществлялось путем декапитации каждые 2 нед. по 4 особи в течение 2 мес.
Всем крысам проведены хирургические манипуляции по предложенной авторам модели [9]. Для этого на правом бедре, в проекции тазобедренного сустава, выполнялся хирургический доступ длиной до 2 см с последующим наложением плотной лигатуры из рассасывающегося шовного материала викрил вокруг шейки бедренной кости, иссечением надкостницы в проксимальном отделе и введением в полость сустава 1.5 мл 2%-ного раствора реополиглюкина. После выведения животных из эксперимента выполнялась экстирпация бедренных костей со стороны индукции асептического некроза и с условно-здоровой в качестве сравнения. Для подтверждения факта развития асептического некроза и степени остеодеструктивных изменений выполнены исследования макропрепарата, а также гистологическое исследование с использованием электронной микроскопии.
Тотальную РНК выделяли из шейки бедренной кости, пораженной асептическим некрозом, а также здоровой кости, с использованием набора RNeasyMicroKit (QIAGEN, Германия) согласно протоколу производителя. Качество и количество выделенной РНК определяли на спектофотометре Qubit 4 (Invitrogen, США) путем оценки индекса RIQ (RNA Integrity and Quality) с использованием набора реагентов Qubit RNA IQ Assay Kit (Invitrogen, США).
Уровень экспрессии генов определяли методом кПЦР с обратной транскрипцией с использованием набора High-Capacity cDNA Reverse Transcription Kit (4368814, Thermo Fisher Scientific, Waltham, MA, США). Праймеры были синтезированы на приборе ABI 3900 high-throughput DNA synthesiser (Thermo Fisher Scientific, Waltham, MA, США) компанией Евроген (Москва, Россия). Результаты кПЦР нормировали с помощью трех референсных генов actb, tbp, b2m (табл. 1) в соответствии с имеющимися рекомендациями. Экспрессию изучаемых генов рассчитывали по методу 2–ΔΔСt и выражали в виде кратного изменения относительно контрольных образцов. Скорректированные значения были представлены в виде тепловой карты (светло-зеленый, серый и сиреневый цвета отражали кратность изменения ≤0.50, 0.51–1.99 и ≥2.00 соответственно).
Таблица 1.
Характеристика праймеров, использованных в эксперименте
| Ген | Последовательность/Референсный номер | Белок |
|---|---|---|
| Il4 | Forward:5'-TGTACCGGGAACGGTATCCA-3' Reverse:5'- GTTGCCGTAAGGACGTCTGG-3' |
Интерлейкин-4 |
| Il6 | Forward:5'-AGCCCACCAGGAACGAAAGTC-3' Reverse: 5'-AGGGAAGGCAGTGGCTGTCA-3' |
Интерлейкин-6 |
| Il1B | Forward:5'-CCTCGTGCTGTCTGACCCAT-3' Reverse: 5'-GGTGGGTGTGCCGTCTTTCA-3' |
Интерлейкин-1b |
| Tnfa | Forward: 5'-AGAGCCCCCAATCTGTGTCC-3' Reverse: 5'-CCGCAATCCAGGCCACTACT-3' |
Фактор некроза опухоли |
| Tgfb | Forward: 5'-ACTCCCGTGGCTTCTAGTGC-3' Reverse: 5'-GGGACTGGCGAGCCTTAGTT-3' |
Трансформирующий ростовой фактор, бета-1 |
| Sp7 | Forward:5'-ACCCGAAGCGACCACTTGAG-3' Reverse:5'-GCTTCTTCTTCCCCGACGCT-3' |
Sp7 транскрипционный фактор (остерикс) |
| Runx2 | Forward: 5'-GCTTCATTCGCCTCACAAACA-3' Reverse: 5'-TGGTCTCGGTGGCTGGTAGT-3' |
Субъединица альфа-1 ядра-связывающего фактора |
| Opn/spp1 | Forward: 5'-AAGCCAGCCAAGGACCAACTA-3' Reverse:5'-GCTTCTGAGATGGGTCAGGCT-3' |
Остеопонтин |
| Bmp2 | Forward: 5'-ACCCGCTGTCTTCTAGTGTTGC-3' Reverse:5'- AGCAGCCTCAACTCAAACTCG-3' |
Костный морфогенетический белок 2 |
| Bglap | Forward:5'-GTCCAAGCAGGAGGGCAGTAA-3' Reverse:5'-GCTCACACACCTCCCTGTGA-3' |
Остеокальцин |
| Rankl | Forward:5'-TGGAAGGTTCGTGGCTCGAT-3' Reverse:5'-ATGGGAACCCGATGGGATGT-3' |
Лиганд рецептора активатора ядерного фактора kappa-B |
| Alpl | Forward:5'-TGCCTACTTGTGTGGCGTGA-3' Reverse:5'-ATGGACGTGACCTCGTTCCC-3' |
Тканеспецифичная щелочная фосфотаза |
| Hif1a | Forward:5'-AACAAAACACGCAGCGAAGC-3' Reverse:5'-GCACCAAGCACGTCATAGGC-3' |
Гипоксией индуцированный фактор 1 |
| b2m | Forward:5'-GGTGACCGTGATCTTTCTGGTG-3' Reverse: 5'-TGAGGAAGTTGGGCTTCCCATT-3' | Микроглобулин бета-2 |
| actb | Forward:5'-ACAACCTTCTTGCAGCTCCTC-3' Reverse: 5'-CCATACCCACCATCACACCCT-3' |
Актин |
| tbp | Forward:5'-TGCCAAGTGTGAGCCTCTCC -3' Reverse: 5'-TGGGTTATCGCACGCACCAT-3' |
TATA-связывающий белок |
Для выполнения сканирующей электронной микроскопии эксплантированные образцы головок бедренных костей фиксировали в формалине в течение 24 ч, затем постфиксировали 1%-ным тетраоксидом осмия в 0.1 M фосфатном буфере и окрашивали 2%-ным раствором тетраоксида осмия в бидистиллированной воде в течение 48 ч. Далее образцы обезвоживали в серии спиртов возрастающей концентрации, окрашивали 2%-ным уранилацетатом (Electron Microscopy Sciences, США) в 95%-ном этаноле, обезвоживали 99.7%-ным изопропанолом (BioVitrum, Россия) в течение 5 ч и ацетоном (Реахим, Россия) в течение 1 ч, пропитывали смесью ацетона с эпоксидной смолой Epon (Electron Microscopy Sciences, США) в соотношении 1 : 1 (6 ч), после чего переносили в свежую порцию эпоксидной смолы (на 24 ч) и далее проводили ее полимеризацию в емкостях FixiForm (Electron Microscopy Sciences, США) при 60°С. После этого образцы в эпоксидных блоках подвергали шлифовке и полировке на установке TegraPol-11 (Struers, США). Контрастирование цитратом свинца проводили по Рейнольдсу в течение 7 мин путем нанесения раствора на поверхность шлифованного образца с последующей его отмывкой бидистиллированной водой. Далее проводили напыление на полированную поверхность эпоксидных блоков углерода (толщина покрытия 10–15 нм) с помощью вакуумного напылительного поста (EM ACE200, Leica). Визуализацию структуры образцов при помощи сканирующей электронной микроскопии в обратно-рассеянных электронах проводили на электронном микроскопе Hitachi-S-3400N (Hitachi, Япония) в режиме BSECOMP при ускоряющем напряжении 15 кВ. Морфометрический анализ гистологических препаратов выполнен с использованием сетки Автандилова.
Статистическую обработку полученных результатов проводили в пакетах программ Statistica for WINDOWS фирмы StatSoftInc (США), версия 10.0 по правилам вариационной статистики. Нормальность распределения выборок оценивали с помощью W-теста Шапиро–Уилка. Проверка на нормальность распределения показала, что данные в исследовании имеют нормальное распределение, поэтому в дальнейшем расчеты производились методами параметрической статистики. Номинальные данные описывались с указанием абсолютных значений, процентных долей (%). Количественные данные представляли в виде средней и стандартной ошибки (М ± m). Сравнение значений уровней метрических показателей в несвязанных выборках проводили с помощью критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
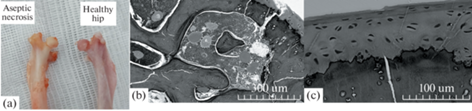
Макропрепарат со стороны асептического некроза через 2 нед. после начала эксперимента характеризовался склерозированием головки бедренной кости без снижения высоты эпифиза в 100% случаев. Электронная микроскопия отобразила сохранение архитектоники костных трабекул без изменений их объема. Однако количество активных остеобластов было несколько снижено по сравнению с контралатеральной условно-здоровой конечностью. Также отмечалось снижение толщины гиалинового хряща, тем не менее, количество хондроцитов не изменялось (рис. 1).
Рис. 1.
(a) – Макропрепарат. (b) – Электронная микроскопия со стороны асептического некроза, увеличение ×150 – сохранение объема костных трабекул. (c) – Электронная микроскопия со стороны асептического некроза, увеличение ×500 – ядра хондроцитов упорядочены.
Локальное снижение обогащения кислородом костной ткани приводит к усилению экспрессии гена гипоксией индуцированного фактора 1 (hif1a) через 2 нед. после индукции аваскулярного некроза. Изменение экспрессии гена hif1a является наиболее выраженным по отношению к другим исследуемым регуляторам метаболических путей в первые 2 нед. исследования. Известно, что hif1a участвует в регуляции транскрипции генов ангиогенеза, клеточного апоптоза, пролиферации, остеогенеза и др. [10]. Так, усиленная транскрипция гена hif1a может рассматриваться как пусковой фактор в изменении профиля мРНК и приводить к нарушению функционирования сигнальных путей, регулирующих костный гомеостаз.
Полуколичественная оценка уровней экспрессии генов представлена в табл. 2. Как видно из таблицы, наряду с увеличением экспрессии hif1a в первые 2 нед. индукции асептического некроза наблюдалась картина снижения активности остеогенной дифференцировки. Ингибированию остеобластогенеза могло способствовать снижение экспрессии одного из ключевых генов, регулирующего клеточный цикл дифференцировки и активации остеобластов транскрипционного фактора – runx2. Кроме того, наблюдалось угнетение транскрипции гена остеопонтина (spp1), кодирующего одноименный белок – одного из основных компонентов внеклеточного костного матрикса.
Таблица 2.
Изменение экспрессии генов через 2 нед. с момента индукции асептического некроза
| Ген | Контроль (M ± m) | Некроз (M ± m) |
|---|---|---|
| bmp2 | 19.3 ± 3.3 | 3.9 ± 0.4* |
| alpl | 11.5 ± 1.5 | 8.5 ± 1.7 |
| hif1a | 0.1 ± 0.001 | 1.7 ± 0.2* |
| rankl | 5.8 ± 1.2 | 3.7 ± 0.7 |
| runx2 | 13.9 ± 3.1 | 6.9 ± 1.4 |
| sp7 | 17.5 ± 3.2 | 13.6 ± 2.1 |
| bglap | 1.8 ± 0.1 | 3.1 ± 0.7 |
| spp1 | 7.4 ± 1.1 | 3.1 ± 1.2 |
| tgfb | 20.1 ± 4.8 | 8.3 ± 1.4* |
| il1b | 0.7 ± 0.029 | 0.8 ± 0.042 |
| tnfa | 6.8 ± 1.8 | 8.8 ± 2.043 |
| il6 | 11.5 ± 2.3 | 7.4 ± 1.2 |
Следует отметить снижение экспрессии трансформирующего фактора роста (tgfb), кодирующего белок, связанный с ангиогенезом и остеогенезом. Наряду с этим не наблюдалось значимых изменений экспрессии генов провоспалительных цитокинов (il1b, tnfa, il6), а экспрессия гена лиганда рецептора активатора ядерного фактора kappa-B (rankl), как одного из основных компонентов сигнального пути остеокластогенеза, напротив, была снижена (табл. 2).
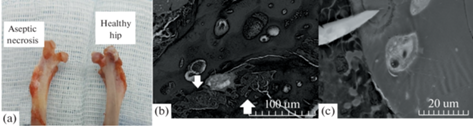
Через 1 мес. после хирургической индукции асептического некроза макропрепарат головки бедренной кости имел признаки склерозирования, высота эпифиза снижена. Гистологическое исследование отобразило истончение костных трабекул, увеличение количества активных остеокластов. Расположение хондроцитов гиалинового хряща беспорядочное. Кроме того, обнаруживались дистрофические изменения в зоне роста (рис. 2).
Рис. 2.
(a) – Макропрепарат. (b) – Электронная микроскопия со стороны асептического некроза, увеличение ×500 – истончение, деформация костных трабекул, дистрофические изменения зоны роста (указаны стрелочкой). (c) – Электронная микроскопия со стороны асептического некроза, увеличение ×2000 – единичный активный остеокласт в зоне костной резорбции.
Через 4 нед. после хирургического вмешательства отмечается резкое угнетение экспрессии гена hif1a со стороны некроза, ее уровень был додиагностический. Также была снижена экспрессия гена тканеспецифической щелочной фосфатазы (alpl), который регулирует минеральную плотность кости.
В динамике отмечены изменения в регулировке остеобластогенеза. Так, экспрессия гена runx2 в динамике нормализовалась и не имела отличий от здоровой конечности, в то время как экспрессия гена остеокальцина (bglap), основного неколлагенового протеина кости, напротив, снизилась. Кроме того, отмечается увеличение экспрессия гена остеопонтина (spp1).
Экспрессия генов провоспалительных цитокинов в головке бедренной кости, подверженной ишемическому стрессу (tnfa, il1b, il6), не отличалась от контралатеральной конечности. Экспрессия гена rankl в динамике имела тенденцию к росту со стороны хирургической индукции аваскулярного некроза, однако через 4 нед. после начала эксперимента не имела значимых отличий от условно-здоровой стороны (табл. 3).
Таблица 3.
Изменение экспрессии генов через 4 нед. с момента индукции асептического некроза
| Ген | Контроль (M ± m) | Некроз (M ± m) |
|---|---|---|
| bmp2 | 199.3 ± 59.1 | 218.7 ± 64.3 |
| alpl | 189.02 ± 48.3 | 91.6 ± 29.7* |
| hif1a | 0.015 ± 0.001 | 0.001 ± 0.0001* |
| rankl | 49.1 ± 10.7 | 59.8 ± 11.3 |
| runx2 | 105.1 ± 30.5 | 97.8 ± 17.2 |
| sp7 | 258.7 ± 69.1 | 272.1 ± 71.4 |
| bglap | 33.031 ± 8.1 | 22.6 ± 6.2 |
| spp1 | 2.9 ± 0.8 | 22.8 ± 5.9 |
| tgfb | 224.9 ± 61.5 | 217.1 ± 53.7 |
| il1b | 1.6 ± 0.1 | 0.6 ± 0.1 |
| tnfa | 216.6 ± 61.2 | 247.8 ± 66.2 |
| il6 | 52.5 ± 4.2 | 59.1 ± 14.3 |
Оценка асептического некроза в 6 нед. показала, что отмечается прогрессирующее снижение высоты эпифиза головки бедренной кости. При гистологическом исследовании обнаруживались ярко выраженные деструктивные изменения зоны роста, разрастание плотной соединительной ткани среди костных трабекул. Ядра хондроцитов с признаками деструктивных изменений расположены хаотично, при этом толщина гиалинового хряща прогрессивно снижалась. Определялось большое количество активных остеокластов в зонах костной резорбции (рис. 3).
Рис. 3.
(a) – Макропрепарат. (b) – Электронная микроскопия со стороны асептического некроза, увеличение ×150 –разрастание соединительной ткани среди костных трабекул (указано стрелочками). (c) – Электронная микроскопия со стороны асептического некроза, увеличение ×1000 – многочисленные активные остеокласты в зоне костной резорбции (указаны стрелочкой).

Через 6 нед. после хирургической индукции асептического некроза становится наиболее очевидная роль провоспалительных цитокинов в индукции остеокластогенеза. Так, исследование отобразило усиление экспрессии генов провоспалительных цитокинов tnfa и il6 в головке бедренной кости после хирургического вмешательства. Синергично с ростом экспрессии провоспалительных цитокинов увеличилась экспрессия гена rankl, кодирующего ключевой мембранный белок, участвующий в работе сигнального пути RANK-RANKL-OPG, направленного на дифференцировку и активацию остеокластов (табл. 4).
Таблица 4.
Изменение экспрессии генов через 6 нед. с момента индукции асептического некроза
| Ген | Контроль (M ± m) | Некроз (M ± m) |
|---|---|---|
| bmp2 | 0.5 ± 0.1 | 0.7 ± 0.1 |
| alpl | 0.2 ± 0.1 | 0.5 ± 0.1 |
| hif1a | 0.1 ± 0.05 | 0.1± 0.008 |
| rankl | 0.1 ± 0.004 | 1.1 ± 0.1* |
| runx2 | 0.2 ± 0.1 | 0.9 ± 0.1 |
| sp7 | 0.6 ± 0.1 | 1.2 ± 0.2 |
| bglap | 3.2 ± 0.7 | 2.3 ± 0.3 |
| spp1 | 5.3 ± 0.9 | 2.4 ± 0.3 |
| tgfb | 0.6 ± 0.1 | 0.6 ± 0.1 |
| il1b | 0.1 ± 0.009 | 0.1 ± 0.008 |
| tnfa | 0.032 ± 0.002 | 0.5 ± 0.015* |
| il6 | 0.2 ± 0.027 | 0.6 ± 0.027* |
Наряду с процессами остеокластогенеза в профиле мРНК появляются признаки индукции остеогенеза. Так, усиливается экспрессия генов остеобластной дифференцировки runx2 и sp7. Кроме того, в динамике угнетение экспрессии гена alpl через 6 нед. течения асептического некроза меняется на ее значимый рост.
Макропрепарат через 8 нед. характеризовался выраженными дистрофическими изменениями со стороны суставного хряща. Головка бедренной кости приобретала эллипсоидную форму, со сниженной высотой эпифиза, укорочением шейки бедренной кости, высоким стоянием большого вертела. Гистологическая картина характеризовалась грубыми нарушениями архитектоники костных трабекул, замещения большого объема кости соединительной тканью. Поверх гиалинового хряща разрасталась соединительная ткань. Однако вместе со столь яркими дегенеративно-дистрофическими изменениями прослеживались признаки остеорепарации в виде определения активных остеобластов (рис. 4).
Рис. 4.
(a) – Макропрепарат. (b) – Электронная микроскопия со стороны асептического некроза, увеличение ×500 – разрастание фиброзной ткани поверх гиалинового хряща (указано стрелочками). (c) – Электронная микроскопия со стороны асептического некроза, увеличение ×1500 – многочисленные активные остеобласты (указаны стрелочкой).

Через 2 мес. в ходе экспериментальной работы отображаются признаки развития процессов образования костной ткани. Со стороны индукции аваскулярного некроза увеличивалась экспрессия генов белков костного матрикса (bmp2), минеральной плотности костной ткани (alpl), внеклеточного костного матрикса (spp1).
Однако наиболее ярко выраженные изменения оставались в системе цитокинов с усиленной экспрессией генов провоспалительных медиаторов, таких как il1b, il6. Тем не менее, активность rankl в динамике снизилась и не имела значимых отличий от условно-здоровой конечности (табл. 5).
Таблица 5.
Изменение экспрессии генов через 8 нед. с момента индукции асептического некроза
| Ген | Контроль (M ± m) | Некроз (M ± m) |
|---|---|---|
| bmp2 | 0.018 ± 0.001 | 0.047 ± 0.002 |
| alpl | 0.1 ± 0.009 | 0.2 ± 0.021 |
| hif1a | 0.1 ± 0,002 | 0.1 ± 0.004 |
| rankl | 0.02 ± 0.001 | 0.04 ± 0.002 |
| runx2 | 0.1 ± 0.001 | 0.1 ± 0.003 |
| sp7 | 0.1 ± 0.003 | 0.2 ± 0.04 |
| bglap | 0.8 ± 0.02 | 1.4 ± 0.1 |
| spp1 | 1.2 ± 0.1 | 3.8 ± 0.2* |
| tgfb | 0.5 ± 0.007 | 0.001 ± 0.0001* |
| il1b | 0.1 ± 0.002 | 0.3 ± 0.03* |
| tnfa | 0.001 ± 0.0001 | 0.001 ± 0.0001 |
| il6 | 0.1 ± 0.003 | 1.8 ± 0.1* |
В целом, исследование динамики изменения экспрессии генов, участвующих в регуляции костного гомеостаза, отобразило гетерогенность развития остеодеструкции на фоне хирургически созданного очага гипоперфузии головки бедренной кости и увеличения внутрисуставного давления в тазобедренном суставе. Так, в первые 2 нед. наиболее активная экспрессия зафиксирована для гена hif1a, на фоне снижения экспрессии tgfb. Кроме того, отмечалось угнетение всех генов костного метаболизма, как остеогенной, так и остеорезорбтивной направленности. Однако экспрессия генов, кодирующих белки сигнальных путей остеобластогенеза, костного матрикса, внеклеточного костного матрикса, снижалась более активно, чем генов остеорезорбции. Через 1 мес. после начала эксперимента профиль мРНК генов костного метаболизма имел тенденцию к нормализации, с последующим усилением экспрессии генов остеокластогенеза, которая достигала наибольшей активности к 6-й неделе эксперимента. Экспрессия генов остеобластной дифференцировки, формирования костной ткани прогрессирующе возрастала в течение 2 мес. эксперимента (рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В разработке новых алгоритмов лечения нозологических форм, сопровождающихся нарушениями регуляции костного гомеостаза, с целью таргетного воздействия на определенное звено патогенеза, важное значение имеет понимание принципов развития и стадийности патологических процессов течения остеодеструкции. Так, выполняются научно-исследовательские работы, посвященные поиску молекулярно-клеточных паттернов, определяющих особенности нарушений функционирования сигнальных путей, регулирующих костный гоместаз при асептическом некрозе головки бедренной кости [11, 12]. Однако в большинстве работ рассматриваются определенные стадии патологии без оценки динамики изменений маркеров костного гомеостаза по мере развития заболевания. Представленная работа посвящена анализу динамики изменения профиля мРНК, гистологической картины развития аваскулярного некроза, поиску закономерностей функционирования сигнальных путей, регулирующих остеокластогенез и остеобластогенез.
Ведущее значение, определяющее достоверность результатов исследования, принадлежит условиям проведения эксперимента, способу моделирования патологического состояния. При несоответствии методов и методик выполнения экспериментальной работы реальным знаниям об этиологии заболеваний, конечные выводы будут носить достаточно условный характер. Так, в проведенной работе хирургическая индукция аваскулярного некроза базируется на двух основных компонентах: создание очага гипоперфузии головки бедренной кости на фоне повышения внутрисуставного давления в полости тазобедренного сустава, так как эти два фактора рассматриваются большинством исследователей как пусковые в манифестации и прогрессировании остеодеструктивных процессов при асептическом некрозе, остеохондропатии тазобедренного сустава. Так, Kim используя МРТ с перфузией у больных с остеохондропатией тазобедренного сустава, подтверждает наличие очага дефицита накопления контрастного вещества в области головки бедренной кости, который определяет в дальнейшем зону костной резорбции [13].
Проведенные хирургические манипуляции у крыс создают условия для формирования локальной тканевой кислородной недостаточности области проксимальной трети бедра. Острое гипоксическое воздействие на клетки костной и хрящевой ткани запускают механизм адаптации в виде усиления продукции типовой регуляторной молекулы – фактора, индуцируемого гипоксией 1-альфа (hif1a). В выполненном исследование через 2 нед. после индукции асептического некроза наибольшие изменения по отношению к условно-здоровой конечности наблюдались в транскрипции гена hif1a, которая была значительно усилена со стороны развития остеодеструкции. При этом, учитывая значимость регуляторной функции hif1a, который принимает участие в ангиогенезе, хондрогенезе, остеогенезе, такие изменения можно рассматривать с позиции пускового фактора в дальнейшем нарушении костного метаболизма и прогрессирующего развития резорбции костной ткани.
Так, через 2 нед. в ходе выполнения экспериментальной работы наблюдается картина угнетения остеобластогенеза, о чем может свидетельствовать снижение экспрессии одного из ключевых генов, регулирующего клеточный цикл дифференцировки остеобластов – runx2. Наряду с этим, развитие остеодеструкции подтверждает ингибирование гена (bmp2) белка костного матрикса – костного морфогенетического белка, гена внеклеточного костного матрикса – остеопонтина (spp1).
Ген остеокальцина (bglap), напротив, продемонстрировал тенденцию к росту экспрессии через 2 нед. после индукции асептического некроза. Такие изменения, по-видимому, связаны с тем, что остеокальцин контролирует более поздние стадии остеогенеза, синтез основного неколлагенового протеина костной ткани, а также связывание кальция и гидроксиапатита во внеклеточном костном матриксе. При этом наиболее быстро на дифференцировку преостеобластов влияет изменение уровня экспрессии мРНК генов runx2 и bmp2 и лишь затем bglap [14].
Угнетение экспрессии гена трансформирующего фактора роста (tgfb), влияющего на ангиогенез, остеокластогенез также может способствовать остеодеструктивным процессам. Снижение активности реваскуляризации зоны гипоперфузии создает предпосылки для дальнейшего прогрессирующего развития тканевой кислородной недостаточности, экспрессии hif1a.
Наряду с этим, в первые 2 нед. течения асептического некроза не отмечалось признаков усиления остеокластогенеза. Экспрессия мРНК таких провоспалительных цитокинов, как IL1b, TNFα и IL6, значимо не изменялась по сравнению с условно-здоровой конечностью. Усиление биологического действия представленных цитокинов способствует индукции остеокластогенеза посредствам сигнального пути RANK-RANKL-OPG. Однако через 2 нед. после хирургических манипуляций уровень мРНК rankl, кодирующего ключевой мембранный протеин, участвующий в дифференцировке и активации зрелых остеокластов, напротив, в проксимальном эпифизе бедренной кости стороны течения аваскулярного некроза был несколько снижен по сравнению с контралатеральной стороной.
Через 1 мес. после хирургической индукции асептического некроза прогениторные гены остеобластной направленности имели тенденцию к восстановлению темпов метаболизма. Уровень мРНК runx2, sp7 не отличался от условно-здоровой конечности. Отмечалось некоторое снижение bglap, что может свидетельствовать о нарушениях в более поздних стадиях дифференцировки остеобластов, снижения синтеза хрящевого матрикса, коллагена.
При этом ген остеопонтина характеризовался значимым усилением экспрессии, в то время как концентрация alpl снижалась. Роль остеопонтина в регулировании костного метаболизма до конца неизвестна, при этом экспрессия белка может проходить как на поверхности остеобластов, так и остеокластов. Существуют исследовательские работы, подтверждающие влияние резкого усиления экспрессии гена остеопонтина на индукцию пролиферации и дифференцировки остеокластов [15]. Наряду со снижением экспрессии гена alpl, такие изменения могут свидетельствовать о прогрессирующем снижении костной плотности на фоне постепенного усиления активности остеокластов и ингибировании основного фермента минерализации кости – тканеспецифической щелочной фосфатазы.
Также отмечалось избыточное угнетение экспрессии hif1a, что может оказывать отрицательное действие на процессы реваскуляризации зоны гипоперфузии, так как известна синергическая роль воздействия hif1a на фактор роста эндотелия сосудов. Таким образом, представленные изменения могут отрицательно влиять на усиление кровотока и оксигенации аваскулярной зоны головки бедренной кости.
Наиболее активная экспрессия генов, участвующих в индукции остеокластогенеза, наблюдалась с 6-й недели эксперимента. Так, рост уровня экспрессии мРНК провоспалительных цитокинов IL6, TNFα сопровождался сверхэкспрессией гена rankl. Известно, что концентрация RANKL напрямую коррелирует с усилением биологического действия провоспалительных цитокинов, при этом связывание RANK с RANKL приводит к активации ядерного транскрипционного фактора с последующей дифференцировкой зрелых остеокластов из преостеоклатных клеток. Такие изменения профиля мРНК способствуют увеличению остеолитической активности, смещению баланса костного гомеостаза за счет индукции остеокластогенеза.
На фоне активации остеорезорбции появляются признаки усиления остеогенеза в виде увеличения экспрессии мРНК тканеспецифической щелочной фосфатазы (alpl), протеинов костного матрикса (bmp2), белков остеобластогенеза (runx2, sp7). Однако изменения в системе остеокластогенеза носят более выраженный характер.
Через 2 мес. проведения экспериментальной работы усилилась активность ремоделирования костной ткани, что отображено в увеличение экспрессии генов bmp2, spp1, alpl. Уровень гена rankl имел тенденцию к снижению. Однако о сохраняющемся преобладании остеорезорбтивных процессов может свидетельствовать значительно превышающая изменения в остальных генах костного метаболизма оверэкспрессия провоспалительных цитокинов.
Таким образом, манифестация хирургически индуцированного асептического некроза головки бедренной кости путем создания зоны гипоперфузии и увеличения внутрисуставного давления связана со значительным усилением экспрессии гена hif1a на фоне пониженной экспрессии tgfb. Концентрация генов остеогенной и остеорезорбтивной направленности снижались неравномерно с преобладанием угнетения остеобластогенеза, генов костного матрикса. Такие паттерны изменения профиля мРНК могут свидетельствовать о первостепенной значимости на ранних стадиях развития асептического некроза hif1a как триггерного фактора развития последующих нарушений костного метаболизма, при этом равновесие в процессах ремоделирования костной ткани смещалось в первые 2 нед. за счет наиболее выраженного подавления остеогенеза.
Индукция остеорезорбции в виде активации большого количества остеокластов, замещения костных трабекул соединительной тканью, разрушения хондроцитов по данным гистологического исследования и оверэкспрессией генов провоспалительных цитокинов сигнального пути остеокластогенеза была наиболее значимой на 6-й неделе эксперимента. Параллельно с процессами, обуславливающими деструкцию кости, прогрессивно усиливалась активность остеорепарации, достигая максимума на 2-м месяце эксперимента. Так, через 8 нед. проведения исследования, по данным гистологического исследования на фоне грубых дегенеративно-дистрофических изменений костной, хрящевой ткани, определяются активные остеобласты, что свидетельствует о постепенной оссификации зон разряжения костной плотности. Профиль мРНК также характеризуется усилением экспрессии генов остеобластогенеза, костного матрикса. Таким образом, полученные данные указывают на гетерогенность развития остеодеструктивных процессов при асептическом некрозе головки бедренной кости, при которых ингибирование остеогенных процессов на ранних стадиях сменяется индукцией остеорезорбции к 6-й неделе и постепенной активацией остеорепарации, начиная со 2-го месяца. Тем не менее, следует отметить, что синтез многих сигнальных белков, в том числе HIF1a, регулируется на посттрансляционном уровне, и уровень экспрессии мРНК не всегда однозначно отображает протекающие биологические процессы. Таким образом, для более детального понимания патогенеза развития асептического некроза, требуется проведение дальнейших исследований по изучению концентрации регуляторных протеинов и их динамического изменения по мере течения остеодеструкции.
Выводы: выполненная работа отображает гетерогенность развития остеодеструкции на фоне создания очага гипоперфузии головки бедренной кости и увеличения внутрисуставного давления в тазобедренном суставе. При этом ведущее значение в патогенезе индукции асептического некроза может принадлежать повышенной экспрессии hif1a с дальнейшим развитием изменений в цитокиновом статусе. Увеличение концентрации гена hif1a на ранних стадиях аваскулярного некроза ведет к нарушению процессов метаболизма костной ткани, ингибированию остеобластогенеза с последующей активацией сигнальных путей остеокластогенеза на более поздних стадиях за счет усиления экспрессии генов провоспалительных цитокинов il1b, tnfa и il6.
Список литературы
Коршунова ЕЮ, Белохвостикова ТС, Дмитриева ЛА (2011) Иммунологический контроль гомеостаза костной ткани. Политравма 1: 82–85. [Korshunova IM, Belokhvostikova TS, Dmitrieva LA (2011) Immunological control of bone tissue homeostasis. Polytrauma 1: 82–85. (In Russ)].
Carrillo-López N, Martínez-Arias L, Fernández-Villabrille S, Dusso A, Cannata-Andía JB, Naves-Díaz M, Panizo S (2021) Role of the RANK/RANKL/OPG and Wnt/β-Catenin Systems in CKD Bone and Cardiovascular Disorders. Calcif Tissue Int 108: 439–451. https://doi.org/10.1007/s00223-020-00803-2
Castro LF, Burke AB, Wang HD, Tsai J, Florenzano P, Pan KS, Bhattacharyya N, Boyce AM, Gafni RI, Molinolo AA, Robey PG, Collins MT (2019) Activation of RANK/RANKL/OPG pathway is involved in the pathophysiology of fibrous dysplasia and associated with disease burden. J Bone and Mineral Res 34(2): 290–294. https://doi.org/10.1002/jbmr.3602
Chen XJ, Shen YS, He MC, Yang F, Yang P, Pang FX, He W, Cao Y, Wei QS (2019) Polydatin promotes the osteogenic differentiation of human bone mesenchymal stem cells by activating the BMP2-Wnt/β-catenin signaling pathway. Biomed & Pharmacother 112. https://doi.org/10.1016/j.biopha.2019.108746
Chong DY, Schrader T, Laine JC, Yang S, Gilbert SR, Kim HKW (2021) Reliability and Validity of Visual Estimation of Femoral Head Hypoperfusion on Perfusion MRI in Legg-Calve-Perthes Disease. J Pediatr Orthopaed 41(9): 780–786. https://doi.org/10.1097/BPO.0000000000001945
Чумакова СП, Уразова ОИ, Винс МВ, Шипулин ВМ, Пряхин АС, Букреева ЕБ, Буланова АА, Кошель АП, Новицкий ВВ (2020) Содержание гипоксия-индуцируемых факторов и медиаторов иммуносупрессии в крови при заболеваниях, ассоциированных с гипоксией. Бюл сибирск мед 19(3): 105–112. [Chumakova SP, Urazova OI, Vince MV, Shipulin VM, Pryakhin AS, Bukreeva EB, Bulanova AA, Purse AP, Novitsky BB (2020) The content of hypoxia-induced factors and mediators of immunosuppression in the blood in diseases associated with hypoxia. Bull Siber Med 19(3): 105–112. (In Russ)].https://doi.org/10.20538/1682-0363-2020-3-105-112
Nikolic N, Jakovljevic A, Carkic J, Beljic-Ivanovic K, Miletic M, Soldatovic I, Andric M, Ivanovic V, Milasin J (2019) Notch Signaling Pathway in Apical Periodontitis: Correlation with Bone Resorption Regulators and Proinflammatory Cytokines. J Endodont 45(2): 123–128. https://doi.org/10.1016/j.joen.2018.10.015
Udagawa N, Koide M, Nakamura M, Nakamichi Y, Yamashita T, Uehara S, Kobayashi Y, Furuya Y, Yasuda H, Fukuda C, Tsuda E (2021) Osteoclast differentiation by RANKL and OPG signaling pathways. J Bone and Mineral Metabol 39: 19–26. https://doi.org/10.1007/s00774-020-01162-6
Шабалдин НА, Шабалдин АВ, Попова НЕ, Постникова АВ, Богданов ЛА, Богданов АВ (2022) Экспериментальная модель асептического некроза головки бедренной кости при изучении болезни Легга–Кальве–Пертеса. Фундамент и клин мед 7(3): 23–30. [Shabaldin NA, Shabaldin AV, Popova NE, Postnikova AV, Bogdanov LA, Bogdanov AV (2022) Experimental model of aseptic necrosis of the femoral head in the study of Legg-Calve-Perthes disease. Fundament and Clin Med 7(3): 23–30. (In Russ)]. https://doi.org/10.23946/2500-0764-2022-7-3-23-30
Yellowley CE, Genetos DC (2019) Hypoxia Signaling in the Skeleton: Implications for Bone Health. Current Osteopor Rep 17: 26–35. https://doi.org/10.1007/s11914-019-00500-6
Kuroyanagia G, Adapala NS, Yamaguchi R, Kamiya N, Deng Z, Aruwajoye O, Kutschke M, Chen E, Jo C, Ren Y, Kim HKW (2018) Interleukin-6 deletion stimulates revascularization and new bone formation following ischemic osteonecrosis in a murine model. Bone 116: 221–231. https://doi.org/10.1016/j.bone.2018.08.011
Adapala NS, Kim HKW (2016) Comprehensive Genome-Wide Transcriptomic Analysis of Immature Articular Cartilage following Ischemic Osteonecrosis of the Femoral Head in Piglets. PLoS One 11(4): e0153174. https://doi.org/10.1371/journal.pone.0153174
Johnson CP, Wang L, Tóth F, Aruwajoye O, Carlson CS, Kim HKW, Ellermann JM (2018) Quantitative MRI Helps to Detect Hip Ischemia: Preclinical Model of Legg–Calvé–Perthes Disease. Radiology 289(2): 386–395. https://doi.org/10.1148/radiol.2018180497
Lee KS, Kim HJ, Li QL, Chi XZ, Ueta C, Komori T, Wozney JM, Kim EG, Choi JY, Ryoo HM, Bae SC (2000) Runx2 is a common target of transforming growth factor b1 and bone morphogenetic protein 2, and cooperation between runx2 and smad5 induces osteoblast-specific gene expression in the pluripotent mesenchymal precursor cell line C2C12. Mol Cell Biol 23(20): 8783–8792. https://doi.org/10.1128/MCB.20.23.8783-8792.2000
Dong M, Yu X, Chen W, Guo Z, Sui L, Xu Y, Shang Y, Niu W, Kong Y. (2018) Osteopontin Promotes Bone Destruction in Periapical Periodontitis by Activating the NF-κB Pathway. Cell Physiol Biochem 49(3): 884–898. https://doi.org/10.1159/000493219
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова



