Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 10, стр. 1430-1442
Влияние спонтанной нервно-мышечной активности на развитие атрофии камбаловидной мышцы в условиях функциональной разгрузки
К. В. Сергеева 1, *, К. А. Шарло 1, В. Е. Калашников 1, О. В. Туртикова 1, С. А. Тыганов 1, Б. С. Шенкман 1
1 Институт Медико-биологических проблем Российской академии наук
Москва, Россия
* E-mail: Sergeeva_xenia@mail.ru
Поступила в редакцию 27.07.2023
После доработки 04.09.2023
Принята к публикации 04.09.2023
- EDN: XRLLUW
- DOI: 10.31857/S0869813923100102
Аннотация
Хорошо известно, что бездействие скелетных мышц млекопитающих приводит к прекращению их электрической активности и сопровождается атрофическими изменениями мышечных волокон. Однако неоднократно отмечалось, что начиная с 3-х суток функциональной разгрузки появляется спонтанная ритмическая нервно-мышечная активность, являющаяся результатом снижения экспрессии калий-хлоридного котранспортера KCC-2 в нейронах поясничного отдела спинного мозга. Снижение экспрессии KCC-2 и возникновение автономной электрической активности мышцы в условиях разгрузки может быть предотвращено введением нейролептика прохлорперазина. Таким образом, целью настоящего исследования было оценить структурные и сигнальные эффекты снижения спонтанной активности разгруженной камбаловидной мышцы крыс. Обнаружено, что ежедневное введение крысам прохлорперазина на фоне 7-суточного антиортостатического вывешивания предотвратило снижение содержания основных маркеров биогенеза рибосом (c-Myc, 18S рРНК и 28S рРНК), а также частично предотвратило уменьшение площади поперечного сечения быстрых и медленных мышечных волокон в камбаловидной мышце. Морфофункциональные изменения, вызванные снижением спонтанной активности разгруженной мышцы, сопровождались полным или частичным предотвращением активации экспрессии ключевых маркеров протеолитических систем (MuRF-1, MAFbx/atrogin-1, убиквитин). Таким образом, мы предполагаем, что именно спонтанная нервно-мышечная активность может являться фактором, углубляющим атрофические процессы в течение первой недели функциональной разгрузки.
ВВЕДЕНИЕ
Камбаловидная мышца (m. soleus) млекопитающих демонстрирует электрическую активность (ЭМГ) в течение 11–16 ч в сутки [1]. Однако если устраняется опора задних конечностей, то активность этой мышцы резко снижается или полностью прекращается [2, 3]. Этот эффект наблюдается при невесомости, создаваемой в ходе полета по параболе Кепплера, или при отрыве задних ног от субстрата в модели вывешивания задних конечностей [4]. При использовании этой модели электрическое и, очевидно, механическое “молчание” мышцы наблюдается в течение 2–3 сут [3]. Однако в дальнейшем применение в отношении камбаловидной мышцы термина “бездействие” (disuse) становится затруднительным. При регистрации ЭМГ начинают спонтанно появляться электрические сигналы, свидетельствующие о появлении и постепенном увеличении мышечной активности [2, 5, 6]. Эта электрическая активность, которую можно было бы назвать спонтанной нервно-мышечной активностью, непрерывно регистрируется и постепенно возрастает, достигая значений амплитуды, близких к контрольным к 14 суткам вывешивания. До сих пор остается неизвестным, какие изменения в процессе развития гипогравитационной атрофии, атонии и фенотипической трансформации, характерных для функциональной разгрузки, вносит спонтанная активность постуральной мышцы. В последнее время стало известно, что при гравитационной разгрузке, как и в экспериментальных моделях спинальной травмы, спонтанная активность является следствием снижения содержания калий-хлоридного котранспортера KCC2 в нейронах поясничного отдела спинного мозга, приводящего к повышенной возбудимости спинальных мотонейронов [7–9]. Оказалось, что применение нейролептика прохлорперазина (PCPZ) позволяет предотвратить снижение уровня KCC-2 и тем самым снизить спонтанную электрическую активность постуральной мышцы. Таким образом, при использовании фармакологической коррекции, снизив интенсивность спонтанной электрической активности мышцы, можно оценить молекулярные последствия этой активности.
Целью настоящего исследования было оценить развитие структурной атрофии и сигнальные эффекты при редукции спонтанной активности разгруженной камбаловидной мышцы крысы с тем, чтобы выявить сигнальные последствия такой активности, наблюдаемой в условиях моделируемой гравитационной разгрузки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Дизайн эксперимента. В экспериментах использовали самцов крыс Вистар в возрасте 1.5–2 мес. и массой тела 180–200 г. Температуру в помещении вивария поддерживали на уровне 24°С и влажности 50% при 12/12-часовом цикле свет/темнота. Все крысы имели доступ к стандартной диете и воде. Эвтаназия животных проводилась посредством внутрибрюшинного введения 10%-ного раствора авертина (10 мл/кг). Крысы были разделены на три группы по 8 животных в каждой: группа виварного контроля (С); группа, подвергнутая разгрузке задних конечностей на протяжении 7 дней (HS); группа разгрузки, совмещенная с введением прохлорперазина (HS + PCPZ). Дималеатную соль прохлорперазина (#P9178; Sigma-Aldrich, Сент-Луис, Миссури, США) вводили два раза в день (каждая инъекция содержала 5 мг/кг в физиологическом растворе + 0.1% ДМСО). Применяемая доза рассчитывалась, исходя из эквивалента человеческой терапевтической дозы (112 мг/кг) [10]. Крысы из группы HS получали эквивалентный объем физиологического раствора + 0.1% ДМСО без прохлорперазина.
Механическая разгрузка производилась с использованием стандартной модели вывешивания задних конечностей (HS, hindlimb suspension) [4]. Вкратце, полоска клейкой ленты была прикреплена к хвосту животного, которое вывешивалось, пропуская ленту через шарнирный механизм, прикрепленный к металлической планке наверху клетки. Это позволяло передним конечностям животных касаться пола решетки и перемещаться по клетке для свободного доступа к пище и воде. Высота подвешивания регулировалась таким образом, чтобы задние конечности не касались какой-либо опорной поверхности.
Анализ экспрессии генов. Для анализа экспрессии мРНК генов из мышечной ткани с помощью набора RNeasy micro kit (Qiagen, США) была выделена тотальная фракция РНК и использована в качестве матрицы для проведения обратной транскрипции с последующей ПЦР-реакцией. Для проведения обратной транскрипции были использованы компоненты фирмы “Синтол” (Россия): 30 мкМ случайных гексануклеотидов, 17.4 мкМ олиго-d(T)15, 1.3 мМ дНТФ, 0.02 ед./мкл ингибитора РНКазы, 6 ед./мкл M-MLV-ревертазы, 5×-буфер для M-MLV-ревертазы. Обратную транскрипцию проводили в амплификаторе (CFX96 Touch Real-Time PCR Detection System, “Bio-Rad Laboratories”, США). Для проведения ПЦР в реальном времени использовали полученную в результате обратной транскрипции кДНК, праймеры с концентрацией 10 мкМ мастер-микс (0.3 мМ дНТФ, 3 мМ MgCl2, 2.5 мкл 10-кратного ПЦР-буфера Б (pH 8.8), 0.06 ед./мкл Taq ДНК-полимеразы, “Синтол”). В качестве референсного гена с помощью базы EST Database был выбран ген rpl19. Все праймеры, использовавшиеся в эксперименте, представлены в табл. 1.
Таблица 1.
Список использованных в работе праймеров
| Ген | Белок | Последовательность праймеров |
|---|---|---|
| MYC | c-Myc | 5'-TTGATGGGGATGACCCTGAC-3' 5'-CTCGCCCAAATCCTGTACCT-3' |
| TRIM63 | MuRF-1 | 5'-GCCAATTTGGTGCTTTTGT-3' 5'-AAATTCAGTCCTCTCCCCGT-3' |
| FBXO32 | MAFbx | 5'-CTACGATGTTGCAGCCAAGA-3' 5'-GGCAGTCGAGAAGTCCAGTC-3' |
| UBB | Ubiqitin | 5′-CACCAAGAAGGTCAAACAGGA-3′ 5′-GCAAGAACTTTATTCAAAGTGCAA-3′ |
| RPL19 | 5'- GTACCCTTCCTCTTCCCTATGC-3' 5'- CAATGCCAACTCTCGTCAACAG-3' |
Анализ содержания белков в тотальной фракции камбаловидной мышцы. Для выделения тотальной белковой фракции был использован набор реагентов RIPA Lysis Buffer System (“Santa Cruz”, США). При этом дополнительно использовались ингибиторы протеаз Complete Protease Inhibitor Cocktail (“Santa Cruz”, США), 10 мкг/мл апротинина (“SIGMA”, США), 10 мкг/мл лейпептина (“SIGMA”, США), 10 мкг/мл пепстатина (“SIGMA”, США), “complete Mini Protease Inhibitor Cocktail” (Roche, Швейцария) 20 мкл, фосфоингибиторный коктейль (Santa Cruz, США) 40 мкл.
Для проведения электрофореза в полиакриламидном геле (ПААГ) образцы разводились в двукратном буфере для образцов (5.4 мМ Tris-HCl (pH 6.8), 4%-ный Ds-Na, 20%-ный глицерин, 10%-ный β-меркаптоэтанол, 0.02%-ный бромфеноловый синий). Электрофорез был проведен в 10%-ном разделяющем ПААГ. Образцы каждой группы загружались на один гель с контрольными образцами. Электрофорез проводили при силе тока 17 мА на гель в мини-системе (“Bio-Rad Laboratories”) при комнатной температуре. Электроперенос белков проводили на нитроцеллюлозную (НЦ) мембрану при 100 В и силе тока 150–250 мА при температуре 4°C в течение 120 мин в системе mini Trans-Blot (“Bio-Rad Laboratories”). После электропереноса НЦ-мембраны инкубировали в растворе 5%-ного сухого молока (“Bio-Rad Laboratories”) в TBST (TBS + 0.1% Tween 20) в течение 1 ч при комнатной температуре или блокирующем буфере EveryBlot. Для выявления белковых полос использовали первичные поликлональные антитела: фосфорилированной (Thr180/Tyr182) p38 (“GeneTex”, GTX59567, 1 : 500, США), тотальной p38 (“Cell signalling”, #9212, 1 : 500, США), фосфорилированной (Ser9) GSK3β (“Cell signalling”, #9323, 1 : 1000, США), тотальной GSK3β (“Cell signalling”, #9315, 1 : 1000, США), фосфорилированной (Ser641) GS (“Cell signalling”, #3891, 1 : 1000, США), тотальной GS (“Cell signalling”, #3893, 1 : 1000, США), фосфорилированной (Thr183/Tyr185) JNK1/2 (“Thermo Fisher Scientific”, 44-682G, 1 : 1000, США), тотальной JNK1/2 (“Sigma-Aldrich”, SAB4200176, 1 : 1000, США), фосфорилированной (Thr389) p70S6K (“Santa Cruz”, sc-11759, 1 : 2000, США), тотальной p70S6K (“Cell signaling”, #9202, 1 : 1000, США). В качестве вторичных антител использовали антитела goat anti-rabbit, конъюгированные с пероксидазой хрена (“Jakson Immuno Research”, Великлбритания) в разведении 1 : 25000. Инкубация блотов с первичными антителами проводилась в течение ночи при 4°С, со вторичными антителами 1 ч при комнатной температуре. Иммунореактивные полосы визуализировали с помощью усиленной хемилюминесценции с использованием C-DiGit Blot Scanner (LI-COR Biotechnology, США) и количественно оценивали с помощью программного обеспечения Image Studio C-DiGit.
Анализ содержания рибосомальной РНК. Образцы РНК разводили в 2× денатурирующем буфере loading dye (Thermo fisher, США), после чего наносили на 1.2%-ный агарозный гель с добавлением бромистого этидия. Объем нанесения рассчитывали исходя из объема мышечной ткани, из которой был выделен образец РНК. Электрофорез проводился при напряжении 5 В на см длины между электродами в буфере TBE. Содержание РНК оценивали с помощью оптической плотности полос на геле, проанализированных на сканере Gel Doc (Bio-Rad, США).
Анализ площади поперечного сечения волокон. C помощью микротома Leica CM1900 изготавливали поперечные срезы замороженной мышцы толщиной 9 мкм. Срезы высушивали на воздухе и хранили при –20°С. Перед окрашиванием срезы оттаивали и регидратировали при комнатной температуре в фосфатно-буферном растворе (PBS) в течение 20 мин, а затем инкубировали с антителами против тяжелых цепей миозина быстрого или медленного типов (MHCI и MHCII, Sigma, США) 1 : 400 в PBS во влажной камере при 37°C в течение часа (или при 4°С на ночь). Затем антитела отмывали в PBS 3 × 5 мин. Инкубацию со вторичными антителами, конъюгированными с AlexaFluor, 1 : 500 в PBS проводили в течение 40 мин при комнатной температуре. После отмывки вторичных антител срезы заключали в среду, стабилизирующую флуоресцентную метку. Срезы анализировали с использованием флуоресцентного микроскопа LeicaQ500MC с встроенной цифровой фотокамерой (TCM 300F, Leica, Германия), с увеличением ×200. Анализ изображений проводился с помощью программы ImageJ. Измеряли площадь поперечного сечения по крайней мере 100 волокон, подсчитывали число волокон медленного и быстрого типов и их количественное соотношение.
Статистическая обработка данных. Все значения представлены как средние ± σ для восьми животных. Для проверки различий между группами, учитывая небольшой размер выборки, был использован непараметрический критерий Краскела–Уоллиса с последующим post-hoc анализом Данна. Значение p менее 0.05 расценивали как статистически значимое.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
После 7 сут вывешивания мы не наблюдали значимой разницы в массе тела животных среди экспериментальных групп (табл. 2). Масса камбаловидной мышцы статистически значимо снижалась на 28 и 15% в группах HS и HS + PCPZ относительно группы контроля (табл. 2).
Таблица 2.
Масса тела животных и масса m. soleus
| С | HS | HS + PCPZ | |
|---|---|---|---|
| Масса тела крыс, г | 191.4 ± 2.4 | 198.5 ± 3.4 | 194.0 ± 6.6 |
| Масса m. soleus, мг | 92.9 ± 2.2 | 73.6 ± 1.7* | 85.4 ± 3.6* |
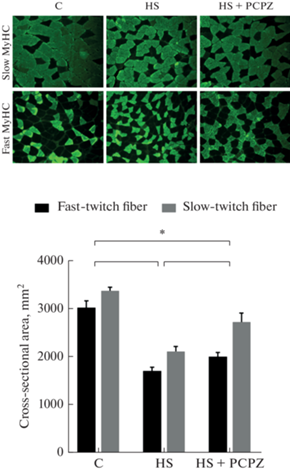
Площадь поперечного сечения (ППС) быстрых волокон снижалась в группах HS и HS + PCPZ на 44 и 34% соответственно. Схожим образом снижалась ППС медленных волокон на 38 и 20%. При этом мы наблюдали значимую разницу между двумя группами с вывешиванием задних конечностей (рис. 1).
Рис. 1.
Площадь поперечного сечения (cross-sectional area) быстрых (fast-twitch) и медленных (slow-twitch) волокон m. soleus. C – контроль; HS – вывешивание в течение 7 сут; HS + PCPZ – вывешивание в течение 7 сут с ежедневным введением прохлорперазина. * ‒ p < 0.05. MyHC (myosin heavy chain) – тяжелые цепи миозина.
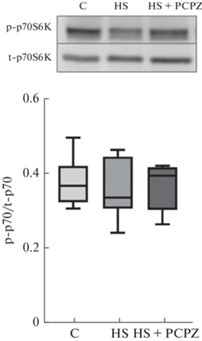
Статус фосфорилирования p70S6K ‒ ключевого субстрата протеинкиназы mTORс1 ‒ не имел различий между тремя исследуемыми группами (рис. 2).
Рис. 2.
Cодержание фосфорилированной (Thr389) формы p70S6K в m. soleus. C – контроль; HS – вывешивание в течение 7 сут; HS + PCPZ – вывешивание в течение 7 сут с ежедневным введением прохлорперазина. * ‒ p < 0.05.
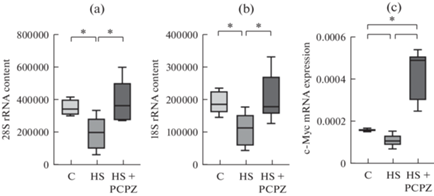
Функциональная разгрузка привела к снижению содержания ключевых рибосомальных РНК (18S и 28S рРНК) в m. soleus крысы в группе 7-суточного вывешивания по сравнению с контрольной группой (рис. 3a, b). Введение животным прохлорперазина предотвратило снижение 18S и 28S рРНК в m. soleus крысы (рис. 3a, b). Содержание мРНК транскрипционного фактора рибосомальных генов c-Myc демонстрировало сходную динамику: снижение в группе “чистого” вывешивания, но при этом существенный рост в группе вывешивания с препаратом (рис. 3с).
Рис. 3.
Содержание 28S рРНК (a), содержание 18S рРНК (b) и экспрессия мРНК c-Myc в m. soleus. C – контроль; HS – вывешивание в течение 7 сут; HS + PCPZ – вывешивание в течение 7 сут с ежедневным введением прохлорперазина. * ‒ p < 0.05.
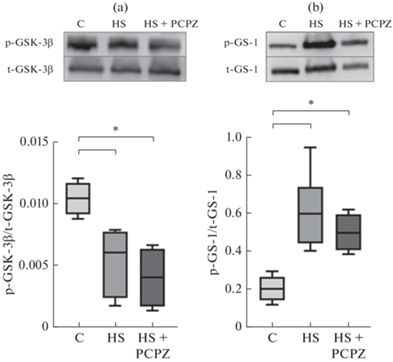
Ферментативная активность киназы гликогенсинтазы 3β (GSK-3β) в камбаловидной мышце крысы была значительно увеличена в обеих группах антиортостатического вывешивания, о чем свидетельствует снижение степени ее негативного фосфорилирования (рис. 4a). Активация GSK-3β также подтверждается значительным увеличением фосфорилирования ее ключевого субстрата – гликогенсинтазы-1 (GS-1) (рис. 4b).
Рис. 4.
Cодержание фосфорилированной (Ser9) формы GSK3β (a) и фосфорилированной (Ser641) формы GS-1 (b) в m. soleus. C – контроль; HS – вывешивание в течение 7 суток; HS + PCPZ – вывешивание в течение 7 суток с ежедневным введением прохлорперазина. * ‒ p < 0.05.
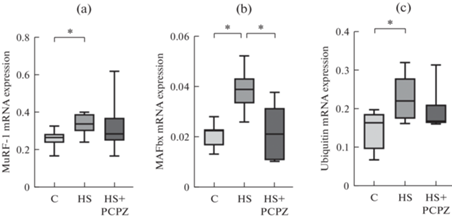
Содержание транскриптов убиквитинлигаз MuRF1, MAFbx и убиквитина было значительно повышено в группе с вывешиванием задних конечностей (рис. 5a–c). При этом введение прохлорперазина на фоне функциональной разгрузки позволило предотвратить увеличение экспрессии данных протеолитических маркеров (рис. 5a–c).
Рис. 5.
Экспрессия мРНК показателей протеолиза MuRF-1 (a), MAFbx (b) и убиквитина (c) в m. soleus. C – контроль; HS – вывешивание в течение 7 сут; HS + PCPZ – вывешивание в течение 7 сут с ежедневным введением прохлорперазина. * ‒ p < 0.05.
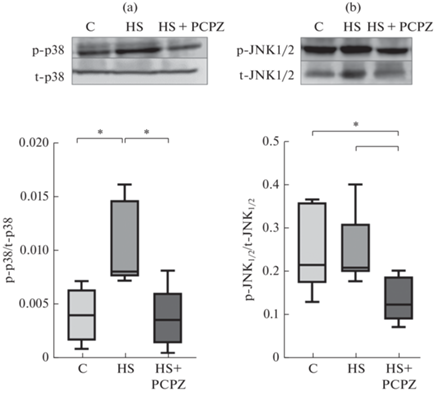
После 7 сут разгрузки наблюдалось значимое увеличение содержания фосфорилированной формы p38 на 160% в группе HS относительно контрольной группы. Введение прохлорперазина животным из группы HS + PCPZ предотвращало это увеличение (рис. 6a). Прохлорперазин также значимо снижал фосфорилирование JNK1/2 в группе вывешивания с препаратом (рис. 6b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
До сих пор никому не удавалось оценить физиологические, структурные, метаболические и сигнальные эффекты спонтанной нервно-мышечной активности на фоне опорной разгрузки постуральной мышцы, так как в арсенале исследователей не было инструментов, позволяющих устранить или существенно уменьшить эту активность. Однако, когда нам удалось связать такую активность на фоне опорной разгрузки со снижением белковой экспрессии калий-хлоридного котранспортера KCC-2 в нейронах поясничного отдела спинного мозга и с последующим значительным повышением возбудимости мотонейронов [9], появилась возможность существенно снизить спонтанную нервно-мышечную активность с помощью фармакологического воздействия, активирующего KCC-2. Такой эффект достигается при использовании нейролептика прохлорперазина или активатора KCC-2 животных CLP-257/290. При действии прохлорперазина удалось существенно снизить спонтанную нервно-мышечную активность у животных, подвергнутых опорной разгрузке с использованием модели вывешивания задних конечностей [9]. В настоящем исследовании оценивали атрофические изменения камбаловидной мышцы и изменения маркеров сигнальных путей анаболической и катаболической направленности в камбаловидной мышце у вывешенных животных с обычным уровнем спонтанной нервно-мышечной активности и у животных, получавших прохлорперазин и характеризующихся значительно сниженным уровнем спонтанной активности.
Согласно нашей первоначальной гипотезе, при устранении спонтанной активности на фоне функциональной разгрузки степень атрофии мышц должна быть глубже, а метаболические и сигнальные изменения должны быть более выраженными, чем у вывешенных животных, принимавших плацебо, электромиограмма которых демонстрирует повышенную активность. Именно такую тенденцию мы выявили при исследовании маркеров регуляции биогенеза митохондрий в камбаловидной мышце вывешенных крыс, получавших прохлорперазин (PGC-1α, TFAM и др.) [11]. Снижение экспрессии этих маркеров оказалось более глубоким у животных, получавших прохлорперазин на фоне разгрузки, по сравнению с вывешенными животными без препарата.
В настоящем исследовании аналогичной тенденции при анализе сырой массы камбаловидной мышцы и площади поперечного сечения мышечных волокон не было отмечено. Напротив, у вывешенных животных, получавших прохлорперазин, снижение сырой массы и площади поперечного сечения мышечных волокон было менее выражено, чем у вывешенных животных, получавших плацебо. И эти различия между двумя группами были статистически значимы. Ранее в эксперименте с вывешиванием в попытке оценить роль спонтанной активности у вывешенных животных проводили денервацию камбаловидной и подошвенной мышцы в разных группах [12]. Денервация камбаловидной мышцы не привела к углублению атрофического ответа этой мышцы. Напротив, атрофия быстрой мышцы у денервированных животных была более выражена, чем у вывешенных животных, не подвергавшихся денервации. Поскольку при денервации прекращается не только импульсная регуляция мышечной активности, но и передача нейротрофических сигналов, которая более характерная для быстрых мышц, то углубление атрофии быстрой мышцы можно считать следствием прекращения этой передачи.
Этот эксперимент со всей очевидностью свидетельствует, что устранение нейрогенной импульсной регуляции мышечных сокращений на фоне функциональной разгрузки, как и в нашем эксперименте, не приводит к углублению атрофии. Мы обнаружили даже уменьшение ее выраженности. Причем это происходит в условиях бо́льшего “бездействия”, чем в условиях сохраняющейся спонтанной активности. Для того, чтобы приблизиться к пониманию причин этого парадокса, мы проанализировали состояние некоторых ключевых маркеров сигнальной регуляции белкового синтеза и распада.
Прежде всего исследовали уровень фосфорилирования рибосомальной киназы p70S6K, основной мишени и одновременно основного эффектора киназного комплекса mTORc1, ключевого фактора трансляционной эффективности, т.е. фактора, способного увеличить количества пептидных продуктов на одну рибосому в единицу времени [13]. Ранее при исследовании динамики этого показателя было обнаружено первоначальное повышение уровня фосфорилирования p70S6K после 12 и 24 ч вывешивания [14, 15] и последующее его снижение до уровня контроля после 7 сут вывешивания [14]. В настоящем исследовании в полном согласии с этими результатами после 7 сут воздействия у вывешенных животных уровень фосфорилирования рибосомальной киназы p70S6K не отличался от контрольного уровня. При этом различий между двумя группами вывешенных крыс (HS и HS + PCPZ) не было отмечено. Таким образом, можно считать, что прием прохлорперазина (и редукция спонтанной нервно-мышечной активности) не оказал влияния на ключевой параметр трансляционной эффективности камбаловидной мышцы. Естественно предположить, что снижение уровня фосфорилирования p70S6K в течение примерно пяти суток после первоначального повышения никак не обусловлено появлением после 2–3 сут спонтанной нервно-мышечной активности.
Совершенно иначе ведут себя параметры так называемой трансляционной емкости (т.е. параметры, способствующие биогенезу рибосом). Ранее в нашей лаборатории было показано, что уже в первые сутки вывешивания интенсивность экспрессии 18S и 28S рибосомальной РНК значимо снижается и поддерживается на уровне ниже контрольного как минимум до 7 сут вывешивания [16]. В настоящем исследовании у вывешенных животных, получавших плацебо, также наблюдали снижение экспрессии рибосомальных РНК. У животных, получавших прохлорперазин такого снижения не было обнаружено. Более того, у этих животных оказалась многократно повышенной экспрессия одного из центральных регуляторов транскрипции рибосомальных генов протоонкогенного белка c-Myc. Экспрессия c-Myc обычно регулируется β-катенином, активность которого может быть заблокирована некоторыми киназами, например, GSK3β или IKKβ [17, 18]. В нашем случае сниженный уровень негативного фосфорилирования GSK3β по сайту Ser9 примерно одинаков у животных двух вывешенных групп. Однако про влияние спонтанной сократительной активности мышцы на киназную активность IKKβ пока ничего не известно. Итак, мы можем констатировать, что именно спонтанная активность подавляет механизмы рибосомального биогенеза при разгрузке. При редукции этой активности уровень экспрессии маркеров трансляционной емкости не демонстрирует значимых отличий от контроля. Таким образом, способствуя снижению трансляционной емкости, спонтанная нервно-мышечная активность может оказаться фактором, углубляющим атрофические процессы в течение первой недели воздействия.
Что касается маркеров сигнальных путей катаболической направленности, то наиболее важными из них являются мРНК основных мышечных Е3-убиквитин лигаз – MuRF1 и MAFbx/atrogin-1. Известно, что при вывешивании экспрессия мРНК этих важнейших ферментов значительно возрастает на 3-и и 7-е сутки воздействия [19, 20 ] . В нашем исследовании этот феномен был также воспроизведен для тех животных, которые в ходе вывешивания получали плацебо. У вывешенных животных, получавших прохлорперазин значимых изменений экспрессии мРНК по сравнению с виварным контролем не было. Поэтому не исключено, что повышенная экспрессия мышечных Е3-убиквитин лигаз в данном случае является результатом спонтанной нервно-мышечной активности. Какие же конкретные механизмы, запущенные этой активностью, могут стимулировать экспрессию мРНК MuRF1 и MAFbx/atrogin-1? В нашем предыдущем исследовании с таким же экспериментальным дизайном [11] у животных, получавших прохлорперазин в ходе разгрузки, наблюдали снижение уровня активных форм кислорода и снижение активности кальций-кальмодулин киназы II (что указывает на снижение содержания ионов кальция) по сравнению с группой вывешенных крыс, получавших плацебо. На этом основании мы предположили, что при возникновении спонтанной активности в камбаловидной мышце накапливаются активные формы кислорода и ионы кальция, способствующие активации митоген-активируемых протеинкиназ, а также сигнального пути NFκB, которые, в свою очередь, стимулируют экспрессию мРНК мышечных Е3-убиквитинлигаз [21]. И действительно, в настоящем исследовании уровень фосфорилирования p38 у животных, получавших прохлорперазин, оказывался сниженным по сравнению с вывешенными животными, получавшими плацебо, что может свидетельствовать об активации p38 и JNK при спонтанной нервно-мышечной активности. Не исключено, что такая активация и приводит к повышенной экспрессии убиквитинлигаз и способствует углублению атрофического процесса.
Таким образом, в настоящем исследовании впервые получены результаты, свидетельствующие о том, что у крыс в условиях моделируемой гравитационной разгрузки при использовании прохлорперазина, способствующего активации калий-хлоридного котранспортера KCC-2 и существенно уменьшающего спонтанную электрическую активность постуральной камбаловидной мышцы, наблюдается достоверно меньшая выраженность атрофических изменений в мышце, чем при разгрузке без дополнительных воздействий. При этом почти не наблюдается снижения параметров рибосомального биогенеза и повышения экспрессии убиквитинлигаз по сравнению с интактным контролем. Установить точные причины наблюдаемого эффекта пока не представляется возможным, так же, как и исключить вероятность того, что данные изменения являются следствием прямого специфического действия прохлорперазина на мышцу. Тем не менее, мы склонны придерживаться гипотезы, предполагающей некоторое углубление развития атрофии в результате генерации спонтанной нервно-мышечной ритмической активности. Возможно, что такое развитие событий обусловлено низкой амплитудой и непрерывным характером электрической импульсации (и, вероятно, сократительной активности).
Список литературы
Hodgson JA, Roy RR, Higuchi N, Monti RJ, Zhong H, Grossman E, Edgerton VR (2005) Does daily activity level determine muscle phenotype? J Exp Biol 208 (Pt 19): 3761–3770. https://doi.org/10.1242/jeb.01825
Alford EK, Roy RR, Hodgson JA, Edgerton VR (1987) Electromyography of rat soleus, medial gastrocnemius, and tibialis anterior during hind limb suspension. Exp Neurol 96(3): 635–649. https://doi.org/10.1016/0014-4886(87)90225-1
Kawano F, Nomura T, Ishihara A, Nonaka I, Ohira Y (2002) Afferent input-associated reduction of muscle activity in microgravity environment. Neuroscience 114(4): 1133–1138. https://doi.org/10.1016/s0306-4522(02)00304-4
Morey-Holton ER, Globus RK (2002) Hindlimb unloading rodent model: technical aspects. J Appl Physiol 92(4): 1367–1377. https://doi.org/10.1152/japplphysiol.00969.2001
De-Doncker L, Kasri M, Picquet F, Falempin M (2005) Physiologically adaptive changes of the L5 afferent neurogram and of the rat soleus EMG activity during 14 days of hindlimb unloading and recovery. J Exp Biol 208(Pt 24): 4585–4592. https://doi.org/10.1242/jeb.01931
Baltina TV, Eremeev AA, Pleshchinskii IN (2006) The state of the contralateral neuromotor apparatus of the rat in conditions of unilateral tenotomy. Neurosci Behav Physiol 36(4): 385–389. https://doi.org/10.1007/s11055-006-0029-5
Boulenguez P, Liabeuf S, Bos R, Bras H, Jean-Xavier C, Brocard C, Stil A, Darbon P, Cattaert D, Delpire E, Marsala M, Vinay L (2010) Down-regulation of the potassium-chloride cotransporter KCC2 contributes to spasticity after spinal cord injury. Nat Med 16(3): 302–307. https://doi.org/10.1038/nm.2107
Hubner CA, Stein V, Hermans-Borgmeyer I, Meyer T, Ballanyi K, Jentsch TJ (2001) Disruption of KCC2 reveals an essential role of K-Cl cotransport already in early synaptic inhibition. Neuron 30(2): 515–524. https://doi.org/10.1016/s0896-6273(01)00297-5
Kalashnikov VE, Tyganov SA, Turtikova OV, Kalashnikova EP, Glazova MV, Mirzoev TM, Shenkman BS (2021) Prochlorperazine Withdraws the Delayed Onset Tonic Activity of Unloaded Rat Soleus Muscle: A Pilot Study. Life 11(11): 1161. https://doi.org/10.3390/life11111161
Nair AB, Jacob S (2016) A simple practice guide for dose conversion between animals and human. JBCP 7(2): 27–31. https://doi.org/10.4103/0976-0105.177703
Sharlo KA, Lvova ID, Tyganov SA, Sergeeva KV, Kalashnikov VY, Kalashnikova EP, Mirzoev Kh M, Kalamkarov GR, Shevchenko TF, Shenkman BS (2023) A Prochlorperazine-Induced Decrease in Autonomous Muscle Activity during Hindlimb Unloading Is Accompanied by Preserved Slow Myosin mRNA Expression. Curr Issues Mol Biol 45(7): 5613–5630. https://doi.org/10.3390/cimb45070354
Ohira Y, Yoshinaga T, Ohara M, Kawano F, Wang XD, Higo Y, Terada M, Matsuoka Y, Roy RR, Edgerton VR (2006) The role of neural and mechanical influences in maintaining normal fast and slow muscle properties. Cells Tissues Organs 182(3–4): 129–142. https://doi.org/10.1159/000093963
Mahoney SJ, Dempsey JM, Blenis J (2009) Cell signaling in protein synthesis ribosome biogenesis and translation initiation and elongation. Prog Mol Biol Transl Sci 90: 53–107. https://doi.org/10.1016/S1877-1173(09)90002-3
Mirzoev T, Tyganov S, Vilchinskaya N, Lomonosova Y, Shenkman B (2016) Key Markers of mTORC1-Dependent and mTORC1-Independent Signaling Pathways Regulating Protein Synthesis in Rat Soleus Muscle During Early Stages of Hindlimb Unloading. Cell Physiol Biochem 39 (3): 1011–1020. https://doi.org/10.1159/000447808
Chibalin AV, Benziane B, Zakyrjanova GF, Kravtsova VV, Krivoi, II (2018) Early endplate remodeling and skeletal muscle signaling events following rat hindlimb suspension. J Cell Physiol 233(10): 6329–6336. https://doi.org/10.1002/jcp.26594
Rozhkov SV, Sharlo KA, Shenkman BS, Mirzoev TM (2022) The Role of Glycogen Synthase Kinase-3 in the Regulation of Ribosome Biogenesis in Rat Soleus Muscle under Disuse Conditions. Int J Mol Sci 23(5): 2751. https://doi.org/10.3390/ijms23052751
Hu D, Bi X, Fang W, Han A, Yang W (2009) GSK3beta is involved in JNK2-mediated beta-catenin inhibition. PloS One 4(8): e6640. https://doi.org/10.1371/journal.pone.0006640
Sui Y, Liu Z, Park SH, Thatcher SE, Zhu B, Fernandez JP, Molina H, Kern PA, Zhou C (2018) IKKbeta is a beta-catenin kinase that regulates mesenchymal stem cell differentiation. JCI Insight 3(2): e96660. https://doi.org/10.1172/jci.insight.96660
Bodine SC, Latres E, Baumhueter S, Lai VK, Nunez L, Clarke BA, Poueymirou WT, Panaro FJ, Na E, Dharmarajan K, Pan ZQ, Valenzuela DM, DeChiara TM, Stitt TN, Yancopoulos GD, Glass DJ (2001) Identification of ubiquitin ligases required for skeletal muscle atrophy. Science 294(5547): 1704–1708. https://doi.org/10.1126/science.1065874
Kachaeva EV, Shenkman BS (2012) Various jobs of proteolytic enzymes in skeletal muscle during unloading: facts and speculations. J Biomed & Biotechnol 2012: 493618. https://doi.org/10.1155/2012/493618
Zhang BT, Whitehead NP, Gervasio OL, Reardon TF, Vale M, Fatkin D, Dietrich A, Yeung EW, Allen DG (2012) Pathways of Ca2+ entry and cytoskeletal damage following eccentric contractions in mouse skeletal muscle. J Appl Physiol 112(12): 2077–2086. https://doi.org/10.1152/japplphysiol.00770.2011
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова