Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 11, стр. 1635-1649
Влияние острого и хронического недосыпания на рабочую и долговременную память у крыс
М. В. Чернышев 1, *, М. А. Гузеев 1, И. В. Екимова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: netmisha@mail.ru
Поступила в редакцию 28.03.2023
После доработки 26.06.2023
Принята к публикации 10.07.2023
- EDN: HGZTDH
- DOI: 10.31857/S0869813923110031
Аннотация
Общеизвестно, что недосыпание или нарушение суточных ритмов сна и бодрствования негативным образом влияет на когнитивные функции. Долгое время полагалось, что главным уязвимым звеном является процесс консолидации памяти, то есть перенос информации из кратковременной/рабочей памяти в долговременную. Однако появляется все больше исследований, показывающих, что особенно сильно нарушения сна отражаются на рабочей памяти. В нашей работе мы попытались дать оценку возможных нарушений рабочей и долговременной памяти после воздействия различных режимов лишения сна в условиях острого и хронического опыта у крыс. Сон крыс популяции Вистар ограничивался с помощью методики качающейся платформы с использованием следующих трех режимов: 1 – острая депривация сна в течение 18 ч; 2 – острое ограничение сна в течение 24 ч (3 ч лишения сна чередовались с 1 ч покоя непрерывно, что суммарно составляло 18 ч лишения сна); 3 – хроническое ограничение сна (воздействие 2 использовалось непрерывно в течение 5 сут). Показано, что острая депривация сна в тесте Y-образный лабиринт приводила к достоверному снижению процента спонтанных чередований рукавов лабиринта, что указывает на нарушение рабочей памяти. В тесте лабиринт Барнс данный тип воздействия не оказывал влияние на долговременную память – время поиска убежища не менялось в этих условиях. Острое и хроническое ограничения сна не оказывали влияние на рабочую и долговременную память. Полученные результаты позволяют сделать вывод о том, что пространственная рабочая память (в отличие от долговременной памяти) является уязвимым компонентом когнитивных функций в условиях полной депривации сна. Данный негативный эффект исчезает, если периоды депривации сна чередуются с кратковременными периодами возможности сна, что указывает на защитное значение коротких периодов отдыха (сна) для когнитивных функций при недосыпании. Следовательно, кратковременный сон полезен для когнитивного здоровья и защищает рабочую память, а непрерывное длительное бодрствование ухудшает ее.
ВВЕДЕНИЕ
Сон продолжительностью 7–8 ч в сутки заложен в генетической природе человека [1]. Сокращение сна до 4 ч в сутки имеет пагубные последствия для здоровья, при этом особую настороженность вызывают связанные с этим различные нарушения когнитивных функций. Общепринятым считается, что недосыпание в первую очередь приводит к снижению концентрации внимания у человека и животных [2–5]. В то же время остается до конца не выясненным вопрос, какие виды памяти в наибольшей мере подвержены негативному влиянию недостатка сна, включая хроническое недосыпание. Существует широко распространенная гипотеза, что сон является важным звеном в системе усвоения новой информации, то есть важным условием консолидации памяти – переноса информации из кратковременной/рабочей памяти в долговременную/референтную [6, 7]. По этой причине дефицит сна должен ухудшать процесс запоминания и приводить к серьезным когнитивным дисфункциям. Еще в начале прошлого века было обнаружено, что у людей процесс формирования долговременной памяти зависит от сна [8]. С тех пор в многочисленных экспериментах было обнаружено влияние недостатка сна на процессы запоминания и формирования долговременной памяти у человека [9–12]. Накоплен также большой экспериментальный материал на грызунах, показывающий нарушение долговременной памяти при остром [13, 14] и хроническом [15] ограничении сна. Однако в литературе можно встретить также и серьезную критику выводов подобных работ о значении сна в процессах консолидации памяти. Имеется предположение, что сон не играет ключевой роли в процессах консолидации памяти [16], это находит свое экспериментальное обоснование в ряде работ [17, 18]. Другой автор еще более остро ставит вопрос, пытаясь вообще опровергнуть саму возможность участия сна в запоминании информации, накопленной в течение бодрствования [19].
Параллельно с этим имеются результаты исследований, указывающие на то, что при недосыпании нарушается не только внимание, но и рабочая память, которая имеет важное значение для реализации всех когнитивных процессов [5, 20–22]. Рабочая память – это вид памяти, обеспечивающий удержание в уме небольшого объема информации в течение короткого промежутка времени для решения различных когнитивных задач. При этом внимание вовлекается в процессы обработки информации в рабочей памяти [23]. Имеющиеся данные литературы указывают, что даже легкое недосыпание в течение 6 ночей (исключение 1 ч сна по сравнению с исходной 7-часовой продолжительностью обычного сна) приводило к нарушению рабочей памяти, но не влияло при этом на концентрацию внимания у испытуемых добровольцев [24]. Другие авторы показали [25], что после хронического недосыпания (5 ч в сутки в течение 5 ночей) одной обычной ночи сна (8 ч) недостаточно, чтобы восстановить рабочую память, что подчеркивает важность длительных периодов нормального сна для восстановления.
В целом, данная картина позволяет отнести пространственную рабочую память к одному из наиболее уязвимых компонентов когнитивных функций в условиях недостатка сна. Вместе с тем имеются отдельные работы, показавшие отсутствие влияния недостатка сна на рабочую память [27]. Существуют даже исследования, в которых проводилось сравнение между чувствительностью к нарушению сна рабочей и референтной памяти у грызунов в различных задачах водного лабиринта. Результаты одних работ [28, 29] позволили авторам предполагать большую чувствительность долговременной/референтной памяти – вида памяти, обеспечивающего кодирование и хранение почти неограниченного объема информации в течение длительного срока с возможностью его извлечения, тогда как результаты других авторов [30, 31] приводили к противоположному выводу. Таким образом, обозначенная проблема представляется весьма запутанной и требующей дальнейшего изучения.
Известно, что одним из ключевых моментов, обуславливающих эффект дефицита сна, являются параметры процедуры ограничения сна. Прежде всего, сюда следует отнести общую длительность, выражаемую либо часами (острый опыт), либо днями (хронический опыт). Важное значение при этом имеет режим ограничения сна: полное лишение (депривация) сна или частичное лишение (ограничение) сна с возможностью отдыха в определенный интервал. Несколько циклов сна в разное время суток (полифазный сон) позволяет сохранить лучшую работоспособность даже у людей при сокращении общего времени сна [32, 33]. Такой режим сна особенно распространен у грызунов, поэтому при моделировании влияния дефицита сна на функции мозга у крыс этот фактор может иметь ключевое значение. Крысы имеют полифазный цикл сон–бодрствование, в котором длительность непрерывного бодрствования редко превышает 2 ч в активное время суток. Этот факт почти не находит отражения в экспериментальных моделях недосыпания у крыс, хотя для корректного сопоставления хронического ограничения сна у людей и грызунов его также следует учитывать. Существует лишь небольшое количество исследований, оценивающих когнитивные функции в условиях полифазного ограничения сна у крыс [34, 35], причем влияние такого воздействия на память рассматривалось всего лишь в одной работе [36]. В нашей работе мы поставили перед собой задачу оценить уязвимость рабочей и долговременной памяти по отношению к полной депривации сна и полифазному ограничению сна в острой и хронической моделях у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Исследование проведено на крысах-самцах популяции Вистар в возрасте 7–8 мес., массой тела 350–450 г, выращенных в виварии Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. За неделю до начала опытов животных перемещали из вивария в экспериментальную комнату и помещали в одиночные клетки площадью 0.12 м2. Животные содержались при световом режиме 12:12 ч (10:00–22:00 – свет включен) и температуре воздуха 23 ± 1°C. Доступ к воде и пище был неограниченным.
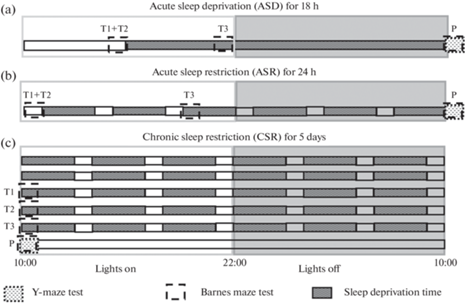
Ограничение сна. Влияние дефицита сна на память и обучение у крыс проводилось с использованием трех моделей: 1) острая депривация сна непрерывно в течение 18 ч; 2) острое ограничение сна в течение 24 ч по схеме 3 /1 (рис. 1): 3 ч лишения сна и 1 ч покоя (суммарная потеря сна составляла 18 ч; 3) хроническое ограничение сна, животные в течение 5 дней лишались сна на 18 ч/сут по схеме, описанной в предыдущей модели (рис. 2). Лишения сна осуществляли качанием клетки с частотой 160–170 об./мин на орбитальном шейкере S-3.02L.A20 (ELMI, Латвия). Такая методика лишения сна эффективно ограничивала время медленноволнового сна (остается не более 5% от общего времени) и полностью устраняла парадоксальный сон [37]. Прерывание сна с помощью лабораторного шейкера у животных является валидным методом и широко применяется в ряде лабораторий и неврологических центров [38, 39]. В периоды покоя шейкер автоматически останавливался, что позволяло животным спать полноценным сном. Во время процедуры лишения сна животные оставались в домашней клетке, влияние человека было минимизировано. До начала эксперимента всех животных адаптировали к работе шейкера, помещая клетку с крысой на качающуюся платформу на 20 мин в светлую фазу суток в течение двух дней.
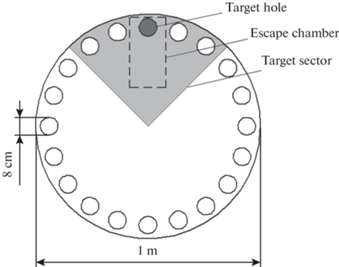
Рис. 1.
Схема ограничения сна и тестирования памяти: (а) – острая депривация сна (ASD), (b) – острое ограничение сна (ASR), (c) – хроническое ограничение сна (CSR). Обучающие предъявления лабиринта Барнс (Т1–Т3), тестовое предъявление лабиринта Барнс (P).
Рабочая память. Влияние дефицита сна на рабочую память определялось в тесте спонтанное чередование в Y-образном лабиринте [40]. Поведение грызунов в данной конструкции лабиринта, состоящего из трех одинаковых рукавов, базируется на стремлении животного исследовать новизну окружающей обстановки, всякий раз посещая тот рукав, который не был обследован в предыдущем заходе. Следование данному предпочтению в выборе рукава указывает на правильность выполнения теста. Всего в экспериментах использовалось 96 крыс. В экспериментах с острой депривацией сна участвовало 30 крыс, с острым ограничением сна – 32 крысы, с хроническим ограничением сна – 34 крысы. Животных случайным образом разделяли на 2 равные группы: одну группу подвергали депривации/ограничению сна с помощью шейкера, вторую (контрольную) группу содержали в клетках на невключенном шейкере, где сон был неограничен. Клетки с включенным и не включенным шейкером находились по соседству. Тестирование рабочей памяти проводили через 10 мин после окончания процедуры лишения сна (рис. 1). В начале тестирования животных помещали в центр лабиринта белого цвета с интенсивностью освещения трех одинаковых рукавов (50 × 40 × 15 см) 80 люкс и давали свободно его обследовать в течение 10 мин. Пространственную рабочую память оценивали по процентному отношению правильных спонтанных чередований к полному числу возможных чередований. Правильными чередованиями считали любую последовательность заходов животного в 3 разных рукава лабиринта подряд. Число возможных чередований определяли как суммарное число всех входов в рукава, из которого вычитали число 2 с целью исключить первые два захода, не позволяющие оценить правильность выполнения данной задачи. Тест проводился в начале светлого времени суток. Для статистического анализа использовали только тех животных, которые совершали не менее 12 входов в рукава [41]. Локомоторную/исследовательскую активность оценивали по суммарному числу всех входов в рукава лабиринта без использования вышеуказанного порога отсечения 12.
Долговременная память и обучение. Влияние дефицита сна на долговременную память и процесс обучения исследовалось в тесте лабиринт Барнс по укороченному протоколу обучения [42]. В экспериментах на мышах в модели болезни Альцгеймера такая модификация протокола показала большую чувствительность к легким нарушениям памяти. В экспериментах участвовало 86 животных: с острой депривацией сна n = 30, с острым ограничением сна n = 32, с хроническим ограничением сна n = 24.
Животных случайным образом разделяли на 2 равные группы: одну группу подвергали депривации/ограничению сна, вторую (контрольную) группу содержали в клетках на невключенном шейкере, где сон был неограничен.
Лабиринт представлял собой белый диск с 20 норками, равномерно расположенными по краю с освещением на поверхности диска 800 люкс. Одна из норок являлась целевой, которая вела в темное убежище, где крыса имела возможность спрятаться. Протокол теста был разработан согласно рекомендациям, предложенным Gawel и соавт. [43]. Протокол состоял из трех этапов: 1. Приучение к лабиринту. 2. Обучение животных поиску убежища. 3. Тестирование долговременной памяти. Приучение животных к лабиринту (1-й этап) проводили за 2 дня до начала эксперимента. Сначала крыс помещали в убежище, давая спокойно его обследовать. Затем животных помещали в центр лабиринта, позволяя обнаружить убежище и спрятаться в него. Всегда время пребывания в убежище составляло 3 мин. Если крыса не обнаруживала убежище, то экспериментатор аккуратно подводил ее рукой к убежищу. На этапе приучения к лабиринту внешняя обстановка не контролировалась. На этапе обучения пространственной задаче (2-й этап) лабиринт огораживали белой ширмой по периметру на расстоянии не менее 30 см от края. На ширме располагались четыре черные картонные фигуры различной формы размером 20 × 20 см с четырех сторон. Животных помещали в центр лабиринта и позволяли спрятаться в убежище. При острой депривации сна и остром ограничении сна животных обучали дважды с интервалом 15 мин перед началом ограничения сна и 1 раз после 6 ч депривации сна. В эксперименте с хроническим ограничением сна животных обучали один раз в день в начале 3-го, 4-го, 5-го дней ограничения сна. Тестирование памяти (3-й этап) проводили после ограничения сна (рис. 1). В тестовую сессию животному давали 3 мин обследовать лабиринт, убежище отсутствовало. Во время тестирования внешние ориентиры оставались в том же положении, что и во время обучения. Эффективность обучения оценивали по времени, затраченному на достижение целевой норки. После каждого испытания лабиринт протирали 3%-ным раствором перекиси водорода для устранения запахов. Пространственную долговременную память оценивали по процентному отношению времени, затраченного на обследование целевой норки и двух ближайших норок с каждой стороны (5 норок целевого сектора) ко времени, затраченному на обследование всех норок в лабиринте (рис. 2), так как этот показатель лучше отражает долговременную память в тестах с короткой обучающей последовательностью [44]. Время обследования норок определялось автоматически по положению носа крысы над норкой с использованием программы видеотрекинга EthoVision XT 12.0 (Нидерланды).
Статистический анализ. Статистический анализ результатов тестов проводился в программе GraphPad Prism 8 (США). Все данные проверялись на нормальность распределения тестом Шапиро–Уилка и на равенство дисперсий F-тестом Фишера. Парные сравнения проводились с помощью t-критерия Стьюдента. Обучение животных сравнивалось c помощью двухфакторного дисперсионного анализа (two-way ANOVA: фактор 1 – этап обучения; фактор 2 – группа животных). Значимыми считались изменения с уровнем p < 0.05. На графиках значения представлены как среднее и ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
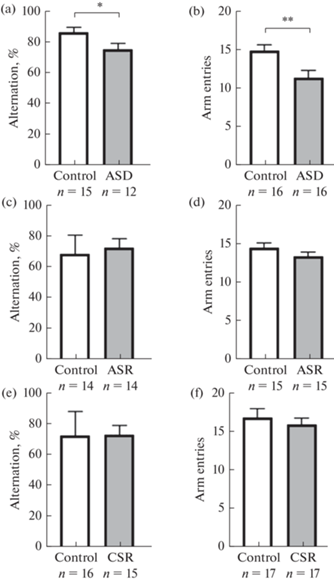
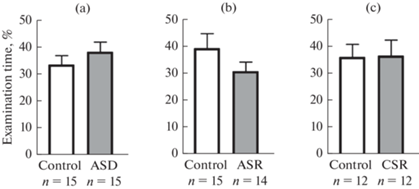
Пространственная рабочая память. При оценке пространственной рабочей памяти в тесте спонтанное чередование в Y-образном лабиринте у крыс с острой депривацией сна было обнаружено достоверное снижение процента спонтанных чередований по сравнению с контрольной группой (t-тест, р < 0.05; рис. 3а), что указывает на ухудшение рабочей памяти. Расчет производился по 11 депривированным крысам и 14 контрольным (5 крыс, совершивших менее 12 входов в рукава, были исключены из данного анализа). После острой депривации сна суммарное число входов в рукава лабиринта снизилось (t-критерий Стьюдента, р < 0.05; рис. 3b) у всех депривированных животных. Сходный анализ данных в группе с острым ограничением сна и в группе с хроническим ограничением сна показал отсутствие различий между экспериментальными и контрольными группами как по проценту спонтанных чередований (t-критерий Стьюдента, р > 0.05; рис. 3c, 3e), так и по количеству входов в рукава лабиринта (t-критерий Стьюдента, р > 0.05; рис. 3d, 3f), что свидетельствует об отсутствии эффекта дефицита сна в этом тесте на пространственную рабочую память и двигательную/исследовательскую активность. Лишь по одному животному из контрольной и экспериментальной групп совершало меньше 12 входов при остром ограничении сна. В эксперименте с хроническим ограничением сна менее 12 входов в рукава наблюдалось у двух животных из каждой группы.
Рис. 3.
Влияние дефицита сна на рабочую память и локомоторное/исследовательское поведение крыс в тесте спонтанного чередования в Y-образном лабиринте. Различные режимы лишения сна: ASD – острая депривация сна (a, b), ASR – острое ограничение сна (c, d), CSR – хроническое ограничение сна (e, f). По вертикали: процент спонтанных чередований (a, c, e), полное число заходов в рукава (b, d, f). Данные представлены как среднее и стандартная ошибка среднего (M ± SEM). * – p < 0.01, ** – p < 0.01, t-критерий Стьюдента.
Долговременная память. На этапе обучения в лабиринте Барнс у животных всех групп наблюдалось прогрессивное сокращение латентного периода до обследования целевой норки, при этом различий между группами с лишением сна и контрольными группами не наблюдалось. При острой полной депривации two-way ANOVA: фактор 1 – этап обучения F (3, 84) = 3.8, p = 0.01; фактор 2 – группа крыс F (1, 28) = 0.4, p = 0.53; взаимодействие факторов – группа × обучение F (3, 84) = 0.92, p = 0.44 (рис. 4a). При остром ограничении сна время two-way ANOVA: фактор 1 этап обучения F (3, 81) = 9.5, p < 0.01; фактор 2 – группа крыс F (1, 27) = 0.38, p = 0.54; взаимодействие факторов – группа × обучение F (3, 81) = 0.35, p = 0.79 (рис. 4b). При хроническом ограничении сна two-way ANOVA: фактор 1 – этап обучения F (3, 66) = 8, p < 0.01; фактор 2 - группа крыс F (1, 22) = 0.08, p = 0.78; взаимодействие факторов – группа × обучение F (3, 66) = 0.23, p = 0.87 (рис. 4c). В конце этапа обучения в лабиринте Барнс все животные при первом обнаружении убежища прятались в него, однако 3 крысы из трех разных групп после 2–3 ошибок прекращали поиск убежища. У таких животных невозможно оценить долговременную память с помощью выбранной нами методики, поэтому эти крысы были исключены из анализа. На этапе тестирования все группы животных как контрольные, так и с ограничением сна, продемонстрировали предпочтение в обследовании норок в целевом секторе (>25% времени обследования), то есть животные запоминали положение целевой норки. Различий между контрольной группой и группами с ограничением сна не найдено (t-тест, р < 0.05; рис. 5). Таким образом, по результатам данного теста мы не обнаружили ухудшения долговременной пространственной памяти ни в одной модели лишения сна.
Рис. 4.
Влияние дефицита сна на обучение животных в лабиринте Барнс. По вертикали – показатель обучения (латентность первого подхода к целевой норке). По горизонтали: Т1–Т3 – обучающие предъявления, Р – тестовое предъявление. Различные режимы лишения сна: ASD – острая депривация сна (a), ASR – острое ограничение сна (b), CSR – хроническое ограничение сна (c). Данные представлены как среднее и стандартная ошибка среднего (M ± SEM). Значимых различий между группами сравнения обнаружено не было (two-way ANOVA, p > 0.05).
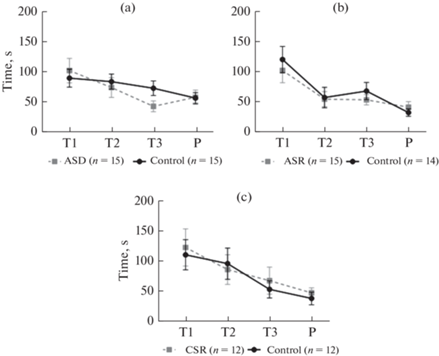
Рис. 5.
Влияние дефицита сна на долговременную память крыс в лабиринте Барнс. По вертикали – процент времени, затраченного на обследование норок в целевом секторе во время тестовой сессии после ограничения сна. Различные режимы лишения сна: ASD – острая депривация сна (a), ASR – острое ограничение сна (b), CSR – хроническое ограничение сна (c). Данные представлены как среднее и стандартная ошибка среднего (M ± SEM). Значимых различий между группами сравнения обнаружено не было (t-критерий Стьюдента, p > 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Важным аспектом нашего исследования было выяснение наиболее значимых параметров депривации сна, способных оказывать влияние на память. Мы использовали три распространенных типа воздействий по длительности: 1) острая депривация сна непрерывно в течение 18 ч; 2) острое ограничение сна в течение 24 ч по схеме 3 /1; 3) хроническое ограничение сна в течение 5 дней также по схеме 3 /1. Последние два типа ограничений сна представляли для нас исходно наибольший интерес, так как они, помимо своей малой изученности, имитировали свойственную грызунам полифазную природу сна (чередование на всем продолжении суток периодов сна и бодрствования). При этом суммарная потеря сна в этих моделях составляла 18 ч в сутки, т.е. столько же, сколько при острой полной депривации сна. Проведенное исследование показало, что использованная нами 18-часовая депривация сна приводила к ухудшению пространственной рабочей памяти в тесте спонтанное чередование в Y-образном лабиринте. Такой результат совпадает с результатами большинства работ, выполненных на человеке с применением часто встречаемой 36-часовой депривации сна [22, 44] и на грызунах с депривацией сна длительностью 10–20 ч [45–47], что сопоставимо с нашей моделью. Примечательно, что в исследовании [46] ухудшение рабочей памяти у мышей зависело от степени сложности выполнения задачи пространственного чередования в T-образном лабиринте. Авторы показали, что изменения в рабочей памяти наблюдались только при длинном интервале между пробами (длительностью 30 с), а при коротком интервале (длительностью 5 с) данные изменения отсутствовали. Это обстоятельство указывает на определенную вариабельность чувствительности рабочей памяти в данном тесте к недостатку сна, что, в свою очередь, помимо физических параметров ограничения сна, может обуславливать наличие/отсутствие эффекта.
Полученный нами эффект 18-часовой депривации сна на рабочую память в задаче спонтанного чередования в Y-образном лабиринте в то же время может отличаться от результатов, в которых использовался непосредственно тот же самый тест, но иные временные интервалы депривации. Было показано [27, 45], что депривации сна длительностью 3 и 6 ч не вызывают изменений в проценте спонтанных чередований при выполнении теста у мышей. Однако уже 10-часовая депривация ухудшала данный показатель [45], демонстрируя схожий с нашим исследованием результат. А депривация длительностью 24 ч в силу увеличения сонливости давала существенное снижение двигательной активности и приводила к неспособности животных совершать требуемые перемещения внутри лабиринта. Этот факт, в свою очередь, согласуется с обнаруженным в нашем исследовании уменьшением общего числа переходов между рукавами. Таким образом, использованный нами период 18 ч оказался оптимальным с точки зрения регистрации негативного эффекта на память. Однако следует упомянуть, что при использовании деприваций длительностью 3 и 6 ч авторы отмечали противоположный эффект – усиление двигательной активности. По-видимому, начальное недосыпание приводит к активации различных систем (в частности локомоции и исследовательского поведения в Y-лабиринте), впоследствии переходящей к дезактивации по мере протекания времени и аккумуляции сонливости.
Интересным результатом нашего исследования явилось отсутствие эффекта при использовании двух других режимов ограничения сна, что было обусловлено введением в протокол воздействия часовых окон для сна по описанной схеме 3 /1. Примечательным является то, что даже в условиях 5-дневного хронического опыта данные часовые интервалы препятствовали появлению эффекта накопления нехватки сна на память. Сравнивая этот результат с данными других исследований, cледует отметить, что в литературе присутствует лишь одна работа [36], в которой использовался подобный методический подход применительно к оценке памяти. Сообщается, что ограничение сна по протоколу 4/2 не оказывало влияния на рабочую память в восьмилучевом лабиринте, а также на ассоциативное обучение и гиппокамп-зависимую долговременную память у мутантных мышей как в условиях острого (24 ч), так и хронического (48 ч). воздействия. Нельзя не отметить, что ограничение сна длительностью 48 ч с трудом можно назвать хроническим, сопоставляя его с 5-дневным воздействием, использованным в нашем эксперименте. Однако результат и в том, и в другом случае оказался одинаковым – полифазный режим ограничения сна не вызывал негативных изменений в памяти.
В подавляющем числе работ используется монофазное ограничение сна – простое сокращение общего времени сна в суточном цикле. В исследованиях, выявивших ухудшение рабочей и долговременной памяти, общая продолжительность такого ограничения сна составляла, как правило, несколько недель у людей с изъятием нескольких часов сна в сутки [24, 25] и не менее 5 дней у грызунов с изъятием чаще всего 18 ч сна в сутки [15, 26, 48, 49]. На эти параметры были ориентированы и мы в своем исследовании, где общая продолжительность хронического ограничения сна составляла 5 дней, а суммарное суточное сокращение сна – 18 ч (для всех вариантов используемых воздействий). Единственной разницей являлось использование в нашей работе протокола 3/1, учитывающего полифазный сон крыс. Таким образом, отсутствие негативного эффекта дефицита сна при использовании данного протокола может указывать на то, что в этих условиях мозг животных, по-видимому, имеет больше возможностей для компенсации недостающего количества сна.
В нашем исследовании не было обнаружено влияния недостатка сна на долговременную память. Несмотря на то, что в литературе существует большое количество экспериментальных работ, показывающих негативное влияние недостатка сна на долговременную память, ранее не проводилось исследований с таким же дизайном, как в данной работе. Это касается применения шейкера для ограничения сна в сочетании с обучением животных в лабиринте Барнс и влияния полифазной схемы депривации сна на долговременную память. Хотя мы наблюдали нормальный процесс обучения во всех группах животных и предпочтение выбранного сектора лабиринта, что говорит о сформировавшейся долговременной памяти, чувствительность выбранного нами метода оценки памяти к тем нарушениям, которые возникают в наших экспериментальных условиях, могла быть недостаточна. Нарушения памяти в лабиринте Барнс наблюдались при фрагментации сна на беговой дорожке в течение 12 дней [48], такие экспериментальные условия могут оказаться более тяжелыми для животных из-за более продолжительного периода нарушения сна. С другой стороны, можно предположить, что нарушения долговременной памяти зависят не только от режима депривации, но и от способа поддержания бодрствования в экспериментальной модели. Так, например, депривация сна с помощью предъявления новых объектов может приводить к повышенной когнитивной активности, депривация на беговой дорожке или в колесе к – чрезмерной двигательной активности [50]. Еще одной причиной различия результатов у грызунов по влиянию сна на долговременную память могут являться особенности теста, используемого для оценки памяти. Так, в ряде исследований было показано ухудшение пространственной долговременной памяти в водном лабиринте Морриса [14, 15]. Хотя тест Барнс и Морриса считают сходными, различия в получаемых результатах могут быть связаны с разным уровнем стресса, который испытывают животные при выполнении задачи [51]. В ряде работ было показано, что повышение уровня кортикостекорна у грызунов после тестирования в водном лабиринте Морриса более значительно, чем в лабиринте Барнс [51, 52]. Если рассматривать сон в качестве стресс-лимитирующего механизма [53], то усиление стресса на фоне недостатка сна может приводить к более выраженным нарушениям когнитивных функций в экспериментах с использованием теста Морриса.
В целом, проведенное исследование показало, что 18-часовая полная депривация сна избирательно ухудшает рабочую память, не нарушая при этом долговременную память при прочих равных условиях. Режим воздействия с имитацией полифазного сна, представляющего собой чередование коротких интервалов для отдыха, предохраняет память от возникновения нарушений, которые могут наблюдаться при непрерывной депривации сна одинаковой продолжительности. Это положительное влияние сохраняется даже в условиях 5-дневного хронического ограничения сна. Важно отметить, что продолжительный здоровый сон является необходимым условием нормального функционирования эндокринной системы, оказывающей большое влияние на углеводный обмен. Последнее время появляются сведения [54] о том, что рабочая память в наибольшей мере зависима от метаболизма глюкозы, при этом сокращение ночного сна приводит даже к снижению ее толерантности. На основании этого делаются попытки объяснить наибольшую чувствительность рабочей памяти к недостаточности сна, о чем в определенной мере свидетельствуют и наши результаты, которые в том числе указывают еще на значимые параметры самого недосыпания (монофазное/полифазное ограничение сна). Кратковременный сон полезен для мозга и защищает рабочую память, а непрерывное бодрствование ухудшает ее. Результаты работы могут являться фундаментальным обоснованием для разработки нового трудового распорядка с введением короткого (10–20 мин) дневного и ночного сна на рабочем месте у людей с 24-часовым графиком работы с целью сохранения здоровья когнитивных функций.
Список литературы
Полуэктов М (2019) Загадки сна: от бессонницы до летаргии М. Альпина Пабл. [Poluektov M (2019) Mysteries of sleep: from insomnia to lethargy. M. Al’pina Pabl. (In Russ)].
Alhola P, Polo-Kantola P (2007) Sleep deprivation: Impact on cognitive performance. Neuropsychiatr Dis Treat 3(5): 553–567.
Lo JC, Groeger JA, Santhi N, Arbon EL, Lazar AS, Hasan S, von Schantz M, Archer SN, Dijk DJ (2012) Effects of partial and acute total sleep deprivation on performance across cognitive domains, individuals and circadian phase. PLoS One 7(9): e45987. https://doi.org/10.1371/journal.pone.0045987
Balkin TJ, Rupp T, Picchioni D, Wesensten NJ (2008) Sleep loss and sleepiness: current issues. Chest 134(3): 653–660. https://doi.org/10.1378/chest.08-1064
McCoy JG, Strecker RE (2011) The cognitive cost of sleep lost. Neurobiol Learn Mem 96(4): 564–582. https://doi.org/10.1016/j.nlm.2011.07.004
Born J, Wagner U (2004) Awareness in memory: being explicit about the role of sleep. Trends Cogn Sci 8: 242–244.
Gais S, Plihal W, Wagner U, Born J (2000) Early sleep triggers memory for early visual discrimination skills. Nat Neurosci 3: 1335–1339.
Jenkins JG, Dallenbach KM (1924) Obliviscence during Sleep and Waking. Am J Psychol 35(4): 605. https://doi.org/10.2307/1414040
Rasch B, Born J (2013) About Sleep’s Role in Memory. Physiol Rev 93(2): 681–766. https://doi.org/10.1152/physrev.00032.2012
Hennecke E, Lange D, Steenbergen F, Fronczek-Poncelet J, Elmenhorst, D, Bauer A, Elmenhorst EM (2020) Adverse interaction effects of chronic and acute sleep deficits on spatial working memory but not on verbal working memory or declarative memory. J Sleep Res 30(4):e13225. https://doi.org/10.1111/jsr.13225
Gais S, Lucas B, Born J (2006) Sleep after learning aids memory recall. Learn Mem 13(3): 259–262.
Payne JD, Tucker MA, Ellenbogen JM, Wamsley EJ, Walker MP, Schacter DL, Stickgold R (2012) Memory for semantically related and unrelated declarative information: the benefit of sleep, the cost of wake. PLoS One 7(3): e33079. https://doi.org/10.1371/journal.pone.0033079
Palchykova S, Winskysommerer R, Meerlo P, Durr R, Tobler I (2006) Sleep deprivation impairs object recognition in mice. Neurobiol Learn Mem 85(3): 263–271. https://doi.org/10.1016/j.nlm.2005.11.005
Guan Z, Peng X, Fang J (2004) Sleep deprivation impairs spatial memory and decreases extracellular signal-regulated kinase phosphorylation in the hippocampus. Brain Res 1018(1): 38–47. https://doi.org/10.1016/j.brainres.2004.05.032
McCoy JG, Christie MA, Kim Y, Brennan R, Poeta DL, McCarley RW, Strecker RE (2013) Chronic sleep restriction impairs spatial memory in rats. NeuroReport 24(2): 91–95. https://doi.org/10.1097/wnr.0b013e32835cd97a
Siegel JM (2021) Memory Consolidation Is Similar in Waking and Sleep. Current Sleep Med Rep 7(1): 15–18. https://doi.org/10.1007/s40675-020-00199-3
McDevitt EA, Zhang J, MacKenzie KJ, Fiser J, Mednick SC (2022) The effect of interference, offline sleep, and wake on spatial statistical learning. Neurobiol Learn Mem 193: 107650. https://doi.org/10.1016/j.nlm.2022.107650
Bailes C, Caldwell M, Wamsley EJ, Tucker MA (2020) Does sleep protect memories against interference? A failure to replicate. PLoS One 15(2): e0220419. https://doi.org/10.1371/journal.pone.0220419
Kovalzon VM (2023) Cerebral information processing during sleep: evolutionary and ecological approaches. J Evol Biochem Phys 59(2): 79–89.
Lim J, Dinges DF (2010) A meta-analysis of the impact of short-term sleep deprivation on cognitive variables. Psychol Bull 136(3): 375–389. https://doi.org/10.1037/a0018883
Lowe CJ, Safati A, Hall PA (2017) The neurocognitive consequences of sleep restriction: A meta-analytic review. Neurosci Biobehav Rev 80: 586–604. https://doi.org/10.1016/j.neubiorev.2017.07.010
Peng Z, Dai C, Ba Y, Zhang L, Shao Y, Tian J (2020) Effect of Sleep Deprivation on the Working Memory-Related N2-P3 Components of the Event-Related Potential Waveform. Front Neurosci 14: 469. https://doi.org/10.3389/fnins.2020.00469
Krause AJ, Simon EB, Mander BA, Greer SM, Saletin JM, Goldstein-Piekarski AN, Walker MP (2017) The sleep-deprived human brain. Nat Rev Neurosci 18(7): 404–418. https://doi.org/10.1038/nrn.2017.55
Santisteban JA, Brown TG, Ouimet MC, Gruber R (2019) Cumulative mild partial sleep deprivation negatively impacts working memory capacity but not sustained attention, response inhibition, or decision making: a randomized controlled trial. Sleep Health 5(1): 101–108. https://doi.org/10.1016/j.sleh.2018.09.007
Hennecke E, Lange D, Steenbergen F, Fronczek-Poncelet J, Elmenhorst D, Bauer A, Aeschbach D, Elmenhorst EM (2021) Adverse interaction effects of chronic and acute sleep deficits on spatial working memory but not on verbal working memory or declarative memory. J Sleep Res 30(4): e13225. https://doi.org/10.1111/jsr.13225
Colavito V, Fabene PF, Grassi-Zucconi G, Pifferi F, Lamberty Y, Bentivoglio M, Bertini G (2013) Experimental sleep deprivation as a tool to test memory deficits in rodents. Front Syst Neurosci 7: 106. https://doi.org/10.3389/fnsys.2013.00106
Ramanathan L, Hu S, Frautschy SA, Siegel JM (2010) Short-term total sleep deprivation in the rat increases antioxidant responses in multiple brain regions without impairing spontaneous alternation behavior. Behav Brain Res 207(2): 305–309. https://doi.org/10.1016/j.bbr.2009.10.014
Beaulieu I, Godbout R (2000) Spatial learning on the Morris Water Maze Test after a short-term paradoxical sleep deprivation in the rat. Brain and Cognit 43(1-3): 27–31.
Le Marec N, Beaulieu I, Godbout R (2001) Four hours of paradoxical sleep deprivation impairs alternation performance in a water maze in the rat. Brain and Cognit 46(1–2): 195–197. https://doi.org/10.1016/s0278-2626(01)80064-6
Ward CP, McCarley RW, Strecker RE (2009) Experimental sleep fragmentation impairs spatial reference but not working memory in Fischer/Brown Norway rats. J Sleep Res 18(2): 238–244. https://doi.org/10.1111/j.1365-2869.2008.00714.x
Youngblood BD, Zhou J, Smagin GN, Ryan DH, Harris RB (1997) Sleep deprivation by the ‘‘flower pot’’ technique and spatial reference memory. Physiol & Behav 61(2): 249–256. https://doi.org/10.1016/s0031-9384(96)00363-0
Porcu S, Casagrande M, Ferrara M, Bellatreccia A (1998) Sleep and Alertness During Alternating Monophasic and Poliphasic Rest-Activity Cycles. Int J Neurosci 95(1-2): 43–50. https://doi.org/10.3109/00207459809000648
Roach GD, Zhou X, Darwent D, Kosmadopoulos A, Dawson D, Sargent C (2017) Are two halves better than one whole? A comparison of the amount and quality of sleep obtained by healthy adult males living on split and consolidated sleep–wake schedules. Accident Analysis & Prevent 99: 428–433. https://doi.org/10.1016/j.aap.2015.10.012
Deurveilher S, Bush JE, Rusak B, Eskes GA, Semba K (2015) Psychomotor vigilance task performance during and following chronic sleep restriction in rats. Sleep 38(4): 515–528. https://doi.org/10.5665/sleep.4562
Deurveilher S, Semba K (2019) Physiological and Neurobehavioral Consequences of Chronic Sleep Restriction in Rodent Models. In: Handbook Behav Neurosci 30: 557–567. https://doi.org/10.1016/B978-0-12-813743-7.00037-2
Bjorness TE, Kelly CL, Gao T, Poffenberger V, Greene RW (2009). Control and function of the homeostatic sleep response by adenosine A1 receptors. J Neurosci 29(5): 1267–1276. https://doi.org/10.1523/JNEUROSCI.2942-08.2009
Гузеев МА, Курмазов НС, Симонова ВВ, Пастухов ЮФ, Екимова ИВ (2021) Создание модели хронического недосыпания для трансляционных исследований. Журн неврол психиатр им CC Корсакова 121(4-2): 6–13. [Guzeev MA, Kurmazov NS, Simonova VV, Pastukhov YF, Ekimova IV (2021) Modeling of chronic sleep restriction for translational studies. Zh Nevrol Psikhiatr im SS Korsakova 121(4-2): 6–13. (In Russ)]. https://doi.org/10.17116/jnevro20211214026
Sinton CM, Kovakkattu D, Friese RS (2009) Validation of a novel method to interrupt sleep in the mouse. J Neurosci Methods 184(1): 71–78. https://doi.org/10.1016/j.jneumeth.2009.07.026
Bertrand SJ, Zhang Z, Patel R, O’Ferrell C, Punjabi NM, Kudchadkar SR, Kannan S (2020) Transient neonatal sleep fragmentation results in long-term neuroinflammation and cognitive impairment in a rabbit model. Exp Neurol 327: 113212. https://doi.org/10.1016/j.expneurol.2020.113212
Hidaka N, Suemaru K, Takechi K, Li B, Araki H (2011) Inhibitory effects of valproate on impairment of Y-maze alternation behavior induced by repeated electroconvulsive seizures and c-Fos protein levels in rat brains. Acta Med Okayama 65(4): 269–277. https://doi.org/10.18926/AMO/46853
Garcia Y, Esquivel N (2018) Comparison of the Response of Male BALB/c and C57BL/6 Mice in Behavioral Tasks to Evaluate Cognitive Function. Behav Sci (Basel) 8(1): 14. https://doi.org/10.3390/bs8010014
Attar A, Liu T, Chan W-T C, Hayes J, Nejad M, Lei K, Bitan G (2013) A shortened Barnes maze protocol reveals memory deficits at 4-months of age in the triple-transgenic mouse model of Alzheimer’s disease. PLoS One 8(11): e80355. https://doi.org/10.1371/journal.pone.0080355
Gawel K, Gibula E, Marszalek-Grabska M, Filarowska J, Kotlinska JH (2019) Assessment of spatial learning and memory in the Barnes maze task in rodents-methodological consideration. Naunyn Schmiedebergs Arch Pharmacol 392(1): 1–18. https://doi.org/10.1007/s00210-018-1589-y
Wang L, Wu H, Dai C, Peng Z, Song T, Xu L, Xu M, Shao Y, Li S, Fu W (2022) Dynamic hippocampal functional connectivity responses to varying working memory loads following total sleep deprivation. J Sleep Res: e13797. https://doi.org/10.1111/jsr.13797
Piérard C, Liscia P, Philippin JN, Mons N, Lafon T, Chauveau F, Van Beers P, Drouet I, Serra A, Jouanin JC, Béracochéa D (2007) Modafinil restores memory performance and neural activity impaired by sleep deprivation in mice. Pharmacol Biochem Behav 88(1): 55–63. https://doi.org/10.1016/j.pbb.2007.07.006
Chauveau F, Laudereau K, Libourel PA, Gervasoni D, Thomasson J, Poly B, Pierard C, Beracochea D (2014) Ciproxifan improves working memory through increased prefrontal cortex neural activity in sleep-restricted mice. Neuropharmacology 85: 349–356. https://doi.org/10.1016/j.neuropharm.2014.04.017
Thomasson J, Canini F, Poly-Thomasson B, Trousselard M, Granon S, Chauveau F (2017) Neuropeptide S overcomes short term memory deficit induced by sleep restriction by increasing prefrontal cortex activity. Eur Neuropsychopharmacol 27(12): 1308–1318. https://doi.org/10.1016/j.euroneuro.2017.08.431
Sportiche N, Suntsova N, Methippara M, Bashi T, Mitrani B, Szymusiak R, McGinty D (2010) Sustained sleep fragmentation results in delayed changes in hippocampal-dependent cognitive function associated with reduced dentate gyrus neurogenesis. Neuroscience 170(1): 247–258. https://doi.org/10.1016/j.neuroscience.2010.06
Yin M, Chen Y, Zheng, H, Pu T, Marshall C, Wu T, Xiao M (2017) Assessment of mouse cognitive and anxiety-like behaviors and hippocampal inflammation following a repeated and intermittent paradoxical sleep deprivation procedure. Behav Brain Res 15(321): 69–78. https://doi.org/10.1016/j.bbr.2016.12.034
Zamore Z, Veasey SC (2022) Neural consequences of chronic sleep disruption. Trends Neurosci 45(9): 678–691. https://doi.org/10.1016/j.tins.2022.05.007
Looti Bashiyan Karabeg MM, Grauthoff S, Kollert SY, Weidner M, Heiming RS, Jansen F, Lewejohann L (2013) 5-HTT deficiency affects neuroplasticity and increases stress sensitivity resulting in altered spatial learning performance in the Morris water maze but not in the Barnes maze. PloS One 8(10): e78238. https://doi.org/10.1371/journal.pone.0078238
Harrison FE, Hosseini AH, McDonald MP (2009) Endogenous anxiety and stress responses in water maze and Barnes maze spatial memory tasks. Behav Brain Res 198(1): 247–251. https://doi.org/10.1016/j.bbr.2008.10.015
Meerlo P, Sgoifo A, Suchecki D (2008) Restricted and disrupted sleep: Effects on autonomic function, neuroendocrine stress systems and stress responsivity. Sleep Med Rev 12(3): 197–210. https://doi.org/10.1016/j.smrv.2007.07.007
Украинцева ЮВ, Левкович КМ (2022) Негативное влияние нарушений сна на рабочую память может быть опосредовано изменениями углеводного обмена. Журн неврол психиатр им СС Корсакова Спецвыпуски 122(5-2): 11–17. [Ukraintseva YuV, Liaukovich KM (2022) The negative impact of sleep disorders on working memory may be mediated by changes in carbohydrate metabolism. Zhurn Nevrol I Psikhiatrii im SS Korsakova 122(5-2): 11–17. (In Russ)]. https://doi.org/10.17116/jnevro202212205211
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова