Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 12, стр. 1832-1846
Роль калиевых каналов в регуляции транспортной функции лимфатических узлов крыс при сепсисе
Г. И. Лобов *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: lobovgi@infran.ru
Поступила в редакцию 01.10.2023
После доработки 18.10.2023
Принята к публикации 19.10.2023
- EDN: CQTUHH
- DOI: 10.31857/S0869813923120063
Аннотация
Лимфа, образующаяся в тканях, обязательно проходит через лимфатические узлы (ЛУ), которые не только выполняют иммунную функцию, но и принимают участие в лимфотоке посредством ритмических высокоамплитудных сокращений. При воспалении в ЛУ экспрессируются несколько ферментов, продуцирующих сигнальные молекулы, обладающие релаксирующим эффектом. В данном исследовании изучалась роль KATP- и BКCa-каналов в сепсис-индуцированном ремоделировании ЛУ. У крыс вызывали сепсис посредством операции лигирования-пункции слепой кишки. Через 12 и 24 ч извлекали брыжеечные ЛУ и исследовали их сократительную активность в миографе. KATP-каналы активировали пинацидилом и блокировали глибенкламидом. BКCa-каналы активировали NS 1619 и блокировали тетраэтиламмонием (ТЭА). Оценивали силу тонического сокращения ЛУ в условиях применения активаторов и блокаторов К+-каналов и ингибиторов индуцибельной NO-синтазы и растворимой гуанилатциклазы. ЛУ крыс с сепсисом имели низкий уровень тонуса при стандартном натяжении. Активатор KATP-каналов – пинацидил приводил к большей релаксации ЛУ крыс с сепсисом по сравнению с контрольной группой, а ингибитор – глибенкламид, вызывал сократительную реакцию. Пинацидил на фоне глибенкламида не приводил к достоверным изменениям тонуса ЛУ. Применение активатора BKCa-каналов приводило к расслаблению ЛУ, в ЛУ септических крыс эффект был более выраженным. ТЭА приводил к повышению тонуса ЛУ, ЛУ септических крыс реагировали на применение ТЭА бóльшим сокращением. Мы пришли к заключению, что NO, продуцируемый экспрессированной iNOS, у животных с сепсисом прямо или опосредованно активирует в ЛУ KATP- и BКCa-каналы гладкомышечных клеток капсулы. Блокатор КАТР-каналов глибенкламид приводил к повышению тонуса ЛУ во всех группах крыс, при этом прирост тонуса в ЛУ крыс с сепсисом был достоверно большим по сравнению с ЛУ крыс контрольной группы. Применение селективного активатора BKCa-каналов NS 1619 сопровождалось выраженной релаксацией ЛУ. В перспективе КАТР- и BKCa-каналы гладкомышечных клеток капсулы ЛУ могут явиться потенциальной мишенью для терапевтического воздействия с целью коррекции иммунного ответа посредством замедления или ускорения потока лимфы через ЛУ.
ВВЕДЕНИЕ
Еще в конце ХХ века воспаление ассоциировалось в основном с инфекциями и травмами. Но данные последних десятилетий свидетельствуют о том, что воспаление сопровождает самые разнообразные патологические процессы (атеросклероз, диабет, ожирение и др.) и является врожденным защитным механизмом организма не только от инфекционного, но и от неинфекционного патологического воздействия [1]. В конечном итоге воспаление обеспечивает выживание во время развития патологического процесса и поддерживает гомеостаз тканей в различных неблагоприятных условиях. Воспалительный процесс представляет собой каскад клеточных и микрососудистых реакций, которые служат для удаления поврежденной и создания новой ткани. Одним из первых признаков воспаления является увеличение проницаемости кровеносных сосудов, позволяющее крупномолекулярным компонентам плазмы и дендритным клеткам выходить из кровотока и накапливаться в поврежденной ткани [2]. В очаг воспаления привлекаются различные иммунные клетки, которые индуцируют продукцию сигнальных молекул, сопровождающих воспаление: провоспалительных цитокинов (TNF, IL-1, IL-6), хемокинов (CCL2 и CXCL8), газотрансмиттеров, липидных медиаторов, протеолитических ферментов и свободных радикалов [3]. Воспалительные макрофаги продуцируют в очаге воспаления большое количество активных форм кислорода и азота, которые являются эффективными средствами борьбы с патогенами, но также приводят к повреждению и гибели различных клеток в воспаленных тканях. Часть макрофагов также погибает в этой высокореактивной среде. В итоге в очаге воспаления накапливается множество различных сигнальных молекул и большое количество клеточного детрита, включающего фрагменты клеток ткани, макрофагов и бактериальных клеток [4]. Несмотря на повышенную проницаемость кровеносных сосудов в воспаленной ткани, крупные молекулы из очага воспаления поступают в лимфатические капилляры и удаляются из ткани лимфатическими сосудами [5], которые доставляют эти молекулы в дренирующие лимфатические узлы (ЛУ) [6].
Иммунные клетки и сигнальные молекулы, доставленные лимфой в ЛУ, взаимодействуют с различными клетками ЛУ: субкапсулярными макрофагами, эндотелиальными клетками лимфатических синусов и стромальными клетками. Результатом подобного взаимодействия является ремоделирование стромы и сосудистой сети ЛУ, расширение фибробластной ретикулярной сети и увеличение ЛУ в объеме до 20 раз [7]. Изменения, происходящие в строме и паренхиме ЛУ при воспалении, хорошо изучены [8]. В то же время данных об изменениях активной транспортной функции ЛУ при воспалении практически нет. Между тем одной из основополагающих функций ЛУ является их активная насосная функция [9]. В ряде исследований показано, что в физиологических условиях капсула ЛУ ритмично сокращается, что приводит к повышению давления в синусах ЛУ и выходу лимфы в выносящие ЛС [10, 11]. Активным элементом, обеспечивающим сокращения капсулы ЛУ, являются гладкомышечные клетки капсулы, плотно контактирующие друг с другом и функционирующие по принципу функционального синцития [12]. Установлено, что воспаление сопровождается экспрессией в капсуле ЛУ индуцибельной синтазы оксида азота (iNOS), циклооксигеназы-2 и цистатионин-γ-лиазы. Продуцируемые ими оксид азота (NO), простагландины и сероводород оказывают ингибирующее влияние на гладкомышечные клетки ЛУ, что приводит к угнетению фазных сокращений, снижению тонического напряжения и расслаблению капсулы [13, 14]. Механизмы ингибирующего действия этих сигнальных молекул на гладкомышечные клетки капсулы ЛУ изучены слабо. В то же время известно, что одним из механизмов ингибирования сократительной функции гладких мышц артерий в процессе развития воспалительного ответа является активация К+-каналов гладкомышечных клеток [15, 16]. Электрофизиологические и функциональные данные демонстрируют аномальную активацию K+-каналов в гладких мышцах кровеносных сосудов у животных с эндотоксическим шоком [17]. На мембране гладкомышечных клеток лимфатических сосудов также найдено несколько видов К+-каналов, в т.ч. BKCa- и KATP-каналы [18, 19]. Доказано их участие в регуляции транспортной функции лимфатических сосудов при воспалении [20]. Роль K+-каналов на мембране гладких мышц капсулы ЛУ до настоящего времени не изучена, соответственно, нет данных об их участии в регуляции сократительной функции гладких мышц ЛУ при воспалении. Целью данного исследования являлось изучение роли BKCa- и KATP-каналов гладкомышечных клеток в ингибировании сократительной функции ЛУ при моделировании сепсиса у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование было проведено на самцах крыс Wistar в возрасте 20 недель и массой 320–350 г из биоколлекции Института физиологии им. И.П. Павлова РАН. Крыс до эксперимента содержали в условиях вивария в помещении с регулируемой температурой 20–22°С и световом режиме 12 ч свет/12 ч темнота при свободном доступе к стандартному корму и питьевой воде. Перед исследованием животных случайным образом разделили на три группы: две опытных по 12 крыс и контрольную (n = 10). У всех крыс перед экспериментом измеряли артериальное давление (АД) с помощью аппарата “Систола” (“Нейроботикс”, Россия). Абдоминальный сепсис вызывали посредством лигирования-пункции слепой кишки (cecal ligation puncture, CLP). Под анестезией золетилом (15 мг/кг, Vibrac, Франция) выбривали шерсть в нижней части живота и дезинфицировали кожу хлоргексидином (Южфарм, Россия). Выполняли срединный разрез брюшной стенки в нижней части живота длиной 2 см, слепую кишку извлекали из брюшной полости и размещали на стерильной салфетке. Затем перевязывали слепую кишку шелковой лигатурой на расстоянии 3 см от дистального конца и прокалывали лигированную часть кишки насквозь иглой 20G. После этого кишку аккуратно массировали до появления кишечного содержимого на поверхности кишки. Затем слепую кишку погружали в брюшную полость и зашивали разрез брюшной стенки. В контрольной группе оперативное вмешательство проводили по аналогичной схеме, но извлеченную из брюшной полости кишку не лигировали и не прокалывали. По завершении операции каждой крысе подкожно вводили по 3 мл теплого физиологического раствора, и с целью обезболивания в раннем постоперационном периоде инфильтрировали область разреза 0.2%-ным раствором лидокаина (0.4 мл, Фармстандарт-Лексредства, Россия). Животных помещали в индивидуальные клетки с подогреваемым полом до полного восстановления от анестезии. Состояние крыс контролировали каждые 12 ч. Через 12 и 24 ч после CLP у крыс вновь измеряли АД.
Брыжеечные ЛУ забирали у крыс через 12 и 24 ч после операции CLP. Под общей анестезией золетилом вскрывали брюшную полость и извлекали 2–3 брыжеечных ЛУ, после чего животных выводили из эксперимента посредством обескровливания (разрез нижней полой вены). До исследования ЛУ хранили в холодильнике на льду в физиологическом солевом растворе (PSS). Перед исследованием у ЛУ удаляли основную массу перинодального жира и окружающую соединительную ткань. Размеры ЛУ определяли под микроскопом МССО (“ЛОМО”) с измерительным окуляром. К полюсам ЛУ фиксировали шелковые лигатуры. ЛУ помещали в камеру миографа, через которую постоянно протекал физиологический солевой раствор (PSS), содержащий (в мМ) 120.4 NaCl, 5.9 KCl, 2.5 CaCl2, 1.2 MgCl2, 1.2 NaH2PO4, 15.5 NaHCO3, 11.5 глюкозы (все вещества химически чистые, производства “Химпром”) и 10 г/л очищенного бычьего сывороточного альбумина (Merck, Sigma-Aldrich). Раствор барботировали газовой смесью, состоящей из 95% О2 и 5% СО2. Температуру раствора поддерживали на уровне 38 ± 0.1°С, рН 7.40 ± 0.02; термометр Testo 103 (Testo SE & Co., Германия, pH-метр Hanna HI 83141 (HANNA Instruments, Германия). С помощью лигатур ЛУ прикрепляли к датчику силы FORT-10 (WPI, США) и микроманипулятору.
Сигнал от датчика подавали на вход усилителя INA333 (Texas Instruments Incorporated, США), далее – в сигма-дельта АЦП, встроенный в микроконтроллер STM32F373 (STMicroelectronics, Франция). Затем поток данных с частотой 50 Гц поступал на USB-порт компьютера. Полученные данные обрабатывали программой регистрации, разработанной в Институте экспериментальной медицины, которая обеспечивала непрерывную запись информации с датчика на протяжении всего эксперимента.
Помимо вышеуказанных химических веществ, в данном исследовании использовали следующие реактивы (все – производства Sigma Aldrich-Merck (Германия): 1400W (N-([3-(Aminomethyl)phenyl] methyl)ethanimidamide dihydrochloride), 20 мкМ; ODQ (1H-1,2,4 Oxadiazolo 4,3-a quinoxalin-1-one), 10 мкМ; пинацидил (Pinacidil monohydrate), 10 мкМ; глибенкламид (Glibenclamide), 10 мкМ; NS 1619 (1,3-Dihydro-1-[2-hydroxy-5-(trifluoromethyl)phenyl]-5-(trifluoromethyl)-2H-benzimidazol-2-one), 1 мкМ; тетраэтиламмоний хлорид, ТЭА (Tetramethyl-d12-ammonium chloride), 1–10 мМ.
Реактивы растворяли в PSS непосредственно перед каждым экспериментом. ODQ, NS 1619, пинацидил и глибенкламид предварительно растворяли в DMSO (Servicebio Technology, Китай) и перед экспериментом добавляли необходимое количество концентрата в физиологический раствор. DMSO в разведении 1 : 1000 не вызывал значимых изменений параметров сократительной активности ЛУ.
Статистическую обработку полученных результатов проводили в программах MS Excel 2010 (Microsoft Corp., США) и InStat 3.1 (GraphPad Software, США). Нормальность распределения полученных данных определяли с помощью критерия Шапиро–Уилка. Данные представлены в виде среднего арифметического значения ± стандартная ошибка (M ± SE). Для сравнения данных использовали t-критерий Стьюдента для непарных выборок. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В процессе исследования через 12 и 24 ч после операции у всех CLP-крыс регистрировали признаки абдоминального сепсиса: учащенное поверхностное дыхание, пилоэрекция, сгорбленность или съеживание в углу клетки, отказ от пищи. Наблюдалось значительное снижение систолического (САД) и диастолического (ДАД) давления (табл. 1). Через 24 ч одна крыса из группы CLP2 погибла.
Таблица 1.
Артериальное давление у крыс
| Группы крыс | Исходное АД (мм рт. ст.) |
АД через 12 ч (мм рт. ст.) |
АД через 24 ч (мм рт. ст.) |
|||
|---|---|---|---|---|---|---|
| САД | ДАД | САД | ДАД | САД | ДАД | |
| CLP1 | 118 ± 7 | 78 ± 5 | 89 ± 5* | 60 ± 4* | – | – |
| CLP2 | 121 ± 8 | 81 ± 6 | 84 ± 4* | 53 ± 4* | 77 ± 5* | 51 ± 5* |
| CG | 119 ± 6 | 79 ± 6 | 121 ± 8 | 77 ± 6 | 122 ± 8 | 81 ± 6 |
При вскрытии брюшной полости крыс СLP обнаруживали кровянистую жидкость, гиперемию и отек кишечника. Брыжеечные ЛУ крыс СLP имели овальную форму, были темно-красного цвета, их размеры были в пределах: длина – 9–12 мм, ширина 6–7 мм. Различий в размерах ЛУ в группах CLP1 и CLP2 не было выявлено, при этом ЛУ крыс CLP2 выглядели более темными и отечными. ЛУ крыс контрольной группы были бледно-розового цвета, имели преимущественно овальную форму, их длина была около 6–7 мм, ширина – 3–4 мм.
После 30-минутного выдерживания в камере миографа с проточным PSS ЛУ подвергали натяжению, соответствующему трансмуральному давлению 4 см водн. ст. На протяжении последующих 1–2 мин наблюдали релаксацию ЛУ и установление стабильного уровня тонуса. Средний уровень тонуса ЛУ в контрольной группе составил 1.23 ± 0.14 мН, в группе CLP1 – 0.73 ± 0.08 мН, в группе CLP2 – 0.67 ± 0.06 мН. ЛУ крыс контрольной группы генерировали спонтанные фазные сокращения со средней частотой 0.82 ± 0.15 мин–1 и амплитудой 0.38 ± 0.08 мН. В ЛУ крыс CLP фазных сокращений не было зарегистрировано.
Ранее нами было показано, что основной сигнальной молекулой, образующейся в ЛУ при воспалении и приводящей к релаксации капсулы ЛУ, является NO, продуцируемый iNOS [14]. В данном исследовании мы также оценивали величину NO-опосредованной релаксации ЛУ крыс CLP. 1400W практически не оказывал влияния на тонус ЛУ крыс контрольной группы, а в ЛУ групп CLP1 и CLP2 приводил к значительному повышению тонуса (рис. 1).
Рис. 1.
Тонус лимфатических узлов крыс при действии 1400W и ODQ. Тонус лимфатических узлов крыс контрольной группы в физиологическом растворе (CG) принят за 100%. CLP1 – лимфатические узлы крыс через 12 ч после операции, CLP2 – лимфатические узлы крыс через 24 ч после операции. Различия достоверны: * – p < 0.05, # – p < 0.01.
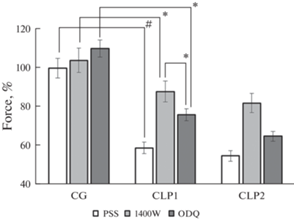
Сигнальный каскад NO → sGC → cGMP регулирует различные физиологические процессы, включая расслабление гладких мышц кровеносных сосудов [21]. Расслабляющий эффект эта сигнальная цепочка оказывает и на лимфатические сосуды и ЛУ [22]. Исходя из этого, мы провели серию экспериментов с ингибированием растворимой гуанилатциклазы. ODQ оказывал слабое влияние на тонус ЛУ крыс контрольной группы, но приводил к значительному повышению тонуса ЛУ крыс CLP1 и CLP2. Необходимо отметить, что в обеих группах крыс CLP повышение тонуса ЛУ под влиянием ODQ было достоверно меньше по сравнению с эффектом 1400W.
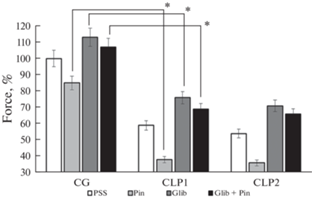
Конечным звеном сигнальной цепочки NO → sGC → cGMP → KATP-каналы являются KATP-каналы. Применение пинацидила приводило к релаксации ЛУ всех групп, при этом амплитуда релаксации ЛУ крыс CLP1и CLP2 была достоверно выше по сравнению с ЛУ крыс контрольной группы (рис. 2). После удаления пинацидила и восстановления ЛУ в камеру миографа добавляли глибенкламид, являющийся блокатором КATP-каналов. Поскольку блокирование КATP-каналов глибенкламидом происходит медленно, для возникновения максимального блока требовалось до 15 мин [23]. Через 15 мин оценивали тонус ЛУ, который во всех группах ЛУ значительно повысился. Затем на фоне действия глибенкламида в раствор добавляли пинацидил. На фоне глибенкламида пинацидил вызывал слабую релаксацию ЛУ всех групп крыс.
Рис. 2.
Тонус лимфатических узлов крыс при действии активатора и блокатора КATP-каналов. Тонус лимфатических узлов крыс контрольной группы в физиологическом растворе (CG) принят за 100%. CLP1 – лимфатические узлы крыс через 12 ч после операции, CLP2 – лимфатические узлы крыс через 24 ч после операции. Pin – пинацидил, Glib – глибенкламид. Различия достоверны: * – p < 0.01.
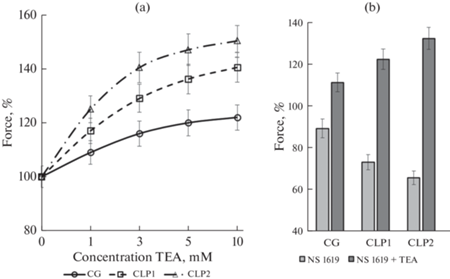
Сепсис представляет собой довольно сложное состояние организма, в его развитие вовлекаются различные системы и различные сигнальные цепочки [24]. В частности, известно, что при септическом шоке состояние гипотонии поддерживается также за счет сверхактивации ВКСа-каналов гладкомышечных клеток артерий [25]. Исходя из этих данных, с учетом того факта, что ВКСа-каналы обнаружены в гладкомышечных клетках лимфатических сосудов, в следующей серии опытов мы исследовали возможное участие ВКСа-каналов гладкомышечных клеток капсулы в сепсис-индуцированной релаксации ЛУ. В омывающий раствор добавляли ТЭА в нарастающих концентрациях (1, 3, 5, 10 мМ). Каждое очередное повышение концентрации ТЭА производили после установления стабильного уровня тонуса, вызванного предыдущей концентрацией ТЭА. ТЭА в изученных концентрациях приводил к повышению тонуса ЛУ, которое в ЛУ септических крыс было достоверно больше по сравнению с ЛУ крыс контрольной группы. Максимальное повышение тонуса было зарегистрировано в ЛУ крыс CLP2.
После 30-минутного восстановления ЛУ исследовали их тонические реакции при добавлении в раствор NS 1619. Действие NS 1619 приводило к релаксации ЛУ, амплитуда релаксации ЛУ септических крыс была достоверно больше по сравнению с эффектом NS 1619 на ЛУ крыс контрольной группы. После завершения расслабления, вызванного NS 1619, в раствор, содержащий NS 1619, добавляли ТЭА в концентрации 3 мМ. ТЭА в течение нескольких минут полностью нивелировал релаксирующий эффект NS 1619 и приводил к повышению тонуса ЛУ всех групп (рис. 3b).
Рис. 3.
Тонус лимфатических узлов крыс при действии блокатора и активатора ВКСа-каналов. CG – лимфатические узлы крыс контрольной группы, CLP1 – лимфатические узлы крыс через 12 ч после операции, CLP2 – лимфатические узлы крыс через 24 ч после операции. (a) – зависимость тонуса лимфатических узлов крыс от концентрации ТЭА, (b) – тонус лимфатических узлов крыс при действии NS 1619 (1 мкМ) и тетраэтиламмония (TEA) (3 мМ). За 100% принимали исходную величину тонуса лимфатических узлов каждой группы в физиологическом растворе. Различия достоверны: * – p < 0.01.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сепсис является тяжелой формой воспалительного процесса, и его моделирование часто применяется в доклинической практике. Наиболее широко используемой клинической моделью сепсиса является лигирование и пункция слепой кишки, эта модель считается “золотым стандартом”, поскольку хорошо воссоздает гемодинамическую и метаболическую фазы сепсиса у человека [26]. Ремоделирование ЛУ обычно начинается с увеличения афферентного лимфатического притока и поступления в ЛУ активированных дендритных клеток и медиаторов воспаления. Вслед за этим происходит массивный приток иммунных клеток из системы кровообращения, а также пролиферация лимфоцитов. Затем к ремоделированию подключаются эндотелиальные и ретикулярные клетки стромального компартмента ЛУ [27]. Несмотря на то, что отдельные клеточные и молекулярные механизмы, лежащие в основе ремоделирования ЛУ, раскрыты, некоторых деталей для полной картины этого сложного процесса явно не хватает. Капсула ЛУ является довольно жесткой и слабо растяжимой соединительнотканной структурой (по сравнению с паренхимой ЛУ), содержащей гладкомышечные клетки, и процессы, происходящие в капсуле при воспалении, важны для понимания механизмов регуляции потоков лимфы через ЛУ и формирования полного представления о процессе гипертрофии ЛУ. В нашем исследовании объем ЛУ крыс CLP через 24 ч после операции увеличивался в 4–5 раз.
В нескольких работах показано, что уже через 4–6 ч после индукции острого воспаления транспорт лимфы по лимфатическим сосудам нарушается, и основным эффектором ингибирования насосной функции лимфатических сосудов является NO [24, 28]. В нашей предыдущей работе при исследовании брыжеечных ЛУ быка, обработанных липополисахаридом, было установлено, что в воспаленных ЛУ экспрессируются различные ферменты, в т.ч. и те, которые продуцируют сигнальные молекулы, вызывающие релаксацию гладких мышц капсулы ЛУ – iNOS, цистатионин-γ-лиаза и циклооксигеназа 2 [14]. Позднее нами были получены примерно такие же данные при исследовании брыжеечных ЛУ крыс после лигирования-пункции слепой кишки [29]. Учитывая, что максимальный релаксирующий эффект на ЛУ был вызван NO, продуцируемым iNOS, в данном исследовании мы сконцентрировали внимание на механизмах действия NO на гладкомышечные клетки брыжеечных ЛУ крыс. Было подтверждено, что механические свойства ЛУ крыс CLP сильно изменяются по сравнению с ЛУ крыс контрольной группы: после стандартного натяжения их тонус устанавливался на уровне 50–60% от соответствующего показателя ЛУ крыс контрольной группы, т.е. они становились более растяжимыми. С целью определения вклада NO в релаксацию ЛУ крыс CLP мы использовали высокоселективный ингибитор iNOS – 1400W, который значительно уменьшал сепсис-индуцированную релаксацию ЛУ крыс CLP (в среднем – на 30%). В данном исследовании мы не принимали во внимание NO, продуцируемый eNOS, поскольку iNOS образует NO, количество которого в десятки и сотни раз превышает количество этого газомедиатора, производимого eNOS. Также с учетом механизма действия 1400W в дальнейшем во всех заключениях в данной работе мы исходили из того, что в ЛУ септических крыс сигнальные цепочки активирует NO, продуцируемый iNOS. На основании данных наших экспериментов мы не можем идентифицировать клетки, экспрессирующие iNOS в ЛУ септических крыс. В этот процесс значительный вклад могут вносить иммунные клетки, поступившие при воспалении в ЛУ. В то же время на основании данных, полученных нами ранее при исследовании изолированных ЛПС-стимулированных полосок капсулы ЛУ [14], мы с достаточным основанием можем утверждать, что определенная часть iNOS экспрессируется клетками капсулы ЛУ. Применение ODQ приводило к значительному повышению тонуса ЛУ крыс CLP, при этом тоническое напряжение ЛУ крыс контрольной группы также достоверно повышалось, но в меньшей степени. Повышение тонуса ЛУ крыс контрольной группы при действии ODQ объясняется тем, что в физиологических условиях эндотелиоциты лимфатических сосудов и ЛУ непрерывно продуцируют небольшие количества NO, который активирует растворимую гуанилатциклазу (soluble guanylate cyclase, sGC) и таким образом способствует небольшому понижению тонуса [30–32]. ODQ блокирует стимулирующее действие NO на sGC, что приводит к повышению тонуса ЛУ. В ЛУ крыс CLP ODQ приводил к большему повышению тонуса ЛУ по сравнению с ЛУ крыс контрольной группы, что, по нашему мнению, объясняется усиленной стимуляцией sGC, осуществляемой большим количеством NO, продуцируемым iNOS. Также значительное повышение тонуса ЛУ под влиянием ODQ можно объяснить сверхэкспрессией sGC в гладкомышечных клетках капсулы ЛУ, наблюдающейся при сепсисе, как, например, это было показано в ткани аорты и миокарде крыс [33].
Сравнение эффектов 1400W и ODQ на тонус ЛУ крыс CLP показывает, что 1400W оказывает достоверное большее влияние на сокращение гладкомышечных клеток капсулы ЛУ. Мы полагаем, что подобное различие эффектов ингибирования продукции NO и cGMP на тонус ЛУ объясняется сложными механизмами влияния NO на гладкомышечные клетки ЛУ. Известно, что NO в гладкомышечных клетках сосудов не только стимулирует sGC, но может влиять на клеточную активность независимо от активации sGC, например, стимулируя кальциевую АТФазу саркоплазматического ретикулума, тем самым снижая внутриклеточную концентрацию кальция и вызывая расслабление гладких мышц [34]. Мы предполагаем, что в гладкомышечных клетках ЛУ при сепсисе могут активироваться и другие NO-опосредованные сигнальные цепочки, следствием чего является снижение концентрации цитоплазматического Са2+ и расслабление гладкомышечных клеток.
Известно, что концентрация цитоплазматического Са2+ является основным фактором, определяющим степень активации сократительных белков в гладкомышечных клетках, она зависит в основном от притока Са2+ извне через потенциалзависимые Са2+-каналы. Их состояние определяется мембранным потенциалом, а последний – преимущественно градиентом концентрации К+, которая зависит от активности К+-каналов [35]. Все виды К+-каналов играют важную роль в поддержании мембранного потенциала в гладкомышечных клетках, а два из них: КАТР-каналы и ВКСа-каналы часто вовлекаются в различные патологические процессы, и их активация является основной причиной расслабления сосудистых гладкомышечных клеток и гипотонии при сепсисе [36].
Во многих публикациях показано, что КАТР-каналы гладкомышечных клеток артерий являются одной из основных мишеней сепсиса, имеющей решающее значение для развития тяжелой гипотонии [36]. Литературы о КАТР-каналах в лимфатических сосудах значительно меньше по сравнению с кровеносными сосудами, но почти вся она предполагает, что эти каналы фундаментально аналогичны каналам в гладких мышцах артерий и что их активация является негативным регулятором лимфатического транспорта [37]. Действие пинацидила на протяжении нескольких минут приводило к релаксации ЛУ крыс всех групп, при этом релаксация ЛУ крыс CLP была достоверно большей по сравнению с ЛУ крыс контрольной группы.
Хотя до настоящего времени нет прямых доказательств наличия КАТР-каналов в гладкомышечных клетках капсулы ЛУ, мы полагаем, что релаксация ЛУ крыс контрольной группы на применение пинацидила могла быть обусловлена лишь активацией КАТР-каналов, поскольку пинацидил является достаточно селективным активатором КАТР-каналов. Кроме того, лимфатические сосуды и ЛУ имеют общее происхождение [38], а КАТР-каналы ранее были обнаружены в гладкомышечных клетках лимфатических сосудов [39], и их активация способствовала прекращению спонтанных фазных сокращений и расслаблению лимфатических сосудов [40]. Небольшая релаксация ЛУ крыс контрольной группы на пинацидил, по нашему мнению, объясняется тем, что КАТР-каналы обычно имеют низкую активность в физиологических условиях, но активируются при патологии и, в частности, при сепсисе, что приводит к гиперполяризации и расслаблению гладкомышечных клеток [41]. Мы полагаем, что большая амплитуда релаксации ЛУ крыс CLP по сравнению с ЛУ крыс контрольной группы была обусловлена сепсис-индуцированной сверхэкспрессией КАТР-каналов в гладкомышечных клетках ЛУ. Ранее у морских свинок с TNBS-индуцированном илеитом в собирательных мезентериальных лимфатических сосудах, дренирующих подвздошную кишку, была выявлена выраженная экспрессия мРНК субъединиц, образующих КАТР-каналы [41].
Эффекты применения глибенкламида подтверждают важность КАТР-каналов в ЛУ в физиологических условиях и при сепсисе. Глибенкламид приводил к повышению тонуса ЛУ во всех группах крыс, при этом прирост тонуса в ЛУ крыс CLP был достоверно большим по сравнению с ЛУ крыс контрольной группы. Затем в раствор, содержащий глибенкламид, мы добавляли пинацидил. Пинацидил на фоне глибенкламида не приводил к достоверной релаксации ЛУ, как это было в опытах без применения глибенкламида, т.е. активатор КАТР-каналов оказался неспособен открыть КАТР-каналы, заблокированные глибенкламидом. Таким образом, мы получили дополнительное подтверждение участия КАТР-каналов в релаксации ЛУ как в физиологических условиях, так и при сепсисе. Наши данные не являются прямым доказательством сверхэкспрессии КАТР-каналов в гладкомышечных клетках ЛУ при сепсисе, но на других объектах показано, что гипореактивность сосудов при сепсисе обусловлена не только увеличением количества открытых КАТР-каналов, но и увеличением их числа на мембране гладкомышечных клеток за счет активации генов [42].
Второй вид калиевых каналов, роль которых в модуляции тонуса ЛУ мы изучали в данной работе – это Са2+-зависимые калиевые каналы большой проводимости (BKCa-каналы). BKCa-каналы экспрессируются на плазматической мембране различных возбудимых и невозбудимых клеток, включая нервные и гладкомышечные, где они являются связующим звеном между мембранным потенциалом и внутриклеточной концентрацией Са2+. Они участвуют во многих клеточных функциях, таких как генерация потенциала действия (реполяризация), высвобождение нейромедиаторов, модуляция тонуса гладкомышечных клеток сосудов и дыхательных путей [43, 44]. Известно также, что BKCa-каналы вовлекаются в различные патологические процессы, так, например, их активность значительно снижена в артериях при диабете 2-го типа [45] и артериальной гипертензии [46].
BKCa-каналы в физиологических условиях управляются мембранным потенциалом и концентрацией цитоплазматического Са2+, при этом на BKCa-каналы оказывают выраженное влияние различные эндогенные вазодилататоры, и, в частности, активность каналов артерий модулирует NO [47]. В экспериментах на животных установлено, что во время септического шока сверхактивируются каналы KATP и BKCa, что ведет к развитию тяжелой гипотонии [48]. Показано, что BKCa-каналы экспрессируются в гладкомышечных клетках лимфатических сосудов мышей [49]. Они также обнаружены в грудном протоке человека [50]. Данных о BKCa-каналах в гладких мышцах капсулы ЛУ в литературе нет.
В наших экспериментах на начальном этапе в качестве блокатора BKCa-каналов мы использовали ТЭА в концентрациях 1–10 мМ (рис 3а). Известно, что TЭA эффективно блокирует BKCa-каналы через внутреннюю или внешнюю сторону мембраны [51]. В концентрации 3 мМ ТЭА оказывал выраженный стимулирующий эффект на тонус ЛУ крыс всех групп. Такая концентрация ТЭА считается селективной для BKCa-каналов [52], поэтому в дальнейшем при исследовании BKCa-каналов ЛУ был использован ТЭА в этой концентрации. Действие ТЭА приводило к повышению тонуса ЛУ во всех исследуемых группах, при этом ЛУ септических крыс демонстрировали значительно больший прирост тонуса по сравнению с ЛУ крыс контрольной группы. Также представляется интересным, что эффект ТЭА на ЛУ крыс группы CLP2 был более выраженным по сравнению с ЛУ крыс CLP1 (рис. 3).
В следующей серии экспериментов мы оценили влияние NS 1619 на тонус ЛУ. NS 1619 представляет собой селективный активатор BKCa-каналов [52] и широко применяется при исследовании функций гладких мышц [53]. Применение NS 1619 сопровождалось выраженной релаксацией ЛУ крыс всех групп. Расслабление ЛУ крыс CLP было более выраженным по сравнению с ЛУ крыс контрольной группы, кроме того, релаксирующий эффект NS 1619 на ЛУ крыс группы CLP2 был достоверно большим по сравнению с ЛУ крыс CLP1(рис 3b). Применение ТЭА на фоне продолжающегося действия NS 1619 сопровождалось быстрым повышением тонического напряжения ЛУ всех групп, максимальное повышение тонуса было зарегистрировано в ЛУ крыс CLP2.
Данные, полученные в экспериментах с применением блокатора и активатора BKCa-каналов, позволяют сделать заключение о том, что в брыжеечных ЛУ крыс в физиологических условиях экспрессируются BKCa-каналы, которые оказывают влияние на сократительную функцию гладкомышечных клеток капсулы ЛУ. Их активация или блокирование сопровождаются достоверными изменениями тонуса ЛУ: релаксацией или повышением тонуса соответственно. Достоверные различия в амплитудах сокращения или релаксации ЛУ крыс контрольной группы и крыс групп CLP1 и CLP2 являются доказательством (хотя и косвенным) сверхэкспрессии BKCa-каналов в гладкомышечных клетках капсулы ЛУ при сепсисе. Необходимо отметить, что сверхэкспрессия BKCa-каналов в гладкомышечных клетках капсулы ЛУ септических крыс продолжала нарастать по мере прогрессирования сепсиса (реакции ЛУ крыс группы CLP2 на применение блокатора или активатора BKCa-каналов были более выраженными по сравнению с ЛУ крыс группы CLP1). Мы не изучали сигнальные механизмы, посредством которых NO активирует BKCa-каналы гладкомышечных клеток ЛУ, но из литературы известно, что NO может активировать BKCa-каналы посредством фосфорилирования каналов или прямым, независимым от циклического цГМФ способом [54].
Таким образом, проведенное исследование позволило установить, что при моделировании сепсиса у крыс воспаление сопровождается увеличением растяжимости капсулы ЛУ, что способствует их ремоделированию и гипертрофии. Одним из механизмов, приводящих к релаксации капсулы ЛУ, является экспрессия в ЛУ индуцибельной NO-синтазы, продуцирующей значительные количества оксида азота. Синтез NO приводит к расслаблению гладкомышечных клеток капсулы ЛУ посредством сверхэкспрессии и активации двух видов К+-каналов: КАТР- и BKCa-каналов. Блокатор КАТР-каналов глибенкламид приводил к повышению тонуса ЛУ во всех группах крыс, при этом прирост тонуса в ЛУ крыс CLP был достоверно большим по сравнению с ЛУ крыс контрольной группы. Применение селективного блокатора BKCa-каналов NS 1619 сопровождалось выраженной релаксацией ЛУ крыс всех групп. Расслабление ЛУ крыс CLP было более выраженным по сравнению с ЛУ крыс контрольной группы. В перспективе КАТР- и BKCa-каналы гладкомышечных клеток капсулы ЛУ могут явиться потенциальной мишенью для терапевтического воздействия с целью коррекции иммунного ответа посредством замедления или ускорения потока лимфы через ЛУ.
Список литературы
Roe K (2021) An inflammation classification system using cytokine parameters. Scand J Immunol 93(2): e12970. https://doi.org/10.1111/sji.12970
Schmid-Schönbein GW (2006) Analysis of inflammation. Annu Rev Biomed Eng 8: 93–131. https://doi.org/10.1146/annurev.bioeng.8.061505.095708
Yeung YT, Aziz F, Guerrero-Castilla A, Arguelles S (2018) Signaling Pathways in Inflammation and Anti-inflammatory Therapies. Curr Pharm Des 24(14): 1449–1484. https://doi.org/10.2174/1381612824666180327165604
Robinson N, Ganesan R, Hegedűs C, Kovács K, Kufer TA, Virág L (2019) Programmed necrotic cell death of macrophages: Focus on pyroptosis, necroptosis, and parthanatos. Redox Biol 26: 101239. https://doi.org/10.1016/j.redox.2019.101239
Лобов ГИ (2023) Иммунная функция лимфатической системы. Успехи физиол наук 54(3): 3–24 [Lobov GI (2023) Immune function of the lymphatic system. Advanc Physiol Sci 54(3): 3–24. (In Russ)]. https://doi.org/10.31857/S0301179823030049
Kesler CT, Liao S, Munn LL, Padera TP (2013) Lymphatic vessels in health and disease. Wiley Interdiscip Rev Syst Biol Med 5(1): 111–124. https://doi.org/10.1002/wsbm.1201
Thierry GR, Gentek R, Bajenoff M (2019) Remodeling of reactive lymph nodes: Dynamics of stromal cells and underlying chemokine signaling. Immunol Rev 289(1): 42–61. https://doi.org/10.1111/imr.12750
Chang JE, Turley SJ (2015) Stromal infrastructure of the lymph node and coordination of immunity. Trends Immunol 36(1): 30–39. https://doi.org/10.1016/j.it.2014.11.003
Lobov GI, Pan’kova MN, Abdreshov SN (2015) Transport function of the lymph nodes in young and old animals. Adv Gerontol 28(4): 681–686.
Ikomi F, Kousai A, Ono N, Ohhashi T (2002) Electrical stimulation-induced alpha1- and alpha2-adrenoceptors-mediated contractions of isolated canine lymph nodes. Auton Neurosci 96(2): 85–92. https://doi.org/10.1016/s1566-0702(01)00363-0
Lobov GI, Pan’kova MN (2011) Mechanical properties of lymph node capsule. Bull Exp Biol Med 151(1): 5. https://doi.org/10.1007/s10517
Pastukhova IA (1986) Myocytes of the inguinal lymph nodes. Arkh Anat Gistol Embriol 90(6): 32–37.
Lobov GI (2021) Role of Endogenous Hydrogen Sulfide in Relaxation of the Lymph Node Capsule in LPS induced Inflammation. J Evol Biochem Physiol 57(6): 1363–1372. https://doi.org/10.1134/S0022093021060156
Lobov GI (2022) Contractile Function of the Capsule of the Bovine Mesenteric Lymph Nodes at the Early Stage of Inflammation. J Evol Biochem Physiol 58(6): 2109–2123. https://doi.org/10.1134/S0022093022060370
Gao Y, Yang Y, Guan Q, Pang X, Zhang H, Zeng D (2010) IL-1beta modulate the Ca2+-activated big-conductance K channels (BK) via reactive oxygen species in cultured rat aorta smooth muscle cells. Mol Cell Biochem 338(1–2): 59–68. https://doi.org/10.1007/s11010-009-0338-4
Wu K, Zhao L, Wang Y, Liu P, Cheng S, Yang X, Wang Y, Zhu Y (2023) Mechanism of large-conductance calcium-activated potassium channel involved in inflammatory response in sepsis. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 35(5): 469–475. https://doi.org/10.3760/cma.j.cn121430-20220314-00240
Chen SJ, Wu CC, Yang SN, Lin CI, Yen MH (2000) Abnormal activation of K+ channels in aortic smooth muscle of rats with endotoxic shock: electrophysiological and functional evidence. Br J Pharmacol 131(2): 213–222. https://doi.org/10.1038/sj.bjp.0703564
Cotton KD, Hollywood MA, McHale NG, Thornbury KD (1997) Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol 503 (Pt 1): 1–11. https://doi.org/10.1111/j.1469-7793.1997.001bi.x
von der Weid PY, Rehal S, Dyrda P, Lee S, Mathias R, Rahman M, Roizes S, Imtiaz MS (2012) Mechanisms of VIP-induced inhibition of the lymphatic vessel pump. J Physiol 590(11): 2677–2691. https://doi.org/10.1113/jphysiol.2012.230599
Wu TF, Carati CJ, Macnaughton WK, von der Weid PY (2006) Contractile activity of lymphatic vessels is altered in the TNBS model of guinea pig ileitis. Am J Physiol Gastrointest Liver Physiol 291(4): G566– G574. https://doi.org/10.1152/ajpgi.00058.2006
Groneberg D, Konig P, Wirth A, Offermanns S, Koesling D, Friebe A. (2010) Smooth muscle-specific deletion of nitric oxide-sensitive guanylyl cyclase is sufficient to induce hypertension in mice. Circulation 121: 401–409.
Zhang LM, Niu CY, Zhao ZG, Si YH, Zhang YP (2012) ATP-sensitive potassium channel involved in modulation of nitride oxide regulating contractile activity of isolated lymphatics from hemorrhagic shock rats. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue 8: 457–460.
Meisheri KD, Khan SA, Martin JL (1993) Vascular pharmacology of ATP-sensitive K+ channels: Interactions between glyburide and K+ channel openers. J Vasc Res 30: 2–12.
Hotchkiss RS, Moldawer LL, Opal SM, Reinhart K, Turnbull IR, Vincent JL (2016) Sepsis and septic shock. Nat Rev Dis Primers 2: 16045. https://doi.org/10.1038/nrdp.2016.45
Cauwels A, Brouckaert P (2008) Critical role for small and large conductance calcium-dependent potassium channels in endotoxemia and TNF toxicity. Shock 29: 577–582. https://doi.org/10.1097/shk.0b013e31815071e9
Garcia LF, Singh V, Mireles B, Dwivedi AK, Walker WE (2023) Common Variables That Influence Sepsis Mortality in Mice. J Inflamm Res 16: 1121–1134. https://doi.org/10.2147/JIR.S400115
Dasoveanu DC, Shipman WD, Chia JJ, Chyou S, Lu TT (2016) Regulation of lymph node vascular-stromal compartment by dendritic cells. Trends Immunol 37: 764–777. https://doi.org/10.1016/j.it.2016.08.013
Aldrich MB, Sevick-Muraca EM (2013) Cytokines are systemic effectors of lymphatic function in acute inflammation. Cytokine 64(1): 362–369. https://doi.org/10.1016/j.cyto.2013.05.015
Косарева МЕ, Чивильдеев АВ, Лобов ГИ (2023) Сепсис-индуцированное ингибирование сократительной функции лимфатических узлов. Бюл экспер биол мед 176(9): 280–285. [Kosareva ME, Chivildeev AV, Lobov GI (2023) Sepsis-induced inhibition of contractile function of lymph nodes. Bull Exp Biol Med 176(9): 280–285. (In Russ)]. https://doi.org/10.47056/0365-9615-2023-176-9-280-285
Shirasawa Y, Ikomi F, Ohhashi T (2000) Physiological roles of endogenous nitric oxide in lymphatic pump activity of rat mesentery in vivo. Am J Physiol Gastrointest Liver Physiol 278(4): G551–G556. https://doi.org/10.1152/ajpgi.2000.278.4.G551
von der Weid PY, Zhao J, Van Helden DF (2001) Nitric oxide decreases pacemaker activity in lymphatic vessels of guinea pig mesentery. Am J Physiol Heart Circ Physiol 280(6): H2707–H2716. https://doi.org/10.1152/ajpheart.2001.280.6.H2707
Лобов ГИ, Панькова МН (2010) NO-зависимая модуляция сократительной функции гладких мышц капсулы лимфатических узлов. Рос физиол журн им ИМ Сеченова 96(5): 489–497. [Lobov GI, Pan’kova MN (2010) NO-dependent modulation of the contractile function of smooth muscles of the lymph node capsule. Russ J Physiol 96(5): 489–497. (In Russ)].
Fernandes D, Sordi R, Pacheco LK, Nardi GM, Heckert BT, Villela CG, Lobo AR, Barja-Fidalgo C, Assreuy J (2009) Late, but not early, inhibition of soluble guanylate cyclase decreases mortality in a rat sepsis model. J Pharmacol Exp Ther 328(3): 991–999. https://doi.org/10.1124/jpet.108.142034
Adachi T, Weisbrod RM, Pimentel DR, Ying J, Sharov VS, Schöneich C, Cohen RA (2004) S-Glutathiolation by peroxynitrite activates SERCA during arterial relaxation by nitric oxide. Nat Med 10(11): 1200–1207. https://doi.org/10.1038/nm1119
Zhao YJ, Wang J, Rubin LJ, Yuan XJ (1997) Inhibition of K(V) and K(Ca) channels antagonizes NO-induced relaxation in pulmonary artery. Am J Physiol 272(2 Pt 2): H904–H912. https://doi.org/10.1152/ajpheart.1997.272.2.H904
Buckley JF, Singer M, Clapp LH (2006) Role of KATP channels in sepsis. Cardiovasc Res 72(2): 220–230. https://doi.org/10.1016/j.cardiores.2006.07.011
Davis MJ, Kim HJ, Nichols CG (2022) KATP channels in lymphatic function. Am J Physiol Cell Physiol 323(4): C1018–C1035. https://doi.org/10.1152/ajpcell.00137.2022
van de Pavert SA, Mebius RE (2014) Development of secondary lymphoid organs in relation to lymphatic vasculature. Adv Anat Embryol Cell Biol 214: 81–91. https://doi.org/10.1007/978-3-7091-1646-3_7
von der Weid PY (1998) ATP-sensitive K+ channels in smooth muscle cells of guinea-pig mesenteric lymphatics: role in nitric oxide and beta-adrenoceptor agonist-induced hyperpolarizations. Br J Pharmacol 125(1): 17–22. https://doi.org/10.1038/sj.bjp.0702026
Garner BR, Stolarz AJ, Stuckey D, Sarimollaoglu M, Liu Y, Palade PT, Rusch NJ, Mu S (2021) KATP Channel Openers Inhibit Lymphatic Contractions and Lymph Flow as a Possible Mechanism of Peripheral Edema. J Pharmacol Exp Ther 376(1): 40–50. https://doi.org/10.1124/jpet.120.000121
Mathias R, von der Weid PY (2013) Involvement of the NO-cGMP-K(ATP) channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol 304(6): G623–G634. https://doi.org/10.1152/ajpgi.00392.2012
Shi W, Cui N, Wu Z, Yang Y, Zhang S, Gai H, Zhu D, Jiang C (2009) Lipopolysaccharides up-regulate Kir6.1/SUR2B channel expression and enhance vascular KATP channel activity via NF-kappaB-dependent signaling. J Biol Chem 285: 3021–3029. https://doi.org/10.1074/jbc.M109.058313
Ghatta S, Nimmagadda D, Xu X, O’Rourke ST (2006) Large-conductance, calcium-activated potassium channels: structural and functional implications. Pharmacol Ther 110(1): 103–116. https://doi.org/10.1016/j.pharmthera.2005.10.007
Hu XQ, Zhang L (2012) Function and regulation of large conductance Ca2+-activated K+ channel in vascular smooth muscle cells. Drug Discov Today 17: 974–987. https://doi.org/10.1016/j.drudis.2012.04.002
Wang Y, Zhang HT, Su XL, Deng XL, Yuan BX, Zhang W, Wang XF, Yang YB (2010) Experimental diabetes mellitus down-regulates large-conductance Ca2+-activated K+ channels in cerebral artery smooth muscle and alters functional conductance. Curr Neurovasc Res 7(2): 75–84. https://doi.org/10.2174/156720210791184925
Pabbidi MR, Roman RJ (2017) Elevated K+ channel activity opposes vasoconstrictor response to serotonin in cerebral arteries of the fawn hooded hypertensive rat. Physiol Genom 49: 27–36. https://doi.org/10.1152/physiolgenomics.00072.2016
Mistry DK, Garland CJ (1998) Nitric oxide (NO)-induced activation of large conductance Ca2+-dependent K+ channels (BK(Ca) in smooth muscle cells isolated from the rat mesenteric artery. Br J Pharmacol 124(6): 1131–1140. https://doi.org/10.1038/sj.bjp.0701940
Kimmoun A, Ducrocq N, Levy B (2013) Mechanisms of vascular hyporesponsiveness in septic shock. Curr Vasc Pharmacol 11(2): 139–149.
Kim HJ, Li M, Nichols CG, Davis MJ (2021) Large-conductance calcium-activated K+ channels, rather than KATP channels, mediate the inhibitory effects of nitric oxide on mouse lymphatic pumping. Br J Pharmacol 178(20): 4119–4136. https://doi.org/10.1111/bph.15602
Telinius N, Kim S, Pilegaard H, Pahle E, Nielsen J, Hjortdal V, Aalkjaer C, Boedtkjer DB (2014) The contribution of K+ channels to human thoracic duct contractility. Am J Physiol Heart Circ Physiol 307(1): H33–H43. https://doi.org/10.1152/ajpheart.00921.201
Heginbotham L, MacKinnon R (1992) The aromatic binding site for tetraethylammonium ion on potassium channels. Neuron 8: 483–491. https://doi.org/10.1016/0896-6273(92)90276-j
Ruiz Rubio JL, Hernández M, Rivera de los Arcos L, Benedito S, Recio P, García P, García-Sacristán A, Prieto D (2004) At a concentration selective for calcium-activated K(KCa) channels (3 mM), tetraethylammonium inhibited rolipram responses but not those of PGE1. Role of ATP-sensitive K+ channels in relaxation of penile resistance arteries. Urology 63(4): 800–805. https://doi.org/10.1016/j.urology.2003.10.071
Armstead WM, Hecker JG (2005) Heat shock protein modulation of KATP and KCa channel cerebrovasodilation after brain injury. Am J Physiol Heart Circ Physiol 289(3): H1184–H1190. https://doi.org/10.1152/ajpheart.00276.2005
Bolotina VM, Najibi S, Palacino JJ, Pagano PJ, Cohen RA (1994) Nitric oxide directly activates calcium-dependent potassium channels in vascular smooth muscle cells. Nature 368: 850–853. https://doi.org/10.1038/368850a0
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


