Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 12, стр. 1847-1855
Влияние антигистаминных препаратов на поведенческую активность Danio rerio
А. В. Жданов 1, 3, *, М. В. Комелькова 1, М. А. Горбунова 3, С. Л. Хацко 2, 3, А. П. Сарапульцев 1, А. В. Калуев 3, 4, 5, 6, 7
1 Южно-Уральский государственный университет
Челябинск, Россия
2 Уральский федеральный аграрный научно-исследовательский центр Уральского отделения
Российской академии наук
Екатеринбург, Россия
3 Уральский федеральный университет им. первого президента России Б.Н. Ельцина
Екатеринбург, Россия
4 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
5 Национальный медицинский исследовательский центр им. В.А. Алмазова МЗ РФ
Санкт-Петербург, Россия
6 Российский научный центр радиологии и хирургической технологии им. акад. А.М. Гранова МЗ РФ
Санкт-Петербург, Россия
7 Научно-технологический университет Сириус
Сочи, Россия
* E-mail: sanya.zhdanov.1996@mail.ru
Поступила в редакцию 02.08.2023
После доработки 17.10.2023
Принята к публикации 19.10.2023
- EDN: CEVVEE
- DOI: 10.31857/S0869813923120154
Аннотация
Гистаминовые рецепторы играют важную физиологическую роль в организме –от участия в аллергических реакциях до регуляции памяти и сна, что делает их важной мишенью для создания новых средств терапии. Поскольку антигистаминные препараты первого поколения обладают мощными антихолинергическими и антисеротониновыми побочными эффектами, в клинике им на смену пришли более узконаправленные препараты второго поколения, лишенные многих побочных эффектов. Несмотря на успешное применение на грызунах и людях, тестирование этих препаратов на более широком круге модельных организмов может улучшить понимание их физиологической активности и скорректировать разработку новых препаратов, действующих на этот тип рецепторов. Одним из удобных объектов исследования являются рыбы зебраданио (zebrafish, Danio rerio) благодаря своей доступности и высокому физиологическому и генетическому сходству с человеком. В работе оценивали влияние хлоропирамина (антигистаминного препарата первого поколения) и препаратов второго поколения (лоратадина и цетиризина) в концентрациях 1, 5 и 10 мг/л на поведение зебраданио в тесте нового аквариума. В целом хлоропирамин и лоратадин оказали седативное влияние, характерное для антигистаминных препаратов, в то время как цетеризин снижал только двигательную активность, но не нарушал другие паттерны поведения рыб. Таким образом, цетиризин показал наименьшее побочное влияние на ЦНС, что делает его наиболее оптимальным и безопасным выбором среди рассматриваемых антигистаминных препаратов.
ВВЕДЕНИЕ
Гистамин и гистаминовые рецепторы опосредуют различные важные функции в организме, включая участие в аллергических реакциях, контроль за эмоциями и регуляцию памяти и сна [1–6]. Поэтому различные гистаминовые рецепторы давно являются мишенью для лекарств и играют важную роль в здоровье человека, например, в иммунной регуляции и контроле анафилактического воспаления [7–9]. В различных тканях известно как минимум четыре рецептора к гистамину, однако большинство проявлений гиперчувствительности немедленного типа и аллергических реакций происходит при участии рецептора Н1 [10, 11]. С момента успешной разработки первого препарата в 1937 г. антигистаминные средства претерпели усовершенствования в виде препаратов первого и второго поколения [12].
Первые классические антагонисты H1-рецепторов представляют собой антигистаминные препараты первого поколения [13]. Они легко проникают через гематоэнцефалический барьер и связываются с гистаминовыми рецепторами в центральной нервной системе (ЦНС), вызывая галлюцинации, сонливость, беспокойство, бессонницу и другие побочные реакции [14]. H1-антигистаминные препараты второго поколения, по сравнению с первым поколением, редко проникают через гематоэнцефалический барьер и избирательно связываются с периферическими H1-рецепторами, вызывая слабые (либо не вызывая) побочные эффекты на ЦНС [15]. Тем не менее данные препараты могут стимулировать повышенный аппетит и приводить к увеличению веса, а также имеют некоторую степень кардиотоксичности [16]. В целом антигистаминные препараты обычно используются при состояниях, не угрожающих жизни, что создало необходимость тщательной проверки безопасности и постоянному совершенствованию данной категории препаратов. Тестирование антигистаминных препаратов в трансляционных исследованиях с использованием экспериментальных животных [17, 18] позволяет подтвердить эффективность уже существующих препаратов и улучшить разработку новых средств, действующих на Н1-рецепторы. Одним из удобных модельных организмов для таких исследований могут стать рыбы зебраданио (zebrafish, Danio rerio), широко использующиеся в нейробиологических и физиологических исследованиях.
Благодаря легко дифференцируемым поведенческим паттернам и возможности проведения экспериментов с большим количеством животных, зебраданио стали удобной платформой для исследований нейротропных лекарственных средств и препаратов-кандидатов [19]. Система гистаминергических нейронов в мозге зебраданио организована так же, как и у большинства других позвоночных животных, и сосредоточена в каудальном отделе гипоталамуса с проекциями почти во все отделы мозга. На сегодняшний момент у зебраданио идентифицировано три из четырех рецептора к гистамину (HRH1, HRH2 и HRH3), которые помимо головного мозга также экспрессируются в кишечнике, печени, селезенке, жабрах, сердце и глазах [20]. Цель настоящего исследования – оценить воздействие антигистаминных препаратов хлоропирамина, лоратадина и цетиризина в концентрациях 1, 5 и 10 мг/л на поведение рыб зебраданио.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполняли на 82 взрослых (возраст 3–5 мес.) короткоплавниковых рыбах данио дикого типа (соотношение самцов и самок ~50 : 50), которые были получены от коммерческого дистрибьютора (ООО “Комета”, Пермь, Россия) и содержались в помещении для водных животных в Уральском федеральном университете. Перед экспериментом животные адаптировались не менее 14 дней к лабораторным условиям и содержались в одном 40-литровом пластиковом аквариуме (высота 45 × 40 длина × 30 ширина, см). Аквариум был заполнен отфильтрованной системной водой с температурой 25°C, pH 6.8–7.2, уровнем аммиака <0.9 мг/л и уровнем нитратов <200 мг/л. Освещение (1000–1100 люкс) обеспечивалось потолочными люминесцентными лампами с 14/10-часовым циклом свет–темнота (включение 8:00) в соответствии с принятыми стандартами содержания и тестирования рыб данио [21]. Все животные, использованные в этом эксперименте, были экспериментально наивными и получали еду (Tetra GMBH, Оснабрюк, Германия) два раза в день.
Исследуемые антигистаминные препараты хлоропирамин (“Супрастин”, ЗАО “Фармацевтический завод ЭГИС”, Будапешт, Венгрия), лоратадин (“Лоратадин-Вертекс”, АО “ВЕРТЕКС”, Санкт-Петербург, Россия) и цетиризин (“Цетрин”, Д-р Редди’с Лабораторис Лтд., Индия), являясь безрецептурными препаратами, были получены из аптеки “Живика” в городе Екатеринбурге. В день эксперимента рыбы случайным образом были разделены на 10 групп: контроль (n = 8) и опытные группы с воздействием хлоропирамином, лоратадином и цетиризином в концентрациях 1, 5 и 10 мг/л (n = 8–10). Выбор концентраций веществ в эксперименте основан на рекомендациях по применению препаратов и их терапевтической дозе для человека. Каждая навеска исследуемых препаратов диспергировалась в 1 мл ДМСО и затем вводилась в экспозиционный аквариум емкостью 1 л, в который поочередно подсаживались особи зебраданио. Рыбы из контрольной группы также подсаживались в экспозиционный аквариум, куда добавлялся 1 мл ДМСО. По истечении 20 мин, которых согласно инструкции достаточно для всасывания и развития антигистаминного эффекта препарата, рыбы далее помещались в тестовые аквариумы и снимались на видеокамеру в течение 5 мин (рис. 1). После каждой съемки в тестовых аквариумах проводилась замены воды. Вода из экспозиционного аквариума с растворенным в ней препаратом также заменялась через каждые 4 рыбы [22].
Тест нового аквариума
Тест нового аквариума является широко известной методикой оценки поведения рыб, активно применяющийся в скрининге различных физиологически активных веществ [23, 24]. Аппарат представляет собой стеклянный аквариум (высота 20 × длина 15 × ширина 5, см), заполненный водой и разделенный горизонтальной маркерной линией снаружи на две равные зоны (рис. 1). Методика аналогична тесту “открытого поля” для грызунов, где животных помещают в новые, ранее незнакомые для них условия. Идея данного теста строится на тенденции зебраданио в первую минуту тестирования тратить 70–85% времени в нижней трети аквариума. Данное поведение чувствительно к широкому спектру препаратов (флуоксетин, диазепам, буспирон, циталопрам, этанол и др.), воздействующие на опиоидные, дофаминовые, серотониновые, холинергические и адренергические рецепторы и процессы ЦНС [25].
Данные видео-трекинга обрабатывались вручную с помощью программного обеспечения RealTimer (ООО “Открытая наука”, Красногорск, Россия), где оценивали частоту, общую продолжительность (с) и латентный период (с) выхода в верхнюю и нижнюю части аквариума, замирание (неподвижность >2 с), атаксию (потеря положения тела и/или координации движений – лежание на боку, плавание на боку, плавание штопором) и число эрратических (беспорядочных) движений в соответствии с описанием в поведенческом каталоге по зебраданио [26]. Видео также анализировалось с помощью программного обеспечения Etho-VisionXT17 (Noldus IT, Вагенинген, Нидерланды), где оценивалась двигательная активность рыб по общему пройденному расстоянию (м), средней скорости движения (м/с) и максимальному ускорению (м/с2).
Все данные представлены как среднее ± стандартная ошибка среднего и проанализированы однофакторным дисперсионным анализом с предварительной проверкой выборки на нормальность распределения (критерий Шапиро–Уилка) и попарным сравнением апостериорным тестом Даннетта (табл. 1). Во всех анализах значимость была установлена на уровне p < 0.05.
Таблица 1.
Статистические данные по эффектам антигистаминных препаратов на поведение взрослых зебраданио в тесте новый аквариум (cм. рис. 2)
| Поведенческий паттерн | Данные статистического критерия | Уровень значимости |
|---|---|---|
| Число выходов в верхнюю часть аквариума | F = 6.56 | p < 0.001 |
| Длительность нахождения в верхней части аквариума | F = 8.81 | p < 0.001 |
| Время первого выхода в верхнюю часть аквариума | F = 6.17 | p < 0.001 |
| Число беспорядочных движений | F = 4.04 | p < 0.001 |
| Частота актов замираний | F = 2.27 | p < 0.03 |
| Длительность актов замираний | F = 32.00 | p < 0.001 |
| Пройденное расстояние | F = 14.97 | p < 0.001 |
| Средняя скорость | F = 14.90 | p < 0.001 |
| Максимальное ускорение | F = 1.93 | p = 0.06 |
| Частота актов атаксии | F = 11.17 | p < 0.001 |
| Длительность актов атаксии | F = 5.91 | p < 0.001 |
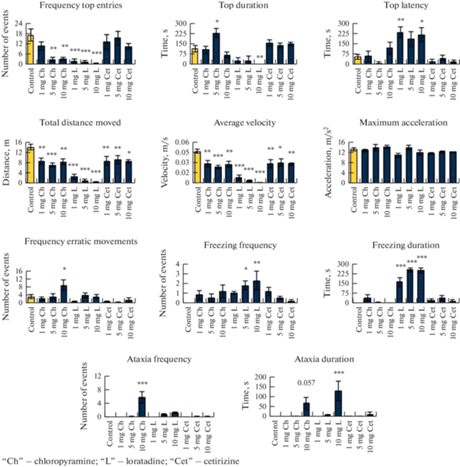
Рис. 2.
Поведенческие эффекты антигистаминных препаратов на взрослых зебраданио в тесте новый аквариум (cм. Детали статистики в табл. 1).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для частоты выхода наверх в тесте нового аквариума отмечен значимый эффект препарата (табл. 1), отмечается его уменьшение в группах c хлоропирамином в концентрации 5 и 10 мг/л и группах с лоратадином во всех концентрациях при сравнении с контролем (рис. 1). В группе с лоратадином также отмечается значимое уменьшение суммарной длительности выхода наверх в концентрации 10 мг/л и увеличение времени латентного периода выхода наверх в концентрации 1 и 10 мг/л при сравнении с контролем. Дополнительно в группе хлоропирамина в концентрации 5 мг/л наблюдается значимое увеличение суммарной длительности выхода наверх по сравнению с контролем. Таким образом, препараты хлоропирамин в концентрации 5 и 10 мг/л и лоратадин во всех трех концентрациях уменьшают показатель выхода наверх, а также повышают его латентный период первого выхода наверх, т.е. вызывают седацию и уменьшают их общую активность. При этом седация в группе с лоратадином стойко проявляется с первой концентрации в отличие от группы с хлопирамином, где эффект проявляется только при высоких дозах препарата (рис. 1).
При рассмотрении двигательной активности рыб отмечается значимое уменьшение показателя пройденного пути и средней скорости во всех опытных группах по сравнению с контролем, что также подтверждает наличие седации (табл. 1). На рис. 1 приведены частоты беспорядочных движений рыб, наблюдается их значимое увеличение в группе с хлоропирамином в концентрации 10 мг/л по сравнению с контролем, что свидетельствует о нарушениях обычных паттернов поведения у опытных зебраданио.
Анализ распределения замираний (рис. 1) показывает увеличение их частоты в группах с лоратадином в концентрациях 5 и 10 мг/л по сравнению с контролем, а также значимое увеличение суммарной длительности замираний в группе с лоратадином, но уже во всех трех концентрациях по сравнению с контрольной группой. Таким образом, лоратадин во всех трех концентрациях значимо увеличивает показатель замираний, что согласуется с эффектом седации.
Из-за наличия седации у тестируемых препаратов в работе также был произведен подсчет актов атаксии, который показал значимое увеличение частоты и суммарной длительности в группах с хлоропирамином и лоратадином в концентрации 10 мг/л по сравнению с контролем (рис. 1). Наличие атаксии в высоких дозах хлоропирамина и лоратадина может говорить о нарушении координации движений и острой неспецифической токсичности у зебраданио.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе исследования было выявлено, что хлоропирамин в концентрации 10 мг/л оказывает седативный эффект на поведение зебраданио в тесте нового аквариума и значимо снижает показатель выхода наверх, двигательную и исследовательскую активность рыб. В той же концентрации хлоропирамин вызывает нарушение координации движений, что характерно для всех антигистаминных препаратов первого поколения и сопоставляется с результатами на грызунах и клиническими испытаниями на человеке [14, 27, 28]. При этом антигистаминный препарат второго поколения лоратадин также оказал седативный эффект на поведение зебраданио, но помимо уменьшения показателя выхода наверх и двигательной активности, препарат еще увеличивал частоту и длительность замираний. Более того, седативный эффект лоратадина проявляется уже с первой рассматриваемой концентрации в 1 мг/л, а в концентрации 10 мг/л, как и хлоропирамин, вызывает атаксию. Согласно данным литературы, лоратадин не оказывает серьезного влияния на ЦНС, тем не менее допускается появление сонливости и седации у некоторых пациентов и детей уже в терапевтических дозах препарата, что мы и можем наблюдать у рыб зебраданио [15].
Наконец, антигистаминный препаратов цетиризин не оказал значимого влияния на поведение рыб кроме снижения двигательной активности, что согласуется с результатами клинических испытаний [15, 29] и делает его наиболее оптимальным и безопасным антигистаминным препаратом в нашем исследовании.
ЗАКЛЮЧЕНИЕ
Несмотря на высокую степень безопасности и многочисленные клинические испытания антигистаминных препаратов, их дальнейшее изучение и тестирование на новых модельных организмах может дать новые представления об эффективности и побочных реакциях на ЦНС. Рассматриваемые антигистаминные препараты, за исключением цетеризина, вызвали у зебраданио выраженный нейротропный побочный эффект, что согласуется с клиническими результатами испытаний на человеке и результатами испытаний на других животных моделях (в частности, рекомендуемыми терапевтическими дозировками для взрослых у хлоропирамина является 25 мг, лоратадина и цетиризина 10 мг). Таким образом, зебраданио ввиду своей более высокой фармакологической чувствительности выявили возможное наличие неблагоприятных эффектов у лоратадина уже в низкой, не терапевтической дозировке, что ранее не наблюдалось в других экспериментах. Данное исследование подтверждает необходимость введения многосторонних трансляционных доклинических испытаний со множеством видов животных, а также создает предпосылки для изучения более безопасных ангистаминных препаратов как находящихся сегодня на рынке, так и новых препаратов на их основе.
Список литературы
Brown RE, Stevens DR, Haas HL (2001) The physiology of brain histamine. Progress Neurobiol 63: 637–672. https://doi.org/10.1016/S0301-0082(00)00039-3
Haas H, Panula P (2003) The role of histamine and the tuberomamillary nucleus in the nervous system. Nature Rev Neurosci 4: 121–130. https://doi.org/10.1038/nrn1034
Panula P (2021) Histamine receptors, agonists, and antagonists in health and disease. Handbook Clin Neurol 180: 377–387. https://doi.org/10.1016/B978-0-12-820107-7.00023-9
Schwartz JC (1991) Histaminergic transmission in the mammalian brain. Physiol Rev 71: 1–51. https://doi.org/10.1152/physrev.1991.71.1.1
Siegel GJ, Albers RW (1994) Basic neurochemistry: molecular, cellular, and medical aspects. Raven Press.
Thurmond RL, Gelfand EW, Dunford PJ (2008) The role of histamine H1 and H4 receptors in allergic inflammation: the search for new antihistamines. Nature Rev Drug Discov 7: 41–53. https://doi.org/10.1038/nrd2465
Akdis CA, Blaser K (2003) Histamine in the immune regulation of allergic inflammation. J Allergy Clin Immunol 112: 15–22. https://doi.org/10.1067/mai.2003.1585
Leurs R (2011) En route to new blockbuster anti-histamines: surveying the offspring of the expanding histamine receptor family. Trends Pharmacol Sci 32: 250–257. https://doi.org/10.1016/j.tips.2011.02.004
Tiligada E (2009) Histamine H3 and H4 receptors as novel drug targets. Expert Opin Invest Drugs 18: 1519–1531. https://doi.org/10.1517/14728220903188438
Golightly LK, Greos LS (2005) Second-generation antihistamines: actions and efficacy in the management of allergic disorders. Drugs 65: 341–384. https://doi.org/10.2165/00003495-200565030-00004
Liu C (2001) Cloning and pharmacological characterization of a fourth histamine receptor (H4) expressed in bone marrow. Mol Pharmacol 59: 420–426. https://doi.org/10.1124/mol.59.3.420
Emanuel M (1999) Histamine and the antiallergic antihistamines: a history of their discoveries. Clin Exp Allergy 29: 1–11. https://doi.org/10.1046/j.1365-2222.1999.00004.x-i1
Simons FER, Simons KJ (2011) Histamine and H1-antihistamines: celebrating a century of progress. J Allergy Clin Immunol 128: 1139–1150. https://doi.org/10.1016/j.jaci.2011.09.005
Okamura N (2000) Functional neuroimaging of cognition impaired by a classical antihistamine, d-chlorpheniramine. Br J Pharmacol 129: 115. https://doi.org/10.1038/sj.bjp.0702994
Yanai K (2017) The clinical pharmacology of non-sedating antihistamines. Pharmacol Therap 178: 148–156. https://doi.org/10.1016/j.pharmthera.2017.04.004
Taglialatela M, Timmerman H, Annunziato L (2000) Cardiotoxic potential and CNS effects of first-generation antihistamines. Trends Pharmacol Sci 21: 52–56. https://doi.org/10.1016/s0165-6147(99)01437-6
Peitsaro N (2003) Modulation of the histaminergic system and behaviour by α-fluoromethylhistidine in zebrafish. J Neurochem 86: 432–441. https://doi.org/10.1046/j.1471-4159.2003.01850.x
Leung LC (2019) Neural signatures of sleep in zebrafish. Nature 571: 198–204. https://doi.org/10.1038/s41586-019-1336-7
Rosa JGS, Lima C, Lopes-Ferreira M (2022) Zebrafish larvae behavior models as a tool for drug screenings and pre-clinical trials: a review. Int J Mol Sci 23: 6647. https://doi.org/10.3390/ijms23126647
Peitsaro N (2007) Identification of zebrafish histamine H1, H2 and H3 receptors and effects of histaminergic ligands on behavior. Biochem Pharmacol 73: 1205–1214. https://doi.org/10.1016/j.bcp.2007.01.014
Sanders GE (2012) Zebrafish housing, husbandry, health, and care: IACUC considerations. ILAR J 53: 205–207. https://doi.org/10.1093/ilar.53.2.205
Maximino C (2010) Measuring anxiety in zebrafish: a critical review. Behav Brain Res 214: 157–171. https://doi.org/10.1016/j.bbr.2010.05.031
Egan RJ (2009) Understanding behavioral and physiological phenotypes of stress and anxiety in zebrafish. Behav Brain Res 205: 38–44. https://doi.org/10.1016/j.bbr.2009.06.022
Robinson KS (2013) Psychopharmacological effects of acute exposure to kynurenic acid (KYNA) in zebrafish. Pharmacol Biochem Behav 108: 54–60. https://doi.org/10.1016/j.pbb.2013.04.002
Cachat JM (2011) Modeling Stress and Anxiety in Zebrafish. In: Kalueff A, Cachat J Zebrafish Models in Neurobehavioral Research. Neuromethods 52 Humana Press. Totowa. NJ. https://doi.org/10.1007/978-1-60761-922-2_3
Kalueff AV (2013) Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish 10: 70–86. https://doi.org/10.1089/zeb.2012.0861
Church M (2010) Risk of first-generation H1-antihistamines: a GA2LEN position paper. Allergy 65: 459–466. https://doi.org/10.1111/j.1398-9995.2009.02325.x
Gray SL (2015) Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA Int Med 175: 401–407. https://doi.org/10.1001/jamainternmed.2014.7663
Timmerman H (2000) Factors involved in the absence of sedative effects by the second-generation antihistamines. Allergy Suppl 60: 5–10. https://doi.org/10.1034/j.1398-9995.2000.055supp60005.x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова