Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 2, стр. 192-213
Влияние инсулина на спайковую активность нейронов супрахиазматического ядра и функциональное состояние афферентных входов из аркуатного ядра крыс
А. Н. Инюшкин 1, *, К. А. Мистрюгов 2, О. В. Ледяева 1, И. Д. Романова 1, Т. С. Исакова 1, А. А. Инюшкин 1
1 Самарский национальный исследовательский университет им. академика С.П. Королева
Самара, Россия
2 Самарский государственный медицинский университет
Самара, Россия
* E-mail: ainyushkin@mail.ru
Поступила в редакцию 19.11.2022
После доработки 06.01.2023
Принята к публикации 09.01.2023
- EDN: NDNZUL
- DOI: 10.31857/S086981392302005X
Аннотация
В экспериментах на сагиттальных срезах гипоталамуса крыс-самцов Вистар изучали влияние 15 нМ инсулина на уровень спайковой активности, параметры спайкового кодирования информации нейронами супрахиазматического ядра и функциональное состояние афферентных входов к этим нейронам из аркуатного ядра. Аппликации инсулина приводили к снижению частоты генерации потенциалов действия и росту энтропии распределения межспайковых интервалов у 33.3% зарегистрированных нейронов, у 12% клеток наблюдались реакции противоположной направленности, показатели спайковой активности остальных 54.7% нейронов не изменялись. Наблюдавшиеся реакции энтропии распределения межспайковых интервалов свидетельствуют о соответствующих изменениях степени нерегулярности межспайковых интервалов под влиянием инсулина. Характеристику афферентных входов к нейронам супрахиазматического ядра из аркуатного ядра производили с помощью электрофизиологической техники построения и анализа перистимульной временной гистограммы. Статистически значимые реакции на стимуляцию аркуатного ядра зарегистрированы у 24 из 38 протестированных нейронов супрахиазматического ядра. Из них у 6 нейронов реакция протекала в виде коротколатентного (<20 мс) возбуждения, у 1 нейрона – в виде длиннолатентного возбуждения, у 6 нейронов – в виде коротколатентного торможения, у 11 нейронов наблюдались комплексные двух- и трехфазные реакции в виде различных сочетаний возбуждения и торможения. Аппликации 15 нМ инсулина вызвали качественное изменение реакций (в виде исчезновения исходных или появления новых реакций) у 5 нейронов, первоначально отвечавших на стимуляцию, и у 1 нейрона, первоначально не отвечавшего на стимуляцию аркуатного ядра. Статистически значимых количественных изменений латентного периода и продолжительности реакций под влиянием инсулина не обнаружено. Полученные результаты указывают на способность инсулина оказывать влияние на уровень активности и спайковый код относительно многочисленной популяции нейронов циркадианного осциллятора супрахиазматического ядра, а также модулировать функциональное состояние афферентных входов к циркадианному осциллятору из гипоталамического аркуатного ядра, играющего важную роль в регуляции аппетита и метаболизма.
ВВЕДЕНИЕ
В настоящее время хорошо известно, что все разнообразие околосуточных ритмов регулируются биологическими часами гипоталамического супрахиазматического ядра, генерирующими собственный эндогенный циркадианный ритм [1, 2]. Однако период ритма супрахиазматического циркадианного осциллятора редко соответствует 24 ч, а потому нуждается в синхронизации с суточным ритмом окружающего мира. Кроме основного, фотического механизма синхронизации [3], в циркадианной системе млекопитающих используются и другие механизмы настройки биологических часов. В частности, роль времязадателя выполняет информация о режиме питания, составе и калорийности пищи. В рамках данного механизма синхронизации в качестве носителей сигнала используются метаболические и гормональные регуляторы, а биологические часы супрахиазматического ядра регулируют суточный паттерн обмена питательных веществ и энергии [4–6].
Потенциальным регулятором, принимающим участие в синхронизации циркадианного осциллятора супрахиазматического ядра в соответствии с пищевой мотивацией, является гормон инсулин. Ранее в электрофизиологическом исследовании in vitro было показано, что инсулин оказывает преимущественно угнетающее влияние на активность клеток супрахиазматического ядра у крыс [7]. Существенный недостаток этой работы заключался в том, что ее авторы выполнили количественную оценку изменений единственного “традиционного” показателя активности нейронов – средней частоты генерации спайков. Такой подход к характеристике биоэлектрической активности нейронов нельзя считать полным, поскольку многие важные аспекты кодирования информации остаются вне поля зрения. Между тем в нашем исследовании на крысах in vivo [8] было продемонстрировано существование в нейронах циркадианного осциллятора суточного ритма показателей спайкового кода. До сих пор возможное влияние инсулина на спайковое кодирование информации нейронами циркадианного осциллятора оставалось неизученным. Вместе с тем известно о способности некоторых гормонов и нейропептидов, участвующих в формировании пищевой мотивации (лептина и нейропептида Y), модулировать параметры спайковой активности клеток супрахиазматического ядра [9, 10].
Поскольку блокада синаптической передачи не препятствовала проявлению влияния инсулина на активность нейронов супрахиазматического ядра [7], есть основания предполагать, что эффекты этого гормона обусловлены в первую очередь его непосредственным воздействием на эти нейроны. Такая возможность хорошо согласуется с данными об экспрессии рецепторов инсулина и инсулиноподобного фактора роста (IGF-1) в этом ядре [11, 12]. В то же время нельзя исключить существования опосредованного действия этого гормона, определяющегося его возможной модуляцией афферентных входов в супрахиазматическое ядро из других структур. Прежде всего такой структурой может служить расположенное непосредственно каудальнее супрахиазматического ядра аркуатное ядро. Данное ядро, играющее важнейшую роль в регуляции аппетита и метаболизма [13], отвечает за реализацию значительной части центральных эффектов инсулина через инсулиновые и IGF-1 рецепторы [14, 15]. Морфологической основой взаимодействия между клетками аркуатного и супрахиазматического ядер являются реципрокные связи между ними, обнаруженные с использованием электрофизиологических и нейрохимических методов [16–19].
В настоящей работе, выполненной на срезах гипоталамуса крыс, изучены особенности влияния инсулина на спайковую активность нейронов супрахиазматического ядра и осуществлена экспериментальная проверка способности инсулина модулировать функциональное состояние афферентных входов из аркуатного ядра к клеткам супрахиазматического ядра.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 28 крысах-самцах Вистар массой тела 80–140 г. Животных содержали в условиях вивария при режиме освещения в виде регулярной смены 12-часовых светлых и темных периодов и свободном доступе к пище и воде.
В начале эксперимента крыс наркотизировали уретаном (Sigma-Aldrich, США, 1.2 г/кг массы тела внутрибрюшинно) и декапитировали. Из полости черепа извлекали головной мозг, быстро охлаждали в искусственной цереброспинальной жидкости при температуре 1–3°С, после чего с помощью вибратома (NVSL, World Precision Instruments, США) готовили сагиттальные срезы гипоталамуса толщиной 300 мкм, включающие супрахиазматическое и аркуатное ядро. Искусственная цереброспинальная жидкость содержала (мМ) 124 NaCl, 25 NaHCO3, 3 KCl, 1.5 CaCl2, 1 MgSO4, 0.5 NaH2PO4, 10 глюкозы. После изготовления срезы по меньшей мере в течение часа инкубировали в насыщенной карбогеном (95% О2 и 5% СО2) искусственной цереброспинальной жидкости при температуре 37°С до начала регистрации. Для регистрации спайковой активности нейронов срезы переносили в камеру из органического стекла, смонтированную на антивибрационном столике (Vibraplane, США). Камеру перфузировали искусственной цереброспинальной жидкостью, насыщенной карбогеном, с постоянной скоростью 1.5 мл/мин с помощью перистальтической помпы (Minipuls 3, Gilson, Франция). Регистрацию производили при температуре 27–30°С.
Спайковую активность нейронов супрахиазматического ядра регистрировали внеклеточно с помощью стеклянных микроэлектродов с диаметром кончика около 1 мкм, заполненных искусственной цереброспинальной жидкостью того же состава. Сигнал от микроэлектрода усиливали (Dagan 2400A, США), устраняли шум частотой 50 Гц (Hum Bug; Quest Scientific, Канада), отцифровывали (Micro 1401, CED, Великобритания) и подавали на персональный компьютер. Для визуализации сигнала, хранения и первичной обработки данных использовали программный пакет Spike 2 (CED, Великобритания).
В первой серии экспериментов регистрировали реакции параметров спайковой активности нейронов супрахиазматичского ядра (n = 75) на аппликации 15 нМ инсулина (Актрапид НМ, NOVO NORDISK, Дания) в перфузионный раствор. При выборе используемой концентрации инсулина мы ориентировались на данные о содержании этого вещества в цереброспинальной жидкости крысы [20], а также на сведения об эффективных концентрациях инсулина, ранее использованных при изучении его центральной активности другими исследователями [7, 14, 21–25]. Регистрацию активности нейронов производили в светлое время суток (в период с 10 до 20 ч). После появления спайковой активности в исходном состоянии наблюдали за стабильностью частоты потенциалов действия в течение 10 мин. При отсутствии видимой тенденции к нарушению постоянства этого показателя перфузию меняли на раствор того же состава с добавлением инсулина на 10 мин, а затем возвращались к исходному раствору на 15 мин для отмывания среза от исследуемого вещества. С целью исключения возможной десенситизации, на каждый срез производили однократную аппликацию инсулина.
Процесс обработки данных о спайковой активности был детально описан ранее [10]. Первым этапом обработки было тщательное выделение всех зарегистрированных спайков из шума и артефактов, которое выполнялось с помощью компьютерной программы LabSpike [26]. Использование данной программы, в частности, позволяло удостовериться, что источником всех зарегистрированных спайков является один и тот же нейрон. Наряду с расчетом основного “традиционного” параметра электрической активности нейронов – средней частоты генерации спайков, вычисляли два параметра, характеризующих спайковое кодирование информации: энтропию распределения межспайковых интервалов, характеризующую степень нерегулярности генерации потенциалов действия, и обоюдную информацию между сопряженными межспайковыми интервалами, отражающую паттернирование спайковой информации [8, 26].
Для оценки эффектов инсулина сравнивали значение параметров спайковой активности в течение двух пятиминутных интервалов времени: в исходном состоянии (непосредственно перед аппликацией) и в конце периода аппликации. Нейронами, реагирующими на воздействие инсулина, считались лишь те, у которых частота генерации спайков изменялась под влиянием этого гормона не менее чем на 20% от исходной [27]. Для определения степени восстановления активности нейрона анализировали параметры спайковой активности в течение заключительного пятиминутного периода отмывания среза и сравнивали с исходной активностью (перед аппликацией).
Во второй серии экспериментов изучали способность инсулина модулировать функциональное состояние афферентных входов к нейронам супрахиазматического ядра из гипоталамического аркуатного ядра. Для этого регистрировали реакции спайковой активности нейронов супрахиазматического ядра (n = 38) на электростимуляцию вентромедиальной области аркуатного ядра, нейроны которой являются источником проекций в супрахиазматическое ядро [17]. Для стимуляции использовали биполярный электрод из нержавеющей стали (диаметр 100 мкм, межэлектродное расстояние 200 мкм). Стимуляцию осуществляли единичными двуфазными прямоугольными импульсами с частотой 1 Гц, амплитудой 200 мкА и продолжительностью 1 мс (продолжительность положительной и следующей непосредственно за ней отрицательной фазы была одинакова и составляла 0.5 мс). Генерацию стимулирующих импульсов производили с помощью электростимулятора Model 2100 (A-M Systems, США). Расстояние между стимулирующим электродом и районом регистрации спайковой активности составляло 2.5–3 мм.
Протокол регистрации активности нейронов супрахиазматического ядра во второй серии экспериментов был аналогичным первой серии, однако аппликация каждого раствора заканчивалась периодом электростимуляции аркуатного ядра. Вначале регистрировали реакцию нейрона на электростимуляцию аркуатного ядра в исходном состоянии (в условиях перфузии среза искусственной цереброспинальной жидкостью). Затем апплицировали в перфузионный раствор инсулин в концентрации 15 нМ на 10 мин, после чего вновь производили электростимуляцию аркуатного ядра на фоне действия инсулина. Наконец снова переключали перфузию на искусственную цереброспинальную жидкость для отмывания среза от инсулина в течение 15 мин и проводили заключительный тест со стимуляцией аркуатного ядра.
На основании полученных данных строили и анализировали перистимульные временные гистограммы (PSTH), по которым определяли характер и выраженность реакций нейронов на стимуляцию. Данная электрофизиологическая техника основана на представлении о том, что сверхпороговый стимул закономерно вызывает генерацию спайка в аксонах, афферентных по отношению к регистрируемой клетке, и что стимуляции подвергается локальная область, прилегающая к кончику стимулирующего электрода (менее 140 мкм от места стимуляции [28]). Гистограмма строилась путем суммации данных об индивидуальных моментах генерации спайков в пределах каждого 1-секундного интервала от предыдущего до последующего стимула за весь период стимуляции [29], составлявший, в зависимости от уровня спайковой активности клетки, от 100 до 400 с. Для определения моментов начала 1-секундных циклов при построении гистограмм в качестве триггера использовали информацию, содержащуюся в канале артефактов стимуляции.
Полученные экспериментальные данные подвергали статистической обработке. Для сравнения значений исследуемых показателей в ходе экспериментальных воздействий с исходным состоянием использовали парный t-тест или ранговый тест Уилкоксона (в случае несоответствия распределения данных в выборках нормальному). Нормальность распределения данных в выборках проверяли с помощью теста Шапиро–Уилка, однородность дисперсий – с помощью теста Левена. Статистические данные о параметрах спайковой активности нейронов в исходном состоянии представлены как средние арифметические ± стандартные ошибки среднего. Изменения исследуемых параметров считались статистически значимыми при р < 0.05. При обработке перистимульных временных гистограмм применялась процедура кумулятивного суммирования [30], дающая возможность идентифицировать малые различия в вероятности генерации спайков в постстимульный период относительно контрольного периода, в качестве которого использовали 200 мс, непосредственно предшествующих стимулу. Реакции возбуждения или торможения идентифицировали по статистически значимому росту или снижению суммарного количества спайков в каждом из интервалов продолжительностью 2 мс, расположенных вслед за моментом стимула, по сравнению с контролем. Статистически значимыми при анализе перистимульных временных гистограмм считали лишь те реакции, где уровень р в непарном t-тесте или ранговом тесте Манна–Уитни составлял p < 0.02 [28].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние 15 нМ инсулина на параметры спайковой активности нейронов супрахиазматического ядра
Реакции параметров спайковой активности на воздействие инсулина изучены на 75 нейронах супрахиазматического ядра. Для всей этой группы нейронов частота генерации потенциалов действия составила 2.55 ± 0.26 с–1, энтропия распределения межспайковых интервалов равнялась 6.59 ± 0.10 бит, а обоюдная информация между сопряженными межспайковыми интервалами составила 0.060 ± 0.013 бит.
Аппликации 15 нМ инсулина в перфузионный раствор вызвали изменение частоты генерации потенциалов действия у 34 из 75 (45.3%) протестированных нейронов супрахиазматического ядра. Остальные нейроны (41 из 75; 54.7%) не изменяли уровень спайковой активности под влиянием инсулина.
У 25 из 75 нейронов (33.3%) реакции на воздействие инсулина характеризовались снижением частоты генерации спайков. Примеры реакций на аппликацию инсулина в виде снижения уровня спайковой активности у нейронов супрахиазматического ядра показаны на рис. 1. Медиана частоты спайков у нейронов данной группы снизилась с 1.34 с–1 в исходном состоянии до 0.43 с–1 в присутствии инсулина (р < 0.001). Характерной особенностью реакций этих клеток на аппликацию инсулина был рост энтропии распределения межспайковых интервалов с 6.73 ± 0.19 до 7.26 ± 0.21 бит (р < 0.01), что свидетельствует о повышении степени нерегулярности генерации спайков. Статистически значимых изменений обоюдной информации между сопряженными межспайковыми интервалами обнаружено не было, несмотря на умеренную тенденцию к увеличению данного показателя, значение которого составило 0.086 ± 0.031 бит в исходном состоянии и 0.111 ± 0.045 бит при воздействии инсулина (р = 0.41). Реакции нейронов супрахиазматического ядра противоположной направленности, в виде повышения уровня биоэлектрической активности, на воздействие 15 нМ инсулина зарегистрированы в 9 случаях из 75 (12.0%). Статистический анализ с использованием z-теста показал, что такие реакции на аппликации инсулина встречались реже, чем реакции в виде снижения активности (р < 0.01). Рост уровня активности клеток проявлялся в повышении медианы частоты генерации потенциалов действия с 0.47 до 0.89 с–1 (р < 0.01). Одновременно с повышением уровня спайковой активности у данной группы нейронов при воздействии инсулина наблюдалось небольшое, но статистически значимое снижение медианы энтропии распределения межспайковых интервалов с 6.85 до 6.65 бит (р < 0.05). Изменений обоюдной информации между сопряженными межспайковыми интервалами обнаружено не было (р = 1.00), а значение медианы данного показателя и в исходном состоянии, и в период действия инсулина оказалось равным нулю.
Рис. 1.
Примеры реакций двух нейронов (Cell 1, Cell 2) супрахиазматического ядра на аппликацию 15 нМ инсулина. Для обоих нейронов в верхней части рисунка представлены гистограммы с данными об изменениях уровня спайковой активности клеток по ходу эксперимента. Период аппликации инсулина показан горизонтальным отрезком над гистограммой. По оси абсцисс – время в секундах (момент начала аппликации соответствует 0), по оси ординат – частота генерации спайков (с-1). Горизонтальным отрезкам под гистограммой (a и b) соответствуют 50-секундные интервалы записи спайковой активности для первого нейрона, и 100-секундные интервалы записи для второго нейрона, представленные под гистограммой: (a) – непосредственно перед воздействием, (b) – в конце аппликации инсулина.

Анализ реакций на воздействие инсулина всех 75 протестированных нейронов как единой группы также выявил статистически значимые изменения показателей спайковой активности клеток супрахиазматического ядра. Медиана частоты генерации спайков снижалась под влиянием инсулина с 1.56 до 1.37 с–1 (р < 0.001). Одновременно с этим наблюдалось увеличение степени нерегулярности спайков, что отражалось в небольшом, но статистически значимом росте медианы энтропии распределения межспайковых интервалов с 6.67 до 6.79 бит (р < 0.05). В то же время обоюдная информация между сопряженными межспайковыми интервалами не изменялась (р = 0.44). Медиана этого показателя равнялась нулю и в исходном состоянии и после аппликации инсулина, что отражает отсутствие паттернирования информации в спайковом коде в данных экспериментальных условиях.
Статистические данные об изменениях показателей спайковой активности под влиянием инсулина у вышеописанных групп клеток представлены на рис. 2.
Рис. 2.
Влияние 15 нМ инсулина на частоту генерации потенциалов действия, с–1 (левые диаграммы), энтропию распределения межспайковых интервалов, бит (средние диаграммы) и обоюдную информацию между сопряженными межспайковыми интервалами, бит (правые диаграммы) нейронов супрахиазматического ядра. (a) – нейроны, активность которых снижалась под влиянием инсулина (n = 25). (b) – нейроны, активность которых повышалась под влиянием инсулина (n = 9). (c) – вся совокупность зарегистрированных нейронов (n = 75). Обозначения под диаграммами: Before – исходное состояние; Insulin – на фоне действия инсулина; Washout – после отмывания среза искусственной цереброспинальной жидкостью. Звездочками отмечены статистически значимые различия с исходным состоянием: *p < 0.05; **p < 0.01; ***p < 0.001.
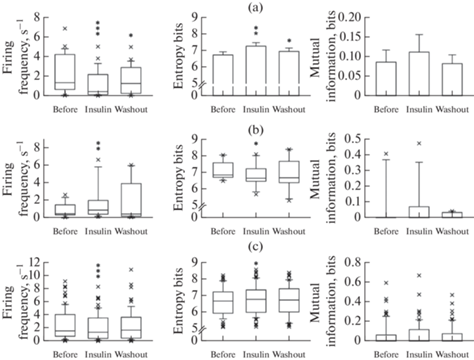
Реакции нейронов супрахиазматического ядра на воздействие инсулина характеризовались полной или частичной обратимостью. На рис. 2 отчетливо прослеживается тенденция к восстановлению исходной величины всех исследуемых параметров после отмывания среза.
Влияние 15 нМ инсулина на функциональное состояние синаптических входов к нейронам супрахиазматического ядра из аркуатного ядра
В настоящей работе охарактеризованы реакции на стимуляцию вентромедиальной области аркуатного ядра 38 нейронов супрахиазматического ядра. Статистически значимые реакции на стимуляцию (р < 0.02) в исходном состоянии (до аппликации инсулина) зарегистрированы у 24 протестированных клеток из (63.2%), у остальных 13 нейронов (34.2%) ответных реакций на стимуляцию не обнаружено. В числе реакций на стимуляцию наблюдались простые монофазные ответы (возбуждение или торможение) и комплексные реакции в форме разнообразных сочетаний возбуждения и торможения.
6 из 38 (15.8%) нейронов супрахиазматического ядра демонстрировали ответные реакции на стимуляцию в форме коротколатентного (<20 мс) ортодромного возбуждения. Реакции данного типа характеризовались пиком на перистимульных временных гистограммах (рис. 3a, левая и центральная гистограммы). Пик располагался на коротком расстоянии от момента стимула, после чего наблюдался постепенно снижающийся до контрольного уровня “хвост”. Местоположение пика на гистограмме соответствует моменту наибольшей вероятности генерации спайков постсинаптической клеткой супрахиазматического ядра, а продолжительность “хвоста” соответствует периоду, в течение которого сохраняется повышенная вероятность генерации спайков. В одном случае реакция на стимуляцию протекала в форме длиннолатентного возбуждения (рис. 3a, правая гистограмма). В данном случае на перистимульной временной гистограмме вместо единственного пика наблюдалась относительно продолжительная область роста активности, которая начиналась спустя значительный латентный период после стимула. Эта область соответствует по продолжительности интервалу времени, характеризующемуся повышенной вероятностью генерации потенциалов действия постсинаптической клеткой супрахиазматического ядра. В 6 случаях (15.8%) реакция супрахиазматических нейронов на стимуляцию аркуатного ядра протекала в форме коротколатентного (<20 мс) ортодромного торможения (рис. 3b). Этот тип реакции находил отражение в характерной форме перистимульной временной гистограммы с “провалом”, располагавшемся на коротком расстоянии от момента стимула, после чего происходило постепенное восстановление активности до контрольного уровня. Область “провала” соответствует периоду сниженной вероятности генерации спайков исследуемым нейроном супрахиазматического ядра.
Рис. 3.
Примеры перистимульных временных гистограмм нейронов супрахиазматического ядра при стимуляции аркуатного ядра. (a) – ортодромное возбуждение: слева и в центре – коротколатентное, справа – длиннолатентное. (b) - ортодромное коротколатентное торможение. (c) – комплексные реакции: слева – коротколатентное ортодромное возбуждение и ортодромное торможение; в центре – коротколатентное ортодромное торможение и ортодромное возбуждение; справа – коротколатентное ортодромное возбуждение, ортодромное торможение и длиннолатентное ортодромное возбуждение. По оси абсцисс – время, мс (отметка “0” соответствует моменту стимула); по оси ординат – суммарное количество спайков за каждый 2-миллисекундный интервал времени.
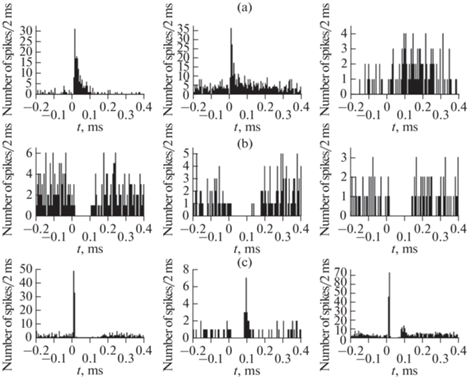
В 11 случаях (28.9%) зарегистрированы комплексные реакции на стимуляцию аркуатного ядра. Такие реакции состояли из различных сочетаний возбуждения и торможения. Наиболее часто (у 6 нейронов; 15.8%) комплекс включал коротколатентное ортодромное возбуждение и последующее ортодромное торможение. Характерный пример реакции данного типа представлен на рис. 3c (левая гистограмма). В одном случае нейрон супрахиазматического ядра ответил на стимуляцию аркуатного ядра ортодромным коротколатентным торможением с последующим ортодромным возбуждением (рис. 3c, центральная гистограмма). Один нейрон супрахиазматического ядра ответил на стимуляцию комплексной реакцией, которая состояла из двух ортодромных возбуждений – коротколатентного и длиннолатентного (рис. 3b), при этом уровень активности в интервале между двумя фазами возбуждения (28 мс) не отличался от контроля (р = 0.21). В одном случае ответная реакция на стимуляцию аркуатного ядра протекала в три фазы: ортодромного коротколатентного и длиннолатентного возбуждения, между которыми имело место ортодромное торможение (рис. 3c).
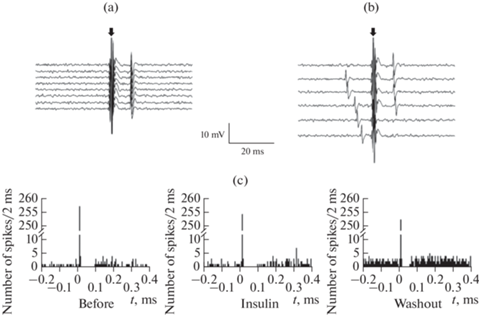
У 2 из 38 (5.3%) исследованных нейронов супрахиазматического ядра наблюдалась комплексная реакция на стимуляцию аркуатного ядра в форме антидромного возбуждения с последующим ортодромным торможением (рис. 4). В условиях использования стабильных параметров сверхпороговых стимулов наиболее важным признаком антидромного возбуждения является устойчивая генерация спайков с постоянным коротким латентным периодом (рис. 4a). Это находит свое отражение в характерной форме перистимульной временной гистограммы в форме узкого высокого пика, который располагается на коротком расстоянии от момента стимула (рис. 4c). Такая форма гистограммы свидетельствует о постоянстве латентного периода генерации спайков при антидромной стимуляции. Дополнительным признаком антидромного возбуждения служит явление коллизии – увеличенная продолжительность латентного периода или отсутствие антидромного спайка в тех случаях, когда момент появления спонтанного спайка приходится на период, непосредственно предшествующий стимулу (рис. 4b). При этом генерация антидромного спайка не происходит по причине того, что момент его потенциальной генерации совпадает с рефрактерной фазой, следующей за спонтанным спайком. У двух нейронов, демонстрировавших реакцию данного типа, латентный период генерации антидромных спайков при стимуляции аркуатного ядра составил 10.70 ± 0.11 мс (n = 126 спайков) и 10.20 ± 0.02 мс (n = 257 спайков).
Рис. 4.
Влияние 15 нМ инсулина на перистимульную временную гистограмму нейрона супрахиазматического ядра в виде реакции антидромного возбуждения с последующим ортодромным торможением на стимуляцию аркуатного ядра. (a) – фрагменты нейронограмм в области артефактов стимуляции (отмечены стрелкой) в исходном состоянии. Суперпозиция нейронограмм с 8 последовательными стимулами показывает постоянство латентного периода вызванного спайка. (b) – появление спонтанного спайка непосредственно перед моментом стимула приводит к удлинению латентного периода вызванного спайка или к полному исчезновению последнего (2 нижние нейронограммы) в соответствии с явлением коллизии. (c) – перистимульные временные гистограммы, суммирующие данные о реакциях на воздействие 270 последовательных стимулов в исходном состоянии (Before), на фоне действия инсулина (Insulin) и после 15-минутного отмывания среза искусственной цереброспинальной жидкостью (Washout). По оси абсцисс – время, мс (отметка “0” соответствует моменту стимула); по оси ординат – суммарное количество спайков за каждый 2-миллисекундный интервал времени.
Аппликации 15 нМ инсулина в ряде случаев приводили к качественным изменениям ответных реакций клеток супрахиазматического ядра на стимуляцию аркуатного ядра. Качественные изменения проявлялись в виде исчезновения исходной реакции (или ее фазы), либо в появлении новой. В отдельных наблюдениях после аппликации инсулина возникали количественные изменения, которые выражались в изменении латентного периода или продолжительности реакции, однако групповой анализ таких изменений показал, что они не достигали уровня статистической значимости.
В группе нейронов, отреагировавших коротколатентным ортодромным возбуждением на стимуляцию аркуатного ядра (n = 6), количественных изменений реакции на стимуляцию под влиянием инсулина выявлено не было. В исходном состоянии латентный период реакции составлял 11.7 ± 1.4 мс, а на фоне действия инсулина он равнялся 13.2 ± 2.3 мс (р = 0.46). Продолжительность ортодромного возбуждения, составившая в исходном состоянии 30.0 ± 11.1 мс, демонстрировала тенденцию к увеличению до 36.8 ± 21.0 мс, однако это изменение не достигло уровня статистической значимости (р = 0.33). Вместе с тем инсулин вызвал качественные изменения реакций на стимуляцию аркуатного ядра у двух нейронов этой группы. Так, нейрон, перистимульные временные гистораммы которого показаны на рис. 5a, в исходном состоянии отвечал на стимуляцию коротколатентным ортодромным возбуждением (p < 0.01). Однако в присутствии инсулина статистически значимого возбуждения у данного нейрона уже не наблюдалось (р = 0.07). После 15-минутного отмывания среза искусственной цереброспинальной жидкостью произошло восстановление реакции (p < 0.05). На гистограмме другого нейрона, отвечавшего в исходном состоянии на стимуляцию аркуатного ядра коротколатентным ортодромным возбуждением (р < 0.01), под действием инсулина появилась вторая, тормозная фаза реакции (р < 0.001); это привело к трансформации простой реакции в комплексную. Отмывание данного нейрона искусственной цереброспинальной жидкостью не вызвало полного восстановления исходного характера реакции на стимуляцию. Реакция по-прежнему сохранила черты комплексного ответа в виде коротколатентного ортодромного возбуждения (р < 0.001) с последующим торможением (р < 0.001).
Рис. 5.
Влияние 15 нМ инсулина на перистимульную временную гистограмму нейронов супрахиазматического ядра в виде реакций коротколатентного ортодромного возбуждения (a), отсутствия исходной реакции (b) и реакции коротколатентного ортодромного торможения (c) на стимуляцию аркуатного ядра. Представлены перистимульные временные гистограммы в исходном состоянии (Before), на фоне действия инсулина (Insulin) и после 15-минутного отмывания среза искусственной цереброспинальной жидкостью (Washout). По оси абсцисс – время, мс (отметка “0” соответствует моменту стимула); по оси ординат – суммарное количество спайков за каждый 2-миллисекундный интервал времени.
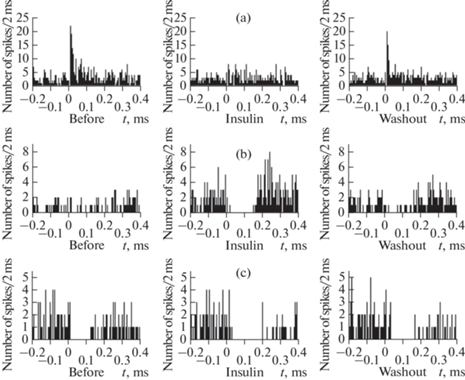
В группе из 6 нейронов, отвечавших на стимуляцию аркуатного ядра простой реакцией коротколатентного ортодромного торможения, воздействие инсулина не вызвало статистически значимых изменений параметров ортодромного торможения относительно их исходных значений. В присутствии инсулина наблюдалась лишь тенденция к увеличению латентного периода реакции, который составил 13.7 ± 1.0 мс в исходном состоянии и 17.3 ± 0.8 мс на фоне действия инсулина (р = 0.06). В исходном состоянии продолжительность торможения составляла 180.0 ± 56.4 мс, а при воздействии инсулина – 189.0 ± 55.4 мс (р = 0.41). Существенных качественных изменений ответной реакции клеток данной группы на стимуляцию под влиянием инсулина также не наблюдалось. Пример реакции нейрона, отвечавшего на стимуляцию аркуатного ядра коротколатентным ортодромным торможением, представлен на рис. 5c.
Наиболее часто (в 6 случаях) среди комплексных реакций нейронов супрахиазматического ядра на стимуляцию аркуатного ядра встречалось последовательное сочетание коротколатентного ортодромного возбуждения и ортодромного торможения. У двух клеток с таким типом реакции на стимуляцию воздействие инсулина привело к качественной трансформации ответа. У нейрона, перистимульные временные гистограммы которого представлены на рис. 6a, аппликация инсулина вызвала исчезновение первой фазы реакции – ортодромного возбуждения, при сохранении второй, тормозной фазы (р < 0.01). Отмывание среза в течение 15 мин искусственной цереброспинальной жидкостью привело к полному восстановлению фазы возбуждения (р < 0.01) и ее исходных параметров. В конце отмывания также сохранилась и последующая фаза торможения (р < 0.001). У другого нейрона, отвечавшего на стимуляцию аркуатного ядра аналогичной комплексной реакцией, воздействие инсулина привело к исчезновению обоих ее компонентов, причем в данном случае признаков восстановления исходной реакции не наблюдалось и после 15-минутного отмывания среза искусственной цереброспинальной жидкостью. У остальных 4 нейронов с данной формой комплексной реакции на стимуляцию инсулин не вызвал статистически значимых количественных и качественных изменений параметров (латентного периода и продолжительности) каждой из двух фаз реакции (р > 0.05).
Рис. 6.
Влияние 15 нМ инсулина на перистимульную временную гистограмму нейронов супрахиазматического ядра в виде комплексных реакций на стимуляцию аркуатного ядра: коротколатентного ортодромного возбуждения с последующим торможением (a), коротколатентного и длиннолатентного ортодромного возбуждения (b) и коротколатентного ортодромного возбуждения, торможения и длиннолатентного возбуждения (c). Представлены перистимульные временные гистограммы в исходном состоянии (Before), на фоне действия инсулина (Insulin) и после 15-минутного отмывания среза искусственной цереброспинальной жидкостью (Washout). По оси абсцисс – время, мс (отметка “0” соответствует моменту стимула); по оси ординат – суммарное количество спайков за каждый 2-миллисекундный интервал времени.

У двух нейронов супрахиазматического ядра комплексная реакция на стимуляцию аркуатного ядра состояла из начальной фазы антидромного возбуждения (р = 0.01) и последующей фазы (р < 0.001) ортодромного торможения (рис. 4c). В исходном состоянии латентный период генерации антидромных спайков этими нейронами при стимуляции аркуатного ядра составлял 10.7 ± 0.1 и 10.2 ± 0.02 мс. В период действия инсулина латентный период генерации антидромных спайков изменился незначительно (р > 0.05), составив соответственно 10.5 ± 0.1 и 10.1 ± 0.06 мс. Под действием инсулина параметры последующей фазы ортодромного торможения у данных нейронов также не претерпевали существенных изменений (рис. 4c).
У одного нейрона супрахиазматического ядра (рис. 3c, в центре) комплексная реакция на стимуляцию аркуатного ядра проявлялась в форме ортодромного коротколатентного торможения (р = 0.01) и последующего ортодромного возбуждения (р < 0.001). В присутствии инсулина наблюдались небольшие количественные изменения параметров реакции. Произошло укорочение на 2 мс латентного периода начальной тормозной фазы реакции и увеличение продолжительности этой фазы на 4 мс; латентный период последующей фазы комплексной реакции (ортодромного возбуждения) увеличился на 2 мс, тогда как ее продолжительность уменьшилась на 18 мс.
Один нейрон супрахиазматического ядра (рис. 6b) ответил на стимуляцию комплексной реакцией в виде сочетания двух ортодромных возбуждений – коротколатентного (р < 0.001) и длиннолатентного (р < 0.001). Под действием инсулина произошла качественная трансформация исходно двухфазной реакции в трехфазную за счет появления дополнительной фазы торможения (р < 0.001) в интервале между коротколатентным и длиннолатентным возбуждением. После 15-минутного отмывания среза искусственной цереброспинальной жидкостью качественного восстановления исходного характера комплексной реакции у данного нейрона не произошло, поэтому реакция по-прежнему осталась трехфазной.
Наконец, в исходном состоянии один нейрон супрахиазматического ядра (рис. 6c) ответил на стимуляцию аркуатного ядра трехфазной реакцией, включавшей коротколатентное ортодромное возбуждение (р < 0.001), ортодромное торможение (р < 0.001) и длиннолатентное ортодромное возбуждение (р < 0.001). На фоне действия инсулина наблюдались небольшие количественные изменения параметров второй и третьей фаз комплексной реакции, наиболее выраженным среди которых оказалось удлинение фазы ортодромного торможения на 14 мс.
У 14 (34.2%) протестированных нейронов супрахиазматического ядра статистически значимых ответных реакций на стимуляцию аркуатного ядра в исходном состоянии обнаружено не было (р > 0.05). У 13 из 14 нейронов этой группы признаков ответной реакции не обнаружено и в присутствии инсулина. Лишь у одного нейрона (рис. 5b), не демонстрировавшего реакции в исходном состоянии (р = 0.10), под влиянием инсулина отчетливо проявилось ортодромное торможение (р < 0.001), признаки которого сохранились и после 15-минутного отмывания среза искусственной цереброспинальной жидкостью (р < 0.001) несмотря на значительное уменьшение продолжительности реакции (на 74 мс).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В циркадианной системе млекопитающих для точной синхронизации ритма циркадианного осциллятора супрахиазматического ядра с 24-часовым ритмом окружающего мира используется целый ряд времязадателей. Наряду с основным, фотическим механизмом настройки [3], существуют и другие, нефотические механизмы синхронизации биологических часов. В рамках этих механизмов важную роль играют времязадатели, связанные с пищей: суточный режим приема пищи, ее состав и калорийность, метаболические сигналы и гормональные регуляторы, являющиеся носителями информации об уровне питательных веществ и метаболическом статусе [4–6], хотя физиологический механизм пищевой синхронизации циркадианной системы изучен недостаточно [31]. Гипотеза о независимом от супрахиазматического ядра осцилляторе, настраиваемом пищей (“food entrainable oscillator”, FEO, [5]), не нашла достаточных экспериментальных подтверждений, поскольку локализация такого осциллятора не установлена, и само существование его остается недоказанным.
В качестве одного из потенциальных времязадателей, связанных с пищей, рассматривается гормон инсулин. Ранее в нашем исследовании на крысах [32] было продемонстрировано, что интраназальное введение инсулина в специфическое время суток вызывает фазовое опережение циркадианного ритма произвольной локомоторной активности (бег в колесе). Недавно было установлено [33], что влияние инсулина и инсулиноподобного фактора роста (IGF-1) на фазу циркадианных часов проявляется как in vivo, так и in vitro, и может быт связано со стимуляцией синтеза протеина PER, вызванной активацией PIP3 и mTORC1 каскадов и подавлением микроРНК.
В настоящем электрофизиологическом исследовании изучались прямые и опосредованные механизмы влияния инсулина на спайковую активность нейронов супрахиазматического ядра крыс in vitro. В первой части настоящей работы изучено влияние инсулина на уровень спайковой активности и параметры спайкового кодирования информации нейронами супрахиазматического ядра in vitro. Использованный в настоящей работе подход к анализу спайковой активности, в соответствии с которым кроме частоты генерации потенциалов действия учитывались показатели спайкового кодирования информации (энтропия распределения межспайковых интервалов и обоюдная информация между сопряженными межспайковыми интервалами), позволил выполнить количественную оценку реакций нейронного кода на воздействие инсулина. Аппликация инсулина оказывала влияние на частоту генерации спайков у 45.3% нейронов супрахиазматического ядра, в остальных случаях существенных изменений активности клеток выявлено не было. Эти данные, по всей видимости, отражают значительную в количественном отношении долю нейронов супрахиазматического ядра, осуществляющих экспрессию рецепторов, способных взаимодействовать с инсулином. Такими рецепторами в этом ядре являются специфические рецепторы инсулина и инсулиноподобного фактора роста (IGF-1) [11, 12]. Преобладающим характером реакций, зарегистрированных в 33.3% случаев, оказалось снижение частоты генерации потенциалов действия. Лишь в 12.0% наблюдений происходил рост исходной частоты генерации потенциалов действия под влиянием инсулина. Этот результат согласуется с данными других авторов [7] о преимущественно угнетающем влиянии инсулина на спайковую активность нейронов супрахиазматического ядра, а также с данными об ингибирующем влиянии инсулина на активность нейронов других структур ЦНС, в частности, нейронов аркуатного ядра, продуцирующих агути-связанный пептид и нейропептид Y (AgRP/NPY) [21], и большинства нейронов этого ядра, продуцирующих проопиомеланокортин (POMK) [14], нейронов префронтальной коры [22] и гиппокампа [23]. Реже встречаются свидетельства противоположного, возбуждающего влияния инсулина, возникшего, в частности, при его воздействии на 11% проопиомеланокортиновых нейронов аркуатного ядра [14], нейроны инсулярной коры [24], дофаминергические нейроны вентральной области покрышки и черной субстанции [25]. В целом обнаруженные в настоящей работе различия в реакциях спайковой активности отдельных клеток могут, в частности, объясняться активацией различных типов мембранных рецепторов нейронов супрахиазматического ядра, включением в реакцию различных каскадов внутриклеточных посредников и нейрохимическим разнообразием клеток супрахиазматического ядра. Данное ядро отличается широким набором фенотипов нейронов, продуцирующих нейропептиды (вазопрессин, вазоактивный интестинальный пептид, калретинин, гастрин-рилизинг пептид и др.) и ГАМК [34].
Поскольку основой информации, передаваемой между нейронами ЦНС, является спайковый код [35], в рамках настоящей работы для оценки эффектов инсулина на уровне супрахиазматического ядра впервые использованы параметры кодирования информации, позволяющие более полно охарактеризовать реакции спайковой активности клеток. При этом одновременно со снижением уровня активности нейронов супрахиазматического ядра под влиянием инсулина происходил рост энтропии распределения межспайковых интервалов, тогда как изменений обоюдной информации между сопряженными межспайковыми интервалами обнаружено не было. Такой характер реакции свидетельствует о том, что под действием инсулина у данной популяции клеток возникал рост нерегулярности генерации потенциалов действия без существенного изменения степени паттернирования спайковой информации в нейронном коде. В то же время у меньшей по численности группы нейронов, уровень активности которых повышался под влиянием инсулина, наблюдалось снижение энтропии распределения межспайковых интервалов, указывающее на уменьшение степени нерегулярности генерации спайков. Таким образом, воздействие инсулина на уровень активности нейронов супрахиазматического ядра, независимо от направленности реакции, сопровождалось изменениями параметра спайкового кода, отражающего нерегулярность генерации потенциалов действия. Эти результаты могут указывать на фундаментальные различия между характеристиками популяций нейронов, демонстрировавших в условиях воздействия инсулина изменения спайковой активности противоположной направленности. В целом полученные данные свидетельствуют о том, что инсулин при непосредственном воздействии способен модулировать уровень активности и оказывать влияние на спайковый код относительно многочисленной популяции нейронов циркадианного осциллятора супрахиазматического ядра.
Во второй части настоящей работы in vitro с помощью электрофизиологической техники анализа перистимульной временной гистограммы изучено влияние инсулина на функциональное состояние афферентных входов к нейронам супрахиазматического ядра из аркуатного ядра. Известно, что аркуатное ядро, играющее важную роль в регуляции аппетита и метаболизма [13], опосредует значительную часть центральных эффектов инсулина через инсулиновые и IGF-1 рецепторы [14, 15]. Ранее в электрофизиологических и нейрохимических исследованиях, а также в работах, выполненных с использованием ретроградных трейсеров, было продемонстрировано существование реципрокных связей между нейронами аркуатного и супрахиазматического ядер [16–19, 36]. Имеются свидетельства того, что реципрокное взаимодействие между этими ядрами является необходимым условием экспрессии циркадианных ритмов [37, 38].
В настоящем исследовании более половины протестированных нейронов супрахиазматического ядра (63.2%) отвечали на стимуляцию аркуатного ядра простыми однофазными или комплексными реакциями. При этом в большинстве случаев реакции оказались коротколатентными (<20 мс). Эти результаты свидетельствуют о том, что большинство нейронов супрахиазматического ядра получают моно- и олигосинаптические проекции из подвергшегося стимуляции вентромедиального отдела аркуатного ядра. Следует заметить, что в интактном мозге количество таких проекций может быть даже более значительным, поскольку в электрофизиологическом исследовании in vivo [16] простые или комплексные реакции на стимуляцию аркуатного ядра были обнаружены у 48 из 56 нейронов супрахиазматического ядра (85.7%). В настоящей работе (так же, как и в исследовании in vivo [16]) коротколатентные реакции встречались гораздо чаще длиннолатентных, при этом количество коротколатентных реакций ортодромного возбуждения и торможения оказалось одинаковым. Это указывает на баланс между стимулирующим и ингибирующим влиянием на активность клеток супрахиазматического ядра со стороны аркуатного ядра. Данный каудальный вход может принимать участие в механизмах нефотической настройки циркадианного осциллятора в соответствии с уровнем энергообмена, режимом питания, выраженностью пищевой мотивации. Ранее была неоднократно продемонстрирована настройка циркадианного ритма экспрессии генов в супрахиазматическом ядре, поведенческих и физиологических циркадианных ритмов в соответствии с режимом питания, особенно в условиях сниженной калорийности пищи [39–41].
В 28.9% случаев стимуляция аркуатного ядра вызвала комплексные реакции нейронов супрахиазматического ядра, состоящие из нескольких фаз. Эти данные показывают, что значительная доля клеток супрахиазматического ядра получает два или более афферентных входа из области аркуатного ядра. Поскольку подавляющее большинство ответов характеризовалось коротким латентным периодом, данные афферентные проекции скорее всего являлись моно- или олигосинаптическими. Лишь в отдельных случаях в состав комплексных реакций входила фаза длиннолатентного возбуждения, свидетельствующая о том, что небольшая часть нейронов супрахиазматического ядра может дополнительно получать возбуждающую афферентацию из области аркуатного ядра через окольные полисинаптические проекции.
Ранее было показано, что нейронные связи между аркуатным и супрахиазматическим ядрами являются реципрокными [16–19, 36]. Существование эфферентных проекций нейронов супрахиазматического ядра в аркуатное ядро нашло подтверждение в двух экспериментах, в которых были зарегистрированы реакции антидромного возбуждения при стимуляции аркуатного ядра (рис. 4). Параметры этих реакций дают возможность ориентировочно судить о скорости аксонного проведения возбуждения между супрахиазматическим и аркуатным ядрами. Учитывая, что кратчайшее расстояние (по прямой) между стимулирующим и регистрирующим электродами составляло 2.5–3 мм, а латентный период антидромного возбуждения приблизительно равнялся 10.5 мс, расчетная скорость проведения возбуждения по аксонам в данных условиях должна была составить не менее 25–30 см/c. Принимая во внимание тот факт, что регистрация производилась при температуре на 7–10°С ниже физиологической, и учитывая данные об уменьшении скорости проведения приблизительно на 5% при снижении температуры на каждый градус в диапазоне температур 29–38°С [42], реальная скорость проведения нервных импульсов в данной области гипоталамуса in vivo может быть примерно на 35–50% выше. Такая скорость проведения характерна для немиелинизированных или тонких миелинизированных аксонов ЦНС млекопитающих [43].
В основе разнообразия ответных реакций нейронов супрахиазматического ядра на стимуляцию может лежать широкий набор нейрохимических фенотипов нейронов аркуатного ядра, служивших источником афферентных входов к исследованным нейронам. В частности, в составе проекций из вентромедиального отдела аркуатного ядра в супрахиазматическое ядро следуют аксоны нейронов, продуцирующих нейропептид Y, агути-связанный пептид (AgRP), проопиомеланокортин, ГАМК, кисспептин, соматолиберин (GHRH) и соматостатин [17, 19, 44].
Одной из задач настоящего исследования было изучение модулирующего влияния инсулина на функциональное состояние афферентных входов к нейронам супрахиазматического ядра из аркуатного ядра. Статистически значимых количественных изменений латентного периода и продолжительности возбуждающих или тормозных реакций нейронов супрахиазматического ядра на электростимуляцию аркуатного ядра в присутствии инсулина зарегистрировано не было. Вместе с тем в 6 случаях (16% протестированных нейронов супрахиазматического ядра) под влиянием инсулина произошла качественная трансформация реакции, заключавшаяся в исчезновении предсуществующей реакции или фазы комплексной реакции (3 нейрона) или в появлении дополнительной реакции или ее фазы (3 нейрона). Таким образом, полученные результаты являются экспериментальным подтверждением модулирующего влияния инсулина на функциональное состояние части афферентных входов, поступающих к нейронам супрахиазматического ядра из вентромедиальной области аркуатного ядра. В связи с этим особый интерес приобретают вопросы о месте приложения и механизмах модулирующего влияния инсулина. В данных экспериментальных условиях потенциально возможными представляются модуляция активности нейронов аркуатного ядра в области стимуляции, модуляция проведения потенциалов действия по аксонам, следующим из области стимуляции в супрахиазматическое ядро, либо модулирующее влияние на функциональное состояние синапсов, через которые к клеткам супрахиазматического ядра передается информация с окончаний афферентных волокон нейронов аркуатного ядра. Среди трех перечисленных возможностей наименее вероятным представляется влияние инсулина на механизмы проведения потенциалов действия по аксонам нейронов аркуатного ядра, во всяком случае в литературе отсутствуют данные о непосредственном влиянии инсулина на механизмы проведения спайков по аксонам в гипоталамусе. На отсутствие такого влияния инсулина косвенно указывают и данные двух экспериментов, выполненных в рамках настоящей работы, в которых было зарегистрировано антидромное возбуждение нейронов супрахиазматического ядра. В этих экспериментах инсулин не оказал существенного влияния на латентный период антидромного возбуждения, что свидетельствует об отсутствии изменений параметров аксонного проведения потенциалов действия в присутствии инсулина. Более вероятной выглядит возможность модулирующего влияния инсулина на уровне инсулиновых и IGF-1 рецепторов нейронов аркуатного ядра или постсинаптических структур супрахиазматического ядра. Ранее была продемонстрирована экспрессия инсулиновых и IGF-1 рецепторов в нейронах аркуатного ядра [14, 15]; через посредство этих рецепторов инсулин передает информацию о текущей потребности в пище и метаболическом статусе организма. Связывание инсулина с инсулиновыми и IGF-1 рецепторами, обладающими тирозинкиназной активностью, вызывает активацию двух основных сигнальных путей: PI3K/AKT и MAPK/ERK [45]. Нейроны супрахиазматического ядра также отличаются высоким уровнем экспрессии рецепторов инсулина и IGF-1, через посредство которых активируются PI3K/AKT и MAPK/ERK сигнальные пути [11, 12]. Тирозинкиназа β-субъединицы инсулиновых рецепторов нейронов супрахиазматического ядра может одновременно активироваться мелатонином (через МТ1/МТ2 рецепторы); это указывает на возможность взаимодействия мелатонина и инсулина на уровне данного ядра [11]. Результаты активации PI3K/AKT и MAPK/ERK сигнальных путей более подробно изучены на примере нейронов аркуатного ядра, где инсулин модулирует активность анорексигенных проопиомеланокортиновых (POMK) нейронов и орексигенных нейронов аркуатного ядра, продуцирующих агути-связанный пептид и нейропептид Y (AgRP/NPY) [21, 46–48]. На уровне POMK нейронов аркуатного ядра инсулин может оказывать как ингибирующее гиперполяризующее влияние за счет активации АТФ-зависимых K+ каналов [49, 50], так и возбуждающее деполяризующее влияние, опосредуемое активацией TRPC5 каналов [51]. Известно также, что инсулин способен активировать PIP3-киназу (но не МАР-киназу) AgRP/NPY нейронов аркуатного ядра, что приводит к росту амплитуды Са2+-активируемого калиевого тока высокой проводимости (ВК-ток), и, в свою очередь, вызывает рост биоэлектрической активности данных клеток [52]. Транскриптомные исследования аркуатного ядра выявили гетерогенность расположенных здесь нейронов и позволили идентифицировать субпопуляции POMK и AgRP клеток, демонстрирующие существенные различия в транскрипции при изменениях энергетического статуса организма [53–55]. Такая неоднородность, наряду с нейрохимическими и функциональными различиями между POMK и AgRP клетками, могла вносить свой вклад в обнаруженное в настоящей работе разнообразие реакций нейронов супрахиазматического ядра на стимуляцию аркуатного ядра.
Таким образом, результаты настоящей работы показывают, что эффекты инсулина не сводятся к непосредственному влиянию на уровень активности и параметры спайкового кодирования информации нейронами супрахиазматического ядра. Дополнительным механизмом влияния этого гормона на функциональное состояние циркадианного осциллятора является модуляция параметров афферентных входов из области аркуатного ядра, благодаря чему инсулин может вовлекаться в синхронизацию циркадианных биологических часов в соответствии с выраженностью пищевой мотивации и уровнем метаболизма.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все процедуры соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям комитета по биоэтике биологического факультета Самарского национального исследовательского университета им. академика С.П. Королева (протокол № 11 от 3.10.2013).
Список литературы
Арушанян ЭБ, Попов АВ (2011) Современные представления о роли супрахиазматических ядер гипоталамуса в организации суточного периодизма физиологических функций. Успехи физиол наук 42(4): 39–58. [Arushanian EB, Popov AV (2011) Recent data about the role of hypothalamic suprachiasmatic nucleus in circadian organization of physiological functions. Uspekhi Fiziol Nauk 42(4): 39–58. (In Russ)].
Hastings MH, Brancaccio M, Maywood ES (2014) Circadian pacemaking in cells and circuits of the suprachiasmatic nucleus. J Neuroendocrinol 26: 2–10. https://doi.org/10.1111/jne.12125
Ashton A, Foster RG, Jagannath A (2022) Photic entrainment of the circadian system. Int J Mol Sci 23: 729. https://doi.org/10.3390/ijms23020729
Kohsaka A, Bass J (2001) A sense of time: how molecular clocks organize metabolism. Trends Endocrinol Metab 18: 4–11. https://doi.org/10.1016/j.tem.2006.11.005
Mistlberger R (2009) Food-anticipatory circadian rhythms: concepts and methods. Eur J Neurosci 30: 1718–1729. https://doi.org/10.1111/j.1460-9568.2009.06965.x
Challet E, Mendoza J (2010) Metabolic and reward feeding synchronises the rhythmic brain. Cell Tissue Res 341: 1–11. https://doi.org/10.1007/s00441-010-1001-9
Shibata S, Liou SY, Ueki S, Oomura Y (1986) Inhibitory action of insulin on suprachiasmatic nucleus neurons in rat hypothalamic slice preparations. Physiol Behav 36: 79–81. https://doi.org/10.1016/0031-9384(86)90077-6
Bhumbra GS, Inyushkin AN, Saeb-Parsy K, Hon A, Dyball RED (2005) Rhythmic changes in spike coding in the rat suprachiasmatic nucleus. J Physiol 653: 291–307. https://doi.org/10.1113/jphysiol.2004.079848
Inyushkin AN, Bhumbra GS, Dyball RED (2009) Leptin modulates spike coding in the rat suprachiasmatic nucleus. J Neuroendocrinol 21: 705–714. https://doi.org/10.1111/j.1365-2826.2009.01889.x
Инюшкин АН, Петрова АА, Ткачева МА, Инюшкина ЕМ (2015) Влияние нейропептида Y на спайковую активность нейронов супрахиазматического ядра крыс in vitro. Рос физиол журн им ИМ Сеченова 101: 1257–1269. [Inyushkin AN, Petrova AA, Tkacheva MA, Inyushkina EM (2015) The effect of neuropeptide Y on spike activity of neurons in the suprachiasmatic nucleus of rat in vitro. Russ J Physiol 101: 1257–1269. (In Russ)].
Anhe GF, Caperuto LC, Pereira-Da-Silva M, Souza LC, Hirata AE, Velloso LA, Cipolla-Neto J, Carvalho CRO (2004) In vivo activation of insulin receptor tyrosine kinase by melatonin in the rat hypothalamus. J Neurochem 90: 559–566. https://doi.org/10.1111/j.1471-4159.2004.02514.x
Bondy CA, Cheng CM (2004) Signaling by insulin-like-growth-factor-1 in brain. Eur J Pharmacol 490: 25–31. https://doi.org/10.1016/j.ejphar.2004.02.042
Jais A, Bruning JC (2022) Arcuate nucleus-dependent regulation of metabolism – pathways to obesity and diabetes mellitus. Endocr Rev 43: 314–328. https://doi.org/10.1210/endrev/bnab025
Dodd GT, Michael NJ, Lee-Young RS, Mangiafico SP, Pryor JT, Munder AC, Simonds SE, Bruning JC, Zhang ZY, Cowley MA, Andrikopoulos S, Horvath TL, Spanswick D, Tiganis T (2018) Insulin regulates POMC neuronal plasticity to control glucose metabolism. eLife 7: e38704. https://doi.org/10.7554/eLife.38704
Balland E, Chen W, Dodd GT, Conductier G, Coppari R, Tiganis T, Cowley MA (2019) Leptin signaling in the arcuate nucleus reduces insulin’s capacity to suppress hepatic glucose production in obese mice. Cell Rep 26: 346–355. https://doi.org/10.1016/j.celrep.2018.12.061
Saeb-Parsy K, Lombardelli S, Khan ZF, McDowall K, Au-Yong ITH, Dyball REJ (2000) Neural connections of hypothalamic neuroendocrine nuclei in the rat. J Neuroendocrinol 12: 635–648.https://doi.org/10.1046/j.1365-2826.2000.00503.x
Yi CX, van der Vliet J, Dai J., Yin G, Ru L, Buijs RM (2006) Ventromedial arcuate nucleus communicates peripheral metabolic information to the suprachiasmatic nucleus. Endocrinology 147: 283–294. https://doi.org/10.1210/en.2005-1051
Guzman-Ruiz M, Saderi N, Cazarez-Marquez F, Guerrero-Vargas NN, Basualdo MC, Acosta-Galvan G, Buijs RM (2014) The suprachiasmatic nucleus changes the daily activity of the arcuate nucleus α-MSH neurons in male rats. Endocrinology 155: 525–535. https://doi.org/10.1210/en.2013-1604
Padilla SL, Perez JG, Ben-Hamo M, Johnson CW, Sanchez REA, Bussi IL, Palmiter RD, de la Iglesia HO (2019) Kisspeptin neurons in the arcuate nucleus of the hypothalamus orchestrate circadian rhythms and metabolism. Curr Biol 29: 592–604. https://doi.org/10.1016/j.cub.2019.01.022
Scherer T, Sakamoto K, Buettner C (2021) Brain insulin signalling in metabolic homeostasis and disease. Nat Rev Endocrinol 17: 468–483. https://doi.org/10.1038/s41574-021-00498-x
Konner AC, Janoschek R, Plum L, Jordan SD, Rother E, Ma X, Xu C, Enriori P, Hampel B, Barsh GS, Kahn CR, Cowley MA, Ashcroft FM, Bruning JC (2007) Insulin action in AgRP- expressing neurons is required for suppression of hepatic glucose production. Cell Metab 5: 438–449. https://doi.org/10.1016/j.cmet.2007.05.004
Trujeque-Ramos S, Castillo-Rolon D, Galarraga E, Tapia D, Arenas-Lopez G, Mihailescu S, Hernandez-Lopez S (2018) Insulin regulates GABAA receptor-mediated tonic currents in the prefrontal cortex. Front Neurosci 12: 345. https://doi.org/10.3389/fnins.2018.00345
Hammoud H, Netsyk O, Tafreshiha AS, Korol SV, Jin Z, Li PJ, Birnir B (2021) Insulin differentially modulates GABA signalling in hippocampal neurons and, in an age-dependent manner, normalizes GABA-activated currents in the tg-APPSwe mouse model of Alzheimer’s disease. Acta Physiol 232: e13623. https://doi.org/10.1111/apha.13623
Takei H, Fujita S, Shirakawa T, Koshikawa N, Kobayashi M (2010) Insulin facilitates repetitive firing in rat insular cortex via phosphoinositide 3-kinase but not mitogen activated protein kinase cascade. Neuroscience 170: 1199–1208. https://doi.org/10.1016/j.neuroscience.2010.07.061
Konner AC, Hess S, Tovar S, Mesaros A, Sanchez-Lasheras C, Evers N, Verhagen LAW, Bronneke HS, Kleinridders A, Hampel B, Kloppenburg P, Bruning JC (2011) Role for insulin signaling in catecholaminergic neurons in control of energy homeostasis. Cell Metab 13: 720–728. https://doi.org/10.1016/j.cmet.2011.03.021
Bhumbra GS, Inyushkin AN, Dyball RED (2004) Assessment of spike activity in the supraoptic nucleus. J Neuroendocrinol 16: 390–397. https://doi.org/10.1111/j.0953-8194.2004.01166.x
Brown TM, Coogan AN, Cutler DJ, Hughes AT, Piggins HD (2008) Electrophysiological actions of orexins on rat suprachiasmatic neurons in vitro. Neurosci Lett 448: 273–278. https://doi.org/10.1016/j.neulet.2008.10.058
Cui LN, Saeb-Parsy K, Dyball REJ (1997) Neurones in the supraoptic nucleus of the rat are regulated by a projection from the suprachiasmatic nucleus. J Physiol 502: 149–159. https://doi.org/10.1111/j.1469-7793.1997.149bl.x
Gerstein GL, Kiang NYS (1960) An approach to the quantitative analysis of electrophysiological data from single neurons. Biophys J 1: 15–28. https://doi.org/10.1016/s0006-3495(60)86872-5
Ellaway PH (1978) Cumulative sum technique and its application to the analysis of peristimulus time histograms. Electroencephalogr Clin Neurophysiol 45: 302–304. https://doi.org/10.1016/0013-4694(78)90017-2
Pendergast JS, Yamazaki S (2018) The mysterious food-entrainable oscillator: insights from mutant and engineered mouse models. J Biol Rhythms 33: 458–474. https://doi.org/10.1177/0748730418789043
Инюшкин АН, Мистрюгов КА, Громова ДС, Пугачев ЕИ, Беляков ВИ, Инюшкина ЕМ (2011) Влияние инсулина на циркадианный ритм произвольной локомоторной активности крыс. Рос физиол журн им ИМ Сеченова 97: 678–689. [Inyushkin AN, Mistrugov KA, Gromova DS, Pugachev EI, Belyakov VI, Inyushkina EM (2011) The effect of insulin on circadian rhythm of voluntary locomotor activity in rats. Russ J Physiol 97: 678–689. (In Russ)].
Crosby P, Hamnett R, Putker M, Hoyle NP, Reed M, Karam CJ, Maywood ES, Stangherlin A, Chesham JE, Hayter EA, Rosenbrier-Ribeiro L, Newham P, Clevers H, Bechtold DA, O’Neil JS (2019) Insulin/IGF-1 drives PERIOD synthesis to entrain circadian rhythms with feeding time. Cell 177: 896–909. https://doi.org/10.1016/j.cell.2019.02.017
Moore RY, Speh JC, Leak RK (2002) Suprachiasmatic nucleus organization. Cell Tissue Res 309: 89–98. https://doi.org/10.1007/s00441-002-0575-2
Campo AT (2020) Inferring neural information flow from spiking data. Comput Struct Biotechnol J 18: 2699–2708. https://doi.org/10.1016/j.csbj.2020.09.007
Krout KE, Kawano J, Mettenleiter TC, Loewy AD (2002) CNS inputs to the suprachiasmatic nucleus of the rat. Neuroscience 110: 73–92. https://doi.org/10.1016/s0306-4522(01)00551-6
Buijs FN, Guzman-Ruiz M, Leon-Mercado L, Basualdo MC, Escobar C, Kalsbeek A, Buijs RM (2017) Suprachiasmatic nucleus interaction with the arcuate nucleus; essential for organizing physiological rhythms. eNeuro 4: e0028-17.2017. https://doi.org/10.1523/ENEURO.0028-17.2017
Mendez-Hernandez R, Escobar C, Buijs RM (2020) Suprachiasmatic nucleus–arcuate nucleus axis: interaction between time and metabolism essential for health. Obesity (2020) 28: S10–S17. https://doi.org/10.1002/oby.22774
Bellet MM, Sassone-Corsi P (2010) Mammalian circadian clock and metabolism – the epigenetic link. J Cell Sci 123: 3837–3848. https://doi.org/10.1242/jcs.051649
Challet E (2010) Interactions between light, mealtime and calorie restriction to control daily timing in mammals. J Comp Physiol B 180: 631–644. https://doi.org/10.1007/s00360-010-0451-4
Mistlberger RE (2011) Neurobiology of food anticipatory circadian rhythms. Physiol Behav 104: 535–545. https://doi.org/10.1111/j.1460-9568.2009.06965.x
Lowitzsch K, Hopf HC, Galland J (1977) Changes of sensory conduction velocity and refractory periods with decreasing tissue temperature in man. J Neurol 216: 181–188. https://doi.org/10.1007/BF00313619
Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (2011) Axon physiology. Physiol Rev 91: 555–602. https://doi.org/10.1152/physrev.00048.2009
Feifel D, Vaccarino FJ (1994) Growth hormone-regulatory peptides (GHRH and somatostatin) and feeding: a model for the integration of central and peripheral function. Neurosci Biobehav Rev 18: 421–443.
Kleinridders A (2016) Deciphering brain insulin receptor and insulin-like growth factor 1 receptor signalling. J Neuroendocrinol 28: https://doi.org/10.1111/jne.12433
Varela L, Horvath TL (2012) Leptin and insulin pathways in POMC and AgRP neurons that modulate energy balance and glucose homeostasis. EMBO Rep 13: 1079–1086. https://doi.org/10.1038/embor.2012.174
Vogt MC, Bruning JC (2013) CNS insulin signaling in the control of energy homeostasis and glucose metabolism - from embryo to old age. Trends Endocrinol Metab 24: 76–84. https://doi.org/10.1016/j.tem.2012.11.004
Zhang ZY, Dodd GT, Tiganis T (2015) Protein tyrosine phosphatases in hypothalamic insulin and leptin signaling. Trends Pharmacol Sci 36: 661–674. https://doi.org/10.1016/j.tips.2015.07.003
Spanswick D, Smith MA, Mirshamsi S, Routh VH, Ashford ML (2000) Insulin activates ATP-sensitive K+ channels in hypothalamic neurons of lean, but not obese rats. Nat Neurosci 3: 757–758. https://doi.org/10.1038/77660
Williams KW, Margatho LO, Lee CE, Choi M, Lee S, Scott MM, Elias CF, Elmquist JK (2010) Segregation of acute leptin and insulin effects in distinct populations of arcuate proopiomelanocortin neurons. J Neurosci 30: 2472–2479. https://doi.org/10.1523/JNEUROSCI.3118-09.2010
Qiu J, Wagner EJ, Ronnekleiv OK, Kelly MJ (2018) Insulin and leptin excite anorexigenic pro-opiomelanocortin neurones via activation of TRPC5 channels. J Neuroendocrinol 30: e12501. https://doi.org/10.1111/jne.12501
Yang MJ, Wang F, Wang JH, Wu WN, Hu ZL, Cheng J, Yu DF, Long LH, Fu H, Xie N, Chen JG (2010) PI3K integrates the effects of insulin and leptin on large-conductance Ca2+-activated K+ channels in neuropeptide Y neurons of the hypothalamic arcuate nucleus. Am J Physiol 298: E193–E201. https://doi.org/10.1152/ajpendo.00155.2009
Henry FE, Sugino K, Tozer A, Branco T, Sternson SM (2015) Cell type-specific transcriptomics of hypothalamic energy-sensing neuron responses to weight-loss. eLife 4: e09800. https://doi.org/10.7554/eLife.09800
Campbell JN, Macosko EZ, Fenselau H, Pers TH, Lyubetskaya A, Tenen D, Goldman M, Verstegen AM, Resch JM, McCarroll SA, Rosen ED, Lowell BB, Tsai LT (2017) A molecular census of arcuate hypothalamus and median eminence cell types. Nat Neurosci 20: 484–496. https://doi.org/10.1038/nn.4495
Chen R, Wu X, Jiang L, Zhang Y (2017) Single-Cell RNA-Seq reveals hypothalamic cell diversity. Cell Rep 18: 3227–3241. https://doi.org/10.1016/j.celrep.2017.03.004
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


