Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 2, стр. 229-240
Участие ацетилхолина и Na+,K+-АТФазы в регуляции роста скелетных мышц куриного эмбриона
Е. В. Лопатина 1, 2, *, А. В. Гавриченко 1, Н. А. Пасатецкая 1
1 Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова МЗ РФ
Санкт-Петербург, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: evlopatina@yandex.ru
Поступила в редакцию 02.09.2022
После доработки 26.11.2022
Принята к публикации 13.01.2023
- EDN: NDTFFO
- DOI: 10.31857/S0869813923020073
Аннотация
В последнее время все большее внимание уделяется обсуждению трофической функции нервной системы и ее участию в запуске сигнальных каскадов, регулирующих клеточный метаболизм. В работе оценивали роль ацетилхолина и Na+,K+-АТФазы в регуляции роста скелетных мышц 10–12-дневных куриных эмбрионов в условиях органотипической культуры ткани. Максимальный трофотропный эффект ацетилхолин проявлял в концентрации 10–8 М. Ингибиторный анализ доказал участие никотиновых холинорецепторов в этом эффекте. Оуабаин дозозависимо регулировал рост эксплантатов ткани скелетной мышцы куриных эмбрионов. В концентрациях, сопоставимых с эндогенными, гликозид стимулировал рост экспериментальных эксплантатов на 33% по сравнению с контрольным значением. Обнаружены миотоксические свойства оуабаина в диапазоне концентраций 10–6–10–4 М. Ацетилхолин устранял миотоксический эффект оуабаина (10–6 М) как прямо, действуя на Na+,K+-АТФазу, так и рецептор-опосредовано через никотиновый холинорецептор.
ВВЕДЕНИЕ
Классическими методами исследования процессов, происходящих на уровне концевой пластинки, являются электрофизиологические и биохимические методы, позволяющие изучить роль мембранных структур в регуляции функционирования синапса. В последнее время все большее внимание уделяется обсуждению трофической функции нервной системы и запуску сигнальных каскадов, регулирующих клеточный метаболизм. Известно, что ацетилхолин выделяется в синаптическую щель из двигательной нервной терминали в виде порций (квантов) и в “неквантовой” форме (активное тоническое выделение молекул) [1]. При квантовом выделении ацетилхолина его концентрация в синаптической щели достигает сотен мкмоль/л, в случае неквантового освобождения концентрация медиатора поддерживается на наномолярном уровне [2].
Исследования роли ацетилхолина в концентрации, сопоставимой с той, что достигается при его неквантовом выделении, в регуляции нервно-мышечной передачи начались в лаборатории нервно-мышечной физиологии НИИ физиологии им. А.А. Ухтомского в 90-х годах XX века. На френико-диафрагмальном препарате белой крысы был изучен антиутомляющий эффект низких концентраций ацетилхолина. Исследования показали, что этот эффект не связан с влиянием медиатора на никотиновые или мускариновые холинорецепторы. Кратковременная аппликация ацетилхолина вызывала гиперполяризацию внесинаптической мембраны мышечных волокон. Эта гиперполяризация сохранялась на протяжении длительного времени после удаления ацетилхолина из омывающего мышцу раствора, но отсутствовала на фоне оуабаина. Авторы сделали вывод о том, что в основе такой гиперполяризации лежит активация Na+,K+-АТФазы [3–8].
Исследования вопросов, связанных с изучением регуляторной роли ацетилхолина в нервно-мышечном соединении, осуществлялись параллельно в Санкт-Петербургском Университете, под руководством профессора И.И. Кривого, и в Казани в лаборатории биофизики клетки, под руководством академика Е.Е. Никольского. В работе Е.Е. Никольского и соавт. также было показано, что наномолярные концентрации ацетилхолина модулируют насосную функцию Na+,K+-АТФазы, что проявляется в локальной гиперполяризации мышечной мембраны [9].
Если вклад ацетихолина в наномолярных концентрациях в модуляцию нервно-мышечной передачи исследован достаточно подробно [1, 10, 11], то о трофотропных эффектах различных концентраций ацетилхолина сведений крайне мало. В 2020 г. вышла работа, свидетельствующая о том, что ацетилхолин в миллимолярной концентрации обеспечивает трофический сигнал, предотвращающий механизмы коннексин-опосредованной мышечной атрофии [12]. Вопрос о трофической функции низких концентраций ацетилхолина остается открытым.
Важнейшей группой природных регуляторов Na+,K+-АТФазы являются сердечные гликозиды. В высоких концентрациях эти стероиды являются ингибиторами Na+,K+-АТФазы, а в низких – модуляторами ее сигнальной функции. Эндогенные структурные аналоги этих соединений получили название эндогенные дигиталисоподобные факторы [13, 14]. Концентрация эндогенного оуабаина в плазме крови человека колеблется в наномолярном диапазоне (от 0.6 до 1.2 нМ) [13, 15]. У пациентов с кардиологической и нефрологической патологией зарегистрировано повышение уровня эндогенных дигиталисоподобных факторов в плазме крови [16].
Чувствительность различных изоформ α-субъединицы Na+,K+-АТФазы к кардиотоническим стероидам может различаться, но у грызунов это различие выражено в наибольшей степени. У этих животных α1-изоформа малочувствительна к оуабаину (константа блокирования составляет десятки и сотни мкМ), напротив, изоформы α2- и α3-высокочувствительны к оуабаину (константа блокирования составляет десятки и сотни нМ). У других млекопитающих, включая человека, чувствительность α1-изоформы к оуабаину лежит в наномолярном диапазоне концентраций [17, 18]. Классическим объектом при изучении свойств сердечных гликозидов является куриный и утиный эмбрион [19]. Предполагается существование двух пулов Na+,K+-АТФазы, один из которых функционирует как ионный насос. Другой пул, преимущественно локализованный в кавеолах, образует молекулярный комплекс с EGFR (рецептор эпидермального фактора роста) и Src-киназой [20–22] и участвует в мембранной и внутриклеточной сигнальной трансдукции [23]. Выявлен участок α-субъединицы (так называемая NaKtide последовательность), отвечающий за реализацию сигнальной функции Na+,K+-АТФазы и предположительно специфичный для α1-изоформы Na+,K+-АТФазы в скелетной мышце [20]. В области концевой пластинки никотиновый холинорецептор колокализован с Na+,K+-АТФазой, фосфолемманом и кавеолином-3 [24, 25]. В настоящее время интенсивно изучается участие эндогенных оуабаин-подобных соединений в механизмах регуляции, реализуемых через сигнальную функцию Na+,K+-АТФазы [26].
Помимо регуляции ионного транспорта Na+,K+-АТФаза в качестве трансдуктора сигнала участвует в модуляции клеточного метаболизма, стимулирует рост и пролиферацию клеток разных тканей. Продемонстрирована роль сигнальной функции Na+,K+-АТФазы в регуляции роста ткани сердца [27, 28], сетчатки [29], сенсорных нейронов [30]. Вклад сигнальной функции Na+,K+-АТФазы и эндогенных дигиталисоподобных факторов в регуляцию трофических процессов скелетной мышцы не исследован.
Цель работы: оценка участия ацетилхолина и Na+,K+-АТФазы в регуляции роста скелетных мышц куриного эмбриона в условиях органотипического культивирования ткани.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись эксплантаты ткани скелетной мышцы голени 10–12-дневных куриных эмбрионов породы белый Леггорн. Каждая серия эксперимента включала 120 контрольных и 120 экспериментальных эксплантатов на каждую исследованную концентрацию действующих веществ. Фрагменты эмбриональной мышечной ткани размером 0.5–1 мм переносили в чашки Петри на коллагеновую подложку. Каждая чашка Петри содержала 20 эксплантатов ткани мышцы голени. Добавляли питательную среду, состоящую из раствора Хенкса (50 об. %) (Биолот, Россия), среды Игла (40 об. %) (Биолот, Россия), эмбриональной телячьей сыворотки (9.5 об. %) (Thermo Fisher Scientific, Бразилия), глюкозы 40% (0.5 об. %) (Производственная фармацевтическая компания Обновление, Россия) ципрофлоксацина (2 мг/мл) (Красфарма, Россия), и культивировали в CO2-инкубаторе (Binder, Германия) при 37°С и 5% СО2. В питательную среду экспериментальных эксплантатов добавляли ацетилхолин (Sigma, США), оуабаина октагидрат (Sigma, США) и d-тубокурарина гидрохлорид (Sigma, США) согласно протоколу эксперимента. Через трое суток культивирования чашки Петри извлекали из CO2-инкубатора и исследовали с использованием морфометрии.
Влияние исследуемых веществ на рост эксплантатов мышечной ткани оценивали при помощи морфометрического критерия – индекс площади, который рассчитывали, как отношение площади всего эксплантата к площади центральной зоны. За условную единицу площади принимали квадрат оккуляр-сетки микроскопа. Значение индекса площади контрольных эксплантатов принимали за 100%. Контрольными являлись эксплантаты, развивающиеся в условиях питательной среды стандартного состава.
Статистическую обработку результатов проводили с помощью программы STATISTICA 10.0. При сравнении контрольной и экспериментальной групп использовали t-критерий Стьюдента для двух независимых выборок. Множественные сравнения проводили с применением дисперсионного анализа ANOVA. Данные представлены как среднее значение ± стандартная ошибка среднего, выраженные в %. Различия считали достоверными при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
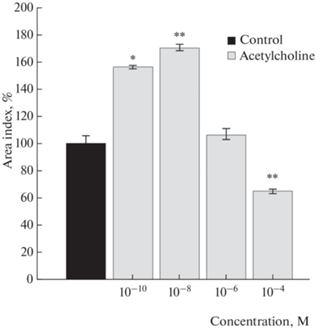
Влияние ацетилхолина на рост эксплантатов ткани скелетной мышцы исследовали в диапазоне концентраций от 10–10 до 10–4 М. Действие ацетилхолина было дозозависимым. Концентрации ацетилхолина 10–10 и 10–8 М проявили трофотропный эффект. Добавление в питательную среду ацетилхолина в концентрации 10–10 М стимулировало рост эксплантатов на 56.0 ± 1.8% (n = 120, p < 0.05) по сравнению с контролем. Максимальный трофотропный эффект ацетилхолин проявил в концентрации 10–8 М: индекс площади экспериментальных эксплантатов был выше контрольного значения на 70.0 ± 2.4% (n = 120, p < 0.01). В дозе 10–6 М ацетилхолин не оказывал действия на рост исследуемой ткани. Ацетилхолин в концентрации 10–4 М ингибировал рост мышечной ткани на 35.0 ± 1.2% (n = 120, p < 0.01) (рис. 1).
Рис. 1.
Ацетилхолин дозозависимо регулирует рост эксплантатов ткани скелетной мышцы. * – p < 0.05, ** – p < 0.01 по сравнению с контрольным значением.
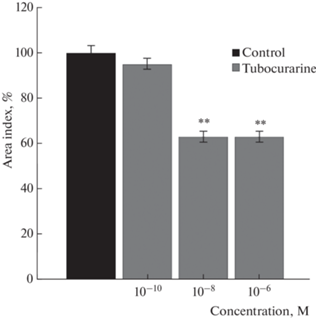
Для оценки вклада никотиновых холинорецепторов в обнаруженный нами трофотропный эффект ацетилхолина провели серию экспериментов с использованием d-тубокурарина гидрохлорида (рис. 2). В концентрациях 10–8 и 10–6 М препарат достоверно ингибировал рост эксплантатов ткани скелетной мышцы на 37.0 ± 3.3% (n = 120, p < 0.01) и 37.0 ± 4.0% (n = 120, p < 0.01) соответственно. В концентрации 10–10 М d-тубокурарин не влиял на рост экспериментальных эксплантатов. Поэтому для культивирования эксплантатов ткани скелетной мышце в питательной среде, содержащей ацетилхолин и d-тубокурарин, была выбрана концентрация блокатора 10–10 М. При культивировании экспериментальных эксплантатов в среде, содержащей блокатор никотиновых холинорецепторов d-тубокурарин (10–10 М) и ацетилхолин (10–8 М), трофотропный эффект ацетилхолина отсутствовал.
Рис. 2.
Влияние тубокурарина на рост эксплантатов ткани скелетной мышцы. ** – p < 0.01 по сравнению с контрольным значением.
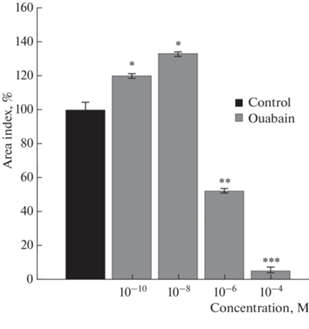
Участие Na+,K+-АТФазы в регуляции роста эксплантатов ткани скелетной мышцы в аналогичных условиях было исследовано в следующей экспериментальной серии. Влияние оуабаина на рост экспериментальных эксплантатов оценивали в диапазоне концентраций от 10–10 до 10–4 М. В концентрации 10–4 и 10–6 М оуабаин проявил миотоксический эффект, индекс площади экспериментальных эксплантатов был на 95.0 ± 2.0% (n = 120, p < 0.001) и 48.0 ± 1.4% (n = 120, p < 0.01) ниже контрольного значения. Максимальный трофотропный эффект препарат обнаружил в концентрации 10–8 М, индекс площади экспериментальных эксплантатов был выше контрольного значения на 33.0 ± 1.3% (n = 120, p < 0.05) (рис. 3). В концентрации 10–10 М оуабаин стимулировал рост на 20.0 ± 1.5% (n = 120, p < 0.05).
Рис. 3.
Оуабаин дозозависимо регулирует рост эксплантатов ткани скелетной мышцы. * – p < 0.05, ** – p < 0.01, *** –p < 0.001 по сравнению с контрольным значением.
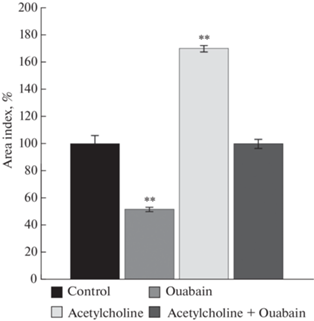
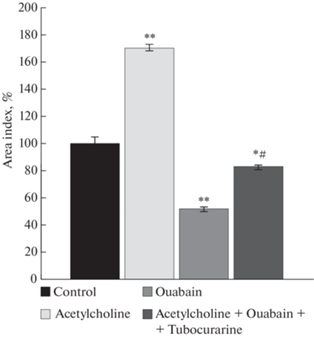
Для того чтобы оценить возможность регуляции сигнальной функции Na+,K+-АТФазы ацетилхолином в концентрации, сопоставимой с той, что достигается при неквантовом выделении, были поставлены отдельные серии экспериментов. Эксплантаты ткани скелетной мышцы культивировали в питательной среде, содержащей совместно ацетилхолин 10–8 М и оуабаин 10–6 М. Оказалось, что ацетилхолин нивелирует миотоксический эффект оуабаина. Индекс площади экспериментальных эксплантатов не отличался от контрольного значения (рис. 4).
Рис. 4.
Ацетилхолин в концентрации, сопоставимой с неквантовым выходом (10–8 М), нивелирует миотоксический эффект оуабаина (10–6 М). ** – p < 0.01 по сравнению с контрольным значением.
Для того чтобы исключить участие никотиновых холинорецепторов в обнаруженном нами эффекте, экспериментальные эксплантаты культивировали в питательной среде, содержащей ацетилхолин (10–8 М), оуабаин (10–6 М) и d-тубокурарин (10–10 М). В присутствии d-тубокурарина ацетилхолин устранял миотоксический эффект оуабаина (10–6 М) не полностью. Индекс площади эксплантатов был ниже контрольного значения на 17.0 ± 1.0% (n = 120, p < 0.05) и отличался от индекса площади эксплантатов, культивируемых в присутствии только оуабаина на 31.0 ± 1.1% (n = 120, p < 0.001) (рис. 5). Полученные результаты свидетельствуют о том, что ацетилхолин устраняет ингибирующее рост эксплантатов скелетной ткани действие оуабаина как прямо, действуя на Na+,K+-АТФазу, так и рецептор-опосредовано через никотиновый холинорецептор.
Рис. 5.
Вклад никотинового холинорецептора в модуляцию сигнальной функции Na+,K+-АТФазы ацетилхолином в концентрации 10–8 М. * – p < 0.05, ** – p < 0.01 по сравнению с контрольным значением. # – p < 0.001 по сравнению с индексом площади эксплантатов, культивируемых в присутствии ацетилхолина и оуабаина.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Физиологическое значение низких концентраций ацетилхолина связывают с поддержанием мембранного потенциала покоя, характерного для иннервированной мышцы [31]. Кроме того, было показано, что неквантовое выделение ацетилхолина из двигательных нервных окончаний в начале иннервационного процесса является обязательным условием перехода от полинейронального характера иннервации к мононейрональному [32]. Описана также шунтирующая роль неквантового ацетилхолина, при которой его выделение из нервного окончания в состоянии покоя препятствует аллостерическому ингибированию фермента, синтезирующего медиатор избытком продукта [31]. Нам удалось показать, что ацетилхолин дозозависимо влияет на рост эксплантатов скелетной мышцы. Максимальный миостимулирующий эффект ацетилхолин проявил в концентрации 10–8 М. При культивировании эксплантатов ткани скелетной мышцы в питательной среде, содержащей ацетилхолин (10–8 М) и d-тубокурарин в концентрации 10–10 М трофотропный эффект ацетилхолина отсутствовал, что свидетельствует о вовлеченности никотиновых холинорецепторов в реализацию трофотропного действия препарата. В условиях органотипического культивирования ткани сердца было обнаружено аналогичное действие ацетилхолина. Также ацетилхолин в концентрации 10–8 М устранял кардиотоксическое действие оуабаина 10–8 М [33].
Na+,К+-АТФаза участвует в регуляции клеточного роста и пролиферации во многих тканях организма [27–30]. Рядом авторов описана роль Na+,K+-АТФазы в регуляции метаболизма скелетной мышцы. В опытах на скелетных мышечных клетках человека показана возможность Src-зависимой регуляции синтеза гликогена наномолярными концентрациями оуабаина [34], обсуждается также участие Src-киназы в реализации сигнальной функции оуабаин-чувствительной α1-изоформы Na+,K+-АТФазы в мышцах [35]. Участие α2- и α3-изоформ α-субъединицы в сигнальной трансдукции в ткани скелетной мышцы подвергается сомнению [20, 21]. Необходимо отметить, что в скелетной мышце куриного эмбриона зарегистрирована экспрессия α1-изоформы Na+,K+-АТФазы [36]. Результаты других исследований демонстрируют, что фукционирование скелетных мышц необходимо для поддержания насосной функции α2-изоформы Na+,K+-АТФазы, а изменению ее активности, в свою очередь, предшествует атрофия мышц, индуцированная краткосрочной функциональной разгрузкой камбаловидной мышцы [37].
В ходе работы обнаружено трофотропное действие оуабаина в концентрациях, сопоставимых с эндогенными (10–8 и 10–10 М). В высоких дозах (10–6 и 10–4 М) оуабаин ингибирует рост эксплантатов скелетных мышц на 48 и 95% соответственно. Полученные результаты сочетаются с данными, обнаруженными Oliveira с соавт. при изучении роли Na+,K+-АТФазы в миогенезе куриных эмбрионов [36]. Оказалось, что оуабаин в концентрации 10–5 М ингибирует рост клеток мышечной ткани на 45%, а также уменьшает образование многоядерных миотрубочек. Ингибитор MEK–ERK сигнальных путей U0126 не влиял на выживаемость клеток и не устранял миотоксическое действие оуабаина. Ингибирующий эффект оуабаина также сохранялся на фоне блокатора p38 SB202190. Таким образом, ингибирующий эффект 10–5 М оуабаина не связан с сигнальной функцией фермента, а опосредован блокированием насосной функции Na+,K+-АТФазы. Авторы не обнаружили изменений в количестве одноядерных клеток, количестве ядер внутри мышечных трубочек и общего количества ядер при действии 10–6 М оуабаина, хотя количество мышечных трубочек уменьшилось. Интересно отметить, что в отличие от оуабаина в дозе 10–5 М 24-часовая инкубация клеток в питательной среде, содержащей оуабаин 10–6 М и блокатор p38, приводила к увеличению числа миотрубочек и одноядерных клеток, хотя общее количество ядер и количество ядер в миотрубочках не изменялось. Дозозависимый эффект оуабаина может быть опосредован различием в механизме действия [36].
Na+,К+-АТФаза может образовывать ансамбли с рецепторами и ионными каналами [38]. Одними из первых были выявлены структурно-функциональные взаимодействия между Na+,К+-АТФазой и никотиновым холинорецептором. Исследования под руководством И.И. Кривого показали, что ацетилхолин в концентрации 100 нМ вызывает гиперполяризацию постсинаптической мембраны на 4 мВ. Этот эффект наблюдался в присутствии ингибитора ацетилхолинэстеразы – армина и негидролизуемых агонистов Н-холинорецепторов: карбамилхолина и никотина. Введение специфических агонистов d-тубокурарина и бунгаротоксина устраняло ацетилхолин-вызванную гиперполяризацию. Введение проадифена, который не связывается с сайтом связывания ацетилхолина, а блокирует натриевый ток через канал, не влияло на ацетилхолин-вызванную гиперполяризацию мышечной мембраны. Выявленная зависимость ацетилхолин-вызванной гиперполяризации от концентрации ацетилхолина позволила предположить, что эффект обусловлен связыванием ацетилхолина со специфическим сайтом связывания рецептора, а не с каким-либо другим белком. Оуабаин ингибировал ацетилхолин-вызванную гиперполяризацию в наномолярном диапазоне, что указывает на участие именно α2-изоформы Na+,К+-АТФазы в модуляции электрогенеза постсинаптической мембраны [22]. Также доказано, что ацетилхолин не влияет на активность Na+,K+-АТФазы, если она не представлена в едином комплексе с никотиновым холинорецептором [4]. Предполагают, что физиологическая роль данной гиперполяризации заключается в тонкой настройке мембранного электрогенеза, а, следовательно, более эффективной нервно-мышечной передаче возбуждения.
Для установления возможности прямой активации Na+,К+-АТФазы ацетилхолином было проведено исследование электрогенной активности Na+,К+-АТФазы при действии ацетилхолина в ткани почки ягненка и эритроцитах – системах, где отсутствует никотиновый холинорецептор. Изменение активности фермента не обнаружено [11]. Однако в этом исследовании оценивали только насосную функцию Na+,К+-АТФазы, запуск сигнальных каскадов, опосредуемый активацией сигнальной функции Na+,К+-АТФазы, не изучался. Обнаруженное нами нивелирование миотоксического эффекта оуабаина ацетилхолином на фоне блокады никотинового холинорецептора d-тубокурарином указывает на возможность прямой регуляции сигнальной функции Na+,K+-АТФазы ацетилхолином. Что касается внутриклеточных процессов, запускаемых ацетилхолином, механизмы, лежащие в основе зарегистрированного нами эффекта, требуют дальнейшего изучения.
Список литературы
Malomouzh AI, Nikolsky EE (2018) Modern concepts of cholinergic neurotransmission at the motor synapse. Biochemistry (Moscow) Suppl Series A Membrane and Cell Biology 12 (3): 209–222. https://doi.org/10.1134/S1990747818030078
Mitchell JF, Silver A (1963) The spontaneous release of acetylcholine from the denervated hemidiaphragm of the rat. J Physiol 165(1): 117–129. https://doi.org/10.1113/jphysiol.1963.sp007046
Kubasov IV, Krivoi II, Lopatina E V (1994) Effect of exogenous acetylcholine on neuromuscular transmission in the stimulated rat diaphragm. Bull Exp Biol Med 118(5): 1153–1155. https://doi.org/10.1007/BF02444610
Кривой ИИ, Кубасов ИВ, Лопатина ЕВ (1994) Исследование восстановления работоспособности утомляемой диафрагмы крысы после применения экзогенного ацетилхолина. Физиол журн им ИМ Сеченова. 80(9): 61–66. [Krivoi II, Kubasov IV, Lopatina EV (1994) A study of recovery of working ability of the fatugued rat diaphragm after application of exogenous acetylcholine. Physiol J IM Sechenov 80(9): 61–66. (In Russ)].
Кубасов ИВ, Кривой ИИ, Лопатина ЕВ (1994) Исследование влияния экзогенного ацетилхолина на эффективность нервно-мышечной передачи в утомляемой диафрагме крысы. Бюл экспер биол мед 118(11): 457–459. [Kubasov IV, Krivoj II, Lopatina EV (1994) Investigation of the effect of exogenous acetylcholine on the effectiveness of neuromuscular transmission in the fatigued rat diaphragm Bjull jeksper biol med 118(11): 457–459. (In Russ)].
Kubasov IV, Krivoi II, Lopatina EV (1997) The role of Na+, K+-ATPase in the presynaptic aftereffect of exogenous acetylcholine in the rat diaphragm. Bull Exp Biol Med 123(5): 531–534. https://doi.org/10.1007/BF02445319
Krivoi II, Kravtsova VV, Lopatina EV (2000) Hyperpolarizing effect of acetylcholine in the skeletal muscle with different types of muscle fibers. J Evol Biochem Physiol 36(4): 491–494. https://doi.org/10.1007/BF02737001
Кривой ИИ, Лопатина ЕВ, Кравцова ВВ (2001) Роль К+-каналов и Na+,K+-АТФазы в гиперполяризации мембраны скелетных мышечных волокон, вызываемой ацетилхолином. Биол мембр 18(21): 10–15. [Krivoi II, Lopatina EV, Kravtsova VV (2001) Role of K+ channels and Na+,K+-ATPase in acetylcholine-induced hyperpolarization of skeletal muscle fibres. Biol Membr 18(1): 10–15. (In Russ)].
Nikolsky EE, Zemková H, Voronin VA, Vyskocil F (1994) Role of non-quantal acetylcholine release in surplus polarization of mouse diaphragm fibres at the endplate zone. J Physiol 477 (Pt 3): 497–502. https://doi.org/10.1113/jphysiol.1994.sp020210
Hamlyn JM, Blaustein MP, Bova S, DuCharme DW, Harris DW, Mandel F, Mathews WR, Ludens JH (1991) Identification and characterization of a ouabain-like compound from human plasma. Proc Natl Acad Sci U S A 88(14): 6259–6263. https://doi.org/10.1073/pnas.88.14.6259
Blaustein MP, Hamlyn JM (2020) Ouabain, Endogenous Ouabain and Ouabain-like Factors: The Na+ Pump/Ouabain Receptor, its linkage to NCX, and its Myriad Functions. Cell Calcium 86: 102159. https://doi.org/10.1016/j.ceca.2020.102159
Schoner W, Scheiner-Bobis G (2007) Endogenous and exogenous cardiac glycosides and their mechanisms of action. Am J Cardiovasc Drugs 7(3): 173–189. https://doi.org/10.2165/00129784-200707030-00004
Akera TT, Brody M (1976) Inotropic action of digitalis and ion transport. Life Sci 18(2): 135–144. https://doi.org/10.1016/0024-3205(76)90017-5
Dobretsov M, Stimers JR (2005) Neuronal function and alpha3 isoform of the Na/K-ATPase. Front Biosci10: 2373–2396. https://doi.org/10.2741/1704
Cherniavsky LM, Karlish SJ, Garty H (2015) Cardiac glycosides induced toxicity in human cells expressing α1-, α2-, or α3-isoforms of Na-K-ATPase. Am J Physiol Cell Physiol 309(2): 126–135. https://doi.org/10.1152/ajpcell.00089.2015
Лазарев НВ (ред) (1961) Руководство по фармакологии. В 2т. М. Медгиз. [Lazarev NV (red) (1961) Manual of Pharmacology. In 2 V. M. Medgiz. (In Russ)].
Cui X, Xie Z (2017) Protein Interaction and Na/K-ATPase-Mediated Signal Transduction. Molecules 22(6): 1–20. https://doi.org/10.3390/molecules22060990
Yu H, Cui X, Zhang J, Xie JX, Banerjee M, Pierre SV, Xie Z (2018) Heterogeneity of signal transduction by Na-K-ATPase alpha-isoforms: role of Src interaction. Am J Physiol Cell Physiol 314(2): 202–210. https://doi.org/10.1152/ajpcell.00124.2017
Li Z, Cai T, Tian J, Xie J, Zhao X, Liu L, Shapiro JI, Xie Z (2009) NaKtide, a Na/K-ATPase-derived peptide Src inhibitor, antagonizes ouabain-activated signal transduction in cultured cells. J Biol Chemi 284(31): 21066–21076. https://doi.org/10.1074/jbc.M109.013821
Wang Y, Ye Q, Liu C, Xie JX, Yan Y, Lai F, Duan Q, Li X, Tian J, Xie Z (2014) Involvement of Na/K-ATPase in hydrogen peroxide-induced activation of the Src/ERK pathway in LLC-PK1 cells. Free Rad Biol Med 71(31): 415–426. https://doi.org/10.1016/j.freeradbiomed.2014.03.036
Heiny JA, Kravtsova VV, Mandel F, Radzyukevich TL, Benziane B, Prokofiev AV, Pedersen SE, Chibalin AV, Krivoi II (2010) The nicotinic acetylcholine receptor and the Na,K-ATPase α2isoform interact to regulate membrane electrogenesis in skeletal muscle. J Biol Chem 285: 28614–28626. https://doi.org/10.1074/jbc.M110.150961
Chibalin AV, Heiny JA, Benziane B, Prokofiev AV, Vasiliev AN, Kravtsova VV, Krivoi II (2012) Chronic nicotine exposure modifies skeletal muscle Na,K-ATPase activity through its interaction with the nicotinic acetylcholine receptor and phospholemman. PLoS One 7: e33719. https://doi.org/10.1371/journal.pone.0033719
Xie Z., Xie J (2015) The Na/K-ATPase-mediated signal transduction as a target for new drug development. Front Biosci 10: 3100–3109. https://doi.org/10.2741/1766
Nikolsky EE, Oranska TI, Vyskocil F (1996) Nonquantal acetylcholine release in the mouse diaphragm after phrenic nerve crush and during recovery. Exp Physiol 81(3): 341–348. https://doi.org/10.1113/expphysiol.1996.sp003938
Krivoi II, Drabkina TM, Kravtsova VV, Vasiliev AN, Eaton MJ, Skatchkov SN, Mandel F (2006) On the functional interaction between nicotinic acetylcholine receptor and Na+,K+-ATPase. Pflüg Arch Eur J Physiol 452(6): 756–765. https://doi.org/10.1007/s00424-006-0081-6
Cisterna BA, Vargas AA, Puebla C (2020) Active acetylcholine receptors prevent the atrophy of skeletal muscles and favor reinnervation. Nat Commun 11(1): 1073. https://doi.org/10.1038/s41467-019-14063-8
Xie Z, Askari A (2002) Na+/K+-ATPase as a signal transducer Eur J Biochem 269: 2434–2439. https://doi.org/10.1046/j.1432-1033.2002.02910.x
Lopatina EV, Kipenko AV, Pasatetskaya N, Penniyaynen VA, Krylov BV (2016) Modulation of the transducer function of Na+,K+-ATPase: new mechanism of heart remodeling. Canad J Physiol Pharmacol 94(10): 1110–1116. https://doi.org/10.1139/cjpp-2015-0577
Lopatina EV, Karetsky AV, Penniyaynen VA, Vinogradova TV (2008) Role of cardiac glycosides in regulation of the growth of retinal tissue explants. Bull Exp Biol Med 146(12): 651–653. https://doi.org/10.1007/s10517-009-0384-7
Pennijajnen VA, Lopatina EV (2005) Role of Na/K-ATPase in regulation of neurite growth in sensory neurons. Bull Exp Biol Med 139(2): 190–192. https://doi.org/10.1007/s10517-005-0244-z
Маломуж АИ, Никольский ЕЕ (2010) Неквантовое освобождение медиатора: миф или реальность? Успехи физиол наук 41(2): 27–43. [Malomouzh AI, Nikolsky EE (2010) Non-quantal mediator release: myth or reality? Uspekhi Fiziol Nauk 41(2): 27–43. (In Russ)].
Vyskocil F, Vrbova G (1993) Non-quantal release of acetylcholine affects polyneuronal innervation on developing rat muscle fibres. Eur J Neurosci 5: 1677–1683. https://doi.org/10.1111/j.1460-9568.1993.tb00235.x
Lopatina EV, Pennijajnen VA, Zajka AA (2005) Regulatory Role of Na,K-ATPase in the Growth of Heart Tissue Explants in Organotypic Culture. Bull Exp Biol Med 140(8): 150–153. https://doi.org/10.1007/s10517-005-0440-x
Kotova O, Al-Khalili L, Talia S, Hooke C, Fedorova OV, Bagrov AY, Chibalin AV (2006) Cardiotonic steroids stimulate glycogen synthesis in human skeletal muscle cells via a Src- and ERK1/2-dependent mechanism. J Biol Chem 281(29): 20085–20094. https://doi.org/10.1074/jbc.M601577200
Pirkmajer S, Bezjak K, Matkovic U, Dolinar K, Jiang LQ, Mis K, Gros K, Milovanova K, Pirkmajer KP, Mars T, Kapilevich L, Chibalin AV (2020) Ouabain Suppresses IL-6/STAT3 Signaling and Promotes Cytokine Secretion in Cultured Skeletal Muscle Cells. Front Physiol 11: 1–50. https://doi.org/. eCollection 2020https://doi.org/10.3389/fphys.2020.566584
Oliveira TN, Possidonio AC, Soares CP, Ayres R, Costa ML, Quintas LE, Mermelstein C (2015) The role of Na+/K+-ATPase during chick skeletal myogenesis. PLoS One 10(3): e0120940. https://doi.org/10.1371/journal.pone.0120940
Kravtsova VV, Matchkov VV, Bouzinova EV, Vasiliev AN, Razgovorova IA, Heiny JA, Krivoi II (2015) Isoform-specific Na,K-ATPase alterations precede disuse-induced atrophy of rat soleus muscle. Bio Med Res Int 2015: 1–11. https://doi.org/10.1155/2015/720172
Лопатина ЕВ, Поляков ЮИ (2011) Синтетический аналгетик аноцептин: результаты доклинических и клинических исследований. Эфферентная терапия 17(3): 79–81. [Lopatina EV, Poljakov JuI (2011) Synthetic analgesic anoceptin: results of preclinical and clinical studies]. Jefferent Terapija 17(3): 79–81. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


