Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 3, стр. 315-333
Эффекты вспомогательных репродуктивных технологий на социальное поведение мышей линии BTBR – модели расстройств аутистического спектра
И. Н. Рожкова 1, С. В. Окотруб 1, Е. Ю. Брусенцев 1, Т. Н. Игонина 1, Т. А. Рахманова 1, 2, Д. А. Лебедева 1, 2, Т. А. Яцук 1, В. С. Козенева 1, 2, В. А. Напримеров 1, С. Я. Амстиславский 1, *
1 Институт цитологии и генетики Сибирского отделения Российской академии наук
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
* E-mail: amstis@yandex.ru
Поступила в редакцию 05.10.2022
После доработки 22.12.2022
Принята к публикации 03.02.2023
- EDN: FSRFDJ
- DOI: 10.31857/S0869813923030044
Аннотация
Работа является первым исследованием влияния такой вспомогательной репродуктивной технологии (ВРТ), как культивирование in vitro преимплантационных эмбрионов на социальное поведение потомков мышей линии BTBR (BTBR T + Itpr3tf/J), которая представляет собой идиопатическую модель аутизма. В качестве контроля были использованы мыши C57BL/6J. У взрослых потомков мышей, полученных в результате естественного спаривания (группы C57BL/6J и BTBR), либо после культивирования in vitro и переноса эмбрионов соответствующих линий мышей псевдобеременным самкам C57BL/6J (группы ВРТ-C57BL/6J и ВРТ-BTBR), было изучено социальное поведение. При межлинейном сравнении было показано, что мыши BTBR имеют сниженные уровни социального распознавания и мотивации по сравнению с мышами C57BL/6J. У самок ВРТ-C57BL/6J и ВРТ-BTBR было установлено снижение интереса к новому партнеру в сессии на социальное распознавание по сравнению с естественно зачатыми животными того же пола. Результаты поведенческого теста свидетельствуют о влиянии культивирования in vitro на социальное распознавание у потомков мышей линий C57BL/6J и BTBR, но только у самок.
ВВЕДЕНИЕ
Расстройства аутистического спектра (РАС) в настоящее время являются неизлечимыми и характеризуются снижением интереса к сверстникам, стереотипным поведением, трудностями в поддержании социальных контактов и нарушением коммуникации [1]. Детально объяснить их патологические механизмы и, следовательно, применить соответствующие профилактические методы лечения пока невозможно. Несмотря на интерес исследователей к РАС, этиологические причины и патогенетические механизмы возникновения этих расстройств изучены лишь частично, каких-либо методов превентивной терапии РАС на сегодняшний день нет, а существующие стратегии направлены лишь на смягчение симптомов [2]. Сложности в понимании этиологии аутизма и механизмов, лежащих в основе РАС, связаны, в частности, с тем, что в патогенез этих расстройств вовлечено множество генетических и средовых факторов в их сложном взаимодействии, а также эпигенетические модификации [3, 4]. Между тем, большинство исследователей согласны, что РАС могут возникать в результате нарушений развития нервной системы в раннем онтогенезе [2, 5, 6].
Культивирование ранних эмбрионов in vitro является одной из основных вспомогательных репродуктивных технологий (ВРТ), широко применяемых как в медицине, так и в исследованиях на животных [7, 8]. Несмотря на более чем 40-летнее использование ВРТ в репродуктивной медицине, накапливаются противоречивые данные по поводу отдаленных эффектов применения этих методов по отношению к потомкам. Одни исследователи обнаруживают влияние этих процедур на здоровье людей, другие нет, что может быть обусловлено применением различных протоколов. Наряду с анализом медицинской литературы, при обсуждении последствий применения репродуктивных технологий следует учитывать результаты экспериментов на животных, выполненных в стандартизированных условиях на разных лабораторных моделях [7, 8].
В последнее десятилетие активно обсуждают возможную связь между применением ВРТ и повышением частоты РАС [9–12] и отклонениями в развитии нервной системы [13, 14] у детей после применения ВРТ. Проблема таких исследований, основанных на мета-анализе клинических данных, заключается в том, что ВРТ характеризуются многочисленными и сложными терапевтическими процедурами, которые до сих пор не унифицированы [15]. Хотя некоторые исследования выявили влияние ВРТ на частоту возникновения РАС у детей [9–11], потенциальный биологический механизм этой связи до сих пор не ясен, что осложнено малой величиной исследованных выборок, отсутствием адекватной контрольной группы, а также тем, что процедуры ВРТ могут различаться в разных клиниках, и объединение данных не всегда корректно. Более того, до сих пор неясно, вызваны ли наблюдаемые нарушения в развитии индивидуумов, рожденных с применением ВРТ, именно применением репродуктивных технологий как таковых, или они обусловлены характерными особенностями субфертильности пар, в отношении которых применяли ВРТ, в частности, наличием у них хронических заболеваний [16–18]. В недавней обзорной статье был проведен анализ соответствующих исследований по наблюдению за детьми, рожденными после применения ВРТ, и сделано заключение о том, что данные достаточно противоречивы и пока их недостаточно для того, чтобы сделать окончательный вывод о возможных последствиях этих процедур на здоровье потомков [19].
В связи с этим более предпочтительным является использование животных моделей для изучения РАС, в частности, влияния ВРТ на проявление характерных для этих расстройств особенностей поведения. Различные линии мышей, несущие модифицированные гены, ассоциированные с РАС, моделируют определенные эндофенотипы, характерные для аутизма [20–22]. Между тем мыши линии BTBR, которые характеризуются выраженной гиперактивностью, стереотипией, нарушением социального поведения, дефицитом пространственного обучения и памяти, признаны в качестве идиопатической модели аутизма, их часто исследуют с целью изучения причин возникновения и последствий РАС, а также механизмов, лежащих в основе этих заболеваний [23–27].
Исследования, выполненные на различных линиях мышей, показали, что применение репродуктивных технологий сопровождается нарушением различных форм поведения у потомков [28–31]. Несмотря на то, что ВРТ применяли по отношению к мышам линии BTBR ранее [32], исследования влияния этих процедур на поведение рожденных после применения ВРТ потомков до сих пор проведено не было. Целью данной работы было изучение эффектов применения такой ключевой репродуктивной технологии, как культивирование in vitro на социальное поведение потомков мышей линий C57BL/6J и BTBR T+Itpr3tf/J.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные и дизайн эксперимента
В эксперименте были использованы две линии мышей: C57BL/6J (39 самцов и 47 самок) и BTBR T+Itpr3tf/J (BTBR: 35 самцов и 44 самки), которых содержали в SPF-виварии Института цитологии и генетики СО РАН (Новосибирск, Россия) в индивидуально вентилируемых клетках (OptiMice, Animal Care, США): 34.3 см × 29.2 см × × 15.5 см, при температуре 22–24°C и влажности 40–50%, с инвертированным 12:12-часовым циклом дня:ночи (рассвет в 3 ч утра); в качестве подстила использовали березовую щепу, фракционную для содержания лабораторных животных (ТУ 16.10.23-001-0084157135-2019). Животные имели постоянный доступ к автоклавированному стандартизированному комбикорму для лабораторных крыс и мышей “Дельта Фидс” ЛбК 120 Р-22, ГОСТ 34566-2019 (БиоПро, Россия) и очищенной воде “Северянка”, обогащенной минеральными добавками (Экопроект, Россия). Животных содержали в группах по три–пять особей одного пола. Для получения потомства самок отбирали по стадиям эстрального цикла, которые определяли цитологическим исследованием мазков из влагалища. Самок, находящихся в проэструсе либо эструсе, подсаживали индивидуально к фертильным самцам той же линии. Матерей с потомством содержали в отдельных клетках. Для создания гнезда самки использовали подстил; дополнительные материалы в клетку не вносили. Отсадку потомства от матери проводили в возрасте 21-го дня.
Были сформированы четыре экспериментальные группы из потомков мышей двух линий, полученных как путем естественного спаривания, так и после культивирования in vitro и переноса эмбрионов самкам-реципиентам. Дизайн эксперимента представлен на рис. 1:
Рис. 1.
Дизайн эксперимента. ET – потомки мышей, полученные после культивирования in vitro и переноса преимплантационных эмбрионов самкам-реципиентам.

1) группа C57BL/6J – самцы и самки линии C57BL/6J, полученные путем естественного спаривания. Было рождено 12 выводков от 12 самок из которых по 1–3 особи каждого пола были случайным образом выбраны для исследования социального поведения (24 самца и 28 самок);
2) группа ВРТ-C57BL/6J – самцы и самки линии C57BL/6J, полученные после культивирования in vitro и переноса эмбрионов линии C57BL/6J самкам-реципиентам C57BL/6J. Было рождено 8 выводков от 8 самок-реципиентов, из которых по 1–3 особи каждого пола были случайным образом выбраны для исследования социального поведения (15 самцов и 19 самок);
3) группа BTBR – самцы и самки линии BTBR, полученные после естественного спаривания. Было рождено 11 выводков от 11 самок, из которых по 1–3 особи каждого пола были случайным образом выбраны для исследования социального поведения (20 самцов и 20 самок);
4) группа ВРТ-BTBR – самцы и самки линии BTBR, полученные после культивирования in vitro и переноса эмбрионов линии BTBR самкам-реципиентам C57BL/6J. Было рождено 12 выводков от 12 самок-реципиентов, из которых по 1–3 особи каждого пола были случайным образом выбраны для исследования социального поведения (15 самцов и 24 самки).
Получение и культивирование преимплантационных эмбрионов
Самкам мышей линии C57BL/6J (n = 8) и BTBR (n = 12) в возрасте 2–3 мес. вводили 5 МЕ хорионического гонадотропина лошади (Фоллигон; Intervet international, B.V., Нидерланды) и через 45–48 ч 5 МЕ хорионического гонадотропина человека (Хорулон; Intervet international, B.V., Нидерланды), затем их ссаживали с фертильными самцами тех же линий (n = 7 и n = 7 соответственно). Подтверждали спаривание наличием влагалищной пробки, а день ее обнаружения считали первым днем беременности.
Для получения эмбрионов на стадии двух клеток самок-доноров эмбрионов подвергали эвтаназии путем ингаляции углекислого газа на следующий день после обнаружения влагалищной пробки. Брюшную полость самки-донора вскрывали, извлекали репродуктивные органы, яйцеводы отделяли от яичника и матки, затем матку и выделенные яйцеводы помещали на 90-миллиметровую чашку Петри (Corning, США) в 100 мкл капли предварительно прогретой до 37°С среды FertiCultTM Flushing (FertiPro, Бельгия). Яйцеводы промывали этой же средой, эмбрионы отмывали от дебриса, проводя по трем 50-микромиллиметровым каплям среды FertiCultTM Flushing, а затем оценивали их качество при помощи стереомикроскопа S8 APO (Leica Microsystems, Германия) по критериям, описанным ранее [33]. Эмбрионы низкого качества: с поврежденными прозрачными оболочками (zonae pellucidae), с неравномерным дроблением бластомеров и/или с фрагментациями (более 25%) отбраковывали [33]. Эмбрионы высокого качества: с неповрежденными прозрачными оболочками и без видимых дефектов (не более 25% поврежденных бластомеров) помещали в среду для культивирования KSOM (EmbryoMax; Merck, Германия) в CO2-инкубатор Galaxy 48R NewBruswik (Eppendorf, Германия). Эмбрионы культивировали в группах по 6–10 в чашках Петри диаметром 35 мм (Corning, США) в течение 48 ч. Непосредственно перед переносом в матку самки-реципиента развитие эмбрионов оценивали визуально c помощью стереомикроскопа S8 APO.
Подготовка суррогатных матерей и перенос эмбрионов
За две недели до начала эксперимента проводили операцию вазэктомии у гибридных самцов CD1×C57BL/6J (n = 7) в возрасте 5 нед. Операцию проводили стандартным способом, как описано ранее [31, 34]. Для получения псевдобеременных самок проводили стерильное спаривание между вазэктомированными гибридными самцами и самками-реципиентами линии C57BL/6J (n = 20) в возрасте 2.5–3 мес. на стадии проэструс/эструс, которые определяли цитологическим исследованием мазков из влагалища. День обнаружения влагалищной пробки у реципиентов считали первым днем псевдобеременности.
Бластоцисты после культивирования in vitro переносили в матку самки-реципиента на третий день псевдобеременности (в среднем по 10 эмбрионов на животное). Таким образом, имел место асинхронный перенос эмбрионов (стадия развития эмбрионов на 1.5–2 сут. опережала стадию развития эндометрия). Как показано ранее, это обеспечивает достаточную эффективность при переносе эмбрионов у грызунов [34, 35].
Операцию по переносу эмбрионов в матку проводили согласно стандартной методике [35]. Для анестезии самке-реципиенту внутрибрюшинно вводили 0.01 мг на мышь медетомидина гидрохлорида (Медитин, 1 мг/мл; Апи-Сан, Россия) и через 10 мин вводили внутримышечно 5 мг на мышь кетамина гидрохлорида (Кетамин, 50 мг/мл; Апи-Сан, Россия). Затем подкожно делали инъекцию антибиотика – 0.01 мл амоксициллина (тригидрат амоксициллина, 150 мг/мл). Готовили операционное поле согласно правилам асептики: шерсть в области операционного поля сбривали, а кожу обрабатывали 70%-ным раствором этанола. Накрывали операционное поле стерильной салфеткой с отверстием для доступа. Применяли правосторонний вертикальный оперативный доступ: кожу и лежащий под ней мышечный слой в области матки разрезали дорзовентрально, 3 мм от нижних ребер в каудальном направлении. Висцеральный жир вместе с яичником, яйцеводом и верхней частью матки захватывали пинцетом и доставали наружу. В правом роге матки делали прокол с помощью стерильной иглы 27 G, затем 6–10 эмбрионов переносили стеклянным капилляром в матку через проделанное отверстие в 2 мкл среды FertiCultTM Flushing. Разрез зашивали и обрабатывали антибиотиком (амоксициллина тригидрат) и антисептиком (ацербин).
Тест “социальная мотивация и распознавание”
Исследование социального поведения животных четырех групп C57BL/6J, ВРТ-C57BL/6J, BTBR, ВРТ-BTBR проводили в возрасте двух месяцев. Каждое животное помещали в чистую индивидуально вентилируемую клетку за 2 дня до оценки поведения. Поверхности оборудования для тестирования протирали после каждого животного 70%-ным раствором этанола для удаления запаховых меток. Время проведения испытания с 16:00 до 18:00, что совпадало с началом темного времени суток в комнате содержания животных (16:00), то есть в период наибольшей активности животных. Использовали установку, предназначенную для проведения теста “открытое поле” (OpenScience, Россия), которая представляет собой круглую арену диаметром 60 см из белого поливинилхлорида, огороженную стенкой высотой 30 см, на полу которой были размещены металлические контейнеры с отверстиями. Расстояние между контейнерами составляло 42 см. Помещение для проведения экспериментов было освещено лампой накаливания 100 Вт; при этом свет был направлен в сторону от поверхности арены, для уменьшения тревожности, испытываемого животным. Регистрацию поведения проводили два исследователя вручную.
В тесте “социальная мотивация и распознавание” было исследовано: C57BL/6J (24 ♂ и 28 ♀); ВРТ-C57BL/6J (14 ♂ и 15 ♀); BTBR (20 ♂ и 20 ♀); ВРТ-BTBR (15 ♂ и 23 ♀). Данный тест является одним из способов оценки социального поведения у лабораторных животных. Исследование было выполнено в соответствии с описанным ранее протоколом [36] и состояло из трех этапов:
1) “адаптация” – для того, чтобы животное привыкло к условиям тестирования, его за хвост плавно помещали в центр арены на 5 мин; при этом располагали тело так, чтобы передняя его часть не была направлена ни на один из контейнеров. Никакого поведения за этот период не фиксировали;
2) “сессия 1” (социальная мотивация) – в “контейнер 1” помещали незнакомую мышь той же линии, пола, возраста и массы тела, что и исследуемое животное (“партнер 1”), в “контейнер 2” – нейтральный объект (черный металлический зажим высотой 4.5 см и шириной 2.5 см, что соответствует среднему размеру мыши в положении сидя, который не должен был иметь для животного сильного запаха). В качестве контейнеров были использованы металлические сетчатые емкости прямоугольной формы высотой 11 см и шириной 8 см. Животное могло видеть и даже частично обнюхать находящийся в контейнере объект, но не имело прямого контакта с ним. Тестируемое животное помещали в центр установки. В течение 10 мин регистрировали продолжительность и число контактов исследуемой мыши с незнакомым партнером и нейтральным объектом (нахождение животного не более чем в 7 см от контейнера, что, как правило, сопровождалось его обнюхиванием), а также время, проведенное в одиночестве (передвижение тестируемого по открытому полю вне контакта с контейнерами, содержащими партнера 1 или нейтральный объект). Рассчитывали “индекс социальной мотивации” по следующей формуле:
В качестве основы была использована формула для вычисления индекса тревожности [37], где были произведены следующие замены: 1) “время в открытых рукавах” на “время рядом с нейтральным объектом”; 2) “общее время в лабиринте” на “суммарное время рядом с нейтральным объектом и партнером 1”; 3) “число заходов в открытые рукава” на “число подходов к нейтральному объекту”; 4) “общее число заходов во все рукава” на “суммарное число подходов к нейтральному объекту и партнеру 1”.
3) “сессия 2” (социальное распознавание) – в “контейнере 2” нейтральный предмет заменяли незнакомой мышью (“партнер 2”). Соответственно в “сессии 2”, тестируемому животному предлагали уже знакомого “партнера 1” и нового “партнера 2”, которых помещали в два контейнера. В течение 10 мин регистрировали продолжительность и число контактов исследуемой мыши со знакомым “партнером 1” и с новым “партнером 2”, а также время, проведенное в одиночестве (передвижение тестируемого по открытому полю вне контакта с контейнерами, содержащими первого либо второго партнера). Рассчитывали “индекс социального распознавания” по следующей формуле:
Также в качестве основы была использована формула для вычисления индекса тревожности [37], где были произведены следующие замены: 1) “время в открытых рукавах” на “время рядом с партнером 1”; 2) “общее время в лабиринте” на “суммарное время рядом с первым и вторым партнером”; 3) “число заходов в открытые рукава” на “число подходов к партнеру 1”; 4) “общее число заходов во все рукава” на “суммарное число подходов к первому и второму партнеру”.
Статистический анализ
Анализ результатов проводили с использованием программного пакета STATISTICA v. 12.0 (StatSoft, Inc., США) и PAST program (Норвегия). Данные по поведенческим параметрам, таким как время, проведенное с партнером 1, нейтральным объектом, партнером 2 и в одиночестве, а также число подходов к партнерам/объекту представлены в виде ящика с усами, с обозначением медианы (Me) с первым (Q1) и третьим (Q3) квартилями. По этим отдельным поведенческим параметрам в тесте “социальная мотивация и распознавание” внутри каждой из исследуемых групп (C57BL/6J, ВРТ-C57BL/6J, BTBR и ВРТ-BTBR) проводили соответствующие попарные сравнения с использованием бутстрепа (bootstrap) с многократной генерацией выборок (Nbootstrap = 9999). Для статистического анализа использовали t-критерий Стьюдента в сочетании с применением бутстрепа. Данные по индексам социальной мотивации и распознавания были проверены на нормальность с помощью критерия Колмогорова–Смирнова и представлены в виде средней с ошибкой средней. Сравнение между группами по индексу социальной мотивации в сессии 1 и по индексу социального распознавания в сессии 2 проводили с помощью многофакторного дисперсионного анализа (Factorial ANOVA) по трем факторам: “линия” (C57BL/6J и BTBR), “тип развития” – т.е. условия преимплантационного развития эмбриона (in vivo/in vitro) (без ВРТ и после ВРТ) и “пол” (самцы и самки), а также последующего post-hoc Fisher LSD. Дополнительно к дисперсионному анализу для обоих индексов были вычислены главные компоненты и рассчитаны корреляции с ними всех исходных признаков. Уровень значимости принимали при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты тестирования на “социальную мотивацию и распознавание” представлены на рис. 2–5. Статистический анализ показал, что в “сессии 1” самцы группы C57BL/6J проводили больше времени с “партнером 1”, чем с предметом (p < 0.001) и чем в одиночестве (p < 0.001) (рис. 2а). Также в “сессии 1” самцы C57BL/6J делали больше подходов к “партнеру 1”, чем к предмету (p < 0.05) (рис. 4а). В “сессии 2” самцы C57BL/6J проводили больше времени с “партнером 2”, чем с “партнером 1” (p < 0.05) (рис. 2а). По числу подходов к “партнеру 1 или 2” в “сессии 2” не было отличий (рис. 4b). Сходное поведение демонстрировали и самки этой группы. В “сессии 1” самки C57BL/6J проводили больше времени с “партнером 1”, чем с предметом (p < 0.05) и чем в одиночестве (p < 0.001), а также больше времени с предметом, чем в одиночестве (p < 0.05) (рис. 3a). В “сессии 2” самки C57BL/6J проводили больше времени с “партнером 2”, чем с “партнером 1” (p < 0.05) и чем в одиночестве (p < 0.01) (рис. 3a). Число подходов в обеих сессиях к “партнеру 1” или “предмету/партнеру 2” не отличалось (рис. 4c, 4d).
Рис. 2.
Социальная мотивация и распознавание самцов линий C57BL/6J и BTBR, полученных естественным спариванием либо с применением репродуктивных технологий (группы C57BL/6J (a), BTB-R (b), ET-C57BL/6J (c) и ET-BTBR(d)). ET – потомки мышей, полученные после культивирования in vitro и переноса преимплантационных эмбрионов самкам-реципиентам. В сессии 1 и 2 показано время, проведенное с партнером 1; с предметом/партнером 2; в одиночестве (передвижение тестируемого по открытому полю вне контакта с контейнерами, содержащими партнера 1 или 2 или предмет).* p < 0.05, **p < 0.05, ***p < 0.001.
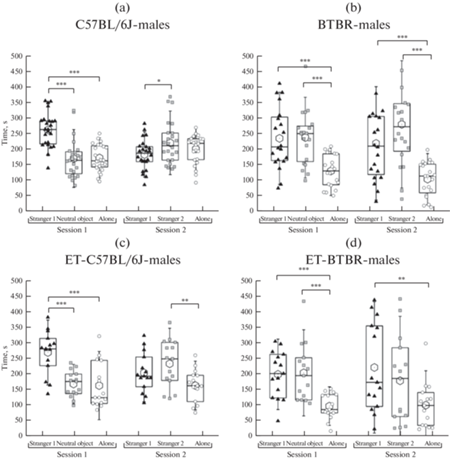
Рис. 3.
Социальная мотивация и распознавание самок линий C57BL/6J и BTBR, полученных естественным спариванием либо с применением репродуктивных технологий (группы C57BL/6J (a), BTBR (b), ET-C57BL/6J (c) и ET-BTBR(d)). ET – потомки мышей, полученные после культивирования in vitro и переноса преимплантационных эмбрионов самкам-реципиентам. В сессии 1 и 2 показаны время, проведенное с партнером 1; с предметом/партнером 2; в одиночестве (передвижение тестируемого по открытому полю вне контакта с контейнерами, содержащими партнера 1 или 2 или предмет). * p < 0.05, ** < 0.05, *** p < 0.001.
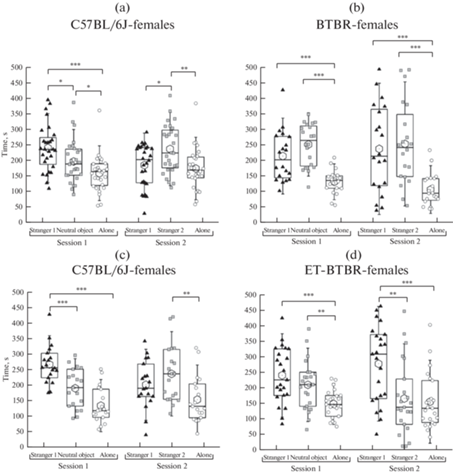
Рис. 4.
Социальная мотивация и распознавание самцов и самок линий C57BL/6J и BTBR, полученных естественным спариванием либо с применением репродуктивных технологий (группы C57BL/6J, E--T‑C57BL/6J, BTBR и ET-BTBR). ET – потомки мышей, полученные после культивирования in vitro и переноса преимплантационных эмбрионов самкам-реципиентам. Показаны параметры: число подходов к партнеру 1, число подходов к предмету в сессии 1, а также число подходов к партнеру 1 и число подходов к партнеру 2 в сессии 2. * p < 0.05 по сравнению с партнером 1 (Stranger 1) в пределах одной сессии.

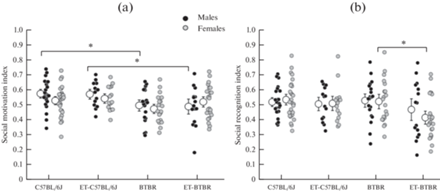
Рис. 5.
Индекс социальной мотивации (a) и социального распознавания (b) у самцов и самок линий C57BL/6J и BTBR, полученных в результате естественного спаривания, либо с применением репродуктивных технологий (группы C57BL/6J, ET-C57BL/6J, BTBR и ET-BTBR). ET – потомки мышей, полученные после культивирования in vitro и переноса преимплантационных эмбрионов самкам-реципиентам. * p < 0.05, ** p < 0.05.
В “сессии 1” самцы ВРТ-C57BL/6J проводили больше времени с “партнером 1” (p < 0.001), чем с предметом и чем в одиночестве (рис. 2c). В “сессии 2” самцы группы ВРТ-C57BL/6J проводили больше времени с “партнером 2” (p < 0.01), чем в одиночестве, однако время, проведенное с “партнером 1” и с “партнером 2”, не отличалось (рис. 2c). Число подходов в обеих сессиях к “партнеру 1” или “предмету/партнеру 2” не отличалось (рис. 4a, 4b). В “сессии 1” самки группы ВРТ-C57BL/6J проводили больше времени с “партнером 1” (p < 0.001), чем с предметом и чем в одиночестве, а также больше времени с предметом (p < 0.01), чем в одиночестве (рис. 3c). В “сессии 2” самки группы ВРТ-C57BL/6J проводили больше времени с “партнером 2”, чем в одиночестве (p < 0.01), однако время, проведенное с “партнером 1” и с “партнером 2” не отличалось (рис. 3c). Число подходов в обеих сессиях к “партнеру 1” или “предмету/партнеру 2” не отличалось (рис. 4c, d).
В “сессии 1” самцы и самки BTBR проводили равное время с “партнером 1” и с предметом, причем в одиночестве они проводили меньше времени (p < 0.001), чем с “партнером 1” и чем с предметом (рис. 2b, рис. 3b). В “сессии 2” самцы и самки BTBR проводили равное время с “партнером 1” и с “партнером 2”, причем в одиночестве они проводили меньше времени (p < 0.001), чем с “партнером 1” и “партнером 2” (рис. 2b, рис. 3b). Число подходов в обеих сессиях к “партнеру 1” или “предмету/партнеру 2” не отличалось (рис. 4a–4d).
В “сессии 1” самцы группы ВРТ-BTBR проводили равное время с “партнером 1” и с предметом, причем в одиночестве они проводили меньше времени (p < 0.001), чем с “партнером 1” и предметом (рис. 2d). В “сессии 2” самцы группы ВРТ-BTBR проводили равное время с “партнером 1” и с “партнером 2”. При этом они проводили больше времени с “партнером 1” (p < 0.001), чем в одиночестве, а время, проведенное с “партнером 2”, не отличалось от времени, проведенного в одиночестве (рис. 2d). Число подходов в обеих сессиях к “партнеру 1” или “предмету/партнеру 2” не отличалось (рис. 4a, 4b). В “сессии 1” самки группы ВРТ-BTBR проводили равное время с “партнером 1” и с предметом, причем в одиночестве они проводили меньше времени, чем с “партнером 1” (p < 0.001) и предметом (p < 0.01) (рис. 3d). В “сессии 2” самки группы ВРТ-BTBR проводили больше времени с “партнером 1”, чем с “партнером 2” (p < 0.01). При этом они проводили больше времени с “партнером 1” (p < 0.001), чем в одиночестве, а время, проведенное с “партнером 2”, не отличалось от времени, проведенного в одиночестве (рис. 3d). Число подходов в обеих сессиях к “партнеру 1” или “предмету/партнеру 2” не отличалось (рис. 4c, 4d).
Однофакторный дисперсионный анализ выявил достоверное влияние фактора “линия” на индекс социальной мотивации для F(1,157) = 12.23; p < 0.001. Однофакторный дисперсионный анализ выявил достоверное влияние фактора “тип развития” на индекс социального распознавания F(1,157) = 7.75; p < 0.01.
Многофакторный дисперсионный анализ выявил эффекты влияния “линии” на “индекс социальной мотивации” в “сессии 1” и “тип развития” на “индекс социального распознавания” в “сессии 2” (табл. 1). По фактору “пол”, а также взаимодействию между факторами достоверных отличий обнаружено не было (p > 0.05). Post-hoc Fisher LSD показал, что самцы группы C57BL/6J имели больший “индекс социальной мотивации” (p < 0.05) по сравнению с линией BTBR. Самки C57BL/6J имели тенденцию (p = 0.065) к увеличению “индекса социальной мотивации” по сравнению с линией BTBR. Самцы группы ВРТ-C57BL/6J также имели более высокий индекс социальной мотивации (p < 0.05) по сравнению с самцами ВРТ-BTBR (рис. 5a). Post-hoc Fisher LSD показал, что у самцов четырех групп “индекс социального распознавания” не отличался, в то время как самки ВРТ-BTBR имели более низкий “индекс социального распознавания” (p < 0.01), чем особи того же пола из группы BTBR (рис. 5b).
Таблица 1.
Данные многофакторного дисперсионного анализа
| Фактор влияния | Индекс социальной мотивации | Индекс социального распознавания |
|---|---|---|
| Линия | F(1,151) = 12.99; p = 0.0004 | F(1,151) = 2.47; p = 0.12 |
| Тип развития | F(1,151) = 0.58; p = 0.45 | F(1,151) = 5.62; p = 0.02 |
| Пол | F(1,151) = 1.03; p = 0.31 | F(1,151) = 0.21; p = 0.64 |
| Линия × Тип развития | F(1,151) = 0.2; p = 0.65 | F(1,151) = 2.24; p = 0.14 |
| Линия × Пол | F(1,151) = 1.59; p = 0.21 | F(1,151) = 0.84; p = 0.36 |
| Тип развития × Пол | F(1,151) = 1.16; p = 0.28 | F(1,151) = 0.48; p = 0.49 |
| Линия × Тип развития × Пол | F(1,151) = 0.3; p = 0.58 | F(1,151) = 0.17; p = 0.68 |
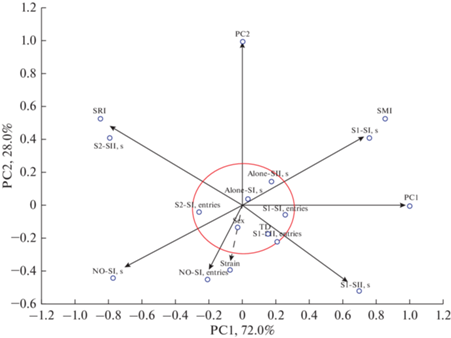
Признаки, отвечающие за время, проведенное рядом с партнерами и нейтральным объектом (S1-SI, (sec); NO-SI, (sec); S1-SII, (sec); S2-SII, (sec)), число подходов к нейтральному объекту в сессии I (NO-SI, entries), а также фактор “линия” (“strain”) значительно сильнее коррелировали с индексами и полученными из них главными компонентами, чем признаки, отвечающие за число подходов (S1-SI, entries; S1-SII, entries; S2-SII, entries), время, проведенное в одиночестве в обеих сессиях (Alone-SI, (sec); Alone-SII, (sec)) и факторы “пол” (“sex”), и “тип развития” (“TD”) (рис. 6).
Рис. 6.
Проекция признаков на плоскость первых двух главных компонент (PC1, PC2). За пределами окружности показаны признаки, для которых корреляция с факторами достоверна при p < 0.001. TD – тип развития; S1-SI (sec) – время (с), проведенное рядом с партнером 1 (stranger1) в сессии 1; NO-SI, (sec) – время (с), проведенное рядом с предметом в сессии 1; SMI – индекс социальной мотивации; Alone-SI, (sec) – время (с), проведенное в одиночестве в сессии 1; S1-SII, (sec) – время (с), проведенное рядом с партнером 1 (stranger1) в сессии 2; S2-SII, (sec) – время (с), проведенное рядом с партнером 2 (stranger2) в сессии 2; SRI – индекс социального распознавания; Alone-SII, (sec) – время (с), проведенное в одиночестве в сессии 1; S1-SI, entries – число подходов к партнеру 1 (stranger1) в сессии 1; NO-SI, entries – число подходов к предмету в сессии 1; S1-SII, entries – число подходов к партнеру 1 (stranger 1) в сессии 2; S2-SII, entries – число подходов к партнеру 2 (stranger 2) в сессии 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Различные нервно-психические заболевания, в том числе расстройства аутистического спектра, характеризуются нарушением социального поведения. Для оценки социального поведения у животных были разработаны тесты, подобные описанному в настоящем исследовании [36, 38]. Использованный нами вариант теста позволяет оценить два важных аспекта социального поведения, такие как социальная мотивация, а также социальное распознавание/новизна. Социальная мотивация определяется как предпочтение проводить время с другой мышью по сравнению со временем, проведенным с нейтральным объектом. Социальное распознавание/новизна определяется как склонность проводить время с ранее незнакомой мышью по сравнению с уже известной тестируемому животному [38]. Нарушение в социальном взаимодействии является ключевым дефицитом при РАС у людей [1], причем одним из компонентов этого нарушения может являться отсутствие предпочтения социальных контактов с новыми людьми по сравнению со знакомыми, т.е. дефицит социального распознавания/новизны [39].
В нашем исследовании было проведено сравнение социального взаимодействия у мышей двух линий: C57BL/6J и BTBR, последняя является признанной идиопатической моделью РАС [40]. В отличие от мышей C57BL/6J, и самцы, и самки линии BTBR уделяли одинаковое время и партнеру, и нейтральному предмету в “сессии 1” теста, а в “сессии 2” эти мыши равное время уделяли новому и знакомому партнеру. Более того, самцы BTBR имели низкий индекс социальной мотивации по сравнению с мышами C57BL/6J. Наши данные согласуются c результатами недавнего исследования, в котором было показано, что индекс социального взаимодействия был снижен и у самцов, и у самок BTBR по сравнению с мышами линии C57BL/6J [27]. Более ранние исследования также указывают на то, что мыши линии BTBR менее социальны в сравнении с мышами C57BL/6J [24–26]. Таким образом, наши результаты, как и данные предыдущих исследований свидетельствуют о снижении социальных взаимодействий у мышей BTBR, это согласуется с мнением о том, что эта линия является адекватной моделью РАС человека [40].
Исследования на различных линиях мышей показали, что применение ВРТ может сопровождаться изменением различных форм поведения у потомков. В частности, у таких потомков изменяется уровень тревожности и социальное поведение, а также нарушается пространственная память [28–31]. В настоящем исследовании тест на социальное поведение показал, что в “сессии 1” самцы и самки группы ВРТ-C57BL/6J, как и естественно зачатые, уделяли больше времени “партнеру 1”, чем нейтральному предмету, что свидетельствует о высокой социальной мотивации. Однако в “сессии 2” самцы и самки ВРТ-C57BL/6J стали уделять равное время новому и знакомому партнеру по сравнению с естественно зачатыми животными, служащими контролем, что может свидетельствовать о снижении у них социального распознавания. Ранее проведенное исследование показало, что самки линии C57BL/6N, полученные после переноса эмбрионов без культивирования in vitro, также имели изменения в социальном поведении, однако они, наоборот, уделяли больше внимания новому партнеру [31]. Возможно, такого рода противоречие обусловлено дополнительным эффектом, который оказала процедура культивирования in vitro, этой процедуры не было произведено в цитируемой выше в работе [31]. Другой причиной может являться то, что в цитируемой работе трансплантация зародышей была осуществлена в яйцевод [31], а в нашем исследовании – в рог матки. Как было показано ранее на мышах линии CD1, поведение потомков, полученных после переноса эмбрионов в яйцевод либо в рог матки, может различаться [30]. В частности, перенос эмбрионов в рог матки самкам-реципиентам вызывал повышение уровня тревожности у рожденных потомков, тогда как подсаживание эмбрионов в яйцевод таких изменений в поведении не вызывало [30]. Между тем, как в нашем исследовании, так и в цитированной выше работе [31], применение ВРТ повлияло преимущественно на поведение потомков-самок. Это может быть связано с тем, что уровень транскрипции большого числа генов различается у преимплантационных эмбрионов мышей разного пола [41, 42]. Кроме того, на этапе преимплантационного развития возникают эпигенетические различия между полами, в частности, сообщалось о том, что эмбрионы мыши разного пола отличаются по скорости развития и метаболическим особенностям; это может обусловливать различия в проявлении отдаленных эффектов у потомков разного пола, вызываемые культивированием in vitro [43–46].
Изменения в социальном поведении были обнаружены и у потомков линии BTBR, однако проявление этих эффектов было отличным от такового у мышей С57BL/6J. В “сессии 1” самцы и самки группы ВРТ-BTBR уделяли одинаковое время и партнеру, и нейтральному предмету. Однако в “сессии 2” самцы BTBR равное время уделяли новому и знакомому партнеру, а самки – больше знакомому “партнеру 1”, чем новому. Кроме того, в отличие от эффектов ВРТ на мышей C57BL/6J, индекс социального распознавания был меньше у самок ВРТ-BTBR по сравнению с естественно рожденным животными, что может свидетельствовать о снижении у них интереса к новому партнеру и социального взаимодействия в целом. Наши результаты хорошо согласуются с результатами более раннего исследования, показавшего, что поведение может по-разному меняться у потомков, полученных после применения ВРТ, в зависимости от линии мышей [29]. В частности, было показано, что потомки мышей DBA/2J, рожденные после культивирования in vitro эмбрионов, менее тревожные, чем линии C3H/HeN [29].
Изменения в социальном поведении мышей, обнаруженные в нашей работе, могут быть связаны с нарушениями эпигенетического характера при развитии эмбрионов в условиях in vitro. В частности, некоторые исследования показали, что существуют изменения уровня метилирования и экспрессии некоторых генов у преимплантационных эмбрионов мышей, культивированных in vitro на различных питательных средах, по сравнению с эмбрионами, развивающимися in vivo [47, 48]. Такого рода нарушения могут иметь отдаленные последствия, в том числе для развития нервной системы. В головном мозге потомков мышей, рожденных после применения ВРТ, было обнаружено снижение синтеза некоторых белков, в частности, Tuba1c, Crk и Psma3, что, как полагают авторы, связано с эпигенетическими изменениями [48]. Также у самцов мышей, полученных после культивирования in vitro эмбрионов, выявлено снижение некоторых нейротрофинов (BDNF, GDNF и NGF) в префронтальной коре и гиппокампе [49]. По нашим неопубликованным данным, у мышей с нокаутом по кальсинтенину-2 (Clstn2-KO), которых можно рассматривать как модельный объект для изучения РАС, было выявлено, что такие процедуры, как культивирование in vitro эмбрионов, оказывают влияние на плотность нейронов в префронтальной коре и гиппокампе, а также на нейрогенез в зубчатой извилине гиппокампа. Можно предположить, что описанные нарушения в головном мозге, вызванные эпигенетическими изменениями после применения процедур ВРТ, связанных с культивированием in vitro эмбрионов, могут отразиться на развитии головного мозга в целом и на поведении потомков, в частности, на социальном взаимодействии.
В настоящем исследовании мы показали, что культивирование in vitro преимплантационных эмбрионов может влиять на социальное распознавание у самок мышей обеих линий, рожденных после применения этих процедур, причем у мышей BTBR (модели РАС) эти нарушения были более выражены. Подобные половые различия были также обнаружены в исследованиях на людях, рожденных после применения ВРТ, где девочки имели более высокий риск возникновения РАС по сравнению с мальчиками [50, 51]. Полученный результат имеет важное значение для медицины, поскольку до сих пор нет четких подтверждений, оказывают ли процедуры ВРТ негативное влияние на развитие заболеваний нервной системы, в частности, РАС. Несмотря на то, что существуют мета-анализы, где описаны отклонения в развитии нервной системы [13, 14] у детей, рожденных после применения ВРТ, и в том числе частоты возникновения РАС [9–11], сложно сделать однозначный вывод о влиянии данных процедур [12]. Поэтому эксперименты, направленные на изучение поведения потомков, полученных после различных процедур ВРТ на животных, с продуманным дизайном и однородной выборкой, вносят важный вклад в изучение отдаленных последствий ВРТ на здоровье потомства.
ЗАКЛЮЧЕНИЕ
В работе было выявлено, что как у самцов, так и у самок BTBR нарушено социальное поведение по сравнению с мышами линии C57BL/6J. Кроме того, в нашем исследовании показано, что культивирование преимплантационных эмбрионов in vitro приводит к характерным изменениям социального поведения мышей линий C57BL/6J и BTBR, а именно – к снижению социального распознавания у самок обеих линий. Эпигенетические нарушения развития при культивировании преимплантационных эмбрионов in vitro могут быть основным механизмом, приводящим к наблюдаемым поведенческим изменениям у потомков. Эта гипотеза нуждается в дальнейшей экспериментальной проверке.
Список литературы
American Psychiatric Association (APA) (2013) Autism spectrum disorder, diagnostic and statistical manual of mental disorders. Fifth ed. Am Psychiatric Publ. Arlington. VA. 50–59.
Kodak T, Bergmann S (2020) Autism spectrum disorder: characteristics, associated behaviors, and early intervention. Pediatr Clin North Am 67: 525–535. https://doi.org/10.1016/j.pcl.2020.02.007
Ivanov HY, Stoyanova VK, Popov NT, Vachev TI (2015) Autism spectrum disorder – a complex genetic disorder. Folia Med (Plovdiv) 57: 19–28. https://doi.org/10.1515/folmed-2015-0015
Waye MMY, Cheng HY (2017) Genetics and epigenetics of autism: a review. Psychiatry Clin Neurosci 72: 228–244. https://doi.org/10.1111/pcn.12606
Yang G, Shcheglovitov A (2020) Probing disrupted neurodevelopment in autism using human stem cell-derived neurons and organoids: An outlook into future diagnostics and drug development. Dev Dyn 249: 6–33. https://doi.org/10.1002/dvdy.100
Girault JB, Piven J (2020) The Neurodevelopment of autism from infancy through toddlerhood. Neuroimaging Clin N Am 30: 97–114. https://doi.org/10.1016/j.nic.2019.09.009
Ramos-Ibeas P, Heras S, Gomez-Redondo I, Planells B, Fernandez-Gonzalez R, Pericuesta E, Laguna-Barraza R, Perez-Cerezales S, Gutierrez-Adan A (2019) Embryo responses to stress induced by assisted reproductive technologies. Mol Reprod Dev 86: 1292–1306. https://doi.org/10.1002/mrd.23119
Berntsen S, Soderstrom-Anttila V, Wennerholm U-B, Laivuori H, Loft A, Oldereid NB, Romundstad LB, Bergh C, Pinborg A (2019) The health of children conceived by ART: “the chicken or the egg?” Hum Reprod Update 25: 137–158.
Sandin S, Nygren KG, Iliadou A, Hultman CM, Reichenberg A (2013) Autism and mental retardation among offspring born after in vitro fertilization. JAMA 310: 75–84. https://doi.org/10.1001/jama.2013.7222
Kissin DM, Zhang Y, Boulet SL, Fountain C, Bearman P, Schieve L, Yeargin-Allsopp M, Jamieson DJ (2015) Association of assisted reproductive technology (ART) treatment and parental infertility diagnosis with autism in ART-conceived children. Hum Reprod 30: 454–465. https://doi.org/10.1093/humrep/deu338
Liu L, Gao J, He X, Cai Y, Wang L, Fan X (2017) Association between assisted reproductive technology and the risk of autism spectrum disorders in the offspring: a meta-analysis. Sci Rep 7: 46207. https://doi.org/10.1038/srep46207
Andreadou MT, Katsaras GN, Talimtzi P, Doxani C, Zintzaras E, Stefanidis I (2021) Association of assisted reproductive technology with autism spectrum disorder in the offspring: an updated systematic review and meta-analysis. Eur J Pediatr 180: 2741–2755. https://doi.org/10.1007/s00431-021-04187-9
Rumbold AR, Moore VM, Whitrow MJ, Oswald TK, Moran LJ, Fernandez RC, Barnhart KT, Davies MJ (2017) The impact of specific fertility treatments on cognitive development in childhood and adolescence: a systematic review. Hum Reprod 32: 1489–1507. https://doi.org/10.1093/humrep/dex085
La Rovere M, Franzago M, Stuppia L (2019) Epigenetics and neurological disorders in ART. Int J Mol Sci 20: 4169. https://doi.org/10.3390/ijms20174169
Sunde A (2019) Embryo culture and phenotype of the offspring. In Vitro Fertilization: 877–889.
Gleicher N, Kushnir VA, Barad DH (2014) Preimplantation genetic screening (PGS) still in search of a clinical application: a systematic review. Reprod Biol Endocrinol 12: 22. https://doi.org/10.1186/1477-7827-12-22
Pontesilli M, Painter RC, Grooten IJ, van der Post JA, Mol BW, Vrijkotte TG, Repping S, Roseboom TJ (2015) Subfertility and assisted reproduction techniques are associated with poorer cardiometabolic profiles in childhood. Reprod Biomed Online 30: 258–267. https://doi.org/10.1016/j.rbmo.2014.11.006
Dayan N, Lanes A, Walker MC, Spitzer KA, Laskin CA (2016) Effect of chronic hypertension on assisted pregnancy outcomes: a population-based study in Ontario, Canada. Fertil Steril 105: 1003–1009. https://doi.org/10.1016/j.fertnstert.2015.11.039
Bergh C, Wennerholm UB (2020) Long-term health of children conceived after assisted reproductive technology. Ups J Med Sci 125: 152–157. https://doi.org/10.1080/03009734.2020.1729904
Banerjee S, Riordan M, Bhat MA (2014) Genetic aspects of autism spectrum disorders: insights from animal models. Front Cell Neurosci 8: 58. https://doi.org/10.3389/fncel.2014.00058
Kazdoba TM, Leach PT, Crawley JN (2016) Behavioral phenotypes of genetic mouse models of autism. Genes Brain Behav 15: 7–26. https://doi.org/10.1111/gbb.12256
Varghese M, Keshav N, Jacot-Descombes S, Warda T, Wicinski B, Dickstein DL, Harony-Nicolas H, De Rubeis S, Drapeau E, Buxbaum JD, Hof PR (2017) Autism spectrum disorder: neuropathology and animal models. Acta Neuropathol 134: 537–566. https://doi.org/10.1007/s00401-017-1736-4
Pobbe RL, Defensor EB, Pearson BL, Bolivar VJ, Blanchard DC, Blanchard RJ (2011) General and social anxiety I the BTBR T+ tf/J mouse strain. Behav Brain Res 216: 446–451. https://doi.org/10.1016/j.bbr.2010.08.039
Langley EA, Krykbaeva M, Blusztajn JK, Mellott TJ (2015) High maternal choline consumption during pregnancy and nursing alleviates deficits in social interaction and improves anxiety-like behaviors in the BTBR T+Itpr3tf/J mouse model of autism. Behav Brain Res 278: 210–220. https://doi.org/10.1016/j.bbr.2014.09.043
Amodeo DA, Pahua AE, Zarate M, Taylor JA, Peterson S, Posadas R, Oliver BL, Amodeo LR (2019) Differences in the expression of restricted repetitive behaviors in female and male BTBR T + tf/J mice. Behav Brain Res 372: 112028. https://doi.org/10.1016/j.bbr.2019.112028
Ahmad SF, Ansari MA, Nadeem A, Bakheet SA, Alqahtani F, Alhoshani AR, Alasmari F, Alsaleh NB, Attia SM (2020) 5-aminoisoquinolinone attenuates social behavior deficits and immune abnormalities in the BTBR T+ Itpr3tf/J mouse model for autism. Pharmacol Biochem Behav 189: 172859. https://doi.org/10.1016/j.pbb.2020.172859
Reshetnikov VV, Ayriyants KA, Ryabushkina YA, Sozonov NG, Bondar NP (2021) Sex-specific behavioral and structural alterations caused by early-life stress in C57BL/6 and BTBR mice. Behav Brain Res 414: 113489. https://doi.org/10.1016/j.bbr.2021.113489
Ecker DJ, Stein P, Xu Z, Williams CJ, Kopf GS, Bilker WB, Abel T, Schultz RM (2004) Long-term effects of culture of preimplantation mouse embryos on behavior. Proc Natl Acad Sci U S A 101: 1595–1600. https://doi.org/10.1073/pnas.0306846101
Rose C, Schwegler H, Hanke J, Rohl FW, Yilmazer-Hanke DM (2006) Differential effects of embryo transfer and maternal factors on anxiety-related behavior and numbers of neuropeptide Y (NPY) and parvalbumin (PARV) containing neurons in the amygdala of inbred C3H/HeN and DBA/2J mice. Behav Brain Res 173: 163–168.
Lopez-Cardona AP, Fernandez-Gonzalez R, Perez-Crespo M, Alen F, de Fonseca FR, Orio L, Gutierrez-Adan A (2015) Effects of synchronous and asynchronous embryo transfer on postnatal development, adult health, and behavior in mice. Biol Reprod 93: 85. https://doi.org/10.1095/biolreprod.115.130385
Lerch S, Tolksdorf G, Schutz P, Brandwein C, Dormann C, Gass P, Chourbaji S (2016) Effects of embryo transfer on emotional behaviors in C57BL/6 mice. J Am Assoc Lab Anim Sci 55: 510–519.
Baan M, Krentz KJ, Fontaine DA, Davis DB (2016) Successful in vitro fertilization and generation of transgenics in Black and Tan Brachyury (BTBR) mice. Transgenic Res 25: 847–854. https://doi.org/10.1007/s11248-016-9974-0
Emiliani S, Van den Bergh M, Vannin AS, Biramanel J, Englert Y (2000) Comparison of ethylene glycol, 1,2-propanediol and glycerol for cryopreservation of slow-cooled mouse zygotes, 4-cell embryos and blastocysts. Hum Reprod 4: 905–910. https://doi.org/10.1093/humrep/15.4.905
Hogan B, Constantiny F, Lacy E (1986) Manipulating the mouse embryo. A laboratory manual. N.Y. Spring Harbor Lab.
Амстиславский СЯ, Игонина ТН, Рожкова ИН, Брусенцев ЕЮ, Роговая АА, Рагаева ДС, Напримеров ВА, Литвинова ЕА, Плюснина ИЗ, Маркель АЛ (2013) Редеривация путем трансплантации эмбрионов линий лабораторных мышей и крыс. Вавиловск журн генетики и селекции 17: 147–161. [Amstislavsky SIA, Igonina TN, Rozhkova IN, Brusentsev IM, Rogovaya AA, Ragaeva DS, Naprimerov VA, Litvinova EA, Plusnina IZ, Markel AL (2013) Rederivation by transplantation of embryo lines of laboratory mice and rats. Vavilov J Genetics and Breeding 17: 147–161. (In Russ)].
Ranneva S, Pavlov K, Gromova A, Amstislavskaya T, Lipina T (2017) Features of emotional and social behavioral phenotypes of calsyntenin2 knockout mice. Behav Brain Res 332: 343–354. https://doi.org/10.1016/j.bbr.2017.06.029
Lee B, Sur B, Cho SG, Yeom M, Shim I, Lee H, Hahm DH (2016) Ginsenoside Rb1 rescues anxiety-like responses in a rat model of post-traumatic stress disorder. J Nat Med 70: 133–144. https://doi.org/10.1007/s11418-015-0943-3
Kaidanovich-Beilin O, Lipina T, Vukobradovic I, Roder J, Woodgett JR (2011) Assessment of social interaction behaviors. J Vis Exp: 2473. https://doi.org/10.3791/2473
Carter MD, Shah CR, Muller CL, Crawley JN, Carneiro AM, Veenstra-VanderWeele J (2011) Absence of preference for social novelty and increased grooming in integrin β3 knockout mice: initial studies and future directions. Autism Res 4: 57–67. https://doi.org/10.1002/aur.180
Meyza KZ, Blanchard DC (2017) The BTBR mouse model of idiopathic autism - Current view on mechanisms. Neurosci Biobehav Rev 76: 99–110. https://doi.org/10.1016/j.neubiorev.2016.12.037
Peaston AE, Evsikov AV, Graber JH, de Vries WN, Holbrook AE, Solter D, Knowles BB (2004) Retrotransposons regulate host genes in mouse oocytes and preimplantation embryos. Dev Cell 7: 597–606. https://doi.org/10.1016/j.devcel.2004.09.004
Fernandez-Gonzalez R, Ramirez MA, Pericuesta E, Calle A, Gutierrez-Adan A (2010) Histone modifications at the blastocyst Axin1(Fu) locus mark the heritability of in vitro culture-induced epigenetic alterations in mice. Biol Reprod 83: 720–727. https://doi.org/10.1095/biolreprod.110.084715
Peippo J, Bredbacka P (1995) Sex-related growth rate differences in mouse preimplantation embryos in vivo and in vitro. Mol Reprod Dev 40: 56–61. https://doi.org/10.1002/mrd.1080400108
Perez-Crespo M, Ramirez MA, Fernandez-Gonzalez R, Rizos D, Lonergan P, Pintado B, Gutierrez-Adan A (2005) Differential sensitivity of male and female mouse embryos to oxidative induced heat-stress is mediated by glucose-6-phosphate dehydrogenase gene expression. Mol Reprod Dev 72: 502–510. https://doi.org/10.1002/mrd.20366
Gutierrez-Adan A, Perez-Crespo M, Fernandez-Gonzalez R, Ramirez MA, Moreira P, Pintado B, Lonergan P, Rizos D (2006) Developmental consequences of sexual dimorphism during pre-implantation embryonic development. Reprod Domest Anim 41(2): 54–62. https://doi.org/10.1111/j.1439-0531.2006.00769.x
Bermejo-Alvarez P, Rizos D, Lonergan P, Gutierrez-Adan A (2011) Transcriptional sexual dimorphism during preimplantation embryo development and its consequences for developmental competence and adult health and disease. Reproduction 141: 563–570. https://doi.org/10.1530/REP-10-0482
de Waal E, Mak W, Calhoun S, Stein P, Ord T, Krapp C, Coutifaris C, Schultz RM, Bartolomei MS (2014) In vitro culture increases the frequency of stochastic epigenetic errors at imprinted genes in placental tissues from mouse concepti produced through assisted reproductive technologies. Biol Reprod 90: 22. https://doi.org/10.1095/biolreprod.113.114785
Zhu W, Zheng J, Wen Y, Li Y, Zhou C, Wang Z (2020) Effect of embryo vitrification on the expression of brain tissue proteins in mouse offspring. Gynecol Endocrinol 36: 973–977. https://doi.org/10.1080/09513590.2020.1734785
Qin NX, Zhao YR, Shi WH, Zhou ZY, Zou KX, Yu CJ, Liu X, Dong ZH, Mao YT, Zhou CL, Yu JL, Liu XM, Sheng JZ, Ding GL, Zhao WL, Wu YT, Huang HF (2021) Anxiety and depression-like behaviours are more frequent in aged male mice conceived by ART compared with natural conception. Reproduction 162: 437–448. https://doi.org/10.1530/REP-21-0175
Hvidtjorn D, Grove J, Schendel D, Schieve LA, Svarke C, Ernst E, Thorsen P (2011) Risk of autism spectrum disorders in children born after assisted conception: a population-based follow-up study. J Epidemiol Community Health 65: 497–502. https://doi.org/10.1136/jech.2009.093823
Davidovitch M, Chodick G, Shalev V, Eisenberg VH, Dan U, Reichenberg A, Sandin S, Levine SZ (2018) Infertility treatments during pregnancy and the risk of autism spectrum disorder in the offspring. Prog Neuropsychopharmacol Biol Psychiatry 86: 175–179. https://doi.org/10.1016/j.pnpbp.2018.05.022
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


