Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 3, стр. 334-347
Роль супероксидного радикала в регуляции функции КV-каналов коронарных сосудов при посттравматическом стрессовом расстройстве
С. С. Лазуко 1, *, Л. Е. Беляева 1, О. П. Кужель 1
1 Витебский государственный ордена Дружбы народов медицинский университет
Витебск, Беларусь
* E-mail: lazuko71@mail.ru
Поступила в редакцию 14.07.2022
После доработки 08.02.2023
Принята к публикации 10.02.2023
- EDN: FSSONZ
- DOI: 10.31857/S0869813923030068
Аннотация
Цель исследования – изучить вклад супероксидного радикала (${\text{O}}_{2}^{{\centerdot - }}$) в механизмы нарушения функциональной активности КV-каналов коронарных сосудов у крыс с посттравматическим стрессовым расстройством (ПТСР). Исследование выполнено на 117 беспородных белых крысах-самцах (Rattus, Muridae) массой 210–240 г. Для воспроизведения экспериментального аналога ПТСР использовали модифицированную модель “имитации присутствия хищника” (контакт с экскрементами кошек 10 дней по 15 мин ежедневно). О наличии ПТСР судили по изменению поведения животных в тесте “Открытое поле”. Тонус коронарных сосудов изучали на сердцах крыс, изолированных по методу Лангендорфа, перфузируемых раствором Кребса–Хензелейта в условиях постоянного потока и сокращающихся в изотоническом режиме. Вклад ${\text{O}}_{2}^{{\centerdot - }}$ в регуляцию тонуса коронарных сосудов изучали путем введения в перфузионный раствор “ловушки” супероксидного радикала тирона (4,5-дигидрокси-1,3-бензолдисульфоновой кислоты). Функциональную активность КV-каналов оценивали по степени прироста коронарного перфузионного давления (КПД) при введении блокатора 4-аминопиридина (4-АП). Для выяснения роли ${\text{O}}_{2}^{{\centerdot - }}$ в механизмах функционирования КV-каналов изолированного сердца крыс в раствор для перфузии вводили тирон и 4-АП. В сыворотке крови животных спектрофотометрическим методом определяли содержание диеновых коньюгатов, малонового диальдегида, активность каталазы и супероксиддисмутазы, методом иммуноферментного анализа — концентрацию С-реактивного белка и содержание интерлейкина 1β (ИЛ-1β). В изолированных сердцах крыс с ПТСР при объемной скорости коронарного потока 10 мл/мин КПД было на 30% меньше по сравнению с группой “Контроль”. Под влиянием 4-АП КПД увеличивалось на 70% в группе контрольных животных и на 24% в группе “ПТСР”. При добавлении тирона в группе “ПТСР” КПД при объемной скорости коронарного потока 10 мл/мин было ниже на 52% по сравнению с таковым в контроле. В группе “ПТСР + тирон + 4-АП” прирост КПД был сопоставим с таковым в сердцах группы “Контроль” под влиянием 4-АП и составлял 71.5%. В сыворотке крови крыс с ПТСР наблюдалось увеличение концентрации ИЛ-1β в 3 раза, С-реактивного белка в 1.6 раза, диеновых коньюгатов в 3.3 раза и малонового диальдегида в 3.6 раза при уменьшении активности супероксиддисмутазы и каталазы на 27 и 59% соответственно по сравнению с контролем. В результате проведенных исследований установлено, что при ПТСР снижается функциональная активность КV-каналов коронарных сосудов, причем одним из важных механизмов такой “каналопатии” может быть гиперпродукция ${\text{O}}_{2}^{{\centerdot - }}$, которая является результатом развития окислительного стресса.
Посттравматическое стрессовое расстройство (ПТСР) представляет собой серьезный и часто инвалидизирующий синдром, развивающийся в ответ на стрессовое событие угрожающего или катастрофического характера. У многих пациентов, у которых изначально развивается это расстройство, впоследствии оно переходит в хроническую форму заболевания, которая в некоторых случаях может длиться много лет и сопровождаться соматическими расстройствами, среди которых – поражение сердечно-сосудистой системы. Аналоги ПТСР описаны и у животных, поэтому они могут быть использованы в качестве объекта исследования этого расстройства для понимания патогенеза симптомов, обусловленных ПТСР, и разработки новых подходов к его лечению [1].
Как в остром, так и в отдаленном периодах ПТСР нередко развиваются ишемические повреждения миокарда, обусловленные коронароспазмом. Одним из его механизмов может быть нарушение функционирования потенциалзависимых калиевых каналов (КV-каналов) клеток коронарных сосудов. КV-каналы образуют самое большое семейство калиевых каналов, которые кодируются у человека 40 генами [2]. Функционально KV-каналы представляют собой гомо- или гетеротетрамерные комплексы, состоящие из шести трансмембранных доменов (S1–S6) и порообразующих α-субъединиц [3]. Положительно заряженные аминокислоты в трансмембранном домене S4 реагируют на изменения мембранного потенциала и служат в качестве потенциалзависимого “сенсора” в этом канале [4, 5]. N-концевой домен канала содержит цистеиновые аминокислотные остатки, которые могут образовывать дисульфидные мостики с другой тиоловой группой данного белка и тем самым изменять его конформацию, что может приводить к нарушению функциональной активности KV-каналов [6]. При действии активных форм кислорода (АФК) сам цистеин может быть окислен до сульфеновой, сульфиновой или сульфоновой кислоты [7]. Деполяризация мембраны клеток сопровождается открытием KV-каналов, что приводит к выходу ионов K+ через эти каналы по концентрационному градиенту, далее к гиперполяризации мембраны и, в конечном счете, к расширению сосудов. Модуляция активности этих каналов осуществляется как вазоконстрикторами, так и вазодилататорами [8]. Доказано, что низкие концентрации активных форм кислорода способны активировать КV-каналы, расположенные в гладкомышечных клетках сосудов, а высокие – подавлять активность этих каналов, это наблюдается, например, при гипергликемии и сахарном диабете [9]. На изолированных сердцах мыши, сокращавшихся в изометрическом режиме при постоянном потоке, было показано, что блокатор 4-аминопиридина (4-АП) приводит к увеличению развиваемого внутрижелудочкового давления. Такое влияние 4-АП авторы объясняют его действием на калиевые каналы, определяющие фазу реполяризации потенциала действия кардиомиоцитов. Предполагают, что более медленная скорость реполяризации во время фазы 1 потенциала действия кардиомиоцитов в присутствии 4-AП приводит к увеличению амплитуды и продолжительности тока Ca2+ через каналы L-типа [10], что потенциально может сопровождаться увеличением образования в митохондриях метаболитов с сосудорасширяющим действием. Учитывая этот факт, для минимизации влияния 4-АП на сократительную функцию миокарда тонус коронарных сосудов изучали на изолированных сердцах крыс, сокращающихся в изотоническом режиме (без введения в левый желудочек латексного баллончика постоянного объема).
Ранее нами было показано, что ПТСР приводит к снижению функциональной активности КV-каналов [11], однако механизмы нарушения функции этих каналов изучены недостаточно.
В связи с этим, цель исследования – изучить вклад супероксидного радикала в механизмы нарушения функциональной активности КV-каналов коронарных сосудов у крыс с ПТСР.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили на 117 беспородных крысах-самцах (Rattus, Muridae) массой 210–240 г, разделенных по группам “Контроль” (n = 46) и посттравматическое стрессовое расстройство (“ПТСР”) (n = 39). Последняя группа была сформирована из экспериментальных животных (n = 71), в клетках которых имитировали присутствие хищника. Все животные находились в стандартных условиях вивария (12-часовой световой режим, температура 20 ± 2°С, влажность 40–60%), получали стандартный рацион и имели свободный доступ к воде. Все экспериментальные исследования были выполнены в первой половине дня. Для воспроизведения экспериментального аналога ПТСР у крыс использовали модифицированную модель “имитации присутствия хищника”, которая в настоящее время считается адекватной моделью ПТСР [12]. Присутствие хищника имитировали путем помещения экскрементов кошек в клетки животных на 15 мин в течение 10 дней, в разное время суток. Следующие 14 дней крысы не подвергались действию стрессора [13]. Поведенческая и исследовательская активность крыс в тесте “Открытое поле” были отслежены и записаны с помощью видео-системы SMART с последующим анализом изучаемых показателей с помощью программного обеспечения SMART 3.0. Признаки ПТСР наблюдались у 55% крыс (таким образом, в эксперименте на изолированном сердце использовалось 20 животных, для биохимического исследования – 19), в клетках которых имитировали присутствие хищника. У крыс с ПТСР обнаружили снижение исследовательской активности и повышение тревожности (уменьшение количества вертикальных стоек на 50%, увеличение времени замирания на 60% и увеличение времени пребывания их в периферической зоне поля на 19%), а также сокращение времени удержания на валике ротарода на 76%, что свидетельствует о нарушении их моторно-координационных функций. Сокращение времени ответной реакции при воздействии на хвост луча от галогеновой лампы у крыс с ПТСР свидетельствует об увеличении их болевой чувствительности. Адекватность используемой модели ПТСР подтверждается и изменением массы стресс-реагирующих органов: снижением относительной массы селезенки на 15.4% и увеличением относительной массы надпочечников на 54% (табл. 1).
Таблица 1.
Масса стресс-реагирующих органов у экспериментальных животных
| Группы экспериментальных животных | ||
|---|---|---|
| контроль | ПТСР | |
| Масса селезенки на 100 г массы тела | 0.337 ± 0.050 (0.293; 0.365) |
0.285 ± 0.020* (0.280; 0.292) |
| Масса надпочечников на 100 г массы тела | 0.015 ± 0.002 (0.015; 0.017) |
0.024 ± 0.003* (0.022; 0.026) |
Животных с признаками ПТСР наркотизировали уретаном (0.1 г/100 г массы тела, внутрибрюшинно). После этого вскрывали брюшную полость, пересекали диафрагму и с двух сторон по реберным углам делали 2 разреза, предварительно наложив зажимы Кохера. Переднюю стенку грудной полости отбрасывали к голове; пинцетом захватывали сосудистый пучок сердца и одним движением ножниц его пересекали. Выделенное сердце останавливали в течение нескольких секунд погружением в чашку Петри с охлажденным до 0°С изотоническим раствором. В аорту вводили металлическую канюлю, соединенную с системой перфузии коронарных сосудов.
Тонус коронарных сосудов изучали на изолированных по методу Лангендорфа сердцах, сокращающихся в изотоническом режиме в условиях постоянной объемной скорости коронарного потока (ОСКП). Эксперимент проводили в два этапа. На первом – сердца перфузировали раствором Кребса–Хензелайта стандартного состава (мМ): NaCl – 118.0, KCl – 4.8, NaHCO3 – 25.0, CaCl2 – 2.5, KH2PO4 – 1.2, MgSO4 – 1.18, глюкоза – 5.5, насыщенным карбогеном (95% О2 и 5% СО2); pH раствора составлял 7.3–7.4 при температуре 37°С. На втором этапе в раствор для перфузии добавляли один из блокаторов либо 4-АП, либо тирон, или их сочетание. Для перфузии сердца использовали установку для изолированных органов мелких лабораторных животных IH-SR типа 844/1 (HSE-HA, Германия), оборудованную датчиками для измерения аортального давления (Isotec pressure transducer). Компьютерную регистрацию и обработку результатов измерения коронарного перфузионного давления (КПД) при ОСКП, составлявшей 6, 8, 10 и 15 мл/мин, осуществляли при помощи программного обеспечения ACAD (HSE, Германия). Для изучения роли супероксидного радикала в регуляции тонуса коронарных сосудов использовали его “химическую ловушку” – 4,5-дигидрокси-1,3-бензолдисульфоновую кислоту (тирон, Sigma, США), который добавляли в раствор для перфузии изолированного сердца в концентрации 10 мМ. Функциональную активность потенциал-зависимых калиевых каналов (КV-каналов) оценивали по степени прироста КПД (после повышения КПД рассчитывали процент его прироста от исходной величины) в ответ на введение в перфузионный раствор 4-АП, 1.5 мМ, (Sigma, США), который добавляли в раствор при ОСКП 10 мл/мин, что соответствует диапазону значений хорошо выраженной ауторегуляции коронарного потока [14]. Под термином “функциональная активность” калиевых каналов понимают вклад этих каналов в поддержание базального тонуса коронарных сосудов, который устраняется введением блокатора этих каналов 4-АП. В этих условиях косвенно мы можем судить о функциональной активности исследуемых каналов (чем больше коронароконстрикторный эффект 4-АП, тем больше вклад KV-каналов, напротив, снижение коронароконстрикторного эффекта под влиянием 4-АП указывает на снижение функциональной активности KV-каналов) [15]. Для выяснения роли супероксидного радикала в механизмах функционирования КV-каналов изолированного сердца экспериментальных животных в раствор для перфузии вводили тирон и 4-АП.
В сыворотке крови экспериментальных животных спектрофотометрическим методом определяли содержание диеновых конъюгатов (ДК) [16], малонового диальдегида (МДА) [17], активность каталазы (КАТ) [18] и супероксиддисмутазы (СОД) [19]. Методом иммуноферментного анализа в сыворотке крови определяли концентрацию С-реактивного белка, используя диагностический набор (Elabscience Rat hs-CRP (high-sensitivity C-Reactive Protein) ELISA Kit Catalog No: E-EL-R3002 с минимальной определяемой концентрацией вещества 4.69 пг/мл) и содержание интерлейкина 1β (ИЛ-1β) с помощью набора Elabscience Rat IL-1β (Interleukin 1 Beta) ELISA Kit Catalog No: E-EL-R0012 с минимальной определяемой концентрацией вещества 18.75 пг/мл.
Статистическую обработку данных проводили с помощью программы Statistica 10.0 (StatSoftinc., STA999K347156-W) и MS Excel. Величины количественных показателей в экспериментальных группах представляли в виде медианы (Ме), интерквартильного интервала [25%; 75%]. Проверку отклонения распределения вероятностей от нормального среди изучаемых признаков проводили с помощью критерия Шапиро–Уилка. Выбор непараметрических статистических методов обработки данных был обусловлен малыми размерами выборок (экспериментальных групп) и распределением данных, отличным от нормального. При сравнении независимых количественных и качественных признаков в двух группах использовали непараметрический критерий U Манна–Уитни, для одновременных сравнений 3 и более переменных применили непараметрический аналог ANOVA (ранговый однофакторный анализ Краскела–Уоллиса). Проверку статистических гипотез выполняли при критическом уровне значимости 5% (p < 0.05) [20].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ступенчатое повышение объемной скорости коронарного потока от 6 до 8, затем до 10 и до 15 мл/мин приводило к закономерному увеличению коронарного перфузионного давления в сердцах животных группы “Контроль” и составило: 30.0 (24.7; 30.2); 36.5 (35.2; 48.2); 79.5 (78.7; 86.5); 119.0 (113.7; 123.2) мм рт. ст. соответственно. В сердцах крыс с посттравматическим стрессовым расстройством (группа “ПТСР”) повышение ОСКП в диапазоне от 6 до 15 мл/мин также приводило к повышению коронарного перфузионного давления. Однако значения КПД в сердцах группы “ПТСР” были ниже, чем в сердцах группы “Контроль”: при ОСКП 10 мл/мин – на 30%, а при ОСКП 15 мл/мин – на 8% (рис. 1a). Таким образом, в сердцах животных с ПТРС наблюдалось снижение тонуса коронарных сосудов.
Рис. 1.
(а, b, с) – Динамика изменения коронарного перфузионного давления (КПД) в изолированных сердцах крыс при ступенчатом увеличении объемной скорости коронарного потока (ОСКП) и при введении тирона в перфузионный раствор. Обозначения: по оси абсцисс: Coronary perfusion pressure, mm Hg – коронарное перфузионное давление в мм рт. ст. По оси ординат: Coronary flow, mL/min – объемная скорость коронарного потока (ОСКП) в мл/мин. * – р < 0.05, по сравнению с группой “Контроль”; # – р < 0.05, по сравнению с группой “ПТСР”; Т – р < 0.05, по сравнению с группой “Тирон”. ▲ – “Контроль”, ◆ – “ПТСР”, ⚫ – “Тирон”, ◼ – группа “ПТСР + тирон”.

Перфузия сердец группы “Контроль” раствором с “ловушкой” супероксидного радикала тироном (“Контроль + тирон”) также сопровождалась закономерным приростом КПД при повышении ОСКП от 6 до 15 мл/мин. Однако КПД при ОСКП 10 и 15 мл/мин было меньше на 46 и 36% соответственно, чем в контроле при аналогичных уровнях (рис. 1b). Этот факт указывает на то, что супероксидный радикал, постоянно образующийся в гладкомышечных клетках и эндотелиоцитах коронарных сосудов в физиологических условиях, играет важную роль в механизмах, обеспечивающих поддержание должного тонуса сосудов сердца, а устранение действия ${\text{O}}_{2}^{{\centerdot - }}$ сопровождается снижением тонуса коронарных сосудов.
При перфузии сердец крыс группы “ПТСР” с добавлением в раствор тирона (“ПТСР + тирон”) КПД закономерно вырастало при увеличении ОСКП от 6 до 15 мл/мин. Однако значения КПД при всех уровнях ОСКП были снижены на 20, 18, 52 и 51% по сравнению с аналогичными уровнями ОСКП в контроле, что свидетельствовало о снижении тонуса коронарных сосудов в группе “ПТСР + тирон” (рис. 1c). Показатели КПД группы “ПТСР + тирон”, в сравнении с группой “ПТСР”, при ОСКП 8, 10, 15 мл/мин были ниже на 25, 32 и 46% соответственно, как и в сравнении с группой “Контроль + тирон”, при аналогичных уровнях ОСКП на 10, 12, 23% соответственно (рис. 1с). Вероятно, увеличение вазодилатирующего эффекта тирона на коронарные сосуды сердец (и, как следствие, снижение тонуса сосудов), выделенных из организмов животных с ПТСР, может свидетельствовать об увеличении продукции супероксидного радикала в клетках коронарных сосудов в этих условиях. Пример оригинальных записей показателей датчика для измерения коронарного перфузионного давления представлен на рис. 2.
Рис. 2.
Репрезентативные примеры оригинальных записей коронарного перфузионного давления в экспериментальных группах. (а) “Контроль”, (b) “ПТСР”, (c) “Тирон”, (d) “ПТСР + Тирон”. Обозначения: CF – объемная скорость коронарного потока; AP – коронарное перфузионное давление.
Вклад супероксидного радикала ${\text{O}}_{2}^{{\centerdot - }}$ в механизмы регуляции функциональной активности КV-каналов коронарных сосудов изолированного сердца контрольных животных и крыс с ПТСР
Добавление в раствор для перфузии изолированных сердец контрольной группы животных блокатора КV-каналов 4-АП (“Контроль + 4-АП”) при ОСКП 10 мл/мин сопровождалось увеличением коронарного перфузионного давления до 143.0 (135.0; 146.0) мм рт. ст., т.е. прирост КПД составлял 70% (табл. 2). Таким образом, КV-каналы вносят большой вклад в механизмы поддержания базального тонуса коронарных сосудов контрольных животных в физиологических условиях, а их активация противостоит коронароконстрикции.
Таблица 2.
Динамика изменения коронарного перфузионного давления (КПД) в изолированных сердцах крыс при введении 4-аминопиридина (4-АП) и тирона в перфузионный раствор
| ОСКП, мл/мин | КПД, мм рт. ст. | |||
|---|---|---|---|---|
| группа контроль n = 12 |
группа контроль + тирон n = 15 |
группа ПТСР n = 10 |
группа
ПТСР + тирон n = 10 |
|
| 10 | 79.5 (78.7; 86.5) |
43.0* (38.0; 57.0) |
56.0* (42.0; 67.2) |
38.0*# Т (35.2; 38.0) |
| 10 + 4-АП | 143.0 (135.2; 146.7) |
94.0* (74.0; 109.5) |
65.5* (64.0; 86.0) |
70.0* (58.0; 82.7) |
| % КПД | 70.0 (62.5; 83.5) |
89.0 (78.0; 141.0) |
23.0* (14.3; 32.5) |
71.5 (51.2; 100.0) |
При совместном использовании 4-АП и тирона в группе “Контроль” (“Контроль + тирон + 4-АП”) выраженность прироста КПД статистически значимо не отличалась от соответствующего прироста в группе “Контроль + 4-АП” и составляла 89% (рис. 2). Следовательно, образующиеся в физиологических условиях супероксидный радикал не изменяет функциональную активность КV-каналов клеток коронарных сосудов.
Добавление в раствор, которым перфузировали сердца группы “ПТСР”, блокатора КV-каналов 4-АП (“ПТСР + 4-АП”) при ОСКП 10 мл/мин приводило к незначительному повышению КПД, которое было на 54.2% ниже такового в группе “Контроль + 4-АП” (табл. 2). Прирост коронарного перфузионного давления в ответ на интракоронарное введение 4-АП составлял всего 23% против 70% в контроле (рис. 3). Следовательно, посттравматическое стрессовое расстройство приводило к снижению функциональной активности КV-каналов клеток коронарных сосудов, что выражалось в уменьшении коронароконстрикторного действия блокатора этих каналов 4-АП.
Рис. 3.
Изменения коронарного перфузионного давления (КПД) (в %) изолированного сердца животных с посттравматическим стрессовым расстройством (ПТСР) в ответ на введение в перфузионный раствор 4,5-дигидрокси-1,3-бензолдисульфоновой кислоты (тирона), 4-аминопиридина (4-АП) или их сочетания. Обозначения: Change in coronary perfusion pressure, % – процент прироста коронарного перфузионного давления; 4-AP – 4-аминопиридин; Control – контрольная группа животных; PTSD – животные с посттравматическим стрессовым расстройством; Tiron – 4,5-дигидрокси-1,3-бензолдисульфоновая кислота (тирон). *– p < 0.05 по сравнению с группой “Control + 4AP”.
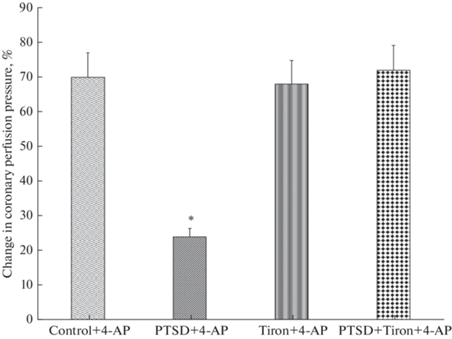
Блокада КV-каналов коронарных сосудов крыс группы “ПТСР” при одновременном использовании тирона и 4-АП (“ПТСР + тирон + 4-АП”) приводила к увеличению КПД при ОСКП 10 мл/мин в той же степени, что и при перфузии сердец животных с ПТСР блокатором 4-АП (“ПТСР + 4-АП”) при аналогичном уровне ОСКП (табл. 2). Прирост коронарного перфузионного давления у крыс с ПТСР в условиях совместной блокады КV-каналов и применения “ловушки” супероксидного радикала был сопоставим с таковым в сердцах группы “Контроль” под влиянием 4-АП и составлял 71.5% (рис. 3, для сравнения, прирост КПД у животных группы “ПТСР + 4-АП” – 23%). Таким образом, можно предположить, что избыточная продукция супероксидного радикала в клетках коронарных сосудов крыс с ПТСР может быть одним из механизмов постстрессорного нарушения функциональной активности КV-каналов коронарных сосудов в этих условиях.
В сыворотке крови животных с ПТСР определялось увеличение концентрации диеновых конъюгатов и малонового диальдегида в 3.3 и 3.6 раза соответственно в сравнении с показателями контрольной группы животных (рис. 4a, 4b).
Рис. 4.
(а) – Изменение концентрации диеновых коньюгатов (ДК, мкмоль/г липидов); (b) – малонового диальдегида (МДА, мкмоль/г белка); (с) – активности супероксиддисмутазы (U/л); (d) – активности каталазы (U/л) в сыворотке крови экспериментальных животных. Обозначения: по оси абсцисс – Control – группа “Контроль”; PTSD – группа “ПТСР”; по оси ординат – концентрация вещества: Diene conjugates, µmol/g lipids - концентрации диеновых коньюгатов, мкмоль/г липидов; Malondialdehyde, µmol/g protein - малоновый диальдегид, мкмоль/г белка; Superoxide dismutase, U/l – супероксиддисмутаза, U/л; Catalase, U/l – каталаза, U/л; статистические значимые различия p < 0.001.

Увеличение концентрации продуктов перекисного окисления липидов сочеталось с уменьшением активности СОД и КАТ в крови на 27 и 59% соответственно (рис. 4c, 4d). Кроме того, в крови увеличивались концентрации С-реактивного белка в 1.6 раза от 2.55 (2.54; 3.57) до 4.25 (3.57; 4.92), р < 0.05) и ИЛ-1β в 3 раза (от 1.71 (1.43; 2.38) до 5.34 (2.29; 6.76), р < 0.05) по сравнению с контрольными значениями.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Перфузия сердец, выделенных из организмов контрольных животных, раствором с “химической ловушкой” супероксидного радикала тироном приводила к меньшему приросту КПД при ОСКП 10 мл/мин, чем в контроле, при аналогичном уровне ОСКП. Этот факт указывает на то, что супероксидный радикал, постоянно образующийся в гладкомышечных клетках и эндотелиоцитах коронарных сосудов в физиологических условиях, играет важную роль в механизмах, обеспечивающих поддержание должного базального тонуса сосудов сердца, а устранение действия ${\text{O}}_{2}^{{\centerdot - }}$ сопровождается снижением тонуса коронарных сосудов. Известно, что действие тирона в качестве антиоксиданта комплексное: помимо его способности выступать в роли скавенджера NO, тирон подавляет образование ${\text{O}}_{2}^{{\centerdot - }}$ в электронно-транспортном комплексе митохондрий, является хелатором железа, увеличивает содержание восстановленного глутатиона, а также снижает активность индуцибельной NO-синтазы, экспрессию ядерного фактора транскрипции NF-κB и фактора некроза опухоли альфа (TNF-α), что косвенно может влиять на образование и/или биодоступность NO [21]. Однако в наших ранее опубликованных работах показано, что действие тирона в коронарных сосудах как контрольных крыс, так и крыс, перенесших стресс, не обусловлено изменением продукции оксида азота [22].
В наших исследованиях установлено, что в сердцах контрольной группы животных потенциалзависимые калиевые каналы играют важную роль в регуляции тонуса коронарных сосудов. Тот факт, что при совместном использовании 4-АП и тирона в группе “Контроль” (“Контроль + тирон + 4-АП”) выраженность прироста коронарного перфузионного давления статистически значимо не отличалась от соответствующего прироста КПД в группе “Контроль + 4-АП”, свидетельствует о том, что образующийся в физиологических условиях супероксидный радикал не изменяет функциональной активности КV-каналов клеток коронарных сосудов. Другими исследователями показано, что регуляция активности KV-каналов является редокс-зависимой [23], и в ней участвуют активные формы кислорода (АФК) и азота (АФА), причем низкие концентрации АФК активируют эти каналы [24].
Уменьшение констрикторного действия 4-АП в сердцах животных с ПТСР указывает на снижение функциональной активности КV-каналов клеток коронарных сосудов, то есть ПТСР приводит к развитию постстрессорной “каналопатии”. У крыс с ПТСР в сыворотке крови увеличена концентрация диеновых конъюгатов и малонового диальдегида на фоне сниженного содержания антиоксидантных ферментов (СОД и КАТ), что может указывать на развитие в этих условиях окислительного стресса. По-видимому, окислительный стресс сопровождался избыточной продукцией АФК и в клетках сосудов сердца. Этот вывод подтверждается большим приростом КПД при перфузии сердец раствором, содержащим тирон (процент прироста в группе “ПТСР + тирон” составлял 71.5%), по сравнению с приростом КПД в сердцах животных с ПТСР без добавления в раствор для перфузии “химической ловушки” ${\text{O}}_{2}^{\centerdot }$ (для сравнения, процент прироста в группе “ПТСР” составлял 24.0%).
Развившееся воспаление низкой интенсивности при ПТСР способно увеличить образование индуцибельной NO-синтазы, а также привести к так называемому “разобщению” эндотелиальной NO-синтазы. При этом эндотелиальная NO-синтаза, наряду с монооксидом азота, способна продуцировать пероксинитрит, нитрозотиолы и супероксидный анион [25]. Как правило, окислительный и нитрозилирующий стресс развиваются одновременно [26] и сопровождаются S-нитрозированием и S-тионилированием белков, входящих в состав КV-каналов, тем самым нарушая конформацию белковых молекул и функциональную активность каналов. В условиях окислительного стресса основными субстратами S-тионилирования белков являются CysSH и GSH [27].
Обнаруженное нами увеличение концентрации С-реактивного белка и ИЛ-1β в сыворотке крови свидетельствует о развитии у животных с ПТСР системного воспаления низкой интенсивности. Системное воспаление низкой интенсивности, наряду с окислительным стрессом, развивающиеся при ПТСР, могут объяснить высокую вероятность развития при этом сосудистых “катастроф”. Предполагаемые причинно-следственные связи между обнаруженными нами событиями упрощенно представлены на рис. 5.
Рис. 5.
Причины и следствия нарушений активности КV-каналов коронарных сосудов у крыс с экспериментальным аналогом посттравматического стрессового расстройства (ПТСР).

Рассуждая таким образом, можно предположить, что последовательность событий, приводящих к уменьшению функциональной активности КV-каналов у крыс с ПТСР, может быть следующей: развитие окислительного стресса и запуск асептического воспаления с образованием медиаторов воспаления интерлейкина-1β, фактора некроза опухоли-α и белка острой фазы воспаления – С-реактивного белка, усиливающих действие друг друга с последующим окислением SH-групп КV-каналов и снижением их активности [24].
Таким образом, полученные результаты позволяют сделать следующий вывод: ПТСР сопровождается снижением активности КV-каналов коронарных сосудов, причем одним из важных механизмов такой “каналопатии” является окислительный стресс.
Список литературы
Richter-Levin G, Stork O, Schmidt MV (2019) Animal models of PTSD: a challenge to be met. Mol Psychiatry 24:1135–1156. https://doi.org/10.1038/s41380-018-0272-5
Gutman GA, Chandy KG, Grissmer S, Lazdunski M, McKinnon D, Pardo LA, Robertson GA, Rudy B, Sanguinetti MC, Stühmer W, Wang X (2005) International Union of Pharmacology. LIII. Nomenclature and molecular relationships of voltage-gated potassium channels. Pharmacol Rev 57(4): 473–508. https://doi.org/10.1124/pr.57.4.10
González C, Baez-Nieto D, Valencia I, Oyarzún I, Rojas P, Naranjo D, Latorre R (2012) K(+) channels: function-structural overview. Comprehens Physiol 2: 2087–2149. https://doi.org/10.1002/cphy.c110047
Nelson MT, Quayle JM (1995) Physiological roles and properties of potassium channels in arterial smooth muscle. Am J Physiol 268: 799–822. https://doi.org/10.1152/ajpcell.1995.268.4.C799
Park SW, Noh HJ, Sung DJ, Kim JG, Kim JM, Ryu SY, Kang K, Kim B, Bae YM, Cho H (2015) Hydrogen peroxide induces vasorelaxation by enhancing 4-aminopyridine-sensitive Kv currents through S-glutathionylation. Pflug Arch 467: 285–297.https://doi.org/10.1007/s00424-014-1513-3
Jerng HH, Dougherty K, Covarrubias M, Pfaffinger PJ (2009) A novel N-terminal motif of dipeptidyl peptidase-like proteins produces rapid inactivation of KV4.2 channels by a pore-blocking mechanism. Channels (Austin) 3(6): 448–461. https://doi.org/10.4161/chan.3.6.10216
Gamper N, Zaika O, Li Y, Martin P, Hernandez CC, Perez MR, Wang AY, Jaffe DB, Shapiro MS (2006) Oxidative modification of M-type K(+) channels as a mechanism of cytoprotective neuronal silencing. EMBO J 25(20): 4996–5004. https://doi.org/10.1038/sj.emboj.7601374
Tykocki NR, Boerman EM, Jackson WF (2017) Smooth Muscle Ion Channels and Regulation of Vascular Tone in Resistance Arteries and Arterioles. Compr Physiol 7(2): 485–581. https://doi.org/10.1002/cphy.c160011
Nieves-Cintrón M, Syed AU, Nystoriak MA, Navedo MF (2018) Regulation of voltage-gated potassium channels in vascular smooth muscle during hypertension and metabolic disorders. Microcirculation 25(1): https://doi.org/10.1111/micc.12423.10.1111/micc.12423
López Alarcón MM, Rodríguez de Yurre A, Felice JI, Medei E, Escobar AL (2019) Phase 1 repolarization rate defines Ca2+ dynamics and contractility on intact mouse hearts. J Gen Physiol 151(6): 771–785. https://doi.org/10.1085/jgp.201812269
Lazuko SS, Kuzhel OP, Belyaeva LE, Manukhina EB, Downey HF, Tseilikman OB, Komelkova MV, Tseilikman VE (2018) Posttraumatic Stress Disorder Disturbs Coronary Tone and Its Regulatory Mechanisms. Cell Mol Neurobiol 38(1): 209–217. https://doi.org/10.1007/s10571-018-0619-0
Verbitsky A, Dopfel D, Zhang N (2020) Rodent models of post-traumatic stress disorder: behavioral assessment. Transl Psychiatry 10(1): 132. https://doi.org/10.1038/s41398-020-0806-x
Tseilikman OB, Lapshin MS, Komelkova MV, Kondashevskaya MV, Dremencov EV, Manukhina EB, Downey H Fred, Lazuko SS, Kuzhel OP, Tseylikman VE, Kozochkin DA (2017) Adrenal insufficiency in rats after prolonged exposure to the predator cue: A new animal model of post-traumatic stress disorder. Psychoneuroendocrinology 83: 83. https://doi.org/10.1016/j.psyneuen.2017.07.460
Солодков АП, Дорошенко АС, Шебеко ВИ, Щербинин ИЮ (2005) Эндотелий, ауторегуляция коронарных сосудов и стресс. Вестн Фонда фундамент исследов 1: 79–94. [Solodkov AP, Doroshenko AS, Shebeko VI, Shcherbinin IYu (2005) Endothelium, coronary autoregulation and stress. Bull Found Fundament Res 1: 79–94. (In Russ)].
Ohya Y, Setoguchi M, Fujii K, Nagao T, Abe I, Fujishima M (1996) Impaired Action of Levcromakalim on ATP-Sensitive K+ Channels in Mesenteric Artery Cells From Spontaneously Hypertensive Rats. Hypertens 27: 1234–1239. https://doi.org/10.1161/01.HYP.27.6.1234
Гаврилов ВБ, Гаврилова АР, Хмара НФ (1988) Измерение диеновых коньюгатов в плазме по ультрафиолетовому поглощению гептановых и изопропильных экстрактов кислотой. Лаб дело 2: 60–64. [Gavrilov VB, Gavrilova AR, Khmara NF (1988) Measurement of diene conjugates in plasma by ultraviolet absorption of heptane and isopropyl extracts with acid. Lab business 2: 60–64. (In Russ)].
Андреева ЛИ, Кожемякин ЛА, Кишкун АА (1988) Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой. Лаб дело 11: 41–43. [Andreeva LI, Kozhemyakin LA, Kishkun AA (1988) Modification of the method for determining lipid peroxides in a test with thiobarbituric acid. Lab business 11: 41–43. (In Russ)].
Королюк МА, Иванова ЛИ, Маморова ИГ, Токарев ВЕ (1988) Метод определения активности каталазы. Лаб дело 1: 16–19. [Korolyuk MA, Ivanova LI, Mamorova IG, Tokarev VE (1988) Method for determining catalase activity. Lab business 1: 16–19. (In Russ)].
Костюк ВА, Потапович АИ, Ковалева ЖВ (1990) Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина. Вопр мед химии 36 (2): 88–91. [Kostyuk VA, Potapovich AI, Kovaleva ZhV (1990) A simple and sensitive method for determining the activity of superoxide dismutase based on the oxidation of quercetin. Vopr Med Chem 36(2): 88–91. (In Russ)].
Красько ОВ (2014) Статистический анализ данных в медицинских исследованиях: в 2 ч. Мн МГЭУ им АД Сахарова. [Krasko OV (2014) Statistical analysis of data in medical research: in 2 parts. Mn MGJeU im AD Saharova. (In Russ)].
Khaled S, Makled MN, Nader MA (2020) Tiron protects against nicotine-induced lung and liver injury through antioxidant and anti-inflammatory actions in rats in vivo. Life Sci 260: 118426. https://doi.org/10.1016/j.lfs.2020.118426
Дорошенко АС, Солодков АП, Шебеко ВИ (2005) Значение супероксид-анионов в регуляции тонуса коронарных сосудов и сократительной функции миокарда на фоне измененного редокс-состояния миокарда. Рос физиол журн им ИМ Сеченова 91(12): 1428–1440. [Doroshenko AS, Solodkov AP, Shebeko VI (2005) Тhe value of superoxide anions in the regulation of coronary vascular tone and myocardial contractile function against the background of an altered myocardial redox state. Russ J Physiol 91(12): 1428–1440. (In Russ)].
Gutterman DD, Miura H, Liu Y (2005) Redox modulation of vascular tone: focus of potassium channel mechanisms of dilation. Arterioscler Thromb Vasc Biol 25(4): 671–678. https://doi.org/10.1161/01.ATV.0000158497.09626.3b
Dwenger MM, Ohanyan V, Navedo MF, Nystoriak MA (2018) Coronary microvascular Kv1 channels as regulatory sensors of intracellular pyridine nucleotide redox potential. Microcirculation 25(1): 10. https://doi.org/10.1111/micc.12426
Kietadisorn R, Juni RP, Moens AL (2012) Tackling endothelial dysfunction by modulating NOS uncoupling: new insights into its pathogenesis and therapeutic possibilities. Am J Physiol Endocrinol Metab 302: 481–495. https://doi.org/10.1152/ajpendo.00540.2011
Ortega AL, Mena S, Estrela JM (2010) Oxidative and nitrosative stress in the metastatic microenvironment. Cancers (Basel) 2(2): 274–304. https://doi.org/10.3390/cancers2020274
Rossi R, Giustarini D, Milzani A, Dalle-Donne I (2009) Cysteinylation and homocysteinylation of plasma protein thiols during ageing of healthy human beings. J Cell Mol Med 13(9B): 31–40. https://doi.org/10.1111/j.1582-4934.2008.00417.x
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


